как определить какая соль слабая и какая сильная?
Ученик
(167),
закрыт
9 лет назад
Condorita
Высший разум
(633052)
9 лет назад
При растворении в воде соли полностью или частично диссоциируют на ионы. Если диссоциация происходит нацело, то соли являются сильными электролитами, иначе — слабыми[8]. Примером типичных сильных электролитов могут служить соли щелочных металлов, которые в растворе существуют в виде сольватированных ионов[3]. Несмотря на то, что широко распространена теория, утверждающая, что соли в водном растворе диссоциируют полностью, в реальности для большинства солей наблюдается частичная диссоциация, например, 0,1 M раствор FeCl3 содержит лишь 10 % катионов Fe3+, а также 42 % катионов FeCl2+, 40 % катионов FeCl2+, 6 % катионов FeOH2+ и 2 % катионов Fe(OH)2+[2
|
Все зависит от степени ее помола.Чем она мельче, тем солонее. Вкус соли воспринимают определенные рецепторы языка. Чем больше площадь контакта кристалликов с поверхностью языка, тем больше клеток-анализаторов задействовано. А значит и восприятие вкуса ярче. автор вопроса выбрал этот ответ лучшим Emet11 3 года назад Практически все в солености зависит от ее происхождения и от способа ее добычи, следовательно и набор элементов, из которых она состоит,-тоже разный и напрямую влияет именно на “соленость”. Соль бывает таких видов: Я покупаю соль одного и того же производителя и обычную и гималайскую, но когда взяла “на пробу” другую,- было очень непривычно, так как обычные порции, которые я бросала в блюдо всегда делали его недосоленным. С чего сделала вывод, что соль, которой я пользуюсь, более соленая и соответственно и выгодней в итоге. Go Green 3 года назад По внешнему виду определить то, какая соль соленее, а какая нет – не получится, поэтому остается определять это только опытным путем – то есть покупать соль разных производителей и пробовать на вкус. Но из собственного опыта могу сказать, что самая соленая соль для меня лично – это морская, каменная соль стоит на втором месте, а вот самая мягкая соль, зато имеющая в своем составе до 80 и больше различных минералов – это тибетская розовая соль (только настоящая, не подделка). Именно от состава и источника добычи зависит соленость соли, на мой взгляд. Еще нужно учесть, что мелкая соль медленнее растворяется в еде, чем соль из крупных кристаллов. поэтому ею нужно солить в несколько приемов. В составе соли не только соль, там ещё находятся противослёжывающие вещества, например алюмосиликат натрия, а так же йод. Причина различной солёности разных видов соли может крыться именно в том, что в некоторые марки соли было добавлено больше постороннего вещества. Или потому что размер гранул разный. Чем мельче соль, тем она солёнее. Точно в цель 3 года назад Определить соленость соли, не попробовав ее – невозможно. Придется пробовать соль на вкус. Очевидно, что морская соль будет намного соленнее обычной соли. Впрочем, найдите для себя подходящий бренд соли – обычно соленость у соли одной марки все время на одинаковом уровне дольфаника 9 лет назад Это на самом деле правда, бывает соль не соленая и сахар не сладкий. Я так думаю, все дело в определенной плотности или количества минералов, химических элементов. Может в одном районе добычи концентрации того соленого больше, чем, например, в другом районе добывания соляных запасов. Вот и получается, в одной пачке сегодня соль нормальная, а через полгода суп уже не досоленый kellymilena 3 года назад В % измеряется содержание солей в воде — солёность. Это количество растворенные 1 мг воды твердых веществ-кристаллов соли. В разных местах добычи соли этот показатель соли разный. Также на него влияет технология выпаривания и производства соли. На производстве соленость продукта определяется с помощью лабораторных исследований. а в быту- на вкус. Бархатные лапки 3 года назад Скорее всего это зависит от места добычи соли. Так в одном районе добычи соли она может быть соленнее, а в другом – наоборот не такая соленая. Если выбрали соль от одного производителя несколько раз, то уже в курсе какая она будет на вкус. Также я заметила, что соль “Экстра” не такая соленая как поваренная соль. Дени эль 3 года назад Соль не соленая – и это не шутка. С этим сталкивалась каждая хозяйка, купишь другую соль, солишь и все вроде не соленое. Это зависит от производителя и технологии производства. Просто покупайте ту соль, которая устраивает и привычна. Нам нравится соль Соль Илецка. Красное облако 3 года назад Думаю что тут всё дело в том где эта соль добывалась. Действительно одна соль может быть гораздо соленей другой соли. То есть место добычи соли на первом месте, всё остальное уже не так важно. Ка определить? На вкус конечно, по внешнему виду не получится. Знаете ответ? |
Сильные и слабые электролиты

4.2
Средняя оценка: 4.2
Всего получено оценок: 670.
4.2
Средняя оценка: 4.2
Всего получено оценок: 670.
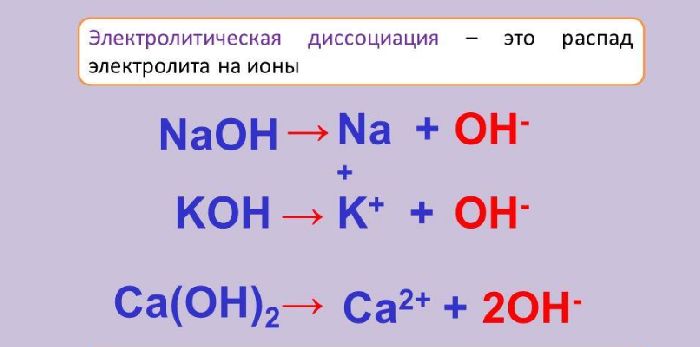
Соединения и простые вещества, расплавы и растворы которых проводят электрический ток, называются электролитами. Выделяют сильные и слабые электролиты.
Что такое электролиты
Под воздействием молекул воды или при нагревании молекулы некоторых веществ распадаются на ионы. В растворе или в расплаве остаются положительно и отрицательно заряженные частицы – катионы и анионы. Они являются переносчиками электрического тока, поэтому растворы и расплавы, содержащие ионы, проводят электрический ток.
Вещества, способные распадаться на ионы, называются электролитами, а процесс распада – электролитической диссоциацией.
Электролиты отличаются друг от друга степенью электролитической диссоциации. Это величина, показывающая отношение распавшихся ионов к общему количеству молекул вещества. Чем больше степень диссоциации, тем быстрее растворяются или расплавляются вещества.
Степень диссоциации вычисляется по формуле α = n/N, где n – количество распавшихся молекул, N – общее количество молекул. Чтобы выразить степень диссоциации в процентах, необходимо n/N умножить на 100 %.
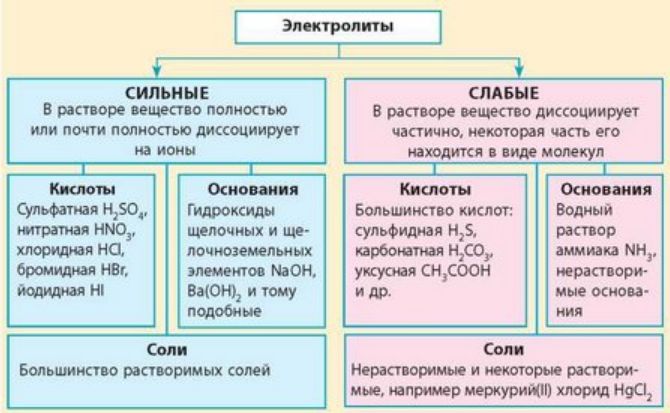
В зависимости от степени диссоциации выделяют два типа электролитов:
- сильные – быстро распадаются на катионы и анионы;
- слабые – затруднительно распадаются ионы.
Диссоциации подвергаются вещества с ковалентными полярными или ионными связями. Молекулы воды оттягиваю полярные молекулы вещества. Нагревание кристаллических веществ вызывает колебание ионов в узлах кристаллической решётки вплоть до её разрушения.
Различия
Краткая характеристика сильных и слабых электролитов представлена в таблице.
|
Признак |
Электролиты |
|
|
Сильные |
Слабые |
|
|
Соединения |
– Растворимые соли (NaCl, KF, Ca(NO3)2, K2PO4); – сильные неорганические кислоты (HNO3, H2SO4, HCl, HBr); – щёлочи (LiOH, NaOH, Ca(OH)2, Ba(OH)2) |
– Органические кислоты (CH3COOH, C2H5COOH); – разбавленные и слабые неорганические кислоты (H2S, H3PO4, HNO2, H2SiO3); – вода; – нерастворимые основания (Mg(OH)2, Fe(OH)2, Zn(OH)2); – гидроксид аммония NH4OH |
|
Степень диссоциации |
α > 30 % |
α < 3 % |
|
Обратимость диссоциации |
Необратимая |
Обратимая. Происходит моляризация – восстановление молекул |
|
Растворимость |
Полностью растворяются |
Частично растворяются |
На степень диссоциации влияют внешние факторы – температура, давление, концентрация вещества или растворителя. При неизменных условиях устанавливается равновесие – константа диссоциации.
Что мы узнали?
Из урока химии узнали, что такое электролиты. Это вещества, способные проводить электрический ток за счёт содержания положительно и отрицательно заряженных ионов – катионов и анионов. Электролиты бывают двух видов. Сильные электролиты необратимо распадаются на ионы. К ним относится большинство солей, сильные кислоты, щёлочи. Слабые электролиты плохо распадаются на ионы. Диссоциация в этом случае протекает обратимо. К слабым электролитам относятся органические и слабые кислоты, вода и нерастворимые основания.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-
Екатерина Давыдова
5/5
-
Лидия Маслова
5/5
Оценка доклада
4.2
Средняя оценка: 4.2
Всего получено оценок: 670.
А какая ваша оценка?
Термин, используемый для описания электрохимического процесса, протекающего в расстворах, а также для обозначения подобного биологического процесса.
Обычно гидролиз представляет собой химический процесс, при котором молекула воды присоединяется к определенному веществу. Иногда это присоединение заставляет молекулу вещества и воды диссоциировать на части. В таких реакциях один фрагмент молекулы-мишени (или родительской молекулы) получает ион водорода. Он разрушает химическую связь в соединении.
Гидролиз солей
Растворимые в воде соли практически полностью диссоциируют на ионы. В некоторых солях катионы более реакционноспособны по сравнению с анионами, и они реагируют с водой с образованием ионов H+. Таким образом, раствор приобретает кислую среду:
M++H2O→MOH+H+M^+ + H_2O → MOH + H^+
В других солях анионы могут быть более реакционноспособными по сравнению с катионами, и они реагируют с водой с образованием ионов ОН–. Таким образом, раствор становится щелочным:
A−+H2O→HA+OH−A^-+ H_2O → HA + OH^-
Процесс гидролиза соли фактически является обратной нейтрализацией:
соль + вода → кислота + основание
Поскольку природа катиона или аниона соли определяет, будет ли ее раствор кислым или щелочным, целесообразно рассмотреть все четыре возможные комбинации.
Соли сильных кислот и слабых оснований
Раствор такой соли является кислым. Катион соли, пришедший из слабого основания, является реакционноспособным. Он реагирует с водой с образованием слабого основания и ионов H+.
B++H2O→BOH+H+B^+ + H_2O → BOH + H^+
Пример 1
Рассмотрим, например, NH4ClNH_4Cl. Он полностью ионизован в воде на ионы NH4+NH_4^+ и Cl−Cl^-. Ионы реагируют с водой с образованием слабого основания (NH4OH)(NH_4OH) и ионов H+H^+.
NH4++H2O→NH4OH+H+NH^+_4 + H_2O → NH_4OH + H^+
Таким образом, концентрация ионов водорода возрастает, и раствор становится кислым.
Соли слабых кислот и сильных оснований
Раствор такой соли является щелочным. Анион соли реагирует с водой с образованием слабых ионов кислоты и OH–ионов.
A−+H2O→HA+OH−A^- + H_2O → HA + OH^-
Пример 2
Рассмотрим, например, соль CH3COONaCH_3COONa. Он полностью ионизирует в воде, чтобы дать ионы CH3COO−CH_3COO^- и Na+Na^+. CH3COO−CH_3COO^- ионы реагируют с водой с образованием слабых кислот, ионов CH3COOHCH_3COOH и OH−OH^- ионов.
CH3COO−+H2O→CH3COOH+OH−CH_3COO^- + H_2O → CH_3COOH + OH^-
Таким образом, концентрация ионов OH–ионов возрастает, раствор становится щелочным.
Соли слабых кислот и слабых оснований
В случае соли такого типа гидролиз происходит максимально, так как катион и анион являются реакционноспособными и реагируют с водой с образованием ионов H+ и OH–. Образованный раствор, как правило, остается нейтральным, но он может быть либо слабо кислым, либо слабощелочным, если обе реакции происходят с разными скоростями.
Пример 3
Рассмотрим, например, соль CH3COONH4CH_3COONH_4. Она диссоциирует на ионы ионы CH3COO−CH_3COO^- и ионы NH4+NH_4^+, которые реагируют с водой:
CH3COO−+H2O→CH3COOH+OH−CH_3COO^- + H_2O → CH_3COOH + OH^-
NH4++H2O→NH4OH+H+NH^+_4 + H_2O → NH_4OH + H^+
Среда раствора соли, образованной слабой кислотой и слабым основанием будет определяться из соотношения pK ее катиона и аниона.
Когда pKa = pKb, pH = 7, то есть раствор соли будет нейтральным.
Когда pKa > pKb. Раствор будет щелочным, так как кислота будет немного слабее, чем основание, а значение pH будет больше 7.
В случае pKa < pKb раствор будет кислым, так как кислота относительно сильнее основания, а pH будет меньше 7.
Соли сильных кислоты и сильных оснований
Такая соль, например NaClNaCl, не подвергается гидролизу, так как ионы не реагируют. Таким образом, раствор будет нейтральным.
Константа и степень гидролиза
Количественно гидролиз оценивают по степени и константе гидролиза.
Количественный показатель характеризующий процесс гидролиза, выражается как степень гидролиза и определяется как доля одного моля соли, которая гидролизуется когда достигнуто равновесие. Он обычно выражается как h или x:
h = (количество гидролизованой соли) / (общее количество соли)
Степень гидролиза зависит от природы соли, ее концентрации и температуры раствора. С разбавлением и повышением температуры раствора степень гидролиза соли растет.
Полнее характеризует гидролиз константа гидролиза (Кг). которая является константой равновесия относительно реакции гидролиза.
Пример 4
Например, для CH3COONaCH_3COONa, гидролиз которого происходит по уравнению:
CH3COO−+H2O→CH3COOH+OH−,CH_3COO^- + H_2O → CH_3COOH + OH^-,
согласно закону действующих масс. Можно записать константу гидролиза Кг в таком виде:
Кг=OH−[CH3COOH][CH3COO−]Кг=frac{OH^-[CH_3COOH]}{[CH_3COO^-]}
Помножим числитель и знаменатель уравнения на [Н+], тогда с учетом того, что [Н+] [ОН–] = Kw, уравнение будет иметь вид
Кг=H+OH−[CH3COOH]H+[CH3COO−]=КwКд(CH3COOH)Кг=frac{H^+OH^-[CH_3COOH]}{H^+[CH_3COO^-]}=frac{Кw}{Кд(CH_3COOH)}
Тест по теме «Гидролиз солей. Константа и степень гидролиза»
Соль подвергается гидролизу, если она растворяется в воде и содержит в своём составе ион слабого электролита.
Любую соль можно рассматривать как продукт реакции основания с кислотой. Вспомним, что основания и кислоты — это электролиты. Они различаются по способности диссоциировать в водных растворах, бывают сильными и слабыми. Сильные основания и кислоты распадаются на ионы полностью, а слабые — частично. В таблице приведены примеры таких оснований и кислот.
|
Сильные основания |
NaOH, LiOH, KOH, Ca(OH)2, Ba(OH)2 |
|
Слабые основания |
NH4OH, Cu(OH)2, Fe(OH)2, Fe(OH)3, Zn(OH)2, Al(OH)3 |
|
Сильные кислоты |
HCl, HBr, HNO3, H2SO4, HClO4 |
|
Слабые кислоты |
HF, H2S, HNO2, H2SO3, H2CO3, H3PO4, CH3COOH |
Способность соли взаимодействовать с водой зависит от того, какие ионы образуются при её растворении в воде. Выделяют четыре группы солей.
Все варианты протекания гидролиза растворимых солей представлены в таблице.