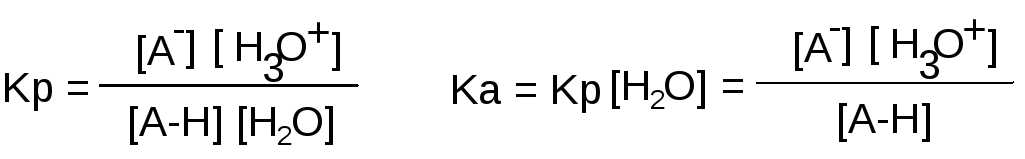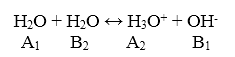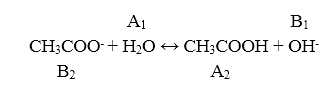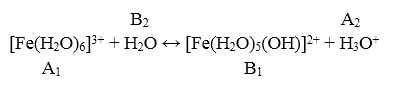H2SO4 + H2O ⇄ HSO4— + H3O+(катион гидроксония)
H2SO4 + CH3COOH ⇄ HSO4— + CH3COOH2+
Номенклатура оснований
Названия оснований образуются весьма просто — сначала идёт слово «гидроксид», а затем название металла, который входит в данное основание. Если металл имеет переменную валентность, это отражают в названии.
KOH — гидроксид калия
Ca(OH)2 — гидроксид кальция
Fe(OH)2 — гидроксид железа (II)
Fe(OH)3 — гидроксид железа (III)
Существует также основание NH4OH (гидроксид аммония), где гидроксогруппа связана не с металлом, а катионом аммония NH4+.
Классификация оснований
Основания можно классифицировать по следующим признакам:
- По растворимости основания делят на растворимые — щёлочи (NaOH, KOH) и нерастворимые основания (Ca(OH)2, Al(OH)3).
- По кислотности (количеству гидроксогрупп) основания делят на однокислотные (KOH, LiOH) и многокислотные (Mg(OH2), Al(OH)3).
- По химическим свойствам их делят на оснóвные (Ca(OH)2, NaOH) и амфотерные, то есть проявляющие как основные свойства, так и кислотные (Al(OH)3, Zn(OH)2).
- По силе (по степени диссоциации) различают:
а) сильные (α = 100 %) – все растворимые основания NaOH, LiOH, Ba(OH)2, малорастворимый Ca(OH)2.
б) слабые (α < 100 %) – все нерастворимые основания Cu(OH)2, Fe(OH)3 и растворимое NH4OH.
Сила оснований
Для оснований можно количественно выразить их силу, то есть способность отщеплять протон от кислоты. Для этого используют константу основности Kb — константу равновесия для реакции между основанием и кислотой, причём в качестве кислоты выступает вода. Чем выше значение константы основности, тем выше сила основания и тем сильнее его способность отщеплять протон. Также вместо самой константы часто используют показатель константы основности pKb. Например, для аммиака NH3 имеем:
Получение
-
Взаимодействие активного металла с водой:
2Na + 2H2O → 2NaOH + H2
Ca + 2H2O → Ca(OH)2 + H2
Mg + 2H2O Mg(OH)2 + H2
-
Взаимодействие основных оксидов с водой (только для щелочных и щелочноземельных металлов):
Na2O + H2O → 2NaOH,
CaO + H2O → Ca(OH)2.
-
Промышленным способом получения щелочей является электролиз растворов солей:
2NaCI + 4H2O 2NaOH + 2H2 + CI2
-
Взаимодействие растворимых солей со щелочами, причем для нерастворимых оснований это единственный способ получения:
Na2SO4 + Ba(OH)2 → 2NaOH + BaSO4
MgSO4 + 2NaOH → Mg(OH)2 + Na2SO4.
Физические свойства
Все основания являются твердыми веществами, имеющими различную окраску. В воде нерастворимы, кроме щелочей.
Внимание! Щёлочи являются очень едкими веществами. При попадании на кожу растворы щелочей вызывают сильные долгозаживающие ожоги, при попадании в глаза могут вызвать слепоту. При работе с ними следует соблюдать технику безопасности и пользоваться индивидуальными средствами защиты.
Внешний вид оснований. Слева направо: гидроксид натрия, гидроксид кальция, метагидроксид железа
Химические свойства
Химические свойства оснований с точки зрения теории электролитической диссоциации обусловлены наличием в их растворах избытка свободных гидроксид – ионов ОН—.
-
Изменение цвета индикаторов:
фенолфталеин – малиновый
лакмус – синий
метиловый оранжевый – желтый
Фенолфталеин придаёт раствору щёлочи малиновую окраску
-
Взаимодействие с кислотами с образованием соли и воды (реакция нейтрализации):
2KOH + H2SO4 → K2SO4 + 2H2O,
растворимое
Mg(OH)2 + 2HCI → MgCI2 + 2H2O.
нерастворимое
-
Взаимодействие с кислотными оксидами:
2KOH + SO3 → K2SO4 + H2O
-
Взаимодействие с амфотерными оксидами и гидроксидами:
а) при плавлении:
2NaOH + AI2O3 → 2NaAIO2 + H2O,
NaOH + AI(OH)3 → NaAIO2 + 2H2O.
б) в растворе:
2NaOH + AI2O3 +3H2O → 2Na[AI(OH)4],
NaOH + AI(OH)3 → Na[AI(OH)4].
-
Взаимодействие с некоторыми простыми веществами (амфотерными металлами, кремнием и другими):
2NaOH + Zn + 2H2O → Na2[Zn(OH)4] + H2
2NaOH + Si + H2O → Na 2SiO3 + 2H2
-
Взаимодействие с растворимыми солями с образованием осадков:
2NaOH + CuSO4 → Cu(OH)2 + Na2SO4,
Ba(OH)2 + K2SO4 → BaSO4 + 2KOH.
-
Малорастворимые и нерастворимые основания разлагаются при нагревании:
Ca(OH)2 → CaO + H2O,
Cu(OH)2 → CuO + H2O.
|
Лекция |
Кислотность
и основность
органических
соединений
Кислотность и
основность – важнейшие понятия,
определяющие многие фундаментальные
физико-химические свойства и биологическую
активность органических соединений.
Теории кислот и
оснований:
– теория
электролитической диссоциации (Аррениус);
– протолитическая
теория (Бренстед-Лоури, 1923 г.);
– теория Льюиса
(1925 г.).
Протолитическая
теории Бренстеда.
В её основе – перенос протона.
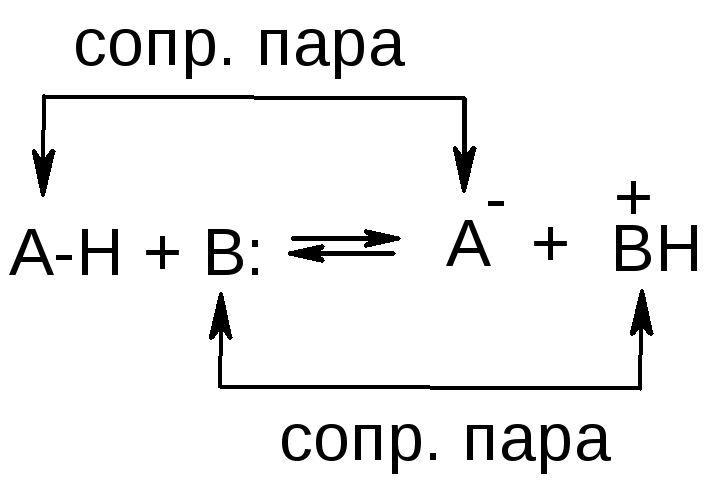
Кислота – это
вещество, способное отдавать протон,
основание –
это вещество, способное присоединять
протон.
Кислота + основание
= сопряженная пара
Кислоты
Кислотами в
принципе являются большинство органических
соединений, т.к. они содержат Н-атомы.
Атом, с которым
связан Н, – центр кислотности. Это могут
быть атомы
C,
O,
N,
S.
Соответственно – CH-,
OH-,
NH-
и SH-кислоты.
Основания
Центрами основности
являются атомы, имеющие неподеленную
пару электронов (n-электроны):
N,
O,
S.
Соответственно
различаются аммониевые,
оксониевые и тиониевые основания
(n-основания).
Это могут быть нейтральные молекулы
или анионы.
Существуют также
π-основания
– соединения с кратными связями или
сопряженной системой π-связей. Они
присоединяют протон, образуя сопряженные
кислоты – π-комплексы.
Количественная
оценка кислотности
Сила кислоты –
это степень сдвига вправо следующего
равновесия:
Ка
– константа кислотности
Ка ↑
– сила кислоты ↑
рКа
= -lgKa
– показатель кислотности; рКа
↑ – сила
кислоты ↓
Количественная
оценка основности
Сила основания
– это степень сдвига вправо следующего
равновесия:
рКвн+
– мера силы основания В: рКвн+
↑ – сила основания В ↑
Качественная
оценка кислотности и основности
Кислоты
(!)
Сила кислоты определяется устойчивостью
сопряженного основания (аниона). Чем
стабильнее анион, тем сильнее кислота.
Устойчивость
аниона, в свою очередь, зависит от
следующих факторов:
– ЭО и поляризуемость
атома в центре кислотности;
– степень
делокализации (-)-заряда в анионе;
– способность
аниона к сольватации.
Природа атома в
центре кислотности
Ряд увеличения
кислотности:
CH < NH < OH < SH
C,
N,
O
– по возрастанию ЭО;
S-Н
– высокая поляризуемость связи (из-за
большого радиуса S)
и её пониженная прочность; большая
делокализация заряда в анионе.
SH-кислоты
– самые сильные, только они способны
образовывать устойчивые соли с металлами.
Они образуют очень прочные комплексы
с тяжелыми металлами и применяются для
их детоксикации и выведения из организма.
Сопряжение
Делокализация
заряда по сопряженной системе увеличивает
стабильность аниона и соответственно
увеличивает кислотность.
(Объяснить на
примере “этанол – фенол – уксусная
кислота”)
Влияние заместителей
Электроакцепторы
усиливают кислотность;
электронодоноры
её уменьшают
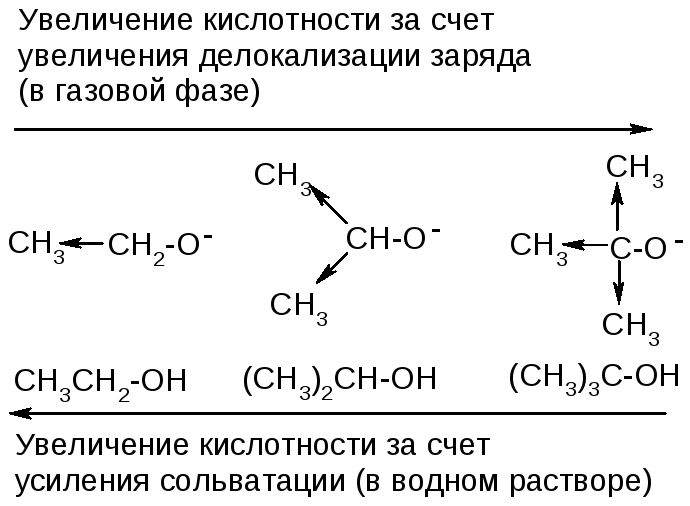
Эффект сольватации
Сольватация
образующего аниона способствует его
устойчивости и увеличивает кислотность.
(!)
Чем меньше размер иона и чем больше в
нем локализован заряд, тем легче он
сольватируется.
Основания
Наиболее сильные
основания – анионы: НО–,
RO–,
NH2–,
HS–.
В реакциях с
кислотами нейтральные молекулы образуют
ониевые соли:
Выделяются три
типа органических оснований:
Сила основания
определяется стабильностью образующегося
катиона, а также доступностью неподеленной
пары электронов для присоединения
протона.
На силу основания
влияют те же факторы, что и на силу
кислоты, но направление их действия
противоположно.
Ряд уменьшения
основности:
R-NH-R
> R-O-R
> R-S-R
> π-основания
– основность
оксониевых оснований уменьшается за
счет большей ЭО кислорода;
– тиониевые
основания более слабые, чем оксониевые
потому, что больший
радиус серы
увеличивает длину связи S-H
в катионе, делает её менее прочной
и тем самым
снижает устойчивость катиона.
Амины – наиболее
сильные основания. Они образуют с
кислотами устойчивые соли растворимые
в воде. Это свойство аминов широко
применяется для их выделения и очистки,
а также для получения растворимых
лекарственных форм.
На силу оснований
большое влияние оказывают заместители
у центра основности:
а) электроноакцепторы
Электроноакцепторы
увеличивают (+)-заряд на катионе, уменьшают
его устойчивость и, следовательно,
уменьшают основность.
б) электронодоноры
Электронодоноры
уменьшают (+)-заряд на катионе, увеличивают
его устойчивость и, следовательно,
увеличивают основность.
Включение
неподеленной электронной пары в
сопряженную систему понижает её
доступность для присоединения протона
и снижает основность:
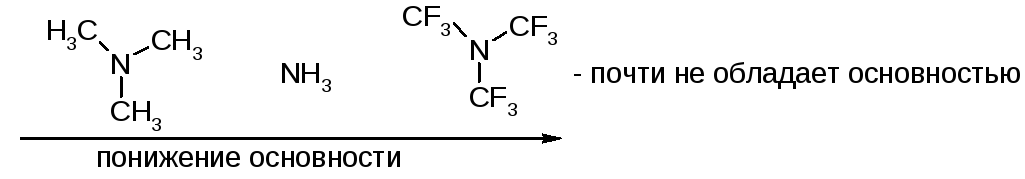
Амиды:
основность по сравнению с аминами резко
снижена, в водных растворах не протонируются
(основность ниже, чем у воды):
Теория кислот и
оснований Льюиса
Кислота – акцептор
электронов;
Основание –
донор электронов
При взаимодействии
кислот и оснований образуются
донорно-акцепторные комплексы:
ИЗМЕНЕНИЕ КИСЛОТНОСТИ
И ОСНОВНОСТИ
ПРИ ДЕЙСТВИИ
РАЗЛИЧНЫХ ФАКТОРОВ
|
Воздействующие |
Кислотность |
Основность |
|
|
Электроотрицательность центрального |
↑ |
↑ |
↓ |
|
↓ |
↓ |
↑ |
|
|
Сопряжение центрального |
↑ |
↓ |
|
|
Заместители |
↑ |
↓ |
|
|
Заместители |
↓ |
↑ |
|
|
Сольватация образующегося |
↑ |
ЛИТЕРАТУРА:
Основная
1. Белобородов
В.Л., Зурабян С.Э., Лузин А.П., Тюкавкина
Н.А. – Органическая химия (основной
курс) – Дрофа, М., 2003 г., с. 138 – 157.
Дополнительная
1.Н.А.Тюкавкина,
Ю.И.Бауков – Биоорганическая химия –
ДРОФА, М.,
2007 г., с.100-111.
11.08.09
9
Соседние файлы в предмете Химия
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Как определить сильное основание
Сильное основание – неорганическое химическое соединение, образованное гидроксильной группой -ОН и щелочным (элементы I группы периодической системы: Li, K, Na, RB, Cs) или щелочноземельным металлом (элементы II группы Ba, Ca). Записываются в виде формул LiOH, KOH, NaOH, RbOH, CsOH, Са(ОН) ₂, Ва(ОН) ₂.

Вам понадобится
- выпарительная чашка
- горелка
- индикаторы
- металлический стержень
- Н₃РО₄
Инструкция
Сильные основания проявляют химические свойства, характерные для всех гидроксидов. Наличие щелочей в растворе определяется по изменению окраски индикатора. К пробе с исследуемым раствором добавьте метилоранж, фенолфталеин или опустите лакмусовую бумажку. Метилоранж дает желтую окраску, фенолфталеин – пурпурную, а лакмусовая бумага окрашивается в синий цвет. Чем сильнее основание, тем интенсивнее окрашивается индикатор.
Если необходимо узнать какие именно щелочи вам представлены, то проведите качественный анализ растворов. Наиболее распространенные сильные основания – гидроксиды лития, калия, натрия, бария и кальция. Основания вступают в реакцию с кислотами (реакции нейтрализации) с образованием соли и воды. При этом можно выделить Са(ОН) ₂, Ва(ОН) ₂ и LiOH. При взаимодействии с ортофосфорной кислотой образуются нерастворимые осадки. Остальные гидроксиды осадков не дадут, т.к. все соли К и Na растворимы.
3 Са(ОН) ₂ + 2 Н₃РО₄ –→ Ca₃(PO₄)₂↓+ 6 H₂О
3 Ва(ОН) ₂ +2 Н₃РО₄ –→ Ва₃(PO₄)₂↓+ 6 H₂О
3 LiOH + Н₃РО₄ –→ Li₃РО₄↓ + 3 H₂О
Процедите их и высушите. Внесите высушенные осадки в пламя горелки. По изменению окраски пламени можно качественно определить ионы лития, кальция и бария. Соответственно вы определите где какой гидроксид. Соли лития окрашивают пламя горелки в карминово-красный цвет. Соли бария – в зеленый, а соли кальция – в малиновый.
Оставшиеся щелочи образуют растворимые ортофосфаты.
3 NaOH + Н₃РО₄–→ Na₃РО₄ + 3 H₂О
3 KOH + Н₃РО₄–→ K₃РО₄ + 3 H₂О
Необходимо выпарить воду до сухого остатка. Выпаренные соли на металлическом стержне поочередно внесите в пламя горелки. Там, где находится соль натрия – пламя окрасится в ярко-желтый цвет, а ортофосфат калия – в розово-фиолетовый. Таким образом имея минимальный набор оборудования и реактивов вы определили все данные вам сильные основания.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Светлана Радиковна Файзуллина
Эксперт по предмету «Химия»
Задать вопрос автору статьи
Константы кислотности и основности
Константа равновесия является количественной характеристикой силы кислоты или основания. Количественно кислотность вычисляют по отношению к воде. При этом мерой кислотности выступает константа равновесия реакции (константа кислотности) $Ka$. Для выражения $A ↔ B + H^+$ константа кислотности равна:
Стандартное равновесие имеет вид: $H_3O^+ ↔ H_2O + H^+$, $Ka = 1$. Тогда для любого кислотно — основного процесса:
$A_1 + B_2 ↔ A_2 + B_1$
При взаимодействии с водой любой кислоты $A$ константы равновесия соответствуют приведенным в справочной литературе значениям:
$A + H_2O ↔ H_3O^+ + B^-$
-
для многоосновных кислот, последовательно отдающих несколько протонов, первая константа кислотности всегда выше последующих;
-
для оксокислот (группы $-OH$ присоединены к одному и тому же атому) $pK_{a2}$ обычно больше $pK_{a1}$ на $5$.
Пример 1
Значения $pK_{ai}$ для ортофосфорной кислоты равны $2,12$; $7,21$; $12,67$ для $i = 1,2,3$ соответственно. То есть в водной среде преобладают разные кислотно — основные равновесия в зависимости от $pH.$
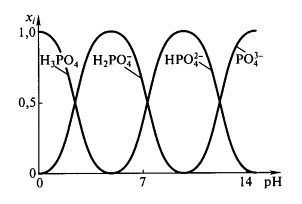
На рис. 1 отображено содержание разных ионов ортофосфорной кислоты как функция $pH$, $x_i$ – доля данного иона в смеси.
Рисунок 1. Зависимость относительного содержания различных ионов ортофосфорной кислоты от $pH$
При небольших значениях $pH$ доля иона ${PO}^{3-}_4$ очень мала, но при $pH > pKa1$ этот ион начинает доминировать. Протонированные ионы, в основном, присутствуют в растворе, когда $pH$ имеет промежуточное между соответствующими $pKa$ значение.
«Сила кислот и оснований» 👇
Константа основности рассчитывается исходя из соотношения:
$B + H_2O ↔ A +OH^-$
Константу кислотности можно связать с константой основности соотношением:
$pKa + pKb = 14.$
Чем сильнее будет сопряженная кислота, тем слабее сопряженное основание. Величине рКa соответствует значение –$lgKa.$
Кислота считается сильной, если $pKa
$HA + H_2O = +A^-$ будут идти практически до конца и кислотные свойства определяются исключительно свойствами $H_3O^+.$
Основание является в водном растворе сильным, если $pKb
Значения $pKa$ для слабых кислот лежат в интервале $sim 2-15,7$.
Автопротолиз воды
Равновесие автопротолиза воды имеет вид:
Рисунок 2.
Для данной реакции термодинамическая константа равновесия установлена экспериментально. При температуре $298 K$ она равна:
$K = [H_3O^+][OH^-] = 1 cdot 10^{-14}$
Данную константу равновесия называют ионным произведением воды $Kw.$
Согласно протолитической теории, константа равновесия реакции автопротолиза равна константе кислотности воды $Ka (H_2O).$ Исходя из величины $Kw$, определяется шкала $pH$:
Рисунок 3.
Гидролиз
Согласно теории Бренстеда — Лоури, гидролиз солей можно рассматривать как частный случай кислотно — основного равновесия. Гидролиз — обменное взаимодействие ионов с водой, протекающее с изменением $pH$.
Гидролиз по аниону представлен уравнением:
Рисунок 4.
Константа гидролиза $Kr$ является константой основности сопряженного основания $CH_3COO^-.$
Гидролиз по каниону представлен уравнением:
Рисунок 5.
В данном примере константа гидролиза является константой кислотности сопряженной кислоты $[Fe(H_2O)_6]^{3+}.$
Чем сильнее гидролиз по аниону, тем слабее кислота. Чем сильнее гидролиз по катиону, тем слабее основание.Равновесие гидролиза практически всегда смещено влево, при $Kr ≪ 1$. Наличие гидролиза можно определить по изменению $pH$ раствора.
Гидролиз усиливается при:
- нагревании;
- разбавлении;
- добавлении веществ, связывающих ионы $OH^-$ или $H_3O^+.$
Находи статьи и создавай свой список литературы по ГОСТу
Поиск по теме

![K_{b}={frac {[{mathsf {NH_{4}^{+}}}]cdot [{mathsf {OH^{-}}}]}{[{mathsf {NH_{3}}}]}}=1{,}79cdot 10^{{-5}};](https://wikimedia.org/api/rest_v1/media/math/render/svg/3a84df26045c54cf2f49c317887b42b68713f776)