Электролиз
Пример
1.
Сколько граммов меди выделится на катоде
при электролизе раствора CuSO4
в течение 1 ч при силе тока 4А? Решение.
Согласно законам Фарадея
![]() (1)
(1)
где m
– масса вещества, окисленного или
восстановленного на электроде; Э –
эквивалент вещества; i
–
сила
тока, A;
t
– продолжительность электролиза, с;
F
– число Фарадея, равное 96500 Кл (А*с).
Эквивалентная
масса меди в СuSO4
равна 63,54 : 2 = 31,77 г. Подставив в формулу
(1) значения Э = 31,77 г, i
=
4 A,
t
= 60*60 = 3600 с, получим :
![]()
Пример
2.
Вычислить эквивалент металла, зная, что
при электролизе раствора хлорида этого
металла затрачено 3880 Кл электричества
и на катоде выделилось 11,742 г металла.
Решение.
Из формулы (1) Э = 11,742*96500/3880 = 29,35 г, где –m
= 11,742 г: it
= Q
= 3880 Кл.
Пример
3.
Чему равна сила тока при электролизе
раствора в течение 1 ч 40 мин 25 с, если
на катоде выделилось 1,4 л водорода,
измеренного при нормальных условиях?
Решение.
Из
формулы (1) i
= m*F/Э*t.
Так
как количество водорода дано в объемных
единицах измерения, то отношение m/Э
заменяем отношением
![]() – объем водорода, л;
– объем водорода, л;![]() – объем эквивалента водорода, л, тогда
– объем эквивалента водорода, л, тогда
![]()
Объем
эквивалента водорода при н.у. равен
половине молекулярного объема 22,4/2 =
11,2 л. Подставив в приведенную формулу
значения
![]() находим:
находим:
![]()
Пример
4.
Сколько граммов едкого кали образовалось
у катода при электролизе раствора
K2SO4,
если
на аноде выделилось 11,2 л кислорода,
измеренного при нормальных условиях?
Решение.
Объем
эквивалента кислорода при нормальных
условиях 22,4/4 =
5,6
л. Следовательно, 11,2 л составляют 2 экв
кислорода. Стойко же, т.е. 2 экв КОН
образовалось
у катода, или 56,11*2 = 112,22 г ( 56,11 г – масса
эквивалента КОН).
261.
Электролиз раствора K2SO4
проводили при силе тока 5 А в течение
3 ч. Составьте электронные уравнения
процессов происходивших на электродах,
вычислите объемы выделившихся на
электродах веществ.
262.
Составьте электронные уравнения
процессов, происходящих на электродах
при электролизе растворов АlСl3
и
NiSO4.
В обоих случаях анод угольный.
263. При
электролизе раствора CuSO4
на
аноде выделилось 168 см3
кислорода,
измеренного при н.у. Сколько граммов
меди выделилось на катоде?
264.
Сколько граммов воды разложилось при
электролизе раствора Na2SO4
при силе тока 7 А в течение 5 ч?
265.
Электролиз раствора нитрата серебра
проводили при силе тока 2 А в течение 4
ч. Сколько граммов серебра выделилось
на катоде?
266.
Электролиз раствора сульфата некоторого
металла проводили при силе тока 6 А в
течение 45 мин, в результате чего на
катоде выделилось 5,49 г металла.
Вычислите эквивалент металла.
267.
Составьте электронные уравнения
процессов, происходящих на электродах
при электролизе раствора КОН, расплава
КОН.
268.
Электролиз раствора сульфата цинка
проводили в течение 5 ч, в результате
чего выделилось 6 л кислорода, измеренного
при н.у. Вычислите силу тока.
269.
Составьте электронные уравнения
процессов, происходящих на электродах
при электролизе раствора Al(SO4)3
в
случае угольного анода; в случае
алюминиевого анода.
270.
Какие вещества и в каком количестве
выдавятся на угольных электродах при
электролизе раствора NаJ
в течение 2,5 ч, если сила тока равна 6 А?
271. При
электролизе; раствора AgNO3
масса серебра анода уменьшилась на
5,4 г. Сколько кулонов электричества
израсходовано на этот процесс?
272.
Какие вещества и в каком количестве
выделятся на угольных электродах при
электролизе раствора КВr
в течение 1 ч 35 мин при силе тока 15 А?
273.
Составьте электронные уравнения
процессов, происходящих при электролизе
раствора CuCl2,
если анод медный; если анод угольный?
274. При
электролизе раствора CaCl2
израсходовано 10722,2 Кл электричества.
Вычислите массы выделившихся на угольных
электродах и образующегося возле
катода веществ.
275.
Составьте электронные уравнения
процессов, происходящих на электродах
при электролизе раствора КСl;
расплава КСl.
276.
Сколько времени нужно проводит электролиз
раствора электролита при силе тока
5 А, чтобы на катоде выделилось 0,1 экв
вещества?
277.
При электролизе растворов MgSO4
и ZnCl2,
соединенных последовательно с
источником тока, на одном из катодов
выделилось 0,25 г водорода. Сколько
граммов вещества выделилось на другом
катоде; на анодах?
278.
Чему равна сила тока, если при электролизе
раствора МgСl2
в течение 30 мин на катоде выделилось
8,4 л водорода, измеренного при н.у.
Вычислите массу вещества выделившегося
на аноде.
279.
Сколько граммов H2SO4
образуется возле анода при электролизе
раствора Na2SO4,
если на аноде выделится 1,12 л кислорода,
измеренного при н.у.? Вычислите массу
вещества, которое выделится на катоде.
280.
Вычислите силу тока, зная, что при
электролизе раствора КОН в течение 1
ч 15 мин 20 с на аноде выделилось 6,4 г
кислорода. Какое вещество и в каком
количестве выделилось на катоде.
Самостоятельное решение задач – боль многих студентов и школьников. Чтобы уменьшить ее, разберем несколько примеров решений задач на электрический ток в электролитах.
Наш телеграм – это полезная информация для всех учащихся, присоединяйтесь! Кстати, у нас есть и второй канал, где публикуется информация об акциях и приятных скидках, не упустите шанс воспользоваться ими.
Электрический ток в электролитах: задачи
Как решать задачи? Прочтите теорию (лучше несколько раз), вспомните памятку по решению физических задач, и вперед!
Задача на ток в электролитах №1
Условие
Проводящая сфера радиусом R = 5 см помещена в электролитическую ванну, наполненную раствором медного купороса. Насколько увеличится масса сферы, если отложение меди длится 30 минут, а электрический заряд, поступающий на каждый квадратный сантиметр поверхности сферы за 1 секунду, равен 0,01 Кл? Молярная масса меди М = 0,0635 кг/моль.
Решение
Площадь поверхности сферы вычислим по формуле:
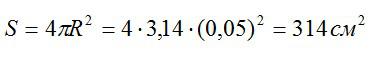
Теперь можем вычислить общий заряд, перенесенный ионами за 30 минут:
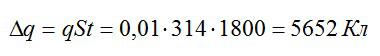
Рассчитаем массу выделившейся меди:
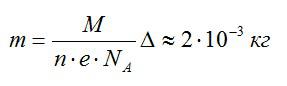
Ответ: 2 грамма.
Задача на ток в электролитах №2
Условие
Электролиз длился один час при силе тока, равной 5 А. Чему равна температура выделившегося атомарного водорода, если при давлении, равном 10^5 Па, его объём равен 1,5 л? Электрохимическии эквивалент водорода принять равным k=1*10^-8 кг/Кл.
Решение
Согласно первому закону Фарадея, масса выделившегося водорода определяется по формуле:
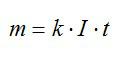
Также эту массу можно выразить из уравнения Клапейрона-Менделеева:
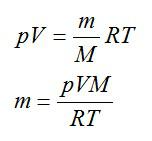
Приравняем два выражения для массы и найдем температуру:
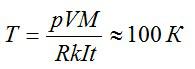
Ответ: 100 К.
Задача на ток в электролитах №3
Условие
В процессе электролиза под действием тока плотностью 300 А/м^2 на электроде выделился слой меди толщиной 0,03 мм. В течении какого времени протекал электролиз?
Решение
Время электролиза определим из закона Фарадея:
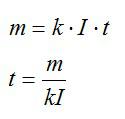
Масса равна плотности, умноженной на объем. Объем меди можно вычислить, зная толщину слоя и плотность. Запишем:
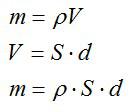
Силу тока выразим через плотность тока и площадь:
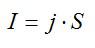
Подставим выражения для массы и силы тока в выражение для времени, упростим его и вычислим:
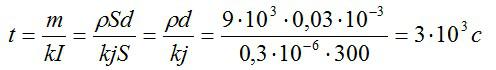
Ответ: 3000 секунд.
Плотность, как и значение электрохимического эквивалента, берутся из таблиц.
Задача на ток в электролитах №4
Условие
Зная электрохимический эквивалент серебра, определите электрохимический эквивалент золота.
Решение
Для решения данной задачи будем применять второй закон Фарадея. Валентость золота и серебра, а также молярные массы этих элементов возьмем из таблицы Менделеева. Запишем известные величины:
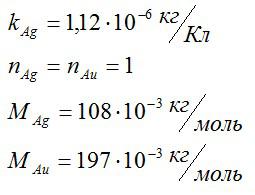
Теперь запишем второй закон Фарадея для золота и серебра:
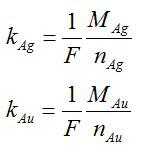
Разделим одно уравнение на другое и выразим искомую величину:
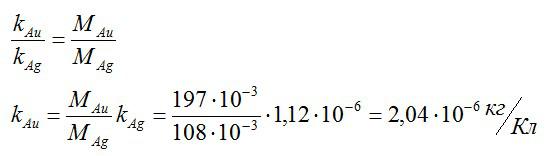
Ответ: 2,04*10^-6 кг/Кл.
Задача на ток в электролитах №5
Условие
Сколько электрической энергии понадобилось для получения серебра массой 0,2 кг, если КПД установки равен 0,8? Электролиз проводят при напряжении 20 В. Электрохимический эквивалент серебра возьмите из предыдущей задачи.
Решение
Энергия, которая идет только на электролиз, равна:
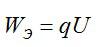
По закону Фарадея:
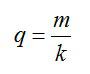
Полная затраченная энергия и энергия, затраченная только на электролиз, связаны выражением:
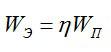
Отсюда:
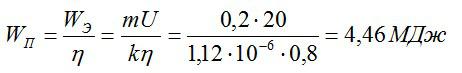
Ответ: 4,46 МДж.
Вопросы на тему «Электрический ток в электролитах»
Вопрос 1. Что такое электролиты?
Ответ. Дадим определение и некоторые сведения об электролитах:
- Электролиты – вещества, проводящие электрический ток вследствие электролитической диссоциации.
- Электролитическая диссоциация – процесс распада молекул на ионы. Диссоциация на ионы происходит в растворах и некоторых твердых кристаллах.
- К электролитам относятся кислоты, соли и некоторые кристаллы.
- Носителями заряда в электролитах являются ионы.
Электролит – широкое понятие, которое используется не только в физике, но также в биологии, химии и медицине. В разных отраслях науки это слово может иметь разные значения.
Вопрос 2. В чем состоит суть электролиза?
Ответ. Электролиз – окислительно-восстановительный процесс, происходящий на электродах, когда ток проходит через раствор электролита. На электродах выделяются части растворенных веществ и продукты вторичных реакций.
Вопрос 3. Сформулируйте первый закон Фарадея.
Ответ. Помимо прочего, Майкл Фарадей занимался задачей исследования проводимости электрического тока в электролитах. Первый закон Фарадея гласит:
Масса вещества, выделившегося на электроде, прямо пропорциональна заряду, переданному на электрод.
Вопрос 4. Как звучит второй закон Фарадея?
Ответ. Второй закон Фарадея гласит:
Масса вещества, осевшего на электроде, прямо пропорциональна молярной массе элемента, деленной на электрохимический эквивалент вещества.
Вопрос 5. Что такое электрохимический эквивалент вещества?
Ответ. Электрохимический эквивалент вещества – количество вещества, которое должно выделиться во время электролиза на электроде, при прохождении через электролит заряда в 1 Кулон.
Нужна скорая помощь в решении задач и других заданий? Обращайтесь за ней в профессиональный сервис для учащихся.
Закон Фарадея для электролиза
Содержание
- 1 Что такое электролиз
- 2 Законы Фарадея об электролизе
- 2.1 Первый закон
- 2.2 Второй закон
- 2.3 Объединённый закон
- 3 Практическое применение
- 4 Видео по теме
В результате исследований Майкла Фарадея были открыты основополагающие законы электролиза. Этот процесс активно используется в современной технике и промышленности. Законы электролиза Фарадея позволяют рассчитать условия протекания процесса и его количественные показатели.

Что такое электролиз
Ток, как известно, представляет собой упорядоченное движение зарядов. Он может протекать не только по проводам, но и через другие вещества. Для этого необходимо, чтобы вещество имело носители зарядов.
В качестве проводника может выступать жидкость, в которой происходят окислительно-восстановительные реакции. В ней имеется большое количество ионов. При пропускании через такой раствор электрического тока происходит оседание вещества на электродах. На практике этим можно воспользоваться, например, для получения металлов с высокой степенью чистоты.

При электролизе на катоде будет проходить процесс восстановления, а на аноде — окисления. Продукты реакций иногда откладываются на электродах, а в некоторых случаях продолжают вступать во вторичные реакции.
Если раствор содержит соли металлов, то последний будет откладываться на катоде, а на аноде образуется газ. Это можно продемонстрировать на электролизе поваренной соли (NaCl). Чистый натрий будет оседать на катоде, а хлор — на аноде.

Растворы веществ, обеспечивающих высокое содержание ионов в жидкости, называются электролитами. Этот термин ввёл в употребление Фарадей. Согласно его определению, речь идёт о тех жидкостях, способных пропускать электроток.
Протекание электролитических реакций возможно при выполнении следующих условий:
- В электролите не должно быть пространственной электрической однородности. В нем должна присутствовать объёмная неравномерность по уровню потенциала. Как пример можно привести ситуацию, когда в аккумуляторах происходит выработка электрического тока. Под его воздействием происходит неравномерное объёмное распределение зарядов в электролитах. Электроток обязательно должен быть постоянным.
- Чтобы можно было говорить о прохождении тока, в растворе должны присутствовать носители электрозарядов. При этом важно, чтобы они могли свободно перемещаться под действием приложенного к ним электрического поля.
На практике к электролитам относят растворимые соли, а также кислоты и щёлочи. При прохождении электротока через металлический проводник в качестве носителей заряда выступают только электроны. В электролитах присутствует ещё одна их разновидность — ионы.

Обычно атомы водорода или металлов теряют электроны и становятся положительными ионами. Отрицательно заряженные ионы —это гидроксильные группы или кислотные молекулярные остатки. При воздействии электрополя на раствор ионы с отрицательным зарядом начинают притягиваться к аноду, а с положительным — к катоду. Электрический ток в жидкостях практически представляет собой одновременное перемещение носителей заряда противоположных знаков.
В результате отрицательные ионы отдают лишние электроны положительному электроду. Соответственно, положительные ионы восполняют недостающие электроны за счёт частиц, которые получают у отрицательного электрода. После восстановления электрической нейтральности эти вещества выделяются из раствора, осаждаясь или выделяясь в виде газа.
Здесь рассмотрена ситуация, когда происходит только одна электролитическая реакция. На практике получившиеся вещества могут участвовать в других реакциях. В результате процесс электролиза становится более сложным. Таких реакций может быть 2, 3 или больше.

Законы Фарадея об электролизе
Процессы электролиза подчиняются законам Фарадея. Он обнародовал свои изыскания в 1833 году, основываясь на собственноручно проделанных опытах.
Первый закон
Первый закон электролиза Фарадея рассматривает массу вещества, которое задержалось на электродах в результате химической реакции при пропускании электротока за определённое время.
Формулировка первого закона Фарадея имеет следующий вид: если взвесить вещество, образовавшееся на электродах в результате пропускания через раствор электротока, то его вес будет пропорционален заряду, прошедшему через этот раствор.

Формула содержит коэффициент пропорциональности k. Он является постоянным для определённого вещества. Его величина равна весу вновь образованного материала при прохождении заряда в 1 Кулон. Коэффициент носит название электрохимического эквивалента.
Уравнение представлено в двух вариантах — с учётом заряда или силы тока. В последнем случае закон Фарадея для электролиза формулируется следующим образом: количество вещества, выделенного на электродах за определённое время, пропорционально силе электротока, протекающего в жидкости.
Закономерность, которую выражает первый закон Фарадея, можно продемонстрировать с помощью опыта. Для этого нужно через раствор медного купороса пропустить электрический ток. Следует сравнить две ситуации, когда пропускается электроток различной силы. При более слабом количество меди, выделившейся на электроде, будет меньше.
Второй закон
Второй закон Фарадея тесно связан с первым. Он гласит следующее: масса, полученного при помощи электролиза вещества, пропорциональна его химическому эквиваленту.
К такому выводу Фарадей пришел, пропуская один и тот же электрический ток в жидкостях различного состава. Взвешивая каждый раз полученный металл, он увидел, что результат получается различным. Ученый понял, что результат зависит от химического состава вещества. Поэтому в законе используется понятие химического эквивалента. Он выражается отношением молярной массы вещества к валентности.

Фарадей провёл дополнительные эксперименты и выяснил, что получить один моль вещества можно, если на электролитическую реакцию затратить 96485 Кулонов. Это число называют постоянной Фарадея и обозначают буквой F.
Исходя из этого, можно записать выражение для определения электрохимического эквивалента:

Следовательно, зная химическую формулу вещества и массу, которую необходимо получить, можно вычислить, какой заряд необходимо в этом случае потратить.
Объединённый закон
Для определения количественных показателей электрохимических реакций на практике используется объединённый закон Фарадея.

Обобщенный закон можно представить в виде такой формулировки: отношение массы полученного вещества к его химическому эквиваленту равно отношению использованного заряда к тому, который надо потратить на извлечение одного моля вещества.
Практическое применение
Электролиз и поясняющие его законы Фарадея, имеют широкое практическое применение. Впервые в истории это явление использовал русский физик Якоби. Он создал оттиски фигур для оформления Исаакиевского собора в Санкт-Петербурге, применив метод, который носит название гальванопластики. Данный метод позволяет получать качественные копии металлических фигур.

Ещё одно направление использования электролиза в химии — получение металлов высокой степени чистоты. В частности, таким образом можно добывать магний, алюминий, натрий и кальций. Обычно электролизу подвергается расплав руды.
Применяя такую технологию, как гальваностегия можно покрывать металлическую деталь тонкой и равномерной оболочкой определённого вещества. Данным способом создают защитные покрытия.
С помощью электролиза можно проводить очищение металлов от примесей, повышая их степень чистоты. Также можно получать концентрированные щёлочи и кислоты.

Электролиз приносит пользу не только за счет того, что на электроде оседает вещество, но и за счет того, что на аноде выделяется газ. Такой технологический процесс позволяет получать, например, водород.
Электрохимия нашла своё применение и при очистке сточных вод. При помощи химического разложения загрязнения выводятся из жидкости, делая её пригодной для повторного использования.
Видео по теме
коэффициент пропорциональности, получивший название электрохимического эквивалента вещества.
Причина электролиза состоит в том, что электролит диссоциирует на ионы, которые движутся под действием электрического поля между электродами и оседают на этих электродах.
В формуле первого закона Фарадея I — полный ток в электролите, равный сумме токов как положительных, так и отрицательных ионов. Обычно это вызывает затруднение у учащихся, которые считают, что к катоду движутся положительные ионы и надо брать ток, равный только току положительных ионов.
Второй закон Фарадея утверждает пропорциональность электрохимических  и химических
и химических  эквивалентов вещества, т. е.
эквивалентов вещества, т. е.  Величина
Величина  где
где  число Фарадея, равное заряду, который должен пройти через электролит, чтобы выделить из него вещество, масса которого численно равна химическому эквиваленту. Химический эквивалент вещества
число Фарадея, равное заряду, который должен пройти через электролит, чтобы выделить из него вещество, масса которого численно равна химическому эквиваленту. Химический эквивалент вещества  где
где  атомный вес,
атомный вес,  валентность вещества.
валентность вещества.
Объединенный закон Фарадея имеет вид 
Задачи по электролизу в основном и сводятся к определению входящих в данную формулу величин.
При выделении вещества на электродах возникает так называемая э.д.с. поляризации —  Ток в цепи уменьшается и становится равным
Ток в цепи уменьшается и становится равным  где
где  напряжение между электродами в электролитической ванне,
напряжение между электродами в электролитической ванне,  сопротивление цепи. В большинстве задач в средней школе Епол не учитывают, так как рассматривают случай, когда
сопротивление цепи. В большинстве задач в средней школе Епол не учитывают, так как рассматривают случай, когда  .
.
Вначале решают тренировочные задачи типа 725, 726, потом более сложные.
725. При серебрении изделия за  на катоде отложилось
на катоде отложилось  серебра. Определите силу тока при электролизе.
серебра. Определите силу тока при электролизе.
Решение. По первому закону электролиза  откуда
откуда  Значение
Значение  берем из таблиц.
берем из таблиц.

Серебро, как и все металлы, откладывается на катоде, так как ионы металла положительные.
726. Сколько никеля выделится при электролизе за время  при токе
при токе  если известно, что атомный вес никеля
если известно, что атомный вес никеля  а валентность
а валентность 
Решение. Массу никеля определяем по объединенному
Железо двухвалентно  значит, число ионов железа, прошедших через раствор, и число выделившихся атомов в 2 раза меньше числа ионов хлора.
значит, число ионов железа, прошедших через раствор, и число выделившихся атомов в 2 раза меньше числа ионов хлора.
Хлор выделяется на аноде, а железо на катоде.
Что такое электролиз
Ток, как известно, представляет собой упорядоченное движение зарядов. Он может протекать не только по проводам, но и через другие вещества. Для этого необходимо, чтобы вещество имело носители зарядов.
В качестве проводника может выступать жидкость, в которой происходят окислительно-восстановительные реакции. В ней имеется большое количество ионов. При пропускании через такой раствор электрического тока происходит оседание вещества на электродах. На практике этим можно воспользоваться, например, для получения металлов с высокой степенью чистоты.
При электролизе на катоде будет проходить процесс восстановления, а на аноде — окисления. Продукты реакций иногда откладываются на электродах, а в некоторых случаях продолжают вступать во вторичные реакции.
Если раствор содержит соли металлов, то последний будет откладываться на катоде, а на аноде образуется газ. Это можно продемонстрировать на электролизе поваренной соли (NaCl). Чистый натрий будет оседать на катоде, а хлор — на аноде.
Растворы веществ, обеспечивающих высокое содержание ионов в жидкости, называются электролитами. Этот термин ввёл в употребление Фарадей. Согласно его определению, речь идёт о тех жидкостях, способных пропускать электроток.
Протекание электролитических реакций возможно при выполнении следующих условий:
- В электролите не должно быть пространственной электрической однородности. В нем должна присутствовать объёмная неравномерность по уровню потенциала. Как пример можно привести ситуацию, когда в аккумуляторах происходит выработка электрического тока. Под его воздействием происходит неравномерное объёмное распределение зарядов в электролитах. Электроток обязательно должен быть постоянным.
- Чтобы можно было говорить о прохождении тока, в растворе должны присутствовать носители электрозарядов. При этом важно, чтобы они могли свободно перемещаться под действием приложенного к ним электрического поля.
На практике к электролитам относят растворимые соли, а также кислоты и щёлочи. При прохождении электротока через металлический проводник в качестве носителей заряда выступают только электроны. В электролитах присутствует ещё одна их разновидность — ионы.
Обычно атомы водорода или металлов теряют электроны и становятся положительными ионами. Отрицательно заряженные ионы —это гидроксильные группы или кислотные молекулярные остатки. При воздействии электрополя на раствор ионы с отрицательным зарядом начинают притягиваться к аноду, а с положительным — к катоду. Электрический ток в жидкостях практически представляет собой одновременное перемещение носителей заряда противоположных знаков.
В результате отрицательные ионы отдают лишние электроны положительному электроду. Соответственно, положительные ионы восполняют недостающие электроны за счёт частиц, которые получают у отрицательного электрода. После восстановления электрической нейтральности эти вещества выделяются из раствора, осаждаясь или выделяясь в виде газа.
Здесь рассмотрена ситуация, когда происходит только одна электролитическая реакция. На практике получившиеся вещества могут участвовать в других реакциях. В результате процесс электролиза становится более сложным. Таких реакций может быть 2, 3 или больше.
Факторы, влияющие на процесс электролиза
Процесс электролиза зависит от следующих факторов:
- Состав электролита. Значительное влияние оказывают различные примеси. Они подразделяются на 3 типа – катионы, анионы и органика. Вещества могут быть более или менее отрицательными, чем основной металл, что и мешает процессу. Среди органических примесей выделяются загрязнители (например масла) и ПАВ. Их концентрация имеет предельно допустимые значения.
- Плотность тока. В соответствии с законами Фарадея, масса осаждаемого вещества увеличивается с увеличением силы тока. Однако возникают неблагоприятные обстоятельства – концентрированная поляризация, повышенное напряжение, интенсивный разогрев электролита. С учетом этого существуют оптимальные значения плотности тока для каждого конкретного случая.
- рН электролита. Кислотность среды также выбирается с учетом металлов. Например оптимальное значение кислотности электролита для цинка – 140 г/куб.дм.
- Температура электролита. Она влияет неоднозначно. С увеличением температуры растет скорость электролиза, но повышается и активность примесей. Для каждого процесса есть оптимальная температура. Обычно она находится в пределах 38-45 градусов.
Важно! Электролиз можно ускорить или замедлить путем различных воздействий и выбора состава электролита. Для каждого варианта применения существует свой режим, который следует строго соблюдать.
Электролиз в промышленности
Принцип разделения веществ с помощью электричества не сложен и хорошо изучен, поэтому много где применяется.
В результате разложения получаются различные химических вещества (металлы, щелочи, газы) в чистом виде, производится синтез органических частиц и неорганического материала, очистка сточных вод, разряжаются аккумуляторы, защищаются от коррозии и других негативных воздействий поверхности техники, инструментов и предметов быта.
Электролиз – это основной (а зачастую – и единственный) способ получения вещества высокой чистоты и качества.
Применение электролиза в технике, благодаря способности катода осаждать на себе молекулы химических элементов, позволяет создавать прочные бесшовные трубы, надежное защитное покрытие для металлических поверхностей, ювелирные украшения, точные слепки со сложных форм.
Добыча металлов
Электролиз расплавов эффективно используется при выделении из руды или солей активных металлов вроде алюминия, калия, бериллия или натрия.
Чтобы создать электролит из бокситов – алюминиевой руды, в которой металл находится в виде оксида – их растворяют в криолите.
В емкости, где проходит электролиз, катодом является дно, покрытое слоем углерода, а анодом – инертный углеродный стержень.
В результате этой реакции продукт электролиза – чистый алюминий – скапливается на дне и сливается через специальные отверстия.
Электрометаллургия
Добыча металлов в электрометаллургии производится двумя видами процессов – электротермическими и электрохимическими.
В первом случае выделение из руд и концентратов чистого вещества или образования сплава достигается за счет использования электричества как источника тепловой энергии.
Во втором случае производство металла основывается на принципах электрохимического взаимодействия веществ.
Электролиз расплава или раствора солей дает возможность получать металлы повышенной чистоты, отделяя их от примесей буквально по молекулам.
Процесс рафинирование – это очистка меди
Чтобы получить очень чистую, рафинированную медь, в качестве электродов используются стержни или пластины из уже очищенного и с примесями металла и электролита – раствора сульфата меди.
Загрязненный электрод заряжается положительно и, в качестве активного анода, растворяется в процессе реакции.
Молекулы меди осаждаются на чистом катоде, а примеси выпадают на дно емкости в виде осадка.
Таким же способом очищают золото, серебро и другие цветные металлы.
Гальванопластика
С помощью нанесения на исходный предмет равномерного металлического слоя возможно создать неограниченное число его копий.
Для этого с оригинала снимается слепок и покрывается слоем электропроводящего вещества.
Таким образом делаются слепки со сложных поверхностей, украшения и многого другого
Гальваническое покрытие
Электролизом можно нанести тонкий равномерный слой металла на поверхность предметов с целью сделать ее менее активной, защитить от негативных влияний, украсить, повысить или понизить электропроводимость.
При этом обрабатываемый предмет выступает в роли электрода, а соль металла – как электролит.
В зависимости от дальнейшего предназначения гальванизируемого предмета его таким способом покрывают цветными и драгоценными металлами.
Законы Фарадея об электролизе
Процессы электролиза подчиняются законам Фарадея. Он обнародовал свои изыскания в 1833 году, основываясь на собственноручно проделанных опытах.
В результате проведения многих исследований в 1834 году английский физикохимик Майкл Фарадей (в его честь названа единица измерения электрической емкости — фарада) вывел два закона, которые способны количественно описать процесс электролиза. Хотя сам факт разложения соединений под действием проходящего электричества через их растворы был открыт задолго до Фарадея. В 1800 году другой английский ученый Уильям Николсон установил экспериментально этот факт.
Заслуги Фарадея в исследовании электролиза огромны. Он ввел в физикохимию основные термины, которые до сих пор используются для описания этого процесса. Два закона ученого в современной формулировке представляются следующим образом:
- Масса вещества, которая оседает на электроде в процессе электролиза, прямо пропорциональна количеству электричества, проходящему через рассматриваемый электрод. Под количеством электричества понимается заряд, который в системе СИ измеряется в кулонах.
- Для постоянного количества электричества масса химического соединения, которая образуется в ходе электролиза на электроде, является прямо пропорциональной величиной эквиваленту этого вещества. Под эквивалентом полагается отношение молярной массы к количеству молей электронов, участвующих в реакции. Это число совпадает с валентностью элемента, например, для Al3+ оно равно 3, а для H+ составляет 1.
Математическая формула
Оба закона получены Фарадеем экспериментальным путем. Их словесные формулировки можно легко объединить и перевести на математический язык. Общее уравнение, которое удобно использовать при решении любых практических задач, принимает следующую форму:
m = (Q/F)*(M/z).
Здесь m — масса образующегося вещества на электроде, Q — заряд, прошедший через электрод в процессе реакции, F — коэффициент пропорциональности, который называют постоянной Фарадея, M — молярная масса вещества, участвующего в химической реакции, z — его валентность (безразмерное число).
Первый множитель этого уравнения математически отражает сформулированный первый закон Фарадея, соответственно, второй множитель является выражением пропорциональности массы вещества его эквиваленту (M/z).
Эту формулу можно преобразовать, если вспомнить из курса общей физики, что заряд вычисляется по формуле:
Q = I*t.
Здесь I — электрический ток в амперах, t — время его прохождения через электролит. Подставив это выражение в математический закон Фарадея, и преобразуя его, можно получить следующие формулы:
m = kIt = (I*t/F)*(M/z) ==>
n*z*F = I*t.
Буквой n здесь обозначено количество выделившегося вещества на электроде в молях (n = m/M).
Значение постоянной F
Численное значение постоянной Фарадея составляет приблизительно 96500 Кл/моль. Физический смысл этой величины заключается в том, что она говорит, какое количество электричества необходимо пропустить через раствор, чтобы выделилось на электроде 1 моль одновалентного вещества.
Величина F тесно связана с постоянной Авогадро NA и с элементарным зарядом электрона e следующим выражением:
F = NA*e.
Эта формула в XIX веке была использована учеными для точного определения числа NA. Сам Фарадей определил постоянную, носящую его фамилию, благодаря изучению процесса электролиза серебряного раствора.
В настоящее время проводятся эксперименты с целью точного определения величины F (а значит, NA), чтобы ее использовать для переопределения единицы измерения массы — килограмма.
Первый закон
Если пропускать через раствор медного купороса электрический ток в течение определённого количества времени, то на катоде выделяется небольшое количество меди. Однако если пустить ток большей силы, за такое же количество времени на катоде образуется большее количество меди. При увеличении времени и одинаковой силе тока также увеличивается количество меди.
Фарадей установил взаимосвязь массы вещества, силы тока и времени. Математически эта взаимосвязь выражается следующим образом:
m = kIt,
где:
- m – масса вещества;
- k – электрохимический эквивалент;
- I – сила тока;
- t – время.
Электрохимический эквивалент – это масса вещества, образованная при прохождении через электролит тока в 1 А за одну секунду. Выражается как соотношение массы вещества к количеству электричества или г/Кл.
Произведение силы тока и времени выражает количество электричества: q = It. Это электрический заряд, измеряемый в кулонах (один ампер к одной секунде). Электрический заряд отражает способность тела быть источником электромагнитного поля и принимать участие в электромагнитном взаимодействии.
Соответственно, уравнение Фарадея приобретает вид:
m = kq. 
Первый закон электролиза Фарадея: масса вещества, выделившегося при электролизе, прямо пропорциональна количеству электрического тока, пропущенного через электролит.
Второй закон
Фарадей, пропуская электрический ток одинаковой силы через различные электролиты, заметил, что массы веществ на электродах неодинаковы. Взвесив выделившиеся вещества, Фарадей сделал вывод, что вес зависит от химической природы вещества. Например, на каждый грамм выделенного водорода приходилось 107,9 г серебра, 31,8 г меди, 29,35 г никеля.
На основе полученных данных Фарадей вывел второй закон электролиза: для определённого количества электричества масса химического элемента, образовавшегося на электроде, прямо пропорциональна эквивалентной массе элемента. Она равна массе одного эквивалента – количеству вещества, реагирующему или замещающему 1 моль атомов водорода в химических реакциях:
μeq = μ/z,
где:
- μ – молярная масса вещества;
- z – число электронов на один ион (валентное число ионов).
Для выделения одного моля эквивалента затрачивается одинаковое количество электричества – 96485 Кл/моль. Это число называется числом Фарадея и обозначается буквой F.
Согласно второму закону, электрохимический эквивалент прямо пропорционален эквивалентной массе вещества:
k = (1/F) μeq или k = (1/zF)μ.
Два закона Фарадея можно привести к общей формуле: m = (q / F) ∙ (μ/z).

Электролиз расплавов
Один из вариантов электролиза – использование в качестве электролита расплав. В этом случае в электролизном процессе участвуют только ионы расплава. В качестве классического примера можно привести электролиз солевого расплава NaCl (поваренная соль). К аноду устремляются отрицательные ионы, а значит, выделяется газ (Cl). На катоде будет происходить восстановление металла, т.е. оседание чистого Na, образующегося из положительных ионов, притянувших избыточные электроны. Аналогично можно получать другие металлы (К, Са, Li и т.д.) из расправа соответствующих солей.
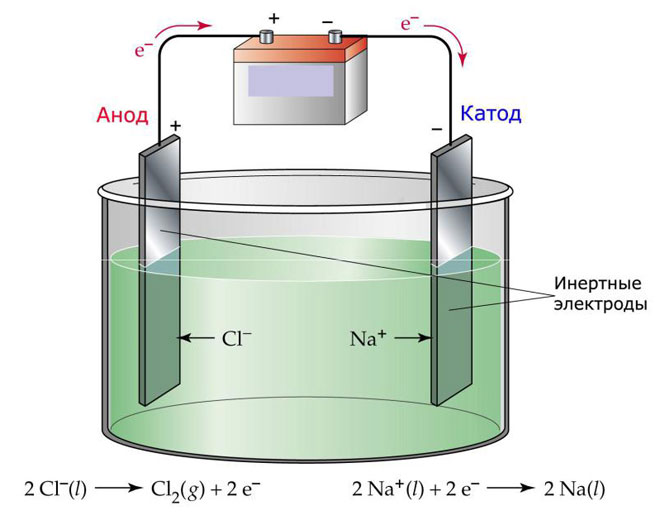
При электролизе в расплаве электроды не подвергаются растворению, а участвуют только в качестве источника тока. При их изготовлении можно использовать металл, графит, некоторые полупроводники. Важно, чтобы материал имел достаточную проводимость. Один из наиболее распространенных материалов – медь.
Особенности электролиза в растворах
Электролиз в водном растворе существенно отличается от расплава. Здесь имеют место 3 конкурирующих процесса: окисление воды с выделением кислорода, окисление аниона и анодное растворение металла. В процессе задействованы ионы воды, электролита и анода. Соответственно, на катоде может происходить восстановление водорода, катионов электролита и металла анода.
Возможность протекания указанных конкурирующих процессов зависит от величины электрических потенциалов системы. Протекать будет только тот процесс, который требует меньше внешней энергии. Следовательно, на катоде будут восстанавливаться катионы, имеющие максимальный электродный потенциал, а на аноде – окисляться анионы с наименьшим потенциалом. Электродный потенциал водорода принят за «0». Для примера, у калия он равен (-2,93 В), натрия – (-2,71 В), свинца (-0,13 В), а у серебра – (+0,8 В).
Законы Фарадея. Выход продукта по току
Количество веществ, образующихся при электролизе на электродах, можно рассчитать, пользуясь двумя законами электролиза, установленными Фарадеем в 1833 г. которые с учетом современной терминологии можно сформулировать в следующем виде:
1) количество вещества, испытавшего электрохимические превращения на электроде, прямо пропорционально количеству прошедшего электричества;
2) массы прореагировавших на электродах веществ при постоянном количестве электричества относятся друг к другу как молярные массы их эквивалентов.
Для расчетов используют математическое выражение обобщенного закона Фарадея:
| где: | Э – эквивалентная масса вещества (молярная масса эквивалента); F– постоянная Фарадея, равная 96500 Кл/моль;. I – сила тока, А; t – время проведения электролиза, с; М – молярная масса вещества; n – число отданных или принятых электронов; К – электрохимический эквивалент вещества. |
Практический расход тока при электролизе вследствие протекания побочных процессов (взаимодействие полученных веществ с электродом или электролитом) превышает его количество, рассчитанное согласно закону Фарадея. Следовательно, практическая масса полученных веществ отличается от теоретически рассчитанной. Отношение массы практически полученного вещества к теоретически рассчитанной массе, выраженное в процентах, называется выходом вещества по току:
Примеры решения типовых задач.
Пример 1.Ряд активности металлов, электродных потенциалов.
Задача 1. Медная пластинка массой 10 г была погружена в раствор нитрата серебра, затем промыта водой и высушена. Масса ее оказалась равной 11,0 г. Сколько серебра из раствора выделилось на пластинке?
Решение.
Для решения этой задачи необходимо знать стандартные электродные потенциалы металлов, т.е. место их в ряду напряжений (ряду активности металлов Бекетова).
Из этих положительных потенциалов стандартный электродный потенциал меди менее положителен, следовательно, пойдёт реакция вытеснения:
Для того чтобы вычислить количество серебра, выделившегося на медной пластинке, надо помнить, что медная пластинка в этой реакции и сама растворяется, теряя в массе.
Обозначим количество растворившейся меди через x г, тогда масса медной пластинки с учётом её растворения будет (10-х) г, масса выделившегося серебра на основе реакции:
64,0 г Cu – 2 ∙ 108 г Ag
х г Cu – (1+х) г Ag
216х =64+64х, 152x=64, x=0,42 г.
Таким образом, в течение реакции растворилось 0,42 г
меди и выделилось 1,0 + 0,42 =
1,42 г
серебра.
Пример 2.Работа гальванического элемента и расчёт ЭДС.
Задача 1. Напишите уравнения реакций, происходящих при работе гальванического элемента, состоящего из цинковой и серебряной пластин, опущенных в растворы своих солей с концентрацией катионов, равной 1 моль/л.
Решение
. Стандартные электродные потенциалы цинкового и серебряного электродов соответственно равны:
Металл, имеющий более отрицательное значение электродного потенциала при работе гальваничеcкого элемента, является анодом. В данном случае протекают реакции:
т.е. цинк, являясь анодом, растворяется при работе гальваничеcкого элемента, а серебро осаждается в виде металла на катоде. ЭДС
гальванического элемента равна
Пример 3.
Зависимость электродных процессов от концентрации.
Задача 1. Рассчитайте, чему равна ЭДС элемента, составленного из медной и магниевой пластин, опущенных в растворы своих солей, если концентрация катиона у анода равна 0,1 моль/л, а у катода – 0,001 моль/л.
Решение.
Стандартные электродные потенциалы магниевого и медного электродов соответственно равны:
Следовательно, анодом будет магниевый электрод, катодом – медный. Электродный потенциал металла, опущенного в раствор с любой концентрацией катиона в растворе, определяют по формуле Нернста:
где: с
– концентрация катиона, моль/л;
п
– число электронов, принимающих участие в реакции.
Отсюда потенциал магниевого электрода
=
–2,38 + lg10 –1 = –2,38 + 0,029(–1) = –2,409 В.
Потенциал медного электрода
=
+0,34 + lg10 –3 = +0,34 + 0,029(–3) = +0,253 В.
Тогда для гальванического элемента
Пример 4.
Определение возможности протекания реакции в гальвани-ческом элементе.
Задача 1. Исходя из величины стандартных электродных потенциалов и значения энергии Гиббса ΔG о 298, укажите, можно ли в гальваническом элементе осуществить следующую реакцию:
Fe 0 + Cd 2+ = Fe 2+ + Cd 0 .
Решение.
Надо составить схему гальванического элемента, отвечающего данной реакции. В этой реакции происходит восстановление ионов кадмия и окисление атомов железа:
Fe 0 – 2е = Fe 2+
Кажущиеся случаи отклонения от законов Фарадея
I закон Фарадея, базирующийся на атомистической природе вещества и электричества, является точным законом природы. Отклонений от него быть не может. Если на практике при расчетах наблюдаются отклонения от этого закона, то они всегда обусловлены неполным учетом процессов, сопутствующих основной электрохимической реакции. Например, при электролизе водного раствора NaCl в системе с платиновыми электродами и разделенными пористой диафрагмой анодным и катодным пространствами на катоде протекает реакция:
2H2O + 2ē = H2 + 2OH-
а на аноде: 2Cl- — 2ē = Cl2
Количество образующегося газообразного хлора всегда меньше, чем это следует по закону Фарадея из-за того, что Cl2растворяется в электролите и вступает в реакцию гидролиза:
Cl2+ H2O → HCl+ HClO
Если учесть массу хлора, прореагировавшего с водой, получим результат, соответствующий рассчитанному по закону Фарадея.
Или при анодном растворении многих металлов параллельно идут два процесса – образование ионов нормальной валентности и так называемых субионов – т.е. ионов низшей валентности, например: Cu0 — 2ē → Cu2+ и Cu- 1ē → Cu+.
Поэтому расчет по закону Фарадея в предположении, что образуются только ионы высшей валентности, оказывается неправильным.
Часто на электроде протекает не одна электрохимическая реакция, а несколько самостоятельных параллельных реакций. Например, при выделении Zn из кислого раствора ZnSO4наряду с разрядом ионов Zn:
Zn2+ +2ē →Zn
протекает реакция восстановления ионов гидроксония: 2Н3О+ +2ē → Н2 + 2H2O.
Если на электроде протекает несколько параллельных электрохимических реакций, то I закон Фарадея будет справедлив для каждой из них.
Законы электролиза Фарадея представляют собой количественные соотношения, основанные на электрохимических исследованиях Майкла Фарадея, которые он опубликовал в 1836 году.
Данные законы определяют связь между количеством веществ, выделяющихся при электролизе и количеством электричества, которое прошло при этом через электролит. Законов Фарадея два. В научной литературе и в учебниках встречаются различные формулировки данных законов.
Электролиз
— выделение из электролита входящих в его состав веществ при прохождении электрического тока. Так, например, при пропускании электрического тока через слегка подкисленную воду вода разлагается на составные части — газы (кислород и водород).
Количество выделившегося из электролита вещества пропорционально количеству протекшего через электролит электричества, т. е. произведению из силы тока на время, в течение которого этот ток протекал. Поэтому явление электролиза может служить для измерения силы тока и определения единицы силы тока.
Электролит
— раствор и вообще сложная жидкость, проводящая электрический ток. В аккумуляторах электролитом служит раствор серной кислоты (в свинцовых) или раствор едкого калия, либо едкого натра (в железоникелевых). В гальванических элементах электролитом служат также растворы каких-либо химических соединений (нашатыря, медного купороса и т. п.).
Предыдущая
РазноеСбережения и рост: как работает сложный процент на депозитах и счетах
Следующая
РазноеКак откалибровать акселерометр?
