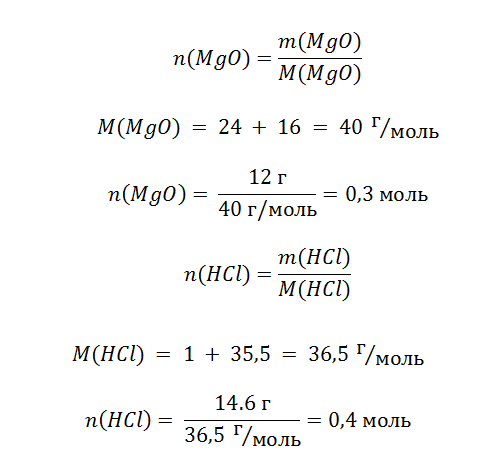В этой статье мы коснемся нескольких краеугольных понятий в химии, без которых совершенно невозможно
решение задач. Старайтесь понять смысл физических величин, чтобы усвоить эту тему.
Я постараюсь приводить как можно больше примеров по ходу этой статьи, в ходе изучения вы увидите множество примеров
по данной теме.

Относительная атомная масса – Ar
Представляет собой массу атома, выраженную в атомных единицах массы. Относительные атомные массы указаны в периодической
таблице Д.И. Менделеева. Так, один атом водорода имеет атомную массу = 1, кислород = 16, кальций = 40.
Относительная молекулярная масса – Mr
Относительная молекулярная масса складывается из суммы относительных атомных масс всех атомов, входящих в состав вещества.
В качестве примера найдем относительные молекулярные массы кислорода, воды, перманганата калия и медного купороса:
Mr (O2) = (2 × Ar(O)) = 2 × 16 = 32
Mr (H2O) = (2 × Ar(H)) + Ar(O) = (2 × 1) + 16 = 18
Mr (KMnO4) = Ar(K) + Ar(Mn) + (4 × Ar(O)) = 39 + 55 + (4 * 16) = 158
Mr (CuSO4*5H2O) = Ar(Cu) + Ar(S) + (4 × Ar(O)) + (5 × ((Ar(H) × 2) +
Ar(O))) = 64 + 32 + (4 × 16) + (5 × ((1 × 2) + 16)) = 160 + 5 * 18 = 250
Моль и число Авогадро
Моль – единица количества вещества (в системе единиц СИ), определяемая как количество вещества, содержащее столько же структурных единиц
этого вещества (молекул, атомов, ионов) сколько содержится в 12 г изотопа 12C, т.е. 6 × 1023.
Число Авогадро (постоянная Авогадро, NA) – число частиц (молекул, атомов, ионов) содержащихся в одном моле любого вещества.

Больше всего мне хотелось бы, чтобы вы поняли физический смысл изученных понятий. Моль – международная единица количества вещества, которая
показывает, сколько атомов, молекул или ионов содержится в определенной массе или конкретном объеме вещества. Один моль любого вещества
содержит 6.02 × 1023 атомов/молекул/ионов – вот самое важное, что сейчас нужно понять.
Иногда в задачах бывает дано число Авогадро, и от вас требуется найти, какое вам дали количество вещества (моль). Количество вещества в химии
обозначается N, ν (по греч. читается “ню”).
Рассчитаем по формуле: ν = N/NA количество вещества 3.01 × 1023 молекул воды и 12.04 × 1023 атомов углерода.

Мы нашли количества вещества (моль) воды и углерода. Сейчас это может показаться очень абстрактным, но, иногда не зная, как найти
количество вещества, используя число Авогадро, решение задачи по химии становится невозможным.
Молярная масса – M
Молярная масса – масса одного моля вещества, выражается в “г/моль” (грамм/моль). Численно совпадает с изученной нами ранее
относительной молекулярной массой.
Рассчитаем молярные массы CaCO3, HCl и N2
M (CaCO3) = Ar(Ca) + Ar(C) + (3 × Ar(O)) = 40 + 12 + (3 × 16) = 100 г/моль
M (HCl) = Ar(H) + Ar(Cl) = 1 + 35.5 = 36.5 г/моль
M (N2) = Ar(N) × 2 = 14 × 2 = 28 г/моль
Полученные знания не должны быть отрывочны, из них следует создать цельную систему. Обратите внимание: только что мы рассчитали
молярные массы – массы одного моля вещества. Вспомните про число Авогадро.
Получается, что, несмотря на одинаковое число молекул в 1 моле (1 моль любого вещества содержит 6.02 × 1023 молекул),
молекулярные массы отличаются. Так, 6.02 × 1023 молекул N2 весят 28 грамм, а такое же количество молекул
HCl – 36.5 грамм.
Это связано с тем, что, хоть количество молекул одинаково – 6.02 × 1023, в их состав входят разные атомы, поэтому и
массы получаются разные.

Часто в задачах бывает дана масса, а от вас требуется рассчитать количество вещества, чтобы перейти к другому веществу в реакции.
Сейчас мы определим количество вещества (моль) 70 грамм N2, 50 грамм CaCO3, 109.5 грамм HCl. Их молярные
массы были найдены нам уже чуть раньше, что ускорит ход решения.

ν (CaCO3) = m(CaCO3) : M(CaCO3) = 50 г. : 100 г/моль = 0.5 моль
ν (HCl) = m(HCl) : M(HCl) = 109.5 г. : 36.5 г/моль = 3 моль
Иногда в задачах может быть дано число молекул, а вам требуется рассчитать массу, которую они занимают. Здесь нужно использовать
количество вещества (моль) как посредника, который поможет решить поставленную задачу.
Предположим нам дали 15.05 × 1023 молекул азота, 3.01 × 1023 молекул CaCO3 и 18.06 × 1023 молекул
HCl. Требуется найти массу, которую составляет указанное число молекул. Мы несколько изменим известную формулу, которая поможет нам связать
моль и число Авогадро.

Теперь вы всесторонне посвящены в тему. Надеюсь, что вы поняли, как связаны молярная масса, число Авогадро и количество вещества.
Практика – лучший учитель. Найдите самостоятельно подобные значения для оставшихся CaCO3 и HCl.
Молярный объем
Молярный объем – объем, занимаемый одним молем вещества. Примерно одинаков для всех газов при стандартной температуре
и давлении составляет 22.4 л/моль. Он обозначается как – VM.
Подключим к нашей системе еще одно понятие. Предлагаю найти количество вещества, количество молекул и массу газа объемом
33.6 литра. Поскольку показательно молярного объема при н.у. – константа (22.4 л/моль), то совершенно неважно, какой газ мы
возьмем: хлор, азот или сероводород.
Запомните, что 1 моль любого газа занимает объем 22.4 литра. Итак, приступим к решению задачи. Поскольку какой-то газ
все же надо выбрать, выберем хлор – Cl2.


Моль (количество вещества) – самое гибкое из всех понятий в химии. Количество вещества позволяет вам перейти и к
числу Авогадро, и к массе, и к объему. Если вы усвоили это, то главная задача данной статьи – выполнена 🙂

Относительная плотность и газы – D
Относительной плотностью газа называют отношение молярных масс (плотностей) двух газов. Она показывает, во сколько раз одно вещество
легче/тяжелее другого. D = M (1 вещества) / M (2 вещества).
В задачах бывает дано неизвестное вещество, однако известна его плотность по водороду, азоту, кислороду или
воздуху. Для того чтобы найти молярную массу вещества, следует умножить значение плотности на молярную массу
газа, по которому дана плотность.
Запомните, что молярная масса воздуха = 29 г/моль. Лучше объяснить, что такое плотность и с чем ее едят на примере.
Нам нужно найти молярную массу неизвестного вещества, плотность которого по воздуху 2.5

Предлагаю самостоятельно решить следующую задачку (ниже вы найдете решение): “Плотность неизвестного вещества по
кислороду 3.5, найдите молярную массу неизвестного вещества”

Относительная плотность и водный раствор – ρ
Пишу об этом из-за исключительной важности в решении
сложных задач, высокого уровня, где особенно часто упоминается плотность. Обозначается греческой буквой ρ.
Плотность является отражением зависимости массы от вещества, равна отношению массы вещества к единице его объема. Единицы
измерения плотности: г/мл, г/см3, кг/м3 и т.д.
Для примера решим задачку. Объем серной кислоты составляет 200 мл, плотность 1.34 г/мл. Найдите массу раствора. Чтобы не
запутаться в единицах измерения поступайте с ними как с самыми обычными числами: сокращайте при делении и умножении – так
вы точно не запутаетесь.

Иногда перед вами может стоять обратная задача, когда известна масса раствора, плотность и вы должны найти объем. Опять-таки,
если вы будете следовать моему правилу и относится к обозначенным условным единицам “как к числам”, то не запутаетесь.
В ходе ваших действий “грамм” и “грамм” должны сократиться, а значит, в таком случае мы будем делить массу на плотность. В противном случае
вы бы получили граммы в квадрате 🙂
К примеру, даны масса раствора HCl – 150 грамм и плотность 1.76 г/мл. Нужно найти объем раствора.

Массовая доля – ω
Массовой долей называют отношение массы растворенного вещества к массе раствора. Важно заметить, что в понятие раствора входит
как растворитель, так и само растворенное вещество.
Массовая доля вычисляется по формуле ω (вещества) = m (вещества) / m (раствора). Полученное число будет показывать массовую долю
в долях от единицы, если хотите получить в процентах – его нужно умножить на 100%. Продемонстрирую это на примере.

Решим несколько иную задачу и найдем массу чистой уксусной кислоты в широко известной уксусной эссенции.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Моль, молярная масса и граммы – эти понятия как-то связаны? Давайте-ка в этом разберёмся и порешаем задачи на молярную массу. Для начала вспоминаем, что моль – это количество вещества, в котором содержится 6,02*10 в двадцать третьей степени части (это число Авогадро).
Молярная масса показывает, сколько весит 1 моль того или иного вещества в граммах.
Молярная масса совпадает с атомной (если речь о простых вещества) или молекулярной (если речь о веществах сложных и газах, молекулы которых состоят из двух атомов, например, О2).
Это была теория. Но любую теорию нужно применять на практике, иначе зачем она нужна? Вот и займёмся этим.
У нас есть химическая реакция:
Н2 + F2 = 2HF
Из уравнения мы видим, что для неё нам нужна 1 молекула водорода и одна молекула фтора. Мы может взять, например, 10 молекул водорода, сколько нам в таком случае понадобится молекул фтора? Тоже 10. Мы можем взять и 100 молекул водорода, тогда потребуется и 100 молекул фтора. Кстати, заодно давайте уж узнаем, сколько молекул фторида водорода мы получим.
Из 1 молекулы водорода и 1 молекулы фтора получается две молекулы фторида водорода
(коэффициент в уравнении перед HF – 2). А если мы берём по 10 молекул водорода и фтора, то сколько получим HF? 20. Ну и взяв по 100 молекул водорода и фтора, мы получим 200 молекул фторида водорода.
Проблема в том, что молекулы настолько малы, что взять даже миллион молекул у человека не получится, это слишком маленькое количество вещества, которое на весах не взвесить. Вот тут и пришёл на помощь моль. Ещё раз запомните: в одном моле любого вещества содержится одно и то же число частиц!
Это очень важно для любых расчётов в химии. В 1 моле водорода содержится число Авогадро частиц, в 1 моле железа содержится число Авогадро частиц, в 1 моле воды содержится число Авогадро частиц, в 1 моле серной кислоты содержится число Авогадро частиц. Но! По массе моли веществ различаются, об это мы говорили раньше. И это обязательно нужно понять.
Теперь вернёмся к нашей реакции:
Н2 + F2 = 2HF
1 молекула Н2 + 1 молекула F2 = 2 молекулы HF
2 молекулы Н2 + 2 молекулы F2 = 4 молекулы HF
100 молекул Н2 + 100 молекул F2 = 200 молекул HF
Всё верно, ведь так?
А теперь вот так:
Н2 + F2 = 2HF
число Авогадро молекул Н2 + число Авогадро молекул F2 = число Авогадро молекул HF
или
1 моль Н2 + 1 моль F2 = 2 моль HF
И как же нам наконец перейти к граммам? Для этого вспоминаем, что молярная масса – это масса 1 моля вещества, совпадающая с атомной или молекулярной. Атомную или молекулярную массу мы определяем по таблице Менделеева: 1 моль водорода весит 2 г (атомная масса водорода 1, формула газообразного водорода Н2, поэтому его молекулярная масса 1*2=2), 1 моль фтора весит 38 г (атомная масса фтора 1, формула газообразного фтора F2, поэтому его молекулярная масса 19*2=38). Таким образом, для того, чтобы произошла реакция, нам нужно взять 2 г водорода и 38 граммов фтора. В этом случае оба вещества прореагируют полностью, образовав 40 граммов фторида водорода.
Теперь ещё пара задач на молярную массу с решениями.
Пример 1.
Сколько граммов оксида кальция и углекислого газа нужно взять, чтобы получить 50 граммов оксида кальция в реакции СаО + СО2 = СаСОз?
Решение.
Первое, что нужно сделать, рассчитать молярные массы всех веществ. Используем периодическую таблицу, чтобы узнать атомные массы:
· молярная масса оксида кальция СаО 40+16=56 г/моль
· молярная масса углекислого газа СО2 12+2*16=44 г/ моль
· молярная масса карбоната кальция СаСО3 40+12+3*16=100 г/моль.
Давайте подумаем, сколько моль карбоната кальция СаСО3 составляют 50 г? 1 моль СаСО3 весит 100 г (см. выше на молярную массу). Следовательно 50г весят 0,5 моль. Это означает, что при проведении реакции в условиях задачи получится 0,5 моль карбоната кальция.
Второе, что нужно сделать, – понять в каком соотношении взяты вещества. Об этом нам говорят коэффициенты в уравнение:
СаО + СО2 = СаСОз
1 моль + 1 моль = 1 моль
Но мы уже выяснили, что в нашем случае мы получим всего 0,5 моль СаСОз. То есть и исходных веществ СаО и СО2 нужно взять по 0,5 моль. Переводя в граммы, получим, что оксида кальция требуется 56 г/моль*0,5 моль=28 г, а углекислого газа – 44 г/моль*0,5 моль=22 г. Это и есть ответ.
Пример 2.
Этот пример не из учебника химии, он сложный, но если вы его поймёте, вас никакой репетитор по химии уже не запугает. Пробуем!
Задача звучит так. Алюминий прореагировал с кислородом с образованием оксида алюминия. Известно, что в реакцию вступило 9 граммов алюминия. Определите, сколько получилось оксида алюминия в граммах.
Решение.
Для начала запишем уравнение 4Al + 3O2 = 2Al2O3 и сразу увидим, что 4 моля алюминия, сгорев, образуют 2 моля оксида алюминия.
Теперь смотрим в таблицу Менделеева и определяемся с молярными массами:
· молярная масса алюминия 27 г/моль, с этим всё просто
· молярная масса оксида алюминия Al2O3 102 г/моль (помните, как мы считаем? 2*27 (это алюминий)+3*16 (это кислород)=54+48=102).
Из условия задачи мы узнали, что в реакцию вступило 9 г алюминия. 1 моль алюминия весит 27 г (это молярная масса). Следовательно, в реакцию вступило 9/27 моль алюминия, или 0,3 моль алюминия. Вернёмся к реакции:
4Al + 3O2 = 2Al2O3
4 моля алюминия при сгорании образуют 2 моля оксида алюминия
0,3 моля алюминия при сгорании образуют Х моля оксида алюминия
Находим Х=0,3*2/4=0,15 моль. Таким образом, если в реакции участвовало 9 г алюминия (или 0,3 моль), то получилось 0,15 моль оксида алюминия. Теперь самое простое – ищем массу в граммах. Припоминаем, что молярная масса оксида алюминия 102 г/моль. То есть 102 г весит 1 моль. А у нас всего 0,15 моль, и весит это количество вещества 102*0,15=15,3 г. Ответ на задачу: при сгорании 9 граммов алюминия получается 15,3 граммов оксида алюминия.
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Моль — условное количество вещества
Добавлено: 3 октября 2021 в 12:58

Химия — наука, изучающая взаимодействие веществ на атомном и молекулярном уровнях. Эти процессы значительно отличаются от привычного нам макроуровня и поэтому требуют специфических подходов, в том числе к «подсчету» и «взвешиванию».
Школьный курс химии включает понятия «моль» и «молярной массы». Они кажутся сложными, но если разобраться, то вы без труда поймете сущность этих понятий и научитесь ими пользоваться при решении задач.
Моль
Понятие «моль» попытаемся разобрать и, самое главное, понять на примере всем знакомой реакции взаимодействия кислорода и водорода. Когда одна молекула O2 соединяется с двумя молекулами H2, получается две молекулы H2O:
- O2 + 2H2 = 2H2O
То есть, чтобы максимально полно провести химическую реакцию, мы должны взять на каждую молекулу кислорода две молекулы водорода. Итак, у нас есть 100 г кислорода.
Сколько понадобится водорода для протекания процесса? И тут возникает первый вопрос: сколько молекул в 100 г кислорода? Наверное, миллиарды или даже миллиарды миллиардов? И сколько их в 100 г водорода? Уж точно в не в 2 раза меньше.
Как вообще подсчитать молекулы, ведь они бывают совершенно разными, «тяжелыми» и «легкими». Этими вопросами задавались и люди, закладывавшие основу современной химической науки.
Был найден простой выход, который помогает легко и изящно решить проблему. Химики решили взять за единицу измерения не одну молекулу, а определенное их количество, причем очень большое. Таким образом эта единица измерения приводит микроуровень к макроуровню. Она называется «моль».
Моль — это количество вещества из 6,02214076⋅1023 атомов или молекул. Оно не имеет физического смысла и изначально было привязано к массе определенного количества (12 граммов) углерода-12, но позже переопределено, как и многие другие единицы системы СИ.
В школьных расчетах количество структурных единиц в моле, которое также называется постоянной Авогадро, обычно округляют до 6,022⋅1023 и обозначают NA.
С этой величиной связано другое химическое понятие — «количество вещества», то есть количество структурных единиц в определенной его порции. Оно обозначается буквой ν (ню).
Примеры
В стакане содержится 2 моль воды. Сколько молекул воды находится в стакане?
- N = ν⋅ NA =2 ⋅ 6,022⋅1023 = 12,044⋅1023 молекул воды.
Также можно решить обратную задачу. Сколько молей вещества составляют 24,088⋅1023 молекул воды?
- ν⋅ = N / NA = 24,088⋅1023 / 6,022⋅1023 = 4 моля.
Что называется молярной массой
Итак, мы поняли, что моль — условное количество вещества, выбранное для удобства химиков. Это даже не миллиарды миллиардов, как мы предположили ранее, а миллиарды триллионов, что никак не облегчает задачу подсчета этих структурных единиц.
Как же все-таки узнать, сколько атомов или молекул в 100 граммах того или иного вещества? Теперь хорошо бы связать количество вещества и его массу, ведь это не одно и то же. Нам поможет «молярная масса» — 1 моль вещества или 6,022⋅1023 структурных единиц этого вещества.
Итак, масса вещества равна массе порции вещества m к количеству молекул ν в его порции:
- М = m / ν.
Вооружившись этим знанием, мы можем переводить граммы в число молекул и наоборот. При этом следует учесть, что молярная масса численно идентична молекулярной массе (то есть массе молекулы), выраженной в атомных единицах массы, и относительной молекулярной массе.
Пример
Найдем массу 5 моль воды.
Чтобы решить эту задачу, обратимся к формуле молярной массы и выразим из нее массу:
- m = М ⋅ ν
В этой формуле мы знаем количество вещества ν = 5 моль, а молярную массу сложной молекулы нужно определить, как сумму молярных масс составляющих ее химических элементов:
- M (H2O) = 2 ⋅M (H) + M (O)
Где взять молярные массы кислорода и водорода (в соединение входит два атома водорода, поэтому его молярную массу умножаем на 2)?
Для этого нам понадобится таблица Менделеева и значение «относительной атомной массы», которая, как мы уже знаем, идентична молекулярной. Это значение приведено для каждого химического элемента и для водорода равно 1,00797 (то есть близко к 1), для углерода — близко к 6, для кислорода — около 16.
Подставим соответствующие значения в исходную формулу и получим:
- M (H2O) = 2 ⋅M (H) + M (O) = 2 ⋅ 1 + 16 = 18 г/моль.
То есть вес 1 моль воды составляет 18 граммов. Теперь можем подсчитать массу 5 моль воды:
- m = М ⋅ ν = 18 ⋅ 5 = 90 г.
Аналогичным образом мы можем подсчитать количество вещества, которое содержится в определенном образце заданной массы. Для примера возьмем оксид алюминия Al2O3 и узнаем, сколько моль в 400 граммах этого вещества. Для этого выразим количество вещества через молярную массу и подставим исходные данные:
- ν = m / М = 400 / (2 ⋅ М (Al) + 3 ⋅ (O)) = 400 / (2 ⋅ 75 + 3 ⋅ 16) = 400 / (150 + 48) = 400 / 198 ≈ 2,02 моль.
Занимайтесь на курсах ЕГЭ и ОГЭ в паре TwoStu и получите максимум баллов на экзамене:

Эксперт по подготовке к ЕГЭ, ОГЭ и ВПР
Задать вопрос
Закончил Московский физико-технический институт (Физтех) по специальности прикладная физика и математика. Магистр физико-математических наук. Преподавательский стаж более 13 лет. Соучредитель курсов ЕГЭ и ОГЭ в паре TwoStu.
Читайте также:
В уроке 5 «Моль и молярная масса» из курса «Химия для чайников» рассмотрим моль как единицу измерения количества вещества; дадим определение числу Авогадро, а также научимся определять молярную массу и решать задачи на количество вещества. Базой для данного урока послужат основы химии, изложенные в прошлых уроках, так что если вы изучаете химию с нуля, то рекомендую их просмотреть хотя бы мельком.
Единица измерения количества вещества
До этого урока мы обсуждали лишь индивидуальные молекулы и атомы, а их массы мы выражали в атомных единицах массы. В реальной жизни с индивидуальными молекулами работать невозможно, потому что они ничтожно малы. Для этого химики взвешивают вещества ни в а.е.м., а в граммах.
Чтобы перейти от молекулярной шкалы измерения масс в лабораторную шкалу, используют единицу измерения количества вещества под названием моль. 1 моль содержит 6,022·1023 частиц (атомов или молекул) и является безразмерной величиной. Число 6,022·1023 носит название Число Авогадро, которое определяется как число частиц, содержащихся в 12 г атомов углерода 12C. Важно понимать, что 1 моль любого вещества содержит всегда одно и то же число частиц (6,022·1023).
Как уже было сказано, термин «моль» применяется не только к молекулам, но также и к атомам. Например, если вы говорите о моле гелия (He), то это означает, что вы имеет количество равное 6,022·1023 атомов. Точно так же, 1 моль воды (H2O) подразумевает количество равное 6,022·1023 молекул. Однако чаще всего моль применяют именно к молекулам.
Молярная масса вещества
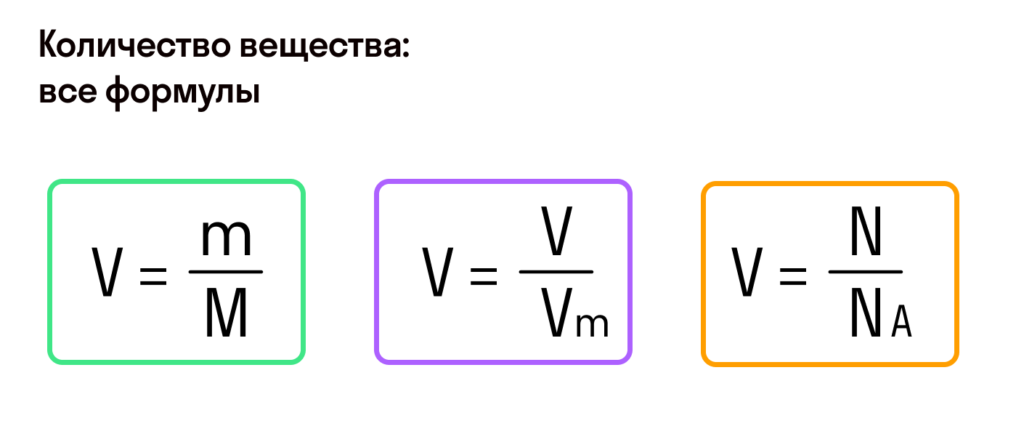
Молярная масса – это масса 1 моля вещества, выраженная в граммах. Молярную массу одного моля любого химического элемента без труда находят из таблицы Менделеева, так как молярная масса численно равна атомной массе, но размерности у них разные (молярная масса имеет размерность г/моль). Запишите и запомните формулы для вычисления молярной массы, количества вещества и числа молекул:
- Молярная масса формула M=m/n
- Количество вещества формула n=m/M
- Число молекул формула N =NA·n
где m — масса вещества, n — количество вещества (число молей), М — молярная масса, N — число молекул, NA — число Авогадро. Благодаря молярной массе вещества химики могут вести подсчет атомов и молекул в лаборатории просто путем их взвешивания. Этим и удобно использование понятия моль.
На рисунке изображены четыре колбы с различными веществами, но в каждой из них всего 1 моль вещества. Можете перепроверить, используя формулы выше.
Задачи на количество вещества
Пример 1. Сколько граммов Н2, Н2O, СН3ОН, октана (С8Н18) и газа неона (Ne) содержится в 1 моле?
Решение: Молекулярные массы (в атомных единицах массы) перечисленных веществ приведены в таблице Менделеева. 1 моль каждого из названных веществ имеет следующую массу:
Поскольку массы, указанные в решении примера 1, дают правильные относительные массы взвешиваемых молекул, указанная масса каждого из перечисленных веществ содержит одинаковое число молекул. Этим и удобно использование понятия моля. Нет даже необходимости знать, чему равно численное значение моля, хотя мы уже знаем, что оно составляет 6,022·1023; эта величина называется числом Авогадро и обозначается символом NA. Переход от индивидуальных молекул к молям означает увеличение шкалы измерения в 6,022·1023 раз. Число Авогадро представляет собой также множитель перевода атомных единиц массы в граммы: 1 г = 6,022·1023 а.е.м. Если мы понимаем под молекулярной массой массу моля вещества, то ее следует измерять в граммах на моль; если же мы действительно имеем в виду массу одной молекулы, то она численно совпадает
с молекулярной массой вещества, но выражается в атомных единицах массы на одну молекулу. Оба способа выражения молекулярной массы правильны.
Пример 2. Сколько молей составляют и сколько молекул содержат 8 г газообразного кислорода O2?
Решение: Выписываем из таблицы Менделеева атомную массу атома кислорода (O), которая равна 15,99 а.е.м, округляем до 16. Так как у нас молекула кислорода, состоящая из двух атомов O, то ее атомная масса равна 16×2=32 а.е.м. Хорошо, а теперь переводим ее в молярную массу: 32 а.е.м = 32 г/моль. Это означает, что 1 моль (6,022·1023 молекул) O2 имеет массу 32 грамма. Ну и в заключении по формулам выше находим количество вещества (моль) и число молекул, содержащихся в 8 граммах O2:
- n = m / M = 8г / 32г/моль = 0,25 моль
- N = NA × n = 6,022·1023 × 0,25 = 1,505·1023 молекул
Пример 3. 1 молекула Н2 реагирует с 1 молекулой Сl2, в результате чего образуются 2 молекулы газообразного хлористого водорода НСl. Какую массу газообразного хлора необходимо использовать, чтобы он полностью прореагировал с 1 килограммом (кг) газообразного водорода?
Решение: Молекулярные массы H2 и Cl2 равны 2,0160 и 70,906 г/моль соответственно. Следовательно, в 1000 г H2 содержится
Даже не выясняя, сколько молекул содержится в одном моле вещества, мы можем быть уверены, что 496 моля Cl2 содержат такое же число молекул, как и 496,0 моля, или 1000 г, H2. Сколько же граммов Cl2 содержится в 496 молях этого вещества? Поскольку молекулярная масса Cl2 равна 70,906 г/моль, то
Пример 4. Сколько молекул H2 и Cl2 принимает участие в реакции, описанной в примере 3?
Решение: В 496 молях любого вещества должно содержаться 496 моля × 6,022·1023 молекул/моль, что равно 2,99·1026 молекул.
Чтобы наглядно показать, сколь велико число Авогадро, приведем такой пример: 1 моль кокосовых орехов каждый диаметром 14 сантиметров (см) мог бы заполнить такой объем, какой занимает наша планета Земля. Использование молей в химических расчетах рассматривается в следующей главе, но представление об этом пришлось ввести уже здесь, поскольку нам необходимо знать, как осуществляется переход от молекулярной шкалы измерения масс к лабораторной шкале.
Надеюсь урок 5 «Моль и молярная масса» был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии.
План урока:
Основные величины и формулы их нахождения
Основные величины и формулы их нахождения
Ключевым понятием в химии является вещество. Урок 2 в данном курсе, напомнит Вам, все необходимые сведения. Формула для определения количества вещества, в зависимости от исходных данных, выражается в следующем виде.
Для веществ характерно взаимодействие друг с другом. Перед химиками стоит задача вычислить какое количество вещества необходимо для реакции с другим веществом.В химической промышленности, на производстве важно знать, какая масса или объём реагентов необходим, и сколько возможно получить в итоге реакции продукта. Вещества реагируют между собой в определённых количествах, точнее эквивалентах. Как трактовать последнее предложение. Вспомните себя маленькими, когда вы только начинали изучать количество, на примере мячиков, яблок, конфет и т.д.
Согласитесь, что самому большому шарику будет тесно в маленьком стаканчике, впрочем, как и маленькому шарику не совсем уютно будет в большом стаканчике. Т.е. мы выбираем стаканчик для шарика эквивалентно его размеру.
Возьмём, к примеру, кислород, который реакционно-способный и окисляет другие соединения.
Вспомним закон сохранения массы вещества (ЗСМВ), без которого невозможно составить химические уравнения.
Источник
Следует отметить, чтобы прореагировало 1 моль СН4, необходим кислород количеством молей 2. Снова обращаясь к базовому закону, мы видим, что реагентов и продуктов масса одинаковая, точнее 80 г. Почему именно эта цифра, и откуда она взялась. Для этого смотрим на уравнение реакции.
Другими словами, чтобы образовалось 1 моль СО2 и 2 моль Н2О, необходимо чтобы метан и кислород прореагировали пропорционально 1: 2.
Выразим массу, которая будет соответствовать этому количеству вещества.
m = n * M
Вспомним, каким образом вычисляется молярная масса.
Давайте попробуем чуть-чуть усложниться, к примеру, будет реагировать не 1 моль метана, а 2,5 моль. Сколько тогда потребуется О2?
И здесь приведём такой наглядный пример. Один килограмм конфет стоит 2 рубля. Сколько Вам понадобится денег, чтобы купить 2,5 кг. Не составит труда дать ответ, что необходимо потратить 5 рублей. А если, Вы захотите 4 кг, то придётся попросить у родителей уже 8 рублей. Вот эти размышления перенесём на наш пример.
Какое количество мы бы не взяли метана, то кислорода необходимо в 2 раза больше. Т.е. для реакции 2,5 моль СН4 необходим О2 количеством 5 моль.
Количество вещества – это уникальная величина, от которой можно перейти к другим параметрам вещества (m или V), используя основные формулы.
Рассмотрим задачи на определение массы вещества,а также объёма с помощью химических уравнений. Как и при решении, абсолютно всех задач, первое, что мы делаем, читаем внимательно условие и выписываем все известные физические величины (дано), а также определяем, что неизвестно (найти).
Задача 1. Сколько литров (н. у.) кислорода необходимо потратить для полного сгорания 8,5 г сероводорода.
Дано:
m(H2S) = 8,5 г
Найти:
V(O2) – ?
Решение.
Переведём условие задачи на химический язык, т.е. составим уравнение реакции. Важно отметить, что для удобства и лёгкости решения подчеркните те соединения, о которых идёт речь.
Теперь обратим внимание на коэффициенты в химических уравнениях, именно они отвечают за соотношение веществ.
Следует заметить, что массу (г) сероводорода необходимо выразить в количестве (моль).
Запишем мольное соотношение сероводорода и кислорода, в значение числителя подставляем коэффициенты с уравнения, а в знаменателе – что известно в условии задания.
Из пропорции определим число молей для кислорода.
Ответим на вопрос задачи (находим объём кислорода)
Ответ. V(O2) = 8.4 л
Теперь представим следующую ситуацию, Вам на день Рождения или на другой праздник подарили деньги, чтобы Вы приобрели себе желаемую вещь. К примеру, вы хотите себе наушники, карту памяти и новый чехол на телефон. Возникает закономерный вопрос, а хватит ли Вам денег. Такие задачи встречаются и в химии.
Задача 2. Хватит ли 10 л кислорода для сгорания 12 г магния и 0,6 г углерода (н.у.)?
Дано:
V(O2) = 10 л
m(Mg) = 12 г
m(C) = 0,6 г
Найти:
V(O2) – ?
Решение
Особенность этой задачи, что будет два уравнения реакции, взаимодействие О2 отдельно с магнием и углеродом. Это как покупка в двух разных магазинах. Используя алгоритм, приведённый выше, вычислим количество вещества кислорода. Следует заметить, что отдельно ведём расчёт по магнию (или по углероду), заполняя данные таблицы.
Обратите внимание, в предыдущей задаче кислород был в избытке, в объёме 10 – 6,72 = 3,28 л. Этому избытку не с чем реагировать. Представьте, что Вы помощник деда Мороза и пакуете новогодние подарки. Допустим в одном наборе должно содержаться 5 шоколадных конфет и 8 карамелек. Вам необходимо разделить 55 шоколадки и 72 карамельки. Вопрос: сколько наборов у Вас получится? Проведём нехитрые математические исчисления, знакомые Вам ещё с курса математики младшей школы.
55 : 5 = 11
72 : 8 = 9
И что получается, что шоколадки можно разместить в 11 наборов, а карамельки только в 9. Таким образом, получится 9 новогодних подарков, и 10 (5 ∙ 2 = 10) шоколадок будут лишними, они в избытке.
Расчёты по химическим уравнениям, где один из реагентов берётся в избытке (т.е. его больше, чем необходимо), проводятся аналогично, как и с одним известным веществом.
Задача 3. 48,75 цинка привели в реакцию с 5,6 л (условия нормальные) хлора. Сколько соли получилось в итоге, ответ выразите в граммах.
Дано:
V(Cl2) = 5.6 л
m(Zn) = 48.75 г
Найти:
m(ZnCl2) – ?
Решение.
Составим схему взаимодействия, не забудьте отметить количество реагирующих молей.
Теперь наша с Вами задача определить, какое вещество прореагировало полностью, а какое осталось в избытке. Вспомните пакеты с подарками, какие конфеты мы разложили полностью и почему остались шоколадные лишними. Поможет определиться с избытком, решение неравенства.
n (Zn) ? n (Cl2) ?
Расчёт для цинка производится согласно формуле:
Хлор – это газообразное вещество, поэтому нужно применить формулу:
Сравним полученные значения n(Zn) > n(Cl2), цинк находится в избытке, поэтому расчёт ведём по хлору, который прореагировал полностью количеством 0,25 моль.
Из пропорции вычислим количество образованной соли (не забываем, что числитель отвечает за коэффициенты, а знаменатель – это данные в условии).
Ответ. Масса соли равна 34 г.
Большинство химических реакций происходит в растворе. Однако при расчётах необходима масса именно растворённого вещества, которое непосредственно реагирует. Допустим, команда с 12 человек, которая на 25% состоит из девочек и 75% мальчиков, поехала на соревнования. В одном из этапов участвуют только мальчики. Ваша задача определить, сколько мальчиков поехало на соревнования.
Вот эти 9 мальчишек и участвовали в определённом туре, а девочки на данный момент были не в счёт, они были в группе поддержки.
Задача 4. На 12 г оксида магния подействовали 146 г раствора соляной кислоты, с массовой долей раствора 10%. Вычислите, сколько соли образовалось в процессе взаимодействия этих веществ?
Дано:
m(MgO) = 12 г
mр-ра(HCl) = 146 г
Wр-ра(HCl) = 10%
Найти:
m(MgCl2) – ?
Решение
Особенностью этой задачи является то, что в условии указана масса всего раствора, а необходимо знать только,сколько содержится кислоты, которая будет реагировать с MgO. Формула определения массы вещества, находящегося в растворе, выражается в следующем виде.
Обратите внимание, что из всей массы раствора (146 г) реагирует только 10%, а именно 14,6 г.
Теперь задача определить, какого из реагентов больше и он прореагирует не полностью.
Схема показывает, что для реакции 0,3 моль MgO требуется 0,6 моль кислоты. На это размышление нам указывает схема реакции. Для полного растворения оксида необходимо потратить в 2 раза больше HCl, смотрите соотношение 1:2.Однако в нашем распоряжении есть только 0,4 моль, поэтому n(MgO) >n(HCl), оксид находится в избытке, в то время как кислота прореагировала полностью и мы смело можем использовать её количество вещества для расчёта массы соли.
Снова воспользуемся пропорцией, чтобы узнать количество образованной соли.
Теперь не составит особого труда найти массу.
Ответ. m(MgCl2) = 19 г.
В желаниях человечества изобрести идеальную машину, во время работы которой не будет никаких потерь. Однако на выходе не бывает заветных 100%. Аналогично и во время химических процессов на производстве или лаборатории не удаётся получить продукт с выходом реакции 100%. При решении задач мы вычисляем так называемый теоретический выход, что должно быть в идеальной ситуации. Но мы живём в реальном мире, где есть потери: газообразные продукты могут улетучиться, осадок, образованный в процессе реакции, можно не в полной мере выделить из раствора. Поэтому практический выход всегда будет меньше теоретического.
Задача 5. В результате взаимодействия 59,5 г нитрата серебра с избытком раствора соляной кислоты, был выделен осадок массой 45 г. Определите выход реакции.
Дано:
m(AgNO3) = 59.5 г
m(осадка) = 45 г
Найти:
η – ?
Решение.
Своеобразие этого типа задач в том, что необходимо отличать теоретическую и практическую массу продукта. Маленькой подсказкой вам послужит время глагола, если видите прошедшее или настоящее время (получено, выделили), значит это практическая масса. Чтобы найти выход продукта, необходимо вычислить теоретическую массу или объём (вот за эти параметры как раз и отвечает схема реакции).
Используя привычный алгоритм, определим n нитрата серебра.
Следующим шагом будет определить количество вещества, выпавшего в осадок (AgCl).
Вычислим массу осадка, это будет теоретическая, т.е. та, которая должна получиться, если бы не было потерь.
В идеальной ситуации, мы бы получили 50,225 г, что составило бы 100%. Однако во время процесса образовалось только 45 г продукта. Получается, выход реакции будет меньше и составит:
Ответ. η = 89,6%
Особый тип задач на определение молярной массы вещества. Состав соединений мы можем узнать с химической формулы. При решении этого типа необходимо вспомнить следующие понятия– это доля (массовая) элемента и относительная плотность газов.
Однако следует заметить, что величину D мы можем использовать только для газообразных соединений.
Задача 6. Определите объём кислорода (условия нормальные), что потребуется для сжигания вещества массой 180 г, которое состоит на 26,67 % из углерода, 2,24 % водорода, а также кислорода. Известно, что равняется 45.
Дано:
DH2 = 45
W(C) = 26.67%
W(H) = 2.24%
m(CxHyOz) = 180 г
Найти:
Формула – ?
V(O2) – ?
Решение.
Чтобы решить эту, на первый взгляд, запутанную задачу, нам необходимо сначала определить, что это за соединение, чтобы была возможность составить уравнения химических реакций.
Однако в условии известно только процентный состав вещества. Но всё-таки, этих данных нам достаточно, чтобы найти формулу вещества.
Запишем выражение для нахождения количества атомов углерода (х), водорода (у) и кислорода (z). Представьте, вы купили в коробке шоколадные конфеты из трёх видов.
Следует отметить, что они имеют разную форму, начинку, как следствие и вес. Вернёмся к нашему веществу, которое состоит из 3 элементов, имеющих разнуюAr. Так вот на долю углерода выпадает 26,67% (условно допустим, что это конфета в виде сердечка), водород занимает 2,24% (конфета с воздушной начинкой), а все остальные конфеты в коробке с ореховой начинкой (в соединении их роль играют атомы кислорода). Вопрос: сколько штук занимает каждый вид конфетки? Логично узнать вес одной конфеты (в нашем случае это Ar элементов). Разделив процентное содержание на атомную массу элемента, получим их количество.
Такого же ведь количества конфет не будет в коробке, вы, наверное, слабо себе можете представить, что там будут находиться части конфет. Чтобы получить целые числа, необходимо, выбрать из этих чисел самое маленькое и каждое на него разделить.
Вычисления показывают, что соотношение элементов в данном соединении можно записать в следующем виде: СНО2. Уточним правильность наших расчётов, определив его молекулярную массу, используя величину D.
Обратите внимание, первоначальная запись формулы вещества СНО2 отвечает молярной массе
Однако, это вещество в 45 раз тяжелее водорода, что отвечает 90 г/моль.Чтобы получить её, мы сохранили соотношение элементов 1:1:2, при этом умножили количество каждого элемента на 2. Следовательно, молекулярная формула С2Н2О4.
Количество вещества, отвечающее 45 г вещества С2Н2О4, вычислим привычным методом.
Используя мольное соотношение, определим число молей кислорода, а также его объём.
Ответ. Для сгорания 45 г С2Н2О4 необходимо 5,6 л кислорода.
Обобщая всё выше сказанное, как решать расчётные задачи по химии, с улыбкой или с шоком, принимать решение только Вам. Рассмотрим ещё одну задачу.
Задача 7. Пропан (С3Н8), объёмом 84 л, который содержит 25% негорючих примесей, сожгли в 56 л кислорода. Газ, который выделился, пропустили через гидроксид бария, определите массу осадка, если выход продукта реакции составил 89%.
Дано:
V(С3H8) = 84 л
W(примеси) = 25%
V(O2) = 56 л
η = 89%
Найти:
m(осадка) – ?
Решение.
На что здесь следует обратить внимание. Пропан содержит не горючие примеси. Представьте, вам необходимо в торт 84 г очищенных орехов. Вы идёте в магазин, приобретаете необходимую массу, но придя домой обнаружили, что там 25% содержится мелких остатков скорлупы. Т.е. масса орехов не будет 84 г. Чистых орехов будет 100% – 25% = 75%.
Негорючие примеси входят в общий объём, а гореть будет только пропан. Находим, сколько же его содержится в 84 л.
Составим схему горения газа
Определим количество вещества реагирующих газов
На первый взгляд кажется, что пропан в избытке n(C3H8) > n(O2). Однако посмотрите на уравнение реакции, чтобы сгорело 2,8125 моль пропана необходимо в 5 раз больше кислорода, что составит 14 моль. По этой причине расчёт будем вести по кислороду.
Это количество СО2 пропускают через Ва(ОН)2, что можно отобразить схемой.
Найдём массу ВаСО3, которая будет в виде осадка
Теперь необходимо усчитать выход соли, который составил всего лишь 89%.
Ответ. m(BaCO3) = 263 г.