Ученик
(148),
закрыт
10 лет назад
Екатерина
Гуру
(3248)
10 лет назад
Число электронов, содержащихся в одном моле
N(e) = 1моль*Na = 6,02*10^23 электронов
где Na = 6,02*10^23 1/моль – число Авогадро
Масса одного моля электронов равна массе одного электрона, умноженной на число электронов, содержащихся в одном моле
m = m(e)*N(e) = 9,1*10^(-31)*6,02*10^23 = 54,782*10^(-8) кг = 54,782*10^(-5) г
m(e) = 9,1*10^(-31) кг – масса одного электрона
ЛЕКЦИИ ДЛЯ УЧИТЕЛЕЙ
Элементы научного поиска
при решении нестандартных
химических задач*
Основной способ активного освоения любой новой
области деятельности – тренировка. В химии и
других естественных науках тренировка сводится
к решению задач. Принципиально разных типов
химических задач сравнительно немного, особенно
в школьном курсе [1]. Все они известны и четко
классифицированы по содержанию и способам
решения [2]. Поэтому в принципе не представляет
больших проблем натренировать школьников решать
стандартные задачи, включающие, например,
расчеты по уравнениям химических реакций или
определение молекулярной формулы по элементному
составу.Другое дело – задачи нестандартные. Любое
малейшее отклонение от проторенной дорожки
приводит большинство учащихся в ступор,
переходящий в полный паралич умственной
деятельности. Они просто не знают, что делать.
Результатом является чистый лист.В этих случаях для выхода из тупиковой ситуации
можно привлечь в помощь элементы научного
способа познания мира. Ведь наука – это, по
определению, поиск нового, создание информации,
отличающейся от уже имеющейся. Поэтому она может
помочь найти новый способ решения задачи.
Элементарные представления о том, как вести себя
в незнакомой ситуации, какие использовать методы
для поиска решения, любому школьнику не повредят.Научная работа как способ деятельности – это
не перманентное творчество, она включает в себя и
повседневный, причем иногда утомительный труд.
Наука – это профессия, поэтому у научных
работников есть много профессиональных приемов
и рецептов, как добиваться своих целей.
Некоторыми из этих приемов мы и хотим поделиться:
они оказываются полезными при решении школьных
химических задач. Каждый рецепт будет
проиллюстрирован примерами.Разумеется, эти рецепты не универсальны: они
годятся для решения одних задач и совершенно
непригодны для других, требующих иных, может
быть, еще неизвестных подходов. Именно поэтому в
науке всегда было, есть и будет место творчеству.
![]() Р е ц е п т 1.
Р е ц е п т 1.
Пробовать
Дмитрий Иванович Менделеев, рассказывая о том,
как он открыл периодический закон, утверждал:
«Искать же что-либо, хотя бы грибы или
какую-нибудь зависимость, нельзя иначе, как
смотря и пробуя». Пробовать – это главный
научный рецепт. Для этого надо предложить любой
(пусть совсем неправильный) способ решения и
посмотреть, к чему он приводит. Можно попытаться
понять, в каком месте возникает отклонение от
условия задачи, и в этом месте подправить способ.
Так, путем проб и ошибок, методом
последовательных приближений иногда можно
решить задачу.
Пример 1. Установите возможную формулу
органического соединения, которое содержит 40%
углерода по массе.
Р е ш е н и е. Дана массовая доля углерода, а
больше про вещество ничего не известно. Давайте
пробовать разные варианты – будем
самостоятельно «назначать» дополнительную
информацию.
Самые простые органические вещества –
углеводороды CxHy. Пусть
неизвестное вещество содержит 40% углерода и 60%
водорода. Найдем его эмпирическую формулу
стандартным способом:
![]()
Углеводород CH18 не существует.
Пробуем дальше. Добавим в формулу вещества
символ кислорода: CxHyOz.
С помощью стандартного приема мы формулу найти
не можем, т.к. массовые доли кислорода и водорода
неизвестны. Попробуем принять наименьшее
возможное значение числа атомов углерода: x =
1. Тогда молярная масса вещества составляет:
M(CHyOz) = 12/0,4 = 30
г/моль.
Из 30 г на углерод приходится 12 г, а на водород и
кислород – 18 г, что соответствует H2O. Таким
образом, эмпирическая формула вещества – CH2O.
Этой формуле соответствуют, например, все
углеводы.
О т в е т. Возможная формула соединения
– CH2O.
Пример 2. Два углеводорода – A и B
– имеют одинаковый элементный состав: каждый
содержит по 92,3% мас. углерода. Образец
углеводорода A может присоединить в 6 раз
большее количество брома, чем равный по массе
образец углеводорода B. Определите возможные
структурные формулы веществ A и B.
Р е ш е н и е. Из элементного состава следует:
![]() (C) :
(C) : ![]() (H) = (92,3/12) : (7,7/1) = 1:1.
(H) = (92,3/12) : (7,7/1) = 1:1.
Эмпирическая формула обоих углеводородов – CH.
Кроме того, они содержат кратные связи, т.к.
способны присоединять бром.
Попробуем рассмотреть несколько простейших
углеводородов такого состава и рассчитаем
количество брома, способное присоединиться к
одной и той же массе каждого углеводорода. В
качестве ограничения выберем 104 г – массу 1 моль
самого тяжелого из рассматриваемых веществ: C8H8
(таблица).
Таблица
| Формула углеводорода |
Структура | Kоличество вещества Br2 на 1 моль углеводорода, моль |
Kоличество вещества Br2 на 104 г углеводорода, моль |
|---|---|---|---|
| C2H2 (Mr = 26) | HC |
2 | 2•4 = 8 |
| C4H4 (Mr = 52) | HC |
3 | 3•2 = 6 |
| C6H6 (Mr = 78) | HC |
4 | 4•4/3 = 16/3 |
| C8H8 (Mr = 104) | C6H5CH=CH2 | 1 | 1 |
Из таблицы видно, что условию задачи
удовлетворяют винилацетилен (A) и стирол (B).
Молярные массы у них отличаются в 2 раза, а
количества вещества присоединяемого брома на 1
моль углеводорода – в 3 раза, итого при равных
массах получаем искомый коэффициент 6.
Уравнения реакций:
HC![]() C–CH=CH2 + 3Br2
C–CH=CH2 + 3Br2
![]() CHBr2CBr2CHBrCH2Br,
CHBr2CBr2CHBrCH2Br,
C6H5CH=CH2 + Br2 ![]() C6H5CHBrCH2Br.
C6H5CHBrCH2Br.
Эта задача имеет бесконечно много решений, тем
она и трудна. Мы привели лишь самое простое
решение, найденное небольшим перебором.
О т в е т. Возможные структурные формулы
веществ: A – HC![]() C–CH=CH2, B
C–CH=CH2, B
– C6H5–CH=CH2.
![]() Р е ц е п т 2.
Р е ц е п т 2.
Правильно выбирать переменные
Решение многих расчетных задач значительно
облегчается правильным выбором переменных –
тех, которые характеризуют наиболее
существенные свойства изучаемых объектов. При
этом надо стараться обходиться минимальным
числом переменных.
Пример 3. В каком оксиде массовая доля
кислорода наибольшая?
Р е ш е н и е. Общая формула бинарных
кислородсодержащих соединений – RxOy.
Если ограничиться оксидами элементов с
постоянной валентностью, то число неизвестных
переменных можно сократить – R2On,
где n – степень окисления элемента R (n
изменяется от 1 до 8).
В задаче осталось две переменных – атомная
масса элемента R (обозначим ее через X) и
степень окисления n. Запишем выражение для
массовой доли кислорода:
![]()
Надо найти максимальное ее значение. С двумя
переменными это сделать очень трудно, но в данном
случае их можно объединить в одну. Поделим
числитель и знаменатель дроби на 16n:
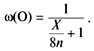
Для того чтобы выражение было максимальным,
знаменатель должен быть минимальным. Значит,
надо найти элемент, у которого отношение атомной
массы к степени окисления (это отношение иногда
называют эквивалентом) наименьшее: X/n = min.
Очевидно, что это водород: X = 1, n = 1. Искомый
оксид – вода.
О т в е т. Массовая доля кислорода
наибольшая в H2O.
Пример 4. 1000 г вещества содержат 0,3227 г
электронов. Определите формулу вещества (масса
электрона равна 1/1823 а.е.м.).
Р е ш е н и е. По данным задачи можно сразу найти
количество вещества электронов:
![]()
Количество самого вещества неизвестно, т.к. мы
не знаем его молярную массу. Обозначим ее через M
– это первая переменная, которую мы вводим.
Теперь находим количество вещества:
![]()
Как связаны между собой две указанные величины?
Для ответа на этот вопрос придется ввести еще
одну переменную n – число электронов в одной
молекуле. Тогда число молей электронов ровно в n
раз превышает число молей вещества:
![]()
Откуда M = 1,7n г/моль.
Предположим, что молярная масса выражается
почти целым числом, тогда n кратно 10. При n =
10 имеем M = 17 г/моль. Этой молярной массе
соответствует аммиак, его молекула содержит как
раз 10 электронов.
О т в е т. Формула вещества – NH3.
![]() Р е ц е п т 3.
Р е ц е п т 3.
Строить модели с разумными допущениями
Многие химические объекты – молекулы,
коллоидные частицы, кристаллы, растворы и т.д. –
исследуют путем построения моделей. Модель – это
идеализированное представление объекта, которое
отражает некоторые его существенные свойства и
пренебрегает всеми остальными. Хорошая модель
содержит лишь небольшое число параметров.
Правильность моделей подтверждается сравнением
с экспериментальными данными. Искусство
научного работника состоит в том, чтобы выбрать
главное в модели и пренебречь несущественным.
Пример 5. Радиус наночастицы золота
равен 1,5 нм, а радиус атома – 0,15 нм. Оцените,
сколько атомов входит в состав наночастицы и
какая их доля находится на поверхности.
Р е ш е н и е. Судя по условию задачи, наночастица
представляет большой шар, заполненный
маленькими шарами – атомами золота.
Шарообразные формы наночастицы и атома – это
первое допущение.
Предлагается определить число атомов по
порядку величины, т.е. получить ответ с невысокой
точностью. В таком грубом приближении можно
пренебречь свободным объемом между атомами в
наночастице и считать, что шары заполняют все
пространство. Это дает ошибку около 20%. Общее
число атомов равно отношению объема наночастицы
к объему атома:
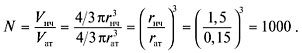
В случае гетерогенных катализаторов реакция
происходит на поверхности частиц. Поэтому, чтобы
оценить каталитические возможности наночастиц,
надо знать долю атомов на поверхности. Для этого
найдем объем поверхностного слоя Vпов и
разделим его на объем наночастицы Vнч.
Объем поверхностного слоя равен разности между
объемами самой наночастицы и «внутреннего» шара,
радиус которого меньше радиуса наночастицы на
диаметр атома (рис.).
Доля атомов на поверхности:
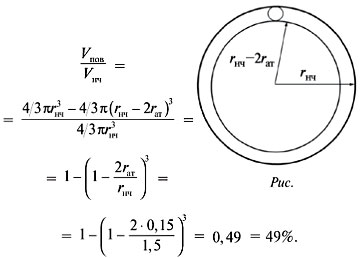
О т в е т. Число атомов золота в составе
наночастицы – 1000;
их доля на поверхности – 49%.
![]() Р е ц е п т 4.
Р е ц е п т 4.
Угадать и доказать, что правильно
Во многих задачах – преимущественно тех, в
которых зашифрованы цепочки превращений с
неизвестными веществами, – ответ можно угадать.
Но надо еще доказать, что он отвечает условиям
задачи.
Пример 6. После пропускания
электрического разряда через смесь газов А и
Б произошла реакция и образовалась смесь газов В
и Г с молярными массами, равными молярным
массам исходных газов. Определите формулы
исходных веществ А и Б.
Р е ш е н и е. Ключ к решению – равенство
молярных масс продуктов и реагентов. Известно
несколько газов с молярной массой 28 г/моль. Это CO,
C2H4, N2, B2H6. Другая
распространенная молярная масса – 44 г/моль, ей
отвечают CO2, N2O, C3H8, CH3CHO.
Числа 44 и 28 отличаются на 16 – это относительная
атомная масса кислорода. Поэтому реакция между
газами A и Б может сводиться к переходу кислорода
от одного вещества к другому. Такие вещества
среди перечисленных выше есть: N2O
(окислитель) и CO (восстановитель). Уравнение
реакции:
![]()
О т в е т. Формулы исходных
веществ – N2O и CO.
Мы рассмотрели лишь некоторые из большого
числа рецептов решения научных задач. Это очень
малая часть «технологии науки».На самом деле самое трудное в науке – не решать
задачи, а придумывать их. Ведь правильно заданный
вопрос содержит в себе большую часть ответа.
Самыми выдающимися считают не тех ученых,
которые решили какую-то проблему, а тех, которые
ее поставили. Самые крупные открытия начинаются
с правильной постановки задачи. Решение задачи –
зачастую дело техники, а вот формулировка
проблемы требует глубокого понимания скрытой
сути явлений. Подробно о том, как делались многие
открытия в химии и физике, можно прочитать в
книге [3].В заключение предлагаем несколько задач, при
решении которых можно использовать описанные
выше рецепты.
![]() Задачи для
Задачи для
самостоятельного решения
1. При количественном окислении 5 г
оптически активного вещества А
перманганатом калия в кислой среде получено 5 г
вещества Б, которое взаимодействует с
веществом А с образованием жидкости В
состава C15H14O2. Установите
структуры веществ А–В.
О т в е т. A – C6H5CH(OH)CH3,
Б – C6H5COОH, В – сложный эфир,
образованный веществами А и Б.
2. Оксид неметалла массой 10,16 г добавили к
124 г 10%-го раствора гидроксида натрия и получили
раствор, в котором массовая доля соли равна 11,27%.
Определите формулы оксида и соли.
О т в е т. SeO3, Na2SeO4.
3. Константа изомеризации некоторого
вещества A = Б равна 0,8. Смешали 5 г вещества A и
10 г его изомера Б и смесь выдержали до
установления равновесия. Вычислите массовую
долю изомера Б в полученной смеси. Зависит ли
результат от количества изомеров в исходной
смеси?
О т в е т. 0,44; не зависит.
4. В cлучае гетерогенных катализаторов
реакция происходит на поверхности частиц. Пусть
частица состоит из атомов металла радиусом r.
Определите долю атомов на поверхности
катализатора, если его частицы имеют форму: а)
шара радиуса R; б) куба со стороной L. В каком
случае – шара или куба – доля атомов на
поверхности больше, если куб и шар имеют
одинаковый объем?
О т в е т. а) 6r/R; б) 12r/L.
В случае куба доля атомов больше.
5. Два газообразных простых вещества,
состоящих из двухатомных молекул, смешали в
объемном соотношении 1 : 9 в закрытом
реакционном сосуде при температуре 20 °С и
высоком давлении. Сосуд нагрели до 215 °С; при
этом с количественным выходом образовалось
газообразное сложное вещество, а давление по
окончании реакции оказалось равным
первоначальному. Определите формулу продукта
реакции.
О т в е т. ClF5.
6. Для полного гидролиза 7,4 г смеси двух
сложных эфиров потребовалось 70 г 8%-го раствора
гидроксида калия. При добавлении к такому же
количеству смеси избытка аммиачного раствора
оксида серебра выделилось 6,48 г осадка.
Определите строение сложных эфиров и их
содержание в исходной смеси (в мольных %).
О т в е т. 30% HCOOC2H5, 70% CH3COOCH3.
7. При нагревании до 170 °С смеси двух
твердых при обычных условиях веществ, взятых в
мольном соотношении 1 : 41, образовались
твердое и газообразное вещества в мольном
соотношении 40 : 41. Определите все вещества.
О т в е т. C40H82, S, C, H2S.
* По материалам лекции для
учителей, прочитанной на Фестивале науки в МГУ
им. М.В.Ломоносова в октябре 2006 г.
Л и т е р а т у р а
1. Еремин В.В., Кузьменко Н.Е. Сборник задач и
упражнений по химии. Школьный курс. М.: Экзамен,
2006.
2. Олейников Н.Н., Муравьева Г.П. Химия.
Основные алгоритмы решения задач. М.: УНЦ ДО, 2003.
3. Краткий миг торжества. О том, как делаются
научные открытия (библиотека журнала «Химия и
жизнь»). М.: Наука, 1988.
В.В.ЕРЕМИН,
профессор химического факультета МГУ
Загрузить PDF
Загрузить PDF
Протоны, нейтроны и электроны – основные частицы, из которых состоит атом. Протоны заряжены положительно, электроны – отрицательно, а нейтроны и вовсе не имеют заряда.[1]
Масса электронов очень мала, а масса протонов и нейтронов практически одинакова.[2]
На самом деле, найти в атоме количество протонов, нейтронов и электронов довольно просто, нужно только научиться ориентироваться по периодической таблице химических элементов Д.И.Менделеева.
-

1
Возьмите периодическую таблицу элементов. Это система, в которой элементы организованы в зависимости от их атомной структуры. Цветное одно- или двухбуквенное сокращение – это название элемента в сокращенном виде. В таблице также представлена информация об атомном номере элемента и атомной массе.[3]
- Таблицу Менделеева можно найти в учебнике по химии или в Интернете.
- Во время контрольных работ периодическую таблицу обычно предоставляют.
-

2
Найдите в таблице нужный вам элемент. Каждый элемент в таблице располагается под своим номером. Все элементы можно разделить на металлы, неметаллы и метоллоиды (полуметаллы). В этих группах элементы классифицируются еще на несколько групп: щелочные металлы, галогены, инертные газы.[4]
- Группы (столбцы) и периоды (строки) нужны для систематизации, по ним легко найти нужный вам элемент.
- Если вы ничего не знаете о нужном вам элементе, просто найдите его в таблице.
-

3
Найдите атомный номер элемента. Атомный номер обозначает число протонов в ядре атома.[5]
Атомный номер располагается над символом элемента, обычно в левом верхнем углу клетки. Он покажет вам, сколько протонов содержится в одном атоме элемента.- Например, Бор (В) обозначен в таблице под номером 5, поэтому у него 5 протонов.
-

4
Определите количество электронов. Протоны – это положительно заряженные частицы в ядре атома. Электроны представляют собой частицы, которые несут отрицательный заряд. Поэтому когда элемент находится в нейтральном состоянии, то есть его заряд будет равен нулю, число протонов и электронов будет равным.
- Например, Бор (В) обозначен в таблице под номером 5, поэтому можно смело утверждать, что у него 5 электронов и 5 протонов.
- Однако если элемент содержит отрицательный или положительный ион, то протоны и электроны не будут одинаковыми. Вам придется вычислить их. Число ионов выглядит как маленький, верхний индекс после элемента.
-

5
Найдите атомную массу элемента. Чтобы найти число нейтронов, вам сначала нужно вычислить атомную массу элемента. Атомная масса – это средняя масса атомов данного элемента, ее нужно рассчитывать. Имейте в виду, что у изотопов атомная масса отличается.[6]
. Атомная масса указана под символом элемента.- Округляйте атомную массу до ближайшего целого числа. Например, атомная масса бора = 10,811, соответственно, ее можно округлить до 11.
-

6
Вычтите из атомной массы атомный номер. Чтобы определить количество нейтронов, нужно вычесть атомный номер из атомной массы. Помните, что атомный номер – это число протонов, которое вы уже определили.[7]
- Возьмем наш пример с бором: 11 (атомная масса) – 5 (атомный номер) = 6 нейтронов.
Реклама
-

1
Определите число ионов. Ион – это атом, состоящий из положительно заряженного ядра, в котором находятся протоны и нейтроны, и отрицательно заряженных электронов. Атом несет нейтральный заряд, но заряд может быть положительным и отрицательным из-за электронов, которые атом может отдавать и принимать.[8]
Поэтому число протонов в атоме не меняется, а число электронов в ионе может меняться.- Электрон несет отрицательный заряд, поэтому если атом отдает электроны, то сам становится заряженным положительно. Когда атом принимает электроны, он становится отрицательно заряженным ионом.
- Например, у N3- заряд -3, а у Ca2+ заряд +2.
- Помните, если число ионов не указано в таблице, вам не нужно делать подобные вычисления.
-

2
Вычтите заряд из атомного номера. Если ион положительно заряжен, нужно вычесть из атомного номера заряд. Если у иона положительный заряд, значит, он отдал электроны. Чтобы подсчитать оставшееся число электронов, нужно вычесть заряд от атомного номера. Если ион заряжен положительно, значит, в нем больше протонов, чем электронов.
- Например, у Ca2+ заряд +2, поэтому можно сказать, что он отдал два электрона. Атомный номер кальция = 20, поэтому у его иона 18 электронов (20-2=18).
-

3
Если ион заряжен отрицательно, чтобы узнать число электронов, нужно добавить заряд к атомному номеру. Потому что ион стал отрицательным из-за того, что принял лишние электроны. Так что нужно просто прибавить заряд к атомному номеру, тогда вы получите число электронов. Разумеется, если ион заряжен отрицательно, то электронов в нем больше, чем протонов.
- Например, у N3- заряд -3, значит, азот получил три дополнительных электрона. Атомный номер азота 7, поэтому число электронов у азота = 10. (то есть 7+3=10).
Реклама
Об этой статье
Эту страницу просматривали 949 885 раз.
Была ли эта статья полезной?
0 голосов
Правильный ответ
Количество электронов в атоме = порядковому номеру элемента.
n(e)=Z*Na/Na=Z
n(e) в 1 моле (Au)=79 моль
n(e) в 1 моле (NaCl)=11+17=28 моль
npiecology_zn
22 Март, 18

0 голосов
В моем понимании это решается так
talgat99_zn
22 Март, 18

0
если проследить размерности в предлагаемой Вами формуле:79е/атом/(атом/моль)=79 е*моль./атом 2. Согласно условию задачи размерность должна быть е/моль
оставил комментарий
npiecology_zn
22 Март, 18
0
1 моль (1 М) электронов е- = 6.1023 электронов е-.
оставил комментарий
talgat99_zn
22 Март, 18
0
n(электронов)=Ne/Na, где Ne- количество частиц электронов в 1 моле рассматриваемого вещества, оно равно (в случае золота) 79*Na
оставил комментарий
npiecology_zn
22 Март, 18
0
Я не говорю что ваше решение не правильное, я не заметил слова ” в одном моле “
оставил комментарий
talgat99_zn
22 Март, 18
0
Я рассчитывал на 1 атом
оставил комментарий
talgat99_zn
22 Март, 18
Количество молей электронов, полученных при использовании эквивалентного веса окислителя Калькулятор
| Search | ||
| Дом | Химия ↺ | |
| Химия | Концепция родинки и стехиометрия ↺ | |
| Концепция родинки и стехиометрия | Эквивалентный вес ↺ |
|
✖Молярная масса химического соединения определяется как масса этого соединения, деленная на количество вещества в этом образце, измеренное в молях.ⓘ Молярная масса химического соединения [M] |
+10% -10% |
||
|
✖Эквивалентный вес (также известный как грамм-эквивалент) — это масса одного эквивалента, то есть масса данного вещества.ⓘ Эквивалентный вес [W eq] |
+10% -10% |
|
✖Количество полученных молей электронов можно определить как количество молей электронов, полученных атомом в соединении от другого атома соединения.ⓘ Количество молей электронов, полученных при использовании эквивалентного веса окислителя [nelectrons gained] |
⎘ копия |
Количество молей электронов, полученных при использовании эквивалентного веса окислителя Решение
ШАГ 0: Сводка предварительного расчета
ШАГ 1. Преобразование входов в базовый блок
Молярная масса химического соединения: 0.029 Килограмм на моль –> 0.029 Килограмм на моль Конверсия не требуется
Эквивалентный вес: 6 грамм –> 0.006 Килограмм (Проверьте преобразование здесь)
ШАГ 2: Оцените формулу
ШАГ 3: Преобразуйте результат в единицу вывода
4.83333333333333 Крот –> Конверсия не требуется
15 Эквивалентный вес Калькуляторы
Количество молей электронов, полученных при использовании эквивалентного веса окислителя формула
Количество молей полученных электронов = Молярная масса химического соединения/Эквивалентный вес
nelectrons gained = M/W eq
Что такое эквивалентный вес?
Эквивалентный вес (также известный как граммовый эквивалент) – это масса одного эквивалента, то есть масса данного вещества, которое будет соединяться с фиксированным количеством другого вещества или вытеснять его. Эквивалентный вес элемента – это масса, которая объединяется или вытесняет 1,008 г водорода, 8,0 г кислорода или 35,5 г хлора. Эти значения соответствуют атомной массе, деленной на обычную валентность, например, для кислорода, которая составляет 16,0 г / 2 = 8,0 г.
Что такое окислитель?
Окислитель – это реагент, который удаляет электроны из других реагентов во время окислительно-восстановительной реакции. Окислитель обычно забирает эти электроны себе, таким образом приобретая электроны и восстанавливаясь. Таким образом, окислитель является акцептором электронов.
