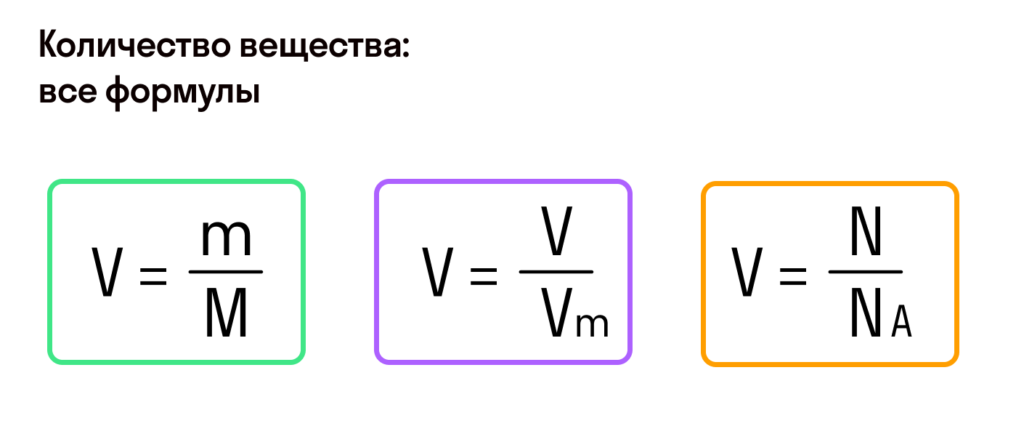
Для задач по химии бывает нужно перевести массу вещества в граммах в количество вещества в молях и обратно.
Решается это через простое соотношение:
,
где – масса вещества в граммах,
– количество вещества в молях,
– молярная масса вещества в грамм/моль
Калькулятор ниже автоматически вычисляет молярную массу по формуле вещества и рассчитывает массу вещества в граммах или количество вещества в молях, в зависимости от выбора пользователя. Для справки также выводится молярная масса соединения и детали ее расчета
Химические элементы следует писать так, как они написаны в таблице Менделеева, т. е. учитывать большие и маленькие буквы. Например Co – кобальт, CO – моноксид углерода, угарный газ. Таким образом, Na3PO4 — правильно, na3po4, NA3PO4 — неправильно.
Перевод из грамм в число молей и из числа молей в граммы
Количество вещества, моль
Точность вычисления
Знаков после запятой: 3
Количество вещества в молях
Молярная масса соединения
Детали расчета молярной массы
Молярная масса — характеристика вещества, отношение массы вещества к количеству молей этого вещества, то есть масса одного моля вещества. Для отдельных химических элементов молярной массой является масса одного моля отдельных атомов этого элемента, то есть масса атомов вещества взятых в количестве равном числу Авогадро (собственно, число Авогадро – это число атомов углерода-12 в 12 граммах углерода-12). Таким образом молярная масса элемента, выраженная в г/моль, численно совпадает с молекулярной массой — массой атома элемента, выраженной в а. е. м. (атомная единица массы). А молярные массы сложных молекул (химических соединений) можно определить, суммируя молярные массы входящих в них элементов.
И, собственно, самым сложным моментом в расчете является определение молярной массы химического соединения.
К счастью, на нашем сайте уже есть калькулятор Молярная масса соединений, который подсчитывает молярную массу химических соединений, основываясь на данных по атомной массе из справочника Таблица Менделеева. Он и используется, чтобы получить молярную массу по введенной формуле химического соединения в калькуляторе.
Внезапно русский язык
Теперь небольшое отступление. При написании этого текста у меня возник вопрос – как правильно писать с точки зрения русского языка: перевод молей в литры или перевод моль в литры.
Согласно викисловарю, слово моль склоняется, т.е. моль, моля, молю, моль, молем, моле в единственном числе, и моли, молей, молям, моли, молями, молях во множественном числе.
При этом согласно Методическому указанию от 1979 года Государственного комитета СССР по стандартам, “Обозначение единиц, совпадающих с наименованиями этих единиц, по падежам и числам изменять не следует, если они помещены после числовых значений, а также в заголовках граф, боковиков таблиц и выводов, в пояснениях обозначений величин к формулам. К таким обозначениям относятся: бар, бэр, вар, моль, рад. Следует писать 1 моль, 2 моль, 5 моль и т.д. Исключение составляет обозначение “св.год”, которое изменяется следующим образом: 1 св.год, 2,3,4 св.года, 5 св.лет.”
Таким образом получается что “перевод молей в литры” – правильно, а “перевод моль в литры” – неправильно, но “5 моль” – правильно, “5 молей” – неправильно.
Моль — условное количество вещества
Добавлено: 3 октября 2021 в 12:58

Химия — наука, изучающая взаимодействие веществ на атомном и молекулярном уровнях. Эти процессы значительно отличаются от привычного нам макроуровня и поэтому требуют специфических подходов, в том числе к «подсчету» и «взвешиванию».
Школьный курс химии включает понятия «моль» и «молярной массы». Они кажутся сложными, но если разобраться, то вы без труда поймете сущность этих понятий и научитесь ими пользоваться при решении задач.
Моль
Понятие «моль» попытаемся разобрать и, самое главное, понять на примере всем знакомой реакции взаимодействия кислорода и водорода. Когда одна молекула O2 соединяется с двумя молекулами H2, получается две молекулы H2O:
- O2 + 2H2 = 2H2O
То есть, чтобы максимально полно провести химическую реакцию, мы должны взять на каждую молекулу кислорода две молекулы водорода. Итак, у нас есть 100 г кислорода.
Сколько понадобится водорода для протекания процесса? И тут возникает первый вопрос: сколько молекул в 100 г кислорода? Наверное, миллиарды или даже миллиарды миллиардов? И сколько их в 100 г водорода? Уж точно в не в 2 раза меньше.
Как вообще подсчитать молекулы, ведь они бывают совершенно разными, «тяжелыми» и «легкими». Этими вопросами задавались и люди, закладывавшие основу современной химической науки.
Был найден простой выход, который помогает легко и изящно решить проблему. Химики решили взять за единицу измерения не одну молекулу, а определенное их количество, причем очень большое. Таким образом эта единица измерения приводит микроуровень к макроуровню. Она называется «моль».
Моль — это количество вещества из 6,02214076⋅1023 атомов или молекул. Оно не имеет физического смысла и изначально было привязано к массе определенного количества (12 граммов) углерода-12, но позже переопределено, как и многие другие единицы системы СИ.
В школьных расчетах количество структурных единиц в моле, которое также называется постоянной Авогадро, обычно округляют до 6,022⋅1023 и обозначают NA.
С этой величиной связано другое химическое понятие — «количество вещества», то есть количество структурных единиц в определенной его порции. Оно обозначается буквой ν (ню).
Примеры
В стакане содержится 2 моль воды. Сколько молекул воды находится в стакане?
- N = ν⋅ NA =2 ⋅ 6,022⋅1023 = 12,044⋅1023 молекул воды.
Также можно решить обратную задачу. Сколько молей вещества составляют 24,088⋅1023 молекул воды?
- ν⋅ = N / NA = 24,088⋅1023 / 6,022⋅1023 = 4 моля.
Что называется молярной массой
Итак, мы поняли, что моль — условное количество вещества, выбранное для удобства химиков. Это даже не миллиарды миллиардов, как мы предположили ранее, а миллиарды триллионов, что никак не облегчает задачу подсчета этих структурных единиц.
Как же все-таки узнать, сколько атомов или молекул в 100 граммах того или иного вещества? Теперь хорошо бы связать количество вещества и его массу, ведь это не одно и то же. Нам поможет «молярная масса» — 1 моль вещества или 6,022⋅1023 структурных единиц этого вещества.
Итак, масса вещества равна массе порции вещества m к количеству молекул ν в его порции:
- М = m / ν.
Вооружившись этим знанием, мы можем переводить граммы в число молекул и наоборот. При этом следует учесть, что молярная масса численно идентична молекулярной массе (то есть массе молекулы), выраженной в атомных единицах массы, и относительной молекулярной массе.
Пример
Найдем массу 5 моль воды.
Чтобы решить эту задачу, обратимся к формуле молярной массы и выразим из нее массу:
- m = М ⋅ ν
В этой формуле мы знаем количество вещества ν = 5 моль, а молярную массу сложной молекулы нужно определить, как сумму молярных масс составляющих ее химических элементов:
- M (H2O) = 2 ⋅M (H) + M (O)
Где взять молярные массы кислорода и водорода (в соединение входит два атома водорода, поэтому его молярную массу умножаем на 2)?
Для этого нам понадобится таблица Менделеева и значение «относительной атомной массы», которая, как мы уже знаем, идентична молекулярной. Это значение приведено для каждого химического элемента и для водорода равно 1,00797 (то есть близко к 1), для углерода — близко к 6, для кислорода — около 16.
Подставим соответствующие значения в исходную формулу и получим:
- M (H2O) = 2 ⋅M (H) + M (O) = 2 ⋅ 1 + 16 = 18 г/моль.
То есть вес 1 моль воды составляет 18 граммов. Теперь можем подсчитать массу 5 моль воды:
- m = М ⋅ ν = 18 ⋅ 5 = 90 г.
Аналогичным образом мы можем подсчитать количество вещества, которое содержится в определенном образце заданной массы. Для примера возьмем оксид алюминия Al2O3 и узнаем, сколько моль в 400 граммах этого вещества. Для этого выразим количество вещества через молярную массу и подставим исходные данные:
- ν = m / М = 400 / (2 ⋅ М (Al) + 3 ⋅ (O)) = 400 / (2 ⋅ 75 + 3 ⋅ 16) = 400 / (150 + 48) = 400 / 198 ≈ 2,02 моль.
Занимайтесь на курсах ЕГЭ и ОГЭ в паре TwoStu и получите максимум баллов на экзамене:

Эксперт по подготовке к ЕГЭ, ОГЭ и ВПР
Задать вопрос
Закончил Московский физико-технический институт (Физтех) по специальности прикладная физика и математика. Магистр физико-математических наук. Преподавательский стаж более 13 лет. Соучредитель курсов ЕГЭ и ОГЭ в паре TwoStu.
Читайте также:
Download Article
Download Article
Moles are a standard unit of measurement in chemistry that take into account the different elements in a chemical compound.[1]
Often, amounts of compounds are given in grams and need to be converted to moles. This conversion can help give you a clearer picture of the number of molecules you’re working with rather than dealing with weight, which can change between molecules. Although the conversion is simple, there are a number of important steps that need to be followed. Using this method, you can learn how to convert grams into moles.
-
1
Gather the necessary tools for solving a chemistry problem. Having everything you need easily accessible will simplify the process of solving the assigned problem. You will need the following:
- A pencil and paper. Calculations are easier to solve when you write them out. Be sure to show all your steps to get full credit.
- A periodic table. You will need to be able to find atomic weight of elements using the periodic table.
- A calculator. Calculators are necessary to simplify calculations of complex numbers.
-
2
Identify the elements in the compound that you need to convert into moles. The first step in calculating molecular mass is identifying each element that composes the compound. It is easy to distinguish elements because abbreviations contain only one or two letters.
- If a compound is abbreviated with two letters, the first will be capitalized while the second will be lowercase. For example, Mg is the abbreviation for magnesium.
- The compound NaHCO3 has four elements in it: sodium (Na), hydrogen (H), carbon (C), and oxygen (O).
Advertisement
-
3
Determine the number of atoms that each element contributes to the compound. You must know how many atoms of each element are present to calculate the molecular mass.[2]
The number of atoms each element contributes will be written in a subscript next to the element.- For example, H2O has two atoms of hydrogen and one atom of oxygen.
- If a compound has parentheses followed by a subscript, each element within the parentheses gets multiplied by the number in the subscript. For example, (NH4)2S has two atoms of N, eight atoms of H, and one atom of S.
-
4
Write down the atomic weight of each element. A periodic table is the easiest way to find the atomic weight of an element. Once you locate the element on the table, the atomic weight is usually found underneath the symbol for that element.
- The atomic weight, or mass, or an element is given in atomic mass units (amu).[3]
- For example, the molecular weight of oxygen is 15.99.
- The atomic weight, or mass, or an element is given in atomic mass units (amu).[3]
-
5
Calculate molecular mass. The molecular mass of a substance is calculated as the number of atoms of each element multiplied by the atomic weight of that element.[4]
Knowing the molecular mass is necessary to convert grams to moles.[5]
- Multiply the number of atoms each element contributes to the compound by the atomic weight of that element.
- Add the total weight of each element in the compound together.
- For example, (NH4)2S has a molecular weight of (2 x 14.01) + (8 x 1.01) + (1 x 32.07) = 68.17 g/mol.
- Molecular mass is also referred to as molar mass.[6]
Advertisement
-
1
Set up the conversion formula. The number of moles you have of a compound can be calculated by dividing the number of grams of the compound by the molecular mass of the compound. [7]
- The formula looks like this: moles = grams of compound/molar mass of compound
-
2
Plug your numbers into the formula. Once you have properly set up the formula, the next step is just putting your calculations into the correct part of the formula. An easy way to check that you have everything in the right place is by the units. Canceling out all the units should leave you with just moles.[8]
-
3
Solve the equation. Using a calculator, divide the number of grams by the molar mass. The result is the number of moles in your element or compound.[9]
- For example, imagine you have 2 g of (NH4)2S and you want to convert it to moles. The molecular mass of (NH4)2S is 68.17g/mol. Divide 2 by 68.17, and you have 0.0293 moles of (NH4)2S.
Advertisement
Calculator, Practice Problems, and Answers
Add New Question
-
Question
What is the difference between moles and molecules?
1 mole of a substance is gram molecular mass of that substance, which contains 6.022*10^23 constituent particles (i.e. molecules). 1 mole = 6.022*10^23 molecules.
-
Question
What are the differences in atoms and molecules?
Atoms are fundamental elements with 1 nucleus (made up of neutrons and protons), with electrons revolving around the nucleus. Molecules involve bonding between 2+ atoms, so there are 2+ nuclei in a molecule.
-
Question
How many moles of CO2 are produced when 0.300 moles of C6H12O6 are fermented?
C6H12O6 = 2 C2H6O (alcohol) + 2 CO2, Since 0.3 moles of C6H12O6 produce 2 CO2, then we have produced 2 x 0.3 = 0.6 moles of CO2.
See more answers
Ask a Question
200 characters left
Include your email address to get a message when this question is answered.
Submit
Advertisement
Video
-
Always include the element or compound name with your answer.
-
If you are asked to show work on your chemistry assignment or test, be sure to identify your answer clearly by circling it or drawing a box around it.
Advertisement
Things You’ll Need
- Periodic table
- Pencil
- Paper
- Calculator
- Chemistry problem
About This Article
Article SummaryX
To convert grams to moles, start by multiplying the number of atoms by the atomic weight for each element in the compound. Then, add all of your answers together to find the molar mass of the compound. Finally, divide the number of grams of the compound by the molar mass of the compound to find the number of moles. To learn how to find the number of atoms and the atomic weight for each element, read on!
Did this summary help you?
Thanks to all authors for creating a page that has been read 839,102 times.
Did this article help you?
Как перевести граммы в моли
При изучении химии и в практической работе часто ставится задача на определение числа молекул в одном грамме вещества. Однако поскольку число молекул слишком велико, их принято измерять “порциями”. Одна подобная порция вещества, содержащая 600 миллиардов триллионов частиц, из которых оно состоит (молекулы, атомы, либо ионы), называется молем. Как же узнать, сколько молей вещества содержится в грамме?

Вам понадобится
- – таблица Менделеева;
- – калькулятор.
Инструкция
Перевести граммы в моли можно по формуле:
n=m/M
где
n – число молей, которое требуется найти
m – известная масса вещества (гр)
М – масса одного моля вещества, или молярная масса (гр/моль)
Таким образом, для решения задачи осталось узнать значение M.
Молярная масса – величина, для каждого вещества постоянная, и в общем случае численно равная его относительной атомной или относительной молекулярной массе. Чтобы определить, молекулярный или атомарный состав у исследуемого вещества, нужно взглянуть на его химическую формулу. Например, Н2О (вода) – молекула, О2 (кислород) – молекула, Fe (железо) – атом, С (углерод) – атом.
Для атомарного вещества достаточно найти его в таблице Менделеева – относительная атомная масса указана в ячейке каждого элемента. Например, относительные атомные массы веществ С, Fe, Na равны 12, 56, 23 (с округлением до целого) – следовательно, их молярные массы М составляют 12 гр/моль, 56 гр/моль, 23 гр/моль.
Если вещество молекулярное, то относительная молекулярная масса складывается из суммы атомных масс всех атомов, входящих в молекулу. Например, относительная молекулярная масса воды с формулой Н2О равна 18 – два атома водорода с массой 1 нужно сложить с одним атомом кислорода с массой 16 (2*1+16=18). У молекулы метана – CH4 – относительная молекулярная масса составит 16 (12+4*1=16). Таким образом, молярные массы М воды и метана будут равны 18 гр/моль и 16 гр/моль соответственно.
Теперь, зная массу вещества m в граммах и его молярную массу М, полученную с помощью таблицы Менделеева и простых расчетов, переводим граммы в моли по вышеприведенной формуле: n=m/M. Число n и будет искомой величиной молей для заданных грамм вещества.
Обратите внимание
Если в формулу вещества входят ионы, их молярная масса подсчитывается так же, как у атомов.
Полезный совет
Существуют специальные таблицы молярных масс для некоторых веществ, а также программы расчета молярных масс.
Источники:
- Фестиваль педагогических идей “Открытый урок”
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Моль, молярная масса и граммы – эти понятия как-то связаны? Давайте-ка в этом разберёмся и порешаем задачи на молярную массу. Для начала вспоминаем, что моль – это количество вещества, в котором содержится 6,02*10 в двадцать третьей степени части (это число Авогадро).
Молярная масса показывает, сколько весит 1 моль того или иного вещества в граммах.
Молярная масса совпадает с атомной (если речь о простых вещества) или молекулярной (если речь о веществах сложных и газах, молекулы которых состоят из двух атомов, например, О2).
Это была теория. Но любую теорию нужно применять на практике, иначе зачем она нужна? Вот и займёмся этим.
У нас есть химическая реакция:
Н2 + F2 = 2HF
Из уравнения мы видим, что для неё нам нужна 1 молекула водорода и одна молекула фтора. Мы может взять, например, 10 молекул водорода, сколько нам в таком случае понадобится молекул фтора? Тоже 10. Мы можем взять и 100 молекул водорода, тогда потребуется и 100 молекул фтора. Кстати, заодно давайте уж узнаем, сколько молекул фторида водорода мы получим.
Из 1 молекулы водорода и 1 молекулы фтора получается две молекулы фторида водорода
(коэффициент в уравнении перед HF – 2). А если мы берём по 10 молекул водорода и фтора, то сколько получим HF? 20. Ну и взяв по 100 молекул водорода и фтора, мы получим 200 молекул фторида водорода.
Проблема в том, что молекулы настолько малы, что взять даже миллион молекул у человека не получится, это слишком маленькое количество вещества, которое на весах не взвесить. Вот тут и пришёл на помощь моль. Ещё раз запомните: в одном моле любого вещества содержится одно и то же число частиц!
Это очень важно для любых расчётов в химии. В 1 моле водорода содержится число Авогадро частиц, в 1 моле железа содержится число Авогадро частиц, в 1 моле воды содержится число Авогадро частиц, в 1 моле серной кислоты содержится число Авогадро частиц. Но! По массе моли веществ различаются, об это мы говорили раньше. И это обязательно нужно понять.
Теперь вернёмся к нашей реакции:
Н2 + F2 = 2HF
1 молекула Н2 + 1 молекула F2 = 2 молекулы HF
2 молекулы Н2 + 2 молекулы F2 = 4 молекулы HF
100 молекул Н2 + 100 молекул F2 = 200 молекул HF
Всё верно, ведь так?
А теперь вот так:
Н2 + F2 = 2HF
число Авогадро молекул Н2 + число Авогадро молекул F2 = число Авогадро молекул HF
или
1 моль Н2 + 1 моль F2 = 2 моль HF
И как же нам наконец перейти к граммам? Для этого вспоминаем, что молярная масса – это масса 1 моля вещества, совпадающая с атомной или молекулярной. Атомную или молекулярную массу мы определяем по таблице Менделеева: 1 моль водорода весит 2 г (атомная масса водорода 1, формула газообразного водорода Н2, поэтому его молекулярная масса 1*2=2), 1 моль фтора весит 38 г (атомная масса фтора 1, формула газообразного фтора F2, поэтому его молекулярная масса 19*2=38). Таким образом, для того, чтобы произошла реакция, нам нужно взять 2 г водорода и 38 граммов фтора. В этом случае оба вещества прореагируют полностью, образовав 40 граммов фторида водорода.
Теперь ещё пара задач на молярную массу с решениями.
Пример 1.
Сколько граммов оксида кальция и углекислого газа нужно взять, чтобы получить 50 граммов оксида кальция в реакции СаО + СО2 = СаСОз?
Решение.
Первое, что нужно сделать, рассчитать молярные массы всех веществ. Используем периодическую таблицу, чтобы узнать атомные массы:
· молярная масса оксида кальция СаО 40+16=56 г/моль
· молярная масса углекислого газа СО2 12+2*16=44 г/ моль
· молярная масса карбоната кальция СаСО3 40+12+3*16=100 г/моль.
Давайте подумаем, сколько моль карбоната кальция СаСО3 составляют 50 г? 1 моль СаСО3 весит 100 г (см. выше на молярную массу). Следовательно 50г весят 0,5 моль. Это означает, что при проведении реакции в условиях задачи получится 0,5 моль карбоната кальция.
Второе, что нужно сделать, – понять в каком соотношении взяты вещества. Об этом нам говорят коэффициенты в уравнение:
СаО + СО2 = СаСОз
1 моль + 1 моль = 1 моль
Но мы уже выяснили, что в нашем случае мы получим всего 0,5 моль СаСОз. То есть и исходных веществ СаО и СО2 нужно взять по 0,5 моль. Переводя в граммы, получим, что оксида кальция требуется 56 г/моль*0,5 моль=28 г, а углекислого газа – 44 г/моль*0,5 моль=22 г. Это и есть ответ.
Пример 2.
Этот пример не из учебника химии, он сложный, но если вы его поймёте, вас никакой репетитор по химии уже не запугает. Пробуем!
Задача звучит так. Алюминий прореагировал с кислородом с образованием оксида алюминия. Известно, что в реакцию вступило 9 граммов алюминия. Определите, сколько получилось оксида алюминия в граммах.
Решение.
Для начала запишем уравнение 4Al + 3O2 = 2Al2O3 и сразу увидим, что 4 моля алюминия, сгорев, образуют 2 моля оксида алюминия.
Теперь смотрим в таблицу Менделеева и определяемся с молярными массами:
· молярная масса алюминия 27 г/моль, с этим всё просто
· молярная масса оксида алюминия Al2O3 102 г/моль (помните, как мы считаем? 2*27 (это алюминий)+3*16 (это кислород)=54+48=102).
Из условия задачи мы узнали, что в реакцию вступило 9 г алюминия. 1 моль алюминия весит 27 г (это молярная масса). Следовательно, в реакцию вступило 9/27 моль алюминия, или 0,3 моль алюминия. Вернёмся к реакции:
4Al + 3O2 = 2Al2O3
4 моля алюминия при сгорании образуют 2 моля оксида алюминия
0,3 моля алюминия при сгорании образуют Х моля оксида алюминия
Находим Х=0,3*2/4=0,15 моль. Таким образом, если в реакции участвовало 9 г алюминия (или 0,3 моль), то получилось 0,15 моль оксида алюминия. Теперь самое простое – ищем массу в граммах. Припоминаем, что молярная масса оксида алюминия 102 г/моль. То есть 102 г весит 1 моль. А у нас всего 0,15 моль, и весит это количество вещества 102*0,15=15,3 г. Ответ на задачу: при сгорании 9 граммов алюминия получается 15,3 граммов оксида алюминия.
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.