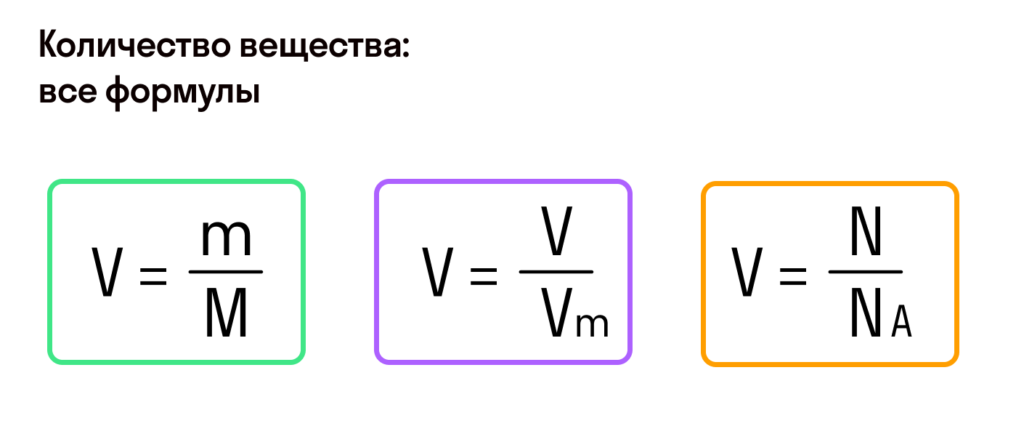
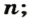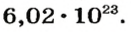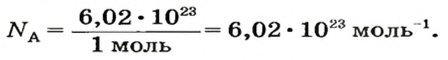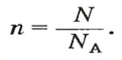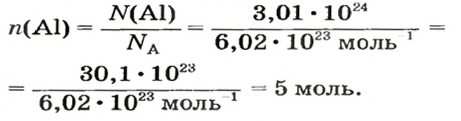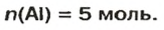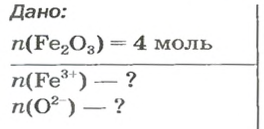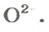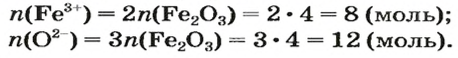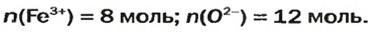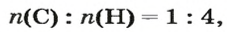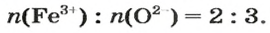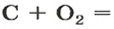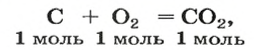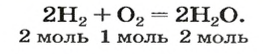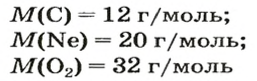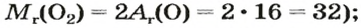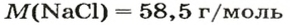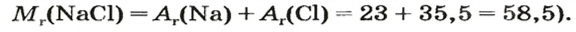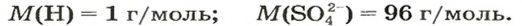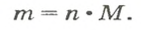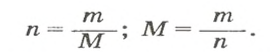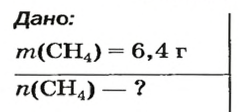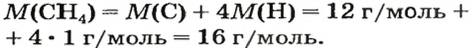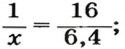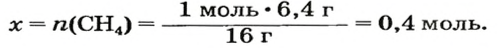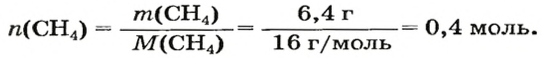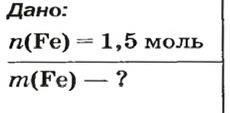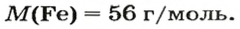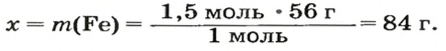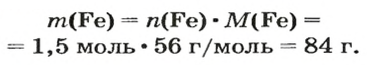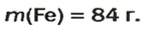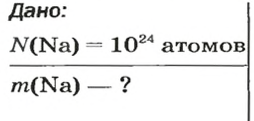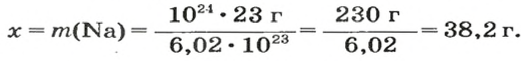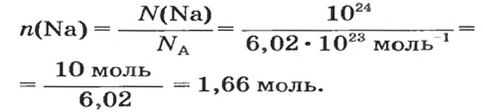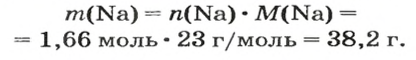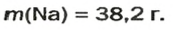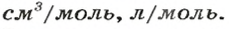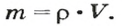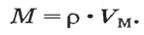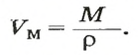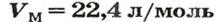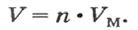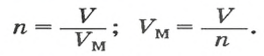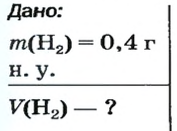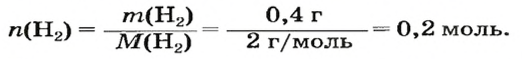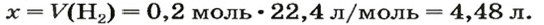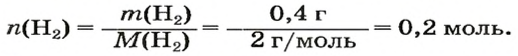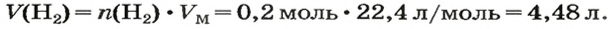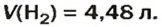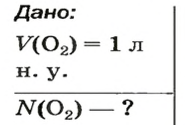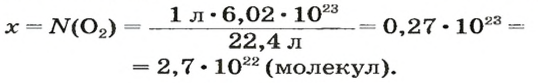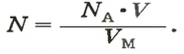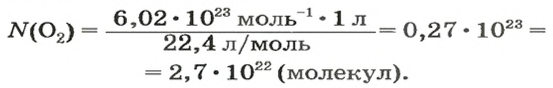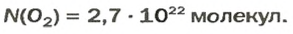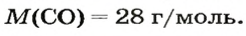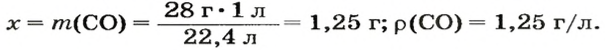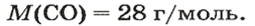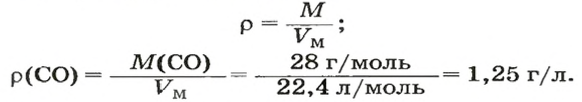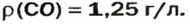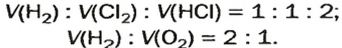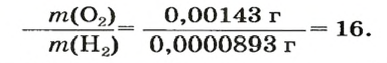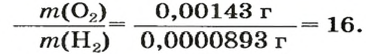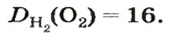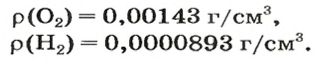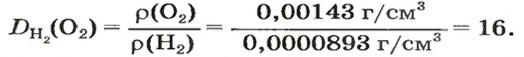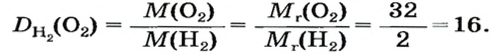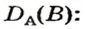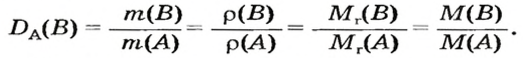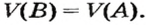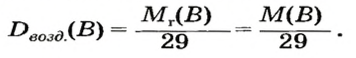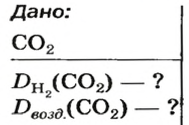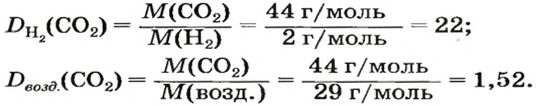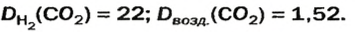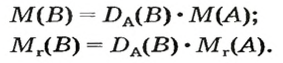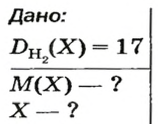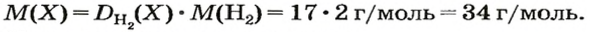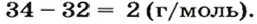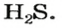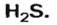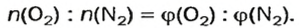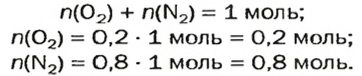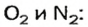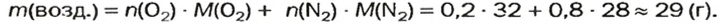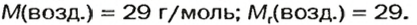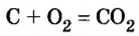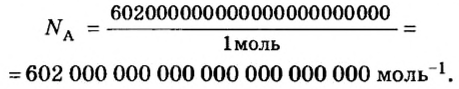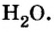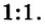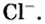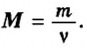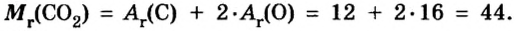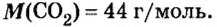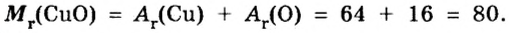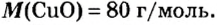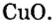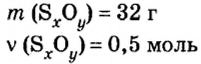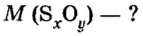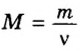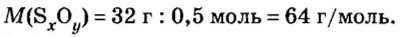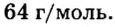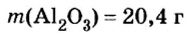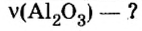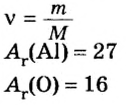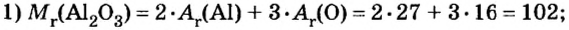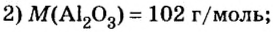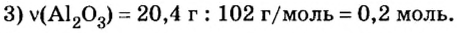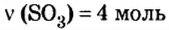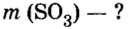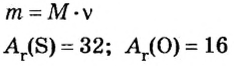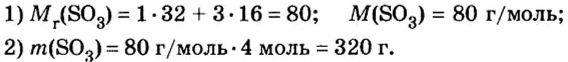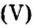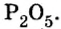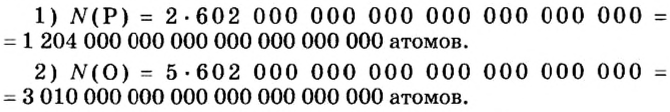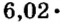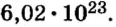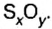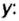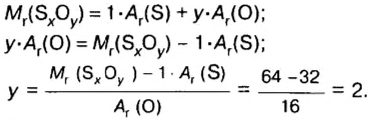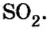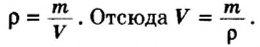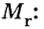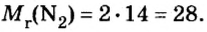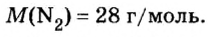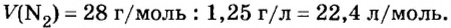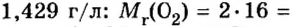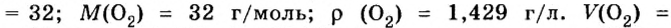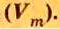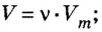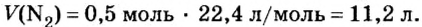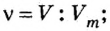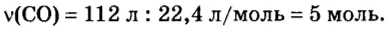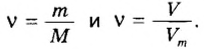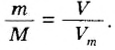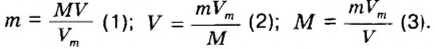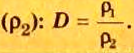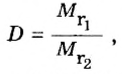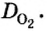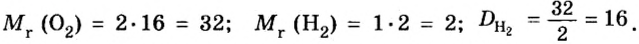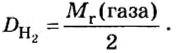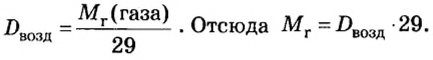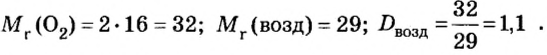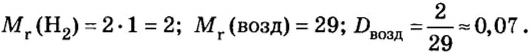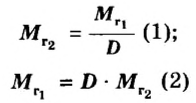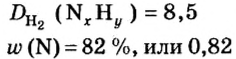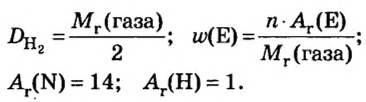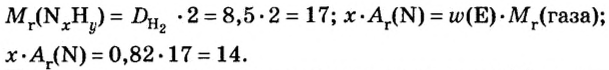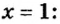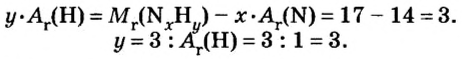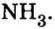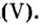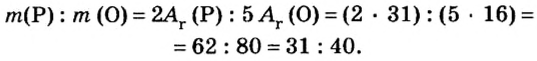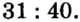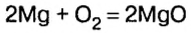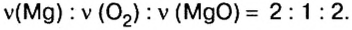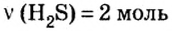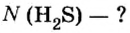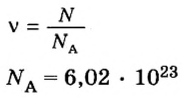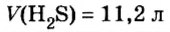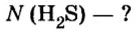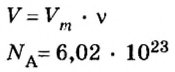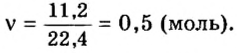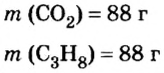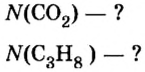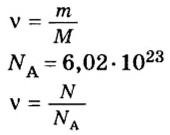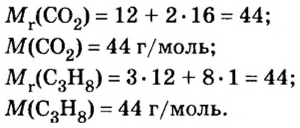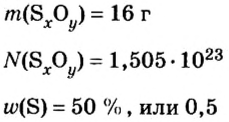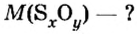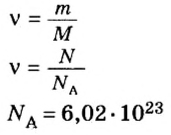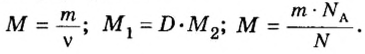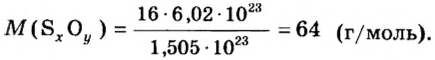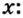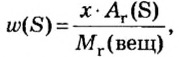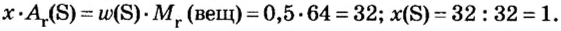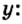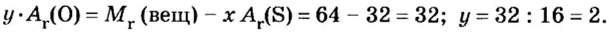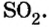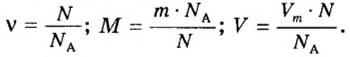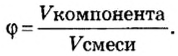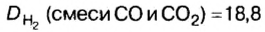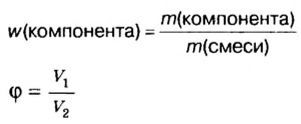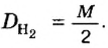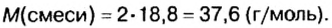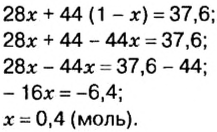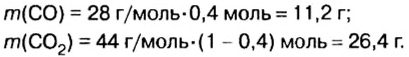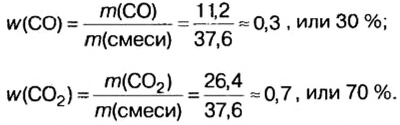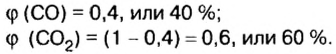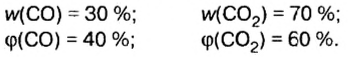Количество вещества
Несколько столетий тому назад алхимики, готовясь к различным опытам и после их проведения, нередко взвешивали вещества, определяли их объемы. После открытия М. В. Ломоносовым и А. Л. Лавуазье закона сохранения массы веществ при химических реакциях химия начала быстро развиваться, обретая статус точной науки. Расчеты стали неотъемлемой частью химических исследований.
Вы уже знаете, что вещества могут иметь молекулярное, атомное или ионное строение. Превращение одних веществ в другие происходит в результате соединения атомов в молекулы, распада молекул на атомы, перегруппировки атомов или ионов.
Комментируя реакцию горения углерода
вы скажете, что каждый атом Карбона взаимодействует с молекулой кислорода с образованием молекулы углекислого газа, два атома Карбона взаимодействуют с двумя молекулами кислорода, образуя две молекулы углекислого газа, и т. д.
Чтобы подготовить какой-либо химический опыт, не имеет смысла пересчитывать атомы, молекулы. Да это и невозможно сделать. Химики используют физическую величину, которая определяется количеством частиц вещества в определенной его порции. Название этой величины — количество вещества. Ее обозначают латинской буквой
Единицей измерения количества вещества является моль*.
Ученые установили, что 1 моль любого вещества содержит 602 ООО ООО ООО ООО ООО ООО ООО его формульных единиц (атомов, молекул, совокупностей ионов). Это число можно записать как 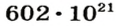
1 моль — это порция вещества, которая содержит 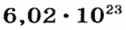
Так, 1 моль углерода (вещество атомного строения) содержит 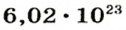
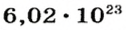
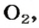
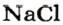
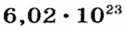
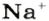
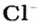
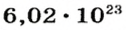
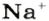
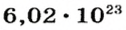
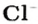
* Термин происходит от латинского слова moles — бесконечное
Понятие «количество вещества» используют не только по отношению к веществам, но и по отношению к частицам — атомам, молекулам, ионам. Например, выражение «1 моль ионов 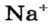
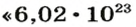
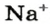
Число 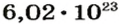
1 моль — это порция вещества, которая содержит столько формульных единиц, сколько атомов Карбона содержится в 12 г углерода.
Представление о порциях различных веществ в 1 моль можно получить из рисунка 1.
Число 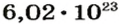
Число Авогадро в миллиарды раз превышает количество волос на головах, в усах, бородах всех живущих на Земле людей. Если покрыть земную поверхность таким количеством (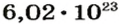
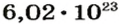
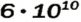
Амедео Авогадро (1776—1856)
Выдающийся итальянский физик и химик. Выдвинул гипотезу о молекулярном строении веществ, в частности газов. Открыл один из законов для газов (1811 год), позже названный его именем. Уточнил атомные массы некоторых элементов, определил состав молекул воды, аммиака, углекислого и угарного газов, метана, сероводорода и др. Разработал экспериментальные методы определения молекулярных масс газообразных веществ.
Числу Авогадро отвечает постоянная Авогадро. Ее обозначение — 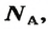
Если порция вещества содержит N частиц (формульных единиц), то можно вывести формулу для вычисления соответствующего количества вещества n:
в 1 моль вещества содержится 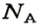
в n моль вещества — N частиц;
Слово «моль» не склоняется, если перед ним есть число, но склоняется, если числа нет.
Примеры словосочетаний: взято 5 моль железа, определение моля.
Решение задач. Решим несколько задач, в которых используется величина «количество вещества».
ЗАДАЧА 1. В каком количестве вещества содержится 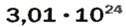
Решение
Воспользуемся формулой, которая отображает связь между количеством вещества и числом частиц (атомов):
Ответ:
В 1 моль какого-либо молекулярного вещества всегда содержится больше чем 1 моль атомов (1 моль элемента). Например, в 1 моль кислорода 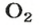

Количества вещества ионов в ионном соединении вычисляют аналогично.
ЗАДАЧА 2. Рассчитать количества вещества ионов в феррум (Ш) оксиде 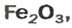
Решение
Формульная единица оксида 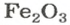
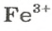
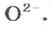
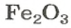
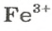
В 4 моль этого соединения количества вещества ионов в четыре раза больше:
Ответ:
По формуле соединения можно определить соотношение в нем количеств вещества атомов (элементов), ионов. Например, в метане
а в феррум(Ш) оксиде 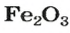
Вернемся к химической реакции 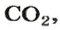
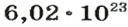
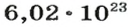
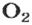
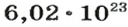
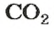
видим, что количества вещества соответствуют коэффициентам. Это справедливо для любой реакции. Приведем еще один пример:
ВЫВОДЫ. Количество вещества в химии определяют числом его частиц. Единица измерения количества вещества — моль. 1 моль содержит 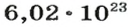
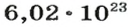
Это интересно. Количество вещества используют для характеристики состава растворов в научных исследованиях.
Молярная масса
Важной величиной, которая связана с количеством вещества, является молярная масса. Ее используют во многих вычислениях — при подготовке к химическому эксперименту, внедрении технологических процессов на заводах, для обработки результатов исследования химических реакций.
Молярная масса — это масса 1 моль вещества.
Молярную массу обозначают латинской буквой М. Ее размерность — г/моль.
Молярная масса численно равна относительной атомной, молекулярной или формульной массе.
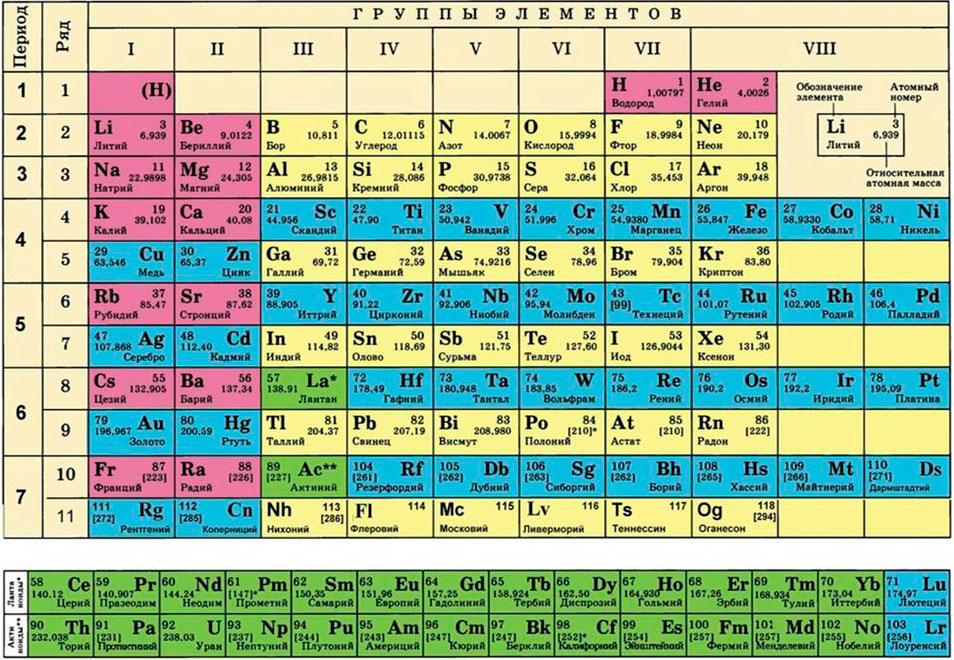
Для того чтобы записать молярную массу какого-либо вещества, достаточно указать значение соответствующей относительной атомной, молекулярной или формульной массы и добавить размерность — г/моль. Относительные атомные массы элементов представлены в периодической системе Д. И. Менделеева, а относительные молекулярные и формульные массы веществ вы научились вычислять в 7 классе.
Примеры записи молярных масс простых и сложных веществ:
(расчет относительной молекулярной массы:
(расчет относительной формульной массы:
Поскольку понятие «моль» используют не только по отношению к веществам, но и по отношению к частицам (атомам, молекулам, ионам), то и для них существуют молярные массы. Учитывая, что масса 1 моль атомов Гидрогена составляет 1 г, а 1 моль ионов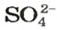
Выведем формулу, которая описывает взаимосвязь между массой, количеством вещества и молярной массой. Если, например, 1 моль атомов Гидрогена имеет массу 1 г, то n моль этих атомов — массу, которая в n раз больше, т. е. n г. Запишем соответствующее математическое выражение:
Общая формула для вычисления массы атомов, ионов, веществ по количеству вещества:
Отсюда
Итак, молярная масса — это отношение массы к количеству вещества.
Решение задач. Рассмотрим два способа решения задач, которые предполагают использование молярной массы. Один из них предусматривает составление пропорции, а другой — вычисления по приведенным выше формулам.
ЗАДАЧА 1. Рассчитать количество вещества метана 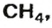
Решение
1-й способ
1. Вычисляем молярную массу соединения:
2. Находим количество вещества метана, составив пропорцию:
1 моль 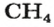
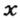
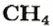
2-й способ
Воспользуемся одной из формул, приведенных в параграфе:
Ответ:
ЗАДАЧА 2. Какая масса железа отвечает количеству вещества 1,5 моль?
Решение
1-й способ
Железо — простое вещество, состоящее из атомов элемента Феррума.
Рассчитываем массу железа с помощью пропорции:
1 моль 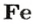
1,5 моль 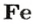
2-й способ
Воспользуемся формулой, приведенной в параграфе:
Ответ:
ЗАДАЧА 3. Вычислить массу 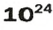
Решение
1-й способ
Поскольку 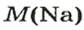
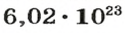
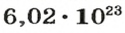
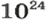
2-й способ
1. Рассчитываем количество вещества Натрия:
2. Вычисляем массу атомов Натрия:
Ответ:
ВЫВОДЫ. Молярная масса — это масса 1 моль вещества. Она численно равна относительной атомной, молекулярной или формульной массе. Молярная масса является отношением массы к количеству вещества.
Молярный объем
Порцию вещества можно охарактеризовать не только ее массой, но и объемом. Поэтому не случайно, что, кроме молярной массы, существует другая физическая величина — молярный, объем.
Молярным объемом называют объем 1 моль вещества.
Обозначение молярного объема — 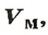
Из курса физики 7 класса вам известна формула, в которую входят масса вещества 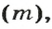
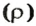
Аналогичная связь существует между молярной массой и молярным объемом:
Из этой формулы получаем другую:
По ней можно вычислять молярный объем любого вещества. Для этого нужно рассчитать молярную массу вещества и найти в справочнике его плотность.
Для каждого твердого и жидкого вещества существует свой молярный объем (например, для алюминия, поваренной соли, воды и спирта — 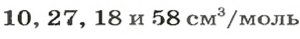
Газы при нагревании или понижении давления заметно расширяются, а при охлаждении или повышении давления сжимаются. Это происходит потому, что расстояния между молекулами в газах очень большие (в отличие от твердых и жидких веществ, где частицы соприкасаются друг с другом).
При изменении условий изменяются также плотность газа и его молярный объем. Поэтому, приводя значения этих физических величин, обязательно указывают соответствующие температуру и давление.
Нормальные условия (н. у.) = О °С; 101,3 кПа
Для газов при н. у.
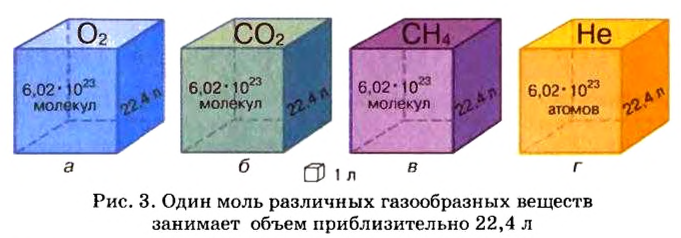
Ученые установили, что молярный объем различных газов при одинаковых условиях один и тот же. В частности, при температуре О °С и давлении 101,3 кПа (или 760 мм рт. ст.) он составляет 22,4 л/моль. Приведенные условия называют нормальными (сокращенно — н. у.).
1 моль любого газа при нормальных условиях занимает объем 22,4 л.
Описывая физические свойства вещества, указывают его агрегатное состояние при обычных условиях. В этом случае речь идет об условиях, которые чаще всего существуют в помещении, где изучают или используют вещество. Это — температура приблизительно +20 °С и давление приблизительно 760 мм рт. ст.
Связь между объемом 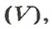
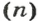
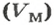
Из нее можно получить две другие:
Итак, молярный объем — это отношение объема к количеству вещества.
Закон Авогадро
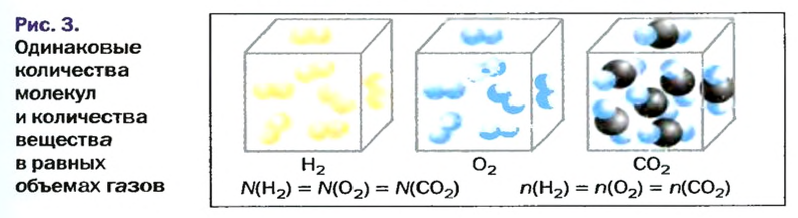
Вы уже знаете, что 1 моль водорода, кислорода или углекислого газа занимает при нормальных условиях объем 22,4 л и содержит 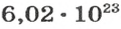
XIX ст. А. Авогадро. Получив впоследствии экспериментальное подтверждение и теоретическое обоснование, эта гипотеза стала законом.
Закон Авогадро формулируют так:
в равных объемах различных газов при одинаковых температуре и давлении содержится одинаковое число молекул*.
Приводим важное следствие закона Авогадро:
в равных объемах различных газов при одинаковых температуре и давлении содержатся одинаковые количества вещества.
* — Для инертных газов – одинаковое число атомов.
Изложенный материал обобщает рисунок 3.
Решение задач. Рассмотрим несколько задач, при решении которых используют молярный объем газа.
ЗАДАЧА 1. Вычислить объем 0,4 г водорода при нормальных условиях.
Решение
1-й способ
1. Находим количество вещества водорода:
2. Вычисляем объем водорода составлением пропорции:
1 моль 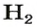
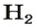
2-й способ
1. Находим количество вещества водорода:
2. Вычисляем объем водорода по соответствующей формуле:
Ответ:
ЗАДАЧА 2. Вычислить количество молекул в 1 л кислорода при нормальных условиях.
Решение
1-й способ
Вычисляем количество молекул кислорода в 1 л газа при нормальных условиях:
в 22,4 л кислорода содержится 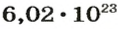
в 1 л кислорода — х молекул;
2-й способ
Вычисляем количество молекул кислорода в 1 л газа при нормальных условиях. Для этого из формулы 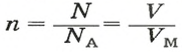
Осуществляем расчет:
Ответ:
Эту задачу можно решить еще одним способом. По соответствующим формулам сначала вычисляют количество вещества кислорода, а затем — количество молекул.
ЗАДАЧА 3. Рассчитать плотность угарного газа СО при нормальных условиях.
Решение
1-й способ
1. Находим молярную массу угарного газа:
2. Вычисляем плотность газа при нормальных условиях:
1 моль угарного газа, т. е.
28 г СО занимает при н. у. объем 22,4 л,
х г СО — 1л;
2-й способ
1. Находим молярную массу угарного газа:
2. Рассчитываем плотность угарного газа при нормальных условиях, преобразовав формулу 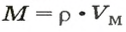
Ответ:
ВЫВОДЫ
Молярный объем — объем 1 моль вещества. Эта физическая величина является отношением объема к количеству вещества.
Молярные объемы твердых и жидких веществ разные, а газов (при одних и тех же температуре и давлении) — одинаковы. При нормальных условиях (температуре О°С и давлении 101,3 кПа, или 760 мм рт. ст.) 1 моль любого газа занимает объем 22,4 л.
В равных объемах различных газов при одинаковых температуре и давлении содержится одинаковое число молекул (закон Авогадро).
Соотношение объемов газов в химических реакциях
Согласно закону Авогадро, равные объемы газов содержат одинаковое число молекул (при одинаковых условиях). Если каждая молекула одного газа реагирует с одной молекулой другого, например, во время реакции
то должны взаимодействовать одинаковые объемы веществ, скажем, 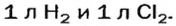
на один объем кислорода должны приходиться два объема реагирующего с ним водорода. Только при таком условии число молекул водорода будет вдвое превышать число молекул кислорода, как того «требует» химическое уравнение.
Обобщением этих выводов является закон объемных соотношений газов, который открыл французский ученый Ж. Гей-Люссак в 1808 г.: объемы газов, которые вступают в реакцию и образуются в результате реакции, соотносятся как небольшие целые числа.
Со временем ученые установили, что эти числа являются соответствующими коэффициентами в химических уравнениях.
Итак, для газов в реакциях (1) и (2)
Использование закона Гей Люссака дает возможность химику или инженеру-технологу определить, какие объемы газов нужно взять для осуществления реакции. Отобрать определенный объем газа значительно легче, чем взвесить его необходимую массу.
Относительная плотность газа
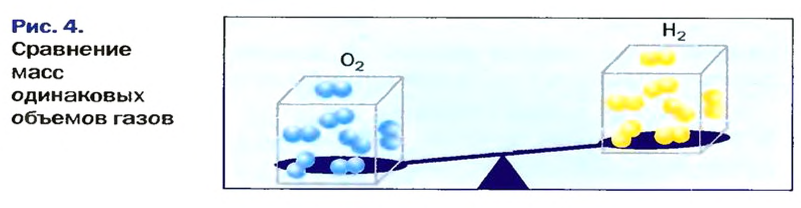
В равных объемах различных газов содержится одно и то же число молекул*. Поскольку молекулы различных веществ обычно имеют разную массу, то массы одинаковых объемов газов, как правило, разные. Например, масса 1 
* — При одних и тех же условиях.
Число 16 называют относительной плотностью кислорода по водороду. Ее обозначают буквой D и записывают так:
Относительная плотность газа по другому газу — это отношение массы определенного объема газа к массе такого же объема другого газа (при одинаковых температуре и давлении).
Масса 1 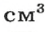
Узнать, во сколько раз кислород тяжелее водорода, можно, разделив плотность кислорода на плотность водорода:
Эта формула объясняет, почему физическую величину, о которой идет речь в параграфе, называют относительной плотностью.
Относительная плотность, как и относительная атомная (молекулярная, формульная) масса, не имеет размерности.
Если взять по 22,4 л кислорода и водорода при нормальных условиях, то массы веществ (в граммах) будут численно равны их молярным массам или относительным молекулярным массам. Отсюда — такие варианты вычисления относительной плотности кислорода по водороду:
Преобразуем все приведенные выше формулы на общие. Более тяжелый газ обозначим буквой В, более легкий — буквой А, а относительную плотность первого газа по второму —
Запомните: соотноы1ение масс газов можно использовать для вычисления относительной плотности лишь при условии, что
Газы часто сравнивают с воздухом. Хотя воздух является смесью газов, его можно условно считать газом с относительной молекулярной массой 29. Это число называют средней относительной молекулярной массой воздуха. Оно находится в промежутке между числами 32 и 28 — относительными молекулярными массами кислорода 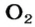
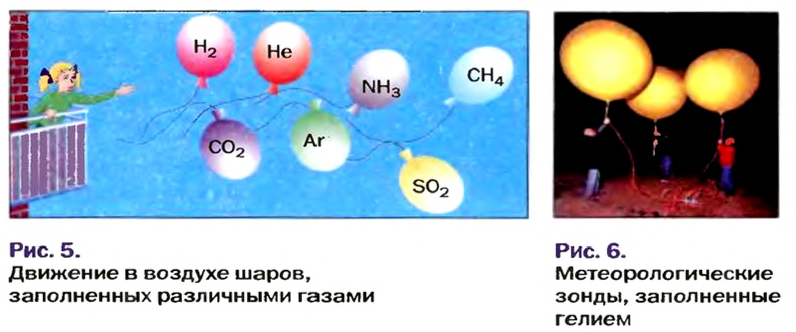
Установить, легче или тяжелее воздуха определенный газ, очень просто. Достаточно заполнить им резиновый шарик и отпустить его (рис. 5, 6).
Формулы для расчета относительной плотности газа В по воздуху имеют такой вид:
Это интересно. Самый легкий среди газов — водород 
Решение задач. Покажем, как решают задачи с использованием изложенного в параграфе материала.
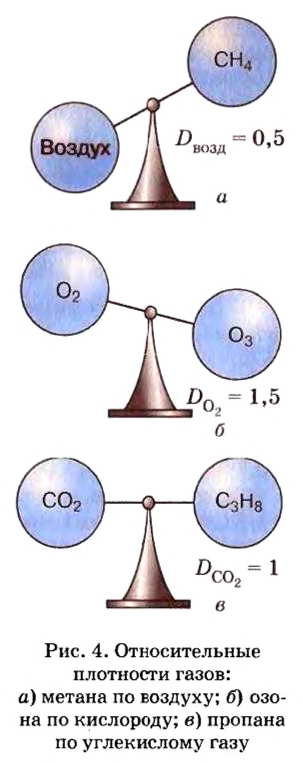
ЗАДАЧА 1. Рассчитать относительную плотность углекислого газа по водороду и по воздуху.
Решение
Находим относительную плотность углекислого газа по водороду и по воздуху.
Ответ:
В соответствии с полученным результатом углекислый газ в 1,52 раза тяжелее воздуха. Очевидно, что воздух во столько же раз легче углекислого газа.
Если для неизвестного газа В определена его относительная плотность по газу А, то можно вычислить молярную или относительную молекулярную массы газа В по формулам, которые являются производными от приведенных выше:
ЗАДАЧА 2. Относительная плотность газа X (соединение Сульфура) по водороду равна 17. Вычислить молярную массу газа Х и найти формулу соединения.
Решение
1. Вычисляем молярную массу газа X по одной из формул, приведенных в параграфе:
2. Находим формулу соединения. Поскольку 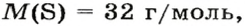
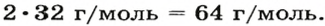
Очевидно, что этим элементом является Гидроген; его атомов в молекуле соединения — два. Формула соединения —
Ответ: 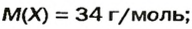
ВЫВОДЫ
Относительная плотность газа по другому газу — это отношение массы определенного объема газа к массе такого же объема другого газа (при одинаковых температуре и давлении). Значение относительной плотности газа показывает, во сколько раз он тяжелее другого газа.
В качестве газа сравнения часто служит воздух. Он ведет себя как газ с относительной молекулярной массой 29.
По относительной плотности газа можно вычислить его молярную массу.
О средней относительной молекулярной массе воздуха.
Почему средняя относительная молекулярная масса воздуха равна 29, а не 30 — среднему арифметическому относительных молекулярных масс кислорода (32) и азота (28)? Потому что в воз духе содержится неодинаковое количество этих газов: кислорода — 21% по объему, азота — 78%.
Вычислим среднюю молярную массу воздуха (она численно равна средней относительной молекулярной массе).
Предположим, что воздух состоит только из кислорода и азота. Тогда средняя молярная масса воздуха будет равна массе 1 моль смеси газов
Количества вещества газов пропорциональны их объемам или объемным долям
Взяв приближенные значения объемных долей газов 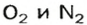
Найдем массу 1 моль воздуха, т. е. 1 моль смеси газов
Таким образом,
Количество вещества
После повторения изученных начальных химических понятий для вас начинается новый этап познания химии. Это — количественные отношения веществ в химических реакциях, связь химических знаний с математическими.
Вы уже знаете, что существуют вещества молекулярного и немолекулярного строения, а их составными частицами могут быть атомы, молекулы, ионы. Абсолютные размеры этих структурных частиц очень малы, тогда как их количественные соотношения в химических уравнениях выражаются небольшими целыми числами, которые равны коэффициентам.
Рассмотрим взаимодействие вещества немолекулярного строения — углерода с веществом молекулярного строения — кислородом:
Как видно из уравнения реакции, 1 атом простого вещества углерода взаимодействует с 1 молекулой простого вещества кислорода и образуется 1 молекула сложного вещества оксида углерода(1У), или углекислого газа. Но для проведения этой реакции никогда не считают атомы углерода и молекулы кислорода, а оперируют такими величинами, как масса углерода и масса или обт/ем кислорода. Как в таких случаях не ошибиться и взять столько каждого из веществ, чтобы их было достаточно для проведения реакции и получения продукта реакции необходимой массы или объема?
Вам известны такие физические величины — время, масса, длина, объем, плотность, температура. С ними в повседневной жизни приходится довольно часто сталкиваться. Однако это не весь перечень характеристик, по которым сравнивают и отличают тела, вещества, явления.
Порция воды объемом 18 мл (приблизительно одна столовая ложка) при комнатной температуре имеет массу 18 г, поскольку плотность воды составляет 1 г/мл. Это привычные для вас числа. А вот приходилось ли вам иметь дело с таким удивительно огромным числом, как 602 000 000 000 000 000 000 000? Именно столько молекул содержится в порции воды объемом 18 мл! Согласитесь, не так уж и удобно отсчитывать число молекул воды (или число любых структурных частиц других веществ) в определенной ее порции, ведь счетчики атомов или молекул еще не сконструированы. Во избежание этих неудобств и была введена физическая величина количество вещества.
Количество вещества — это физическая величина, которая характеризуется числом структурных частиц вещества в определенной ее порции.
Количество вещества обозначают буквой греческого алфавита 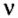
В каких случаях используют эту физическую величину? Прежде всего, когда нужно количественно охарактеризовать реагенты или продукты реакции.
Для каждой физической единицы существует эталон, сравнивая с которым проводят измерения, и способы или приборы для измерений. Вводя ту или иную физическую величину, сразу предлагают и единицы ее измерения. Например, для измерения массы введен кг и производные от него — мг, г, т; для измерения длины — м (мм, см, км). Так, вы можете легко измерить длину медной проволоки или определить массу пакета поваренной соли и не допустить при этом ошибки.
А с чем сравнивать порцию вещества, определяя количество вещества в ней? В каких единицах измеряют эту физическую величину? Существует ли ее эталон?
За единицу измерения количества вещества принят моль. Если единицы большинства физических величин введены в оборот давно, то единицу количества вещества моль ввели лишь в 1971 году. В переводе «моль» означает множественное число.
Моль — это количество вещества, которое содержит столько структурных частиц (атомов, молекул и т. п.) этого вещества, сколько атомов содержится в 12 г более легкой разновидности атома углерода.
Вспомните: изучая в 7 классе атомную единицу массы, вы узнали, что в природе преобладает более легкая разновидность атомов углерода, в ядрах которого есть по 6 протонов и нейтронов. В то же время более тяжелая разновидность углерода представлена атомами, ядра которых состоят из 6 протонов и 7 нейтронов, и в природе их мало.
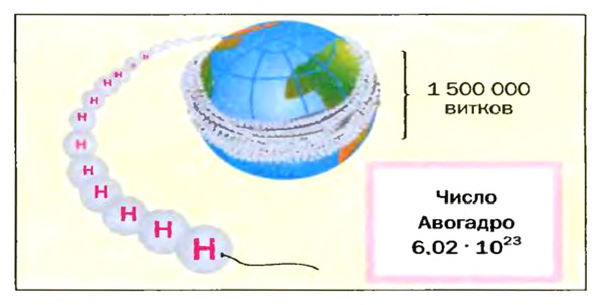
Из чего состоит 1 моль вещества. Как показали расчеты, 12 г более легкой разновидности атомов углерода содержат 602 204 500 000 000 000 000 000 атомов. С введением физической величины количество вещества было принято, что это число показывает, сколько структурных частиц вещества содержится в одном моле любого вещества. В честь итальянского ученого Амедео Авогадро его назвали числом Авогадро (обозначается 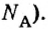
Это — универсальное число, которое указывает на количество структурных частиц в одном моле вещества, независимо от его агрегатного состояния. Число Авогадро 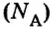
Единица измерения количества вещества моль обозначается так: 1 моль воды, 2 моль сахара, 5 моль углекислого газа и т. п. Обратите внимание, что окончание не изменяется, если слово «моль» пишется после цифры. Если же запись сделана без цифры, то окончание изменяется согласно падежу. Например: «Сколько молей кислорода выделится, если разложить 4 моль перманганата калия?»; «В одном моле воды содержится число Авогадро молекул».
Поупражняемся в применении числа Авогадро относительно конкретных структурных частиц разных веществ — атомов, молекул и др.
Пример 1. Графит 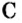
Пример 2. Вода 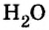
Пример 3. Хлорид натрия 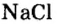
В 7 классе вы записывали химическую формулу поваренной соли, или хлорида натрия 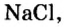
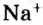
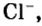
Относительно хлорида натрия число Авогадро означает число формульных единиц вещества в 1 моль этого вещества.
Формульная единица вещества — это совокупность его частиц, которая отображена химической формулой.
Для веществ, структурными частицами которых являются атомы, формульная единица вещества — атом. Для веществ, структурными частицами которых являются молекулы, формульная единица — молекула. А для веществ, структурными частицами которых являются ионы, формульная единица — совокупность ионов, которая отображена в химической формуле вещества. Например, в поваренной соли 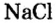
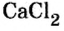
Поэтому правильно говорить, что в 1 моль хлорида натрия насчитывается 1 моль катионов 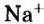
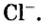
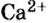
Вы уже умеете оперировать такими физическими величинами, как масса и объем веществ и тел. Умеете пользоваться и приборами для их измерения. Для измерения же количества вещества приборов не существует (рис. 1).
Как же тогда отмерить, например, порцию воды количеством вещества 2 моль? Чтобы получить ответ на этот вопрос, необходимо выяснить сущность понятия «молярная масса».
Итоги:
Амедео Авогадро (1776—1856 гг.) — итальянский химик и физик, первым стал систематически исследовать количественный и качественный состав веществ на основе соотношения объемов газообразных веществ, из которых они образованы. Ему принадлежат правильные записи формул: воды 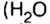
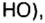
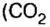
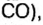
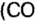
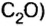
В 1811 г. Авогадро открыл закон, который до сих пор является общепризнанным: в одинаковых объемах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул. Закон носит имя своего первооткрывателя.
Ученый первым предсказал, что молекулы водорода, кислорода, азота двухатомны. В его честь число формульных единиц, которое содержится в 1 моль вещества, назвали числом Авогадро.
Один из минералов металлического элемента цезия (в периодической системе находится в ячейке под номером 55) — авогадрит также назван в честь ученого.
Молярная масса
Понятие молярная масса введено для определения соотношения количества вещества 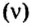
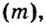
Молярная масса 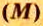
Молярную массу вычисляют по формуле:
То есть, молярная масса — это величина, которая характеризует конкретное вещество и измеряется в килограммах на моль (кг/моль) или в граммах на моль (г/моль). Следует отметить, что в химии преимущественно используют единицу г/моль.
Если взять порции различных веществ, массы которых численно равны их относительным молекулярным массам, например 12 г углерода (С), 18 г воды 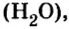
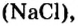
Таким образом, несмотря на разную относительную молекулярную массу веществ 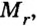
Масса одного моля любого вещества численно равна его относительной молекулярной массе и содержит число Авогадро структурных частиц (формульных единиц) вещества.
Для определения молярной массы вещества нет необходимости каждый раз делить массу порции вещества на количество вещества в ней. Достаточно вычислить ее относительную молекулярную массу и найденное число выразить в единицах молярной массы, то есть в г/моль.
Пример 1.
Таким образом, один моль углекислого газа — вещества молекулярного строения — имеет массу 44 г и содержит число Авогадро молекул.
Пример 2.
Таким образом, один моль оксида меди 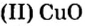
Зная массу порции любого вещества и количество вещества в ней, по формуле 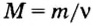
Пример 3. Вычислить молярную массу бинарного соединения серы с кислородом, если в порции массой 32 г количество вещества равно 0,5 моль.
Дано:
Решение:
Ответ: молярная масса соединения равна
Производные формулы 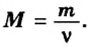
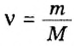
Пример 4. Определить количество вещества в порции оксида алюминия 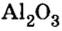
Дано:
Решение:
Ответ: количество вещества в порции оксида алюминия массой 20,4 г составляет 0,2 моль.
Формула 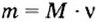
Пример 5. Определить массу порции оксида серы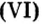
Дано:
Решение:
Ответ: масса порции оксида серы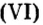
Как вычислить число структурных частиц вещества. Вам известно, что формулы многих веществ содержат индексы. Это дает возможность, характеризуя количественный состав вещества, отмечать число структурных частиц в формульной единице вещества. Число структурных частиц вещества в одном моле вещества принято помечать 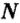
Пример 6. Вычислить, сколько атомов фосфора и сколько атомов кислорода содержится в одном моле оксида фосфора
Анализируя химическую формулу 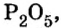
И снова имеем дело с большими числами. На уроках математики вы также будете выполнять действия с очень большими или очень малыми числами. Для удобства их записывают в стандартном виде, то есть в виде 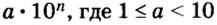
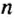
Такими числами удобно пользоваться для обозначения числа Авогадро. Вы легко убедитесь в том, что, умножив 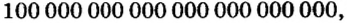
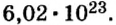
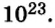
Итоги:
В примере мы ограничились найденным ответом 64 г/моль относительно молярной массы неизвестного вещества. Но вам, наверное, интересно знать, что это за бинарное соединение серы с кислородом? Для этого необходимо установить неизвестные индексы 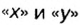
Рассуждаем так: если бы 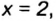
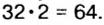
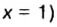
Ответ: формула бинарного соединения —
Молярный объем газов
Как известно, вещества могут находиться в твердом, жидком и газообразном агрегатных состояниях. Особенность газообразного состояния заключается в том, что между структурными частицами (молекулами) газов расстояния в тысячи раз большие, чем расстояния между структурными частицами жидкого, а тем более твердого вещества. Так, один моль воды при комнатной температуре и нормальном атмосферном давлении занимает объем 18 мл (приблизительно 1 столовая ложка). Объем 1 моль мелкокристаллического хлорида натрия втрое больше объема 1 моль воды, а объем 1 моль сахара — больше почти в 20 раз (рис. 2). А для одного моля азота при тех же условиях необходим сосуд приблизительно в 1240 раз вместительнее, чем столовая ложка.
Следовательно, объем одного моля газообразного вещества азота существенно отличается от объема одного моля жидкого или твердого вещества, в то время как разница объемов одного моля жидкости воды и твердого вещества хлорида натрия или сахара незначительная.
Вычислим объем 1 моль азота и некоторых других газообразных веществ в литрах. Для этого воспользуемся такой физической характеристикой вещества, как плотность 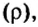
Поскольку давление и температура существенно влияют на объем газообразных веществ, принято проводить определения при температуре 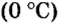
Температура 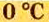
Нормальные условия сокращенно обозначаются их первыми буквами с точкой после каждой в круглых скобках — (н.у.).
Вычисление объема 1 моль азота начнем с нахождения его относительной молекулярной массы
Поскольку молярная масса численно равна относительной молекулярной, то
При нормальных условиях плотность азота 1,25 г/л.
Подставляем значение молярной массы 28 г/моль и плотности азота 1,25 г/л в формулу 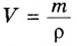
Итак, 1 моль азота при нормальных условиях занимает объем 22,4 л. Заметим, что при других условиях, он будет иметь и другие значения. Так, при 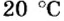
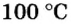
Вычислим молярный объем кислорода при нормальных условиях, если его плотность равна 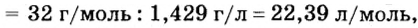
Если бы мы вычисляли молярный объем других газообразных веществ при нормальных условиях, то получили бы значения, близкие к 22,4 л.
Одной из величин, которая характеризует 1 моль любого газообразного вещества при нормальных условиях, является молярный объем газов
Следовательно, 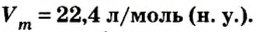
Подумайте и сделайте вывод — одинаковую ли массу они при этом имеют.
Вы, очевидно, обращали внимание на то, что определяющей физической величиной для жидкостей является объем, тогда как для твердых веществ — масса. Это потому, что твердые вещества сохраняют свою форму, а жидкие — нет, они приобретают форму сосуда, в котором содержатся. В этом отношении газы похожи на жидкости, поскольку собственной формы у них также нет.
Рассмотрим примеры вычислений с использованием молярного объема газов.
Пример 1. Вычислить объем азота количеством вещества 0,5 моль при нормальных условиях.
Решение
Воспользуемся формулой
Ответ: объем азота количеством вещества 0,5 моль составляет 11,2 л.
Пример 2. Какому количеству вещества оксида углерода 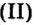
Решение
Воспользуемся формулой
Ответ: количество вещества оксида углерода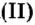
Итоги:
Теперь вы знаете, что количество вещества 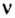
Приравняем их правые части:
Отсюда можно определить массу порции вещества и ее объем, а также молярную массу вещества:
Все три формулы широко применяются в химической практике. Например, если в формулу 1 подставить значение объема известного вещества, то сразу вычислим массу порции этого вещества. Если же в формулу 2 подставить значение массы порции известного вещества, то вычислим объем ее порции. Молярную массу неизвестного вещества можно вычислить с помощью одного действия по формуле 3. Для этого нужно знать массу и объем порции вещества.
Относительная плотность газов
При изучении веществ и явлений не обойтись без сравнений. Их проводят по разным характеристикам — массе, плотности, размерам, зарядам структурных частиц, физическим или химическим свойствам веществ и т. п.
Для газообразных веществ сравнения часто проводят по относительной плотности газов (обозначается буквой латинского алфавита 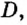
Относительная плотность одного газа по другому газу 
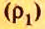
Поскольку плотность — это масса одного объема вещества, а молярный объем всех газов при нормальных условиях одинаков и составляет 22,4 л, делаем вывод, что плотности газов относятся между собой, как и их молярные массы. Вам известно, что молярные массы численно равны относительным молекулярным массам веществ. Отсюда относительная плотность газов может быть вычислена по формуле:
где 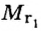
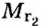
Внизу справа после буквы 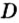
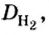
Из формулы для вычисления относительной плотности одного газа по другому следует, что необходимо знать относительные молекулярные массы обоих газообразных веществ. Как и относительная молекулярная масса, относительная плотность газа — величина безразмерная, потому что показывает, во сколько раз один газ легче или тяжелее другого.
Относительную плотность газов можно вычислить по любому газу — водороду, кислороду, углекислому газу и др., а также по газообразным смесям (рис. 4). Чаще всего ее вычисляют по водороду и воздуху. Если говорят о газообразных смесях веществ, то речь идет о средней относительной молекулярной массе смеси, определенной при нормальных условиях в объеме 22,4 л. Так, средняя относительная молекулярная масса воздуха равна 29.
Рассмотрим на примерах, как вычисляется относительная плотность газов и как, воспользовавшись формулой для ее вычисления, находят относительную молекулярную и молярную массы газообразного вещества.
Пример 1. Вычислить относительную плотность кислорода по водороду.
Решение
Ответ: 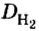
Вычисляя относительную плотность газа по водороду, в знаменателе всегда записывают число 2 (относительная молекулярная масса водорода). Отсюда формулу для вычисления относительной плотности газов по водороду можем подать в таком виде:
На практике часто необходимо определить относительную плотность газа по воздуху. Вспомните: в 7 классе вы выясняли, как необходимо располагать сосуд для собирания газообразного вещества, чтобы наполнить его газом способом вытеснения воздуха.
Поскольку относительная молекулярная масса воздуха составляет 29, то относительную плотность по воздуху вычисляют по формуле:
Пример 2. Вычислить относительную плотность кислорода по воздуху.
Решение
Ответ: относительная плотность кислорода по воздуху равна 1,1.
Таким образом, кислород несколько тяжелее воздуха и потому, чтобы собрать его способом вытеснения воздуха, сосуд располагают книзу дном.
Пример 3. Вычислить относительную плотность водорода по воздуху.
Решение
Ответ: относительная плотность водорода по воздуху равна 0,07.
В рассмотренных примерах кислород тяжелее водорода и воздуха, а водород легче воздуха. Эти и другие примеры доказывают, что если относительная плотность газа больше единицы, то газ тяжелее того газа, с которым его сравнивают. И наоборот, если полученная величина меньше единицы, то газ легче того газа, с которым его сравнивают.
Производными относительной плотности газов являются такие формулы:
Пример 4. Бинарное соединение азота с водородом имеет относительную плотность по водороду 8,5. Установить химическую формулу вещества, если массовая доля азота в ней равна 82 % .
Дано:
Решение
Поскольку относительная атомная масса азота 14, то
Ответ: формула соединения
Итоги:
- Относительная плотность газов — это безразмерная величина, которая показывает, во сколько раз один газ тяжелее или легче другого.
- Для вычисления относительной плотности газа относительную молекулярную или молярную массу одного газа делят на относительную молекулярную или молярную массу другого газа.
- Выбирают способ сбора газов вытеснением воздуха по результатам вычисления относительной плотности газов по воздуху: если она больше единицы, то сосуд для наполнения газом держат книзу дном, а если меньше — вверх дном.
Перенасыщение углекислым газом опасно для организма человека и животного. Установлено, что когда содержание углекислого газа в воздухе превышает 10 %, наступает потеря сознания и даже смерть.
В Италии есть пещера, названная «Собачьей». В нее не рекомендуют заходить с собаками, потому что она почти вполовину человеческого роста заполнена углекислым газом. Если вы определите относительную плотность углекислого газа по воздуху, то поймете, почему человек может находиться в этой пещере определенное время, тогда как собака вскоре начинает задыхаться и может даже погибнуть.
Расчеты по химическим формулам
Изучая химию, вы, наверное, обратили внимание, насколько важная для характеристики вещества информация содержится в его химической формуле. Обобщая эти знания, можно сделать вывод, что химическая формула содержит сведения о молекуле или другой формульной единице вещества, а также о количестве вещества.
Химическая формула информирует о:
- качественном составе вещества (какие элементы его образуют);
- количественном составе вещества (сколько атомов каждого элемента входит в состав его формульной единицы массы);
- принадлежности вещества к простым или сложным.
- Пользуясь химической формулой, можно осуществлять расчеты:
- относительной молекулярной массы вещества;
- молярной массы вещества;
- отношения масс элементов в веществе;
- массовой части элемента в веществе;
- числа структурных частиц вещества в определенной его порции;
- молярной массы, количества и объема вещества;
- относительной плотности газов.
Частью этих расчетов вы уже овладели, ознакомимся с другими расчетами.
Расчеты отношения масс элементов в веществе. Химическая формула, как вам известно, состоит из символов химических элементов и индексов. Индексы являются теми числами, которые передают количественный состав вещества. Это дает возможность по химической формуле вычислять соотношение масс элементов. Рассмотрим такие расчеты на примере.
Пример 1. Вычислить соотношение масс элементов в оксиде фосфора
Решение
Составляем формулу соединения по валентности фосфора: 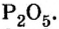
Ответ: отношение масс элементов фосфора и кислорода в оксиде фосфора 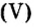
В 7 классе вам демонстрировали горение фосфора в кислороде. Теперь вы знаете, что эти два вещества реагируют полностью, без остатка, если их взять в отношении масс 

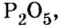
Пример 2. Какие вещества образуются в закрытом сосуде после сжигания в нем фосфора массой 93 г в кислороде массой 160 г?
Не будем строить прогнозы, а проведем четкие математические расчеты. Сначала вычислим, сколько кислорода необходимо, чтобы прореагировал весь фосфор. Для этого составим уравнение, в левой части которого запишем отношение масс элементов фосфора и кислорода по формуле, а в правой — по условию задачи, обозначив массу кислорода
Расчеты показали, что для полного взаимодействия порции фосфора массой 93 г достаточно 120 г кислорода. Его же было 160 г. Следовательно, после прекращения реакции в сосуде еще остается: 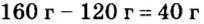
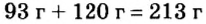
Ответ: после сжигания в сосуде будет 213 г оксида фосфоpa
Итоги:
- Химическая формула вещества отображает ее качественный и количественный состав и дает возможность вычислять количество вещества, относительную молекулярную массу, молярную массу, объем и массу порции вещества, число структурных частиц вещества в определенной его порции.
- По химической формуле вычисляют также массовые доли элементов и отношения масс элементов в веществе.
Химики часто устанавливают не только отношения масс элементов по химической формуле вещества, но и отношения количества вещества реагентов и продуктов реакции. Так, если нужно установить массу или объем продуктов реакции, лучше воспользоваться физической величиной количество вещества. Это потому, что коэффициенты (если их правильно расставить) показывают, сколько молей одного вещества реагирует, а другого — образуется. Из уравнения реакции окисления магния
следует, что 2 моль магния вступают в реакцию соединения с 1 моль кислорода и образуют 2 моль оксида магния.
Для этой реакции отношение количества вещества реагентов и продуктов реакции является таким:
Это значит, что, взяв определенное количество вещества магния, мы получим столько же молей оксида магния , тогда как израсходованное количество вещества кислорода будет вдвое меньшим.
Это учитывают на химических заводах по производству различных веществ и всегда проводят необходимые вычисления.
Вычисления с использованием числа Авогадро
К вычислениям по химическим формулам относятся также определение числа структурных частиц в данном количестве вещества, установление молярной массы вещества, массы или объема определенной порции вещества, по известному числу структурных частиц, из которых оно образовано. Рассмотрим конкретные примеры таких вычислений.
Определение числа атомов (молекул) в данном количестве вещества.
Пример 1. Определить число молекул в порции сульфида водорода 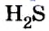
Дано:
Решение
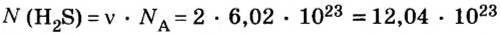
Ответ: в порции сульфида водорода количеством вещества 2 моль содержится 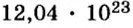
Усложним условие предыдущей задачи.
Пример 2. Определить число молекул в порции сульфида водорода 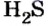
Дано:
Решение
1. Для определения числа молекул необходимо знать количество вещества. Поэтому из формулы 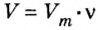
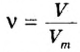
2. Определяем число молекул в порции сульфида водорода количеством вещества 0,5 моль:
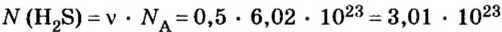
Ответ: в порции сульфида водорода 

Пример 3. Определить, где больше молекул — в порции углекислого газа массой 88 г или в порции газа пропана 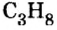
Дано:
Решение
1. Вычислим относительные молекулярные и молярные массы углекислого газа и пропана:
2. Вычислим количество вещества в порции углекислого газа массой 88 г:
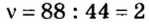
3. Вычислим количество вещества в порции пропана массой 88 г:
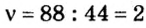
Количество вещества в обеих порциях одинаково, следовательно, число молекул также одинаково.
Ответ: число молекул в порциях углекислого газа и пропана массой 88 г каждая одинаковое.
Пример 4 Вычислить молярную массу соединения серы с кислородом и найти его формулу, если масса 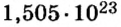
Дано:
Решение
Для вычисления молярной массы соединения нужно знать его химическую формулу. Если же химическая формула неизвестна, можно прибегнуть к вычислениям молярной массы вещества по таким формулам:
1. По формуле 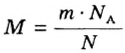
2. По массовой доле серы находим, сколько атомов этого элемента обозначено в формуле буквой
отсюда
3. Находим, сколько атомов кислорода обозначено в формуле буквой
Ответ: молярная масса соединения серы с кислородом равна 64 г/моль, а ее формула —
Итоги:
Используя число Авогадро, определяют числа структурных частиц вещества в данной его порции, устанавливают молекулярную формулу вещества.
Вычисления с применением числа Авогадро проводят по формулам:
Физическую величину количество вещества можно применить не только к индивидуальным веществам, но и к их смесям. Это дает возможность проводить расчеты по более сложным химическим формулам, чем те, которые были приведены в параграфе. В частности, можно вычислять содержимое компонентов в составе газообразной смеси, а также массовые и объемные части газов в смеси.
Пример. Вычислить массовые и объемные доли газов в смеси оксида углерода 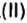
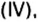
Объемная доля компонента 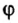
Объемную долю вычисляют в процентах или в долях от единицы.
Дано:
Решая эту задачу, важно помнить, что физическую величину количество вещества 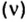
Решение
Вычислим молярную массу смеси по формуле:
Обозначим содержимое оксида углерода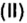
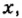
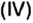
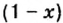
Данными сведениями заполним таблицу:
Составим алгебраическое уравнение и решим его:
Вычислим массу каждого компонента смеси:
Вычислим массовые доли компонентов смеси:
Находим объемные доли компонентов смеси. Поскольку в молярном объеме смеси объемные доли каждого компонента равны его количеству вещества, то:
Ответ: массовые и объемные доли газов в смеси составляют:
- Органические соединения
- Теория химического строения органических соединений А. М. Бутлерова
- Насыщенные углеводороды
- Ненасыщенные углеводороды
- Неметаллы в химии
- Галогены в химии
- Подгруппа кислорода
- Подгруппа азота
Моль — условное количество вещества
Добавлено: 3 октября 2021 в 12:58

Химия — наука, изучающая взаимодействие веществ на атомном и молекулярном уровнях. Эти процессы значительно отличаются от привычного нам макроуровня и поэтому требуют специфических подходов, в том числе к «подсчету» и «взвешиванию».
Школьный курс химии включает понятия «моль» и «молярной массы». Они кажутся сложными, но если разобраться, то вы без труда поймете сущность этих понятий и научитесь ими пользоваться при решении задач.
Моль
Понятие «моль» попытаемся разобрать и, самое главное, понять на примере всем знакомой реакции взаимодействия кислорода и водорода. Когда одна молекула O2 соединяется с двумя молекулами H2, получается две молекулы H2O:
- O2 + 2H2 = 2H2O
То есть, чтобы максимально полно провести химическую реакцию, мы должны взять на каждую молекулу кислорода две молекулы водорода. Итак, у нас есть 100 г кислорода.
Сколько понадобится водорода для протекания процесса? И тут возникает первый вопрос: сколько молекул в 100 г кислорода? Наверное, миллиарды или даже миллиарды миллиардов? И сколько их в 100 г водорода? Уж точно в не в 2 раза меньше.
Как вообще подсчитать молекулы, ведь они бывают совершенно разными, «тяжелыми» и «легкими». Этими вопросами задавались и люди, закладывавшие основу современной химической науки.
Был найден простой выход, который помогает легко и изящно решить проблему. Химики решили взять за единицу измерения не одну молекулу, а определенное их количество, причем очень большое. Таким образом эта единица измерения приводит микроуровень к макроуровню. Она называется «моль».
Моль — это количество вещества из 6,02214076⋅1023 атомов или молекул. Оно не имеет физического смысла и изначально было привязано к массе определенного количества (12 граммов) углерода-12, но позже переопределено, как и многие другие единицы системы СИ.
В школьных расчетах количество структурных единиц в моле, которое также называется постоянной Авогадро, обычно округляют до 6,022⋅1023 и обозначают NA.
С этой величиной связано другое химическое понятие — «количество вещества», то есть количество структурных единиц в определенной его порции. Оно обозначается буквой ν (ню).
Примеры
В стакане содержится 2 моль воды. Сколько молекул воды находится в стакане?
- N = ν⋅ NA =2 ⋅ 6,022⋅1023 = 12,044⋅1023 молекул воды.
Также можно решить обратную задачу. Сколько молей вещества составляют 24,088⋅1023 молекул воды?
- ν⋅ = N / NA = 24,088⋅1023 / 6,022⋅1023 = 4 моля.
Что называется молярной массой
Итак, мы поняли, что моль — условное количество вещества, выбранное для удобства химиков. Это даже не миллиарды миллиардов, как мы предположили ранее, а миллиарды триллионов, что никак не облегчает задачу подсчета этих структурных единиц.
Как же все-таки узнать, сколько атомов или молекул в 100 граммах того или иного вещества? Теперь хорошо бы связать количество вещества и его массу, ведь это не одно и то же. Нам поможет «молярная масса» — 1 моль вещества или 6,022⋅1023 структурных единиц этого вещества.
Итак, масса вещества равна массе порции вещества m к количеству молекул ν в его порции:
- М = m / ν.
Вооружившись этим знанием, мы можем переводить граммы в число молекул и наоборот. При этом следует учесть, что молярная масса численно идентична молекулярной массе (то есть массе молекулы), выраженной в атомных единицах массы, и относительной молекулярной массе.
Пример
Найдем массу 5 моль воды.
Чтобы решить эту задачу, обратимся к формуле молярной массы и выразим из нее массу:
- m = М ⋅ ν
В этой формуле мы знаем количество вещества ν = 5 моль, а молярную массу сложной молекулы нужно определить, как сумму молярных масс составляющих ее химических элементов:
- M (H2O) = 2 ⋅M (H) + M (O)
Где взять молярные массы кислорода и водорода (в соединение входит два атома водорода, поэтому его молярную массу умножаем на 2)?
Для этого нам понадобится таблица Менделеева и значение «относительной атомной массы», которая, как мы уже знаем, идентична молекулярной. Это значение приведено для каждого химического элемента и для водорода равно 1,00797 (то есть близко к 1), для углерода — близко к 6, для кислорода — около 16.
Подставим соответствующие значения в исходную формулу и получим:
- M (H2O) = 2 ⋅M (H) + M (O) = 2 ⋅ 1 + 16 = 18 г/моль.
То есть вес 1 моль воды составляет 18 граммов. Теперь можем подсчитать массу 5 моль воды:
- m = М ⋅ ν = 18 ⋅ 5 = 90 г.
Аналогичным образом мы можем подсчитать количество вещества, которое содержится в определенном образце заданной массы. Для примера возьмем оксид алюминия Al2O3 и узнаем, сколько моль в 400 граммах этого вещества. Для этого выразим количество вещества через молярную массу и подставим исходные данные:
- ν = m / М = 400 / (2 ⋅ М (Al) + 3 ⋅ (O)) = 400 / (2 ⋅ 75 + 3 ⋅ 16) = 400 / (150 + 48) = 400 / 198 ≈ 2,02 моль.
Занимайтесь на курсах ЕГЭ и ОГЭ в паре TwoStu и получите максимум баллов на экзамене:

Эксперт по подготовке к ЕГЭ, ОГЭ и ВПР
Задать вопрос
Закончил Московский физико-технический институт (Физтех) по специальности прикладная физика и математика. Магистр физико-математических наук. Преподавательский стаж более 13 лет. Соучредитель курсов ЕГЭ и ОГЭ в паре TwoStu.
Читайте также:
Как найти количество моль
В химических процессах участвуют мельчайшие частицы вещества – атомы, молекулы, ионы, электроны. Число таких частиц даже в очень малом количестве исследуемого образца чрезвычайно велико. Для того чтобы избежать математических расчетов с огромными числами, была введена специальная единица – моль.

Вам понадобится
- – таблица Менделеева.
Инструкция
Моль – это количество вещества, содержащее в себе определенное число частиц (атомов, ионов, молекул), равное постоянной Авогадро. Na = 6,02 Х 10 в 23 степени. Сама же постоянная Авогадро определяется, как количество атомов, содержащееся в двенадцати граммах углерода.
Исходя из этого, можно рассчитать, какое количество молей содержится в веществе, если вам известно количество атомов или молекул в нем. Данное значение необходимо разделить на число Авогадро. К примеру, если в исследуемом образце имеется 12,04 х 10 в 23 степени молекул, то количество молей будет 2. Обозначается количество моль как n.
Молярная масса вещества (М) – это масса, которую имеет один моль этого вещества. Получить эти данные можно, пользуясь таблицей Менделеева. Для этого необходимо сложить молярные массы каждого элемента, учитывая при этом имеющиеся коэффициенты. К примеру, для метана CH4 молярная масса М будет равна 12 + 4 х 1 = 16. Измеряется данная величина в грамма, деленных на моль.
Для того чтобы рассчитать моль, необходимо помимо молярной массы знать и массу исследуемого образца. Дальнейшие расчеты ведутся по формуле n = m/M, где m – масса вещества.
Если вы знаете концентрацию и объем раствора, можно найти количество моль вещества, исходя из этих данных. Для этого вам необходимо перемножить объем и концентрацию. Формула выглядит следующим образом: n = c x V.
Если вы хотите высчитать количество молей, содержащихся в газе при нормальных условиях (давлении, равном 101 325 Па, и температуре 273 К), вам необходимо знать лишь объем газа. Формула в данном случае выглядит так: n = V/Vm. Vm – это молярный объем идеального газа, постоянная величина при нормальных условиях. Равен молярный объем 22,4 литра/моль. Также зачастую он измеряется в кубических дециметрах, деленных на моль.
Источники:
- 10 в 23 степени
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
В этой статье мы коснемся нескольких краеугольных понятий в химии, без которых совершенно невозможно
решение задач. Старайтесь понять смысл физических величин, чтобы усвоить эту тему.
Я постараюсь приводить как можно больше примеров по ходу этой статьи, в ходе изучения вы увидите множество примеров
по данной теме.

Относительная атомная масса – Ar
Представляет собой массу атома, выраженную в атомных единицах массы. Относительные атомные массы указаны в периодической
таблице Д.И. Менделеева. Так, один атом водорода имеет атомную массу = 1, кислород = 16, кальций = 40.
Относительная молекулярная масса – Mr
Относительная молекулярная масса складывается из суммы относительных атомных масс всех атомов, входящих в состав вещества.
В качестве примера найдем относительные молекулярные массы кислорода, воды, перманганата калия и медного купороса:
Mr (O2) = (2 × Ar(O)) = 2 × 16 = 32
Mr (H2O) = (2 × Ar(H)) + Ar(O) = (2 × 1) + 16 = 18
Mr (KMnO4) = Ar(K) + Ar(Mn) + (4 × Ar(O)) = 39 + 55 + (4 * 16) = 158
Mr (CuSO4*5H2O) = Ar(Cu) + Ar(S) + (4 × Ar(O)) + (5 × ((Ar(H) × 2) +
Ar(O))) = 64 + 32 + (4 × 16) + (5 × ((1 × 2) + 16)) = 160 + 5 * 18 = 250
Моль и число Авогадро
Моль – единица количества вещества (в системе единиц СИ), определяемая как количество вещества, содержащее столько же структурных единиц
этого вещества (молекул, атомов, ионов) сколько содержится в 12 г изотопа 12C, т.е. 6 × 1023.
Число Авогадро (постоянная Авогадро, NA) – число частиц (молекул, атомов, ионов) содержащихся в одном моле любого вещества.

Больше всего мне хотелось бы, чтобы вы поняли физический смысл изученных понятий. Моль – международная единица количества вещества, которая
показывает, сколько атомов, молекул или ионов содержится в определенной массе или конкретном объеме вещества. Один моль любого вещества
содержит 6.02 × 1023 атомов/молекул/ионов – вот самое важное, что сейчас нужно понять.
Иногда в задачах бывает дано число Авогадро, и от вас требуется найти, какое вам дали количество вещества (моль). Количество вещества в химии
обозначается N, ν (по греч. читается “ню”).
Рассчитаем по формуле: ν = N/NA количество вещества 3.01 × 1023 молекул воды и 12.04 × 1023 атомов углерода.

Мы нашли количества вещества (моль) воды и углерода. Сейчас это может показаться очень абстрактным, но, иногда не зная, как найти
количество вещества, используя число Авогадро, решение задачи по химии становится невозможным.
Молярная масса – M
Молярная масса – масса одного моля вещества, выражается в “г/моль” (грамм/моль). Численно совпадает с изученной нами ранее
относительной молекулярной массой.
Рассчитаем молярные массы CaCO3, HCl и N2
M (CaCO3) = Ar(Ca) + Ar(C) + (3 × Ar(O)) = 40 + 12 + (3 × 16) = 100 г/моль
M (HCl) = Ar(H) + Ar(Cl) = 1 + 35.5 = 36.5 г/моль
M (N2) = Ar(N) × 2 = 14 × 2 = 28 г/моль
Полученные знания не должны быть отрывочны, из них следует создать цельную систему. Обратите внимание: только что мы рассчитали
молярные массы – массы одного моля вещества. Вспомните про число Авогадро.
Получается, что, несмотря на одинаковое число молекул в 1 моле (1 моль любого вещества содержит 6.02 × 1023 молекул),
молекулярные массы отличаются. Так, 6.02 × 1023 молекул N2 весят 28 грамм, а такое же количество молекул
HCl – 36.5 грамм.
Это связано с тем, что, хоть количество молекул одинаково – 6.02 × 1023, в их состав входят разные атомы, поэтому и
массы получаются разные.

Часто в задачах бывает дана масса, а от вас требуется рассчитать количество вещества, чтобы перейти к другому веществу в реакции.
Сейчас мы определим количество вещества (моль) 70 грамм N2, 50 грамм CaCO3, 109.5 грамм HCl. Их молярные
массы были найдены нам уже чуть раньше, что ускорит ход решения.

ν (CaCO3) = m(CaCO3) : M(CaCO3) = 50 г. : 100 г/моль = 0.5 моль
ν (HCl) = m(HCl) : M(HCl) = 109.5 г. : 36.5 г/моль = 3 моль
Иногда в задачах может быть дано число молекул, а вам требуется рассчитать массу, которую они занимают. Здесь нужно использовать
количество вещества (моль) как посредника, который поможет решить поставленную задачу.
Предположим нам дали 15.05 × 1023 молекул азота, 3.01 × 1023 молекул CaCO3 и 18.06 × 1023 молекул
HCl. Требуется найти массу, которую составляет указанное число молекул. Мы несколько изменим известную формулу, которая поможет нам связать
моль и число Авогадро.

Теперь вы всесторонне посвящены в тему. Надеюсь, что вы поняли, как связаны молярная масса, число Авогадро и количество вещества.
Практика – лучший учитель. Найдите самостоятельно подобные значения для оставшихся CaCO3 и HCl.
Молярный объем
Молярный объем – объем, занимаемый одним молем вещества. Примерно одинаков для всех газов при стандартной температуре
и давлении составляет 22.4 л/моль. Он обозначается как – VM.
Подключим к нашей системе еще одно понятие. Предлагаю найти количество вещества, количество молекул и массу газа объемом
33.6 литра. Поскольку показательно молярного объема при н.у. – константа (22.4 л/моль), то совершенно неважно, какой газ мы
возьмем: хлор, азот или сероводород.
Запомните, что 1 моль любого газа занимает объем 22.4 литра. Итак, приступим к решению задачи. Поскольку какой-то газ
все же надо выбрать, выберем хлор – Cl2.


Моль (количество вещества) – самое гибкое из всех понятий в химии. Количество вещества позволяет вам перейти и к
числу Авогадро, и к массе, и к объему. Если вы усвоили это, то главная задача данной статьи – выполнена 🙂

Относительная плотность и газы – D
Относительной плотностью газа называют отношение молярных масс (плотностей) двух газов. Она показывает, во сколько раз одно вещество
легче/тяжелее другого. D = M (1 вещества) / M (2 вещества).
В задачах бывает дано неизвестное вещество, однако известна его плотность по водороду, азоту, кислороду или
воздуху. Для того чтобы найти молярную массу вещества, следует умножить значение плотности на молярную массу
газа, по которому дана плотность.
Запомните, что молярная масса воздуха = 29 г/моль. Лучше объяснить, что такое плотность и с чем ее едят на примере.
Нам нужно найти молярную массу неизвестного вещества, плотность которого по воздуху 2.5

Предлагаю самостоятельно решить следующую задачку (ниже вы найдете решение): “Плотность неизвестного вещества по
кислороду 3.5, найдите молярную массу неизвестного вещества”

Относительная плотность и водный раствор – ρ
Пишу об этом из-за исключительной важности в решении
сложных задач, высокого уровня, где особенно часто упоминается плотность. Обозначается греческой буквой ρ.
Плотность является отражением зависимости массы от вещества, равна отношению массы вещества к единице его объема. Единицы
измерения плотности: г/мл, г/см3, кг/м3 и т.д.
Для примера решим задачку. Объем серной кислоты составляет 200 мл, плотность 1.34 г/мл. Найдите массу раствора. Чтобы не
запутаться в единицах измерения поступайте с ними как с самыми обычными числами: сокращайте при делении и умножении – так
вы точно не запутаетесь.

Иногда перед вами может стоять обратная задача, когда известна масса раствора, плотность и вы должны найти объем. Опять-таки,
если вы будете следовать моему правилу и относится к обозначенным условным единицам “как к числам”, то не запутаетесь.
В ходе ваших действий “грамм” и “грамм” должны сократиться, а значит, в таком случае мы будем делить массу на плотность. В противном случае
вы бы получили граммы в квадрате 🙂
К примеру, даны масса раствора HCl – 150 грамм и плотность 1.76 г/мл. Нужно найти объем раствора.

Массовая доля – ω
Массовой долей называют отношение массы растворенного вещества к массе раствора. Важно заметить, что в понятие раствора входит
как растворитель, так и само растворенное вещество.
Массовая доля вычисляется по формуле ω (вещества) = m (вещества) / m (раствора). Полученное число будет показывать массовую долю
в долях от единицы, если хотите получить в процентах – его нужно умножить на 100%. Продемонстрирую это на примере.

Решим несколько иную задачу и найдем массу чистой уксусной кислоты в широко известной уксусной эссенции.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
В сентябре, когда я начинаю работать с новыми учениками, всегда волнуюсь. Первые занятия – самые важные, поскольку происходит построение “призмы”, через которую я буду передавать знания и опыт, а ученик – воспринимать информацию и учиться работать с ней.
Я преподаю химию как точный предмет, в основе которого лежит строгая математическая логика. Я учу строить систему в любой поступающей информации, видеть главные узлы системы и связи между ними. Только так можно изучить такой сложный предмет, каким является химия. Ребята учатся грамотно учиться, затем свои знания и опыт работы они переносят в высшую школу, изучая более сложные медицинские предметы.
Не все проходит гладко. Накопление информации и опыта всегда индивидуально и связано с формированием сложной системы условных рефлексов. Но даже в самых тяжелых и запущенных случаях я не опускаю руки, использую современные технологии нейрофизиологии для ускорения процесса образования и повышения его качества.
Вспоминаю 2008 год. Это был последний год без ЕГЭ. Тяжелые задания на письменных вступительных экзаменах подразумевали серьезную подготовку, особенно по решению сложных задач. В тот год у меня были очень сильные ученики. Все как на подбор, быстро схватывали материал, набирались опыта и решали сложные задачи. И только Дима резко отставал от всех остальных. На занятиях он работал отлично, но как только покидал стены кабинета, весь изученный материал и накопленный опыт исчезали бесследно. На следующем занятии приходилось начинать все с начала. Так продолжалось несколько месяцев. Я понимала, что это не вина, а беда мальчика, а ключ к решению проблемы спрятан в индивидуальных особенностях физиологии высшей нервной деятельности. Пришлось обратиться за советом к своим бывшим ученикам, профессиональным нейрофизиологам. Как решилась проблема Димы и кем он стал теперь, я расскажу позже. А мы продолжим изучать химию. Тема сегодняшней статьи – количество вещества (моль).
Количество вещества (моль)
Количество вещества (моль) – важная расчетная величина в химии. Это именно тот золотой ключик, которым открывают любую, даже самую потайную дверь химической задачи. Термины “моль” и “молекула” – однокоренные, они произошли от латинского слова “moles”. В XVII в. появился термин “молекула” (“маленькая масса”). Понятие “моль” (“большая масса”, “порция”) появилось в начале XX века. Автор термина “моль” – немецкий химик и физик Вильгельм Оствальд.
Количество вещества определяется числом частиц, из которых состоит данное вещество (атомов, молекул, ионов), и обозначается греческой буквой “ню”. Для характеристики количества вещества в химии используют особую единицу измерения – моль.
Моль – это количество вещества, которое содержит столько структурных единиц (атомов, молекул, ионов), сколько атомов углерода содержится в 12 г изотопа углерода 12С. Экспериментально установлено, что один моль любого вещества содержит число Авогадро структурных единиц. В настоящее время известно более 60 независимых экспериментальных методов определения значения числа Авогадро.
Молярная масса – это масса 1 моля вещества, то есть отношение массы вещества к его количеству, выраженное в г/моль.
Абсолютная масса одной молекулы (атома) определяется делением молярной массы на число Авогадро
Итак, мы освоили первые математические формулы для химических расчетов. Попробуем закрепить наши знания и умение пользоваться этими формулами на решении простейших задач по химии.
Задача 1
Определите массу карбоната натрия и воды, которые содержатся в 0,8 моль кристаллической соды
Задача 2
Вычислите абсолютную массу одной молекулы углекислого газа в граммах
Задача 3
Образец вещества, массой 5,6 г содержит десятую часть числа Авогадро молекул. Определите молярную массу вещества
Задача 4
Эквимолярная смесь оксида фосфора (V) и диоксида кремния имеет массу 60,6 г. Определите массу оксида фосфора (V)
Вот мы и освоили первые, самые важные расчетные величины и поучились с ними работать. Но это еще не все. С количеством вещества можно вытворять такие замечательные трюки, которые вы даже представить не можете! Об этом скоро в следующих статьях.
А теперь о Диме и его проблеме с изучением химии. Тайна лежала в индивидуальных особенностях бета-тета активности головного мозга. Мои бывшие ученики, а теперь – ведущие нейрофизиологи МГУ работают с ритмами мозга. Они определили, что бета-тета ритмы мозга находится под влиянием гиппокампа, который играет ключевую роль в ускоренной переработке информации и активации долговременной памяти. Стимуляция бета-тета волновой активности способствует изучению иностранных языков, усвоению новых терминов, более быстрому и конструктивному получению фундаментальных знаний. Дима прошел курс БОС терапии по стимуляции мозговой активности в одной из лабораторий МГУ. Уже через месяц он не только достиг уровня своих товарищей, но и даже превзошел их. Как показали исследования, после трех часов решения задач по химии также происходил невероятный всплеск бета-тета волн, а через три месяца регулярных занятий формировался высокий уровень бета-тета потенциала! Дима блестяще сдал вступительные экзамены и в 2008 году поступил в РГМУ им. Н.И.Пирогова (РНИМУ им. Н.И. Пирогова). Сегодня Дима работает врачом-педиатром в одной из центральных клиник Москвы.
Вы готовитесь к ЕГЭ и хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии http://repetitor-him.ru. Здесь вы найдете огромное количество задач, заданий и теоретического материала, познакомитесь с моими учениками, многие из которых уже давно работают врачами. Звоните мне +7(903) 186-74-55. Приходите ко мне на курс, на Мастер-классы “Решение задач по химии” – и вы сдадите ЕГЭ с высочайшими баллами, и станете студентом престижного ВУЗа!
PS! Если вы не можете со мной связаться из-за большого количества звонков от моих читателей, пишите мне в личку ВКонтакте, или на Facebook. Я обязательно отвечу вам.
Репетитор по химии и биологии кбн В.Богунова