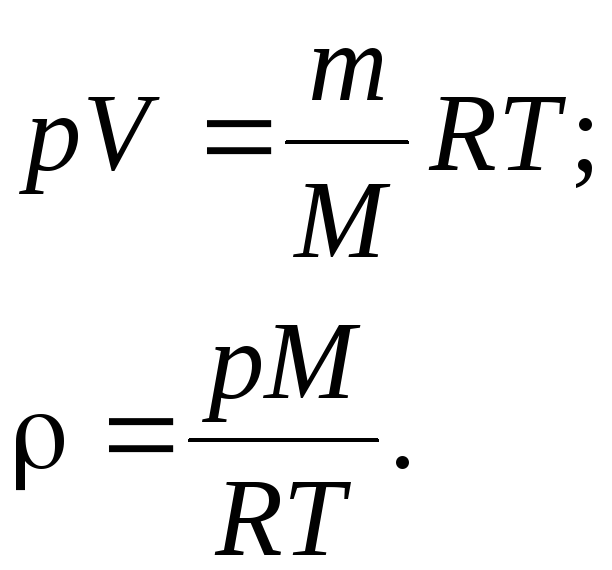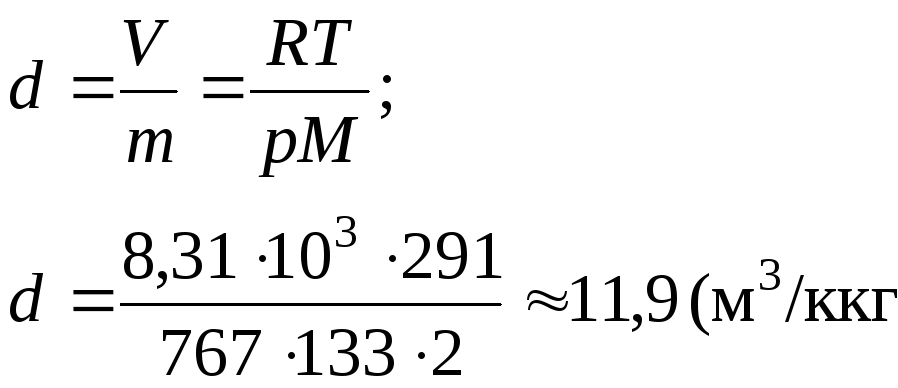Задача. Определите число молей идеального газа, находящегося в сосуде вместимостью см3 при нормальных условиях.
Дано:
см3
Найти:
— ?
Решение
Думаем: фраза «при нормальных условиях» говорит о ещё нескольких добавочных дано (нормальное давление — Па, нормальная температура —
К). При заданных условиях (давление, объём и температура), химическое количество вещества может быть найдено исходя из уравнения Менделеева-Клапейрона:
(1)
Решаем: выразим из (1) искомое химическое количество
(2)
Считаем: учитывая м
*кг*с
*К
*Моль
и переведя объём в единицы СИ
см
м
, получим
моль
Ответ: моль.
Ещё задачи на тему «Химическое количество вещества«.
Demon …
Знаток
(357),
закрыт
11 лет назад
Лучший ответ
Nighthawk
Высший разум
(118781)
11 лет назад
У меня два варианта. Либо в большинстве школ в восьмом классе учитель не может написать на доске формулу вычисления количества вещества:
n = m/M = V/Vm = N/Na
и объяснить, как делать перерасчет между массой, объемом и количеством частиц вещества, или ученики не в состоянии воспринять действия сложнее сложения.
_______________
Подставь в формулу и реши:
M(O2) = 32 г/моль
Na (число Авогадро) = 6.02*10^23
Остальные ответы
Похожие вопросы
Как найти количество молекул в молях
Молекула обладает настолько мизерными размерами, что количество молекул даже в крохотной крупинке или капле какого-либо вещества будет просто грандиозным. Оно не поддается измерению с помощью обычных методов исчисления.
Для определения, сколько молекул находится в том или ином количестве вещества, используется понятие «моль». Моль – это такое количество вещества, в котором находится 6,022*10^23 его молекул (или атомов, или ионов). Эта громадная величина носит название «постоянная Авогадро», она названа в честь знаменитого итальянского ученого. Величина обозначается NA. С помощью постоянной Авогадро можно очень легко определить, сколько молекул содержится в любом количестве молей любого вещества. Например, в 1,5 молях содержится 1,5*NA = 9,033*10^23 молекул. В тех случаях, когда требуется очень высокая точность измерения, необходимо использовать значение числа Авогадро с большим количеством знаков после запятой. Наиболее полная его величина составляет: 6,022 141 29(27)*10^23.
Определить, сколько молей содержится в каком-то количестве вещества, очень просто. Для этого нужно только иметь точную формулу вещества и таблицу Менделеева под рукой. Предположим, у вас есть 116 граммов обыкновенной поваренной соли. Вам нужно определить, сколько молей содержится в таком количестве (и, соответственно, сколько там молекул)?
Прежде всего вспомните химическую формулу поваренной соли. Она выглядит следующим образом: NaCl. Молекула этого вещества состоит из двух атомов (точнее, ионов): натрия и хлора. Какова ее молекулярная масса? Она складывается из атомных масс элементов. С помощью таблицы Менделеева вы знаете, что атомная масса натрия приблизительно равна 23, а атомная масса хлора – 35. Следовательно, молекулярная масса этого вещества составляет 23 + 35 = 58. Масса измеряется в атомных единицах массы, где за эталон принят самый легкий атом – водорода.
А зная молекулярную массу вещества, вы тут же сможете определить и ее молярную массу (то есть массу одного моля). Дело в том, что численно молекулярная и молярная масса полностью совпадают, у них только разные единицы измерения. Если молекулярная масса измеряется в атомных единицах, то молярная – в граммах. Следовательно, 1 моль поваренной соли весит приблизительно 58 граммов. А у вас, по условиям задачи, 116 граммов поваренной соли, то есть 116/58 = 2 моля. Умножив 2 на постоянную Авогадро, вы определите, что в 116 граммах хлорида натрия находится примерно 12,044*10^23 молекул, или примерно 1,2044*10^24.
Вода в сосуде занимает объем 10 см3 при температуре 4°C. Какое число молекул воды содержится в сосуде? Найти массу молекулы и оценить ее размер.
Оцените сложность задачи:
0 голосов, средняя сложность: 0.0000
Решения задачи
Данные задачи: Вода в сосуде
| Объем воды | V | $10^{-5}$ | м3 |
|---|---|---|---|
| Температура воды | t | 4 | °C |
| Число молекул | N | ? | |
| Масса молекулы | $m_{0}$ | ? | |
| Размер молекулы | d | ? |
Число молекул можно найти, если определить число молей воды в занимаемом ею объеме
$ N = N_{A}ν $
Зная химическую формулу воды
$ H_{2}O $
с помощью периодической системы элементов Д.И. Менделеева находим ее молярную массу
$ μ = (1×2+16)×10^{-3}=18×10^{-3}frac{кг}{моль} $
Число молей
$ ν = frac{m}{μ} $
Массу вещества находим
$ m = ρV $
$ρ – плотность воды$
узнаем из таблиц физических величин, ее значение заданное при определенной температуре
Откуда находим число молекул
$ N = N_{A}frac{ρV}{μ}=6,02×10^{23}frac{1000×10^{-5}}{18×10^{-3}}=3,34×10^{23} молекул $
Масса одной молекулы
$ m_{0} = frac{μ}{N_{A}}=frac{18×10^{-3}}{6,02×10^{23}}=2,99×10^{-26} кг $
Чтобы оценить размер молекулы d, сделаем допущение: молекулы плотно прилегают друг к другу и образуют кубическую ячейку. Тогда объем молекулы
$ V_{0} = d^{3} $,
а
$ d = sqrt{V_{0}} $
С другой стороны, объем занимаемый одной молекулой, можно найти зная объем воды и число молекул в этом объеме
$ V_{0} = frac{V}{N}=frac{μ}{ρN_{A}} $
И тогда находим
$ d = sqrt{frac{V}{N}}=sqrt{frac{10^{-5}}{3,34×10^{23}}}=sqrt{frac{μ}{ρN_{A}}}=3,11×10^{-10} м $
Ответ:
$ 3,34×10^{23} – число молекул; $
$ 2,99×10^{-26} кг – масса молекулы $
и
$ размер молекулы 3,11×10^{-10} м $
Чтобы предложить решение пожалуйста войдите или зарегистрируйтесь
Примеры решения задач
1. Молекулярно-кинетическая теория идеальных газов
Задача
1. Определить,
сколько киломолей и молекул водорода
содержится в объеме 50 м3
под давлением 767 мм рт. ст. при температуре
18°С. Какова плотность и удельный объем
газа?
|
Дано: V = 50 м3 Ρ = 767 Т = 291 К М = 2 |
Решение: На основании уравнения
|
|
ν N ρ d |
можно
определить
ν:
Число
молекул N,
содержащихся
в данном объеме, находим, используя
число Авогадро NА
(которое определяет какое количество
молекул содержится в одном киломоле).
Общее количество молекул, находящихся
в массе m
данного
газа, может быть установлено, так как
известно число молей ν.
Подставляя
в формулу число киломолей, устанавливаем
число молекул, содержащихся в объеме
V:
.
Плотность
газа ρ = m/V
определяем
из уравнения Менделеева – Клайперона:
Подставляя
числовые значения в единицах СИ в
формулу, определим плотность газа:
Удельный
объем газа d
определяем из уравнения Менделеева –
Клайперона:
(м3/кг).
Ответ:
11,9 м3/кг.
Задача
2. В сосуде
объемом 2 м3
находится смесь 4 кг гелия и 2 кг
водорода при температуре 27°С. Определить
давление и молярную массу смеси газов.
|
Дано: V = 2 м3 m1= 4 кг М1= 4·10-3 кг/кмоль m2= 2 кг М2= 2·10-3 кг/кмоль Т1= 300 К |
Решение:
Воспользуемся
где |
|
р М |
М1
– его молярная
масса; V
– объем
сосуда; Т
– температура газа;
R = 8,31 Дж/(моль·К)
–молярная газовая постоянная; р2
–
парциальное
давление водорода; m2
– масса
водорода; М2
– его молярная масса.
По
закону Дальтона:
(3)
Из
уравнений (1) и (2) выразим р1
и р2
и подставим
в уравнение (3):
(4)
С
другой стороны, уравнение Менделеева
– Клайперона для смеси газов имеет вид:
(5)
Сравнивая
(4) и (5) найдем молярную массу смеси газов
по формуле:
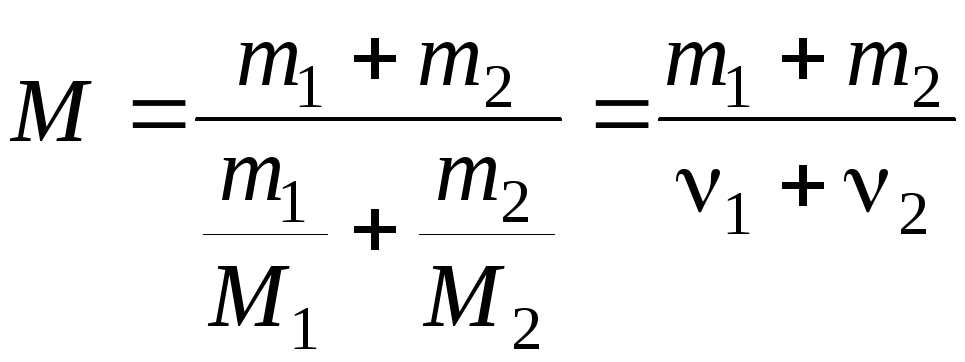
(6)
где
ν1
и ν2
– число молей гелия и водорода
соответственно.
(кг/моль).
Ответ:
3·10-3 кг/моль.
Задача
3. При каком
давлении средняя длина свободного
пробега молекул водорода <λ> = 2,5
см при температуре 68°С? Диаметр молекул
водорода принять равным d = 2,3·10
–10 м.
|
Дано: <λ>= 2,5·10-2 Т= 341 К d= 2,3·10-10 м NA = 6,02·1026 кмоль-1 |
Решение: Давление |
|
р |
Это
проводится следующим образом:
;
;
;
где
NA
– число
Авогадро и k
– постоянная Больцмана.
Следовательно,
Так как
,
имеем.
Число
молекул в 1 м3
выразим через среднюю длину свободного
пробега. Из формулы
,
находим
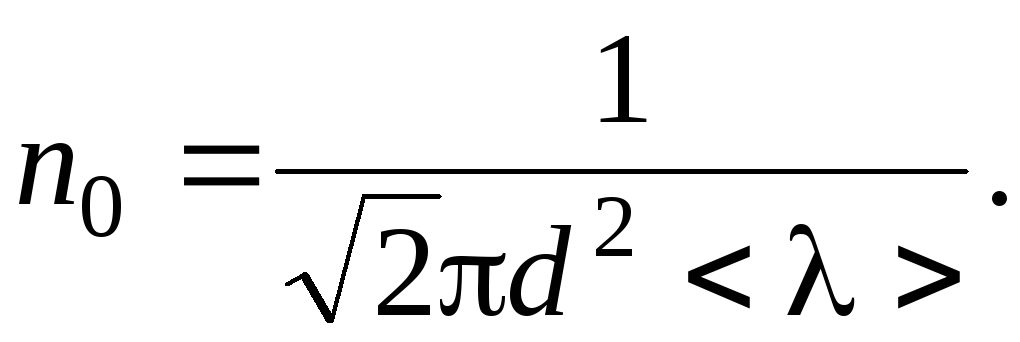
образом:
(Па).
Ответ:
0,8 Па.
Задача
4. Определить
плотность разреженного азота, если
средняя длина свободного пробега молекул
10 см. Какова концентрация молекул?
|
Дано: < λ > = 10 |
Решение: Средняя |
|
р n0 |
,
(1)
где
d
– эффективный
диаметр молекул (для азота d = 0,31·10
–9 м).
Концентрацию
молекул найдем из равенства:
, (2)
где
NA
– число
Авогадро; М = 28·10
–3 кг/моль
– молярная масса азота.
Решая
совместно уравнения (1) и (2), находим:
(кг/м3).
Ответ:
1,09·10-6 кг/м3.
Задача 5.
Вычислить
коэффициент внутреннего трения и
коэффициент диффузии кислорода,
находящегося при давлении 0,2 МПа и
температуре 280 К.
|
Дано: p = 2·105 Па d = 2,9·10-10 м М = 32·10-3 кг/моль Т = 280 К |
Решение: На |
|
η D |
(1);
(2),
где
ρ –
плотность газа; < λ >
– средняя длина свободного пробега
молекул; <υар>
– средняя арифметическая скорость
молекул.
Из
(1) и (2) следует (3)
Среднюю
арифметическую скорость и среднюю длину
свободного пробега молекул находим по
формулам:
(4)
,
(5)
где
R = 8,31 Дж/(моль·К) – молярная
газовая постоянная; Т – термодинамическая
температура;
d = 2,9·10 –10 м – эффективный
диаметр молекулы кислорода; n0 – число
молекул в 1 м3
(концентрация).
Из
уравнения Менделеева – Клайперона
определяем n0
(см. задачу
3):
(6)
где
р
– давление; k
= 1,38·10 –23
Дж/К –
постоянная Больцмана.
Подставляя
(6) в уравнение (5), получаем:. (7)
Окончательный
вид расчетной формулы для коэффициента
диффузии найдем, подставляя выражения
(4) и (7) в уравнение (2):
.
(8)
Плотность
кислорода определяется по формуле:.
С учетом (6) имеем:. (9)
Подставляя
(9) и (8) в (3), получаем расчетную формулу
для коэффициента внутреннего трения:
.
Вычисляем:
Ответ:
.
Задача
6. Наружная
поверхность кирпичной стены площадью
25 м2
и толщиной 37 см имеет температуру
259 К, а внутренняя поверхность–293 К.
Помещение отапливается электроплитой.
Определить ее мощность, если температура
в помещении поддерживается постоянной.
Теплопроводность кирпича 0,4 Вт/(м·К).
|
Дано: S D T1 T2 χ |
Решение: Количество
где |
|
N |
За
время t
– электроплита
должна выделить такое же количество
теплоты: (2)
Приравнивая
правые части уравнений (1) и (2), получаем:
,
откуда
,
Ответ:
0,92 кВт.
Соседние файлы в папке FIZIKA
- #
- #
- #
- #
- #
- #
- #