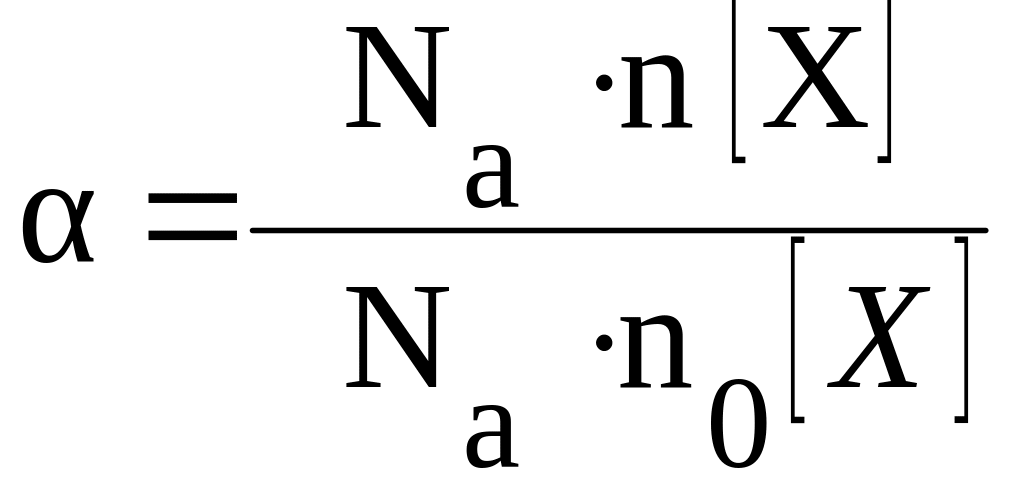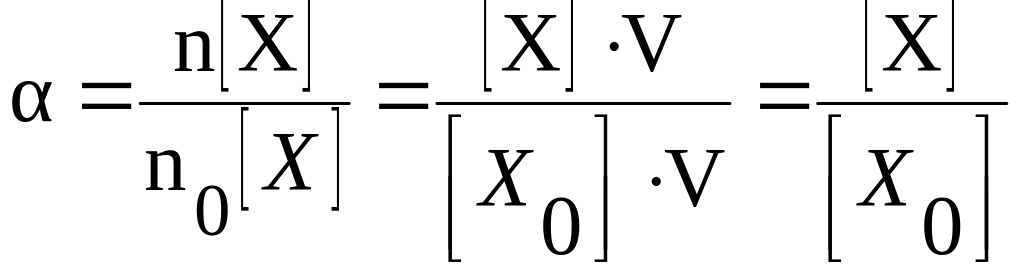Учебно-методическое пособие
9 класс
Продолжение. См. 21, 22/2003
1. Электролитическая диссоциация
1.5. Вычисления по теме
«Электролитическая диссоциация»
Степень электролитической диссоциации ![]() :
:
![]() = N1/N,
= N1/N,
где N1 – число диссоциированных
молекул, N – общее число молекул в растворе.
Значения a выражают в долях единицы или в
процентах.
Количество вещества n:
![]() = m/M.
= m/M.
масса m:
m = ![]() •M.
•M.
Объем V:
V = VM•![]() .
.
Единицы измерения: ![]() – моль, m – г (кг), V – л (м3).
– моль, m – г (кг), V – л (м3).
Число частиц N:
N = NA•![]()
Постоянные величины:
молярный объем VM = 22,4 л/моль – такой
объем занимает 1 моль любого газа при нормальных
условиях (н. у.) (t = 0 °С, р = 105 Па);число Авогадро NA = 6,02•1023 –
столько частиц (атомов, молекул, ионов) содержит 1
моль любого вещества.
Способы выражения концентрации растворов
Массовая доля растворенного вещества ![]() (p. в.):
(p. в.):
![]() (p. в.)
(p. в.)
= m (p. в.)/m (p-ра),
выражается в долях единицы или в процентах.
Молярная концентрация СМ:
СМ = ![]() /V,
/V,
где ![]() –
–
количество вещества (моль), V – объем (л).
Раствор с молярной концентрацией, равной x
моль/л, называется x-молярным (xМ,
например 1М KOH, 0,4М HCl).
Кристаллогидраты – кристаллические вещества,
содержащие молекулы воды:
СuSO4•5Н2О – пятиводный
кристаллогидрат сульфата меди(II), медный купорос;
Nа2SO4•10Н2О – десятиводный
кристаллогидрат сульфата натрия, глауберова
соль.
Вычисление молекулярной массы
кристаллогидрата:
Mr(CuSO4•5H2O) = Mr(CuSO4)
+ 5Mr(H2O) = 160 + 90 = 250.
Вычисления по теме «Степень диссоциации».
(Алгоритм 9.)
Задача 1. Определите, чему равна
степень диссоциации электролита, если при 20 °С
из каждых 150 молекул распалось на ионы 90. Сильный
или слабый это электролит?
Задача 2. Определите, сколько молекул
электролита продиссоциировало в растворе, если
степень диссоциации электролита равна 0,1, а в
раствор было введено 3,01•1020 молекул.

Задания для
самоконтроля
1. Рассчитайте степень диссоциации борной
кислоты Н3ВО3, если известно, что в
растворе из каждых 500 молекул распались на ионы
только 40. Сильный, средний или слабый по силе этот
электролит?Ответ. 8%, слабый.
2. Рассчитайте, сколько молекул электролита
продиссоциирует из каждых 120 молекул в растворе,
если степень диссоциации составляет 95%.Ответ. 114.
3. Укажите, сколько молекул сернистой кислоты
находятся в недиссоциированном состоянии в 4%-м
растворе сернистой кислоты массой 100 г, если
степень ее диссоциации составляет 0,02.Ответ. 2,9•1022.
Массовая доля растворенного вещества.
(Алгоритм 10.)
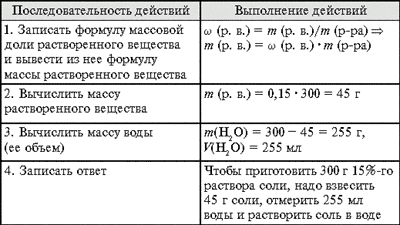
Задача 1. Как приготовить 300 г раствора
с массовой долей соли 15%?
Приготовление растворов
Задача 2. К 120 г 15%-го раствора соли
добавили 80 г воды. Вычислите массовую долю соли
во вновь полученном растворе.
Разбавление растворов

Задача 3. К 200 г 4%-го раствора сахара
добавили 5 г сахара. Рассчитайте массовую долю
вещества в полученном растворе.
Концентрирование растворов
Задача 4. К 120 г 20%-го раствора серной
кислоты добавили 40 г 50%-го раствора серной
кислоты. Какова массовая доля вещества во вновь
полученном растворе?
Смешивание двух растворов

Задачи для
самоконтроля
1. Навеску технической поваренной соли,
содержащей нерастворимые примеси, массой 25 г
растворили в 60 г воды и получили раствор с
массовой долей хлорида натрия 25%. Какова массовая
доля нерастворимых примесей в образце соли?Ответ. 20%.
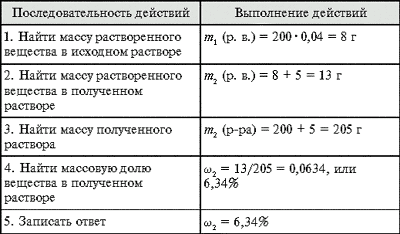
2. К 80 г раствора с неизвестной массовой долей
вещества прибавили 40 г воды. Вычислить массовую
долю соли в исходном растворе, если после
разбавления она стала равна 18%.Ответ. 27%.
3. Определите массу соли, которую надо добавить
к 80 г 10%-го раствора, чтобы получить 25%-й раствор
этой соли.Ответ. 16 г.
4. Определите массу воды, в которой надо
растворить 2 г натриевой селитры, чтобы получить
10%-й раствор для полива комнатных растений.Ответ. 18 г.
5. Сколько граммов 8%-го и 75%-го растворов
некоторого вещества нужно взять для получения 400
г 42%-го раствора?
Ответ. 197 г 8%-го раствора
и 203 г 75%-го раствора.
Молярная концентрация. (Алгоритм 11.)
Задача. Вычислите молярную
концентрацию 20%-го раствора хлорида калия (![]() = 1,13 г/мл).
= 1,13 г/мл).

Задания для
самоконтроля
1. Вычислите массовую долю нитрата натрия в 1M
растворе этого вещества ((р-ра) = 1,05 г/мл).
Ответ. 8,1%.
2. Смешали 325 мл 8%-го раствора серной кислоты (
= 1,05 г/мл) и 375 мл 1,5M
раствора этого же вещества (= 1,1 г/мл). Определите массовую
долю вещества в полученном растворе и его
молярную концентрацию (изменением объема
раствора после смешивания пренебречь).
Ответ.
= 10,9%,
C = 1,21 моль/л.
Вычисления по уравнениям реакций,
если одно из веществ дано в избытке. (Алгоритм 12.)
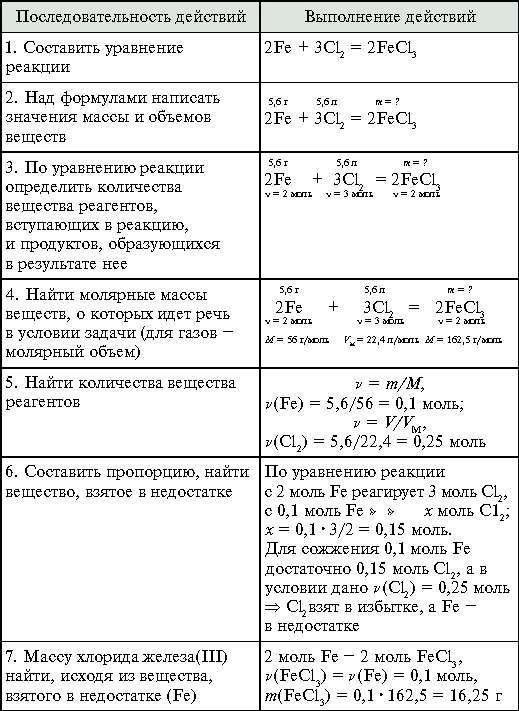
Задача. Железо массой 5,6 г сожгли в 5,6 г
хлора (н. у.). Вычислите массу образовавшегося
хлорида железа(III).
Задания для
самоконтроля
1. Рассчитайте массу осадка, который образуется
при сливании 15 г 5%-го раствора хлорида бария и 10 г
8%-го раствора сульфата натрия.
Ответ. 0,84 г.
2. Какой объем газа выделится (н. у.) при сливании
150 г 30%-й соляной кислоты с раствором карбоната
натрия, содержащим 0,5 моль этой соли?
Ответ. 11,2 л.
3. К раствору, содержащему 1 моль хлорида меди(II),
добавили раствор, в котором растворен гидроксид
натрия количеством вещества 3 моль. Какова
реакция полученного раствора на индикатор?
Какова масса полученной соли?
Ответ. Щелочная, 117 г.
4. Какой объем оксида углерода(IV) выделится при
взаимодействии 0,5 моль карбоната натрия с
раствором соляной кислоты объемом 400 мл и
концентрацией 2,5 моль/л?
Ответ. 11,2 л.
5. Какая масса соли образуется при
взаимодействии 400 мл раствора серной кислоты с
концентрацией 0,5 моль/л и 10,4%-го раствора хлорида
бария объемом 200 мл и
плотностью 1,22 г/см3?
Ответ. 28,4 г.
Кристаллогидраты. (Алгоритм 13.)
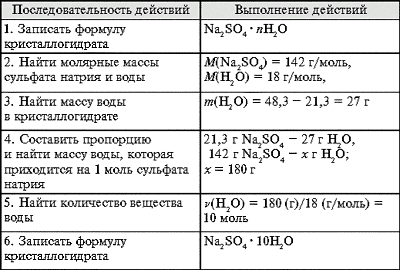
Задача 1. При полном обезвоживании 48,3 г
кристаллогидрата получено 21,3 г сульфата натрия.
Определите формулу кристаллогидрата.
Задача 2. Сколько воды и английской
соли (семиводный кристаллогидрат сульфата
магния) необходимо взять для приготовления 440 г
раствора сульфата магния с массовой долей 8%?

Задания для
самоконтроля
1. Кристаллогидрат хлорида бария содержит 14,8%
кристаллизационной воды. Определите формулу
кристаллогидрата.Ответ. BaCl2•2H2O.
2. Определите формулу кристаллогидрата, если
известно, что при прокаливании кристаллогидрата
карбоната натрия массой 14,3 г его масса
уменьшилась на 9 г.Ответ. Na2СО3•10H2O.
3. Какая масса кристаллической соды Nа2СО3•10Н2О
потребуется для получения 10%-го раствора
безводного карбоната натрия массой 200 г?Ответ. 54 г.
4. Какова массовая доля сульфата цинка в
растворе, полученном при растворениии 114,8 г ZnSO4•7Н2О
в воде объемом 85,2 мл?Ответ. 32,2%.
2. Закономерности течения
химических реакций
Знать: энергетику химических
превращений; закон Гесса; зависимость скорости
химической реакции от температуры, концентрации,
площади соприкосновения реагирующих веществ,
природы реагирующих веществ, участия
катализаторов и ингибиторов; правило Вант-Гоффа;
принцип Ле Шателье; условия смещения химического
равновесия.
Уметь: на конкретных примерам
разъяснять зависимость скорости химических
реакций от различных факторов и смещение
химического равновесия в зависимости от условий
течения реакций; использовать понятия скорости
химической реакции, теплот образования и
сгорания при решении расчетных задач.
Основные понятия: тепловой эффект,
термохимическое уравнение, экзотермические и
эндотермические реакции, энтальпия, энергия
активации, теплоты образования и сгорания
веществ, энтропия, химическое равновесие,
реакции обратимые и необратимые, реакции прямые
и обратные, равновесные концентрации, константа
химического равновесия, скорость химической
реакции, катализатор, ингибитор, каталитическая
реакция.
Контрольные вопросы
1. От каких факторов зависит скорость реакции?
2. Что называют скоростью химической реакции?
3. По каким формулам можно рассчитать величину
скорости реакции?
4. Как формулируют закон действия масс?
5. Как читается правило Вант-Гоффа?
6. Почему при повышении температуры скорость
реакции возрастает?
7. Какие вещества называют катализаторами, а
какие ингибиторами?
8. Что называют кинетическим уравнением реакции?
9. Что называют энергией активации?
10. Какие реакции называют обратимыми и какие
необратимыми?
11. Что называют химическим равновесием?
12. Что называют константой равновесия?
13. Что называют смещением химического
равновесия?
14. Как читается принцип Ле Шателье?
15. Почему любая химическая реакция
сопровождается тепловым эффектом?
16. Какие реакции называют экзотермическими, а
какие эндотермическими?
17. Сформулируйте закон Гесса и следствия из него.
2.1. Скорость химической реакции
Скорость химической реакции ![]() – физическая величина.
– физическая величина.
![]()
где С1 – начальная концентрация
одного из реагирующих веществ в момент времени ![]() 1, С2 –
1, С2 –
концентрация в момент времени ![]() 2,
2, ![]() 1 – начальное время,
1 – начальное время, ![]() 2 – время окончания
2 – время окончания
реакции.
Поскольку значение скорости реакции не может
быть отрицательным, то в случае получения
отрицательного значения берем его
математический модуль.
Единицы измерения величин: С – моль/л, ![]() – с (секунда),
– с (секунда), ![]() – моль/(л•с).
– моль/(л•с).
Скорость химической реакции зависит:
а) от природы реагирующих веществ;
б) от концентрации реагентов;
в) от температуры;
г) от поверхности соприкосновения реагирующих
веществ (для гетерогенных систем);
д) от участия катализатора или ингибитора.
Для реакции А + В = С
![]() = k[A]•[B],
= k[A]•[B],
где k – константа скорости, [A] –
концентрация вещества А, [В] – концентрация
вещества В.
Если в реакции в отдельном столкновении
участвуют а молекул А и b молекул В,
т. е. аА + bВ = С, то выражение ![]() = k•[A]а•[B]b
= k•[A]а•[B]b
называют законом действующих масс. (Отметим, что
показатели степени а и b часто не равны
стехиометрическим коэффициентам вследствие
сложного механизма реакции.)
При повышении температуры на каждые 10°
скорость реакции возрастает в 2–4 раза (правило
Вант-Гоффа):
![]()
где ![]() 2 –
2 –
скорость реакции при температуре ![]() 2,
2, ![]() 1 – скорость реакции при
1 – скорость реакции при
температуре ![]() 1,
1,
![]() – температурный
– температурный
коэффициент, он принимает значения от 2 до 4.
Скорость реакции обратно пропорциональна
времени:
![]()
Изучая
свойства растворов электролитов, С.
Аррениус ввёл понятие «степень
диссоциации», предположив, что некоторые
электролиты не могут полностью
диссоциировать на ионы.
Степенью
диссоциации называется отношение
числа молекул, распавшихся в растворе
на ионы, к общему числу молекул электролита
в растворе.
|
|
(1) |
где:
N(X)
– число продиссоциировавших молекул
электролита X;
N0(X)
– общее число молекул электролита X
в растворе.
Степень
диссоциации ()
зависит от следующих факторов:
– от
природы электролита и растворителя;
– концентрации
электролита;
– температуры.
Степень
диссоциации можно также выразить через
количество вещества по формуле:
|
|
(2) |
где
n(X)
– количество молей продиссоциировавшего
вещества X;
n0б(X)
– общее количество молей вещества X
в растворе;
Na
–
число Авогадро.
Количество вещества
можно выразить через молярную концентрацию
раствора и объём раствора, поэтому
степень диссоциации можно также
определить как отношение молярной
концентрации продиссоциировавшего
вещества к молярной концентрации всего
вещества, находящегося в растворе.
|
|
( |
где
[Х] – молярная концентрация
продиссоциировавшего вещества X;
[Х0]
– общая молярная концентрация вещества
X
в растворе.
Электролиты
можно разделить на 2 большие группы:
электролиты сильные и слабые.
Сильные
электролиты
диссоциируют в растворах полностью и
процесс диссоциации необратим:
HNO3
H+
+ NO3–
. Из этого следует, что степень
диссоциации сильного электролита равна
1.
Сильными
электролитами являются:
–все
растворимые соли;
– гидроксиды
щелочных и щелочно-земельных металлов
(NaOH,
KOH,
Ba(OH)2;
– некоторые
кислоты (H2SO4,
HNO3,
HCl,
HBr,
HI.
Для
слабых электролитов степень диссоциации
α < 1,
поскольку слабые электролиты диссоциируют
лишь частично, и
процесс диссоциации обратим, т.е.
в растворе устанавливается динамическое
равновесие между ионами и
непродиссоциировавшими молекулами.
Основные
слабые электролиты:
– вода
H2O;
– гидроксиды
Al(OH)3;
Обратимый
характер диссоциации слабых электролитов
отражается при записи уравнений.
CH3COOH
⇆
CH3COO–
+ H+
H3PO4
⇆
H+
+ H2PO4–
H2PO4–
⇆
H+
+ HPO42–
HPO42–
⇆
H+
+ PO43–
4 Константа диссоциации
К
равновесию, которое устанавливается в
растворе слабого электролита между
молекулами и ионами, можно применить
законы химического равновесия и записать
выражение константы равновесия.
Ниже
приводится выражение константы равновесия
для процесса диссоциации уксусной
кислоты CH3COOH
⇆
CH3COO–
+ H+.
К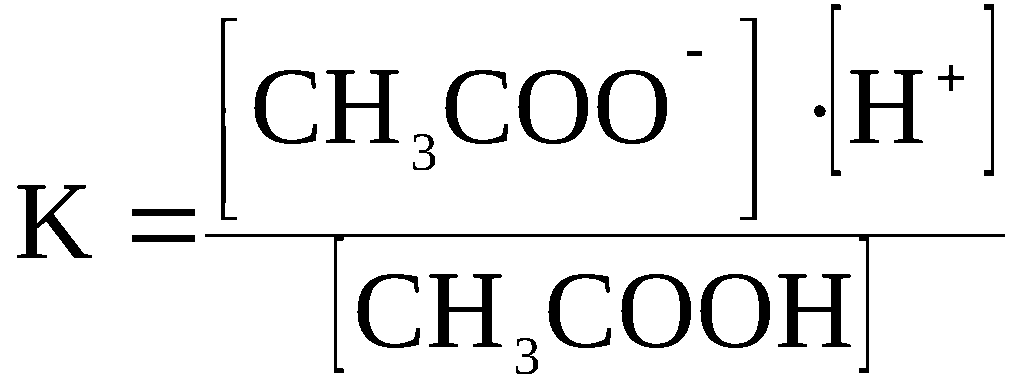
онстанта
равновесия, соответствующая процессу
диссоциации слабого электролита,
называется
константой
диссоциации.
Величина
константы диссоциации зависит от природы
электролита и растворителя, температуры,
но не зависит от концентрации электролита
в растворе.
Она
характеризует способность данной
кислоты или данного основания распадаться
на ионы: чем легче электролит диссоциирует
на ионы, тем больше константа диссоциации.
Константа
диссоциации является справочной
величиной.
Ступенчатая
диссоциация электролитов. Многоосновные
кислоты и многокислотные основания
диссоциируют ступенчато.
Каждая
стадия ступенчатой диссоциации
многоосновной кислоты характеризуется
своей константой диссоциации.
H3PO4
⇆
H+
+ H2PO4–
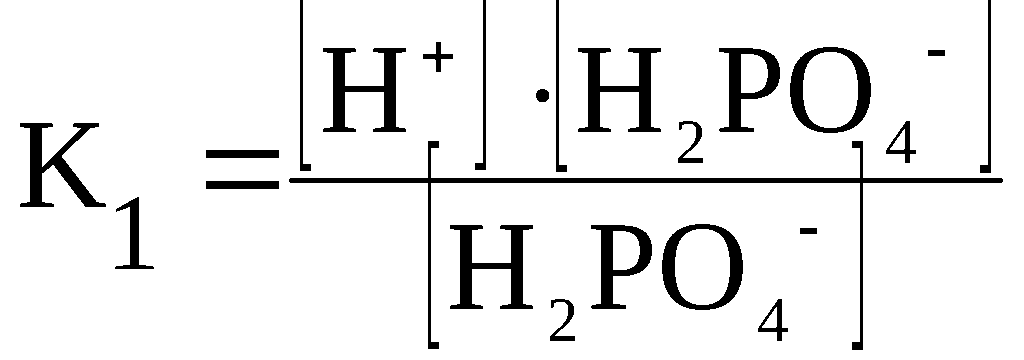
H2PO4–
⇆
H+
+ HPO42–
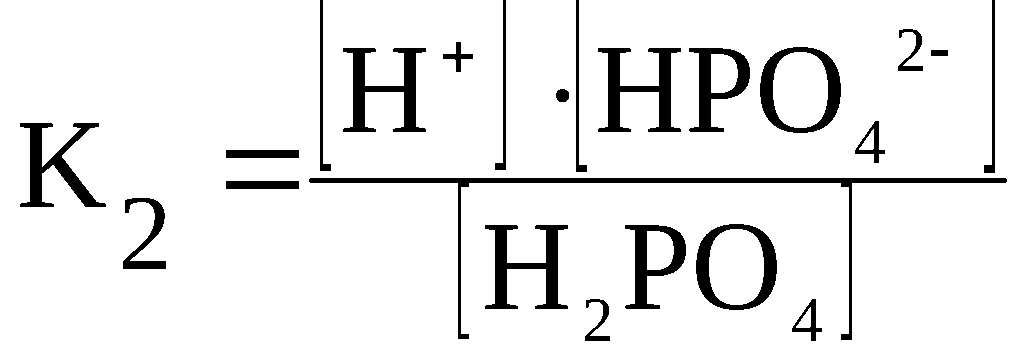
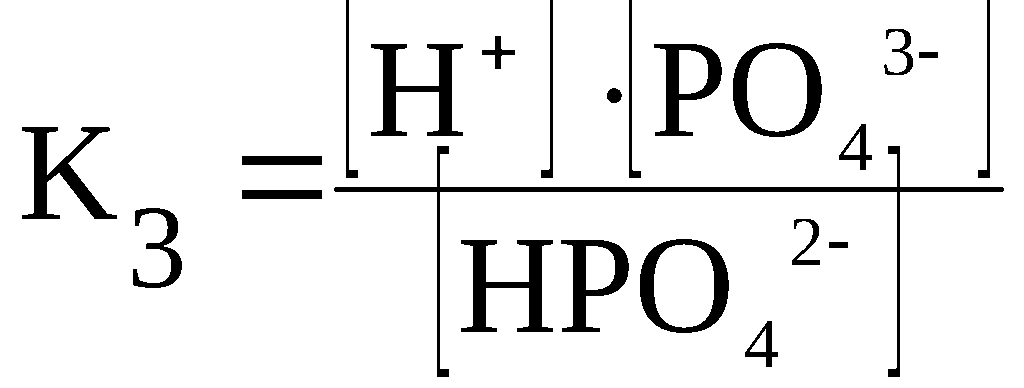
HPO42–
⇆
H+
+ PO43–
Аналогичные
соотношения характеризуют и ступенчатую
диссоциацию оснований многовалентных
металлов.
Fe(OH)2
⇆
FeOH+
+ OH–
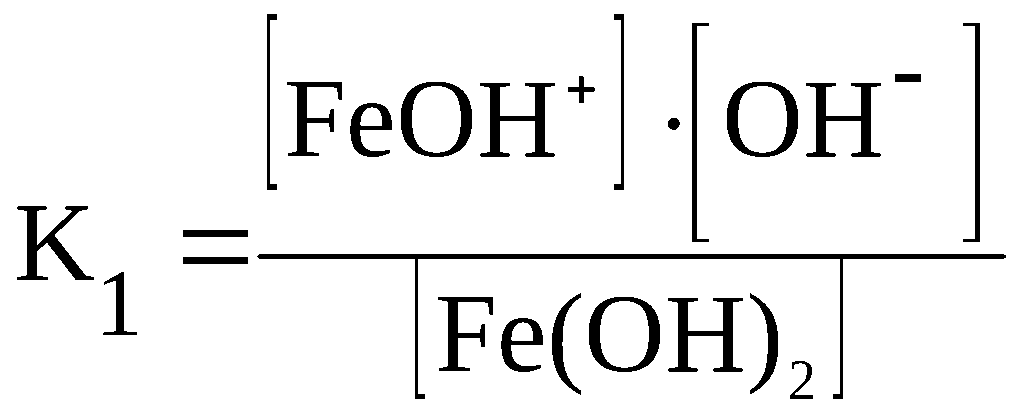
F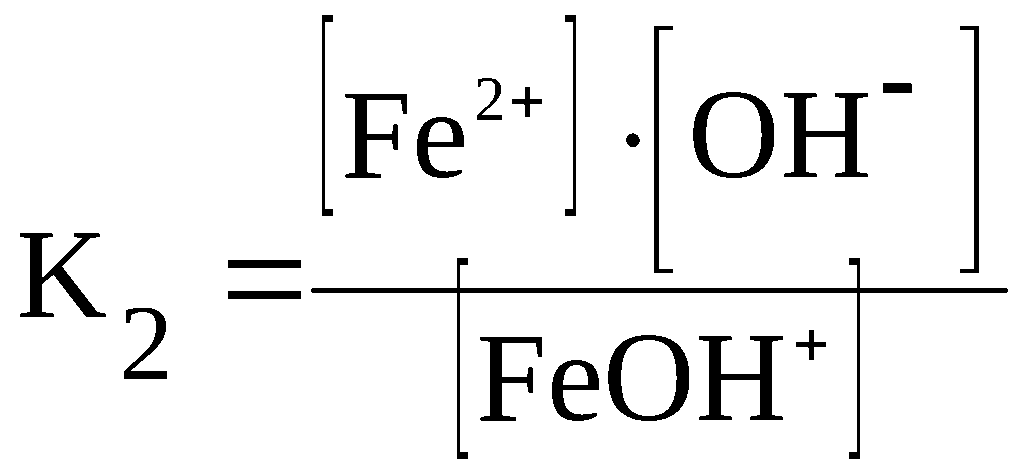
eOH+
⇆
Fe2+
+ OH–
При
ступенчатой диссоциации веществ распад
по первой ступени всегда происходит в
гораздо большей степени, чем по второй;
по второй стадии – больше, чем по третьей
и т.д. Иначе говоря, соблюдается
неравенство:
K1
>> K2
> K3
> … .
Это
объясняется тем, что энергия, необходимая
для отрыва иона от нейтральной молекулы,
меньше, чем от заряженной частицы.
Например, отрыв иона H+
будет происходить более легко от
нейтральной частицы – молекулы H3PO4,
чем от отрицательно заряженного иона
H2PO4–.
В свою очередь, отрыв иона H+
от однозарядного иона H2PO4–
требует меньшей энергии, чем от
двухзарядного иона HPO4–.
Кислые
и основные соли также диссоциируют
ступенчато, например:
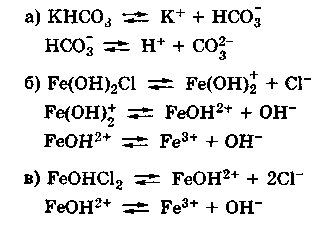
Нетрудно заметить,
что диссоциация гидроаниона или
гидроксокатиона идентична второй или
третьей ступени диссоциации соответствующих
кислоты или основания и потому подчиняется
тем же закономерностям, которые были
сформулированы для ступенчатой
диссоциации кислот и оснований. В
частности, если основная соль
соответствует слабому основанию, а
кислая соль – слабой кислоте, то диссоциация
гидроаниона или гидроксокатиона (т. е.
вторая или третья ступень диссоциации
соли) протекает в незначительной степени.
Во всякой
кислородсодержащей кислоте и во всяком
основании (имеются в виду кислоты и
основания в традиционном понимании)
имеются гидроксогруппы. Разница между
кислотой и основанием заключается в
том, что в первом случае диссоциация
происходит по связи ЭО—Н, а во втором
— по связи Э—ОН.
Амфотерные
гидроксиды диссоциируют и как основания,
и как кислоты (и те и другие очень слабые).
Так, ионизацию гидроксида цинка можно
представить следующей схемой (без учета
гидратации образующихся ионов):
![]()
Прибавление кислоты
смещает эти равновесия влево, а
прибавление щелочи – вправо. Поэтому
в кислой среде преобладает диссоциация
по типу основания, а в щелочной — по
типу кислоты. В обоих случаях связывание
в молекулы воды ионов, образующихся
при диссоциации малорастворимого
амфотерного электролита, вызывает
переход в раствор новых порций таких
ионов, их связывание, переход в раствор
новых ионов и т. д. Следовательно,
растворение такого электролита происходит
как в растворе кислоты, так и в растворе
щелочи.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Как определить количество продиссоциировавших молекул?
Ученик
(173),
на голосовании
4 года назад
Голосование за лучший ответ
Станислав Шульгин
Ученик
(113)
4 года назад
Ион – это электрически заряженная частица. Она образуется, когда атом или молекула притягивает к себе дополнительные электроны или же отдает свои. Положительно заряженные ионы называются катионами, а отрицательно заряженные – анионами. Частицы образуются в растворах в ходе процесса, который называется электролитической диссоциацией. Но это может происходить и при воздействии высокой температуры, электрического тока и т. д. При диссоциации даже крохотного количества вещества образуется определенное число ионов.
Как вычислить степень диссоциации
Степень диссоциации – это величина, равная отношению количества молекул вещества, распавшихся на ионы, к общему количеству молекул этого вещества в растворе или расплаве.

Инструкция
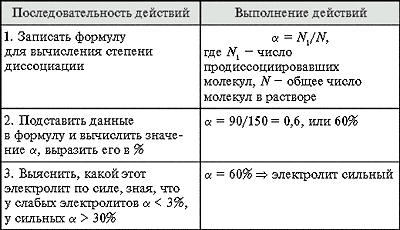
Предположим, перед вами поставили такую задачу. Имеется раствор нашатырного спирта с концентрацией 0,1М. По результатам лабораторных исследований вам известно, что концентрация недиссоциированных молекул спирта равна 0,099 моль/литр. Какова же будет степень диссоциации?
Прежде всего, вспомните определение степени диссоциации и формулу, по которой она вычисляется: а = n/N, где n – количество молекул вещества, распавшихся на ионы, а N – общее количество молекул вещества.
После этого напишете уравнение электролитической диссоциации нашатырного спирта, оно будет выглядеть следующим образом:NH4OH = NH4+ + OH-
По условиям задачи известна изначальная молярная концентрация спирта. Обозначьте ее буквой С. Тогда концентрация молекул спирта, подвергшихся диссоциации, обозначьте как аС. Соответственно, и концентрации ионов NH4+ и OH- также будут равны этой величине, то есть аС.
Определите, чему равна величина аС. Нетрудно понять, что 0,001 моль/литр (вы получите это значение, отняв от изначальной концентрации всего спирта концентрацию не распавшихся молекул). Следовательно, искомая величина составляет: 0,001/0,1 = 0,01. Задача решена. Степень диссоциации нашатырного спирта при заданных условиях равна 0,01 (или 1%, в другом исчислении).
Обратите внимание
Постарайтесь запомнить простое правило: чем ближе степень диссоциации к единице (или к 100%), тем сильнее электролит, чем ближе к нулю – тем слабее.
Полезный совет
Если электролит сильный, то диссоциации подвергается значительная часть его молекул (в ряде случаев, практически все). Соответственно, чем слабее электролит, тем меньшее количество его молекул распадается на ионы. Критерием оценки силы электролита служит степень диссоциации.
Источники:
- как рассчитать степень диссоциации
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Определите, сколько молекул электролита продиссоциировало в растворе, если степень диссоциации а=0,1, а в раствор было ввдено 3,01*10(20) молекул.
Елизавета
22.10.12
Учеба и наука / Химия
1 ответ