Как найти количество молекул в молях
Молекула обладает настолько мизерными размерами, что количество молекул даже в крохотной крупинке или капле какого-либо вещества будет просто грандиозным. Оно не поддается измерению с помощью обычных методов исчисления.
Для определения, сколько молекул находится в том или ином количестве вещества, используется понятие «моль». Моль – это такое количество вещества, в котором находится 6,022*10^23 его молекул (или атомов, или ионов). Эта громадная величина носит название «постоянная Авогадро», она названа в честь знаменитого итальянского ученого. Величина обозначается NA. С помощью постоянной Авогадро можно очень легко определить, сколько молекул содержится в любом количестве молей любого вещества. Например, в 1,5 молях содержится 1,5*NA = 9,033*10^23 молекул. В тех случаях, когда требуется очень высокая точность измерения, необходимо использовать значение числа Авогадро с большим количеством знаков после запятой. Наиболее полная его величина составляет: 6,022 141 29(27)*10^23.
Определить, сколько молей содержится в каком-то количестве вещества, очень просто. Для этого нужно только иметь точную формулу вещества и таблицу Менделеева под рукой. Предположим, у вас есть 116 граммов обыкновенной поваренной соли. Вам нужно определить, сколько молей содержится в таком количестве (и, соответственно, сколько там молекул)?
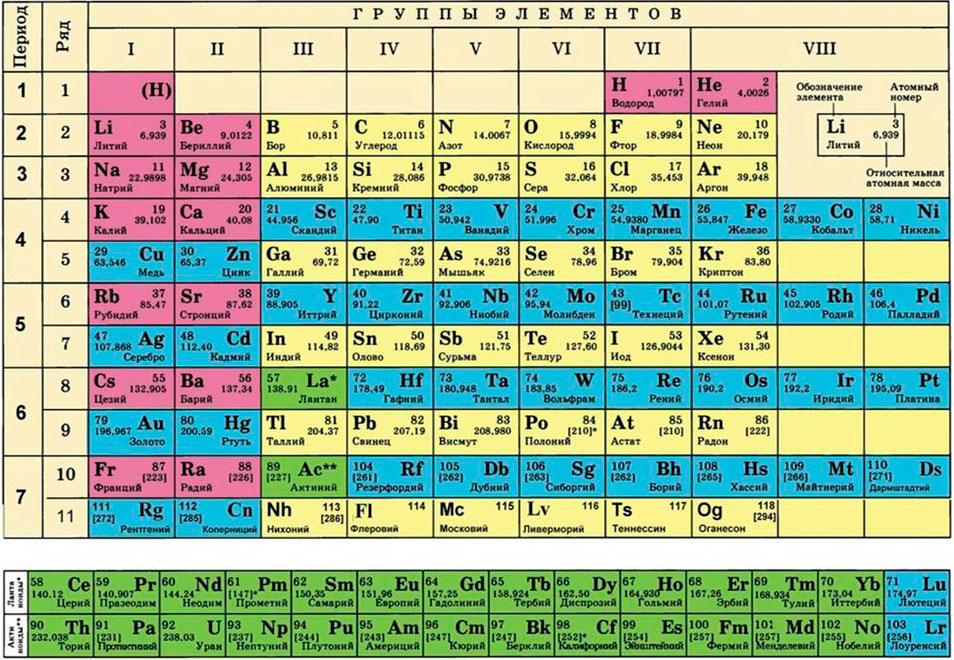
Прежде всего вспомните химическую формулу поваренной соли. Она выглядит следующим образом: NaCl. Молекула этого вещества состоит из двух атомов (точнее, ионов): натрия и хлора. Какова ее молекулярная масса? Она складывается из атомных масс элементов. С помощью таблицы Менделеева вы знаете, что атомная масса натрия приблизительно равна 23, а атомная масса хлора – 35. Следовательно, молекулярная масса этого вещества составляет 23 + 35 = 58. Масса измеряется в атомных единицах массы, где за эталон принят самый легкий атом – водорода.
А зная молекулярную массу вещества, вы тут же сможете определить и ее молярную массу (то есть массу одного моля). Дело в том, что численно молекулярная и молярная масса полностью совпадают, у них только разные единицы измерения. Если молекулярная масса измеряется в атомных единицах, то молярная – в граммах. Следовательно, 1 моль поваренной соли весит приблизительно 58 граммов. А у вас, по условиям задачи, 116 граммов поваренной соли, то есть 116/58 = 2 моля. Умножив 2 на постоянную Авогадро, вы определите, что в 116 граммах хлорида натрия находится примерно 12,044*10^23 молекул, или примерно 1,2044*10^24.
В уроке 5 «Моль и молярная масса» из курса «Химия для чайников» рассмотрим моль как единицу измерения количества вещества; дадим определение числу Авогадро, а также научимся определять молярную массу и решать задачи на количество вещества. Базой для данного урока послужат основы химии, изложенные в прошлых уроках, так что если вы изучаете химию с нуля, то рекомендую их просмотреть хотя бы мельком.
Единица измерения количества вещества
До этого урока мы обсуждали лишь индивидуальные молекулы и атомы, а их массы мы выражали в атомных единицах массы. В реальной жизни с индивидуальными молекулами работать невозможно, потому что они ничтожно малы. Для этого химики взвешивают вещества ни в а.е.м., а в граммах.
Чтобы перейти от молекулярной шкалы измерения масс в лабораторную шкалу, используют единицу измерения количества вещества под названием моль. 1 моль содержит 6,022·1023 частиц (атомов или молекул) и является безразмерной величиной. Число 6,022·1023 носит название Число Авогадро, которое определяется как число частиц, содержащихся в 12 г атомов углерода 12C. Важно понимать, что 1 моль любого вещества содержит всегда одно и то же число частиц (6,022·1023).
Как уже было сказано, термин «моль» применяется не только к молекулам, но также и к атомам. Например, если вы говорите о моле гелия (He), то это означает, что вы имеет количество равное 6,022·1023 атомов. Точно так же, 1 моль воды (H2O) подразумевает количество равное 6,022·1023 молекул. Однако чаще всего моль применяют именно к молекулам.
Молярная масса вещества
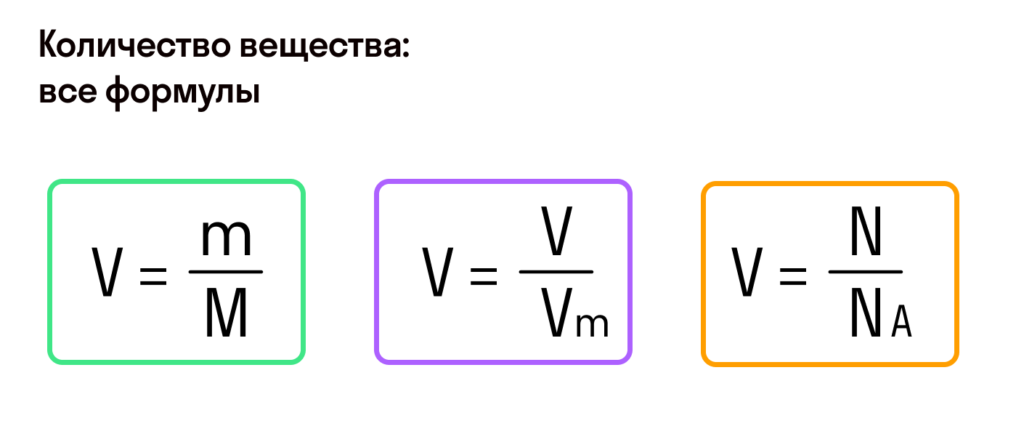
Молярная масса – это масса 1 моля вещества, выраженная в граммах. Молярную массу одного моля любого химического элемента без труда находят из таблицы Менделеева, так как молярная масса численно равна атомной массе, но размерности у них разные (молярная масса имеет размерность г/моль). Запишите и запомните формулы для вычисления молярной массы, количества вещества и числа молекул:
- Молярная масса формула M=m/n
- Количество вещества формула n=m/M
- Число молекул формула N =NA·n
где m — масса вещества, n — количество вещества (число молей), М — молярная масса, N — число молекул, NA — число Авогадро. Благодаря молярной массе вещества химики могут вести подсчет атомов и молекул в лаборатории просто путем их взвешивания. Этим и удобно использование понятия моль.
На рисунке изображены четыре колбы с различными веществами, но в каждой из них всего 1 моль вещества. Можете перепроверить, используя формулы выше.
Задачи на количество вещества
Пример 1. Сколько граммов Н2, Н2O, СН3ОН, октана (С8Н18) и газа неона (Ne) содержится в 1 моле?
Решение: Молекулярные массы (в атомных единицах массы) перечисленных веществ приведены в таблице Менделеева. 1 моль каждого из названных веществ имеет следующую массу:
Поскольку массы, указанные в решении примера 1, дают правильные относительные массы взвешиваемых молекул, указанная масса каждого из перечисленных веществ содержит одинаковое число молекул. Этим и удобно использование понятия моля. Нет даже необходимости знать, чему равно численное значение моля, хотя мы уже знаем, что оно составляет 6,022·1023; эта величина называется числом Авогадро и обозначается символом NA. Переход от индивидуальных молекул к молям означает увеличение шкалы измерения в 6,022·1023 раз. Число Авогадро представляет собой также множитель перевода атомных единиц массы в граммы: 1 г = 6,022·1023 а.е.м. Если мы понимаем под молекулярной массой массу моля вещества, то ее следует измерять в граммах на моль; если же мы действительно имеем в виду массу одной молекулы, то она численно совпадает
с молекулярной массой вещества, но выражается в атомных единицах массы на одну молекулу. Оба способа выражения молекулярной массы правильны.
Пример 2. Сколько молей составляют и сколько молекул содержат 8 г газообразного кислорода O2?
Решение: Выписываем из таблицы Менделеева атомную массу атома кислорода (O), которая равна 15,99 а.е.м, округляем до 16. Так как у нас молекула кислорода, состоящая из двух атомов O, то ее атомная масса равна 16×2=32 а.е.м. Хорошо, а теперь переводим ее в молярную массу: 32 а.е.м = 32 г/моль. Это означает, что 1 моль (6,022·1023 молекул) O2 имеет массу 32 грамма. Ну и в заключении по формулам выше находим количество вещества (моль) и число молекул, содержащихся в 8 граммах O2:
- n = m / M = 8г / 32г/моль = 0,25 моль
- N = NA × n = 6,022·1023 × 0,25 = 1,505·1023 молекул
Пример 3. 1 молекула Н2 реагирует с 1 молекулой Сl2, в результате чего образуются 2 молекулы газообразного хлористого водорода НСl. Какую массу газообразного хлора необходимо использовать, чтобы он полностью прореагировал с 1 килограммом (кг) газообразного водорода?
Решение: Молекулярные массы H2 и Cl2 равны 2,0160 и 70,906 г/моль соответственно. Следовательно, в 1000 г H2 содержится
Даже не выясняя, сколько молекул содержится в одном моле вещества, мы можем быть уверены, что 496 моля Cl2 содержат такое же число молекул, как и 496,0 моля, или 1000 г, H2. Сколько же граммов Cl2 содержится в 496 молях этого вещества? Поскольку молекулярная масса Cl2 равна 70,906 г/моль, то
Пример 4. Сколько молекул H2 и Cl2 принимает участие в реакции, описанной в примере 3?
Решение: В 496 молях любого вещества должно содержаться 496 моля × 6,022·1023 молекул/моль, что равно 2,99·1026 молекул.
Чтобы наглядно показать, сколь велико число Авогадро, приведем такой пример: 1 моль кокосовых орехов каждый диаметром 14 сантиметров (см) мог бы заполнить такой объем, какой занимает наша планета Земля. Использование молей в химических расчетах рассматривается в следующей главе, но представление об этом пришлось ввести уже здесь, поскольку нам необходимо знать, как осуществляется переход от молекулярной шкалы измерения масс к лабораторной шкале.
Надеюсь урок 5 «Моль и молярная масса» был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии.
|
объясните как можно подробнее, просто ответ не пишите Моль здесь это количество вещества, равное 6,02*10^23 структурных единиц данного вещества – молекул (если вещество из молекул), атомов (если атомарное вещество), ионов (если вещество является ионым соединением ). Путем различных экспериментов в науке было доказано, что в 1 моле любого вещества содержится 6,02 х 10^23 молекул. Данное число называется постоянной Авогадро(Na). Количество молекул можно найти по формуле: N=n*Na, где N — количество молекул, n — количество вещества, Na — постоянная Авогадро. По условию нашей задачи n=0,04 моль, поэтому N=0,04*6,02*10^23=0,2408*10^23 (молекул). Эту задачу также можно решить с помощью пропорции: 1 моль – 6,02*10^23 молекул 0,04 моль – х молекул => х = 0,2408*10^23 система выбрала этот ответ лучшим КорнетОболенский 3 месяца назад Думается, что ответ на эту задачу интересует школьника, прогулявшего урок химии по соответствующей теме. Сама задача сложностей не представляет. Только следует четко понимать, что скрывается за терминами “количество вещества” и “моль”. Попробую разъяснить этот момент. Когда мы в магазине покупаем 5 килограммовых пачек сахара, то это можно трактовать так: сахар – вещество, 5кг – его количество, измеренное в единице измерения килограмм. Если бы за единицу измерения взяли грамм, то количество сахара составило бы 5000 грамм. Если за единицу измерения взять одну сахаринку, то там бы была другая, ещё бо́льшая цифра. Так вот, на уроках химии изучают различные вещества (серу,алюминий, углерод и пр.). Все эти вещества состоят из атомов или молекул (структурных единиц) в зависимости от того, какое строение имеет конкретное вещество. Количество вещества и определяется числом этих структурных единиц (атомов или молекул). И оно выражается в молях (по рассмотренной выше аналогии с сахаром – граммы или килограммы). Т.о. моль – единица измерения количества вещества. За один моль в химии принято считать количество вещества, содержащее в себе такое же количество структурных единиц (атомов или молекул), сколько содержится атомов в 12 граммах углерода. /то есть в ситуации с сахаром за единицу можно было бы взять количество сахаринок в 1 грамме/ Учёными установлено, что в 12г углерода содержится этих атомов. Это число имеет название “постоянная Авогадро” в честь открывшего его итальянского учёного. Постоянная Авогадро – гигантское число, намного превосходящее число стаканов воды, содержащихся во всех мировых океанах. Это была матчасть. Теперь перейдем к решению задачи. Вычисление производится по формуле N = n * Na, где N — количество молекул, n — количество вещества (по условию задачи оно равно 0,04 моль), Na — постоянная Авогадро. Решение задачи: FatalMoon 4 месяца назад 1 моль любого вещества – 6,02•10^23 молекул, это просто как константа. Соответственно, чтобы найти количество молекул в любом веществе, зная только его моль, нужно их перемножить (константу на известные данные) и мы получим ответ! И получаеся ничего сложного, 0,04 * 6,02•10^23 = 0,2408*10^23 maugli1 5 лет назад Чтобы узнать число молекул в определённом количестве вещества воспользуйтесь формулой N = Na*n N – число молекул Na – постоянная Авогадро равное 6*10 в 23 степени n – кол-во вещества в моль Isnotbig 5 лет назад 1 моль вещества = 6,02*10^23 молекул. 0.04 моль это 0.04*6.02*10^23 молекул. SVFE48 4 месяца назад Для того, чтобы найти количество молекул в 0,04 моль вещества, необходимо использовать уравнение Лоуренса: М = n/V где М – молярная масса вещества, n – количество молекул вещества, V – объем раствора. Поскольку в задаче указано, что количество вещества равно 0,04 моль, то мы можем записать уравнение следующим образом: М = n/V = 0,04 моль / V Чтобы найти количество молекул, нужно решить это уравнение для n. Для этого нужно знать молярную массу вещества и объем раствора. После того, как эти значения будут найдены, количество молекул можно вычислить с помощью уравнения Лоуренса. Степан БВ 3 месяца назад Если известно, что количество вещества равно 0,04 моль, то количество молекул можно найти, используя следующую формулу: Количество молекул = количество вещества (моль) / молекулярный вес вещества (г/моль) Здесь молекулярный вес вещества можно найти, используя периодическую таблицу элементов. Он указывается в единицах грамм на моль. Когда мы имеем молекулярный вес, мы можем вычислить количество молекул, деля количество вещества (0,04 моль) на молекулярный вес. владсандрович 3 месяца назад 1 моль того или иного вещества приравнивается к 6,02•10^23 молекулам, что является константой. Поэтому если мы хотим вычислить количество молекул в том или ином веществе, при том что нам известно количество его моль, нужно произвести умножение константы на известные данные и так мы сможем получить в итоге верный ответ. В данном вопросе нам известно количество вещества 0,04 моль, а значит нам надо: 0,04 * 6,02•10^23 = 0,2408*10^23. Скмшка 4 года назад Экспериментально доказано, что 1 моль любого вещества содержит 6,02•10^23 молекул. Это число названо постоянной Авогадро (Na). Найти число молекул можно по формуле: N=n•Na, где N-число молекул, n – количество вещества, Na – постоянная Авогадро. По условию задачи n=0,04 моль, тогда N=0,04•6,02•10^23=0,2408•10^23 (молекул). Можно решить и пропорцией: 1 моль – 6,02•10^23 молекул 0,04 моль – х молекул => х=0,2408•10^23 Rnd 3 месяца назад Количество молекул в любом веществе можно легко вычислить, используя константу Avogadro. Один моль любого вещества эквивалентен 6,02 x 10^23 молекулам. Просто перемножьте известное количество молей с этой константой, и вы получите общее количество молекул. Например, 0,04 моль * 6,02 x 10^23 молекул/моль = 0,2408 x 10^23 молекул. Долинн 4 месяца назад Моль в химии имеет вот такое определение: А в углероде-12 массой 0,012 кг содержится 6,02•10^23 молекул. Таким образом, один моль любого вещества – это 6,02•10^23 молекул. Дальше просто: умножаем число молей (тут по условию 0,04) на 6,02•10^23 и получаем ответ 0,2408*10^23 Знаете ответ? |
Смотрите также: ВПР по химии 8 класс 2020, задания, ответы, демоверсии, где найти? Химия 8 класс учебник Аббасов, где читать онлайн, краткое содержание? Химия 8 класс учебник Усманова, Сакарьянова, где читать онлайн? Химия 8 класс учебник Григорович, где читать онлайн, краткое содержание? Химия 8 класс учебник Еремин, Кузьменко, Дроздов, Лунин, где читать онлайн? Химия 8 класс учебник Габриелян, где читать онлайн, краткое содержание? Химия 8 класс учебник Кузнецова, Титова, Гара, где читать онлайн? ВПР 2022, химия, 8 класс, все варианты с ответами – где найти, скачать? ВПР по химии 8 класс 2021, задания, ответы, демоверсии, где найти? ВПР по химии 8 класс с ответами 2019 год все варианты – где найти/скачать? |
Моль — условное количество вещества
Добавлено: 3 октября 2021 в 12:58

Химия — наука, изучающая взаимодействие веществ на атомном и молекулярном уровнях. Эти процессы значительно отличаются от привычного нам макроуровня и поэтому требуют специфических подходов, в том числе к «подсчету» и «взвешиванию».
Школьный курс химии включает понятия «моль» и «молярной массы». Они кажутся сложными, но если разобраться, то вы без труда поймете сущность этих понятий и научитесь ими пользоваться при решении задач.
Моль
Понятие «моль» попытаемся разобрать и, самое главное, понять на примере всем знакомой реакции взаимодействия кислорода и водорода. Когда одна молекула O2 соединяется с двумя молекулами H2, получается две молекулы H2O:
- O2 + 2H2 = 2H2O
То есть, чтобы максимально полно провести химическую реакцию, мы должны взять на каждую молекулу кислорода две молекулы водорода. Итак, у нас есть 100 г кислорода.
Сколько понадобится водорода для протекания процесса? И тут возникает первый вопрос: сколько молекул в 100 г кислорода? Наверное, миллиарды или даже миллиарды миллиардов? И сколько их в 100 г водорода? Уж точно в не в 2 раза меньше.
Как вообще подсчитать молекулы, ведь они бывают совершенно разными, «тяжелыми» и «легкими». Этими вопросами задавались и люди, закладывавшие основу современной химической науки.
Был найден простой выход, который помогает легко и изящно решить проблему. Химики решили взять за единицу измерения не одну молекулу, а определенное их количество, причем очень большое. Таким образом эта единица измерения приводит микроуровень к макроуровню. Она называется «моль».
Моль — это количество вещества из 6,02214076⋅1023 атомов или молекул. Оно не имеет физического смысла и изначально было привязано к массе определенного количества (12 граммов) углерода-12, но позже переопределено, как и многие другие единицы системы СИ.
В школьных расчетах количество структурных единиц в моле, которое также называется постоянной Авогадро, обычно округляют до 6,022⋅1023 и обозначают NA.
С этой величиной связано другое химическое понятие — «количество вещества», то есть количество структурных единиц в определенной его порции. Оно обозначается буквой ν (ню).
Примеры
В стакане содержится 2 моль воды. Сколько молекул воды находится в стакане?
- N = ν⋅ NA =2 ⋅ 6,022⋅1023 = 12,044⋅1023 молекул воды.
Также можно решить обратную задачу. Сколько молей вещества составляют 24,088⋅1023 молекул воды?
- ν⋅ = N / NA = 24,088⋅1023 / 6,022⋅1023 = 4 моля.
Что называется молярной массой
Итак, мы поняли, что моль — условное количество вещества, выбранное для удобства химиков. Это даже не миллиарды миллиардов, как мы предположили ранее, а миллиарды триллионов, что никак не облегчает задачу подсчета этих структурных единиц.
Как же все-таки узнать, сколько атомов или молекул в 100 граммах того или иного вещества? Теперь хорошо бы связать количество вещества и его массу, ведь это не одно и то же. Нам поможет «молярная масса» — 1 моль вещества или 6,022⋅1023 структурных единиц этого вещества.
Итак, масса вещества равна массе порции вещества m к количеству молекул ν в его порции:
- М = m / ν.
Вооружившись этим знанием, мы можем переводить граммы в число молекул и наоборот. При этом следует учесть, что молярная масса численно идентична молекулярной массе (то есть массе молекулы), выраженной в атомных единицах массы, и относительной молекулярной массе.
Пример
Найдем массу 5 моль воды.
Чтобы решить эту задачу, обратимся к формуле молярной массы и выразим из нее массу:
- m = М ⋅ ν
В этой формуле мы знаем количество вещества ν = 5 моль, а молярную массу сложной молекулы нужно определить, как сумму молярных масс составляющих ее химических элементов:
- M (H2O) = 2 ⋅M (H) + M (O)
Где взять молярные массы кислорода и водорода (в соединение входит два атома водорода, поэтому его молярную массу умножаем на 2)?
Для этого нам понадобится таблица Менделеева и значение «относительной атомной массы», которая, как мы уже знаем, идентична молекулярной. Это значение приведено для каждого химического элемента и для водорода равно 1,00797 (то есть близко к 1), для углерода — близко к 6, для кислорода — около 16.
Подставим соответствующие значения в исходную формулу и получим:
- M (H2O) = 2 ⋅M (H) + M (O) = 2 ⋅ 1 + 16 = 18 г/моль.
То есть вес 1 моль воды составляет 18 граммов. Теперь можем подсчитать массу 5 моль воды:
- m = М ⋅ ν = 18 ⋅ 5 = 90 г.
Аналогичным образом мы можем подсчитать количество вещества, которое содержится в определенном образце заданной массы. Для примера возьмем оксид алюминия Al2O3 и узнаем, сколько моль в 400 граммах этого вещества. Для этого выразим количество вещества через молярную массу и подставим исходные данные:
- ν = m / М = 400 / (2 ⋅ М (Al) + 3 ⋅ (O)) = 400 / (2 ⋅ 75 + 3 ⋅ 16) = 400 / (150 + 48) = 400 / 198 ≈ 2,02 моль.
Занимайтесь на курсах ЕГЭ и ОГЭ в паре TwoStu и получите максимум баллов на экзамене:

Эксперт по подготовке к ЕГЭ, ОГЭ и ВПР
Задать вопрос
Закончил Московский физико-технический институт (Физтех) по специальности прикладная физика и математика. Магистр физико-математических наук. Преподавательский стаж более 13 лет. Соучредитель курсов ЕГЭ и ОГЭ в паре TwoStu.
Читайте также:
Дмитрий Вюрц
Образование
45
Готовлю к ОГЭ и ЕГЭ по химии онлайн. Выпустил более 2000 учеников, провожу бесплатные и… · 21 окт 2020
По формуле N = N(A) x n, где:
N(A) – постоянная Авогадро, 6,022×10^23 [моль^(-1)]
n – количество молей вещества [моль]
N – количество частиц вещества
Вот так вот 🙂
12,6 K
Комментировать ответ…Комментировать…
Вы знаете ответ на этот вопрос?
Поделитесь своим опытом и знаниями
Войти и ответить на вопрос