Скорость молекул идеального газа
Средняя скорость молекул идеального газа (или средняя квадратичная скорость молекул) вычисляется по формулам, описанным ниже, и измеряется в м/с.
Формула скорости молекул газа
По формуле средней квадратичной скорости молекул вычисляется и скорость молекул идеального газа (v):

где R – универсальная газовая постоянная, равная 8,31, Дж/К•моль;
Т – температура, К;
М – молярная масса, кг/моль;
k – постоянная Больцмана, равная 1,38*10-23, Дж/К;
m – масса одной молекулы идеального газа, кг.
Известно, что молярная масса М равна произведению массы молекулы на число Авогадро 6,02*1023 (моль-1) , т.е. М = Nam.
Скорость молекул газа вычисляется в м/с.
Следовательно, скорость частичек газа зависит от температуры и их массы. Чем выше температура, тем быстрее движутся молекулы газа, а чем они тяжелее, тем медленнее их скорость.
Что такое идеальный газ
Идеальным считается настолько разряженный газ, что в нем можно пренебречь взаимодействием между молекулами. Иными словами в таком газе молекул настолько мало, что между ними почти не происходит столкновений и взаимного притяжения.
При небольшом давлении и не самой низкой температуре обычные газы близки к идеальному состоянию. Например, водород и кислород в обычных условиях можно считать идеальными газами.
Скорость молекул некоторых газов в обычных условиях приведены в таблице:

Средняя скорость молекул
В физике выделяют 2 скорости, характеризующие движение молекул: средняя скорость движения молекул и средняя квадратичная скорость.
Средняя скорость движения молекул
Средняя скорость движения молекул называется также скоростью теплового движения молекул.
Формула средней относительной скорости молекул в физике представлена следующим выражением:
υotn=28kTπm0=2υ.
Средняя квадратичная скорость
Средняя квадратичная скорость движения молекул газа это следующая величина:
υkυ=1N∑i=1Nυi2
Формулу средней квадратичной скорости можно переписать так:
υkυ2=∫0∞υ2Fυdυ.
Проводя интегрирование, аналогичное интегрированию при получении связи средней скорости с температурой газа, получаем:
υkυ=3kTm0=3RTμ
Именно средняя квадратичная скорость поступательного движения молекул газа входит в состав основного уравнения молекулярно-кинетической теории:
p=13nm0υkυ,
где n=NV – это концентрация частиц вещества, N – это количество частиц вещества, V – это объем.
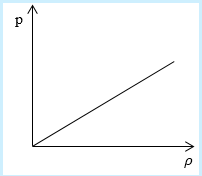
Необходимо определить, как изменяется средняя скорость движения молекул идеального газа с увеличением давления в процессе, изображенном на графике (рисунок 1).
Рисунок 1
Решение
Запишем выражение для средней скорости движения молекул газа следующим образом:
υ=8kTπm0
Из графика видно, что p~ρ или p=Cρ, где C – это некоторая константа.
m0=ρn, p=nkT=Cρ→kT=Cρn
Подставив m0=ρn, p=nkT=Cρ→kT=Cρn в υ=8kTπm0, получаем:
υ=8kTπm0=8Cρπnnρ=8Cπ
Ответ: В процессе, представленном на графике, с увеличением давления средняя скорость движения молекул не меняется.
Можно ли найти среднюю квадратичную скорость молекулы идеального газа, если известно: давление газа (p), молярная масса газа (μ), а также концентрация молекул газа (n)?
Решение
Применим выражение для υkυ:
υkυ=3RTμ
Помимо этого, из уравнения Менделеева-Клайперона и зная, что mμ=NNA:
pV=mμRT=NNART.
Поделим правую и левую части pV=mμRT=NNART на V, и зная NV=n, получаем:
p=nNART→RT=pNAn
Подставляем p=nNART→RT=pNAn в выражение для среднеквадратичной скорости υkυ=3RTμ, получаем:
υkυ=3pNAμn
Ответ: По заданным в условии задачи параметрам среднеквадратичная скорость движения молекул газа вычисляется при помощи формулы υkυ=3pNAμn.
Для характеристики движения молекул в физике используют две скорости: среднюю и среднюю квадратичную скорость молекул.
Важно. Следует обязательно понимать, что в реальных условиях мы не можем точно знать ни конкретное число молекул в системе, ни тем более скорость каждой из них в конкретный момент времени. Это обусловлено неимоверно гигантским числом частиц в реальных и даже сколько-нибудь приближенных к ним системах. Например, в 1 см3 при давлении 200 мм. рт. ст. содержится 4,18*1018 молекул водорода. Говоря более понятными категориями, это более чем 4 миллиарда миллиардов. Заметим, что указанное давление меньше атмосферного почти в 4 раза. Последнее в среднем равняется 760 мм. рт. ст. Разрежённый водород по своим свойствам наиболее близок к идеальному газу. В данном случае физика вынуждена иметь дело с распределениями скоростей и энергий частиц.
Что такое средняя скорость движения молекул
Среднюю скорость движения молекул часто именуют скоростью их теплового движения.
Определение 1
Вид формулы средней относительной скорости молекул в физике можно представить выражением:
[text { Vотн }=sqrt{2} sqrt{frac{8 R T}{pi m_{0}}}]
Выражение под корнем – средняя скорость молекул идеального газа.
Как определить среднюю квадратичную скорость движения молекул
Определение 2
Средней квадратичной скоростью молекул идеального газа называют величину равную квадратному корню из среднего арифметического величины квадратов скоростей каждой из молекул.
Средняя скорость молекул равна:
[leftlanglemathrm{V}_{mathrm{KB}}rightrangle=sqrt{frac{1}{N} sum_{i=1}^{N} v_{i}^{2}}]
Если обе её части возвести в квадрат и проинтегрировать, то получим выражение:
[langlemathrm{VKB}rangle^{2}=int_{0}^{infty} v^{2} F(v) d v]
Ещё одно выражение для среднеквадратичной скорости:
[leftlangle V_{K B}rightrangle=sqrt{frac{3 k T}{m_{0}}}=sqrt{frac{3 R T}{mu}}]
Именно она присутствует в уравнении, именуемом основным уравнением молекулярно-кинетической теории
P = (1/3)nm*<Vкв>
Где n – концентрация молекул, которая вычисляется делением их общего числа на объём.
Пример. 1.
Рассмотрим простейший случай, чтобы использование интегрирования не затруднило понимание сути явления и помогло лучше понять материал. Вычислим как меняется средняя скорость движения молекул в идеальном газе при линейном увеличении его давления. График следующий:
Напомним, что средняя скорость частиц:
[mathrm{Vcp}=sqrt{frac{8 R T}{pi m_{0}}}]
Если присмотреться к представленному графику, то можно заметить, что P приблизительно равно ρ. Эти две величины можно связать соотношением
P=C*ρ
Где С – некоторая постоянная величина, константа.
Далее считаем m0= ρ/n, p = n*k*T = C* ρ. Отсюда следует, что k*T = (C*ρ)/n.
Нужно лишь подставить эти значения в формулу для средней скорости:
[V c p=sqrt{8 mathrm{kT} / pi mathrm{m}}=sqrt{(8 mathrm{C} rho / pi mathrm{n})(mathrm{n} / rho)}=sqrt{8 mathrm{C} / pi}]
В полученном выражении нет ни одной переменной величины, т. е. при увеличении давления, вопреки ожиданиям, скорость оказалась неизменной.
Ответ: В процессе, который был дан нам на графике, при увеличении давления средняя скорость молекул никак не меняется.
Нет времени решать самому?
Наши эксперты помогут!
Пример. 2.
Определим среднюю квадратичную скорость молекул газа при условии, что нам известны его давление (P), молярная масса (M) и концентрация частиц (n).
Воспользуемся формулой:
[leftlanglemathrm{V}_{kappa в}rightrangle=sqrt{frac{3 k T}{m_{0}}}=sqrt{frac{3 R T}{mu}}]
Также нам потребуется уравнение Менделеева-Клайперона
Здесь мы воспользовались тем, что:
m/μ = N/Na
PV = (m/μ)*RT = (N/Na)*RT
Если обе части этого уравнения поделить на V и принять во внимание, что
(N/V) = n, то можно получить
P = (n/Na)*RT. Отсюда находим, что RT = (p*N)/n
Если мы это подставим в выражение для среднеквадратичной скорости [leftlangle V_{K B}rightrangle=sqrt{3 mathrm{kT} / mathrm{m}_{0}}=sqrt{3 mathrm{RT} / mu}], получим, что средняя квадратичная скорость движения молекул газа: [leftlangle V_{K B}rightrangle=sqrt{left(3 rho N_{a}right) /(mu mathrm{n})}]
Ответ: Формула средней квадратичной скорости молекул исходя из данный нам условий следующая:
[leftlangle V_{K B}rightrangle=sqrt{left(3 rho N_{a}right) /(mu mathrm{n})}]
Понятие
идеального газа. Уравнение состояния
идеального газа. Основное уравнение
молекулярно-кинетической теории
идеального газа (вывод). Средняя
квадратичная скорость движения молекул
газа.
Идеальный
газ – это
такой газ, взаимодействием между
молекулами которого можно пренебречь.
Соотношение,
определяющее связь между параметрами
состояния какого-либо тела, называется
уравнением
состояния идеального газа.
|
F(p,V,T)=0 |
Основное
уравнение молекулярно-кинетической
теории идеального газа (вывод)
Средняя
квадратичной скоростью поступательного
движения молекул газа называется корень
квадратный из среднего арифметического
значения квадратов скоростей
поступательного движения всех его
молекул:
|
Vкв.=√1/N |
14.Распределение молекул идеального газа по скоростям хаотического теплового движения.
Функция
распределения Максвелла и ее физический
смысл. График функции распределения
молекул по скоростям движения. Наиболее
вероятная, средняя арифметическая,
среднеквадратичная скорость.
Закон
Максвелла описывается некоторой функцией
f(v),
называемой
функцией
распределения
молекул по скоростям.
Если разбить диапазон скоростей молекул
на малые интервалы, равные dv,
то на каждый интервал скорости будет
приходиться некоторое число молекул
dN(v),
имеющих скорость, заключенную в этом
интервале. Функция f(v)
определяет относительное число молекул
dN(v)/N,
скорости которых лежат в интервале от
v
до v+dv,
т.
е. dN(v)/N=¦(v)dv,
откуда
|
¦(v)= |
(2.32) |
Применяя
методы теории вероятностей, Максвелл
нашел функцию f(v)–
закон о распределении молекул идеального
газа по скоростям:
|
¦(v) |
(2.33) |
Из
(2.33) видно, что конкретный вид функции
зависит от рода газа (от массы молекулы)
и от параметра состояния (от температуры
T).
График
функции (2.33) приведен на рисунке 2.6.
Рисунок
2.6
Так
как при возрастании v
множитель exp[-m0v2/(2kT)]
уменьшается быстрее,
чем
растет множитель v2,
то функция ¦(v)
начинаясь от нуля, достигает максимума
при vВ,
и затем асимптотически стремится к
нулю. Кривая несимметрична относительно
vВ.
Относительное
число молекул dN(v)/N,
скорости которых лежат в интервале от
v
до v+dv,
находится как площадь заштрихованной
полоски на рисунке 2.6. Площадь, ограниченная
кривой распределения и осью абсцисс,
равна единице. Это означает, что функция
¦(v)
удовлетворяет условию нормировки
|
|
(2.34) |
Скорость,
при которой функция распределения
молекул идеального газа по скоростям
максимальна, называется
наиболее вероятной скоростью.
Значение наиболее вероятной скорости
можно найти, продифференцировав выражение
(2.33) (постоянные множители опускаем) по
аргументу v,
приравняв результат нулю и используя
условие для максимума выражения ¦(v):
|
|
(2.35) |
Значения
v
=
0 и v
=
¥ соответствуют минимумам выражения
(2.33), а значение v,
при котором выражение в скобках становится
равным нулю, и есть искомая наиболее
вероятная скорость vВ:
|
vВ |
(2.36) |
Из
формулы (2.36) следует, что при повышении
температуры максимум функции распределения
молекул по скоростям (рисунок 2.7) сместится
вправо (значение наиболее вероятной
скорости становится больше). Однако
площадь, ограниченная кривой, остается
неизменной, поэтому при повышении
температуры кривая распределения
молекул по скоростям будет растягиваться
и понижаться.
Рисунок
2.7
Средняя
арифметическая скорость молекулы <v>
определяется по формуле
|
|
(2.37) |
Подставляя
сюда f(v)
и интегрируя, получаем
|
|
(2.38) |
Скорости,
характеризующие состояние газа:
1)
наиболее вероятная
;
2)
средняя
;
3)
средняя квадратичная
.
Исходя
из распределения молекул по скоростям
|
|
(2.39) |
можно
найти распределение молекул газа по
значениям кинетической энергии
.
Для этого перейдем от переменнойv
к переменной
.
Подставив в (2.39)и
получим
|
|
(2.40) |
где
dN
(e) – число молекул, имеющих кинетическую
энергию поступательного движения,
заключенную в интервале от e
до e+de.
Таким
образом, функция
распределения молекул по энергиям
теплового движения
|
|
(2.41) |
Средняя
кинетическая энергия <e
> молекулы идеального газа
|
|
Соседние файлы в папке шпоргалка
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
24.01.2014730.62 Кб106шпора_оптика.doc
Определение средней квадратичной скорости молекул газа
Содержание:
- Средняя квадратичная скорость молекул газа — что это за параметр
- От каких величин зависит в идеальном газе
-
Формула средней квадратичной скорости молекул
- Как посчитать в зависимости от природы газа и температуры?
Средняя квадратичная скорость молекул газа — что это за параметр
Молекулы любого газа пребывают в постоянном движении. Его можно охарактеризовать с точки зрения средней их скорости или средней квадратичной скорости. Первое понятие имеет специальный термин — скорость теплового движения. Второе — средняя квадратичная скорость — величина, для которой существует специальная формула.
Для того, чтобы полностью разобраться в понятии средней квадратичной скорости молекул газа, вводится условный участник процесса — идеальный газ.
Определение
Идеальный газ — это математическая модель, потенциальную энергию которой принимают за ноль, а кинетическую характеризуют в полном объеме. Идеальный газ подходит в качестве модели окружающих нас газов, например, обычного воздуха.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Определение
Средняя квадратичная скорость — физическая величина, отличная от средней арифметической скорости молекул, определяемая по формуле: корень квадратный из средней арифметической квадратов скоростей различных молекул.
Кинетическая энергия определяется скоростью движения молекул, поэтому зависит от температуры. Скорости молекул одного газа не одинаковы. Часть молекул движутся очень быстро, часть — с незначительной скоростью. Однако для большинства существует некое среднее значение. Если изобразить это на графике в виде параболы, такие молекулы со средней скоростью будут составлять ее верхнюю часть.
В единице объема газа содержится огромное число молекул. Поэтому, например, его давление на стенки сосуда — величина постоянная. В ином случае, если бы в единицу времени о стенку ударялось различное количество молекул, давление бы «скакало».
Из изложенного можно сделать вывод: скорость — свойство отдельной молекулы газа, а давление — характеристика их совокупности.
От каких величин зависит в идеальном газе
Для идеального газа средняя квадратичная скорость прямо пропорциональна его температуре и обратно пропорциональна молярной массе газа.
В математическом выражении данная зависимость выражается через корень квадратный:
(V=surd(3RT/mu)
)
где R — универсальная постоянная величина, Т — температура газа, μ — молярная масса.
Из формулы видно, что искомая величина (средняя квадратичная скорость) зависит от природных свойств газа и его температуры.
Формула средней квадратичной скорости молекул
Математическое выражение формулы выглядит следующим образом:
(V_{ср;кв}=surd(V_{12}+V_{22}+V_{n2})/N)
В формуле присутствуют следующие условные обозначения: V1, V2, Vn — скорости молекул, а N — их количество.
Формула может иметь и другой вид:
(V_{ср;кв}=surd1/Nastsum V_2)
или
(V_{ср;кв}=int V_2F(V)dV)
Как посчитать в зависимости от природы газа и температуры?
Проведенное интегрирование формулы, цель которого определить зависимость искомой единицы от природных свойств иттемпературы газа, приводит расчеты к формуле:
(V_{ср;кв}=surd(3kT/mo))
или
(V_{ср;кв}=surd(3RT/mu))
При поступательном движении молекул газа Vср кв — составляющая уравнения для молекулярно-кинетической теории.
Если n=N/V, где N — число частиц, а V — объем, то концентрация частиц n получает следующее формульное выражение:
(p=1/3ast nmo(V_{ср;кв})^2)
Насколько полезной была для вас статья?
Рейтинг: 2.33 (Голосов: 3)
Выделите текст и нажмите одновременно клавиши «Ctrl» и «Enter»
Текст с ошибкой:
Расскажите, что не так


 v2exp[-m0v2/(2kT)]
v2exp[-m0v2/(2kT)] 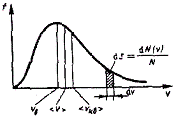


 .(
.( ,
,
