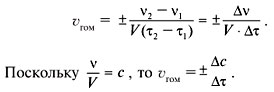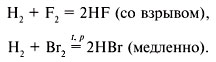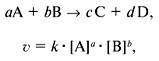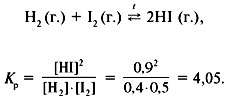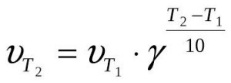Гомогенные и гетерогенные химические реакции
Химические реакции протекают с различными скоростями: с малой скоростью — при образовании сталактитов и сталагмитов, со средней скоростью — при варке пищи, мгновенно — при взрыве. Очень быстро проходят реакции в водных растворах, практически мгновенно. Смешаем растворы хлорида бария и сульфата натрия — сульфат бария в виде осадка образуется немедленно. Быстро, но не мгновенно, горит сера, магний растворяется в соляной кислоте, этилен обесцвечивает бромную воду. Медленно образуется ржавчина на железных предметах, налет на медных и бронзовых изделиях, медленно гниет листва, разрушаются зубы.
Предсказание скорости химической реакции, а также выяснение ее зависимости от условий проведения процесса — задача химической кинетики — науки о закономерностях протекания химических реакций во времени.
Если химические реакции происходят в однородной среде, например, в растворе или в газовой фазе, то взаимодействие реагирующих веществ происходит во всем объеме. Такие реакции, как вы знаете, называют гомогенными.
Скорость гомогенной реакции ($v_{гомог.}$) определяется как изменение количества вещества в единицу времени в единице объема:
$υ_{гомог.}={∆n}/{∆t·V},$
где $∆n$ — изменение числа молей одного вещества (чаще всего исходного, но может быть и продукта реакции); $∆t$ — интервал времени (с, мин.); $V$ — объем газа или раствора (л).
Поскольку отношение количества вещества к объему представляет собой молярную концентрацию $С$, то
${∆n}/{V}=∆C.$
Таким образом, скорость гомогенной реакции определяется как изменение концентрации одного из веществ в единицу времени:
$υ_{гомог.}={∆C}/{∆t}[{моль}/{л·с}]$
если объем системы не меняется. Если реакция идет между веществами, находящимися в разных агрегатных состояниях (например, между твердым веществом и газом или жидкостью), или между веществами, неспособными образовывать гомогенную среду (например, между несмешивающимися жидкостями), то она проходит только на поверхности соприкосновения веществ. Такие реакции называют гетерогенными.
Скорость гетерогенной реакции определяется как изменение количества вещества в единицу времени на единице поверхности:
$υ_{гомог.}={∆C}/{∆t·S}[{моль}/{c·м^2}]$
где $S$ — площадь поверхности соприкосновения веществ ($м^2, см^2$).
Если при какой-либо протекающей реакции экспериментально измерять концентрацию исходного вещества в разные моменты времени, то графически можно отобразить ее изменение с помощью кинетической кривой для этого реагента.
Скорость реакции не является постоянной величиной. Мы указывали лишь некоторую среднюю скорость данной реакции в определенном интервале времени.
Представьте себе, что мы определяем скорость реакции
$H_2+Cl_2→2HCl$
а) по изменению концентрации $Н_2$;
б) по изменению концентрации $HCl$.
Одинаковые ли мы получим значения? Ведь из $1$ моль $Н_2$ образуется $2$ моль $HCl$, поэтому и скорость в случае б) окажется больше в два раза. Следовательно, значение скорости реакции зависит и от того, по какому веществу ее определяют.
Изменение количества вещества, по которому определяют скорость реакции, — это внешний фактор, наблюдаемый исследователем. По сути, все процессы осуществляются на микроуровне. Очевидно, для того, чтобы какие-то частицы прореагировали, они прежде всего должны столкнуться, причем столкнуться эффективно: не разлететься, как мячики, в разные стороны, а так, чтобы в частицах разрушились или ослабли старые связи и смогли образоваться новые, а для этого частицы должны обладать достаточной энергией.
Расчетные данные показывают, что, например, в газах столкновения молекул при атмосферном давлении исчисляются миллиардами за $1$ секунду, т.е. все реакции должны были бы идти мгновенно. Но это не так. Оказывается, что лишь очень небольшая доля молекул обладает необходимой энергией, приводящей к эффективному соударению.
Минимальный избыток энергии, который должна иметь частица (или пара частиц), чтобы произошло эффективное соударение, называют энергией активации $E_a$.
Таким образом, на пути всех частиц, вступающих в реакцию, имеется энергетический барьер, равный энергии активации $E_a$. Когда он мал, то находится много частиц, которые могут его преодолеть, и скорость реакции велика. В противном случае требуется толчок. Когда вы подносите спичку, чтобы зажечь спиртовку, вы сообщаете дополнительную энергию $E_a$, необходимую для эффективного соударения молекул спирта с молекулами кислорода (преодоление барьера).
В заключение сделаем вывод: многие возможные реакции практически не идут, т.к. высока энергия активации.
Это имеет огромное значение для нашей жизни. Представьте, что бы случилось, если бы все термодинамически разрешенные реакции могли идти, не имея никакого энергетического барьера (энергии активации). Кислород воздуха прореагировал бы со всем, что может гореть или просто окисляться. Пострадали бы все органические вещества, они превратились бы в углекислый газ $CO_2$ и воду $H_2O$.
Скорость химической реакции зависит от многих факторов. Основными из них являются: природа и концентрация реагирующих веществ, давление (в реакциях с участием газов), температура, действие катализаторов и поверхность реагирующих веществ в случае гетерогенных реакций. Рассмотрим влияние каждого из этих факторов на скорость химической реакции.
Температура
Вам известно, что при повышении температуры в большинстве случаев скорость химической реакции значительно возрастает. В XIX в. голландский химик Я. Х. Вант-Гофф сформулировал правило:
Повышение температуры на каждые $10°С$ приводит к увеличению скорости реакции в 2–4 раза (эту величину называют температурным коэффициентом реакции).
При повышении температуры средняя скорость молекул, их энергия, число столкновений увеличиваются незначительно, зато резко повышается доля активных молекул, участвующих в эффективных соударениях, преодолевающих энергетический барьер реакции.
Математически эта зависимость выражается соотношением:
$υ_{t_2}=υ_{t_1}γ^{{t_2-t_1}/{10}},$
где $υ_{t_1}$ и $υ_{t_2}$ — скорости реакции соответственно при конечной $t_2$ и начальной $t_1$ температурах, а $γ$ — температурный коэффициент скорости реакции, который показывает, во сколько раз увеличивается скорость реакции с повышением температуры на каждые $10°С$.
Однако для увеличения скорости реакции повышение температуры не всегда применимо, т.к. исходные вещества могут начать разлагаться, могут испаряться растворители или сами вещества.
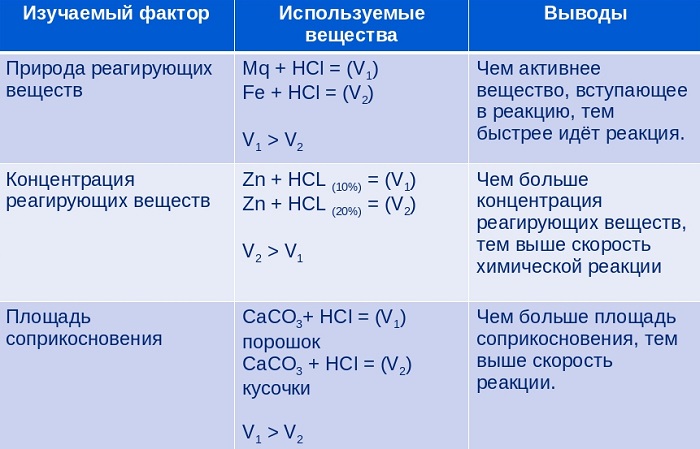
Концентрация реагирующих веществ
Изменение давления при участии в реакции газообразных веществ также приводит к изменению концентрации этих веществ.
Чтобы осуществилось химическое взаимодействие между частицами, они должны эффективно столкнуться. Чем больше концентрация реагирующих веществ, тем больше столкновений и, соответственно, выше скорость реакции. Например, в чистом кислороде ацетилен сгорает очень быстро. При этом развивается температура, достаточная для плавления металла. На основе большого экспериментального материала в 1867 г. норвежцами К. Гульденбергом и П. Вааге и независимо от них в 1865 г. русским ученым Н. И. Бекетовым был сформулирован основной закон химической кинетики, устанавливающий зависимость скорости реакции от концентрации реагирующих веществ.
Скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных их коэффициентам в уравнении реакции.
Этот закон называют также законом действующих масс.
Для реакции $А+В=D$ этот закон выражается так:
$υ_1=k_1·C_A·C_B$
Для реакции $2А+В=D$ этот закон выражается так:
$υ_2=k_2·C_A^2·C_B$
Здесь $С_А, С_В$ — концентрации веществ $А$ и $В$ (моль/л); $k_1$ и $k_2$ — коэффициенты пропорциональности, называемые константами скорости реакции.
Физический смысл константы скорости реакции нетрудно установить — она численно равна скорости реакции, в которой концентрации реагирующих веществ равны $1$ моль/л или их произведение равно единице. В таком случае ясно, что константа скорости реакции зависит только от температуры и не зависит от концентрации веществ.
Закон действующих масс не учитывает концентрации реагирующих веществ, находящихся в твердом состоянии, т.к. они реагируют на поверхности, и их концентрации обычно являются постоянными.
Например, для реакции горения угля
$C+O_2=CO_2$
выражение скорости реакции должно быть записано так:
$υ=k·C_{O_2}$,
т. е. скорость реакции пропорциональна только концентрации кислорода.
Если же уравнение реакции описывает лишь суммарную химическую реакцию, проходящую в несколько стадий, то скорость такой реакции может сложным образом зависеть от концентраций исходных веществ. Эта зависимость определяется экспериментально или теоретически на основании предполагаемого механизма реакции.
Действие катализаторов
Можно увеличить скорость реакции, используя специальные вещества, которые изменяют механизм реакции и направляют ее по энергетически более выгодному пути с меньшей энергией активации. Их называют катализаторами (от лат. katalysis — разрушение).
Катализатор действует как опытный проводник, направляющий группу туристов не через высокий перевал в горах (его преодоление требует много сил и времени и не всем доступно), а по известным ему обходным тропам, по которым можно преодолеть гору значительно легче и быстрее. Правда, по обходному пути можно попасть не совсем туда, куда ведет главный перевал. Но иногда именно это и требуется! Именно так действуют катализаторы, которые называют селективными. Ясно, что нет необходимости сжигать аммиак и азот, зато оксид азота (II) находит применение в производстве азотной кислоты.
Катализаторы — это вещества, участвующие в химической реакции и изменяющие ее скорость или направление, но по окончании реакции остающиеся неизменными количественно и качественно.
Изменение скорости химической реакции или ее направления с помощью катализатора называют катализом. Катализаторы широко используют в различных отраслях промышленности и на транспорте (каталитические преобразователи, превращающие оксиды азота выхлопных газов автомобиля в безвредный азот).
Различают два вида катализа.
Гомогенный катализ, при котором и катализатор, и реагирующие вещества находятся в одном агрегатном состоянии (фазе).
Гетерогенный катализ, при котором катализатор и реагирующие вещества находятся в разных фазах. Например, разложение пероксида водорода в присутствии твердого катализатора оксида марганца (IV):
$2H_2O_2{→}↖{MnO_2(I)}2H_2O_{(ж)}+O_2↑(г)$
Сам катализатор не расходуется в результате реакции, но если на его поверхности адсорбируются другие вещества (их называют каталитическими ядами), то поверхность становится неработоспособной, требуется регенерация катализатора. Поэтому перед проведением каталитической реакции тщательно очищают исходные вещества.
Например, при производстве серной кислоты контактным способом используют твердый катализатор — оксид ванадия (V) $V_2O_5$:
$2SO_2+O_2⇄2SO_3$
При производстве метанола используют твердый цинкохромовый катализатор ($8ZnO·Cr_2O_3×CrO_3$):
$CO_{(г)}+2H_{2(г)}⇄CH_3OH_{(г)}$
Очень эффективно работают биологические катализаторы — ферменты. По химической природе это белки. Благодаря им в живых организмах при невысокой температуре с большой скоростью протекают сложные химические реакции. Ферменты отличаются особой специфичностью, каждый из них ускоряет только свою реакцию, идущую в нужное время и в нужном месте с выходом, близким к $100%$. Создание аналогичных ферментам искусственных катализаторов — мечта химиков!
Вы, конечно, слышали и о других интересных веществах — ингибиторах (от лат. inhibere — задерживать). Они с высокой скоростью реагируют с активными частицами с образованием малоактивных соединений. В результате реакция резко замедляется и затем прекращается. Ингибиторы часто специально добавляют в разные вещества, чтобы предотвратить нежелательные процессы.
Например, с помощью ингибиторов стабилизируют растворы пероксида водорода, мономеры для предотвращения преждевременной полимеризации, соляную кислоту, чтобы была возможность ее транспортировки в стальной таре. Ингибиторы содержатся и в живых организмах, они подавляют различные вредные реакции окисления в клетках тканей, которые могут инициироваться, например, радиоактивным излучением.
Природа реагирующих веществ (их состав, строение)
Значение энергии активации является тем фактором, посредством которого сказывается влияние природы реагирующих веществ на скорость реакции.
Если энергия активации мала ($< 40$ кДж/моль), то это означает, что значительная часть столкновений между частицами реагирующих веществ приводит к их взаимодействию, и скорость такой реакции очень большая. Все реакции ионного обмена протекают практически мгновенно, ибо в этих реакциях участвуют разноименно заряженные ионы, и энергия активации в этих случаях ничтожно мала.
Если энергия активации велика ($> 120$ кДж/моль), то это означает, что лишь ничтожная часть столкновений между взаимодействующими частицами приводит к реакции. Скорость такой реакции поэтому очень мала. Например, протекание реакции синтеза аммиака при обычной температуре заметить практически невозможно.
Если энергии активации имеют промежуточные значения ($40–120$ кДж/моль), то скорости таких реакций будут средними. К таким реакциям можно отнести взаимодействие натрия с водой или этиловым спиртом, обесцвечивание бромной воды этиленом, взаимодействие цинка с соляной кислотой и др.
Поверхность соприкосновения реагирующих веществ
Скорость реакций, идущих на поверхности веществ, т.е. гетерогенных, зависит при прочих равных условиях от свойств этой поверхности. Известно, что растертый в порошок мел гораздо быстрее растворяется в соляной кислоте, чем равный по массе кусочек мела.
Увеличение скорости реакции объясняется, в первую очередь, увеличением поверхности соприкосновения исходных веществ, а также рядом других причин, например, разрушением структуры правильной кристаллической решетки. Это приводит к тому, что частицы на поверхности образующихся микрокристаллов значительно реакционноспособнее, чем те же частицы на гладкой поверхности.
В промышленности для проведения гетерогенных реакций используют кипящий слой, чтобы увеличить поверхность соприкосновения реагирующих веществ, подвод исходных веществ и отвод продуктов. Например, при производстве серной кислоты с помощью кипящего слоя проводят обжиг колчедана; в органической химии с применением кипящего слоя проводят каталитический крекинг нефтепродуктов и регенерацию (восстановление) вышедшего из строя (закоксованного) катализатора.
И.В.ТРИГУБЧАК
Пособие-репетитор по химии
ЗАНЯТИЕ 10
10-й класс (первый год обучения)
Продолжение. Начало см. в № 22/2005; 1, 2, 3, 5, 6, 8, 9, 11, 13, 15, 16, 18/2006
Основы химической кинетики.
Состояние химического равновесия
План

Химическая кинетика и область ее изучения.
2. Скорость гомогенной и гетерогенной реакции.
3. Зависимость скорости реакции от различных
факторов: природы реагирующих веществ,
концентрации реагентов (закон действующих масс),
температуры (правило Вант-Гоффа), катализатора.
4. Обратимые и необратимые химические реакции.
5. Химическое равновесие и условия его смещения.
Принцип Ле Шателье.
Раздел химии, изучающий скорости и механизмы
протекания химических реакций, называется
химической кинетикой. Одним из основных в этом
разделе является понятие скорости химической
реакции. Одни химические реакции протекают
практически мгновенно (например, реакция
нейтрализации в растворе), другие – в течение
тысячелетий (например, превращение графита в
глину при выветривании горных пород).
Скорость гомогенной реакции – это количество
вещества, вступающего в реакцию или
образующегося в результате реакции за единицу
времени в единице объема системы:
Другими словами, скорость гомогенной реакции
равна изменению молярной концентрации
какого-либо из реагирующих веществ за единицу
времени. Скорость реакции – величина
положительная, поэтому в случае выражения ее
через изменение концентрации продукта реакции
ставят знак «+», а при изменении концентрации
реагента знак «–».
Скорость гетерогенной реакции – это
количество вещества, вступающего в реакцию или
образующегося в результате реакции за единицу
времени на единице поверхности фазы:
Важнейшие факторы, влияющие на скорость
химической реакции, – природа и концентрация
реагентов, температура, присутствие
катализатора.
Влияние природы реагентов проявляется в
том, что при одних и тех же условиях различные
вещества взаимодействуют друг с другом с разной
скоростью, например:
При увеличении концентрации реагентов
увеличивается число столкновений между
частицами, что приводит к увеличению скорости
реакции. Количественно зависимость скорости
реакции от концентрации реагентов выражается з а
к о н о м д е й с т в у ю щ и х м а с с
(К.М.Гульдберг и П.Вааге, 1867 г.; Н.И.Бекетов, 1865 г.). Скорость
гомогенной химической реакции при постоянной
температуре прямо пропорциональна произведению
концентрации реагирующих веществ в степенях,
равных их стехиометрическим коэффициентам
(концентрации твердых веществ при этом не
учитываются), например:
где А и В – газы или жидкости, k – константа
скорости реакции, равная скорости реакции при
концентрации реагентов 1 моль/л. Константа k
зависит от свойств реагирующих веществ и
температуры, но не зависит от концентрации
веществ.
Зависимость скорости реакции от температуры
описывается экспериментальным п р а в и л о м
В а н т-Г о ф ф а (1884 г.). При повышении температуры
на 10°, скорость большинства химических реакций
увеличивается в 2–4 раза:
где –
температурный коэффициент.
Катализатором называется вещество,
изменяющее скорость химической реакции, но не
расходующееся в результате этой реакции.
Различают положительные катализаторы
(специфические и универсальные), отрицательные
(ингибиторы) и биологические (ферменты, или
энзимы). Изменение скорости реакции в
присутствии катализаторов называется катализом.
Различают гомогенный и гетерогенный катализ.
Если реагенты и катализатор находятся в одном
агрегатном состоянии, катализ является
гомогенным; в разных – гетерогенным.
Гомогенный катализ:
гетерогенный катализ:
Механизм действия катализаторов является
очень сложным и не изученным до конца. Существует
гипотеза об образовании промежуточных
соединений между реагентом и катализатором:
А + кат. [A кат.],
[A кат.] + В АВ + кат.
Для усиления действия катализаторов применяют
промоторы; существуют также каталитические яды,
ослабляющие действие катализаторов.
На скорость гетерогенной реакции влияют величина
поверхности раздела фаз (степень
измельченности вещества) и скорость подвода
реагентов и отвода продуктов реакции от
поверхности раздела фаз.
Все химические реакции делятся на два типа:
обратимые и необратимые.
Необратимыми называются химические реакции,
протекающие только в одном направлении, т.е.
продукты этих реакций не взаимодействуют друг с
другом с образованием исходных веществ. Условия
необратимости реакции – образование осадка,
газа или слабого электролита. Например:
BaCl2 + H2SO4 = BaSO4 + 2HCl,
K2S + 2HCl = 2KCl + H2S,
HCl + NaOH = NaCl + H2O.
Обратимыми называются реакции, протекающие
одновременно в прямом и обратном направлениях,
например:
При протекании обратимой химической реакции
скорость прямой реакции вначале имеет
максимальное значение, а затем уменьшается
вследствие уменьшения концентрации исходных
веществ. Обратная реакция, наоборот, в начальный
момент времени имеет минимальную скорость,
которая постепенно увеличивается. Таким образом,
в определенный момент времени наступает состояние
химического равновесия, при котором скорость
прямой реакции равна скорости обратной реакции.
Состояние химического равновесия является
динамическим – продолжают протекать как прямая,
так и обратная реакции, но поскольку скорости их
равны, то концентрации всех веществ в
реакционной системе не изменяются. Эти
концентрации называются равновесными.
Отношение констант скоростей прямой и
обратной реакций является постоянной величиной
и называется константой равновесия (Кр).
Концентрации твердых веществ не входят в
выражение константы равновесия. Константа
равновесия реакции зависит от температуры и
давления, но не зависит от концентрации
реагирующих веществ и от присутствия
катализатора, который ускоряет ход как прямой,
так и обратной реакции. Чем больше Кр, тем
выше практический выход продуктов реакции. Если Кр
> 1, то в системе преобладают продукты реакции;
если Кр < 1, в системе преобладают
реагенты.
Химическое равновесие является подвижным, т.е.
при изменении внешних условий может
увеличиваться скорость прямой или обратной
реакции. Направление смещения равновесия
определяется п р и н ц и п о м, сформулированным
французским ученым Ле Шателье в 1884 г. Если на
равновесную систему оказывается внешнее
воздействие, то равновесие смещается в сторону
той реакции, которая противодействует этому
воздействию. На смещение равновесия влияют
изменения концентрации реагентов, температуры и
давления.
Увеличение концентрации реагентов и вывод
продуктов приводят к смещению равновесия в
сторону прямой реакции.
При нагревании системы равновесие смещается в
сторону эндотермической реакции, при охлаждении
– в сторону экзотермической.
Для реакций, в которых принимают участие
газообразные вещества, повышение давления
смещает равновесие в сторону реакции,
протекающей с уменьшением числа молекул газа.
Если реакция протекает без изменения числа
молекул газообразных веществ, то изменение
давления никак не влияет на смещение равновесия.
Тест по теме «Основы химической
кинетики.
Состояние химического равновесия»

В некоторой реакции температурный коэффициент
равен 2. При повышении температуры от 0 до 50 °С
скорость этой реакции увеличится в число раз:
а) 4; б) 16; в) 32; г) 64.
2. При повышении давления в 5 раз скорость
реакции образования йодоводорода из простых
веществ возрастет в число раз:
а) 5; б) 10; в) 25; г) 125.
3. Реакция при температуре 20 °С протекает
за 6 мин 45 с. При температуре 60 °C (коэффициент
Вант-Гоффа для данной реакции равен 3) эта же
реакция закончится через (в с):
а) 5; б) 15; в) 20; г) 25.
4. Реакция при температуре 30 °С протекает
за 2 мин 40 с, а при температуре 70 °С эта же
реакция протекает за 10 с. Температурный
коэффициент данной реакции равен:
а) 1,5; б) 2; в) 2,5; г) 3.
5. Из перечисленных реакций выбрать ту,
которая протекает с максимальной скоростью.
а) Образование хлорида серебра из нитрата
серебра и хлорида натрия в растворе;
б) окисление этанола в организме человека;
в) брожение глюкозы;
г) коррозия железа во влажном воздухе.
6. На смещение равновесия в ходе реакции
восстановления оксида железа(III) водородом
оказывает влияние:
а) изменение давления;
б) введение катализатора;
в) удаление из сферы реакции образующихся
продуктов;
г) изменение температуры.
7. Катализ может быть:
а) окислительно-восстановительным;
б) биологическим;
в) гомогенным;
г) гетерогенным.
8. Ингибитором называют:
а) биологический катализатор;
б) отрицательный катализатор;
в) положительный катализатор;
г) совсем не катализатор.
9. Для какой из перечисленных реакций
давление не влияет на смещение равновесия?
а) Образование воды из простых веществ;
б) образование аммиака из простых веществ;
в) образование метана из простых веществ;
г) образование бромоводорода из простых
веществ.
10. Две реакции протекают с одинаковой
скоростью при 30 °С, коэффициенты Вант-Гоффа
для этих реакций 3 и 5 соответственно. Отношение
скоростей этих реакций, протекающих при 60 °С,
равно:
а) 5,0; б) 4,63; в) 1,67; г) 0,22.
Ключ к тесту
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| в | в | а | б | а | в, г | б, в, г | б | г |
г |
Задачи и упражнения по
химической кинетике
Скорость химической реакции. Закон
действующих масс (закон Гульдберга и Вааге)

Как изменится скорость образования диоксида
азота в реакции оксида азота(II) с кислородом, если
давление в системе увеличить в 3 раза, а
температуру оставить неизменной?
Ответ. Возрастет в 27 раз.
2. Как изменится скорость элементарной
реакции А2 + 2В2 = 2АВ2,
протекающей в газовой фазе в закрытом сосуде,
если увеличить давление в 6 раз?
Решение
Для реакции, описываемой уравнением:
А2 + 2В2 = 2АВ2,
скорость реакции:
1 =
k•[A2]•[B2]2.
При увеличении давления в сосуде в 6 раз
концентрации всех веществ также возрастут в 6
раз. Выражение для скорости реакции примет вид:
2 =
k•6[A2]•(6[B2])2 = 216k•[A2]•[B2]2.
Ответ. Возрастет в 216 раз.
3. Определить среднюю скорость химической
реакции восстановления углекислого газа
водородом до угарного газа и воды, если через 80 с
после начала реакции молярная концентрация воды
была равна 0,24 моль/л, а через 2 мин 7 с стала равна
0,28 моль/л.
Ответ. 0,051 моль/(л•мин).
4. Как изменится скорость реакции получения
аммиака из простых веществ, если при неизменной
температуре уменьшить объем газовой смеси в 3
раза?
Ответ. Увеличится в 81 раз.
5. Во сколько раз изменится скорость
химической реакции 2А + В = А2В, если
концентрацию вещества А увеличить в 2 раза, а
концентрацию вещества В уменьшить в 2 раза?
Ответ. Возрастет в 2 раза.
Правило Вант-Гоффа
1. Во сколько раз увеличится скорость
химической реакции образования йодоводорода из
простых веществ при повышении температуры от
20 °С до 170 °С, если при повышении температуры
на каждые 25 °С скорость реакции увеличивается
в 3 раза?
Ответ. Увеличится в 716 раз.
2. Коэффициент Вант-Гоффа для некоторой
реакции равен 2,5. Во сколько раз увеличится
скорость этой реакции при повышении температуры
от 10 °С до 55 °С?
Решение
Выражение для скорости реакции 2 по сравнению со скоростью
реакции 1 при
изменении температуры Т
имеет вид:
Ответ. Возрастет в 61,76 раза.
3. Скорость некоторой реакции возрастает в
3,5 раза при повышении температуры на каждые
20 °C. Как изменится время протекания данной
реакции при повышении температуры от 20 °C до
85 °С?
Ответ. Уменьшится в 58,475 раза.
4. Растворение образца цинка в соляной
кислоте при 20 °С заканчивается через 27 мин, а
при 40 °С такой же образец металла растворяется
за 3 мин. За какое время данный образец цинка
растворится при 55 °С?
Ответ. За 34,6 с.
5. Растворение образца железа в серной
кислоте при 20 °С заканчивается через 15 мин, а
при 30 °С такой же образец металла растворяется
за 6 мин. За какое время данный образец железа
растворится при 35 °С?
Ответ. За 3,8 мин.
Состояние равновесия. Равновесные
концентрации
1. Равновесие реакции образования
йодоводорода из простых веществ установилось
при следующих концентрациях: [H2] = 0,4 моль/л,
[I2] = 0,5 моль/л, [HI] = 0,9 моль/л. Определить
исходные концентрации водорода и йода и
рассчитать константу равновесия данной реакции.
Решение
Для реакции образования йодоводорода:
Равновесные концентрации:
[H2] = 0,4 моль/л, [I2] = 0,5 моль/л,
[HI] = 0,9 моль/л.
Прореагировало в объеме: 0,45 моль/л Н2 и 0,45
моль/л I2, получилось 0,9 моль/л HI.
Исходные концентрации:
с0(H2) = 0,4 + 0,45 = 0,85 моль/л,
с0(I2) = 0,5 + 0,45 = 0,95 моль/л.
Ответ. с0(Н2) = 0,85 моль/л, с0(I2)
= 0,95 моль/л, Кр = 4,05.
2. В реакции А + В = С + D смешали по 1 моль всех
веществ A–D. После установления равновесия в
смеси оказалось 1,5 моль вещества С. Определить
константу равновесия данной реакции.
Ответ. Кр = 9.
3. Равновесие реакции образования аммиака
из простых веществ устанавливается при
следующих концентрациях: [N2] = 0,01 моль/л, [Н2]
= 2 моль/л, [NН3] = 0,4 моль/л. Вычислить
константу равновесия и исходные концентрации
азота и водорода.
Ответ. Кр = 2, с0(N2)
= 0,21 моль/л, с0(Н2) = 2,6 моль/л.
4. Равновесие реакции образования
диоксида азота из монооксида и кислорода
установилось при следующих концентрациях
реагирующих веществ: оксида азота(II) – а
моль/л, кислорода – в моль/л, оксида азота(IV) –
с моль/л. Как изменятся скорости прямой и
обратной реакций, если уменьшить объем,
занимаемый газами, в 2 раза? Сместится ли при этом
равновесие?
Ответ. Возрастут в 8 и 4 раза,
равновесие сместится вправо.
5. Исходные концентрации азота и водорода в
реакционной смеси для получения аммиака
составляли 4 и 10 моль/л соответственно. Вычислить
равновесные концентрации компонентов смеси и
константу равновесия данной реакции, если к
моменту наступления равновесия прореагировало
50% азота.
Ответ. Равновесные концентрации:
[N2] = 2 моль/л,
[Н2] = [NН3] = 4 моль/л,
Кр = 1/8.
Принцип Ле Шателье
1. Какие факторы способствуют смещению
равновесия в эндотермической реакции
восстановления углекислого газа до угарного с
помощью углерода в сторону образования продукта
реакции?
Ответ. Для реакции
СО2 (г.) + С (тв.) 2СО (г.) – Q
смещению равновесия вправо
способствуют:
а) нагревание; б) понижение давления;
в) увеличение концентрации СО2;
г) вывод СО из сферы реакции.
2. Какие факторы способствуют смещению
равновесия в эндотермической реакции
восстановления оксида железа(III) с помощью
водорода в сторону прямой реакции?
Ответ. Для реакции
Fe2О3 (тв.) + 3Н2 (г.) 2Fe (тв.) + 3Н2О
(г.) – Q
смещению равновесия вправо
способствуют:
а) нагревание; б) увеличение концентрации Н2;
в) вывод Н2О из реакции.
3. Какие факторы способствуют смещению
равновесия в экзотермической реакции
образования сероводорода из простых веществ в
сторону образования продукта реакции?
Ответ. Для реакции
Н2 (г.) + S (тв.) Н2S (г.) + Q
смещению равновесия в сторону
образования Н2S способствуют:
а) охлаждение; б) увеличение концентрации Н2;
в) вывод Н2S из реакции.
4. Для каких из указанных реакций повышение
давления приведет к смещению равновесия в том же
направлении, что и понижение температуры?
а) N2 + O2 2NO – Q;
б) CO2 + C 2CO – Q;
в) 2CO + O2 2CO2 + Q;
г) CO + H2O (г.) CO2 + H2 + Q.
Ответ. б, в.
Комбинированные задачи повышенной
сложности
1. Один моль смеси пропена с водородом,
имеющей плотность по водороду 15, нагрели в
замкнутом сосуде с платиновым катализатором при
320 °С, при этом давление в сосуде уменьшилось
на 25%. Рассчитать выход продукта гидрирования в
процентах от теоретического.
Ответ. 83,3%.
2. Пары этаналя смешали с водородом в
молярном отношении 1:2 при давлении 300 кПа и
температуре 400 °С в замкнутом реакторе,
предназначенном для синтеза этанола. После
окончания процесса давление газов в реакторе при
неизменной температуре уменьшилось на 20%.
Определить объемную долю паров этанола в
реакционной смеси и процент превращения
уксусного альдегида в этанол.
Ответ. Объемная доля паров этанола
в конечной реакционной смеси – 25%,
степень превращения альдегида в этанол – 60%.
3. При нагревании до некоторой температуры 36
г уксусной кислоты и 7,36 г безводного этанола в
присутствии серной кислоты получена равновесная
смесь. Эта смесь при действии избытка раствора
хлорида бария образует 4,66 г осадка, а при
действии избытка раствора гидрокарбоната калия
выделяет 12,1 л углекислого газа (н.у.). Найти
количество сложного эфира в равновесной смеси.
Ответ. 0,1 моль.
4. Угарный газ смешали с водородом в
молярном соотношении 1:4 при давлении 10 МПа и
температуре 327 °С в замкнутом реакторе,
предназначенном для синтеза метанола. После
окончания процесса давление газов в реакторе при
неизменной температуре уменьшилось на 10%.
Определить объемную долю паров метанола в
реакционной смеси и процент превращения
угарного газа в метанол.
Ответ. Объемная доля паров метанола
в конечной реакционной смеси – 5,55%,
степень превращения угарного газа в метанол – 25%.
Приветствую вас, уважаемые читатели, на своем канале!
В данной статье разберем вопрос химической кинетики или скорости химической реакции.
Химическая кинетика – раздел химии, изучающий скорость химической реакции и факторы, влияющие на нее.
Гомогенные реакции – реакции, в которых между реагентами отсутствует граница раздела (реакции, протекающие в растворах, или газовые реакции).
Гетерогенные реакции – реакции, в которых реагенты находятся в разных агрегатных состояниях. Гетерогенные реакции протекают на границе раздела фаз, например между твердым веществом и газом, между твердым веществом и растворенным веществом.
Скорость гомогенной реакции – изменение количества реагирующего вещества или продукта реакции в единице объема в единицу времени или изменение концентрации реагента или продукта в единицу времени:
Скорость гетерогенной реакции – изменение количества реагента или продукта реакции в единицу времени на единице поверхности на границе раздела фаз:
Факторы, влияющие на скорость химической реакции
Пример. Перечислите факторы (воздействия), увеличивающие скорость реакции взаимодействия магния с раствором серной кислоты.
Решение:
Характеристика реакции: реакция гетерогенная, оба исходных вещества «не газы».
Скорость реакции будет увеличиваться при:
1) повышении температуры;
2) увеличении концентрации кислоты;
3) измельчении твердого вещества (измельчении Mg).
На скорость реакции не будут влиять изменение давления, концентрации MgSO4 (продукт реакции), увеличение количества (т.е. добавление кусочков металла) магния.
Разбор теории по первому вопросу можно посмотреть здесь:
Разбор теории по второму вопросу можно посмотреть здесь:
Разбор теории по типам химических связей и кристаллических решеток можно посмотреть здесь.
Решение заданий 30 и 31 разных вариантов можно посмотреть здесь:
Решение заданий 32 разных вариантов можно посмотреть здесь:
Решение заданий 33 разных вариантов можно посмотреть здесь:
Решение заданий 34 разных вариантов можно посмотреть здесь:
Решение заданий 35 разных вариантов можно посмотреть здесь:
Не забываем поставить лайк этой статье и подписаться на канал!
Всем успехов в изучении химии!
Скорость химической реакции — определение довольно древнее, но по-прежнему актуальное, так как является базовым понятием в химической науке и её прикладном значении. Сама возможность влияния человека на скорость и объем химического процесса позволила в свое время сделать резкий прорыв в этой и многих других областях, потому что больше не приходилось дожидаться результата так же долго, сколько он занимает в естественной природной среде.
Соответственно, наличие катализаторов позволяет ученым и сейчас ускорять прогресс науки, достигать поставленных задач. Такой раздел знаний изучает химическая кинетика — наука, определяющая закономерности влияния физических и химических условий на протекание химических реакций.
Скорость химической реакции — изменение количества одного из реагентов за промежуток времени в реакционном пространстве. Эта скорость является фундаментальным понятием химической кинетики. Она измеряется путём изменения концентрации одного из веществ. Как правило, рассчитывается в молях (классическая единица измерения) на литр за единицу времени.
Стоит сказать, что абсолютно все химические реакции рассматриваются только в системе, т. е. в совокупности отдельно взятых веществ и объектов.
Скорость реакции в гомогенной системе
В химии различают гомогенные (одинаковые фазы внешней среды) и гетерогенные (различающиеся фазы окружающей среды) реакции в зависимости от фаз среды.
Реакции в гомогенной системе происходят только в однородной фазе в общем объеме реакционной системы. Реакция происходит исключительно при взаимодействии растворов жидкостей или газов.
Скорость химической реакции в гомогенной системе — это изменение концентрации одного из веществ, участвующих в химической реакции, за единицу времени.
Ниже приведены примеры таких реакций и нужная формула:
-
NO2(г) + CO(г) = NO(г) + CO2(г);
-
NaOH(р-р) + HCl(р-р) = NaCl(р-р) + H2O.
Скорость реакции в гетерогенной системе
В гетерогенных же системах химические реакции протекают только на поверхности раздела разных фаз.
Поверхность раздела фаз — это граничная поверхность между двумя веществами, вступающими в реакцию, в контакт между собой.
Например, при взаимодействии железа с соляной кислотой: Fe + 2HCl → FeCl2 + H2.
Факторы, влияющие на скорость химической реакции
Как ранее было сказано, скорость химической реакции зависит от нескольких параметров:
-
температуры;
-
соотношения концентраций реагентов;
-
наличия катализаторов;
-
природы взятых реагентов;
-
площади соприкосновения реагентов;
-
давления (применимо, если в случае реагентов взяты газообразные вещества).
Температура
Правилом Вант-Гоффа и уравнением Аррениуса определяется скорость взаимодействия реагентов. Сванте Аррениус искал взаимосвязь скорости и температуры. Он установил, что химические процессы поддаются равенству константы скорости:
Пояснения:
-
Еа — min энергия для запуска реакции;
-
Т —температура;
-
R —постоянная газа;
-
A — постоянная, указывающая на вероятность возможного взаимодействия молекул.
Удобно пользоваться и правилом Якоба Вант-Гоффа, смысл которого гласит, что увеличивается v реакции от двух до четырех раз при росте температуры на десять градусов (по Цельсию). Для простоты расчётов было создано уравнение:
Соотношение концентраций реагентов
Обусловленность скорости от концентрации реагентов в системе известна в науке, как закон действующих масс. Его открыли Като Гульдберг и Петер Вааге.
Скорость этих реакций выражается уравнением:
Здесь:
-
v — скорость взаимодействия веществ;
-
cA и cB — концентрации реагентов;
-
k —коэффициент скорости.
Катализаторы
Самым распространённым способом изменить скорость реакции является добавление к ней катализатора (ускорителя) или ингибитора (замедлителя).
Основное преимущество таких веществ в том, что они не являются расходным материалом и не влияют на равновесие в продуктах внутри системы.
Для простоты возьмем реакцию разложения пероксида водорода: 2Н2О2 = 2Н2О + О2.
Без дополнительных веществ эта простая реакция протекает довольно медленно, но если добавить оксид марганца (MnO2), то сразу заметим наличие газа (O2).
Природа веществ
Скорость реакции также зависит от природы взятых веществ. Здесь тоже не все так просто, ведь имеет вес почти каждая мелочь этого вещества: характер и прочность кристаллической решетки и химических связей, строение оболочки атомов и расположения на ней электронов (согласно периодическому закону Д. И. Менделеева о порядке веществ в таблице).
Для простоты объяснения приведем пример: согласно строению веществ, натрий (Na) гораздо легче отдает свои электроны, чем олово (Sn), соответственно, реагировать с одним и тем же веществом он будет быстрее.
Площадь соприкосновения реагентов
Что касается смесей твердых и жидких фаз, то тут для увеличения скорости реакции поможет увеличение площади соприкосновения этих веществ.
Приведем пример: если мы возьмем часть щелочного метала в водном растворе, то реакция пойдет достаточно быстро, однако, если мы сделаем из кусочка металла порошок, то скорость взаимодействия увеличится.
Давление
В случае химической реакции, реагентами которой являются газы, то изменить скорость взаимодействия можно увеличением давления в системе, потому что таким образом повышается и концентрация газа. Зависимость скорости от давления будет прямо пропорциональной.
Скорость
гомогенной химической реакции r
по веществу j
определяется как изменение количества
этого вещества nj
в единице объема V
за единицу времени .
Ее можно представить следующим
дифференциальным уравнением:
или
при V=const
Очевидно,
что можно говорить и о скорости стадии.
Тогда
или
при V=const
Связь
между rj
и rj
следующая:
В
этом уравнении ij
берется со знаком «»,
если вещество j
расходуется на i-й
стадии, со знаком «+», если оно образуется,
или равно нулю, если вещество j
не участвует на i-й
стадии. Наблюдается полная аналогия со
стехиометрическим материальным балансом.
Пример
5
Для
реакции ААBB
представить связь скорости реакции по
веществам А и В с инвариантной скоростью
стадии r
и друг с другом.
Решение
rА=Аr;
rВ=Вr
или
Пример
6
Для
реакций
1АА
+ 1YY
1BB
2ВВ
+ 2YY
2ZZ
представить
связь скоростей реакций по веществам
A,
Y,
B,
Z
со скоростями стадий r1
и r2.
Решение
rА=1Аr1;
rZ=2Zr2;
rY=1Y
r12Y
r2;
rВ=1В
r12В
r2.
Задача
кинетического исследования (решение
обратной задачи) сводится к определению
всех участников процесса, числа его
стадий и определению вида функциональной
зависимости скорости каждой стадии от
концентрации реагентов и температуры.
Начнем рассмотрение этой задачи с
простых реакций.
Пусть,
например имеем реакцию АА
+ YY
BB
+ ZZ,
что было определено экспериментально.
Реакция гомогенная и изучалась в реакторе
периодического действия при V=const.
Для нее справедливо:
Если
будет установлена зависимость скорости
реакции по любому из веществ от
концентраций всех участников реакции,
а также от температуры, то затем можно
находить состав реакционной смеси в
любой момент времени, решая полученное
дифференциальное уравнение при заданных
начальных условиях, т. е. когда известны
cA,0,
cY,0,
cB,0,
cZ,0
при =0.
Самое сложное
это представить вид уравнения в
зависимости от концентраций реагентов.
В этих опытах температуру в реакторе
держат строго фиксированной (постоянной).
Для
элементарной реакции известно, что ее
скорость пропорциональна концентрациям
реагентов в степенях, равных их
стехиометрическим коэффициентам.
Простая реакция, которая может состоять
из нескольких элементарных, также часто
представляется в виде степенной функции.
Однако в этом случае степени далеко не
всегда равны стехиометрическим
коэффициентам реагентов. Их нужно
находить экспериментально при постановке
специальных опытов и соответствующей
обработке полученных результатов.
Будем
считать, что скорость реакции определяли,
например, по изменению концентрации
реагента А. Тогда
где
а, у
это так называемые частные порядки
реакции по реагентам A
и Y,
k
коэффициент пропорциональности,
зависящий от температуры, или константа
скорости (инвариантная по отношению ко
всем участникам реакции).
Очевидно,
что
или
kA=Ak,
где
kА
константа скорости реакции по веществу А.
Сумма
частных порядков (а+у)
это суммарный порядок реакции.
Если
размерность скорости rA
–
,
размерности концентраций веществ А иY
это
,
то тогда размерность константы скорости
будет
|
|
Рис. |
Скорость
реакции по веществу имеет графическую
интерпретацию. Это тангенс угла наклона
касательной к кривой, выражающей
зависимость концентрации участника
реакции от времени (рис. 2). Скорости
положительны для накапливающихся
продуктов В и отрицательны для
расходующихся веществ А.
Константа
скорости на некотором температурном
интервале выражается уравнением
Аррениуса:
где
k0
предэкспоненциальный множитель, имеющий
ту же размерность, что и k;
Е
энергия активации, Дж/моль; R
универсальная газовая постоянная,
равная 8,314 соответственно,
При
решении прямой задачи удобнее пользоваться
величиной Е*.
Константу
скорости иногда называют удельной
скоростью реакции, потому что она
численно совпадает со скоростью реакции
при единичных концентрациях всех
реагентов.