Темы кодификатора ЕГЭ: Скорость реакции. Ее зависимость от разных факторов.
Скорость химической реакции показывает, как быстро происходит та или иная реакция. Взаимодействие происходит при столкновении частиц в пространстве. При этом реакция происходит не при каждом столкновении, а только когда частица обладают соответствующей энергией.
Скорость реакции – количество элементарных соударений взаимодействующих частиц, заканчивающихся химическим превращением, за единицу времени.
Определение скорости химической реакции связано с условиями ее проведения. Если реакция гомогенная – т.е. продукты и реагенты находятся в одной фазе – то скорость химической реакции определяется, как изменение концентрации вещества в единицу времени:
υ = ΔC / Δt
Если реагенты, или продукты находятся в разных фазах, и столкновение частиц происходит только на границе раздела фаз, то реакция называется гетерогенной, и скорость ее определяется изменением количества вещества в единицу времени на единицу реакционной поверхности:
υ = Δν / (S·Δt)
Факторы, влияющие на скорость химической реакции
1. Температура
Самый простой способ изменить скорость реакции – изменить температуру. Как вам, должно быть, известно из курса физики, температура – это мера средней кинетической энергии движения частиц вещества. Если мы повышаем температуру, то частицы любого вещества начинают двигаться быстрее, а следовательно, сталкиваться чаще.
Однако при повышении температуры скорость химических реакций увеличивается в основном благодаря тому, что увеличивается число эффективных соударений. При повышении температуры резко увеличивается число активных частиц, которые могут преодолеть энергетический барьер реакции. Если понижаем температуру – частицы начинают двигаться медленнее, число активных частиц уменьшается, и количество эффективных соударений в секунду уменьшается. Таким образом, при повышении температуры скорость химической реакции повышается, а при понижении температуры — уменьшается.
Обратите внимание! Это правило работает одинаково для всех химических реакций (в том числе для экзотермических и эндотермических). Скорость реакции не зависит от теплового эффекта. Скорость экзотермических реакций при повышении температуры возрастает, а при понижении температуры – уменьшается. Скорость эндотермических реакций также возрастает при повышении температуры, и уменьшается при понижении температуры.
Более того, еще в XIX веке голландский физик Вант-Гофф экспериментально установил, что скорость большинства реакций примерно одинаково изменяется (примерно в 2-4 раза) при изменении температуры на 10оС.
Правило Вант-Гоффа звучит так: повышение температуры на 10оС приводит к увеличению скорости химической реакции в 2-4 раза (эту величину называют температурный коэффициент скорости химической реакции γ).
Точное значение температурного коэффициента определяется для каждой реакции.

здесь v2 — скорость реакции при температуре T2,
v1 — скорость реакции при температуре T1,
γ — температурный коэффициент скорости реакции, коэффициент Вант-Гоффа.
В некоторых ситуациях повысить скорость реакции с помощью температуры не всегда удается, т.к. некоторые вещества разлагаются при повышении температуры, некоторые вещества или растворители испаряются при повышенной температуре, т.е. нарушаются условия проведения процесса.
2. Концентрация
Также изменить число эффективных соударений можно, изменив концентрацию реагирующих веществ. Понятие концентрации, как правило, используется для газов и жидкостей, т.к. в газах и жидкостях частицы быстро двигаются и активно перемешиваются. Чем больше концентрация реагирующих веществ (жидкостей, газов), тем больше число эффективных соударений, и тем выше скорость химической реакции.
На основании большого числа экспериментов в 1867 году в работах норвежских ученых П. Гульденберга и П. Вааге и, независимо от них, в 1865 году русским ученым Н.И. Бекетовым был выведен основной закон химической кинетики, устанавливающий зависимость скорости химической реакции от концентрации реагирующих веществ:
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных их коэффициентам в уравнении химической реакции.
Для химической реакции вида: aA + bB = cC + dD закон действующих масс записывается так:
![]()
здесь v — скорость химической реакции,
CA и CB — концентрации веществ А и В, соответственно, моль/л
k – коэффициент пропорциональности, константа скорости реакции.
Например, для реакции образования аммиака:
N2 + 3H2 ↔ 2NH3
закон действующих масс выглядит так:
![]()
Константа скорости реакции k показывает, с какой скоростью будут реагировать вещества, если их концентрации равны 1 моль/л, или их произведение равно 1. Константа скорости химической реакции зависит от температуры и не зависит от концентрации реагирующих веществ.
В законе действующих масс не учитываются концентрации твердых веществ, т.к. они реагируют, как правило, на поверхности, и количество реагирующих частиц на единицу поверхности при этом не меняется.
В большинстве случаев химическая реакция состоит из нескольких простых этапов, в таком случае уравнение химической реакции показывает лишь суммарное или итоговое уравнение происходящих процессов. При этом скорость химической реакции сложным образом зависит (или не зависит) от концентрации реагирующих веществ, полупродуктов или катализатора, поэтому точная форма кинетического уравнения определяется экспериментально, или на основании анализа предполагаемого механизма реакции. Как правило, скорость сложной химической реакции определяется скоростью его самого медленного этапа (лимитирующей стадии).
3. Давление
Концентрация газов напрямую зависит от давления. При повышении давления повышается концентрация газов. Математическое выражение этой зависимости (для идеального газа) — уравнение Менделеева-Клапейрона:
pV = νRT
Таким образом, если среди реагентов есть газообразное вещество, то при повышении давления скорость химической реакции увеличивается, при понижении давления — уменьшается.
Например. Как изменится скорость реакции сплавления извести с оксидом кремния:
CaCO3 + SiO2 ↔ CaSiO3 + CO2↑
при повышении давления?
Правильным ответом будет – никак, т.к. среди реагентов нет газов, а карбонат кальция – твердая соль, нерастворимая в воде, оксид кремния – твердое вещество. Газом будет продукт – углекислый газ. Но продукты не влияют на скорость прямой реакции.
4. Катализатор
Еще один способ увеличить скорость химической реакции – направить ее по другому пути, заменив прямое взаимодействие, например, веществ А и В серией последовательных реакций с третьим веществом К, которые требуют гораздо меньших затрат энергии (имеют более низкий активационный энергетический барьер) и протекают при данных условиях быстрее, чем прямая реакция. Это третье вещество называют катализатором.

Катализаторы – это химические вещества, участвующие в химической реакции, изменяющие ее скорость и направление, но не расходующиеся в ходе реакции (по окончании реакции не изменяющиеся ни по количеству, ни по составу). Примерный механизм работы катализатора для реакции вида А + В можно представить так:
A + K = AK
AK + B = AB + K
Процесс изменения скорости реакции при взаимодействии с катализатором называют катализом. Катализаторы широко применяют в промышленности, когда необходимо увеличить скорость реакции, либо направить ее по определенному пути.
По фазовому состоянию катализатора различают гомогенный и гетерогенный катализ.
Гомогенный катализ – это когда реагирующие вещества и катализатор находятся в одной фазе (газ, раствор). Типичные гомогенные катализаторы – кислоты и основания. органические амины и др.
Гетерогенный катализ – это когда реагирующие вещества и катализатор находятся в разных фазах. Как правило, гетерогенные катализаторы – твердые вещества. Т.к. взаимодействие в таких катализаторах идет только на поверхности вещества, важным требованием для катализаторов является большая площадь поверхности. Гетерогенные катализаторы отличает высокая пористость, которая увеличивает площадь поверхности катализатора. Так, суммарная площадь поверхности некоторых катализаторов иногда достигает 500 квадратных метров на 1 г катализатора. Большая площадь и пористость обеспечивают эффективное взаимодействие с реагентами. К гетерогенным катализаторам относятся металлы, цеолиты — кристаллические минералы группы алюмосиликатов (соединений кремния и алюминия), и другие.

Пример гетерогенного катализа – синтез аммиака:
N2 + 3H2 ↔ 2NH3
В качестве катализатора используется пористое железо с примесями Al2O3 и K2O.
Сам катализатор не расходуется в ходе химической реакции, но на поверхности катализатора накапливаются другие вещества, связывающие активные центры катализатора и блокирующие его работу (каталитические яды). Их необходимо регулярно удалять, путем регенерации катализатора.
В биохимических реакция очень эффективными оказываются катализаторы – ферменты. Ферментативные катализаторы действуют эффективно и избирательно, с избирательностью 100%. К сожалению, ферменты очень чувствительны к повышению температуры, кислотности среды и другим факторам, поэтому есть ряд ограничений для реализации в промышленных масштабах процессов с ферментативным катализом.
Катализаторы не стоит путать с инициаторами процесса и ингибиторами.
Например, для инициирования радикальной реакции хлорирования метана необходимо облучение ультрафиолетом. Это не катализатор. Некоторые радикальные реакции инициируются пероксидными радикалами. Это также не катализаторы.
Ингибиторы – это вещества, которые замедляют химическую реакцию. Ингибиторы могут расходоваться и участвовать в химической реакции. При этом ингибиторы не являются катализаторами наоборот. Обратный катализ в принципе невозможен – реакция в любом случае будет пытаться идти по наиболее быстрому пути.
5. Площадь соприкосновения реагирующих веществ
Для гетерогенных реакций одним из способов увеличить число эффективных соударений является увеличение площади реакционной поверхности. Чем больше площадь поверхности контакта реагирующих фаз, тем больше скорость гетерогенной химической реакции. Порошковый цинк гораздо быстрее растворяется в кислоте, чем гранулированный цинк такой же массы.
В промышленности для увеличения площади контактирующей поверхности реагирующих веществ используют метод «кипящего слоя».
Например, при производстве серной кислоты методом «кипящего слоя» производят обжиг колчедана.
6. Природа реагирующих веществ
На скорость химических реакций при прочих равных условиях также оказывают влияние химические свойства, т.е. природа реагирующих веществ.
Менее активные вещества будут имеют более высокий активационный барьер, и вступают в реакции медленнее, чем более активные вещества.
Более активные вещества имеют более низкую энергию активации, и значительно легче и чаще вступают в химические реакции.
Более стабильные вещества — это, например, те вещества, которые окружают нас в быту, либо существуют в природе.
Например, хлорид натрия NaCl (поваренная соль), или воды H2O, или металлическое железо Fe.
Более активные вещества мы можем встретить в быту и природе сравнительно редко.
Например, оксид натрия Na2O или сам натрий Na в быту и в природе не не встречаем, т.к. они активно реагируют с водой.
При небольших значениях энергии активации (менее 40 кДж/моль) реакция проходит очень быстро и легко. Значительная часть столкновений между частицами заканчивается химическим превращением. Например, реакции ионного обмена происходят при обычных условиях очень быстро.
При высоких значениях энергии активации (более 120 кДж/моль) лишь незначительное число столкновений заканчивается химическим превращением. Скорость таких реакций пренебрежимо мала. Например, азот с кислородом практически не взаимодействует при нормальных условиях.
При средних значениях энергии активации (от 40 до 120 кДж/моль) скорость реакции будет средней. Такие реакции также идут при обычных условиях, но не очень быстро, так, что их можно наблюдать невооруженным глазом. К таким реакциям относятся взаимодействие натрия с водой, взаимодействие железа с соляной кислотой и др.
Вещества, стабильные при нормальных условиях, как правило, имеют высокие значения энергии активации.
524
Создан на
11 января, 2022 От Admin

Скорость химических реакций
Тренажер задания 18 ЕГЭ по химии
1 / 10
Из предложенного списка химических реакций выберите все, скорость которых увеличивается при повышении давления
1) N2 + 3H2 = 2NH3
2) CO + 2H2 = CH3OH
3) Zn + 2HCl = ZnCl2 + H2
4) 2Na + S = Na2S
5) C + Si = SiC
2 / 10
Из предложенного перечня выберите все внешние воздействия, которые приводят к уменьшению скорости реакции азота с водородом.
1) понижение давления
2) понижение температуры
3) уменьшение концентрации N2
4) уменьшение концентрации NH3
5) добавление катализатора
Запишите номера выбранных ответов.
3 / 10
Из предложенного перечня выберите все реакции, для которых увеличение давления не приведёт к увеличению скорости реакции.
1) КОН + Н2SO4 = КНSO4 + Н2О
2) 2Р + ЗСl2(г) = 2РСl3
3) Fe2O3 + 6HCl(р-р) = 2FеСl3 + ЗН2O
4) Мg + 2H+(р-р) = Мg2+ + Н2
5) Fе + S(тв) = FeS
Запишите номера выбранных ответов.
4 / 10
Из предложенного перечня выберите два фактора, которые приводят к увеличению скорости химической реакции магния с раствором серной кислоты.
1) повышение температуры
2) понижение давления в системе
3) увеличение давления в системе
4) использование ингибитора
5) увеличение концентрации кислоты
Запишите в поле ответа номера выбранных факторов.
5 / 10
Из предложенного перечня выберите два вещества, между которыми реакция протекает с наибольшей скоростью в одинаковых условиях.
1) AgNO3 (р-р)
2) FeO
3) HCl (р-р)
4) BaCO3
5) Mg(OH)2
6 / 10
Из предложенного перечня выберите все внешние воздействия, которые приведут к увеличению скорости реакции этанола с уксусной кислотой.
1) увеличение давления
2) увеличение объёма реакционного сосуда
3) увеличение температуры
4) добавление катализатора
5) добавление воды
Запишите в поле ответа номера выбранных внешних воздействий.
7 / 10
Из предложенного перечня выберите два фактора, которые приводят к увеличению скорости химической реакции между цинком и раствором хлорида меди(II).
1) повышение давления в системе
2) понижение давления в системе
3) увеличение концентрации хлорида меди(II)
4) добавление воды
5) измельчение цинка
Запишите в поле ответа номера выбранных факторов
8 / 10
Из предложенного перечня выберите все реакции, для которых уменьшение концентрации кислоты приведёт к уменьшению скорости реакции.
1) SO2 + H2O = Н2SO3
2) CH3NH2 + H+ → CH3NH3+
3) Аl2O3 + 3H2SO4 = Al2(SO4)3 + 3H2O
4) Мg + 2H+ = Mg2+ + H2
5) Cl2 + H2O = HCl + HClO
Запишите номера выбранных ответов.
9 / 10
Из предложенного перечня выберите все внешние воздействия, которые практически не влияют на скорость реакции магния с соляной кислотой.
1) повышение температуры
2) измельчение магния
3) увеличение давления
4) добавление хлорида магния
5) добавление воды
Запишите номера выбранных ответов.
10 / 10
Из предложенного перечня выберите две схемы химических реакций, для которых увеличение концентрации кислоты приведёт к увеличению скорости их протекания.
1) H2О(ж) + Cl2(г) → HCl(р-p) + HClO(р-р)
2) Zn(тв.) + HCl(р-р) → ZnCl2(р-р) + H2(г)
3) P2O5(тв.) + H2О(ж) → H3PO4(p-p)
4) SO2(г) + H2O(ж) → H2SО3(p-p)
5) CuO(тв.) + H2SO4(p-p) → CuSO4(p-p) + H2О(ж)
Запишите в поле ответа номера выбранных схем реакций.
Ваша оценка
The average score is 39%
Работа №10
Изучение скорости разложения пероксида водорода газометрическим методом.
Цель работы: изучить реакцию разложения пероксида водорода, газометрическим методом определить константу скорости реакции. Используя результаты расчета и графические зависимости определить, протекает ли данная реакция по первому порядку.
Литература: Практикум 1986, с.319-324, 328-333, 339-340, 354-356 или Практикум 1974, с.322-346, 365-367.
Теоретическая часть
Скорость химической реакции определяется изменением количества данного компонента в единицу времени в единице объема:
|
1 |
dn |
i 0 |
||
|
i |
V d |
|||
где n-число молей данного компонента в объеме V данной фазы в момент времени t.
Если объем величина постоянная, то скорость определяется изменением концентрации реагирующего вещества за единицу времени:
|
V const : |
d n |
i |
/ V |
d c |
i |
||
|
i |
d |
d |
|||||
Скорость реакции всегда положительна.
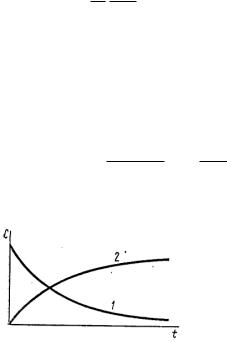
Кинетические кривые для исходных веществ(1) и продуктов реакции(2)
Основной постулат химической кинетики:
скорость реакции в каждый момент времени пропорциональна произведению возведенных в некоторую степень концентраций реагирующих веществ (закон действующих масс).
|
А |
А |
B |
B |
D |
D … продукты, |
|||
|
d ci |
kcAp cBq cDr |
|||||||
|
i d |
Коэффициент пропорциональности k называется константой скорости химической реакции. Ее физический смысл: константа скорости равняется
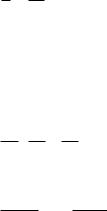
скорости реакции при единичной концентрации, поэтому ее называют также удельной скоростью реакции.
Величина константы зависит от всех факторов, которые влияют на скорость химической реакции, за исключением изменения концентрации реагирующих веществ. Числовое значение зависит так же от выбора единиц времени и концентрации. Размерность определяется тем кинетическим уравнением, по которому производится ее расчет, т.е. зависит от порядка реакции
Порядок реакции является эмпирической величиной. Частным называется порядок, характеризующийся изменением концентрации одного из веществ, вступающих в реакцию. Чтобы определить порядок по данному веществу, необходимо создать такие условия, чтобы в процессе реакции изменялась концентрация только данного вещества. Для этого концентрации всех остальных участников должны быть взяты в большом избытке. Сумма частных порядков дает общий порядок реакции.
Молекулярность реакции определяется числом частиц, участвующих в одном элементарном акте химического превращения.
Период полупревращения-это время, за которое исходная концентрация реагента уменьшится в 2 раза. Измерение периода полупревращения приносит большую пользу при исследованиях порядка реакции.
Математические выражения для расчета констант скорости реакций: 1. Необратимые реакции 1-го порядка
2. Необратимые реакции 2-го порядка
|
1 |
1 |
1 |
1 |
x |
л |
||||||||||
|
k |
, k, |
||||||||||||||
|
с |
c0 c0 x |
с моль |
|||||||||||||
|
с0 |
3. Необратимые реакции 3-го порядка
4. Необратимые реакции нулевого порядка
Где с0– начальная концентрация исходных веществ, с – концентрация после протекания реакции, t – время, х – концентрация прореагировавшего вещества за промежуток времени
Методы определения порядка реакции 1. Интегральные методы определения порядка реакции
а) метод подбора уравнения
1)аналитический – суть метода состоит в подстановке ci реагирующего
вещества для различных моментов времени от начала реакции в кинетические уравнения различных порядков (1го, 2го , 3го и т.д ). Искомым является тот порядок, для которого наблюдается постоянство (неизменность) значения константы скорости реакции при различных концентрациях
2)графический – состоит в нахождении такой функции концентрации от времени, которая имела бы линейный характер:
1 порядок –
2 порядок –
3 порядок –
0 порядок –
|
lnc k const lnc0 |
, |
|
|
1/ c k const 1/ c0 , |
, |
|
|
1/ c |
2 |
2 |
|
2k const 1/ c0 |
с k c0 .
б) метод Оствальда-Нойеса – использует зависимость
|
lg |
/ |
|||
|
n |
1/ 2 |
1/ 2 |
1 |
|
|
lg c |
/ c |
|||
|
0,2 |
0,1 |
|||
f
:
3. Дифференциальные методы Вант-Гоффа а) Аналитический метод – по двум значениям
dc d
при двух
c
1) по одной кинетической кривой – временной порядок
|
dc |
dc |
|||||||
|
lg |
lg |
|||||||
|
n |
d 1 |
d 2 |
||||||
|
lg c1 |
lg c2 |
|||||||
2) по 2ум начальным концентрациям – концентрационный порядок
|
dc |
dc |
|||||||
|
lg |
lg |
|||||||
|
n |
d |
0,1 |
d |
|||||
|
lg c |
0,1 |
lg c |
0,2 |
|||||
0,2
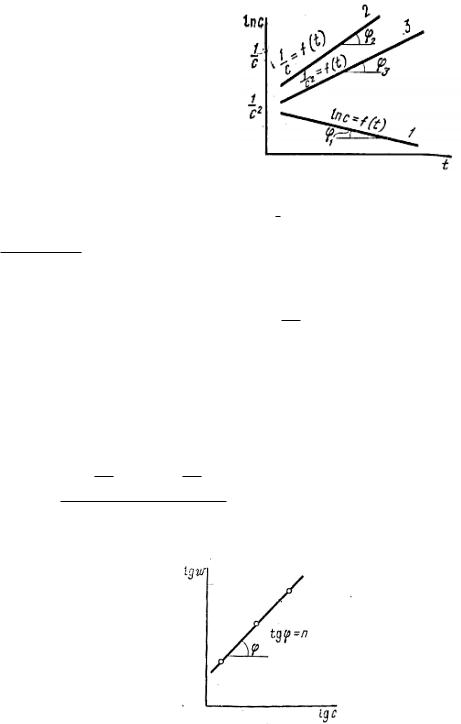
б) Графический вариант метода Вант-Гоффа
lg lg k n lg c
tg n
Задача
Кинетику реакции разложения N2O5 в жидком CCL4 изучали при температуре 42оС газоволюметрическим методом. Результаты измерений объемов кислорода, выделившегося в разные моменты времени, представлены в таблице:
|
t, |
5 |
10 |
15 |
20 |
30 |
40 |
60 |
80 |
100 |
∞ |
|
мин |
||||||||||
|
VO2, |
12,45 |
23,8 |
34,15 |
43,5 |
59,85 |
73,3 |
93,7 |
107,7 |
117,7 |
138,1 |
|
мл |
||||||||||
Графическим вариантом дифференциального метода Вант-Гоффа определить порядок химической реакции: N2O5= N2O4 + ½ O2
Рассчитать среднюю аналитическую константу скорости реакции и период полупревращения исходного вещества при указанной температуре.
Решение.
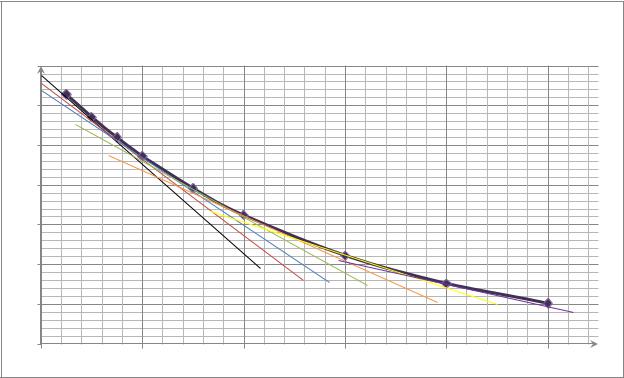
Определим порядок реакции графическим методом. Для этого построим
|
график зависимости |
. По нему определим скорость реакции в |
|
|
определенный момент времени: |
. Далее построим график |
|
|
зависимости: |
, где |
|
, |
, где |
мл |
||||
|
t, мин |
, мл |
) |
v, мл/мин |
lnv |
k, мин-1 |
|
|
5 |
125,65 |
4,83 |
– |
– |
0,01890 |
|
|
10 |
114,3 |
4,74 |
2,17 |
0,775 |
0,01892 |
|
|
15 |
103,95 |
4,64 |
1,97 |
0,678 |
0,01894 |
|
|
20 |
94,6 |
4,55 |
1,7 |
0,531 |
0,01892 |
|
|
30 |
78,25 |
4,36 |
1,49 |
0,399 |
0,01894 |
|
|
40 |
64,8 |
4,17 |
1,11 |
0,104 |
0,01892 |
|
|
60 |
44,4 |
3,79 |
0,86 |
-0,151 |
0,01891 |
|
|
80 |
30,4 |
3,41 |
0,6 |
-0,511 |
0,01892 |
|
|
100 |
20,4 |
3,02 |
– |
– |
0,01912 |
|
|
∆ |
2 |
, |
График зависимости ∆ 2= ( ). |
||||
|
мл |
|||||||
|
140 |
|||||||
|
120 |
|||||||
|
100 |
|||||||
|
80 |
|||||||
|
60 |
|||||||
|
40 |
|||||||
|
20 |
|||||||
|
0 |
t, мин |
||||||
|
0 |
20 |
40 |
60 |
80 |
100 |
|
Из данного графика : |
||
|
При |
мл/мин |
|
|
При |
мл/ мин |
|
|
При |
мл/ мин |
|
|
При |
мл/ мин |
|
|
При |
мл/ мин |
|
|
При |
мл/ мин |
|
|
При |
мл/ мин |
|
|
Далее построим график зависимости: |
, по которому и |
|
|
определим порядок реакции: |
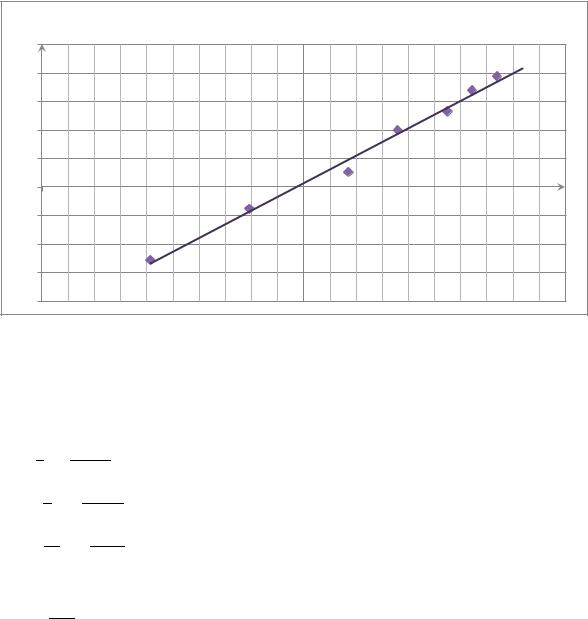
|
График зависимости: = ( ∆ |
) |
||
|
1 |
2 |
||
|
y = 0,9635x – 3,8232 |
|||
|
0,8 |
|||
|
0,6 |
|||
|
0,4 |
|||
|
0,2 |
∆ 2 |
||
|
0 |
|||
|
3 |
4 |
5 |
|
|
-0,2 |
|||
|
-0,4 |
|||
|
-0,6 |
|||
|
-0,8 |
|||
|
Из графика |
. Т.е. реакция первого порядка |
||
|
Рассчитаем среднюю аналитическую константу скорости реакции: |
|||
|
) – |
для 1-го порядка |
||
|
( |
) |
мин-1 |
( ) мин-1
Аналогично рассчитываем для остальных значений (см. таблицу выше)
∑0,01894 мин-1
Период полупревращения исходного вещества:
|
⁄ |
мин |
|||
Ответ:
n=1, т.е. реакция N2O5= N2O4 + ½ O2 1-го порядка (доказано графическим вариантом дифференциального метода Вант-Гоффа)
0,01894 мин-1
⁄ мин
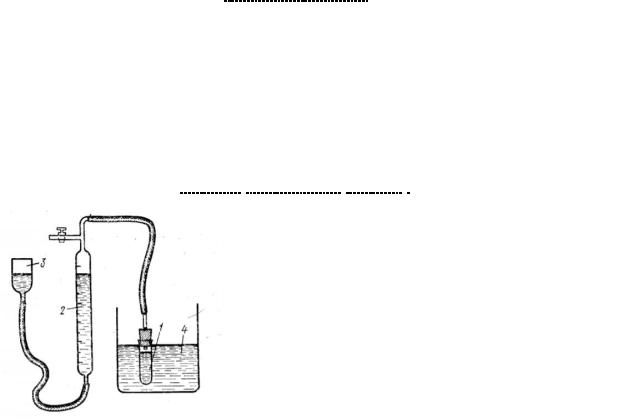
Экспериментальная часть
Задание на работу Исследовать процесс разложения пероксида водорода:
Н2О2 = Н2О + 0,5О2 Условия проведения эксперимента:
Катализатор: ионы Fe2+ , Fe3+, Cr2O72- , CrO42-, WO42-, MoO42-; CuSO4+MoO42-, CuSO4+NiSO4
Порядок выполнения работы
Схема установки для изучения скорости разложения Н2О2 газометрическим методом: 1-реакционный сосуд 2-бюретка 3-уравнительный сосуд 4-термостат
1.Термостатировать раствор катализатора
2.Влить в колбу с раствором катализатора определѐнное количество пероксида водорода.
3.Раствор тщательно размешать и поместить в предварительно термостатированный реакционный сосуд и поместить в термостат.
4.Уравнительный сосуд и бюретку наполнить подкрашенной водой и, присоединив реакционный сосуд к бюретке, проверить установку на герметичность.
Установить одинаковые уровни жидкости в бюретке и уравнительном сосуде.
Записать первое и последующие измерения с интервалом 2-5 минут.
5.После того, как реакция практически прекратится, реакционный сосуд поместить в кипящую водяную баню на некоторое время. Реакция считается законченной, если уровень газа в бюретке не изменяется.
6.После полного разложения пероксида водорода реакционный сосуд охладить до температуры термостата.
7.Произвести расчет.

Обработка экспериментальных данных
|
№ |
t, мин |
VO2, мл |
, мл |
) |
k, мин-1 |
|
п/п |
|||||
|
1 |
5 |
6,4 |
60,8 |
4,108 |
0,02002 |
|
2 |
7 |
12,0 |
55,2 |
4,011 |
0,0281 |
|
3 |
9 |
17,2 |
50 |
3,912 |
0,0329 |
|
4 |
11 |
21,6 |
45,6 |
3,820 |
0,0353 |
|
5 |
13 |
25,8 |
41,4 |
3,723 |
0,0373 |
|
6 |
15 |
29,6 |
37,6 |
3,627 |
0,0387 |
|
7 |
17 |
32,8 |
34,4 |
3,538 |
0,0394 |
|
8 |
19 |
35,4 |
31,8 |
3,459 |
0,0394 |
|
9 |
21 |
37,2 |
30 |
3,401 |
0,0384 |
|
10 |
23 |
39,6 |
27,6 |
3,318 |
0,0387 |
|
11 |
25 |
42,0 |
25,2 |
3,227 |
0,0392 |
|
12 |
27 |
44,4 |
22,8 |
3,127 |
0,04003 |
|
13 |
29 |
46,2 |
21 |
3,045 |
0,0401 |
|
14 |
31 |
47,6 |
19,6 |
2,976 |
0,0397 |
|
15 |
33 |
49,4 |
17,8 |
2,879 |
0,0403 |
|
16 |
35 |
51,0 |
16,2 |
2,785 |
0,0406 |
|
17 |
37 |
52,2 |
15 |
2,708 |
0,0405 |
|
18 |
39 |
53,4 |
13,8 |
2,625 |
0,0406 |
|
19 |
41 |
54,2 |
13 |
2,565 |
0,04007 |
|
∞ |
∞ |
67,2 |
– |
– |
– |
Рассчитаем среднюю аналитическую константу скорости реакции:
,
где – объем кислорода, выделившийся после разложения всего Н2О2, – объем кислорода, выделившийся в момент измерения t.
|
( |
) |
( |
) |
мин-1 |
|||||||||
|
( |
) |
( |
) |
мин-1 |
|||||||||
|
( |
) |
( |
) |
мин-1 |
|||||
|
Аналогично рассчитываем для остальных значений, данные занесены в |
|||||||||
|
таблицу выше. |
|||||||||
|
Тогда получаем, |
∑ |
0,03733 мин-1 |
|||||||
|
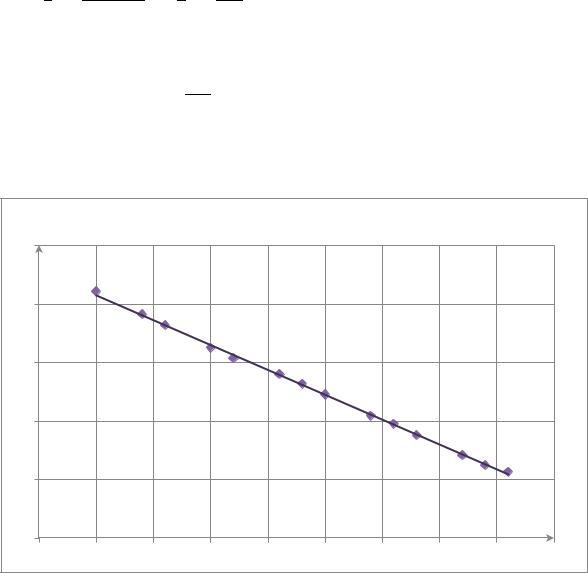
Теперь определим константу скорости графическим методом. Для этого |
|||||||||
|
построим график зависимости в координатах |
) = f(t) |
||||||||
|
График зависимости в ( |
− ) = f(t) |
||||||||
|
4,5 |
∞ |
||||||||
|
( ∞− ) |
|||||||||
|
y = -0,0428x + 4,2918 |
|||||||||
|
4 |
|||||||||
|
3,5 |
|||||||||
|
3 |
|||||||||
|
2,5 |
|||||||||
|
2 |
t, мин |
||||||||
|
0 |
5 |
10 |
15 |
20 |
25 |
30 |
35 |
40 |
45 |
|
По графику |
; |
||||||||
|
Из этого следует, что |
мин-1 |
||||||||
|
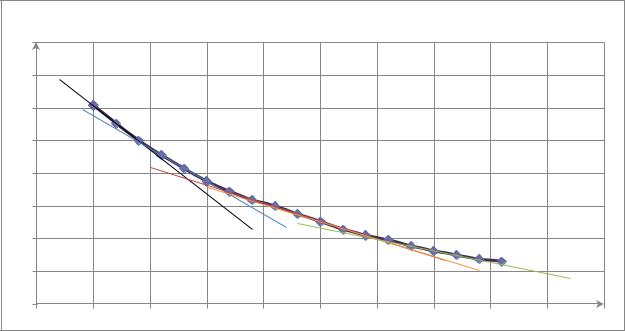
Определим порядок реакции графическим методом. Для этого построим |
|||||||||
|
график зависимости |
. По нему определим скорость реакции |
||||||||
|
в определенный момент времени: |
. Далее построим график |
||||||||
|
зависимости: |
, где |
|
График зависимости ( |
∞ |
− )= ( ). |
||||||||||
|
80 |
∞− , |
|||||||||||
|
мл |
||||||||||||
|
70 |
||||||||||||
|
60 |
||||||||||||
|
50 |
||||||||||||
|
40 |
||||||||||||
|
30 |
||||||||||||
|
20 |
||||||||||||
|
10 |
||||||||||||
|
0 |
, мин |
|||||||||||
|
0 |
5 |
10 |
15 |
20 |
25 |
30 |
35 |
40 |
45 |
50 |
|
Из данного графика : |
||
|
При |
мл/мин |
|
|
При |
мл/мин |
|
|
При |
мл/мин |
|
|
При |
мл/мин |
|
|
При |
мл/мин |
|
|
Далее построим график зависимости: |
, по которому и |
|
|
определим порядок реакции: |
при
при
при
при
при
Соседние файлы в предмете Физическая химия
- #
- #
- #
- #
- #
Скорость – реакция – разложение
Cтраница 1
Скорости реакций разложения обычно или превышают скорости реакций окисления, ли имеют один и тот же порядок. Из этого следует, что процессы термического разложения и превращения исходных продуктов могут протекать в зонах пламени незначительной толщины и за очень короткое время.
[1]
Скорость реакции разложения СаСО3 подчиняется закону Аррениуса, она пропорциональна разности между равновесным давлением двуокиси углерода и давлением, поддерживаемым в шахте печи. Лимитирующей стадией процесса диссоциации является скорость образования кристаллических зародышей окиси кальция, которая, в свою очередь, зависит от скорости диффузии ионов металла. Более благоприятные условия для зарождения кристаллов СаО создаются при повышении температуры.
[2]
Скорость реакции разложения гидразина во всех изученных случаях пропорциональна количеству взятого катализатора. Реакция разложения является гетерэгенной каталитической реакцией.
[3]
Скорость реакции разложения сильно меняется в зависимости от количества и концентрации кислоты. В случае применения 10 % – ного раствора серной кислоты для полного разложения гидроперекиси требуется около 1 ч, тогда как в присутствии 1 % – ного раствора кислоты – 5 ч, а при применении 94 – 96 % – ной серной кислоты в количестве 0 1 % от веса гидроперекиси – менее одной минуты.
[4]
Скорость реакции разложения ацетальдегида ( этаналя), имеющего второй кинетический порядок, была намерена в ицтерналс температур 700 – 850 К; константы скорости приведены ниже.
[5]
Скорость реакции разложения NO при низких температурах незначительна, поэтому, хотя окись азота при таких температурных условиях термодинамически неустойчива, заметного разложения NO не происходит. Так, для разложения чистой окиси азота на 50 % при 1230 С требуется 197 с, а при 2630 С – всего 2 1Q – с. Теоретический выход азотной кислоты на 1 кВт ч затраченной энергии соответствует получению 2500 г HN03, в действительности на 1 кВт ч получается 55 – 80 г кислоты.
[6]
Скорость реакции разложения NO при низких температурах незначительна, поэтому, хотя окись азота в этих температурных условиях термодинамически неустойчива, заметного разложения NO не происходит. Так, для разложения чистой окиси азота на 50 % при 1230 С требуется 197 сек, а при 2630 С всего 2 – 10 – сек. Теоретический выход азотной кислоты на 1 кет – ч затраченной энергии соответствует получению 2500 г HNO3, в действительности на 1 кет – ч получается 55 – 80 г кислоты.
[7]
Скорость реакции разложения перекиси при полимеризации приближенно выражается уравнением первого порядка.
[8]
Скорость реакции разложения фосфатов серной кислотой с повышением температуры 9293 ] 08 от 50 до 90 – 100 и выше сильно возрастает.
[9]
Скорость реакции разложения окиси азота при низких температурах мала, поэтому, несмотря на то, что окись азота при этих температурах термодинамически неустойчива, она заметно не разлагается. Так, время, необходимое для разложения чистой окиси азота на 50 %, при 1230 составляет 197 сек. Поэтому окисление азота воздуха стремятся проводить при высоких температурах, при которых возможно получение повышенного количества окиси азота.
[10]
Скорость реакции разложения водяного пара имеет один порядок со скоростью реакции восстановления углекислоты. Однако реакция разложения водяного пара протекает несколько медленнее и высота слоя, необходимая для завершения разложения водяного пара, по исследованиям Н. А. Фуфрянского, в 1 5 – 2 раза превышает соответствующую высоту, необходимую для восстановления углекислоты.
[11]
Скорость реакции разложения ацильных перекисей и гидроперекисей может быть резко повышена за счет актов одноэлектрон-ного окисления-восстановления, вызываемых некоторыми органическими соединениями или ионами металлов переменной валентности.
[13]
Зависимость скорости реакции разложения от температуры выражается уравнением Аррениуса.
[15]
Страницы:
1
2
3
4
Скорость химических реакций
Скорость химической реакции — это величина, показывающая как изменяются концентрации исходных веществ или продуктов реакции за единицу времени.
Разложение муравьиной кислоты
Найдите температурный коэффициент скорости реакции разложения муравьиной кислоты (HCOOH) на углекислый газ (CO2) и водород (H2)в присутствии золотого катализатора, если константа скоростей этой реакции при 413 К равна 5,5 ⋅ 10-4 с-1, а при 458 К – 9,2 ⋅ 10-3 с-1.
Время реакции
При 353 К реакция заканчивается за 20 секунд. Сколько длится время реакции при 293 К, если температурный коэффициент этой реакции равен 2,5.
Увеличить общее давление в системе
Определите, как изменится скорость прямой реакции, если увеличить общее давление в системе в 4 раза. 2 CO + O2 = 2 CO2
Вычислить скорость химической реакции
Реакция между веществами A и B протекает по уравнению 2А + В = С; концентрация вещества А равна 6 моль/л, а вещества B – 5 моль/л. Константа скорости реакции равна 0,5 л2 ⋅ моль-2 ⋅ с-1. Вычислите скорость химической реакции в начальный момент и в тот момент, когда в реакционной смеси останется 45 % вещества […]
В системе уменьшить давление
Равновесие реакции 2NO + O2 = 2NO2 установилось при следующих концентрациях реагирующих веществ (моль/л): С (NO) = 0,5; С (O2) = 0,7; С (NO2) = 2,1. Как изменится скорость прямой и обратной реакций, если в системе уменьшить давление в 2 раза? Произойдет ли при этом смещение равновесия реакции?
В какую сторону сместится химическое равновесие
В какую сторону сместится химическое равновесие реакции: AB = A +B, если повысить температуру на 30 0С? Температурные коэффициенты прямой и обратной реакций соответственно равны 2 и 3.
Скорость реакции объем
Как изменится скорость реакции 2NO(г)+O2(г) = 2NO2(г), если уменьшить объем системы в 2 раза. Скорость реакции объем
Скорость реакции концентрация
Как изменится скорость реакции 2NO(г)+O2(г) = 2NO2(г), если повысить концентрацию в 3 раза. Скорость реакции концентрация
Скорость реакции давление
Как изменится скорость реакции 2NO(г)+O2(г) = 2NO2(г), если увеличить давление в системе в 3 раза. Скорость реакции давление
Период полураспада равен
Константа скорости разложения перекиси водорода равна 0,05 мин-1. Чему равен период полураспада.
