-
Скрытая теплота парообразования
Удельная
теплоемкость
Удельная
теплоемкость — это количество тепла
в Джоулях (Дж), необходимое для повышения
температуры вещества. Удельная
теплоемкость является функцией
температуры. Для газов необходимо
проводить различие между удельной
теплоемкостью при постоянном давлении
и при постоянном объеме.
Удельная
теплота плавления
Удельная
теплота плавления твердого вещества —
это количество тепла в Дж, необходимое
для перевода 1 кг вещества из твердого
состояния в жидкое при температуре
плавления.
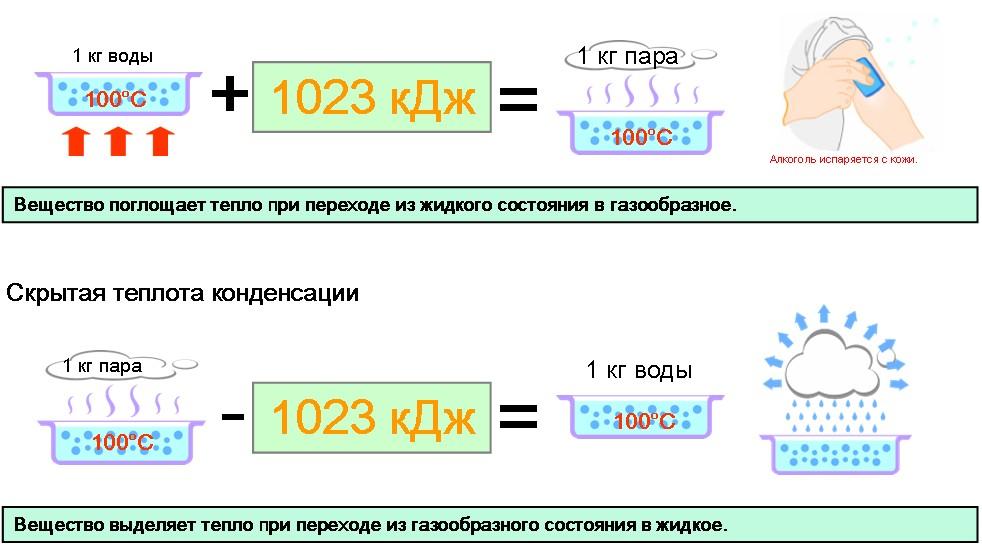
Скрытая
теплота парообразования
Скрытая
теплота парообразования жидкости —
это количество тепла в Дж, необходимое
для испарения 1 кг жидкости при
температуре кипения. Скрытая теплота
парообразования сильно зависит от
давления. Пример: если к емкости,
содержащей 1 кг воды при 100С
(на уровне моря) подвести тепло, вода
поглотит 1023 кДж скрытого тепла без
какого-либо изменения в показаниях
термометра. Однако, произойдет изменение
агрегатного состояния из жидкости в
пар. Поглощенное водой тепло называется
скрытой теплотой парообразования.
Пар сохранит 1023 кДж, поскольку
эта энергия требовалась для изменения
агрегатного состояния.
Скрытая
теплота конденсации
При
обратном процессе, когда тепло отводится
от 1 кг водяного пара при 100С
(на уровне моря), пар выделит 1023 кДж
тепла без изменения в показаниях
термометра. Однако,
произойдет изменение агрегатного
состояния из пара в жидкость. Поглощенное
водой тепло называется скрытой теплотой
конденсации.
-
Температура и давление
Тепловые
измерения
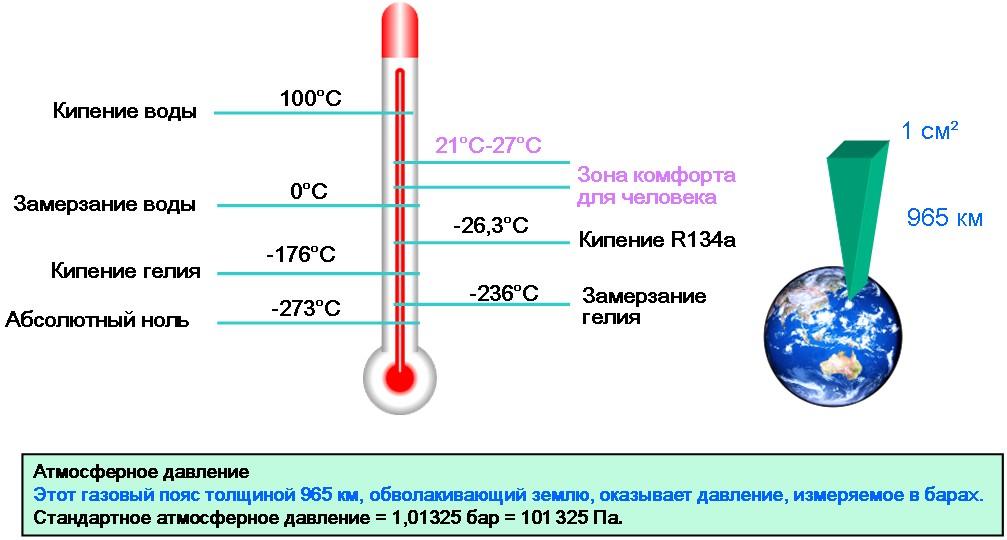
Температура,
или ИНТЕНСИВНОСТЬ тепла, измеряется
термометром. Большинство значений
температуры в данном руководстве
приводятся в градусах Цельсия (С),
однако иногда используются и градусы
Фаренгейта (F).
Значение температуры говорит только
об интенсивности тепла или о ЯВНОМ
ТЕПЛЕ, а не о действительном количестве
тепла. Комфортная температура для
человека находится в пределах от 21 до
27С. В этом диапазоне
температур человек чувствует себя
наиболее комфортно. Когда любая
температура выше или ниже этого
диапазона, человек воспринимает это
как теплое или холодное. В науке
существуют понятие «абсолютный ноль» —
температура, при которой от тела отведено
все тепло. Температура
абсолютного нуля определяется как
–273°C. Любое вещество при температуре
выше абсолютного нуля содержит некоторое
количество тепла. Для понимания
основ кондиционирования воздуха также
необходимо понимать связь между
давлением, температурой и агрегатным
состоянием. Наша планета окружена
воздухом, иначе говоря газом. Давление
в газе передается во всех направлениях
одинаково. Окружающий нас газ состоит
на 21% из кислорода и на 78% из азота.
Остающийся 1% занимают другие редкие
газы. Эта комбинация газов называется
атмосферой. Она простирается на
несколько сотен километров над
земной поверхностью и удерживается
силой гравитации. На уровне моря
атмосферное давление составляет 1,0
бар, а точка кипения воды — 100С.
В любой точке выше уровня моря
атмосферное давление ниже, а также ниже
температура кипения воды. При
понижении давления до 0,38 бар, температура
кипения воды составляет 75С,
а при давлении 0,12 бар — 50С.
Если на точку кипения воды влияет
уменьшение давления, логично предположить,
что увеличение давления также на нее
повлияет. Пример — пароварочный
котел!
Дополнительная
информация: как перевести градусы
Фаренгейта в градусы Цельсия и наоборот:
C = 5/9 × (F – 32). F = (9/5 × C)+32.
Кельвин = C + 273. Ренкин = F + 460.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Свойства пара
СВОЙСТВА НАСЫЩЕННОГО ПАРА
Что это такое и как им пользоваться
Численные значения параметров теплоты, а также взаимосвязь между температурой и давлением, приведенные в настоящем Руководстве, взять из Таблицы “Свойства насыщенного пара”.
Определение применяемых терминов:
Насыщенный пар
Чистый пар, температура которого соответствует температуре кипения воды при данном давлении.
Абсолютное давление
Абсолютное давления пара в барах (избыточное плюс атмосферное).
Зависимость между температурой и давлением
Каждому значению давления чистого пара соответствует определенная температура. Например: температура чистого пара при давлении 10 бар всегда равна 180°С.
Удельный объём пара
Масса пара, приходящаяся на единицу его объёма, кг/м3.
Теплота кипящей жидкости
Количество тепла, которое требуется чтобы повысить температуру килограмма воды от 0°С до точки кипения при давлении и температуре, указанных в Таблице. Выражается в ккал/кг.
Скрытая температура парообразования
Количество тепла в ккал/кг, необходимое для превращения одного килограмма воды при температуре кипения в килограмм пара. При конденсации одного килограмма пара в килограмм воды высвобождает такое же самое количество теплоты. Как видно из Таблицы, для каждого сочетания давления и температуры величина этой теплоты будет разной.
Полная теплота насыщенного пара
Сумма теплоты кипящей жидкости и скрытой теплоты парообразования в ккал/кг. Она соответствует полной теплоте, содержащейся в паре с температурой выше 0°С.
Как пользоваться таблицей
Кроме определения зависимости между давлением и температурой пара, Вы, также, можете вычислить количество пара, которое превратится в конденсат в любом теплообменнике, если известно передаваемое им количество теплоты в ккал. И наоборот, Таблицу можно использовать для определения количества переданной теплообменником теплоты если известен расход образующегося конденсата.
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
Абсолют. Давление бар |
Температ пара °C |
Уд.объем пара м3/кг |
Плотность пара кг/м3 |
Теплота жидкости ккал/кг |
Скрытая теплота парообра- зования ккал/кг |
Полная теплота пара |
|
P |
t |
V |
7 |
q |
r |
X=q+r |
|
0,010 |
7,0 |
129,20 |
0,007739 |
7,0 |
593,5 |
600,5 |
|
0,020 |
17,5 |
67,01 |
0,01492 |
17,5 |
587,6 |
605,1 |
|
0,030 |
24,1 |
45,67 |
0,02190 |
24,1 |
583,9 |
608,0 |
|
0,040 |
29,0 |
34,80 |
0,02873 |
28,9 |
581,2 |
610,1 |
|
0,050 |
32,9 |
28,19 |
0,03547 |
32,9 |
578,9 |
611,8 |
|
0,060 |
36,2 |
23,47 |
0,04212 |
36,2 |
577,0 |
613,2 |
|
0,070 |
39,0 |
20,53 |
0,04871 |
39,0 |
575,5 |
614,5 |
|
0,080 |
41,5 |
18,10 |
0,05523 |
41,5 |
574,0 |
615,5 |
|
0,090 |
43,8 |
16,20 |
0,06171 |
43,7 |
572,8 |
616,5 |
|
0,10 |
45,8 |
14,67 |
0,06814 |
45,8 |
571,8 |
617,6 |
|
0,20 |
60,1 |
7,650 |
0,1307 |
60,1 |
563,3 |
623,4 |
|
0,30 |
69,1 |
5,229 |
0,1912 |
69,1 |
558,0 |
627.1 |
|
0,40 |
75,9 |
3,993 |
0,2504 |
75,8 |
554,0 |
629,8 |
|
0,50 |
81,3 |
3,240 |
0,3086 |
81,3 |
550,7 |
632,0 |
|
0,60 |
86,0 |
2,732 |
0,3661 |
85,9 |
547,9 |
633,8 |
|
0,70 |
90,0 |
2,365 |
0,4229 |
89,9 |
545,5 |
635,4 |
|
0,80 |
93,5 |
2,087 |
0,4792 |
93,5 |
543,2 |
636,7 |
|
0,90 |
96,7 |
1,869 |
0,5350 |
96,7 |
541,2 |
637,9 |
|
1,00 |
99,6 |
1,694 |
0,5904 |
99,7 |
539,3 |
639,0 |
|
1,5 |
111,4 |
1,159 |
0,8628 |
111,5 |
531,8 |
643,3 |
|
2,0 |
120,2 |
0,8854 |
1,129 |
120,5 |
525,9 |
646,4 |
|
2,5 |
127,4 |
0,7184 |
1,392 |
127,8 |
521,0 |
648,8 |
|
3,0 |
133,5 |
0,6056 |
1,651 |
134,1 |
516,7 |
650,8 |
|
3,5 |
138,9 |
0,5240 |
1,908 |
139,5 |
512,9 |
652,4 |
|
4,0 |
143,6 |
0,4622 |
2,163 |
144,4 |
509,5 |
653,9 |
|
4,5 |
147,9 |
0,4138 |
2,417 |
148,8 |
506,3 |
655,1 |
|
5,0 |
151,8 |
0,3747 |
2,669 |
152,8 |
503,4 |
656,2 |
|
6,0 |
158,8 |
0,3155 |
3,170 |
160,1 |
498,0 |
658,1 |
|
7,0 |
164,9 |
0,2727 |
3,667 |
166,4 |
493,3 |
659,7 |
|
8,0 |
170,4 |
0,2403 |
4,162 |
172,2 |
488,8 |
661,0 |
|
9,0 |
175,4 |
0,2148 |
4,655 |
177,3 |
484,8 |
662,1 |
|
10 |
179,9 |
0,1943 |
5,147 |
182,1 |
481,0 |
663,1 |
|
11 |
184,1 |
0,1774 |
5,637 |
186,5 |
477,4 |
663,9 |
|
12 |
188,0 |
0,1632 |
6,127 |
190,7 |
473,9 |
664,6 |
|
13 |
191,6 |
0,1511 |
6,617 |
194,5 |
470,8 |
665,3 |
|
14 |
195,0 |
0,1407 |
7,106 |
198,2 |
467,7 |
665,9 |
|
15 |
198,3 |
0,1317 |
7,596 |
201,7 |
464,7 |
666,4 |
|
16 |
201,4 |
0,1237 |
8,085 |
205,1 |
461,7 |
666,8 |
|
17 |
204,3 |
0,1166 |
8,575 |
208,2 |
459,0 |
667,2 |
|
18 |
207,1 |
0,1103 |
9,065 |
211,2 |
456,3 |
667,5 |
|
19 |
209,8 |
0,1047 |
9,555 |
214,2 |
453,6 |
667,8 |
|
20 |
212,4 |
0,09954 |
10,05 |
217,0 |
451,1 |
668,1 |
|
25 |
223,9 |
0,07991 |
12,51 |
229,7 |
439,3 |
669,0 |
|
30 |
233,8 |
0,06663 |
15,01 |
240,8 |
428,5 |
669,3 |
|
40 |
250,3 |
0,04975 |
20,10 |
259,7 |
409,1 |
668,8 |
|
50 |
263,9 |
0,03943 |
25,36 |
275,7 |
391,7 |
667,4 |
|
60 |
275,6 |
0,03244 |
30,83 |
289,8 |
375,4 |
665,2 |
|
70 |
285,8 |
0,02737 |
36,53 |
302,7 |
359,7 |
662,4 |
|
80 |
295,0 |
0,02353 |
42,51 |
314,6 |
344,6 |
659,2 |
|
90 |
303,3 |
0,02050 |
48,79 |
325,7 |
329,8 |
655,5 |
|
100 |
311,0 |
0,01804 |
55,43 |
336,3 |
315,2 |
651,5 |
|
110 |
318,1 |
0,01601 |
62,48 |
346,5 |
300,6 |
647,1 |
|
120 |
324,7 |
0,01428 |
70,01 |
356,3 |
286,0 |
642,3 |
|
130 |
330,8 |
0,01280 |
78,14 |
365,9 |
271,1 |
637,0 |
|
140 |
336,6 |
0,01150 |
86,99 |
375,4 |
255,7 |
631,1 |
|
150 |
342,1 |
0,01034 |
96,71 |
384,7 |
239,9 |
624,6 |
|
200 |
365,7 |
0,005877 |
170,2 |
436,2 |
141,4 |
577,6 |
1 ккал = 4,186 кдж
1 кдж = 0,24 ккал
1 бар = 0,102 МПа
ПАР ВТОРИЧНОГО ВСКИПАНИЯ
Что такое пар вторичного вскипания:
Когда горячий конденсат или вода
из котла, находящиеся под определенным давлением, выпускают в пространство, где
действует меньшее давление, часть жидкости вскипает и превращается в так
называемый пар вторичного вскипания.
Почему он имеет важное значение :
Этот пар важен потому, что в нем
содержится определенное количество теплоты, которая может быть использована для
повышения экономичности работы предприятия, т.к. в противном случае она будет
безвозвратно потеряна. Однако, чтобы получить пользу от пара вторичного
вскипания, нужно знать как в каком количестве он образуется в конкретных
условиях.
Как он образуется :
Если воду нагревать при атмосферном давлении, ее
температура будет повышаться пока не достигнет 100°С – самой высокой
температуры, при которой вода может существовать при данном давлении в виде
жидкости. Дальнейшее добавление теплоты не повышает температуру воды, а
превращает ее в пар.
Теплота, поглощенная водой в
процессе повышения температуры до точки кипения, называется физической теплотой
или тепло-содержанием. Теплота, необходимая для превращения воды в пар, при
температуре точки кипения, называется скрытой теплотой парообразования.
Единицей теплоты, в общем случае, является килокалория (ккал), которая равна
количеству тепла, необходимому для повышения температуры одного килограмма воды
на 1°С при атмосферном давлении.
Однако, если воду нагревать при
давлении выше атмосферного, ее точка кипения будет выше 100°С, в силу чего
увеличится также и количество требуемой физической теплоты. Чем выше давление,
тем выше температура кипения воды и ее теплосодержание. Если давление
понижается, то теплосодержание также уменьшается и температура кипения воды
падает до температуры, соответствующей новому значению давления. Это значит,
что определенное количество физической теплоты высвобождается. Эта избыточная
теплота будет поглощаться в форме скрытой теплоты парообразования, вызывая
вскипание части воды и превращение ее в пар. Примером может служить выпуск
конденсата из конденсатоотводчика или выпуск воды из котла при продувке.
Количество образующегося при этом пара можно вычислить.
Конденсат при температуре пара 179,9
°C
и
давлении 10 бар обладает теплотой в количестве 182, 1ккал/кг. См. Колонку 5
таблицы параметров пара. Если его выпускать в атмосферу, т.е. при абсолютном
давлении 1 бар, теплосодержание конденсата сразу же упадет до 99,7 ккал/кг.
Избыток теплоты в количестве 82,3 ккал/кг вызовет вторичное вскипание части
конденсата. Величину части конденсата в %, которая превратится в пар вторичного
вскипания, определяют следующим образом :
Разделите разницу между
теплосодержанием конденсата при большем и при меньшем давлениях на величину
скрытой теплоты парообразования при меньшем давлением значении давления и
умножьте результат на 100.
Выразив это в виде формулы,
получим :
% пар вторичного вскипания
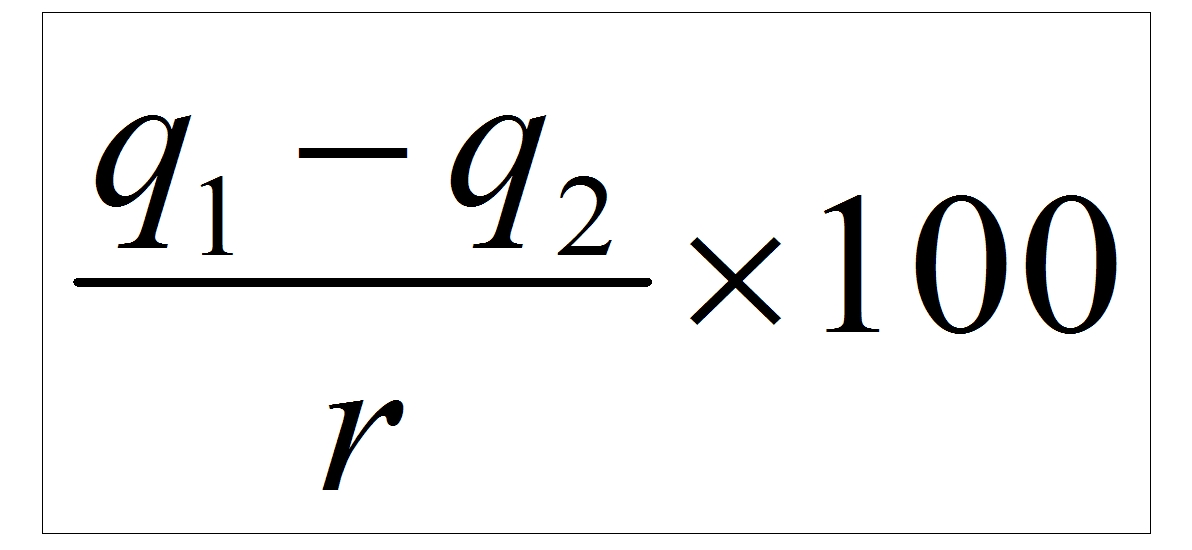
q1 = теплота конденсата при
большем значении давления до его выпуска
q2 = теплота конденсата при
меньшем значении давления, т.е. в пространстве, куда производится выпуск
r =
скрытая теплота парообразования пара при меньшем значении давления, при
котором производится выпуск конденсата
% пара вторичного вскипания =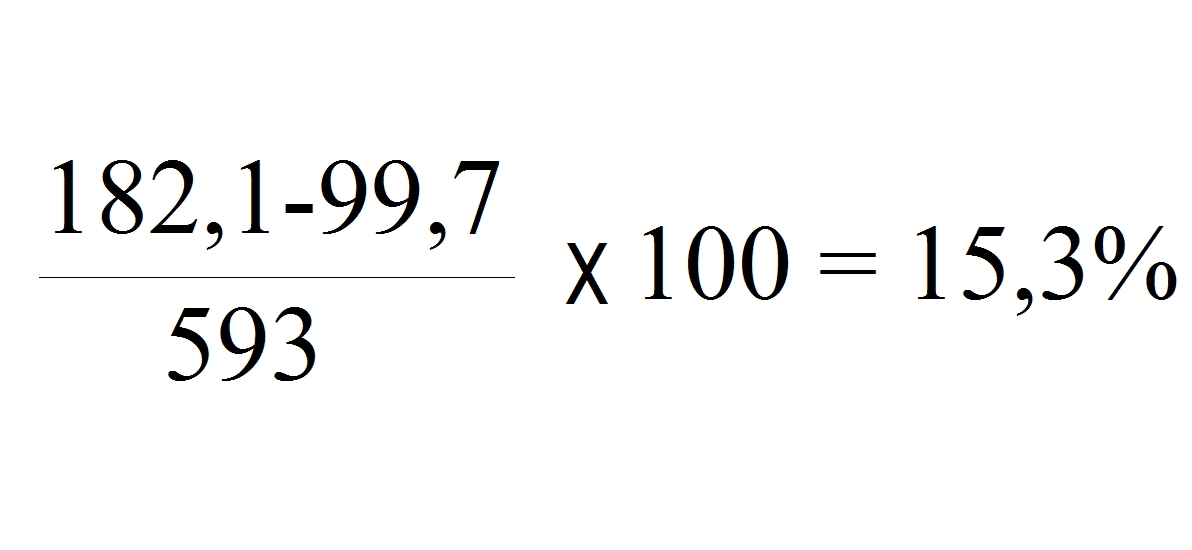
График 1.
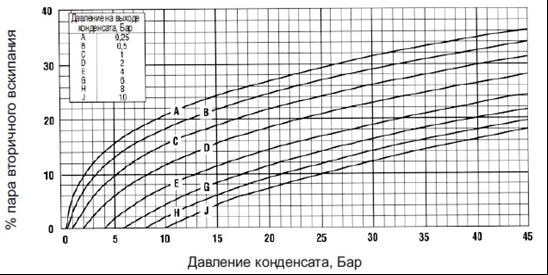
График 2. 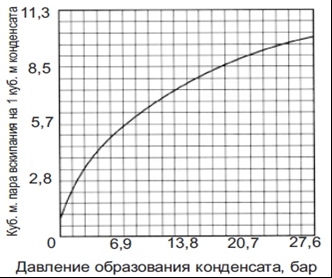
Объем пара вторичного вскипания при выпуске
одного кубического метра конденсата в систему с атмосферным давлением.
Для упрощения
расчетов, на графике показано количество пара вторичного вскипания, которое
будет образовываться, если выпуск конденсата будет производится при разных
давлениях на выходе
Пар… основные понятия
Влияние присутствия воздуха на температуру пара
Рис. 1 поясняет, к чему приводит
присутствие воздуха в паропроводах, а в
Таблице 1 и на Графике 1 показана зависимость снижения температуры пара от
процентного содержания в нем воздуха при различных давлениях.
Влияние присутствия воздуха на теплопередачу
Воздух, обладая отличными
изоляционными свойствами, может образовать, по мере конденсации пара,
своеобразное “покрытие” на поверхностях теплопередачи и значительно
понизить ее эффективность.
При определенных условиях, даже
такое незначительное количество воздуха в паре как 0,5% по объему может
уменьшить эффективность тепло – передачи
на 50%. См. Рис.1
СО2 в газообразной
форме, образовавшись в котле и перемещаясь вместе с паром, может растворится в
конденсате, охлажденном ниже температуры пара, и образовать угольную кислоту.
Эта кислота весьма агрессивна и, в конечном итоге “проест”
трубопроводы и теплообменное оборудование. См. Рис.2. Если в систему попадает
кислород, он может вызвать питтинговую
коррозию чугунных и стальных поверхностей. См. Рис. 3.

Паровая камера со 100%
содержанием пара. Общее давление 10 бар.
Давления пара 10 бар температура пара 180°С
Рис.1. Камера, в которой
находится смесь пара и воздуха, передает только ту часть теплоты, которая
соответствует парциальному давлению пара, а не полному давлению в ее полости.

Паровая камера с содержанием
пара 90%
И воздуха 10%. Полное давление
10 бар. Давление
Пара 9 бар, температура пара 175,4°С
Таблица 1.
|
Снижение температуры паро-воздушной |
||||
|
Давление |
Температура насыщ. пара |
Температура паро-воздушной смеси от |
||
|
бар |
°C |
10% |
20% |
30% |
|
2 |
120,2 |
116.7 |
113.0 |
110.0 |
|
4 |
143.6 |
140.0 |
135.5 |
131.1 |
|
6 |
158.8 |
154.5 |
150.3 |
145.1 |
|
8 |
170.4 |
165.9 |
161.3 |
155.9 |
|
10 |
179.9 |
175.4 |
170.4 |
165.0 |
Свойства пара
Теплофизические свойства воды и водяного пара (программа расчета)
Методические указания по очистке и контролю возвратного конденсата (РД 34.37.515-93)
From Wikipedia, the free encyclopedia

Temperature-dependency of the heats of vaporization for water, methanol, benzene, and acetone
In thermodynamics, the enthalpy of vaporization (symbol ∆Hvap), also known as the (latent) heat of vaporization or heat of evaporation, is the amount of energy (enthalpy) that must be added to a liquid substance to transform a quantity of that substance into a gas. The enthalpy of vaporization is a function of the pressure at which the transformation (vaporization or evaporation) takes place.
The enthalpy of vaporization is often quoted for the normal boiling temperature of the substance. Although tabulated values are usually corrected to 298 K, that correction is often smaller than the uncertainty in the measured value.
The heat of vaporization is temperature-dependent, though a constant heat of vaporization can be assumed for small temperature ranges and for Reduced temperature Tr ≪ 1. The heat of vaporization diminishes with increasing temperature and it vanishes completely at a certain point called the critical temperature (Tr = 1). Above the critical temperature, the liquid and vapor phases are indistinguishable, and the substance is called a supercritical fluid.
Units[edit]
Values are usually quoted in J/mol, or kJ/mol (molar enthalpy of vaporization), although kJ/kg, or J/g (specific heat of vaporization), and older units like kcal/mol, cal/g and Btu/lb are sometimes still used among others.
Enthalpy of condensation[edit]
The enthalpy of condensation (or heat of condensation) is by definition equal to the enthalpy of vaporization with the opposite sign: enthalpy changes of vaporization are always positive (heat is absorbed by the substance), whereas enthalpy changes of condensation are always negative (heat is released by the substance).
Thermodynamic background[edit]
Molar enthalpy of zinc above 298.15 K and at 1 atm pressure, showing discontinuities at the melting and boiling points. The enthalpy of melting (ΔH°m) of zinc is 7323 J/mol, and the enthalpy of vaporization (ΔH°v) is 115330 J/mol.
The enthalpy of vaporization can be written as
It is equal to the increased internal energy of the vapor phase compared with the liquid phase, plus the work done against ambient pressure. The increase in the internal energy can be viewed as the energy required to overcome the intermolecular interactions in the liquid (or solid, in the case of sublimation). Hence helium has a particularly low enthalpy of vaporization, 0.0845 kJ/mol, as the van der Waals forces between helium atoms are particularly weak. On the other hand, the molecules in liquid water are held together by relatively strong hydrogen bonds, and its enthalpy of vaporization, 40.65 kJ/mol, is more than five times the energy required to heat the same quantity of water from 0 °C to 100 °C (cp = 75.3 J/K·mol). Care must be taken, however, when using enthalpies of vaporization to measure the strength of intermolecular forces, as these forces may persist to an extent in the gas phase (as is the case with hydrogen fluoride), and so the calculated value of the bond strength will be too low. This is particularly true of metals, which often form covalently bonded molecules in the gas phase: in these cases, the enthalpy of atomization must be used to obtain a true value of the bond energy.
An alternative description is to view the enthalpy of condensation as the heat which must be released to the surroundings to compensate for the drop in entropy when a gas condenses to a liquid. As the liquid and gas are in equilibrium at the boiling point (Tb), ΔvG = 0, which leads to:
As neither entropy nor enthalpy vary greatly with temperature, it is normal to use the tabulated standard values without any correction for the difference in temperature from 298 K. A correction must be made if the pressure is different from 100 kPa, as the entropy of a gas is proportional to its pressure (or, more precisely, to its fugacity): the entropies of liquids vary little with pressure, as the compressibility of a liquid is small.
These two definitions are equivalent: the boiling point is the temperature at which the increased entropy of the gas phase overcomes the intermolecular forces. As a given quantity of matter always has a higher entropy in the gas phase than in a condensed phase (
,
the Gibbs free energy change falls with increasing temperature: gases are favored at higher temperatures, as is observed in practice.
Vaporization enthalpy of electrolyte solutions[edit]
Estimation of the enthalpy of vaporization of electrolyte solutions can be simply carried out using equations based on the chemical thermodynamic models, such as Pitzer model[1] or TCPC model.[2]
Selected values[edit]
Elements[edit]
The vaporization of metals is a key step in metal vapor synthesis, which exploits the increased reactivity of metal atoms or small particles relative to the bulk elements.
Other common substances[edit]
Enthalpies of vaporization of common substances, measured at their respective standard boiling points:
| Compound | Boiling point, at normal pressure | Heat of vaporization | |||
|---|---|---|---|---|---|
| (K) | (°C) | (°F) | (J/mol) | (J/g) | |
| Acetone | 329 | 56 | 133 | 31300 | 538.9 |
| Aluminium | 2792 | 2519 | 4566 | 294000 | 10500 |
| Ammonia | 240 | −33.34 | −28 | 23350 | 1371 |
| Butane | 272–274 | −1 | 30–34 | 21000 | 320 |
| Diethyl ether | 307.8 | 34.6 | 94.3 | 26170 | 353.1 |
| Ethanol | 352 | 78.37 | 173 | 38600 | 841 |
| Hydrogen (parahydrogen) | 20.271 | −252.879 | −423.182 | 899.2 | 446.1 |
| Iron | 3134 | 2862 | 5182 | 340000 | 6090 |
| Isopropyl alcohol | 356 | 82.6 | 181 | 44000 | 732.2 |
| Methane | 112 | −161 | −259 | 8170 | 480.6 |
| Methanol | 338 | 64.7 | 148 | 35200[3] | 1104 |
| Propane | 231 | −42 | −44 | 15700 | 356 |
| Phosphine | 185 | −87.7 | −126 | 14600 | 429.4 |
| Water | 373.15 | 100 | 212 | 40660 | 2257 |
See also[edit]
- Clausius–Clapeyron relation
- Shimansky equation, describes the temperature dependence of the heat of vaporization
- Enthalpy of fusion, specific heat of melting
- Enthalpy of sublimation
- Joback method, estimation of the heat of vaporization at the normal boiling point from molecular structures
- Latent heat
References[edit]
- ^ Ge, Xinlei; Wang, Xidong (20 May 2009). “Estimation of Freezing Point Depression, Boiling Point Elevation, and Vaporization Enthalpies of Electrolyte Solutions”. Industrial & Engineering Chemistry Research. 48 (10): 5123. doi:10.1021/ie900434h.
- ^ Ge, Xinlei; Wang, Xidong (2009). “Calculations of Freezing Point Depression, Boiling Point Elevation, Vapor Pressure and Enthalpies of Vaporization of Electrolyte Solutions by a Modified Three-Characteristic Parameter Correlation Model”. Journal of Solution Chemistry. 38 (9): 1097–1117. doi:10.1007/s10953-009-9433-0. ISSN 0095-9782. S2CID 96186176.
- ^ NIST
- CODATA Key Values for Thermodynamics
- Gmelin, Leopold (1985). Gmelin-Handbuch der anorganischen Chemie / 08 a (8., völlig neu bearb. Aufl. ed.). Berlin [u.a.]: Springer. pp. 116–117. ISBN 978-3-540-93516-2.
- NIST Chemistry WebBook
- Young, Francis W. Sears, Mark W. Zemansky, Hugh D. (1982). University physics (6th ed.). Reading, Mass.: Addison-Wesley. ISBN 978-0-201-07199-3.
Физика > Скрытая теплота
Скрытая теплота – энергия, связанная с переменой состояния вещества.
Задача обучения
- Рассмотреть скрытую теплоту как форму энергии.
Основные пункты
- Энергия нужна для изменения состояния вещества (например, для разрыва связей между молекулами во льде, чтобы он расплавился).
- Во время изменения состояния энергию могут добавить или отнять, но температура останется стабильной (меняется лишь в самом конце).
- Тепло, необходимое для изменения фазы: Q = mLf (плавление или замораживание) и Q = mLv (испарение или конденсация), где Lf и Lv – скрытое тепло плавления и испарения.
Термины
- Сублимация – переход вещества из твердого состояния в парообразное, минуя жидкий этап.
- Скрытая теплота испарения – энергия, которая нужна для перехода из жидкости в пар.
- Скрытая теплота плавления – энергия, которая нужна для перехода из твердого состояния в жидкость.
Скрытая теплота
Давайте рассмотрим воду, стекающую с сосулек, плавящихся на крыше под солнечным светом. А также воду, замерзающую в поддоне.

Тепло от воздуха передается льду, что приводит к таянию
Чтобы твердое вещество расплавилось, понадобится определенное количество энергии. Ей придется раздробить связанные молекулы, чтобы обеспечить им перемещение. Также потребуется энергия для испарения. Когда меняется состояние, температура остается той же. Энергия выделяется в виде тепловой, а работа выполняется суммой сил при объединении молекул.
Энергия зависит от двух факторов: количества и силы связей. Число связей выступает пропорциональным количеству молекул, а значит массе. Сила основывается на типе молекул. Теплота вычисляется по формуле:
Q = mLf (плавление или заморозка).
Q = mLv (выпаривание или конденсация).
Здесь Lf – скрытая теплота плавления, a Lv – скрытая теплота испарения.

(а) – Энергия расходуется на частичное преодоление сил притяжения между молекулами в твердом теле с трансформацией в жидкость. Она удалится в процесс заморозки. (b) – Молекулы разделены большими дистанциями при переходе от жидкости к пару, поэтому понадобится много энергии, чтобы побороть молекулярное притяжение. Когда меняется состояние, температурный показатель остается прежним
Скрытая теплота – интенсивное свойство, выраженное в Дж/кг. Lf и Lv зависят от вещества, особенно от молекулярных сил. Это коэффициенты скрытого тепла. При перемене состояния энергия поступает и удаляется, не вызывая изменения в температуре, поэтому считается скрытой. Плавление и испарение выступают эндотермическими процессами, потому что поглощают энергию, а замораживание и конденсация – экзотермические, так как выделяют ее.
Энергия связана с изменением состояния. Допустим нам нужно расплавить килограмм льда, чтобы получить килограмм воды при 0°C. Возьмем уравнение для изменения температуры и значения для воды (334 кДж/кг) и получим Q = mLf = (1.0 кг)(334 кДж/кг) = 334 кДж. Это то количество энергии, которую нужно потратить на плавление воды. Для испарения понадобится еще больше энергии. 1 кг воды перейдет в пар при 2256 кДж.
Перемены состояния могут обладать стабилизирующим эффектом. Добавим тепло в лед с температурой -20°C. Сначала температура поднимается линейно, поглощая тепло со стабильной скоростью 0.50 кал/г⋅C до достижения нуля. Здесь лед начнет таять и на финальной стадии поглотит 79.8 кал/г тепла. Как только процесс плавления закончится, температура воды повысится, поглощая тепло при новой постоянной скорости 1.00 кал/г·С. При температуре 100°C запускается кипение, а температурный показатель снова стабилен, пока вода не поглотит 539 кал/г тепла. Когда вся жидкость превращается в пар, температура снова поднимается, поглощая тепло со скоростью 0.482 кал/г⋅С.

Этот график показывает, как температура зависит от энергии. Здесь пар не испаряется, пока не нагреется лед, чтобы стать жидкой водой. Длинные отрезки стабильных показателей температуры при 0°C и 100°C отражают значительное скрытое тепло плавления и испарения
Обсуждаемый переход состояний – сублимация (из твердого вещества в пар). Есть также и обратный процесс – осаждение. У сублимации есть собственное скрытое тепло Ls.
Лабораторная работа № 10
Определение скрытой теплоты парообразования жидкости.
Цель
работы: Определить скрытую теплоту парообразования
жидкости.
Принадлежности:
Форвакуумный насос; ртутный манометр;
ловушка; краны.
Литература:
1. А.Н. Матвеев. Молекулярная
физика; М.: Высшая школа; 1987
2.
А.К. Кикоин, И. К. Кикоин. Молекулярная физика; М.: Наука; 1976
3.
И.В. Радченко Молекулярная физика; М.: Наука; 1965
4.
В.М. Гзогян, Ю.И. Полыгалов. Ключевые вопросы молекулярной физики; Кемерово;
2003 г.
Краткая теория
Из анализа уравнения
Ван-дер-Ваальса и экспериментальных изотерм следует, что при некоторых условиях
жидкость может находиться в равновесии со своим паром. Это равновесие
устанавливается само собой, если жидкость находится в закрытом сосуде. В этом
случае пар над жидкостью называется насыщенным.
Равновесие
устанавливается следующим образом. В закрытом сосуде наряду с процессом
испарения будет идти и процесс конденсации. Ясно, что число конденсирующихся
молекул пропорционально концентрации (числу в единице
объема) молекул пара. Поэтому в закрытом сосуде непременно наступит равновесие,
т. е. такой момент, когда число молекул, покинувших жидкость, станет равно
числу молекул, конденсирующихся за то же время. при этом в сосуде установится
некоторая постоянная концентрации молекул пара, которая соответствует определенному
давлению. это давление называется упругостью насыщенного пара.
Рассмотрим процесс
испарения подробнее. часть молекул покидает жидкость, образуя пар. очевидно,
что покинуть жидкость могут не все молекулы, а только те, кинетическая энергия
которых достаточна для преодоления сил притяжения со стороны оставшихся
молекул, и для совершения работы против давления уже образовавшегося пара.
Таким образом, жидкость будут покидать самые быстрые молекулы, однако, как
известно, температура – мера кинетической энергии молекул, а так как самые
быстрые молекулы покидают жидкость, температура ее в процессе испарения будет
уменьшаться. Для того, чтобы испарение жидкости шло без понижения температуры,
к ней надо подводить тепло. Это тепло называется скрытой теплотой
парообразования (испарения) и обозначается ![]() .
.
Удельной скрытой теплотой парообразования называется количество теплоты,
необходимое для изотермического испарения 1 кг жидкости при давлении, равном
давлению ее насыщающих (обозначается ![]() ). Для
). Для
молярной скрытой теплоты испарения, очевидно, имеет место:
 , где
, где ![]() – молярная масса данной жидкости.
– молярная масса данной жидкости.
Рассуждая
аналогично, приходим к выводу, что процесс конденсации будет сопровождаться
выделением теплоты, называемой скрытой теплотой конденсации. Ясно, что скрытая
теплота испарения равна скрытой теплоте конденсации. Скрытая теплота испарения
– одна из основных характеристик жидкости. Как мы видели, она зависит от
внешнего давления насыщенных паров и от силы взаимодействия молекул, т. е. эта
величина качественно характеризует силу связи между молекулами жидкости. Чем ![]() больше, тем больше эти силы.
больше, тем больше эти силы.
Существует
ряд методов измерений скрытой теплоты испарения (конденсации) жидкостей. В
большинстве своем они основаны на применении калориметров, при помощи которых
измеряется количество поглощенной (или выделившейся) теплоты. Все они достаточно
сложны при практическом исполнении, кроме того, несмотря на применение калориметров
будет затруднительно учесть все тепловые воздействия на исследуемую жидкость.
Описанный ниже метод достаточно прост в исполнении и дает хорошие результаты.
Теория метода основана на статистических закономерностях.
Краткая теория метода. Как известно,
распределение Больцмана можно записать в виде:
![]()
(1)
Здесь
![]() – концентрация молекул, обладающих
– концентрация молекул, обладающих
нулевой по отношению к ![]() потенциальной энергии,
потенциальной энергии, ![]() – концентрация молекул, обладающих потенциальной
– концентрация молекул, обладающих потенциальной
энергией ![]() ,
, ![]() – температура в Кельвинах ( по абсолютной
– температура в Кельвинах ( по абсолютной
шкале), ![]() – постоянная Больцмана.
– постоянная Больцмана.
Средняя энергия
молекул, вылетевших из жидкости, отличается от энергии молекул внутри жидкости
на величину ![]() , где
, где ![]() –
–
молярная скрытая теплота испарения, ![]() – число Авогадро.
– число Авогадро. ![]() – это и есть та энергия
– это и есть та энергия ![]() , которая входит в формулу (1). Значит, мы
, которая входит в формулу (1). Значит, мы
можем записать:
![]() (2)
(2)
Здесь ![]() –
–
концентрация молекул жидкости, их потенциальную энергию принимаем равной нулю, ![]() – концентрация молекул пара.
– концентрация молекул пара.
Исходя
из основного уравнения молекулярно-кинетической теории ![]() ,
,
где ![]() – давление,
– давление, ![]() –
–
концентрация молекул газа, можно записать для нашего случая:
![]()
(3)
Здесь
![]() , очевидно, будет парциальным давлением
, очевидно, будет парциальным давлением
пара, т.е. давлением, которое оказывал бы данный пар в отсутствии иных газов.
Подставим выражение для ![]() в формулу (2)
в формулу (2)

или
![]()
(4)
Это
уравнение определяет температурную зависимость упругости насыщенного пара. При
выводе (4) мы молчаливо полагали, что ![]() и
и ![]() не зависит от
не зависит от ![]() . При
. При
строгом рассмотрении (4) необходимо учитывать, что и ![]() и
и ![]() также зависят от температуры.
также зависят от температуры.
Практически
более удобно записывать (4), предварительно прологарифмировать его. Тогда
имеем:

Легко
заметить, что ![]() есть величина постоянная (при
есть величина постоянная (при
наших допущениях). Обозначим ![]() = С (константа),
= С (константа),
характерная для данной жидкости. Замечаем также, что![]() , тогда
, тогда
![]() (5)
(5)
![]() – это медленно меняющаяся функция
– это медленно меняющаяся функция
температуры, в первом приближении ее можно считать постоянной и включить в
константу С. Тогда (5) примет вид:
![]()
(6)
Таким образом, имея
данную зависимость, можно определить значение ![]() .
.
Именно эта формула является рабочей формулой метода. Уравнение (6) можно
вывести еще одним способом – основываясь на термодинамических закономерностях
(см. Молекулярная физика. А. К. Кикоин, И.К. Кикоин).
Описание экспериментальной установки.
Как
видно из формулы (6) для того, чтобы определить ![]() необходимо
необходимо
снять зависимость ![]() . С этой целью используется
. С этой целью используется
установка, изображенная на рис. 1.,
где
1 – цилиндр с исследуемой жидкостью,
рабочая часть установки, представляющая собой толстостенный цилиндр из дюралюминия,
в который помещена исследуемая жидкость ( в данной работе – вода). В цилиндре
имеется два окна, позволяющих визуально засекать момент закипания жидкости.
Внутри имеется также нагреватель, позволяющий нагреть исследуемую жидкость до
желаемой температуры. Шнур нагревателя выведен наружу.;
2 – термометр, позволяющий
контролировать температуру внутри цилиндра.;
3 – ловушка, внутренняя часть которой
заполняется льдом, служит для сбора влаги. Пар воды, засасываемый насосом
вместе с воздухом, проходят через ловушку, конденсируется на холодном стекле и
не достигается манометра и насоса.;
4 – ртутный манометр, предназначенный
для измерения давления в системе ( градуировка в мм. рт. ст.).;
5 – двухходовой кран К1, позволяющий подключить насос
к системе, изолировать систему от атмосферы и соединять насос с атмосферой.
6 – форвакуумный насос, позволяющий
понизить давление в системе до любого, требуемого уровня ( не ниже 25 – 30 мм.
рт. ст.).
7 – кран К2 для соединения системы с атмосферой.

Рис. 1. Установка для определения скрытой теплоты
парообразования жидкости
Измерения
Примечание: Прежде чем приступать к
работе, выясните, чему соответствует каждое положение ручек кранов К1
и К2.
Кран К1 – двухходовой. При помощи
такого крана можно соединять насос либо с системой, либо с атмосферой.
а)
если рукоятка крана направлена на надпись “система” – в этом случае установка
подключена к форвакуумному насосу;
б)
если рукоятка крана направлена на надпись “ закрыто” – это означает, что
система отключена от насоса;
в)
если рукоятка крана направлена на надпись “атмосфера”- это означает, что
система отключена от насоса и насос соединен с атмосферой.
Кран К2 – проходной, служит для
сообщения, либо разъединения системы с атмосферой.
а)
если рукоятка направлена на надпись “ закрыто” – система изолирована от
атмосферы;
б)
если рукоятка направлена на “открыто” – система соединена с атмосферой.
1.
В вакуумную ловушку осторожно положите кусочек льда для того,
чтобы пары воды не попадали в насос, а конденсировались в ловушке.
2.
Поставьте краны К1 и
К2 в положение
“закрыто” и включите форвакуумный насос в сеть.
3.
Плавно поверните кран К1
в положение “система” и откачайте воздух из установки до
давления 25 – 30 мм. рт. ст.. Давление при этом контролируется по ртутному
манометру.
4.
После этого кран К1
поставьте в положение “закрыто”, отключите от сети форвакуумный насос и тотчас
же поверните кран К1 в
положение “атмосфера”.
Обязательно
проделайте эту операцию, иначе масло из насоса попадет в систему!
5.
Далее
непосредственно переходите к эксперименту. Для этого включите нагреватель,
который находится в цилиндре с исследуемой жидкостью и , контролируя поведение
жидкости, снимите показания термометра и манометра в момент закипания жидкости.
После этого нагреватель отключите от сети.
6.
При помощи
крана К2 впустите в систему небольшую порцию воздуха из окружающей среды
(атмосферы), чтобы давление повысилось на 40 – 50 мм. рт. ст.. Вновь доведите
воду до кипения и снимите показания термометра и манометра.
7.
Таким
образом, повторяя операцию пункта 6, снимите 8 – 10 точек, повышая каждый раз
давление на 40 – 50 мм. рт. ст. по сравнению с предыдущей точкой.
8.
Для
определения скрытой теплоты парообразования жидкости по результатам измерений
строится график ![]() ,
, ![]() где Т – температура в
где Т – температура в
градусах Кельвина, Р – давление в Н/м2. График имеет приведенные на рис. 2 вид.
Рис 2.
Примерный вид графика зависимости ![]()
По тангенсу угла
наклона ![]() прямой
прямой ![]() определяется
определяется
![]() . Практически нужно определить
. Практически нужно определить ![]() . Так как
. Так как ![]() , тригонометрические
, тригонометрические
формулы приведения дают ![]() . Таким образом,
. Таким образом, ![]() ;
; ![]() .
.
Контрольные
вопросы
1. Что такое
насыщенный пар? Запишите уравнение зависимости давления насыщенного пара от
температуры (уравнение Клапейрона-Клаузиуса).
2. Получите
уравнение Клапейрона-Клаузиуса, используя метод воображаемых круговых
процессов.
3.
Путем интегрирования уравнения Клапейрона-Клаузиуса получите
формулу  .
.
4. Какие еще
процессы можно описывать с помощью уравнения Клапейрона-Клаузиуса?
5. На диаграмме ![]() приведите кривые этих процессов.
приведите кривые этих процессов.
Рассмотрите отдельно случаи ![]() и
и![]() , где
, где ![]() –
–
объемы твердого и жидкого состояний.
6. Дайте понятие
тройной точки, приведите значения параметров тройной точки для воды.
7. Какими эффектами
сопровождаются фазовые первого рода?
8. Можно ли
использовать (и как) уравнение Клапейрона-Клаузиуса для описания фазовых
переходов второго рода? Какие переходы относятся к переходам второго рода?
9. Какой критерий
термодинамического потенциала Гиббса используется при разделении фазовых
переходов первого и второго рода?
10. Как Вы понимаете полиморфные
превращения, приведите конкретные примеры таких превращений? К переходам какого
рода относятся эти превращения?
11. Чем отличается процесс кипения
от процесса испарения? Почему закипая вода “шумит”?
12. Дайте понятие перегретого и
пересыщенного пара, перегретой и переохлажденной жидкости. Какие меры
предосторожности можно предпринять для предотвращения перегрева жидкости? В чем
опасность перегрева жидкости? В какой области физики используют явление пересыщения
водяного пара и перегрева воды?
13. Что следует понимать под
понятием скрытой теплоты парообразования (плавления, сублимации)?
14. В координатной системе ![]() , где
, где ![]() -температура,
-температура,
![]() – время приведите диаграмму плавкости
– время приведите диаграмму плавкости
твердых тел. Рассмотрите также возможность переохлаждения жидкости.
15. Выведите барометрическую
формулу и рассмотрите закон изменения давления с высотой для различных газов.
Почему процентный состав в воздухе, до высот порядка 20 км, остается
постоянным?
16. Объясните устройство и
принцип действия форвакуумного насоса. Что такое скорость откачки?
17. Вывести рабочую формулу для
определения скрытой теплоты парообразования.
18. Как изменяется энтропия
системы при фазовых переходах первого и второго рода?



