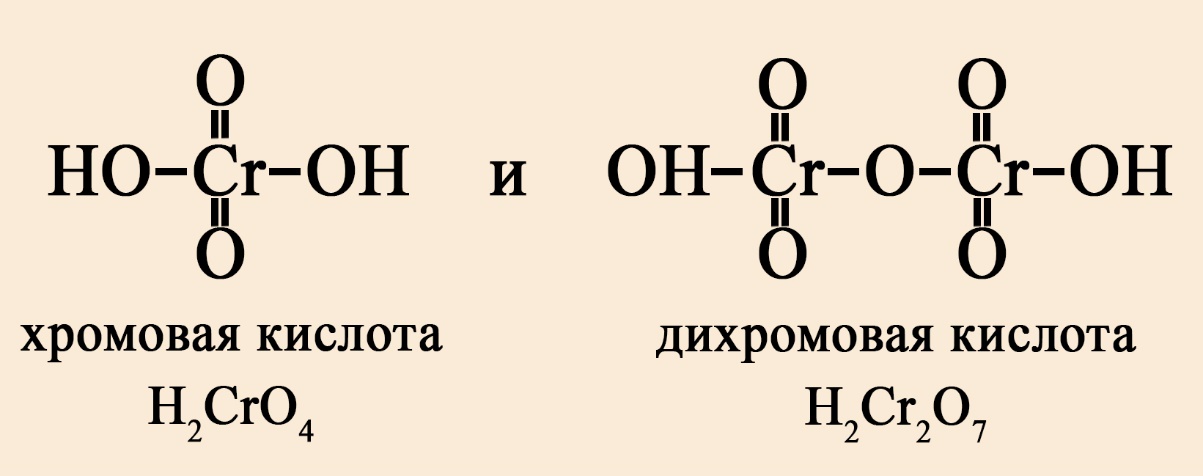Классификация кислот
Материал по химии
- Определение кислот
- Классификация кислот по составу
- Классификация кислот по основности
- Сильные и слабые кислоты
- Тривиальные названия некоторых кислот
- «Протон» или «катион»?
- Кислоты и индикаторы
Определение кислот
Кислоты ‒ это вещества, способные в растворах отдавать катион (протон) водорода.
Примеры диссоциации кислот:
HCl ↔ H+ + Cl‒
H2SO4 ↔ 2H+ + SO42‒
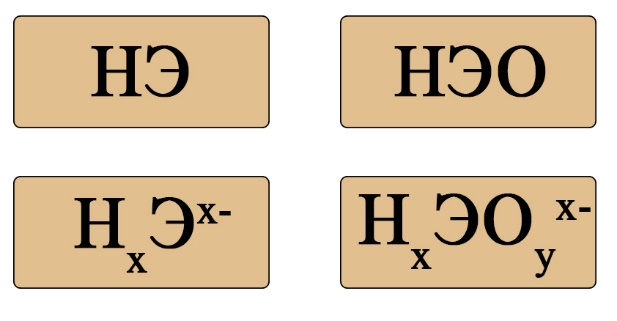
Если пока понятие диссоциации неизвестно, легче ориентироваться по общим формулам кислот:
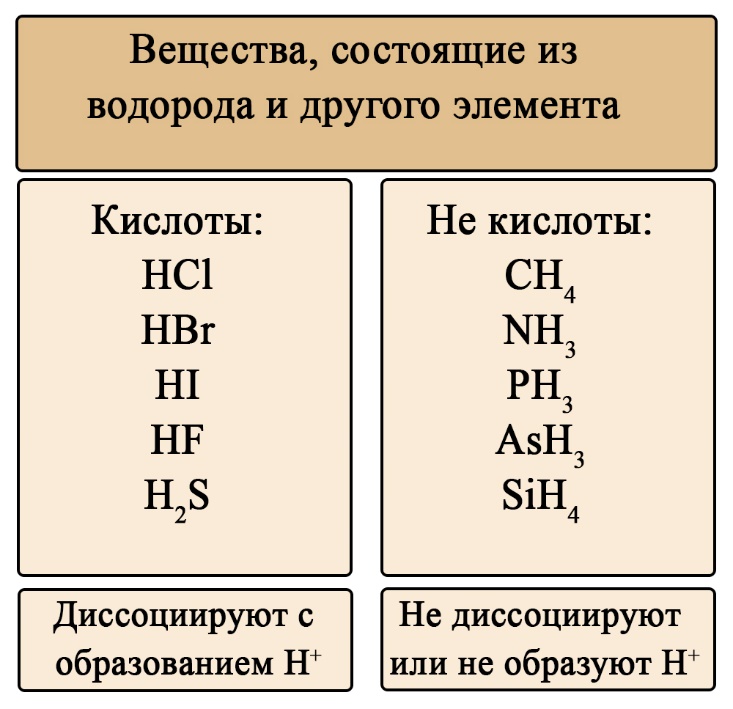
Важен не только состав, но и последовательность. На первом месте должен стоять водород, за ним – элемент, если в составе есть кислород, то он должен стоять последним. Например, HCl – кислота (соответствует формуле HЭ), H2S – тоже кислота (на первом месте водород, на втором – сера), а вот NH3 несмотря на то, что состоит из водорода и элемента, не является кислотой, это легко определить по последовательности: в этой формуле сначала стоит элемент, а за ним – водород (иногда, чтобы запутать сдающего, составитель может написать не NH3, а H3N, Вы должны помнить, что NH3 (аммиак), PH3(фосфин), AsH3 (арсин), CH4 (метан) – не являются кислотами, так как в воде либо не диссоциируют, либо диссоциируют без образования протона водорода. H2SO4 – является кислотой, так как формула имеет порядок элементов «водород → элемент → кислород», а NaOH, тоже состоящая из элемента, кислорода и водорода – кислотой не является, так как тут последовательность будет такова: «элемент → кислород → водород».
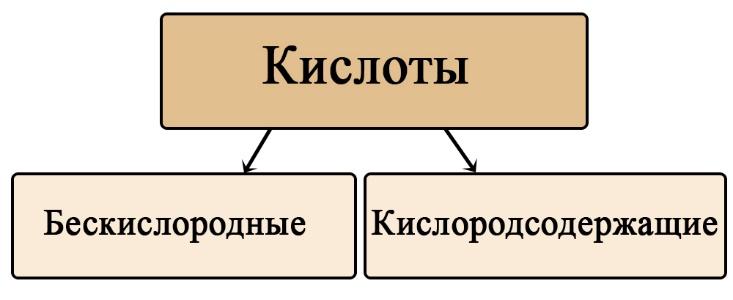
Классификация кислот по составу
Кислоты можно разделить на кислородсодержащие и бескислородные. Не трудно догадаться, что бескислородные не содержат атомов кислорода, а кислородсодержащие – содержат. Кислородсодержащие кислоты образованы соответствующими оксидами, а бескислородные образованы прямым взаимодействием простых веществ.
Таб. Примеры бескислородных и кислородсодержащих кислот, образованных одним и тем же неметаллом
|
Бескислородные |
Кислородсодержащие |
|
HCl |
HClO4 |
|
H2S |
H2SO3 |
|
HBr |
HBrO |
|
HI |
HIO2 |
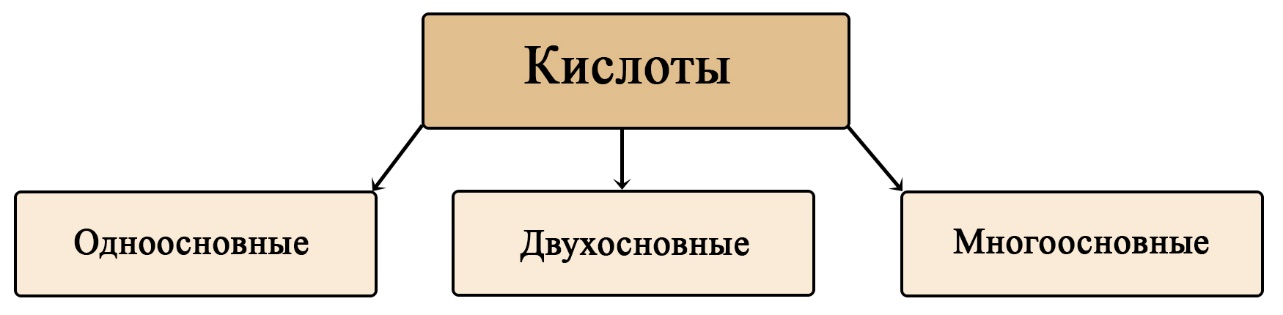
Классификация кислот по основности
Кислоты могут отдать столько водорода, сколько имеется в их составе (в большинстве случаев, есть исключения). Если может отдать максимум один водород – то кислота относится к одноосновным, если может отдать максимум два протона водорода – то двухосновная и так далее.
Например:
HCl ↔ H+ + Cl‒ (одноосновная)
H2SO4 ↔ 2H+ + SO42‒ (двухосновная)
H3PO4 ↔ 3H+ + PO43- (трехосновная/многоосновная)
Таб. Примеры кислот с разной основностью
|
Одноосновные (один водород) |
Двухосновные (два водорода) |
Многоосновные (три и более протона водорода) |
|
HNO3 |
H2S |
H3PO4 |
|
HF |
H2SiO3 |
H3BO3 |
|
HBrO |
H2CO3 |
H4P2O7 |
Сильные и слабые кислоты
От чего зависит сила кислот? В первую очередь от скорости отдачи протона водорода при диссоциации (чем быстрее кислота отдает протон водорода, тем она считается сильнее). Как определить скорость «на глаз», не имея под рукой никаких справочных материалов, кроме таблицы Менделеева?
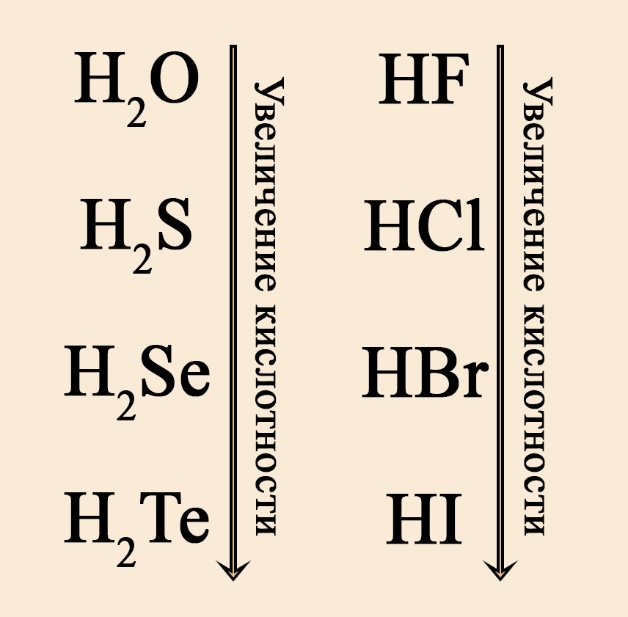
- Если кислота бескислородная, то скорость диссоциации можно определить по радиусу атома, образующего эту кислоту элемента. Напомним, что радиус увеличивается в ПС (периодической системе) сверху-вниз и справа-налево. Так, в ряду кислот HF → HCl → HBr → HI радиус увеличивается от фтора к йоду, так как йод стоит в ПС значительно ниже, чем фтор. Радиус фтора небольшой, поэтому протон водорода прочно связан со фтором, скорость диссоциации будет низкой, значит, кислота слабая. У йода пять электронных оболочек, между йодом и водородом большее расстояние, чем между фтором и водородом, поэтому молекула йодоводорода будет диссоциировать значительно быстрее, значит, кислота сильная. Аналогичную закономерность можно наблюдать в ряду кислот, образованных халькогенами (неметаллами VIА-группы): чем ниже халькоген, тем сильнее образуемая им кислота, поэтому H2S слабее H2Se, а H2Se слабее, чем H2Te.
- Если кислота кислородсодержащая, то её сила зависит от количества кислорода, не входящего в гидроксо-группы. Чем больше кислорода вне -OH группы, тем сильнее кислота. Так, дихромовая кислота сильнее хромовой, потому как дихромовая кислота имеет четыре кислорода вне гидроксо-группы, а хромовая – два кислорода вне гидроксогруппы.
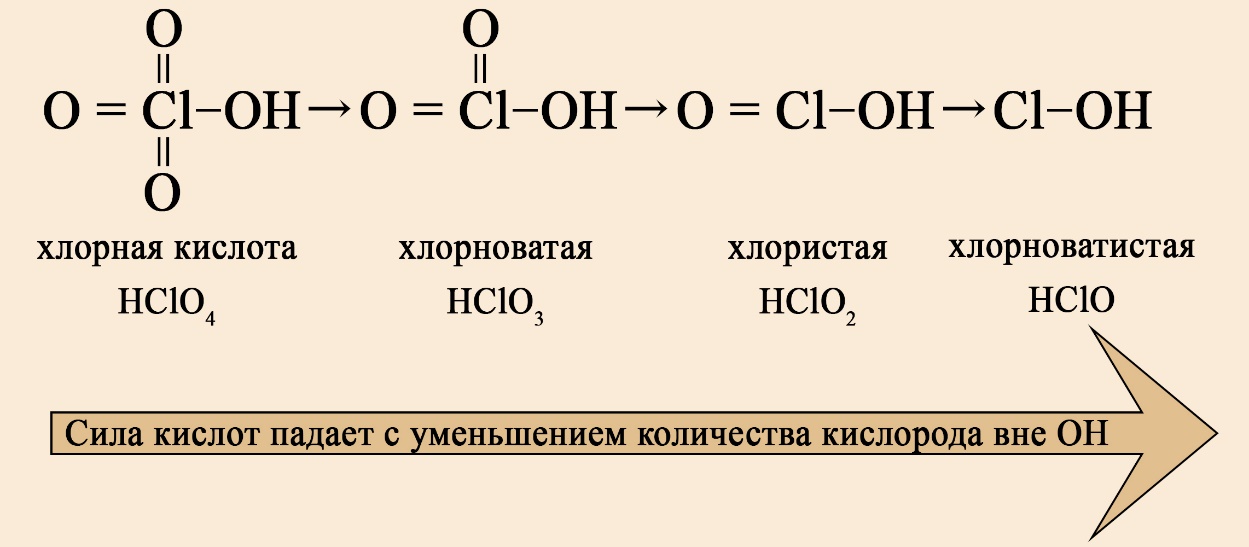
В ряду хлорсодержащих кислот наблюдается такая же закономерность:
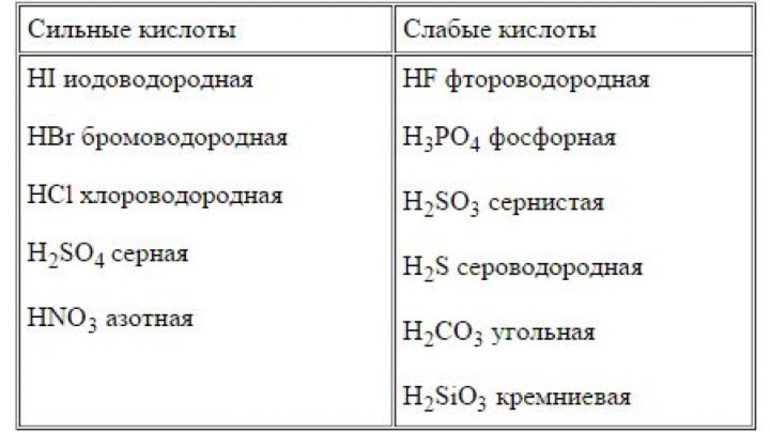
Список сильных кислот: HI, HCl, HBr, HNO3, HClO4, HClO3, HBrO3, H2SO4, HMnO4, H2Cr2O7.
Список слабых кислот: H2S, HF, HNO2, H2SO3, H2CO3, HClO, карбоновые кислоты.
В действительности классификация кислот по их силе несколько богаче, и те кислоты, которые в школе записывают в слабые (например, ортофосфорную и фтороводородную) на самом деле относят к кислотам средней силы. Помимо классификации важно знать и названия кислот, а также их остатки. Остатками кислот называют отрицательно-заряженные ионы (анионы), которые образуются при диссоциации кислоты в воде. То есть остаток кислоты – это частица, которая остаётся, если отнять у кислоты весь водород. Вот несколько таблиц, в которых кислоты сгруппированы по силе, с указанием соответствующих кислотных остатков и примерами солей:
Таб. Самые сильные кислоты и их остатки
|
Формула |
Название |
Кислотный остаток |
Пример соли |
|
HI |
йодоводородная |
I‒ |
NaI -йодид натрия |
|
HBr |
Бромоводородная |
Br‒ |
KBr – бромид калия |
|
HCl |
Хлороводородная, соляная |
Cl‒ |
CaCl2 – хлорид кальция |
|
HClO4 |
Хлорная |
ClO4‒ |
NaClO4 – перхлорат натрия |
|
H2SO4 |
Серная |
SO42‒ |
K2SO4 – сульфат калия |
|
HMnO4 |
Марганцовая |
MnO4‒ |
NaMnO4 – перманганат натрия |
Таб. Сильные кислоты и их остатки
|
Формула |
Название |
Кислотный остаток |
Пример соли |
|
HClO3 |
Хлорноватая |
ClO3‒ |
KClO3 – хлорат калия |
|
HBrO3 |
Бромноватая |
BrO3‒ |
Ba(BrO3)2 – бромат бария |
|
H2Cr2O7 |
Дихромовая |
Cr2O72‒ |
(NH4)2Cr2O7 – дихромат аммония |
Таб. Кислоты средней силы и их остатки (в ОГЭ и ЕГЭ считаем слабыми)
|
Формула |
Название |
Кислотный остаток |
Пример соли |
|
HNO2 |
Азотистая |
NO2‒ |
NaNO2 – нитрит натрия |
|
H3PO4 |
Фосфорная (ортофосфорная) |
PO43‒ |
(NH4)3PO4 – фосфат аммония |
|
HF |
Фтороводородная (плавиковая) |
F‒ |
CaF2 – фторид кальция |
|
HClO2 |
Хлористая |
ClO2‒ |
KClO2 – хлорит калия |
Таб. Слабые кислоты и их остатки
|
Формула |
Название |
Кислотный остаток |
Пример соли |
|
H2S |
Сероводородная |
S2‒ |
MgS – сульфид магния |
|
HCN |
Циановодородная |
CN‒ |
KCN – цианид калия |
|
H2CO3 |
Угольная |
CO32‒ |
CaCO3 – карбонат кальция |
|
H2SO3 |
Сернистая |
SO32‒ |
BaSO3 – сульфит бария |
|
HClO |
Хлорноватистая |
ClO‒ |
NaClO – гипохлорит натрия |
|
H2SiO3 |
Кремниевая |
SiO32‒ |
K2SiO3 – силикат калия |
|
CH3COOH |
Уксусная |
CH3COO‒* |
CH3COONa – ацетат натрия |
*В органических кислотах водород пишется не в начале молекулы, а в конце, например:
CH3COOH – уксусная кислота, диссоциирует следующим образом:
CH3COOH ↔ CH3COO‒ + H+
C2H5COOH – пропионовая кислота
CH3CH2COOH ↔ CH3CH2COO‒ + H+
C3H7COOH – масляная кислота.
C3H7COOH ↔ C3H7COO‒ + H+
Задание в формате ЕГЭ с ответом:
Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- H2SO2
- HCl
- HNO3
- кислородсодержащая сильная
- кислородсодержащая слабая
- бескислородная сильная
- бескислородная слабая
Пример задания из КИМ ЕГЭ:
Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- HNO2
- HBr
- H3PO4
- одноосновная сильная
- одноосновная слабая
- многоосновная сильная
- многоосновная слабая
Задание по образцу ФИПИ:
Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- HF
- H2CO3
- H2SiO3
- кислородсодержащая сильная
- кислородсодержащая слабая
- бескислородная сильная
- бескислородна слабая
Тривиальные названия некоторых кислот
Многие кислоты имеют альтернативное историческое название, например, хлороводородную кислоту еще называют соляной кислотой, потому что она образует самую популярную соль – NaCl (поваренная соль, используемая в быту). Фтороводородную кислоту называют плавиковой, так как она плавит стекло (поэтому данную кислоту не хранят в стеклянной таре). Муравьиную и щавелевую кислоты назвали так по источнику получения.
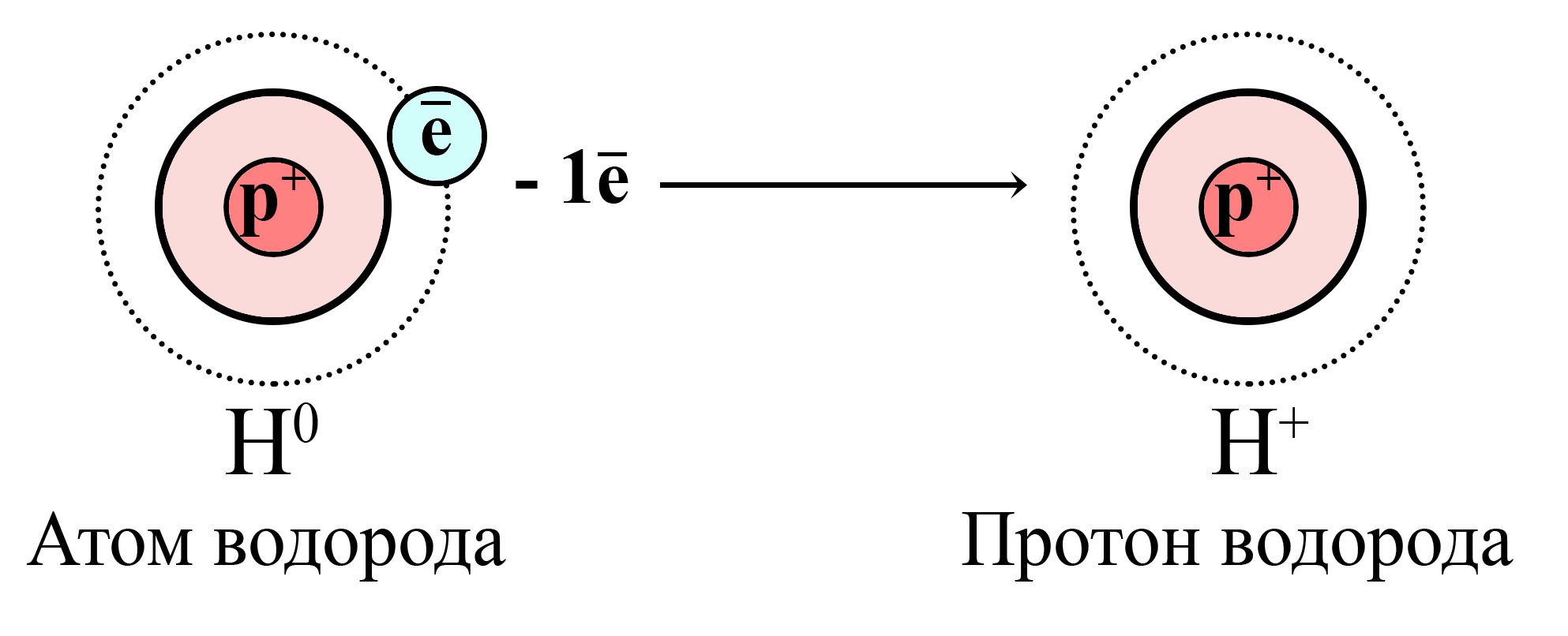
«Протон» или «катион»?
Для всех положительно заряженных частиц характерен термин «катион», однако, по отношению к водороду принято говорить «протон». А дело всё в том, что другие элементы при потере внешних электронов, все равно обладают электронами внутренних слоёв, тогда как водород, содержащий всего один электрон, потеряв его, становится протоном (нейтронов в ядре тоже нет).
Поэтому принято говорить, что кислота отдает не катион водорода, а протон водорода.
Кислоты и индикаторы
Для определения кислот в растворах можно использовать стандартные индикаторы (вещества, меняющие цвет в определенной среде): лакмус и метиловый оранжевый, фенолфталеин кислотами не окрашивается. Лакмус в кислых растворах (рН < 7) становится красным, а метиловый оранжевый – красным или розовым.
На сильные и слабые эти субстанции подразделяются в зависимости от возможности отдавать ионы водорода во время взаимодействия с металлами.
Общие свойства
Все кислоты содержат атомы водорода, которые способны вступать в реакцию. Таким образом, кислота представляет собой сложное вещество, молекулы которого состоят из разного количества атомов водорода и кислотного остатка. Эти соединения обладают кислым и зачастую слегка металлическим вкусом. При контакте с ними индикаторы приобретают другой оттенок вплоть до кардинальной смены цвета.
Химические свойства, являющиеся общими для всех кислот:
- Все вещества, содержащие кислород, в процессе разложения образуют воду и кислотный оксид.
- Бескислородные соединения распадаются на простые элементы.
- Окислители вступают в реакцию со всеми расположенными слева от H металлами из ряда активности.
- Кислоты взаимодействуют с солями, образованными более слабым соединением.
Физические свойства веществ могут кардинально отличаться. Например, одни из них имеют запах, у других он отсутствует совершенно.
Кислоты могут быть жидкими, газообразными и твёрдыми. К твёрдым соединениям относятся, например, C2H204 и H3BO3.
Концентрация вещества
Зачастую химикам приходится решать задачи на определение количества чистой кислоты, находящейся в растворе, в процентах. В таких случаях искомым значением является концентрация.
Это величина, позволяющая определять количественный состав жидкого химического вещества. К примеру, для того, чтобы узнать, сколько чистой серной кислоты находится в разбавленном растворе, необходимо небольшое количество смеси налить в мерный стакан, взвесить и определить искомое значение по таблице плотности. Указанная таблица используется при вычислениях, так как плотность неразрывно связана с концентрацией.
Основная классификация
Чаще всего кислые вещества разделяют на кислородосодержащие и бескислородные. Состав последних соединений отличается тем, что в них нет кислорода, но есть водород. В связи с этим их названия всегда дополнены словом «водородная». Например, хлороводородная, сероводородная.
Кроме того, кислоты имеют классификацию по количеству атомов водорода.
Так, они подразделяются на следующие типы:
- одноосновные;
- двухосновные;
- трехосновные.
Но также существуют органические кислоты, то есть органические вещества, которые проявляют свойства, присущие кислотным соединениям. Из них наиболее известны уксусная, щавелевая, муравьиная, лимонная, молочная и яблочная.
Все кислые вещества и основания подразделяются на сильные и слабые. Но необходимо понять, что эти понятия никак не связаны с концентрацией соединений. Сила кислоты определяется её способностью вступать в химическую реакцию, отдавая водородные ионы.
Так, вещество считается сильным, если этот процесс проходит легко.
Сильные и слабые реагенты
Если реагент в водном растворе полностью распадается на ионы, то есть диссоциирует, то оно является сильным, поскольку слабые химические соединения никогда не растворяются до конца.
Кроме того, отличить слабую кислоту можно посредством измерения её проводимости. Сильные соединения являются хорошими электролитами. Сильные основания при попадании в воду также распадаются. Следует отметить, что основания также называют гидроксидами или гидроокисями.
Существует специальные перечни слабых и сильных кислот и оснований. Таблица, приведённая ниже, также может использоваться для классификации реагентов.
| Сильная кислота | Слабая кислота | Сильное основание | Слабое основание |
|---|---|---|---|
| HCI соляная или хлороводородная | HF фтороводородная | NaOH гидроокись натрия | Mg(OH)2 гидроокись магния |
| HBr бромоводородная | CH3COOH уксусная | KOH гидроокись калия | Fe(OH)2 гидроокись железа (II) |
| HI йодоводородная | H2SO3 сернистая | Ca(OH)2 гидроокись кальция | Zn(OH)2 гидроокись цинка |
| HNO3 азотная | H2S сероводородная | Ba(OH)2 гидроокись бария | NH4OH гидроокись аммония |
| HClO4 хлорная | HNO2 азотистая | LiOH гидроокись лития | Fe(OH)3 гидроокись железа (III) |
| H2SO4 серная | H2SiO3 кремниевая |
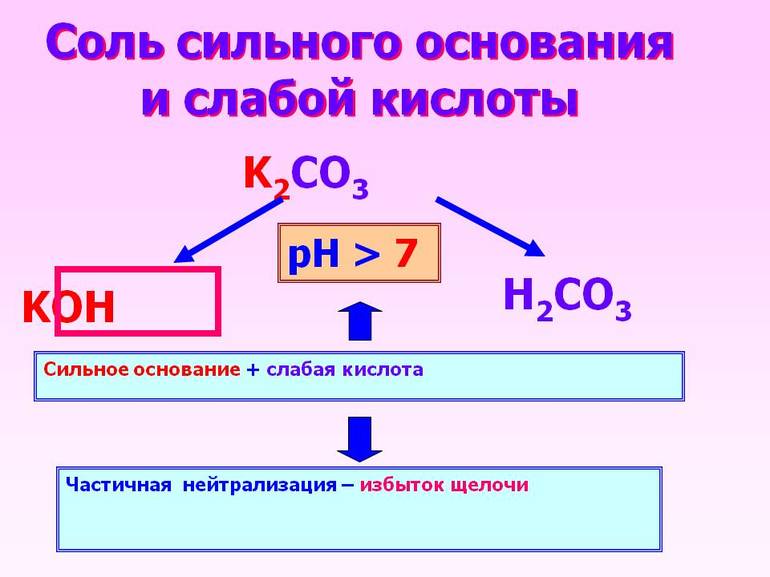
А также следует отметить, что кислородсодержащая угольная (H2CO3) и ортофосфорная (H3PO4) или фосфорная кислоты — слабые. К сильным же необходимо добавить хромовую, которая является средней по силе.
Кроме того, нужно учитывать, что современная химия позволяет учёным создавать новые соединения. В связи с этим список кислот, как сильных, так и слабых, постоянно пополняется.
Химические реакции
При соединении сильной кислоты с таким же основанием получится нейтральный раствор. Произошедшая в этом случае химическая реакция называется нейтрализацией. Если же заменить основание на слабое, то полностью диссоциирует только кислое вещество.
Второй компонент не распадается на ионы полностью.
Слабое основание лишь незначительно вступает в реакцию со слабой кислотой.
Когда кислотное соединение реагирует с сильным основанием, то первый реагент проходит частичную диссоциацию, второй же полностью диссоциирует.
Полученный в результате раствор обладает слабыми свойствами основания.
Водородный показатель
При проведении диссоциирующих реакций важно правильно определить уровень кислотности воды. Для его количественного выражения применяется величина pH, называющаяся силой, весом или потенциалом водорода. Она позволяет измерить активность ионов водорода. Если уровень pH превышает 7, то у вещества присутствуют кислотные свойства, если же этот показатель меньше 7, то свойства являются основными.
Способы определения
Результаты химических реакций, в которых участвует любое вещество, напрямую зависят от уровня его кислотности. А потому химики всегда измеряют этот показатель.
Существует несколько методов определения pH:
- Инструментальный способ. В этом случае применяется pH-метр. Этот прибор трансформирует концентрацию протонов в какой-либо жидкости в электрический сигнал.
- Индикаторы. Это вещества, изменяющие оттенок цвет в зависимости от показателя pH. Использование различных индикаторов позволяет получить довольно точные данные об уровне кислотности.
- Соль. Соль представляет собой соединение ионов, которое полностью диссоциирует в слабом водном растворе. Для определения кислотно-щелочных свойств соляного раствора, прежде всего, нужно установить и изучить свойства ионов, находящиеся в растворе.
Буферный раствор
Буферным раствором называется вещество, отличающееся наличием постоянной концентрации ионов водорода.
При добавлении сильной кислоты или такого же основания в небольших дозах эти растворы сохраняют изначальный уровень кислотности.
Для приготовления такой смеси нужно смешать слабое кислое вещество или основание с соответствующей солью.
При изготовлении буферного раствора необходимо учитывать следующие факторы:
- Интервал уровня кислотности, в котором вещество станет эффективным.
- Ёмкость раствора, то есть какой объём сильного кислотного соединения или основания можно добавить в смесь, не изменив её pH.
- При соединении веществ не должно быть реакций, способных повлиять на состав раствора.
Самые опасные кислотные соединения
На сегодняшний день самой сильной кислотой в мире считается пентафторид сурьмы фтористоводородной кислоты. Её химическая формула — HFSbF5. Не существует точных данных об активности этого соединения, но установлено, что его 55-процентный раствор почти в миллион раз сильнее концентрированной серной кислоты.
Следующим по силе является карборановое кислотное соединение. Это вещество разрешается хранить только в специальной ёмкости. Она также во много раз опаснее серной и растворяет даже стекло.
Ещё одной суперкислотой является плавиковая. Она не имеет цвета и, подобно предыдущему веществу, способна разъедать стекло. Для перевозки этого едкого соединения применяют полиэтилен. Вещество прекрасно вступает в реакцию с большинством металлов, но не взаимодействует с парафином. Соединение токсично, даже его пары опасны для здоровья. Кислота обладает эффектом наркотика.
Самое известное сильное вещество — серная кислота. Из-за больших производственных объёмов некоторые химики считают именно её самой опасной в мире. По мере того как увеличивается концентрация реагента, растёт и его опасность для здоровья человека, хотя даже растворы серного кислотного соединения могут нанести серьёзный вред. Это вещество окисляет металлы и является крайне едким, даже пары реагента очень опасны. При контакте происходит поражение кожи и слизистых оболочек, органов дыхания, а также внутренних органов человека.
Часто используемая в быту муравьиная кислота тоже относится к ядовитым химикатам. Эта ситуация объясняется тем, что опасность возникает только при высокой концентрации вещества. В обычных условиях оно бесцветно, легко образует водные растворы, а также успешно растворяется в ацетоне.
При концентрации меньше 10% реагент вызывает только раздражение. Если же этот показатель повышен, то соединение может разъесть ткани и множество других веществ. Его пары повреждают глаза, слизистые оболочки и дыхательные пути. При попадании внутрь организма наступает серьёзное отравление. Но в минимальных концентрациях реагент успешно перерабатывается и выводится из организма. В небольших дозах оно присутствует во фруктах, выделениях насекомых, крапиве.
Мощным ядом является азотная кислота. В разных пропорциях она прекрасно смешивается с водой. Реагент крайне опасен для человека. Его пары наносят серьёзный вред органам дыхания и слизистым оболочкам. Кожный покров при попадании кислоты становится жёлтым, на нём остаются язвы. Пострадавшие места требуют длительного восстановительного процесса.
При воздействии высокой температуры или света азотная кислота распадается, превращаясь в довольно токсичный газ. У вещества не возникает химической реакции со стеклом, а потому этот материал применяют для хранения реагента. Создателем ядовитого соединения является алхимик Джабир.
Кривые титрования
Кривые титрования представляют собой график зависимости параметра вещества, который связан с концентрацией реагента, подвергающегося титрованию, титранта или продукта химической реакции, от степени протекания процесса. Если проходит кислотно-основная реакция, то показателем концентрации каждого её участка является уровень рН.
Существуют теоретические и экспериментальные кривые. Теоретические используются для того, чтобы обосновать выбор индикатора. Их расчёт осуществляется по уравнению реакции и данным об исходной концентрации соединений, вступающих в реакцию. Экспериментальные кривые позволяют определить точки эквивалентности. Их получают путём измерения одного из свойств системы в процессе титрования.
Протекание и результат химических реакций, в которые вступает любая кислота, напрямую зависят от того, является это вещество сильным или слабым. В специальных химических таблицах приведены наименования самых распространённых соединений, что позволяет безошибочно определить силу реагента.
Узнать, сильная или слабая кислота можно по константе диссоциации, которая приводится в справочниках по химии, а также на химических сайтах в интернете. Чем ее значение ближе к единице, тем кислота более сильная. Для очень сильных кислот была построена также шкала констант диссоциации выше единицы, но она несколько условна и зависит от методики измерений и расчетов.
Часто, для удобства, приводятся значения показателей константы диссоциации. Это отрицательный десятичный логарифм от значения константы диссоциации. При этом значения имеют более компактную запись.
Следует учесть, что константа диссоциации является константой только в определенном растворителе и при определенной температуре. Обычными условиями для ее выражения являются водные растворы и температура 20-25 С. При изменении растворителя и температуры, константа диссоциации меняется. Обычно она увеличивается при нагревании. Влияние растворителя более сложно, но обычно в кислых растворителях константа диссоциации кислот снижается, а в основных – увеличивается. Для измерения силы сильных кислот, часто используют уксусную кислоту, в которой сильные кислоты становятся более слабыми.
Многие школьники и студенты часто путают силу кислоту (которая количественно выражается константой диссоциации) и коррозионную активность кислоты (способность разрушать материалы, растворять металлы). Эти величины связаны лишь косвенно и для учета коррозионной активности необходимо учитывать еще несколько факторов (электродные реакции, комплексообразование, образование защитных слоев и др.), а не только силу кислоты. Например, фтороводородная кислота – средней силы по константе диссоциации, но растворяет многие материалы за счет сильной сольватирующей и комплексообразующей способности. Причем безводный фтороводород может растворять белки и нуклеиновые кислоты без разрушения, что используется в биохимии.
Кислоты и основания
После прочтения статьи Вы сможете разделять вещества на соли, кислоты и основания. В статье описано, что такое
pH раствора, какими общими свойствами обладают кислоты и основания.
Простым языком, кислота – это всё что с H, а основание – c OH. НО! Не всегда. Что бы отличать кислоту от основания
необходимо… запомнить их! Сожалею. Что бы хоть как то облегчить жизнь, три наших друга, Аррениус и Бренстед с
Лоури, придумали две теории, которые зовутся их именем.
Как металлы и неметаллы, кислоты и основания – это разделение веществ по схожим свойствам. Первая теория кислот
и оснований принадлежала швецкому учёному Аррениусу. Кислота по Аррениусу – это класс веществ, которые
в реакции с водой диссоциируют (распадаются), образовывая катион водорода H+. Основания Аррениуса в водном растворе образуют
анионы OH–. Следующая теория в 1923 году была предложена учёными Бренстедом и Лоури. Теория Бренстеда-Лоури
определяет кислотами вещества, способные в реакции отдавать протон (протоном в реакциях называют катион водорода). Основания,
соответственно, – это вещества, способные принять протон в реакции. Актуальная на данный момент теория – теория Льюиса.
Теория Льюиса определяет кислоты как молекулы или ионы, способные принимать электронные пары, тем самым формируя
аддукты Льюиса (аддукт – это соединение, образующееся соединением двух реагентов без образования побочных продуктов).
В неорганической химии, как правило, под кислотой имеют ввиду кислоту Бренстеда-Лоури, то есть вещества, способные отдать
протон. Если имеют ввиду определение кислоты по Льюису, то в тексте такую кислоту называют кислотой Льюиса. Данные правила
справедливы для кислот и оснований.
Диссоциация
Диссоциация – это процесс распада вещества на ионы в растворах или расплавах. Например, диссоциация соляной кислоты – это распад
HCl на H+ и Cl–.
Свойства кислот и оснований
Кислоты, содержащие водород, в водном растворе выделяют катионы водорода. Основания, содержащие гидроксид-ион,
в водном растворе выделяют анион OH–.
Основания, как правило, мыльные на ощупь, кислоты, в большинстве своём, имеют кислый вкус.
При реакции основания со многими катионами формируется осадок. При реакции кислоты с анионами, как правило, выделяется
газ.
Часто используемые кислоты:
H2O, H3O+, CH3CO2H, H2SO4,
HSO4−, HCl, CH3OH, NH3
Часто используемые основания:
OH−, H2O, CH3CO2−,
HSO4−, SO42−, Cl−
Сильные и слабые кислоты и основания
Сильные кислоты
Такие кислоты, которые полностью диссоциируют в воде, производя катионы водорода H+ и анионы.
Пример сильной кислоты – соляная кислота HCl:
HCl(р-р) + H2O(ж) → H3O+(р-р) + Cl–(р-р)
Примеры сильных кислот: HCl, HBr, HF, HNO3, H2SO4, HClO4
Список сильных кислот
- HCl – соляная кислота
- HBr – бромоводород
- HI – йодоводород
- HNO3 – азотная кислота
- HClO4 – хлорная кислота
- H2SO4 – серная кислота
Слабые кислоты
Растворяются в воде только частично, например, HF:
HF(р-р) + H2O(ж) → H3O+(р-р) + F–(р-р) –
в такой реакции более 90% кислоты не диссоциирует:
[H3O+]=[F–] < 0,01M для вещества 0,1М
Сильную и слабую кислоту можно различить измеряя проводимость растворов: проводимость зависит от количества ионов,
чем сильнее кислота тем она более диссоциирована, поэтому чем сильнее кислота тем выше проводимость.
Список слабых кислот
- HF фтороводородная
- H3PO4 фосфорная
- H2SO3 сернистая
- H2S сероводородная
- H2CO3 угольная
- H2SiO3 кремниевая
Сильные основания
Сильные основания полностью диссоциируют в воде:
NaOH(р-р) + H2O ↔ NH4
К сильным основаниям относятся гидроксиды металлов первой (алкалины, щелочные металы) и второй (алкалинотеррены,
щёлочноземельные металлы) группы.
Список сильных оснований
- NaOH гидроксид натрия (едкий натр)
- KOH гидроксид калия (едкое кали)
- LiOH гидроксид лития
- Ba(OH)2 гидроксид бария
- Ca(OH)2 гидроксид кальция (гашеная известь)
Слабые основания
В обратимой реакции в присутствии воды образует ионы OH–:
NH3 (р-р) + H2O ↔ NH+4 (р-р) + OH–(р-р)
Большинство слабых оснований – это анионы:
F–(р-р) + H2O ↔ HF(р-р) + OH–(р-р)
Список слабых оснований
- Mg(OH)2 гидроксид магния
- Fe(OH)2 гидроксид железа (II)
- Zn(OH)2 гидроксид цинка
- NH4OH гидроксид аммония
- Fe(OH)3 гидроксид железа (III)
Реакции кислот и оснований
Сильная кислота и сильное основание
Такая реакция называется нейтрализацией: при количестве реагентов достаточном для полной диссоциации кислоты и
основания, результирующий раствор будет нейтральным.
Пример:
H3O+ + OH– ↔ 2H2O
Слабое основание и слабая кислота
Общий вид реакции:
Слабое основание(р-р) + H2O ↔ Слабая кислота(р-р) + OH–(р-р)
Сильное основание и слабая кислота
Основание полностью диссоциирует, кислота диссоциирует частично, результирующий раствор имеет слабые свойства
основания:
HX(р-р) + OH–(р-р) ↔ H2O + X–(р-р)
Сильная кислота и слабое основание
Кислота полностью диссоциирует, основание диссоциирует не полностью:
NH3 (р-р) + H+ ↔ NH4
Диссоциация воды
Диссоциация – это распад вещества на составляющие молекулы. Свойства кислоты или основания зависят от
равновесия, которое присутствует в воде:
H2O + H2O ↔ H3O+(р-р) + OH–(р-р)
Kc = [H3O+][OH–]/[H2O]2
Константа равновесия воды при t=25°: Kc = 1.83⋅10-6, также имеет место следующее
равенство: [H3O+][OH–] = 10-14, что называется константой
диссоциации воды. Для чистой воды [H3O+] = [OH–] = 10-7,
откуда -lg[H3O] = 7.0.
Данная величина (-lg[h3O]) называется pH – потенциал водорода. Если pH < 7, то вещество
имеет кислотные свойства, если pH > 7, то вещество имеет основные свойства.
Способы определения pH
Инструментальный метод
Специальный прибор pH-метр – устройство, трансформирующее концентрацию протонов в растворе в электрический
сигнал.
Индикаторы
Вещество, которое изменяет цвет в некотором интервале значений pH в зависимости от кислотности раствора,
используя несколько индикаторов можно добиться достаточно точного результата.
Соль
Соль – это ионное соединение образованное катионом отличным от H+ и анионом отличным от O2-.
В слабом водном растворе соли полностью диссоциируют.
Что бы определить кислотно-щелочные свойства раствора соли, необходимо определить, какие ионы присутствуют
в растворе и рассмотреть их свойства: нейтральные ионы, образованные из сильных кислот и оснований не влияют на pH:
не отдают ионы ни H+, ни OH– в воде. Например, Cl–, NO–3,
SO2-4, Li+, Na+, K+.
Анионы, образованные из слабых кислот, проявляют щелочные свойства (F–, CH3COO–,
CO2-3), катионов с щелочными свойствами не существует.
Все катионы кроме металлов первой и второй группы имеют кислотные свойства.
Буфферный раствор
Растворы, которые сохраняют уровень pH при добавлении небольшого количества сильной кислоты или сильного
основания, в основном состоят из:
- Смесь слабой кислоты, соответствующей соли и слабого основания
- Слабое основание, соответствующая соль и сильная кислота
Для подготовки буфферного раствора определённой кислотности необходимо смешать слабую кислоту или основание
с соответствующей солью, при этом необходимо учесть:
- Интервал pH в котором буфферный раствор будет эффективен
-
Ёмкость раствора – количество сильной кислоты или сильного основания, которые можно добавить не повлияв
на pH раствора - Не должно происходить нежелаемых реакций, которые могут изменить состав раствор
Тест:
Weak acids are those whose solutions do not entirely ionize them. They frequently do not entirely separate into their component ions in the solution. These are among the most well-liked acid subtypes. Let’s learn the concept of weak acids.
Weak Acids
By designating a proton to another molecule, acids react with water to form H+ ions. They contain hydrogen, which when dissolved in water forms both an anion and a hydrogen ion. The nature of these hydrogen ions is one of extreme reactivity. A blue litmus paper will change color when dipped into an acidic solution to become a red one. Additionally, acids have a pH (power of hydrogen) value lower than 7, and their flavor is sour.
This process, known as neutralization reaction, occurs when acids and bases react to produce salt and water. Weak acids are those whose solutions do not entirely ionize them. They frequently do not entirely separate into their component ions in the solution. Strong acids are those that totally break down into their ions in the solution and dissolve entirely.
According to the definition, weak acids are those that do not completely release all of their hydrogen ions into the solution and have low values for Ka (a measure of an acid’s strength) in comparison to strong acids.
Weak Acids Example
- Acetic Acid
- Formic Acid
- Benzoic Acid
- Oxalic Acid
- Sulfurous Acid
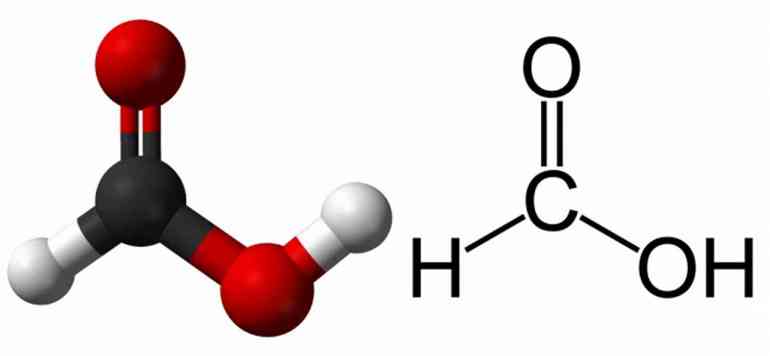
Acetic Acid
Ethanoic acid, often known as acetic acid, has the chemical formula CH3COOH (CH3CO2H, C2H4O2, or HC2H3O2). This is a type of carboxylic acid as well, the second most basic type in which methane is joined to the COOH group. Acetic acid’s chemical structure is as follows:
After water, acetic acid makes up the majority of vinegar and makes up 4 to 7% of the total volume of the solution in water. Acetic acid is the main component of vinegar, which is diluted in water and is most likely created through fermentation and further oxidation with ethanol. Since acetic acid in its concentrated form can damage human skin, it should be handled carefully and away from direct contact.
In order to create cellulose acetate, an essential chemical reagent called acetic acid is also a common industrial ingredient used in photographic film. This acid also aids in the manufacturing of synthetic fibers, polyvinyl acetate for wood glue, and other fibers. Acetic acid is a weak acid because, when dissolved in water, it partially dissociates into its component parts. Under normal conditions of pressure and temperature, acetic acid has a smell similar to vinegar and a molecular mass of 60.052 grams per mole. Acetic acid has a density of 1.27 grams per cubic cm in its solid form compared to 1.049 grams per cubic cm in its liquid form. It is well known that hydrogen bonding exists in the acetic acid solid state.
Acetic acid has a melting point of 16 and 17 degrees Celsius and a boiling point of 118 degrees Celsius. It produces miscible mixes when it is a byproduct of water-based combinations. The acid’s pKa value is 4.756. Methanol is used in one of the procedures used to make acetic acid.
Acetic Acid Dissociation:
CH3COOH ⇔ CH3CO2− + H+
Formic Acid
The most basic type of carboxylic acid is formic acid, also referred to as methanoic acid. Formic acid has the chemical formula HCOOH (CH2O2). The following diagram depicts formic acid’s structure:
Ants produce formic acid. Keep in mind how it feels to get bitten by an ant. Right, it hurts like it’s burning there. The acid from the ant’s body penetrates our body, causing pain. One of the most significant weak acids is regarded to be formic acid. Under normal temperature and pressure, it appears to be a fuming, white liquid. Additionally, it has an unpleasant smell that is both potent and penetratingly pungent. Formic acid is frequently used to treat leather and textiles, which is one of its common applications or uses. Formic acid can be produced in the form of its esters in addition to being a naturally occurring substance in ant bodies. Methyl alcohol and carbon monoxide combine when a catalyst is present.
Here we cover some of the fundamental characteristics of formic acids. This acid has a molar mass of 46.03 grams and a density of 1.22 grams per milliliter. Formic acid freezes at 8.4 degrees Celsius while boiling at 100.3 degrees Celsius. Given that it has a pKa value of 3.745, it can be easily dissolved in water.
Additionally, formic acid and other organic solvents like acetone are miscible. The mixture of glycerol, ethanol, and methanol may also be only partially soluble in other aromatic substances, such as benzene and toluene. In hydrocarbons that form hydrogen-bonded dimers rather than as individual molecules, this acid is slightly miscible. The ideal gas law is broken by formic acid.
Benzoic Acid
With the molecular formula C6H5COOH, benzoic acid is the most basic aromatic carboxylic acid. The acid is also referred to as Benzene Carboxylic Acid and Carboxy Benzene, as you must be aware. This is a weak acid that is easily found in nature in plants and gum benzoin. Its salts are widely employed in the food industry as preservatives. Under normal temperature and pressure, benzoic acid exists as a crystalline solid that is either colorless or white and is not highly soluble in water. Because benzoic acid has an aromatic structure, it has a somewhat pleasant scent. The structure of benzoic acid is:
Under normal temperature and pressure conditions, benzoic acid has a molar mass of 122.123 grams and a density of 1.26 grams per cubic cm. This acid’s boiling point is 250 degrees Celsius, whereas its melting point is 122 degrees Celsius.
As the temperature rises, benzoic acid becomes more soluble in water. The solubility of benzoic acid in water is 3.44 grams at a temperature of 25 degrees celsius; however, if the temperature is raised to 100 degrees Celsius, the solubility of benzoic acid in water increases dramatically to 56.31 grams per liter. Regarding solubility, we must point out that this acid is soluble in a few organic solvents, including benzene, acetone, carbon tetrachloride, and hexane.
Oxalic Acid
With the chemical formula C2H2O4, oxalic acid is the most basic type of dicarboxylic acid and is regarded as a weak acid because it does not separate into its component parts when dissolved in water. Oxalic acid has substantially higher acidity as compared to acetic acid. The oxalic acid’s chemical structure:
The molar mass of oxalic acid is 90.03 grams per mole; however, the molar mass of the dihydrated form of the same acid, at standard pressure and temperature, is 126.06 grams per mole. The mass density of oxalic acid in its anhydrous state, under identical circumstances, is 1.9 grams per cm cube. This acid has a melting point of 190 degrees Celsius and a boiling point of 149 to 160 degrees Celsius.
It is completely soluble in water with regard to solubility. Its structure contains hydrogen bonds and it functions as a reducing agent.
Derivation for pH of Weak Acids
CH3COOH ⇔ CH3COO− + H+
CH3COOH CH3COO– H+ Moles 1-α α α Concentration [(1-α)/v] [α/v] [α/v] Ka = [H+]×[CH3COO–] / [CH3COOH]
∴ Ka = (α/v × α/v) / ((1-α)/v)
∴ Ka = α2 / v(1-α)
∴ Ka = α2c / (1-α) …(c = 1/v)
Very weak acid, α <<<<< 1
(1-α) ≈ 1
So, Ka = α2c
∴ α = √Ka/c
Degree of Dissociation.
Concentration of [H+] = αc = √Ka/c × c = √Kac
pH = 1/2[pKa – log10c]
where,
Ka is dissociation constant of weak acid
c is concentration of solution
Properties of Weak Acid
- Like the majority of other acids, weak acids have a sour taste.
- Your nose would burn if you were to smell it.
- Sticky in nature
Keep in Mind
- If the Ka and concentration of the solution are known, it is possible to compute the pH of any solution.
- The calculation methods used to determine pH might vary and are predicated on assumptions.
- Making buffer solutions requires the use of weak acids.
- Weak acids have a sour taste, are sticky in consistency, and can cause nose burn when smelled.
- Strong concentrations of weak acids can be destructive and harmful.
Solved Examples of Weak Acids
Example 1: KOH(aq) + HCN(aq) ⇔ H2O(l) + KCN(aq) According to the given chemical equation, KOH and HCN react in aqueous solution. What was the concentration of the initial HCN solution if 36 mL of a KCN solution required 32.9 mL of a 0.21 M KOH solution to titrate?
Solution:
KOH(aq) + HCN(aq) ⇔ H2O(l) + KCN(aq)
Ka = [KOH(aq)]×[KCN(aq)] / [HCN(aq)]
∴ Ka = 32.9 × 0.21 / 36
∴ Ka = 6.909 / 36
∴ Ka = 0.19 M
Example 2: HF(aq) + H2O(l) ⇔ H3O+(aq) + F–(aq) According to the given chemical equation, concentration of H3O+ solution is 21.8 mL, F– solution is 1.23 M and HF solution concentration is 38 mL . What is the value of Ka?
Answer:
HF(aq) + H2O(l) ⇔ H3O+(aq) + F–(aq)
Ka = [H3O+(aq)]×[F–(aq)] / [HF(aq)]
∴ Ka = 21.8 × 1.28 / 38
∴ Ka = 27.904 / 38
∴ Ka = 0.73 M
Example 3: CH3COOH(aq) + H2O(l) ⇔ H3O+(aq) + CH3COO−(aq) according to the given chemical equation, concentration of H3O+ solution is 31.1 mL, CH3COO− solution is 2 M and CH3COOH solution concentration is 29.2 mL . Then Find the Ka.
Answer:
CH3COOH(aq) + H2O(l) ⇔ H3O+(aq) + CH3COO−(aq)
Ka = [H3O+]×[CH3COO−] / [CH3COOH]
∴ Ka = 31.1 × 2 / 29.2
∴ Ka = 62.2 / 29.2
∴ Ka = 2.13 M
Example 4: B + H2O ⇔ BH+ + OH–, BH+ solution concentration is 20.1 mL, OH– solution concentration is 3.7 M, and B solution concentration is 29.2 mL, all in accordance with the chemical equation provided. Calculate Ka.
Answer:
B + H2O ⇔ BH+ + OH–
Ka = [BH+]×[OH−] / [B]
∴ Ka = 20.1 × 3.7 / 29.2
∴ Ka = 74.37 / 29.2
∴ Ka = 2.54 M
FAQs on Weak Acid
Question 1: What applications does hydrofluoric acid have?
Answer:
Glass and silicon wafers are etched using hydrofluoric acid. Additionally, it is utilized in the production of pharmaceuticals, pesticides, high-octane fuel, aluminium, plastics, and other products.
Question 2: Write down the benzoic acid chemical formula. What is it used for?
Answer:
The chemical name for benzoic acid, commonly known as benzene carboxylic acid or carboxybenzene, is C6H5COOH.
Benzoic acid, which is a weak acid that is easily found in nature in plants and gum benzoin, is utilized extensively in the food industry as a preservative.
Question 3: What does the term “weak acids” mean?
Answer:
Weak acids are those whose solutions do not entirely ionize them. They frequently do not entirely separate into their component ions in the solution. When opposed to strong acids, weak acids have modest values for Ka (the quantitative indicator of acid strength), do not give away all of their hydrogen ions in the solution, and have higher values for strong acids.
Question 4: Which acid is thought to be the least powerful acid?
Answer:
In addition to the fact that there are numerous other weak acids, hydrocyanic acid is regarded as the weakest acid. 4.9 × 10-10 is its pKa value.