Массовая доля соли
Найдите массовую долю соли в полученном растворе, если к раствору хлорида кальция (CaCl2) массой 140 грамм с массовой долей 10% добавили 10 грамм этой же соли и 25 миллилитров воды (H2O).
Решение задачи
Для удобства решения задачи я предлагаю исходный раствор обозначить как 1 раствор, а полученный как 2 раствор.
Итак, запишем общую формулу для нахождения массовой доли соли в полученном растворе:
![]()
Учитывая, что после добавления хлорида кальция (CaCl2) масса соли изменилась, получаем:
![]()
Используя формулу, нахождения массовой доли соли в исходном растворе:
![]()
найдем массу исходного вещества хлорида кальция (CaCl2) в 1 растворе по формуле:
![]()
m1 (вещества) = 140 ⋅ 0,1 = 14 (г).
Если раствор 10-процентный, то массовая доля соли хлорида кальция (CaCl2) в нем 0,1.
Найдем массу второго вещества хлорида кальция (CaCl2) во 2 растворе:
m2 (вещества) = 14 + 10 = 24 (г).
После добавления воды и хлорида кальция (CaCl2) изменилась масса полученного раствора:
![]()
Используя вышеуказанную формулу, вычислим массу полученного раствора:
m2 (раствора) = 140 + 25 + 10 = 175 (г).
Так как плотность воды (H2O) равна 1 г/мл, то объём будет численно равен массе.
Найдем массовую долю соли хлорида кальция (CaCl2) во 2 растворе:
![]()
Ответ:
массовая доля соли 0,14.
Автор: Татьяна Владимировна Клочкова
«РАСЧЕТЫ ПО ХИМИЧЕСКИМ ФОРМУЛАМ. УСТАНОВЛЕНИЕ ФОРМУЛЫ ХИМИЧЕСКОГО СОЕДИНЕНИЯ»
Т.В. Клочкова
МУ ДО «Малая академия»
г. Краснодар, Краснодарский край, Российская Федерация
Решение олимпиадных химических задач требует от учащихся достаточно высокого уровня теоретической подготовки по предмету, умения пользоваться на практике приобретенными знаниями. Усложненные и нестандартные задачи входят в раздел «задания высокого уровня сложности» Единого государственного экзамена, в контрольно-измерительные материалы дополнительных вступительных испытаний Московского государственного университета и других высококонкурсных вузов на профильные факультеты.
Для качественной подготовки учащихся к этим испытаниям целесообразно организовать образовательный процесс наиболее эффективным образом. Учащимся необходим навык качественно иной мыслительной работы: не вспоминать алгоритм решения типовых заданий, а в результате рассуждений, используя ограниченный объём информации из текста задачи, смоделировать вариант задачи с некоторыми допущениями, привлекая дополнительные знания из других предметных областей, например, физики и математики. Такой навык может быть сформирован на основе постоянных занятий в форме практикума-тренинга, с применением заданий из архива химических олимпиад различных уровней, интеллектуальных соревнований и заданий вступительных экзаменов в высококонкурсные вузы.
Особое место в этой работе выделяется самостоятельной работе учащихся в формате КСР (контролируемой самостоятельной работы). Самостоятельная работа учащихся планируется по тематическим блокам (модулям), на выполнение которой отводится от двух до четырех недель в зависимости от объёма темы. К каждому тематическому блоку предлагается методическая разработка, которая включает подробный разбор 15-20 задач с применением разных подходов и алгоритмов решения, а также задачи для самостоятельного решения из архива химических олимпиад.
Умение решать сложные задачи приобретается единственно возможным путем. Это путь настойчивого и неустанного применения на практике тех закономерностей и технологических приемов, которые составляют «копилку» настоящих олимпиадников. Давно на практике доказано, что рецепт «ежедневно по 2-3 задачи», а в особо сложных случаях «ежедневно до 10 задач» срабатывает обязательно у тех, кто упорно следует к поставленной цели.
Несомненно, педагог-наставник может рекомендовать своему подопечному для самостоятельной работы до десятка современных задачников. За последние годы их опубликовано и выложено в электронном виде немало. Только в этих задачниках тематические подборки в логике «от простого к сложному» с подробным разбором каждого решения встречаются нечасто. Такой пробел предлагается восполнить, причем для некоторых задач приводятся решения, которые предлагали в различные годы сами учащиеся [1].
Итак, с чего начнем? Конечно, с теории!
Всякое чистое химическое соединение, не зависимо от места и способа его получения, имеет постоянный качественный и количественный состав (Закон постоянства вещества, Ж.-Л. Пруст, 1799 г.).
Качественный состав показывает, из каких элементов состоит вещество. Количественный состав сложного вещества определяется отношением атомов в молекуле, а также массовой долей элемента в веществе.
Массовая доля элемента
(Э) – это отношение массы данного элемента m(Э) во всякой порции вещества к массе этой порции вещества. Массовую долю элемента выражают в долях от единицы или в процентах:
(Э) =
;
%(Э) =
.
Для бинарного вещества АхВу:
(А) =
;
(В) =
;
х =
; у =
.
Для начала вспомним, как вычисляют массовые доли химических элементов в сложном соединении на примере первой задачи.
1. Вычислите массовые доли каждого элемента в составе малахита (CuOH)2CO3 (в долях от единицы по химической формуле).
Решение: Массовая доля элемента определяется по расчетной формуле:
(Э) =
.
Молярная масса основного карбоната меди: М(в-ва) = 222 г/моль.
Вычисляем массовую долю каждого элемента:
(Cu) =
0,5766;
(Н) =
0,0090;
(О) =
0,3604;
(С) =
0,0544.
Ответ:
(Cu) = 0,5766;
(Н) = 0,0090;
(О) = 0,3604;
(С) = 0,0544.
Теперь перейдем к расчету количественного состава бинарного вещества известного класса и определенной массы, если известна масса одного из элементов.
2. Определите простейшую формулу оксида, если 16 г его содержит 6,4 г серы.
Решение: Формула оксида SхОу. Количество вещества серы в этом оксиде определяется по формуле:
(S) =
0,2 (моль).
Масса кислорода в этом оксиде: m(О) составляет 16 – 6,4 = 9,6 г.
ν (О) =
0,6 (моль).
Отношение количества вещества элементов позволяет установить соотношение числа атомов в молекуле бинарного соединения: х : у =
(S) :
(О) = 0,2 : 0,6 = 1 : 3.
Ответ: SO3 – формула искомого оксида серы.
Решение задач, в условии которых указана массовая доля известного элемента в бинарном соединении с неким другим элементом с известной валентностью решаются простым способом, через нахождение молярной массы бинарного вещества по формуле нахождения массовой доли одного из элементов. Прежде такие задачи рекомендовалось решать по закону эквивалентов в его традиционном варианте.
3. Массовая доля хлора в хлориде 0,655. Определите элемент, если он трехвалентен.
Решение: В соответствие с условием задачи формула хлорида ЭCl3.
Массовая доля хлора определяется по формуле:
(Cl) =
.
Обозначим молярную массу неизвестного элемента через х:
М(ЭCl3) = (х + 106,5) г/моль.
Составим уравнение материального баланса:
0,655 =
; 106,5 = 0,655 (х + 106,5);
0,655х = 36,70; х = 56 г/моль (Fe).
Ответ: железо.
Когда в условии задачи валентность искомого элемента не указана, решение задачи сводится к подбору степени окисления. Порой задача осложняется тем обстоятельством, что при подборе обнаруживается несколько вариантов, близких по значению молярной массы.
4. Массовая доля металла в оксиде 0,694. Определите металл.
Решение: По условию задачи валентность металла неизвестна, тогда представим его степень окисления как +n. Степень окисления кислорода в оксиде -2. Формула оксида ЭхОу или Э2+nОn. Массовая доля кислорода составляет: 1 – 0,694 = 0,306.
Согласно формуле:
.
Составим уравнение материального баланса:
; М(Э) =
18,445n (г/моль).
Далее применим «метод перебора». Составим таблицу зависимости молярной массы элемента от валентности:
|
n |
М(Э) |
Э |
М |
|
1 |
18,445 |
— |
|
|
2 |
36,80 |
— |
|
|
3 |
55,33 |
Fe(?) |
55,847 |
|
4 |
73,82 |
Ge(?) |
72,59 |
|
5 |
92,225 |
Nb(?) |
92,906 |
Расхождение в значении вычисленных молярных масс с табличными значениями составляет для железа 1,02%, для германия 1,68%, для ниобия всего 0,72 %, таким образом приходим к выводу, что искомый элемент – ниобий [2].
Ответ: ниобий.
Классическим примером решения задач, в которых необходимо установить некоторый элемент, входящий в состав сложного вещества, если массовые доли каждого элемента известны, является задача из популярного задачника Н.Е. Кузьменко [3]. Надо заметить, что некогда эта задача была предложена абитуриентам МГУ на вступительных экзаменах.
5. Определите формулу соединения, если известно, что оно содержит 28% металла, 24% серы и 48% кислорода по массе.
Решение: Предположим, что данное вещество относится к классу солей и найдем мольные соотношения элементов серы и кислорода на основании известных массовых долей этих элементов. ν (S) : ν (O) = 24/32:48/16 = 0,75:3 =1:4. Полученное соотношение дает основание утверждать, что вещество является сульфатом некоторого металла с неизвестной валентностью, причем в порции соли массой 100 г на 28 г этого металла приходится 72 г кислотного остатка (0,75 моль сульфат -аниона). Далее можно выполнить несколько несложных расчетов, чтобы определить молярную массу металла. Для 1 валентного металла на 0,75 моль кислотного остатка приходится 1,5 моль металла, тогда М(Ме) =m/ν =28г /1,5 моль = 18,67 г/моль. Металла с такой атомной массой нет. Для металла с валентностью равной II количество вещества кислотного остатка равно количеству вещества металла, т.е. 0,75 моль. В таком случае М(Ме) =m/ν =28 г/0,75 моль = 37,33 г/моль, что опять не соответствует реальному элементу. Если считать, что металл проявляет валентность равную трем, тогда формула соли содержит на 2 моль металла 3 моль кислотного остатка, или 2 : 3=Х : 0,75. Отсюда х = 0,5 моль, М(Ме) =m/ν =28 г/0,5 моль = 56 г/моль. Металл с такой молярной массой и валентностью равной трем – это железо.
Ответ: Формула соединения Fe2(SO4)3.
Следующая задача заимствована из пособия Г.П. Хомченко [4]. Решение этой задачи можно осуществить исключительно алгебраическим методом, составив систему уравнений с двумя неизвестными.
6. Некоторые элементы Х и Y образуют соединения X2Y2O3 (массовая доля кислорода равна 25,26%) и X2YO4 (массовая доля кислорода равна 36,78%). Определите элементы X и Y.
Решение: Используя значение массовой доли кислорода в данных соединениях, выразим и рассчитаем молярные массы. М1 = 3.16/0,2526 =190 г/моль; М2 = 4.16/0,3678 = 174 г/моль.
Обозначим молярные массы элемента Х как М(Х), элемента Y как М(Y).
Составим и решим систему уравнений:
2М(Х) + 2 М(Y)+48 =190
2М(Х) + М(Y)+64 =174, отсюда М(Х) = 39 (калий); М(Y)= 32 (сера).
Ответ: Формулы соединений K2S2O3 и K2SO4.
Довольно распространенными задачами являются задачи, в которых необходимо установить формулу кристаллогидратов. Приведем примеры наиболее распространенных типов этих задач и предложим способы их решения.
7. Медный купорос, который является кристаллогидратом сульфата двухвалентной меди, содержат 12,82 % серы. Определите формулу медного купороса [5].
Решение: Зная, как определяются массовые доли элементов, можем преобразовать формулу, для вычисления молярной массы кристаллогидрата.
(S) =
0,1282;
0,1282 (160 + 18n) = 32; 160 + 18n = 250.
М(CuSO4 . nH2O) =
= 250 (г/моль); n =
5.
Ответ: Формула медного купороса (пентагидрата сульфата меди) CuSO4 . 5H2O.
8. Кристаллогидрат сульфата натрия содержит 55,90 % кристаллизационной воды. Определите формулу кристаллогидрата [6].
Решение: Формула соли имеет вид Na2SO4.nH2O. Молярная масса кристаллогидрата может быть рассчитана по формуле:
1 =
;
2 =
.
Вычислим массовую долю безводной соли: 100 – 55,90 = 44,10 %.
М(Na2SO4 . nH2O) =
;
М(Na2SO4 . nH2O) = 322 г/моль.
n =
; n = 10.
Ответ: Декагидрат сульфата натрия Na2SO4.10H2O (глауберова соль, мирабилит).
Еще одна группа задач посвящена установлению формулы природного минерала. При решении таких задач приходится применять нестандартные подходы и новые принципы составления алгебраических выражений (например, «принцип электронейтральности молекул», задача 16).
9. Качественный анализ некоторого минерала показал, что он содержит ионы калия, магния и хлора. После прокаливания 0,9852 г образца этого минерала его масса уменьшилась на 0,3832 г. Прокаленный образец растворили в воде и обработал небольшим избытком раствора AgNO3 в результате чего выпал осадок массой 1,5246 г. Определите формулу и название минерала и вычислите состав минерала в массовых долях [7].
Решение: Уменьшение массы после прокаливания соли свидетельствует о том, что удаляется кристаллизационная вода:
. В результате взаимодействия с AgNO3:
Cl —+ AgNO3 → AgCl↓ + NO –3
, что значит
.
Пусть Х моль КCl содержат Х моль К+, а У моль MgCl2 содержат У моль Mg2+.
Тогда 39х+24у = 0,2248 г, соответственно 35,5х+2у·35,5 = 35,5·0,0106, т.е. х+2у =0,0106. Т.о.
Решим систему уравнений и получим: у=0,0034 х=0,0038. Состав минерала: хКCl × уMgCl2× nН2ОÞ х : у : n=0,0038:0,0034:0,0213=1:1:6Þ
КCl × MgCl2× 6Н2О — карналлит
Ответ: КCl × MgCl2× 6Н2О — карналлит
10. Навеску природного минерала каинита массой 57,16 г растворили в воде. При действии на полученный раствор избытка раствора хлорида бария выпал белый кристаллический осадок массой 53,59 г. Дальнейший анализ минерала показал, что при прокаливании идет уменьшение массы образца на 21,73%, а массовая доля хлора в образце после прокаливания составила 18,25%. Установите формулу минерала [8].
Решение: При прокаливании минерала выделяется кристаллизационная вода:
. Масса минерала после прокаливания:
т1 = 57,16 — 12,42 = 44,74г. т(Cl) в составе минерала = 0,1825 · 44,74 = 8,17г
. Масса оставшейся «соли» без воды и хлорид – иона: т2=44,74 — 8,17 = 36,57г.
Т.к. водный раствор минерала дает белый кристаллический осадок с хлоридом бария, то в минерале содержится группа SO2-4. По известной массе выпавшего осадка рассчитаем количество вещества сульфат-аниона:
ν (SO2-4) = ν (BaSO4) = 53,59 г: 233 г/моль = 0,23 моль. Чтобы найти катионы в составе минерала предположим, что остаток массой 36,57 г содержит пропорциональные количества сульфат-иона и некоторых катионов.
Составим пропорцию:
Мбез SO2-4 = 159 – 96 = 63 г/моль. Это масса двух металлов: К (39) и Mg (24).
Масса сульфат-катиона составляет = 0,23моль .96 г/моль = 22,08 г.
Масса двух металлов соответственно равна 36,57 г- 22,08 г = 14,49 г.
Допустим, что 0,23 моль сульфат- иона связывают 0,23 моль ионов магния, а 0,23 моль хлорид-ионов связаны с таким же количеством вещества ионов калия. Тогда m (K+) = 0,23 моль .39 г/моль = 8,97 г,
а масса m(Mg2+) = 0,23. моль 24 г/моль = 5,52 г. Сумма этих значений совпадает с вычисленной массой двух металлов 8,97 + 5,52 = 14,49 г. Значит наше предположение было верным, в ином случае массы могли не совпасть.
Минерал каинит имеет формулу 0,23моль (MgSO4) : 0,23 моль (KCl) : 0,69 моль (H2O) = 1:1:3
Ответ: MgSO4 .KCl .3H2O
11. Минерал блёдит имеет следующий состав: натрия – 13,77%, магния – 7,18%, кислорода –57,48%, водорода – 2,39%, а остальное приходится на элемент, который Вам предстоит установить. Выведите брутто-формулу блёдита и установите его химическую природу [9].
Формулу минерала условно обозначим NaxMgyOzHnЭm. Массовая доля неизвестного элемента 19,18%, молярная масса А, степень окисления а. Рассчитаем мольные соотношения элементов в составе этого минерала x:y:z:n:m = 13,77/23: 7,18/24:57,48/16 : 2,39:1 :19,18/A=
0,6 : 0,3 : 3,6 : 2,4 : 19,18/A. Из условия электронейтральности молекул составим алгебраическое уравнение:
0,6(+1) + 0,3(+2) +3,6(-2) + 2,4(+1) +19,18а/А=0.
Решая уравнение относительно А, получим: А= 5,33 а. Что бы найти значение А, выполняем действие подбора значения а от +1 до +7. При а=6 получаем А =32, что соответствует молярной массе элемента серы. Находим: ν(S) = 19,18/32 = 0,6 моль. Подставляем полученное значение в мольные соотношения элементов в составе минерала и приводим их к целочисленным значениям
0,6 : 0,3 : 3,6 : 2,4 : 0,6 = 2 : 1 : 12 : 8 : 2. Молекулярная формула имеет вид Na2Mg1O12H8S2.
Логично предположить, что минерал представляет собой кристаллогидрат двойной соли Na2SO4 .MgSO4 .4H2O.
Ответ: Na2SO4 .MgSO4 .4H2O.
Список литературы
1. Сборник олимпиадных задач по химии с решениями/Сост. Е.М. Покровская, Т.В. Клочкова, З.М. Ахрименко. Кубан. гос. ун-т. – Краснодар, 1999. – 234 с.
2. Лидин Р.А., Молочко В.А., Андреева Л.Л. Химические свойства неорганических веществ. Учеб. пособие для вузов. 3-е изд., испр./Р. А. Лидин, В. А. Молочко, Л. Л. Андреева; под ред. Р. А. Лидина. – М.: Химия, 2000. 480 с.
3. Кузьменко Н.Е. 2500 задач по химии с решениями для поступающих в вузы: учебное пособие/ Н.Е. Кузьменко, В.В. Еремин. – М. Издательство «Экзамен», 2006. – 638 с.
4. Хомченко Г.П. Пособие по химии для поступающих в вузы. – М.: «Новая волна», 2018, 480 с.
5. Хомченко Г.П., Хомченко И.Г. Сборник задач по химии для поступающих в вузы. – 4-е изд. – М.: «Издательство Новая Волна», 2002. – 278 с.
6. Кузьменко Н.Е. Химия. Для школьников старших классов и поступающих в вузы: учебное пособие / Кузьменко Н.Е., Еремин В.В., Попков В.А. – Москва: МГУ имени М.В. Ломоносова, 2015. – 472 c.
7. Николаенко В.К. Сборник задач повышенной трудности: учебное пособие для средних учебных заведений/Под ред. проф. Г.В. Лисичкина. – М.: РОСТ, МИРОС, 1996. – 192.
8. Кузьменко Н.Е., Еремин В.В., Чуранов С.С. Сборник конкурсных задач по химии для школьников и абитуриентов. – М.: Экзамен: Издательский дом «ОНИКС 21 век», 2001.
9. Химия: Задачи с ответами и решениями. Учеб. – метод. Пособие/ П.А. Оржековский, Ю.Н. Медведев, А.В. Чураков, С.С. Чуранов. Под ред. проф. Г.В. Лисичкина. М.: ООО «Издательство АСТ»: ООО «Издательство Астрель», 2004.
Способов, как определить формулу вещества, достаточно много. Все зависит от исходных данных. Наиболее разнообразны подобные вычисления в органической химии. И это не удивительно, так как органических соединений значительно больше, чем неорганических.
Содержание:
1.Понятие простейшей и истинной формулы вещества
2.Массовая доля химического элемента: что означает и как высчитывается
3.Как определить формулу вещества по массовым долям элементов
4.Как определить формулу органического соединения:
4.1. по общей формуле вещества
4.2. по продуктам сгорания вещества
5. Как определить формулу вещества: комбинированные задачи
1.Понятие простейшей и истинной формулы вещества
В одних задачах на определение формулы вещества необходимо найти его простейшую формулу, а в других – истинную. В чем разница?
Простейшая, или иными словами, эмпирическая формула, указывает на соотношение атомов в молекуле (или в формульной единице, если речь идет о не ковалентном соединении).
Так, например: СН2 – простейшая формула алкена – показывает, что на каждый 1 атом углерода приходится 2 водородных атома. То есть существует соотношение 1:2. Поэтому для нахождения простейшей (эмпирической) формулы вещества важно рассчитать количество вещества атомов, которые входят в его состав, то есть n(C) и n(H).
Истинная формула, или иначе молекулярная, отражает действительное количество атомов всех элементов в молекуле.
Например, для пропилена, относящегося к классу алкенов, истинная (молекулярная) формула будет C3H6. Она говорит о том, что молекула данного вещества включает 3 атома С и 6 атомов Н. Это вполне соответствует простейшей формуле, отвечающей соотношению атомов 1:2. Для нахождения истинной (молекулярной) формулы соединения требуется посчитать его относительную молекулярную (Mr) или молярную массу (M).
2.Массовая доля химического элемента: что означает и как высчитывается
Массовая доля – это отношение массы компонента системы к массе системы, выраженное в процентах или долях от единицы.
Ну, а теперь проще.
Молекула имеет массу. Все атомы в молекуле также имеют свои массы. Атомов одного химического элемента в молекуле может быть 1 или несколько. Важна масса всех атомов одного элемента. Если ее разделить на массу молекулы, то получится массовая доля этого элемента. Ее выражают либо в процентах, которые всегда меньше 100%, либо в долях от единицы, которые всегда меньше 1.
Массовая доля элемента обозначается греческой буквой «омега» — ω. И записывается, например, так: ω(Н), ω(Сl), ω(С) и т.д. и рассчитывается:
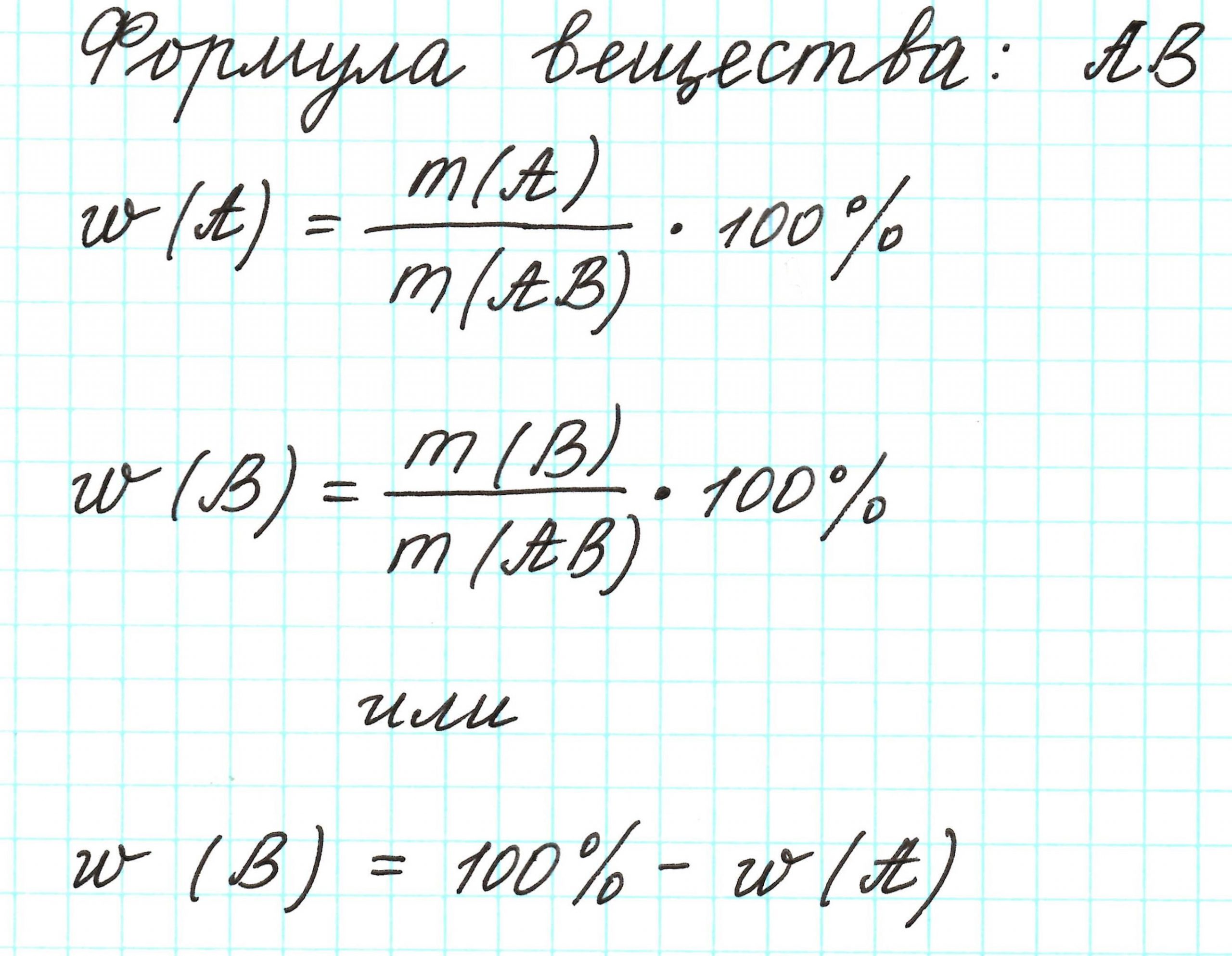
Пример 1. Каковы массовые доли элементов в оксиде железа (III) Fe2O3.
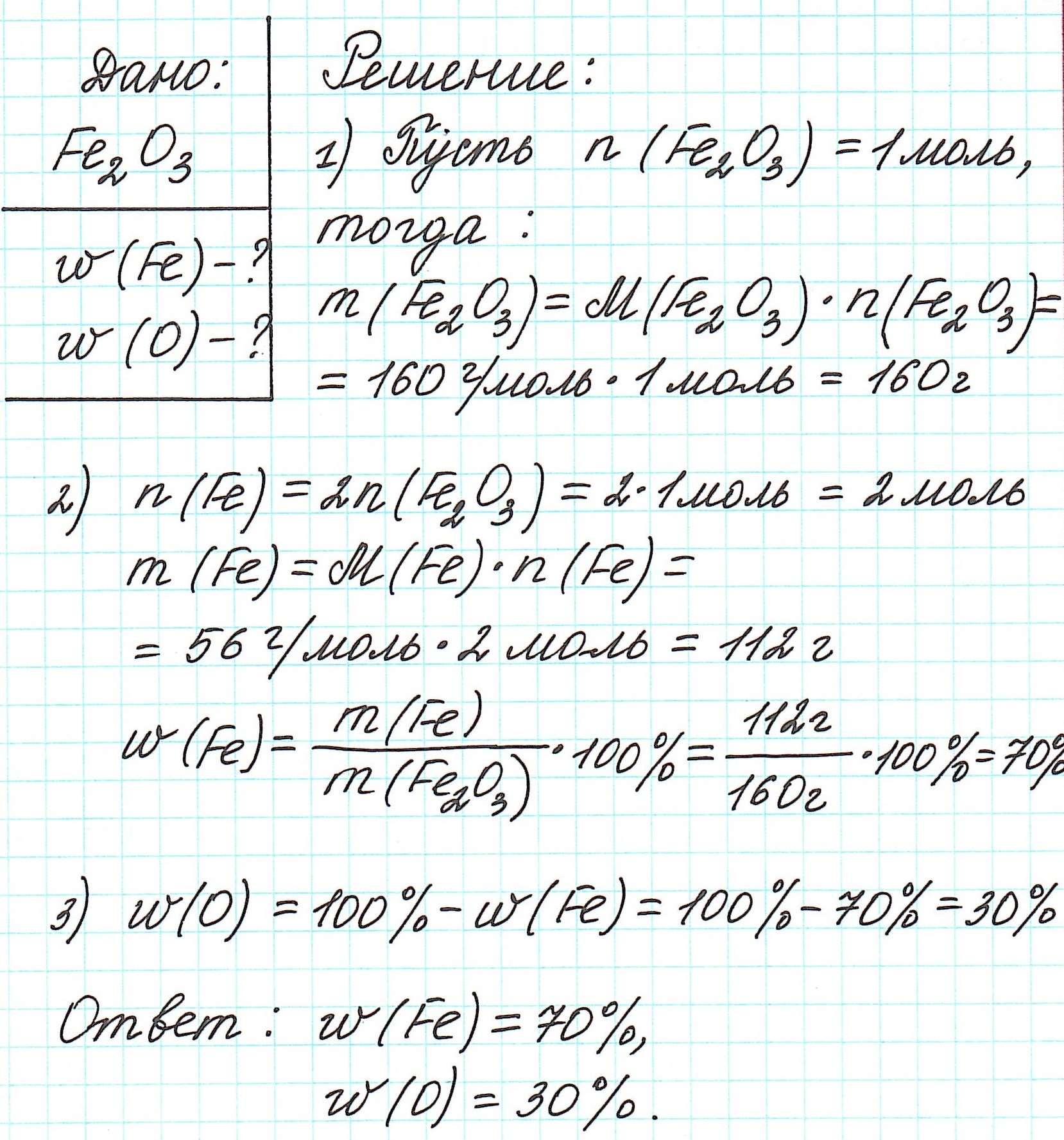
3.Как определить формулу вещества по массовым долям элементов
Нахождение формулы вещества по массовым долям элементов применимо как к органическим, так и к неорганическим соединениям.
Пример 2. Сероуглерод содержит 15,8% углерода по массе. Какова простейшая формула этого вещества?
Поскольку речь идет о массовых долях элементов, то необходимо знать массу вещества. В нашем случае – массу сероуглерода. В условии задачи о ней ничего не говорится. Поэтому допускаем, что масса вещества равна 100 г.
Почему 100 г? Это «круглое» число, и его использование облегчает все расчеты. Так как в итоге будем находить соотношения количеств веществ элементов, то какое-то особенное значение массы вещества не играет никакой роли.
Попробуйте ради эксперимента принять массу сероуглерода равной 23 г, 467 г и т.п. Результат будет один и тот же.
Допустим, что атомов углерода в молекуле х, а атомов серы – у. В таком случае формула вещества примет вид: СхSу.
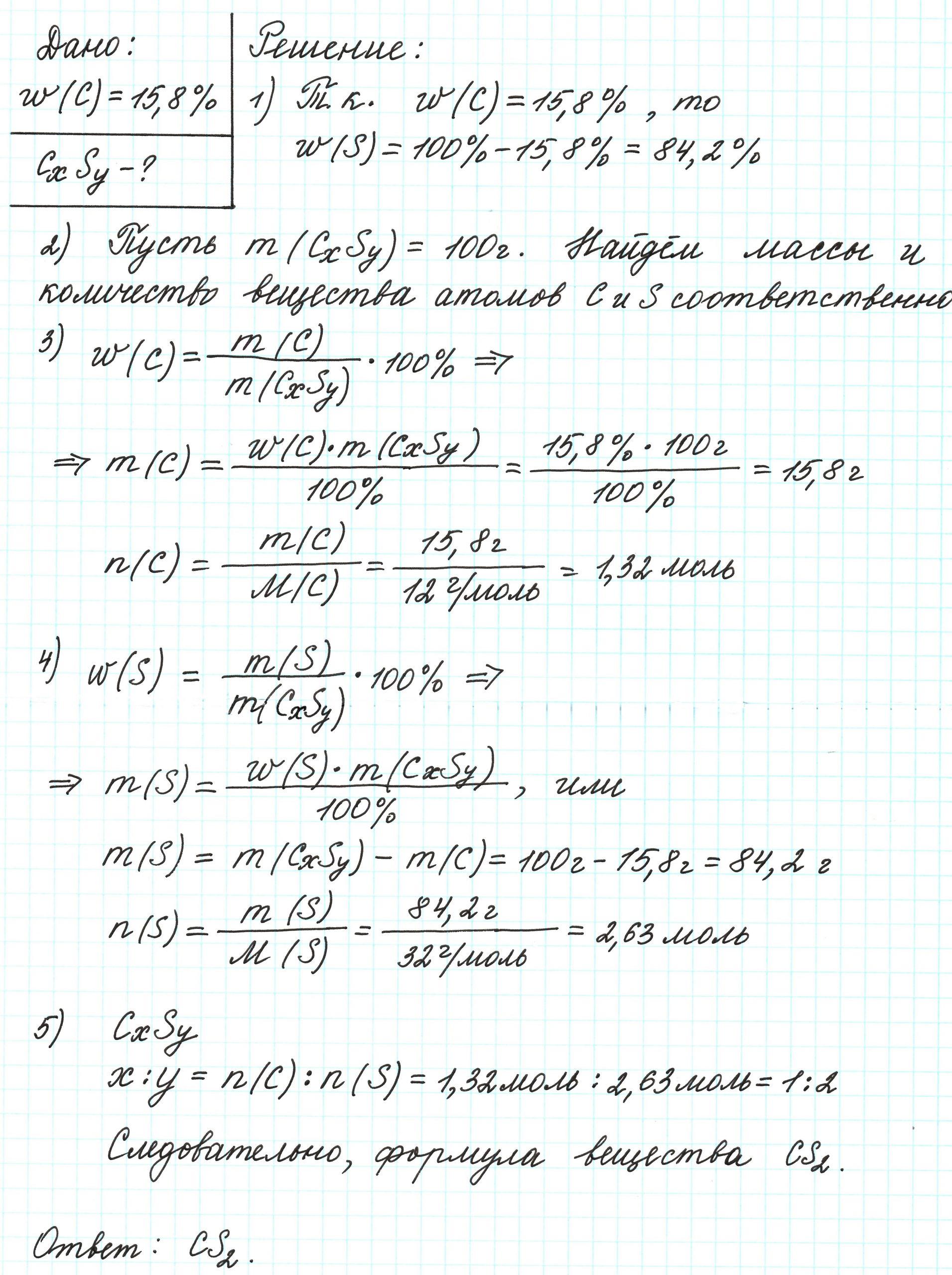
Пример 3. Содержание углерода в углеводороде составляет 83,33%. Плотность паров соединения по водороду – 36. Какова молекулярная формула углеводорода?
Из данных задачи следует, что углеводород может находиться в газообразном состоянии, так как известна плотность его паров. Эта величина всегда требуется для нахождения молярной (относительной молекулярной) массы вещества. Как она находится и что это такое читайте подробнее здесь.
Чтобы не загромождать записи, массовую долю элементов будем считать не в процентах, а в долях от единицы.

Пусть вас не удивляет получившаяся простейшая формула. Ведь, исходя из определения простейшей формулы, на каждый 1 атом углерода приходится 2,4 атома водорода. Это всего лишь соотношение. Соединения с формулой СН2,4 в принципе не существует. Не всегда простейшая и истинная формулы совпадают друг с другом.
А если полученная формула СН2,4 вас все же смущает, вы можете решать задачу и вторым способом. Но это несколько более сложный способ, когда требуется составить и решить уравнение с двумя неизвестными.
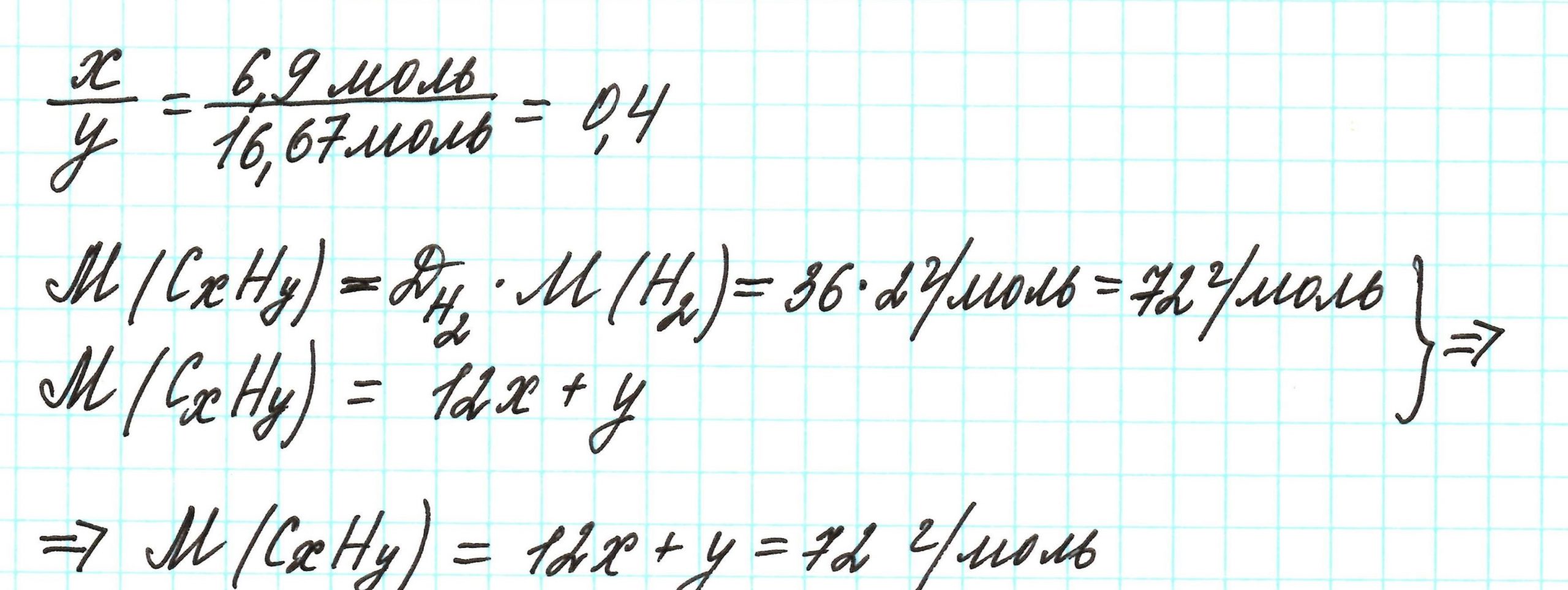

Не все химические вещества являются бинарными, то есть состоят из атомов двух химических элементов. Но в любом случае, алгоритм решения задачи тот же.
Пример 4. Некоторая кислота содержит водород (2,2%), иод (55,7%) и кислород (42,1%). Определите простейшую формулу этой кислоты.
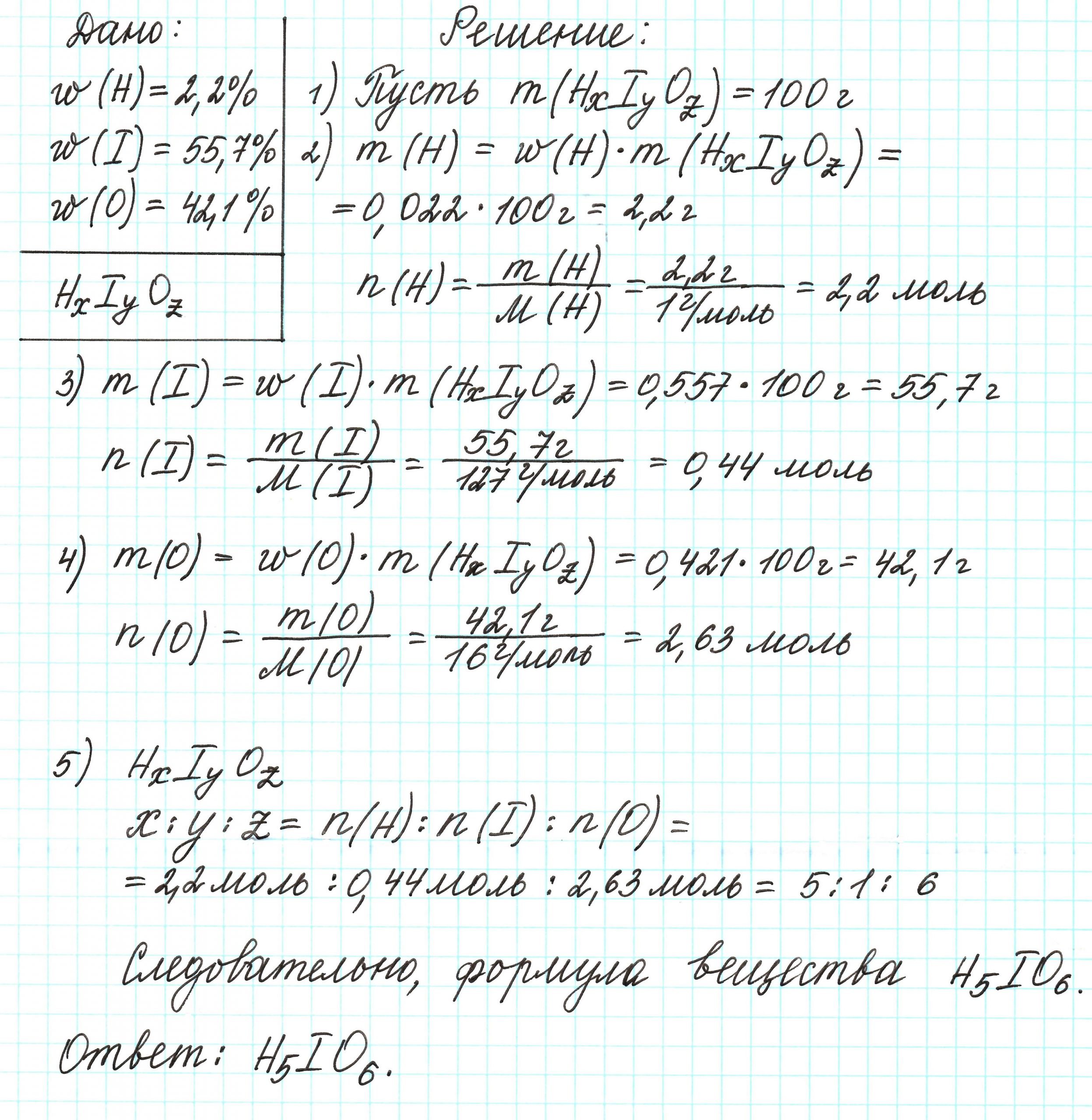
4.Как определить формулу органического соединения
Определить формулу органического вещества можно не только зная массовые доли элементов в его составе.
4.1. Как определить формулу органического соединения
по общей молекулярной формуле вещества
Органические вещества сгруппированы по самостоятельным классам на основе общности строения и свойств. Каждый класс соединений характеризуется своей общей молекулярной формулой. Особенно это наглядно видно на примере углеводородов.
Если другие органические вещества рассматривать как их производные, в молекулы которых введена какая-либо функциональная группа, то и для них также можно составить общую молекулярную формулу.
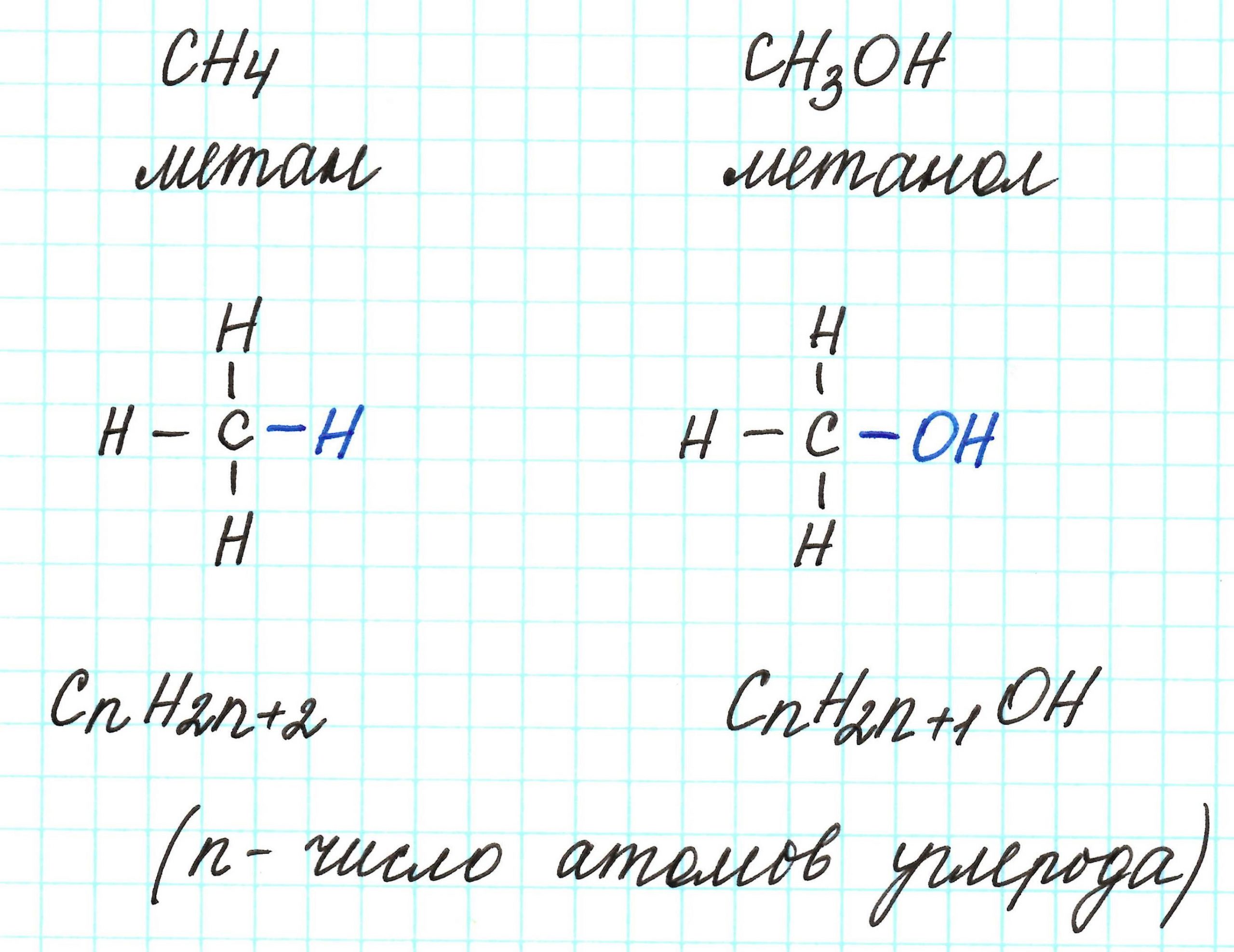
К слову, метан СН4 является представителем алканов, в молекулах которых на n атомов углерода и приходится 2n+2 атомов водорода. Алканы имеют общую молекулярную формулу, отражающую их состав: СnH2n+2.
Предельные одноатомные спирты можно рассматривать как производные алканов, в молекулах которых 1 атом водорода замещен на гидроксильную группа –ОН. Таким образом, их общая молекулярная формула такая: СnH2n+1ОН.
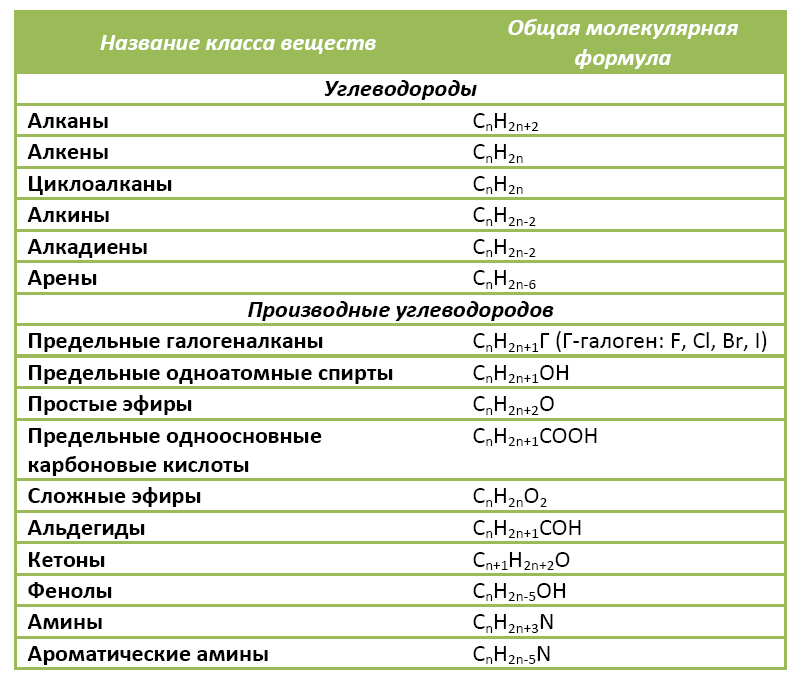
Ниже в таблице приведены общие молекулярные формулы основных классов органических соединений.
 Разберем примеры решения задач с использованием общей молекулярной формулы вещества.
Разберем примеры решения задач с использованием общей молекулярной формулы вещества.
Пример 5. Плотность паров по воздуху некоторого алкана 4,414. Какова формула алкана?

4.2. Как определить формулу органического соединения
по продуктам его сгорания
Это еще один распространенный тип задач на определение формулы органического соединения.
Необходимо запомнить и понять основные моменты:
— так как все органические вещества содержат атомы С, Н, а также атомы О (кислородсодержащие соединения), то всегда при их сгорании выделяется углекислый газ СО2 и образуется вода Н2О;
— все углеродные атомы, входящие в состав органического соединения, окажутся в составе углекислого газа СО2; следовательно, n(С) как в соединении, так и в СО2 – это одна и та же величина;
— все атомы водорода Н, которые имеются в составе вещества, перейдут в состав воды Н2О; следовательно, n(Н) и в данном веществе, и в Н2О – это одна и та же величина;
— при сгорании веществ, включающих в себя азот (например, амины), кроме СО2 и Н2О, образуется еще и N2.
Разберем несколько примеров.
Пример 6. Сожгли 7,2 г углеводорода. Плотность его паров по водороду составляет 36. В результате реакции образовалось 22 г оксида углерода (IV) и 10,8 г воды. Какова молекулярная формула соединения?

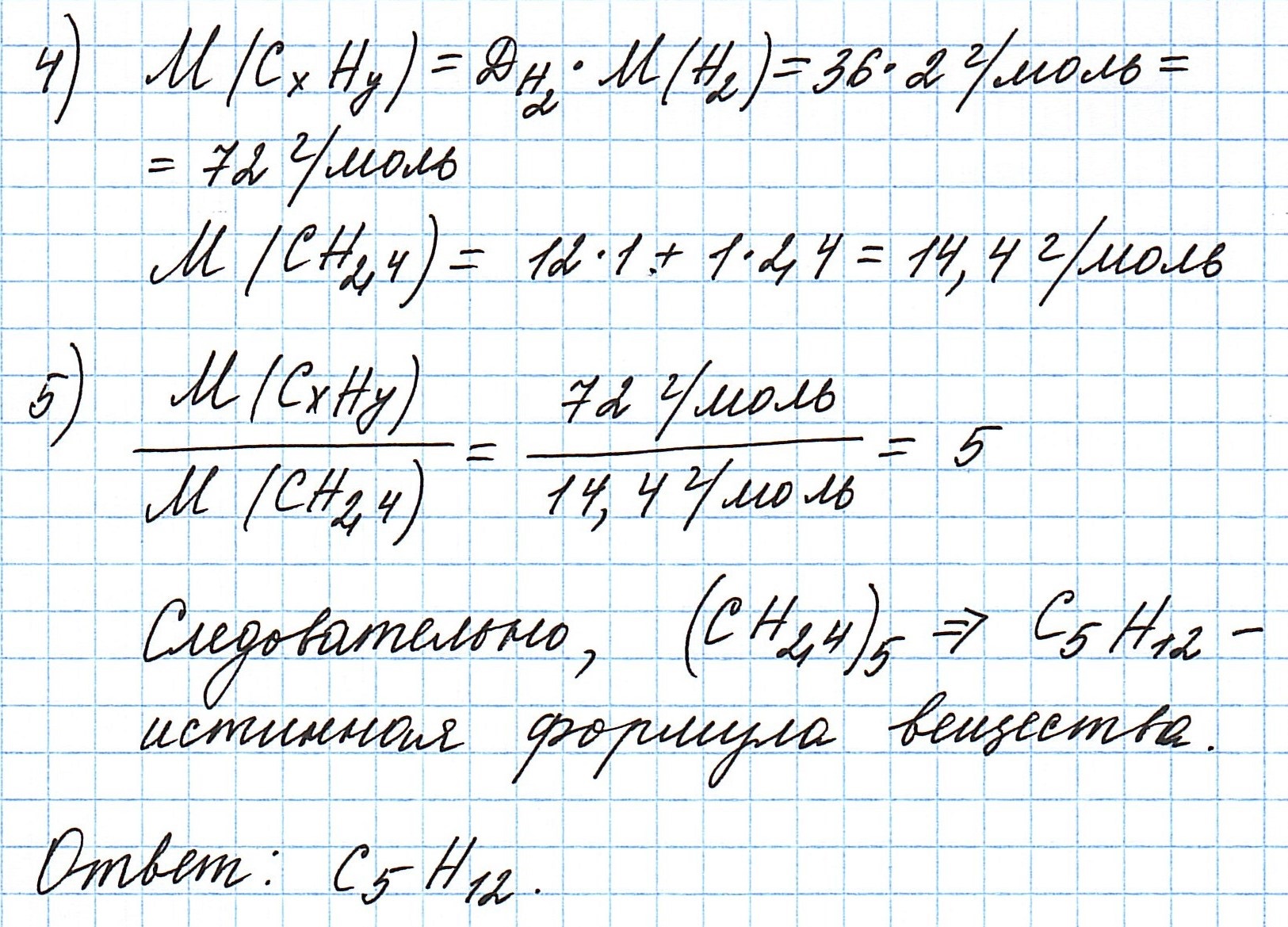
Пример 7. В результате сгорания 4,8 г органического соединения выделилось 3,36 л (н.у.) оксида углерода (IV) и образовалось 5,4 г воды. Плотность паров искомого соединения по кислороду равна 1. Вычислите молекулярную формулу вещества.


Пример 8. Результатом сжигания 0,31 г газообразного органического соединения, имеющего плотность 1,384 г/л, стало выделение 0,224 л (с.у.) оксида углерода (IV), 0,112 л азота и образование 0,45 г воды. Вычислите молекулярную формулу этого вещества.


5. Как определить формулу вещества: комбинированные задачи
Наибольший интерес и некоторую трудность представляют комбинированные задачи, сочетающие в себе необходимость найти формулу соединения:
— используя приемы, применяемые в рассмотренных выше задачах;
— используя сведения не только о химических, но и физических свойствах вещества.
Вот несколько примеров.
Пример 9. Какова молекулярная формула предельного углеводорода, при полном сгорании 8,6 г которого выделилось 13, 44 л (н.у.) оксида углерода (IV).
В этой задаче:
1) известен класс вещества, поэтому возможно применить его общую молекулярную формулу;
2) речь идет о сгорании вещества, поэтому количество атомов в составе молекулы будем искать, используя данные о продукте сгорания – СО2.

Пример 10. Алкен нормального строения содержит двойную связь при первом углеродном атоме. Образец этого алкена массой 0,7 г присоединил бром массой 1,6 г. Вычислите формулу алкена и назовите его.
В предлагаемых условиях:
1) известен класс вещества, следовательно, применим его общую молекулярную формулу;
2) речь идет об одном из химических свойств: способности алкенов присоединять галогены по месту разрыва двойной связи.

Пример 11. После полного сжигания в кислороде арена, имевшего массу 0,92 г, выделился оксид углерода (IV). Пропуская газ через избыток раствора щелочи Ca(OH)2, получили 7 грамм осадка. Какова молекулярная формула арена?
В предлагаемой задаче:
1) известен класс вещества;
2) речь идет о сжигании соединения и образовании в качестве продукта горения углекислого газа, который при взаимодействии со щелочью Са(ОН)2 привел к выпадению осадка известной массы.

Следующий пример очень характерен для задач, встречающихся в заданиях второй части ЕГЭ по химии.
Пример 12. Некоторое соединение, образующее альдегид в реакции окисления, взаимодействует с избытком бромоводородной кислоты, образуя 9,84 г продукта (выход составляет 80% от теоретического), имеющего плотность паров по Н2 61,5. Определите строение этого соединения, а также его массу, вступившую в реакцию?
В этой задаче:
1) говорится о химических свойствах искомого соединения; анализируя их, приходим к выводу, что заданным веществом является предельный одноатомный спирт;
2) известна общая молекулярная формула предельных одноатомных спиртов;
3) более подробно говорится о взаимодействии заданного вещества с бромоводородной кислотой; спирт, реагируя с HBr, дает галогеналкан, для которого известны его масса, практический выход и относительная плотность по Н2; именно от этих данных и нужно отталкиваться при решении данной задачи.

Итак, способов, как определить формулу вещества, действительно, множество. Мы рассмотрели лишь основные из них. Важно правильно уяснить понятия «простейшая формула вещества» и «истинная формула вещества», чтобы не путать их.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.

