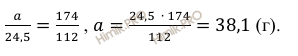Масса образовавшейся соли
К 25 граммам серной кислоты (H2SO4) прилили 25 грамм гидроксида калия (KOH), содержащего 2% примесей. Найдите массу образовавшейся соли.
Решение задачи
Запишем уравнение реакции нейтрализации раствора гидроксида калия (KOH) раствором серной кислоты (H2SO4):
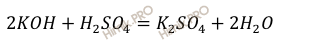
Используя формулу нахождения массовой доли растворенного вещества:
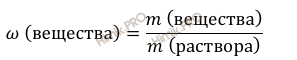
выразим массу вещества:

Найдём массу вещества гидроксида калия (KOH):
m
(вещества KOH) = 25 ∙ 0,98 = 24,5
(г).
Если раствор 98-процентный
(известно, что примеси составляют 2% поэтому: 100% — 2% = 98%), то массовая
доля гидроксида калия (KOH) в нем 0,98.
Учитывая, что молярные массы гидроксида калия (KOH) и серной кислоты (H2SO4) соответственно равны 56 г/моль и 98 г/моль (смотри таблицу Д.И. Менделеева), по уравнению реакции рассчитаем, сколько грамм серной кислоты (H2SO4) нужно для нейтрализации 1,192 г гидроксида калия (KOH):

на
нейтрализацию 112 г KOH
нужно 98 г H2SO4
на
нейтрализацию 24,5 г KOH
нужно х г H2SO4
Откуда:
Это означает, что серная кислота (H2SO4) находится в избытке и
дальнейшие расчеты производим по недостатку, то есть по гидроксиду калия (KOH).
Учитывая, что молярная масса сульфата калия (К2SO4) равна 174 г/моль (смотри таблицу Д.И. Менделеева), по уравнению реакции найдём массу образовавшейся соли:
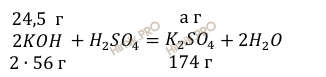
112
г KOH нужно для
образования 174 г соли
24,5
г KOH нужно для
образования а г соли
Откуда масса образовавшейся соли:
Масса образовавшейся соли равна 38,1 грамм.
Ответ:
масса образовавшейся соли равна
38,1 грамм.
Похожие задачи
Типовые задачи с решениями по солям
Задача 26
Назвать следующие соли по международной номенклатуре:
Решение:
Задача 27
Найти эмпирические формулы следующих солей: гидрокарбонат кальция, гидроксосульфат магния, хромат калия.
Решение:
Задача 28
Привести графические формулы следующих солей: 
Решение:
Задача 29
К каким типам относятся следующие соли: 

Решение:
Задача 30
Составить уравнения следующих химических реакций:
Решение:
Задача 31
Предложить все возможные методы получения соли 
Решение:
Эти задачи взяты со страницы решения задач по неорганической химии:
Задачи с решением по неорганической химии
Возможно эти страницы вам будут полезны:
Здравствуйте, уважаемые читатели!
В этой статье я предлагаю вашему вниманию 5 авторских задач по неорганике. Основной их особенностью является кажущееся “нагромождение” разного рода усложнений. Делала это специально, рассматривая данные задачи как тренажеры для отработки этих усложнений в комплексе.
Итак, задача № 1. В нее включила:
приготовление серной кислоты из олеума, кислотный гидролиз фосфида натрия, идентификацию продуктов реакции по среде полученного раствора, кристаллогидраты, растворимость, атомистику.
Приготовили раствор серной кислоты из 371,8 г 2,64%-ного раствора серной кислоты и некоторого количества олеума. К раствору добавили фосфид натрия. Среда раствора после окончания реакции – нейтральная. После охлаждения выпало в осадок 322 г декагидрата сульфата натрия и осталось 227,2 г насыщенного раствора сульфата натрия. Растворимость безводной соли в условиях эксперимента = 28 г /100 г воды. Найти массовую долю протонов серы в олеуме.
Решение задачи начинается с «конца задачи», так как фактической информации в начале задачи недостаточно для расчетов.
1.Найдем n израсх H2SO4:
n Na2SO4*10H2O=322/322=1 моль
m Na2SO4 в насыщ рре= 227,2*28 /128=49,7 г, n Na2SO4=49,7/142=0,35 моль
n сумм Na2SO4= n Na2SO4*10H2O + n Na2SO4 в насыщ рре=1,35 моль
n сумм Na2SO4= n израсх Н2SO4=1,35 моль
2.Найдем m приготовленного раствора Н2SO4:
А) 3H2SO4+2Na3P=3Na2SO4+2PH3↑(1)
Так как среда раствора после окончания реакции нейтральная, исходные вещества прореагировали полностью.
n1 H2SO4=1,35 моль, n1 Na3P = n1 PH3 =(2/3)*1,35 моль=0,9 моль
б) Составим выражение для материального баланса:
m Na2SO4*10H2O+m насыщ рра+m PH3=mприг.рра H2SO4+mNa3P,
откуда mприг.рра H2SO4=322+227,2+0,9*34-0,9*100=489,8 г
3.Найдем массовую долю протонов серы в олеуме.
А) найдем массу олеума:
mприг.рра H2SO4=mолеума+m исх рра H2SO4
откуда mолеума=489,8-371,8=118 г
б) найдем nS в олеуме:
nS в исх рре H2SO4= nисх H2SO4=371,8*0,0264/98=0,1 моль
nS в олеуме= n1 H2SO4- nS в исх рре H2SO4=1,35-0,1=1,25 моль
в) найдем mпротонов S в олеуме:
nпротонов S=16 nS=16*1,25=20 моль,
mпротонов S=20*1=20 г
г)W(протонов S)=20*100/118=16,95%
В задачу 2 включены:
приготовление серной кислоты из олеума, идентификация продуктов реакции по концентрации полученного раствора серной кислоты, нахождение формулы кристаллогидрата, растворимость, атомистика.
Задача 2
Приготовили раствор серной кислоты из 180,5 г 13,57% рра серной кислоты и 64,5 г олеума, содержащего 37,21% серы. К раствору добавили сульфид железа(2), содержащий всего 1,2 *10^24 атомов. В реакции выделялся только неприятно пахнущий газ. После окончания реакции из реакционной смеси выпало 262,38 г кристаллогидрата полученной соли. Найти формулу кристаллогидрата. Растворимость безводной соли = 29,5 г/100 г воды
Решение
1.Характеристики приготовленного раствора:
А)найдем количество кислоты, которую можно приготовить из олеума:
nсумм(S)=64,5*0,3721/32=0,75 моль
n(S)= n(H2SO4)из олеума=0,75 моль
б) Найдем общее количество кислоты в приготовленном растворе:
n общ (H2SO4)=180,5*0,1357/98+ n(H2SO4)из олеума=0,25+0,75=1 моль
в) mприг.рра=180,5+64,5=245 г, (W=98/245=0,4- относительно разбавленная кислота)
2.Найдем количество FeS:
n атомов в FeS=1,2 *10^24 атомов/6,02*10^23=2моль
1 моль сульфида содержит 2 моля атомов, тогда
n(FeS)=1 моль
3.Найдем состав полученной смеси после растворения сульфида:
А)FeS+H2SO4=H2S+FeSO4 (1) , n(FeS)=1 моль, n общ (H2SO4)= 1 моль, вещества прореагировали полностью.
Б) n1 FeSO4=1 моль, m FeSO4=152 г
m реакц.смеси= 245+1*88-1*34=299 г
4.Найдем состав выпавшего в осадок кристаллогидрата FeSO4*xH2O
Для этого составим баланс по соли, учитывая, что mисх FeSO4=152 г:
А m FeSO4*xH2O =262,38г, тогда m FeSO4 в кристаллогидрате=262,38*152/(152+18x);
Б)m ост. насыщенного Рра=299-262,38=36,62 г, m FeSO4 в оставшемся насыщенном растворе= 29,5*36,62/129,5=8,342 г
В) баланс по соли:
152=262,38*152/(152+18x)+ 8,342 г , откуда х=7
Ответ: FeSO4*7H2O
В задачу 3 включены:
термические превращения безводных солей и кристаллогидратов, атомистика. нахождение формулы кристаллогидрата, получение олеума
Задача 3
296,2 г смеси сульфата железа (3) и кристаллогидрата этой же соли, взятых в мольном соотношении 6:1 соответственно, массовая доля протонов водорода в которой составляет 0,608 %, осторожно нагрели до стабилизации массы. Выделившиеся пары сконденсировали. Оставшуюся безводную соль прокалили до постоянной массы при 500 град С. Полученный газ осторожно смешали с полученным на первой стадии конденсатом. Найти массу и состав полученного раствора.
Решение.
1.Найдем состав смеси солей:
А) Пусть n Fe2(SO4)3* аH2O=х моль, тогда n Fe2(SO4)3=6 х моль,
б)выразим состав кристаллогидрата Fe2(SO4)3*аH2O
n(H)=296,2*0,00608/1=1,8 моль=2ах или ах=0,9 (1).
В) m смеси=400*6х+х*(400+18а)=2400х+400х+18ах=2800х+18ах=296,2 (2)
Решая совместно уравнения 1 и 2, получим: а=0,9/х=0,9/0,1=9
х=0,1 моль= n Fe2(SO4)3* 9H2O ; n Fe2(SO4)3=6 х моль=0,6 моль.
2.Найдем количество воды(конденсата), выделившейся на первом этапе нагревания смеси – обезвоживание кристаллогидрата:
Fe2(SO4)3* 9H2O= Fe2(SO4)3+9H2O (3)
Выделилось Н2О: 0,1*9=0,9 моль
3.Найдем количество SO3, выделившегося на втором этапе – прокаливании безводной соли:
Fe2(SO4)3 = Fe2O3+3SO3 (500 градС)(4)
nисх Fe2(SO4)3=0,1+0,6=0,7 моль, n4(SO3)= 0,7*3=2,1 моль
4. Найдем массу и состав раствора, полученного при смешивании
конденсата (0,9 моль )и SO3 (2,1 моль): .
А) SO3+ Н2О=H2SO4 (5)
n5 (H2SO4)= n(Н2О)= 0,9 моль
б) nост (SO3)=2,1-0,9=1,2 моль
в)m(рра SO3 в H2SO4)=18*0,9+2,1*80=184,2 г
W(SO3)=100*1,2*80/184,2=52,1%
В задачу 4 включены:
приготовление фосфорной кислоты из фосфорного ангидрида, идентификация продуктов реакции по соотношению между реагентами, атомистика.
Задача 4.
Рассчитайте массовые доли веществ в растворе, образующемся при добавлении к 200 мл раствора фосфата калия с массовой долей соли 20% и плотностью 1,06 г/мл такого количества оксида фосфора (V), при растворении которого в 50 г 19,6% раствора фосфорной кислоты массовая доля протонов фосфора в растворе увеличивается в 3,51 раза
Решение задачи начинается с «конца задачи», так как фактической информации в начале задачи недостаточно для расчетов.
1. Найдем количество добавленного Р2О5:
А)Найдем W протонов Р в растворе после добавления Р2О5 к рру Н3РО4
n исх Н3РО4=50*0,196/98=0,1 моль, n исх протонов Р= 0,1*15=1,5 моль,
W исх протонов Р=1,5/50=0,03=3%, W кон протонов Р=3*3,51=10,53%
P2O5+3Н2О=2Н3РО4(1)
б)Пусть nдоб(P2O5)=x, nдобР=2x, m доб протонов Р=2х*15=30х, m пол. протонов=1,5+30х
mполуч рра(Н3РО4)= 50+142х,
Согласно условию W кон протонов Р= 10,53%:
(1,5+30х)/( 50+142х)=0,1053, откуда х= nдоб(P2O5)=0,25 моль
2. Характеристика процессов, протекающих при добавлении оксида фосфора к рру фосфата:
а)реакция Р2О5 с водой:
nдоб(P2O5)=0,25 моль
P2O5+3Н2О=2Н3РО4 (2), n2(Н3РО4)=0, 5 моль
б)Реакция кислоты со средней солью
n (К3РО4)=200*0,2*1,06/212=0,2моль, n (Н3РО4)=0, 5 моль (избыток)
К3РО4+2Н3РО4=3К Н2РО4(3)
n3(Н3РО4)=2 n (К3РО4)= 0,4 моль,
3. Характеристика конечного раствора:
nост(Н3РО4)=0,5-0,4=0,1 моль, nобр(К Н2РО4)= 3n (К3РО4)= 0,6 моль
mрра=200*1,06+0,25*142=247,5 г
W(К Н2РО4)=0,6*136*100/247,5=33%
W(Н3РО4)=0,1*98*100/247,5=3,96%
В задачу 5 включены:
получение фосфора из содержащего примеси фосфорита, растворимость газов и кислых солей, особенности реакции фосфорной кислоты с аммиаком, идентификация продуктов реакции по соотношению между реагентами.
Задача 5
Фосфор, полученный восстановлением 221,4 кг фосфорита, содержащего 30 % примесей, сожгли в избытке кислорода, и продукт сгорания растворили в 83,508л насыщенного раствора аммиака плотностью 0,88 г/мл ( Растворимость аммиака составляет 700 объемов в 1 объеме воды). Определите состав и массу осадка, выпавшего из раствора, если известно, что в условиях эксперимента растворимость гидрофосфата аммония =62 г/100 г воды, растворимость дигидрофосфата аммония = 368 г/100 г воды.
1. Найдем массу полученного фосфора
n(Ca3(PO4)2=221,4*0,7/310=0,5 кмоль=500 моль
Ca3(PO4)2 +5С+3SiO2 = 3CaSiO3+5CO+2P(1)
n1(P)=2 n(Ca3(PO4)2==1000 моль
2.Найдем массу полученного Р2О5
4Р+5О2=2Р2О5(2)
n2(P2О5)=0,5 n1(P)=500 моль
3. Найдем количество вещества аммиака в насыщенном растворе
700 л NH3 растворяются в 1 л воды. Тогда m(NH3)=700*17/22,4=531,25 г,
W NH3 в насыщ рре=531,25/1531,25=0,347
M NH3 в 83,508 л рра= 0,347*83 508*0,88=25 496 г
n(NH3)=25496/17=1500 моль
4.Найдем состав полученной реакционной смеси
Реакцию образования фосфата аммония не рассматриваем, так как в водных растворах фосфат аммония сразу гидролизуется.
А)Р2О5+2NH3+3H2O=2NH4H2PO4(3)
Р2О5+4NH3+3H2O= 2(NH4)2HPO4(4)
n(NH3)=138600*0,2*0,92/17=1500 моль
n(NH3)/ n(P2О5)=3/1, пойдут реакции 3и 4.
Б)Пусть n3(NH4H2PO4)=х, n4((NH4)2HPO4)=у, тогда:
n3(NH3)=х, n1(P2О5)=0,5х, n4(NH3)=2у, n5(P2О5)=0,5у,
Составим систему:
Х+2у=1500
0,5(х+у)=500, откуда х= n (NH4H2PO4)= 500 моль, у= n4((NH4)2HPO4)= 500моль
Mрра= 500*142+83508*0,88=144487 г, в том числе 57500 г NH4H2PO4,
66000 г (NH4)2HPO4, 20987 г воды
5. Найдем массу осадка, выпавшего из раствора:
А) В данном количестве воды может раствориться 13011 г ((NH4)2HPO4 (раствор пересыщен), в осадок выпадет (66000-13011)=52989 г соли (NH4)2HPO4
Б) В данном количестве воды может раствориться 77232 г NH4H2PO4(в растворе находится 57500 г, раствор ненасыщен)
Ответ: в осадок выпадет 52,989 кг (NH4)2HPO4
Заранее благодарна за конструктивные замечания.
Всего доброго!
- Подробности
- Категория: Общая химия
Определение массы соли сульфата железа (lll) в реакции оксида железа (lll) и серной кислоты
Задача 2.
Вычислите массу соли, образовавшейся при взаимодействии оксида железа (lll) с 245г 60%-ного раствора серной кислоты.
Решение:
Уравнение реакции имеет вид:
Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O
Из уравнения реакции следует, что на образование 1 моля сульфата железа (lll) требуется 3 моля серной кислоты, получим:
n[Fe2(SO4)3] = 3n(H2SO4) или n[Fe2(SO4)3] : 3n(H2SO4);
М(H2SO4) = 98 г/моль; М[Fe2(SO4)3] = 400 г/моль.
Рассчитаем массу и количество серной кислоты, используя данные из условия задачи, получим:
m(H2SO4) = m(р-ра) * w% = (245 г * 60%)/100% = 147 г;
n(H2SO4) = m(H2SO4) /M(H2SO4) = 147 г/98 г/моль = 1,5 моль.
Отсюда находим массу сульфата железа (lll):
1моль[Fe2(SO4)3] : 3моль(H2SO4) = хмоль[Fe2(SO4)3] : 1,5моль(H2SO4);
хмоль[Fe2(SO4)3] = [1моль[Fe2(SO4)3] * 1,5моль(H2SO4)]/ 3моль(H2SO4) = 0,5моль[Fe2(SO4)3].
Отсюда
m[Fe2(SO4)3] = n[Fe2(SO4)3] * M[Fe2(SO4)3] = 0,5 моль * 400 г/моль = 200г.
Ответ: m[Fe2(SO4)3] = 200г.
Задача по химии
Знаток
(298),
закрыт
10 лет назад
Geselle
Гений
(63461)
10 лет назад
Обозначим m массу соли (здесь безразлично, какая соль, лишь бы она не образовывала кристаллогидратов. (Хлорид калия не образует кристаллогидратов) .
Составим уравнение:
100m/(m + 100) = 8
m + 100 -это масса раствора, в котором m г соли и 100 г воды.
m = 8,7 г (округленно) – это ответ
Мила
Ученик
(237)
10 лет назад
Сначала раскрой массовую доли воды. А она раскрывается как наверняка знаешь.. . а потом в раскрытом виде приравняй с солью. проценты перевиди и умножь…. 100 прибавь. . все легко