Масса образовавшейся соли
К 25 граммам серной кислоты (H2SO4) прилили 25 грамм гидроксида калия (KOH), содержащего 2% примесей. Найдите массу образовавшейся соли.
Решение задачи
Запишем уравнение реакции нейтрализации раствора гидроксида калия (KOH) раствором серной кислоты (H2SO4):
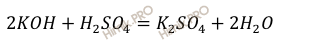
Используя формулу нахождения массовой доли растворенного вещества:
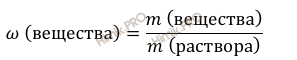
выразим массу вещества:

Найдём массу вещества гидроксида калия (KOH):
m
(вещества KOH) = 25 ∙ 0,98 = 24,5
(г).
Если раствор 98-процентный
(известно, что примеси составляют 2% поэтому: 100% — 2% = 98%), то массовая
доля гидроксида калия (KOH) в нем 0,98.
Учитывая, что молярные массы гидроксида калия (KOH) и серной кислоты (H2SO4) соответственно равны 56 г/моль и 98 г/моль (смотри таблицу Д.И. Менделеева), по уравнению реакции рассчитаем, сколько грамм серной кислоты (H2SO4) нужно для нейтрализации 1,192 г гидроксида калия (KOH):

на
нейтрализацию 112 г KOH
нужно 98 г H2SO4
на
нейтрализацию 24,5 г KOH
нужно х г H2SO4
Откуда:

Это означает, что серная кислота (H2SO4) находится в избытке и
дальнейшие расчеты производим по недостатку, то есть по гидроксиду калия (KOH).
Учитывая, что молярная масса сульфата калия (К2SO4) равна 174 г/моль (смотри таблицу Д.И. Менделеева), по уравнению реакции найдём массу образовавшейся соли:
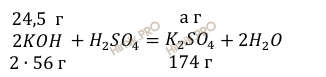
112
г KOH нужно для
образования 174 г соли
24,5
г KOH нужно для
образования а г соли
Откуда масса образовавшейся соли:
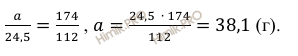
Масса образовавшейся соли равна 38,1 грамм.
Ответ:
масса образовавшейся соли равна
38,1 грамм.
Похожие задачи

Типовые задачи с решениями по солям
Задача 26
Назвать следующие соли по международной номенклатуре:

Решение:

Задача 27
Найти эмпирические формулы следующих солей: гидрокарбонат кальция, гидроксосульфат магния, хромат калия.
Решение:

Задача 28
Привести графические формулы следующих солей:  ,
, 
Решение:
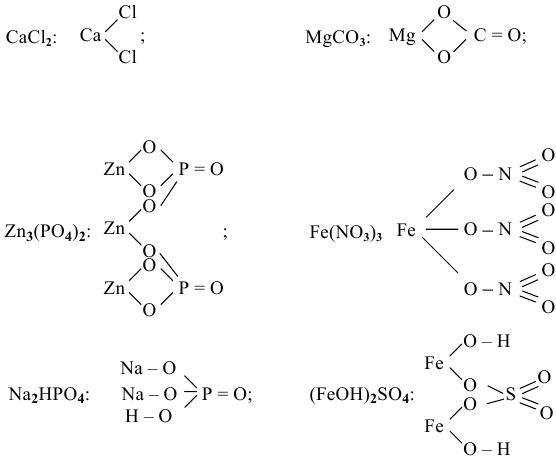
Задача 29
К каким типам относятся следующие соли:  ,
,  ?
?
Решение:

Задача 30
Составить уравнения следующих химических реакций:

Решение:

Задача 31
Предложить все возможные методы получения соли  .
.
Решение:

Эти задачи взяты со страницы решения задач по неорганической химии:
Задачи с решением по неорганической химии
Возможно эти страницы вам будут полезны:

- Подробности
- Категория: Общая химия
Определение массы соли сульфата железа (lll) в реакции оксида железа (lll) и серной кислоты
Задача 2.
Вычислите массу соли, образовавшейся при взаимодействии оксида железа (lll) с 245г 60%-ного раствора серной кислоты.
Решение:
Уравнение реакции имеет вид:
Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O
Из уравнения реакции следует, что на образование 1 моля сульфата железа (lll) требуется 3 моля серной кислоты, получим:
n[Fe2(SO4)3] = 3n(H2SO4) или n[Fe2(SO4)3] : 3n(H2SO4);
М(H2SO4) = 98 г/моль; М[Fe2(SO4)3] = 400 г/моль.
Рассчитаем массу и количество серной кислоты, используя данные из условия задачи, получим:
m(H2SO4) = m(р-ра) * w% = (245 г * 60%)/100% = 147 г;
n(H2SO4) = m(H2SO4) /M(H2SO4) = 147 г/98 г/моль = 1,5 моль.
Отсюда находим массу сульфата железа (lll):
1моль[Fe2(SO4)3] : 3моль(H2SO4) = хмоль[Fe2(SO4)3] : 1,5моль(H2SO4);
хмоль[Fe2(SO4)3] = [1моль[Fe2(SO4)3] * 1,5моль(H2SO4)]/ 3моль(H2SO4) = 0,5моль[Fe2(SO4)3].
Отсюда
m[Fe2(SO4)3] = n[Fe2(SO4)3] * M[Fe2(SO4)3] = 0,5 моль * 400 г/моль = 200г.
Ответ: m[Fe2(SO4)3] = 200г.
Вычисление количества вещества, массы или объема вещества по количеству веществ, массе или объему одного из реагентов или продуктов реакции
Основой для проведения количественных расчётов в химии является закон сохранения массы. Согласно этому закону масса реагентов равна массе продуктов реакции.
Отсюда следует, что для любой химической реакции массы реагентов и продуктов реакции относятся между собой как молярные массы веществ, умноженные на их стехиометрические коэффициенты.
Для расчёта по химическим уравнениям можно использовать два эквивалентных способа: через количество вещества или через пропорцию. Подчеркнём ещё раз: официального запрета на использование метода пропорций при решении задач на ОГЭ и ЕГЭ нет!
Для определения массы (или количества вещества) продуктов реакции или исходных веществ по уравнениям химических реакций вначале составляют уравнение химической реакции и устанавливают стехиометрические коэффициенты; затем определяют молярную массу, массу и количество вещества известных реагентов химической реакции; составляют и решают пропорцию, в которую в зависимости от условий задачи вводят числовые значение величин: молярные массы, массы, количества веществ или их объёмы (для газов).
При этом в одном столбце пропорций должны находиться одинаковые характеристики вещества с одной и той же размерностью.
Пример 1. Масса железа, вступившего в реакцию с 6 моль хлора, равна _________ г. (Ответ запишите с точностью до целого числа.)
Решение. Составляем уравнение химической реакции:
Из этого уравнения следует, что 3 моль Cl2 реагируют с 2 моль Fe, т. е.:
Определяем массу железа:
Пример 2. Масса нитрида лития, образовавшегося в результате его реакции с азотом объёмом 8,96 л, равна_______________ г.
Решение. Составляем уравнение химической реакции:
Определяем количество вещества азота, вступившего в реакцию:
Из уравнения реакции следует, что из 1 моль N2 образуется 2 моль Li3N, т. е.:
Определим массу Li3N:
Пример 3. Объём углекислого газа, образовавшегося в результате разложения карбоната магния количеством вещества 4 моль избытком соляной кислоты, равен________ л.
Решение. Составляем уравнение химической реакции:
Из этого уравнения следует, что количество вещества углекислого газа и карбоната магния равны между собой, т. е. n(CO2) = 4 моль.
Пример 4. Объём водорода, который выделится при растворении 16,8 г железа в избытке разбавленной соляной кислоты, равен _________ л.
Решение. Составляем уравнение химической реакции:
Определим количество вещества железа:
Количество вещества железа и водорода в данном уравнении реакции равны между собой. Следовательно, количество вещества водорода также равно 0,3 моль.
Вычислим объём водорода:
Пример 5. Масса осадка, который образуется в результате взаимодействия 40,0 г хлорида кальция с избытком карбоната натрия, равна _________г.
Решение. Составляем уравнение реакции:
Согласно уравнению химической реакции составим пропорцию и решим её:
Пример 6. 250 г раствора нитрата серебра смешали с избытком раствора йодида калия. Выпал осадок массой 11,75 г. Вычислите массовую долю нитрата серебра в исходном растворе.
Элементы ответа (допускаются иные формулировки ответа, не искажающие его смысла)
1) Составлено уравнение химической реакции:
2) По массе осадка йодида серебра рассчитано его количество вещества, а затем в соответствии с уравнением реакции — количество вещества и масса нитрата серебра, содержащегося в исходном растворе:
Из уравнения реакции следует, что n(AgI) = n(AgNO3) = 0,05 моль, тогда:
3) Вычислена массовая доля нитрата серебра в исходном растворе:
| Критерии оценивания | Баллы |
| Ответ правильный и полный, включает все названные элементы | 3 |
| Правильно записаны два первых элемента из названных выше | 2 |
| Правильно записан один из названных выше элементов (1-й или 2-й) | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 3 |
Тренировочные задания
1. К 300 г раствора нитрата бария прибавили избыток раствора сульфата натрия. Масса выпавшего осадка составила 23,3 г. Определите концентрацию соли в исходном растворе.
2. К 150 г раствора сульфата натрия прибавили избыток раствора хлорида бария. Масса выпавшего осадка составила 23,3 г. Определите концентрацию соли в исходном растворе.
3. К 300 г раствора силиката натрия прибавили избыток раствора нитрата кальция. Масса выпавшего осадка составила 12,0 г. Определите концентрацию соли в исходном растворе.
4. К 150 г раствора карбоната калия прибавили избыток раствора соляной кислоты. При этом выделился газ объёмом 3,36 л (н. у.). Определите концентрацию соли в исходном растворе.
5. К 250 г раствора гидрокарбоната натрия прибавили избыток раствора бромоводородной кислоты. При этом выделился газ объёмом 5,6 л. Определите концентрацию соли в исходном растворе.
6. К 50 г раствора карбоната натрия прибавили избыток раствора хлорида бария. Масса выпавшего осадка составила 7,88 г. Определите концентрацию соли в исходном растворе.
7. К 200 г раствора хлорида бария прибавили избыток раствора карбоната калия. Масса выпавшего осадка составила 7,88 г. Определите концентрацию соли в исходном растворе.
8. К 200 г раствора хлорида железа (II) прибавили избыток раствора гидроксида калия. Масса выпавшего осадка составила 18,0 г. Определите концентрацию соли в исходном растворе.
9. К 400 г раствора нитрата свинца прибавили избыток раствора йодида натрия. Масса выпавшего осадка составила 23,05 г. Определите концентрацию соли в исходном растворе.
10. К 300 г раствора йодида натрия прибавили избыток раствора нитрата свинца. Масса выпавшего осадка составила 23,05 г. Определите концентрацию соли в исходном растворе.
11. Определите массу осадка, который выпадет при взаимодействии 150 г 14,8%-ного раствора хлорида кальция с избытком раствора карбоната натрия.
12. Определите объём газа (н. у.), который выделится при взаимодействии 120 г 8,8%-ного раствора карбоната натрия с избытком раствора соляной кислоты.
13. Определите массу соли, которая выпадет в осадок при взаимодействии 140 г 13,5%-ного раствора нитрата цинка с избытком раствора сульфида натрия.
14. Определите массу осадка, который выделится при взаимодействии 200 г 18,8%-ного раствора нитрата меди с избытком раствора сульфида натрия.
15. Определите массу осадка, который выпадет при взаимодействии 200 г 6,1%-ного раствора силиката натрия с избытком раствора хлорида цинка.
16. Определите массу осадка, который выделится при взаимодействии 200 г 12,7%-ного раствора хлорида железа (II) с избытком раствора сульфида натрия.
17. Определите массу осадка, который выделится при взаимодействии 50 г 17%-ного раствора нитрата серебра с избытком раствора бромида калия.
18. Определите массу осадка, который образуется при взаимодействии 200 г 6,1%-ного раствора силиката натрия с избытком раствора нитрата кальция.
19. Определите массу осадка, который образуется при взаимодействии 50 г 5,8%-ного раствора хлорида магния с избытком раствора фосфата натрия.
20. Определите объём газа, который выделится при взаимодействии 200 г 6,9%-ного раствора карбоната калия с избытком раствора соляной кислоты.
21. Оксид фосфора (V) массой 21,3 г растворили в растворе гидроксида калия, в результате чего был получен раствор средней соли массой 500 г. Определите концентрацию фосфата калия в конечном растворе.
22. Раствор хлорида железа (II) полностью прореагировал со 120 г раствора гидроксида натрия, в результате чего образовалось 6,0 г осадка. Определите массовую долю гидроксида натрия в исходном растворе.
23. Какой объём аммиака (н. у.) может полностью прореагировать со 150 г 20%-ного раствора серной кислоты с образованием средней соли?
24. В 200 г 20%-ного раствора соляной кислоты растворили магний до прекращения выделения газа. Определите объём выделившегося при этом водорода (н. у.).
25. Аммиак объёмом 10 л (н. у.) пропустили через раствор серной кислоты с массовой долей 8% до образования средней соли. Определите массу исходного раствора.
26. Определите объём сероводорода (н. у.), который необходимо пропустить через 130 г 6%-ного раствора хлорида меди (II) до полного осаждения сульфида меди (II).
27. Сероводород объёмом 3,36 л (н. у.) пропустили через раствор гидроксида натрия, в результате чего получили 180 г раствора сульфида натрия. Определите массовую долю соли в полученном растворе.
28. Алюминий массой 8,1 г может нацело прореагировать с 250 г раствора серной кислоты. Определите массовую долю серной кислоты в исходном растворе.
29. К 250 г раствора нитрата серебра добавили раствор хлорида калия до прекращения выделения осадка, масса которого составила 14,35 г. Определите массовую долю нитрата серебра в исходном растворе.
30. К 300 г 5%-ного раствора хлорида магния добавили избыток раствора фосфата калия. Вычислите массу выпавшего при этом осадка.
Расчет массы соли в химическом уравнении
В условиях задач такого типа указаны массы или объёмы двух реагирующих веществ, одно из которых дано в избытке, поэтому при решении таких задач нужно определить, какое вещество взято в избытке. Расчёт массы или объёма продукта реакции ведётся по данным вещества взятого в недостатке.
I. Алгоритм решения задачи: “Вычисление массы или количества продукта реакции, если один из реагентов взят в избытке”
Пример 1. Смешали два раствора, содержащих соответственно 33,3г хлорида кальция и 16,4г фосфата натрия. Вычислите массу осадка.
Последовательность выполнения действий
Оформление решения задачи
1. Записываем условие задачи
2. Вычислим молярные массы для формул, записанных вдано
3. Вычислим количества веществ, масса которых дана в условии
4. Запишем УХР. Расставим коэффициенты.
Под формулами напишем стехиометрические соотношения, отображаемые уравнением реакции.
5. Определим, какой из реагентов взят в избытке. Для этого сравним дроби.
CaCl2 – взят в избытке, расчёт ведём по недостатку, т.е. поNa3PO4.
6. Вычислим количество вещества, массу которого нужно найт
7.Вычислим искомую массу
8. Запишем ответ
Пример 2. Вычислите объём водорода (н.у.), который образуется при взаимодействии 6,5 г цинка с соляной кислотой массой 7,5 г.
Последовательность выполнения действий
Оформление решения задачи
1. Записываем условие задачи
2. Вычислим молярные массы для веществ с известной массой, записанных в дано
3. Вычислим количества веществ, масса которых дана в условии
ν(Zn) = m/M= 6,5/65г/моль=0,1моль
4. Запишем УХР. Расставим коэффициенты.
Под формулами напишем стехиометрические соотношения, отображаемые уравнением реакции.
5. Определим, какой из реагентов взят в избытке. Для этого сравним дроби.
НCl – взят в избытке, расчёт ведём по недостатку, т.е. по Zn.
6. Вычислим количество вещества, объём которого нужно найти
7.Вычислим искомый объём
8. Запишем ответ
II. Алгоритм решения задач на “Избыток – недостаток” (в общем виде)
Расчёты по уравнению реакции, если один из реагентов взят в избытке
Дано: m (ν, V, W) реагентов
Найти: m (ν, V, W) продукта
1. Составляем уравнение реакции
2. Нахождение количества вещества реагентов ν(А) и ν(В):
3. Сравнение дробей – нахождение недостатка:
Если, ν(А)/a > ν(В)/b, то вещество В в недостатке, расчёт ν(С) ведём по ν(В)
© 2017 Персональный сайт учителя химии Кардаевой Татьяны Александровны. Все права защищены.
Hекоторые файлы и информация, находящиеся на данном сайте, были взяты из методической литературы, найдены в сети Интернет, как свободно распространяемые (авторство данных материалов сохранено). Если Вы являетесь правообладателем той или иной продукции или информации, и условия, на которых она представлена на данном ресурсе, не соответствуют действительности, просьба сообщить об этом с целью устранения правонарушения.
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH – | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | – | – | Н | Н | Н | |
| F – | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | – | Н | Р | Р |
| Cl – | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br – | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I – | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | – | – | – | Н | – | – | Н | – | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS – | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | – | Н | ? | Н | Н | ? | М | М | – | Н | ? | ? |
| HSO3 – | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | – | Н | Р | Р |
| HSO4 – | Р | Р | Р | Р | Р | Р | Р | Р | – | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 – | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | – | Р |
| NO2 – | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | – | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO – | Р | Р | Р | Р | Р | Р | Р | Р | Р | – | Р | Р | – | Р | Р | Р | Р | Р | Р | Р | – | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые (
Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса ” ” на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса ” ” содержит ошибку, нажмите на кнопку “Отправить”. Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки – помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация – такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. [spoiler title=”источники:”] http://kardaeva.ru/89-dlya-uchenika/9-klass/144-vychislenie-massy-ili-kolichestva-produkta-reaktsii http://acetyl.ru/f/help36.php [/spoiler] |
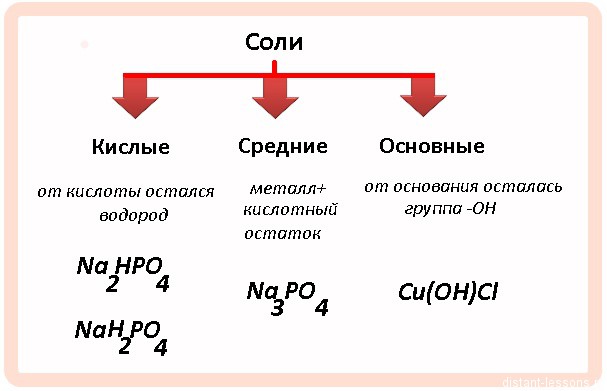
Кислые и средние соли
09-Дек-2014 | комментария 4 | Лолита Окольнова
Задания на соли встречаются в ЕГЭ не только в части А, но и в части С.
Давайте разберем основные примеры задач на
кислые и средние соли
1. Определите, какое вещество, и в каком количестве образуется, если прореагировали (н.у.):
а) 0,2 моль Н2S и 0,2 моль КОН;
б) 2,24 л SO2 и 4 г NaOH;
в) 4,48 л СО2 и 7,4 г Са(ОН)2;
г) 4,48 л аммиака и 19,6 г серной кислоты;
д) 0,3 моль гидроксида натрия и 0,3 моль фосфорной кислоты;
е) 4,48 л аммиака и 100 г 9,8 %-ного раствора фосфорной кислоты;
ж) 14,2 г Р2О5 и 0,4 моль КОН;
з) 5,6 г оксида кальция и 0,2 моль серной кислоты.
Итак, как образуются кислые и средние соли?
Обычно это взаимодействие основного оксида или основания с кислотой или кислотным оксидом.
Какая соль образуется — зависит от соотношения реагентов
LiOH + H2SO3 = LiHSO3 + H2O (образовалась кислая соль)
(1 моль щелочи : 1 моль кислоты)
2LiOH + H2SO4 = Li2SO4 + 2H2O (образовалась средняя соль)
(2 моль щелочи : 1 моль кислоты)
Вывод:
- если в избытке основание, то образуется средняя соль;
- при эквимолярном соотношении — кислая соль
Обратите внимание — сравнивать нужно именно количества веществ — моли!
В нашем задании:
а) соотношение сероводорода и гидроксида калия 1:1, значит, получится кислая соль KHS;
б) 0,1 моль SO2 и 0,1 моль NaOH (формулы: n=mMr и т=VV м). Соль — NaHSO3
в) 0,2 моль CO2 и 0,1 моль Ca(OH)2:
CO2 + Ca(OH)2 = CaCO3 + H2O
Т.к. реагируют двухвалентный кальций и кислотный остаток имеет заряд -2, то образуется карбонат кальция — средняя соль
г) 0,2 моль NH3 и 0.2 моль H2SO4. Соотношение 1:1, значит, получится соль — NH4HSO4 — гидросульфат аммония;
д) NaOH и H3PO4. Соотношение 1:1. Получится NaH2PO4 — дигидрофосфат натрия — кислая соль;
e) 0.2 моль NH3 и 0.1 моль (см. формулу массовой доли ω). Аммиак в избытке, значит, получится средняя соль — (NH4)2SO4
ж) 0.1 моль P2O5 и 0,4 моль КОН
3KOH + H3PO4 = K3PO4 + 3H2O
Гидроксид калия дан в значительном избытке, значит, получится фософат калия — средняя соль
з) 0.1 моль CaO и 0.2 моль H2SO4
CaO + 2H2SO4 = Ca(НSO4)2 + H2O
2. Определить количества растворенных веществ в растворе, полученном пропусканием через 200 г 4 %-ного раствора гидроксида натрия при н.у.:
а) 1,12 л углекислого газа;
б) 2,24 л сернистого газа;
в) 3,36 л сероводорода;
г) 4,48 л углекислого газа;
д) 20 г SO3.
n(NaOH)=m(раствора)*ω Mr = 200 г*0.04 40 гмоль = 0.2 моль
Выпишем все уравнения:
CO2 + 2NaOH = Na2CO3 + H2O
0,05 0.2 —> 0,05 моль
SO2 + 2NaOH = Na2SO3 + H2O
0.1 0.2 —> 0.1 моль
H2S + NaOH = NHS + H2O
0,15 0.2 моль —> 0,15 моль
CO2 + NaOH = NaHCO3
0.2 0.2 —> 0.2 моль
SO3 + NaOH = NaHSO4
0.25 0.2 —> 0.2 моль
Количества вещества продукта реакции находим традиционно по недостатку.
Обсуждение: “Кислые и средние соли”
(Правила комментирования)
