Как определить тип оксида?
В заданиях ЕГЭ есть такие вопросы, где требуется определить тип оксида. Прежде всего, следует запомнить четыре типа оксидов:
1) несолеобразующие
2) основные
3) кислотные
4) амфотерные
Основные, кислотные и амфотерные оксиды часто также объединяют в группу солеобразующих оксидов.
Не вдаваясь в теоретические подробности, изложу пошаговый алгоритм определения типа оксида.
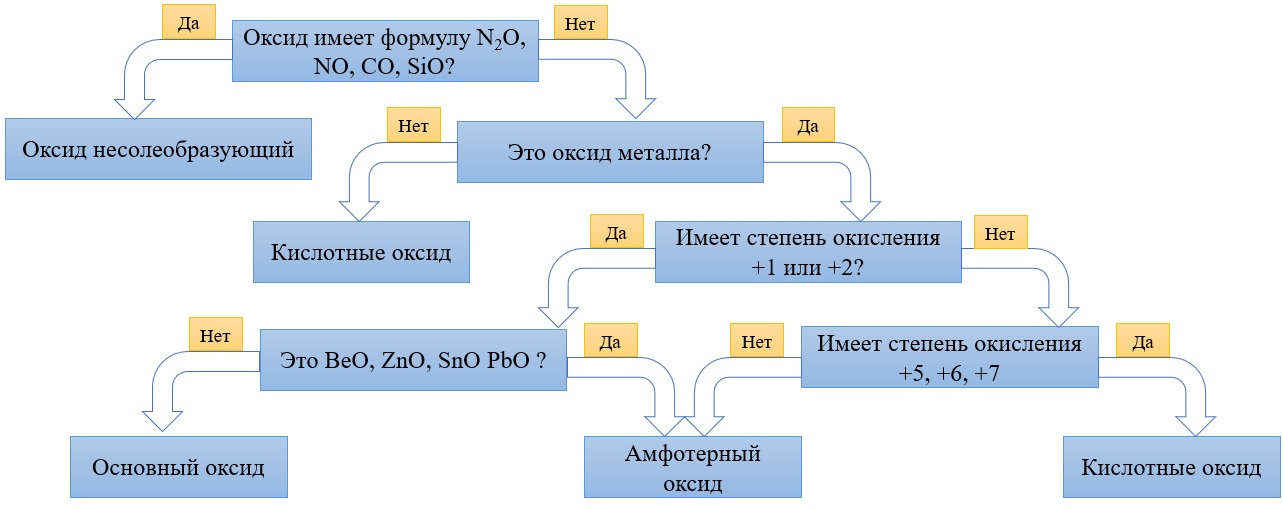
Первое — определите: оксид металла перед вами или оксид неметалла.
Второе — установив, какой оксид металла или неметалла перед вами, определите степень окисления элемента в нем и воспользуйтесь таблицей ниже. Естественно, правила отнесения оксидов в этой таблице нужно выучить. Поначалу можно решать задания, подглядывая в нее, но ваша цель ее запомнить, так как на экзамене никаких источников информации, кроме таблицы Д.И. Менделеева, таблицы растворимости и ряда активности металлов, у вас не будет.
|
Оксид неметалла |
Оксид металла |
|
1) Степень окисления неметалла +1 или +2 Вывод: оксид несолеобразующий Исключение: Cl2O не относится к несолеобразующим оксидам |
1) Степень окисления металла равна +1, +2 Вывод: оксид металла основный Исключение: BeO, ZnO, SnO и PbO не относятся к основным оксидам!! |
|
2) Степень окисления больше либо равна +3 Вывод: оксид кислотный Исключение: Cl2O относится к кислотным оксидам, несмотря на степень окисления хлора +1 |
2) Степень окисления металла +3, +4, Вывод: оксид амфотерный. Исключение: BeO, ZnO, SnO и PbO амфотерны, несмотря на степень окисления +2 у металлов |
|
3) Степень окисления металла +5,+6,+7 Вывод: оксид кислотный. |
Примеры:
Задание: определите тип оксида MgO.
Решение: MgO является оксидом металла, при этом степень окисления металла в нем +2. Все оксиды металлов в степени окисления +1 и +2 основны, кроме оксида бериллия или цинка.
Ответ: MgO – основный оксид.
Задание: определите тип оксида Mn2O7
Решение: Mn2O7 – оксид металла, и степень окисления металла в этом оксиде равна +7. Оксиды металлов в высоких степенях окисления (+5,+6,+7) относятся к кислотным.
Ответ: Mn2O7 – кислотный оксид
Задание: определите тип оксида Cr2O3.
Решение: Cr2O3 – оксид металла, и степень окисления металла в этом оксиде равна +3. Оксиды металлов в степенях окисления +3 и +4 относятся к амфотерным.
Ответ: Cr2O3 – амфотерный оксид.
Задание: определите тип оксида N2O.
Решение: N2O – оксид неметалла, и степень окисления неметалла в этом оксиде равна +1. Оксиды неметаллов в степенях окисления +1 и +2 относятся к несолеобразующим.
Ответ: N2O – несолеобразующий оксид.
Задание: определите тип оксида BeO.
Решение: оксид бериллия, а также оксид цинка являются исключениями. Несмотря на степень окисления металлов в них, равную +2, они амфотерны.
Ответ: BeO – амфотерный оксид.
С химическими свойствами оксидов можно ознакомиться здесь
Как узнать какой оксид? солеобразующий, или нет, если да, то какой Амфотерный, Основной или Кислотный?
Мастер
(1528),
закрыт
11 лет назад
Anna
Мыслитель
(7372)
11 лет назад
Солеобразу́ющие окси́ды (ангидри́ды) — оксиды неметаллов и металлов, при взаимодействии с водой образующие соответствующие кислоты, при взаимодействии с основаниями — соответствующие нормальные и кислые соли.
Солеобразующие оксиды, в свою очередь, делятся на:
осно́вные оксиды, элемент которых при образовании соли становится катионом; например, Na2O, CuO, K2O, СаО;
кислотные оксиды, элемент которого при образовании соли входит в состав кислородсодержащего аниона; например, SO3, NO2;
амфотерные оксиды, которые могут реагировать и как кислотные, и как основные оксиды; например, ZnO, Al2О3.
Несолеобразующие оксиды — оксиды, не проявляющие ни кислотных, ни основных, ни амфотерных свойств и не образующие соли. По сравнению с другими видами, количество несолеобразующих оксидов невелико, их как правило образуют одно – и двухвалентные неметаллы. Типичными представителями таких оксидов являются гемиоксид азота (закись азота) N2O, монооксид азота NO, монооксид углерода СО, монооксид кремния SiO.
NStrictМастер (1528)
11 лет назад
Спасибо, но все-же интересует, как, имея произвольный оксид его классифицировать. (по данной классификации), или это нужно зубрить, и признаков по которым происходит данная классификация не существует?
Солеобразу́ющие окси́ды — оксиды, которые при химических реакциях с кислотами и основаниями образуют соль и воду[1][2].
Солеобразующие оксиды делятся на:
- осно́вные оксиды, элемент которых при образовании соли становится катионом;
- кислотные оксиды, элемент которого при образовании соли входит в состав кислородсодержащего аниона;
- амфотерные оксиды, которые могут реагировать и как кислотные, и как основные оксиды.
См. также[править | править код]
- Оксиды
- Несолеобразующие оксиды
Примечания[править | править код]
- ↑ О.В. Мешкова. Химия. — Москва: Эксмо, 2017. — С. 189. — 368 с. — ISBN 978-5-699-95854-2.
- ↑ В.А. Вихрева и др. Химия неорганическая. — Пенза: РИО ПГСХА, 2013. — С. 13. — 71 с.
Ссылки[править | править код]
- [www.xumuk.ru/encyklopedia/2/3047.html Оксиды в Химической энциклопедии]
|
|
Некоторые внешние ссылки в этой статье ведут на сайты, занесённые в спам-лист. Эти сайты могут нарушать авторские права, быть признаны неавторитетными источниками или по другим причинам быть запрещены в Википедии. Редакторам следует заменить такие ссылки ссылками на соответствующие правилам сайты или библиографическими ссылками на печатные источники либо удалить их (возможно, вместе с подтверждаемым ими содержимым). Список проблемных ссылок
|

Классификация оксидов
Материал по химии
Все сложные неорганические вещества можно разделить на следующие группы:
Классификация оксидов
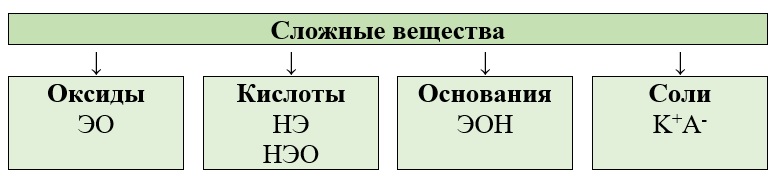
Классификация веществ
Рассмотрим эти классы по отдельности, начиная с оксидов.
Оксиды – это соединения кислорода в степени окисления «‒2» с другими элементами. Но не все соединения кислорода с элементами будут являться оксидами, степень окисления кислорода очень важна!
Таб. «Соединения кислорода»

* Так как фтор принимает только отрицательную степень окисления (так как может выступать только в качестве окислителя), кислород во фториде кислорода может быть только положительным. Положительные ионы записываются первыми в формуле, поэтому правильнее писать OF2.
** Hадпероксид калия состоит из ионов K+ и O2-1.
Зачем нужно знать классификацию оксидов?
Рассмотрим несколько уравнений:
- K2O + H2O = 2KOH
- CaO + H2O = Ca(OH)2
- FeO + H2O ≠
- CuO + H2O ≠
Почему какие-то оксиды реагируют с водой, а другие – нет? Нужно знать классификацию оксидов на растворимые и нерастворимые.
- CaO + N2O3 = Ca(NO3)2
- CaO + Cs2O ≠
Как определить, какие оксиды реагируют друг с другом, а какие нет? Для ответа на этот вопрос нужно знать, какие оксиды относятся к кислотным, а какие к основным, амфотерным или несолеобразующим.
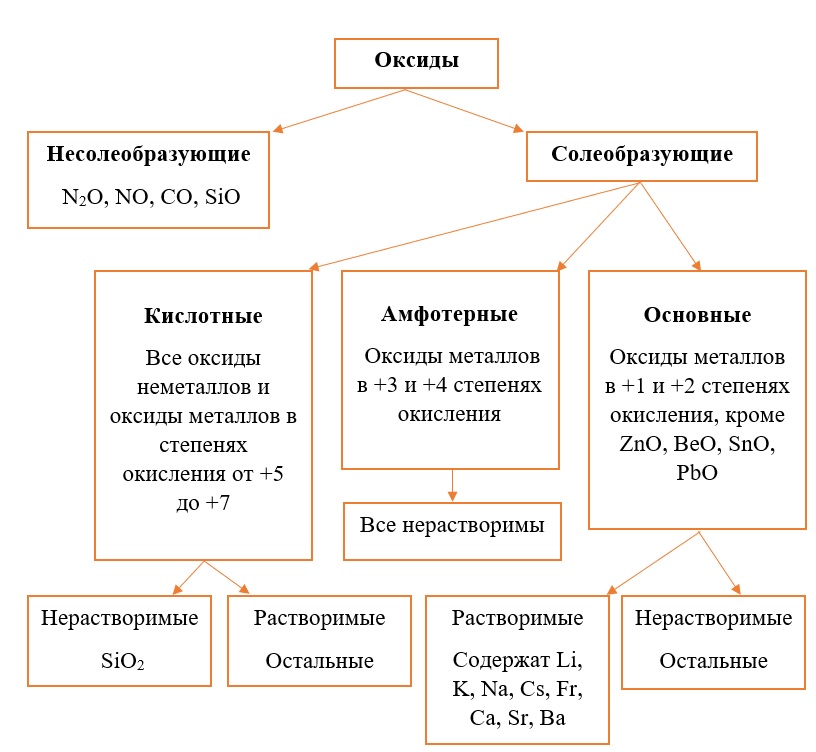
Классификация оксидов на солеобразующие и несолеобразующие
Существует две группы оксидов – те, что при взаимодействии с кислотами/основаниями или друг с другом образуют соли и те, что не вступают в типичные реакции оксидов и не способны образовывать соли (несолеобразующие), их свойства рассматриваются отдельно.
Самыми распространёнными несолеобразующими оксидами являются: N2O, NO, CO, SiO, остальные оксиды считаем солеобразующими (с типичными свойствами).
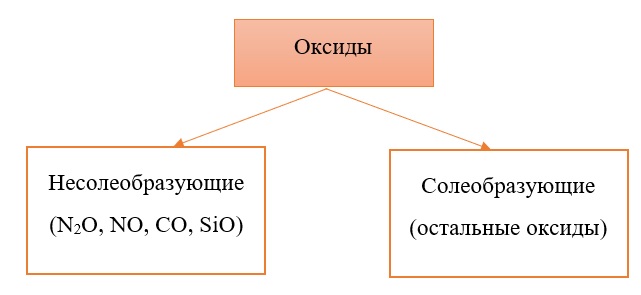
Классификация солеобразующих оксидов
Все солеобразующие оксиды делятся на основные, кислотные и амфотерные.
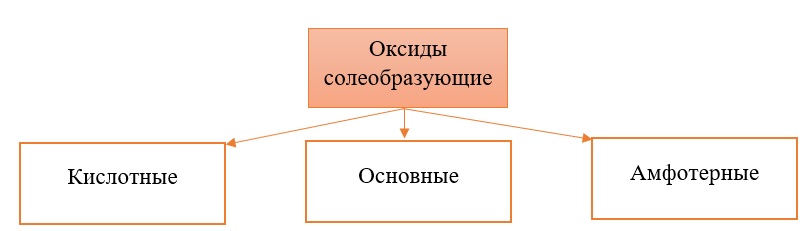
Кислотные оксиды соответствуют определенным кислотам, они легко взаимодействуют со своими противоположностями – основными веществами.
Основные оксиды соответствуют определенным основаниям, они легко взаимодействуют со своими противоположностями – кислотными веществами.
Амфотерные оксиды, соответствуют определённым гидроксидам, имеют двойственную природу: с кислотными веществами реагируют как основные соединения, а с основными – как кислотные соединения.
Таб. «Некоторые оксиды и соответствующие им гидроксиды»
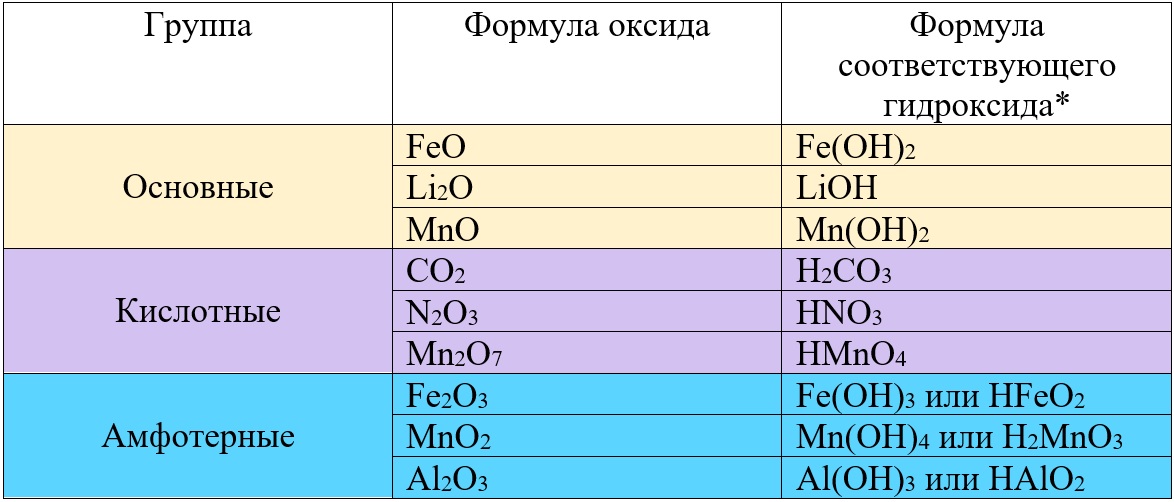
* Гидроксид – соединение элемента с гидроксо-группой (OH‒).
Проанализировав таблицу, Вы заметите, что разные оксиды железа могут быть основными или амфотерными, а разные оксиды марганца оказались во всех трех группах. Что бы лучше понимать, от чего зависит принадлежность к тому или иному виду оксидов, необходимо глубже разобраться в классификации этих веществ.
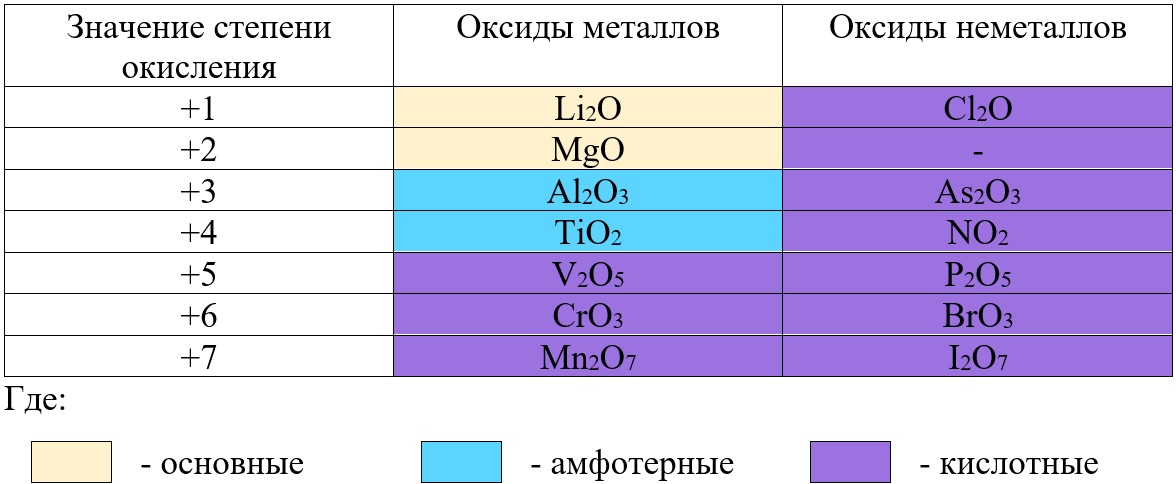
Классификация оксидов неметаллов.
Все солеобразующие оксиды неметаллов относятся к кислотным. Большая часть из них являются растворимыми:
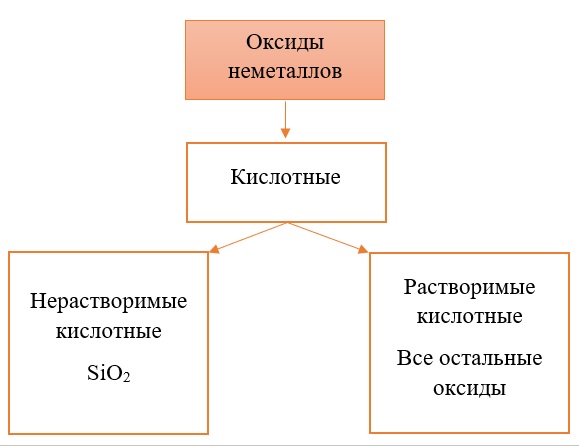
Классификация оксидов металлов.
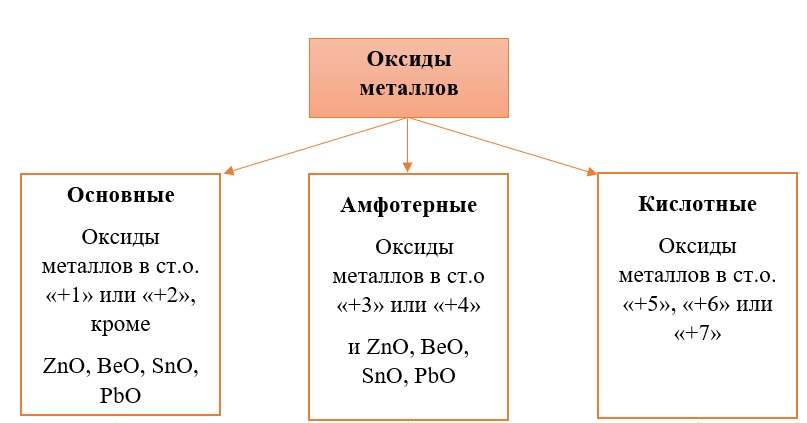
В отличие от предыдущей группы, в этой не так всё однозначно. Среди оксидов металлов встречаются как основные, так и амфотерные, и даже кислотные. А принадлежность к определённой группе зависит он степени окисления металла, который входит в состав оксида.
Основные оксиды – это оксиды, в которых металл имеет степень окисления «+1» или «+2» (для элементов с большим диапазоном возможных степеней окисления это будут низшие степени окисления). Есть исключения, например, BeO, ZnO хоть и имеют в своём составе металлы в степени окисления «+2», проявляют амфотерные свойства. Список таких оксидов гораздо шире (SnO, PbO, CuO), но в ЕГЭ остальные примеры исключений игнорируются.
Амфотерные оксиды содержат металлы в степени окисления «+3» и «+4» (промежуточные значения степеней окисления для веществ с большим диапазоном возможных степеней окисления), и два примера оксидов с металлами в ст. о. «+2», написанных выше (BeO, ZnO).
Кислотные оксиды содержат металлы в степени окисления «+5», «+6» и «+7» (для элементов с большим диапазоном возможных степеней окисления это будут высшие степени окисления).
Все кислотные оксиды металлов растворяются в воде и реагируют с ней. Все амфотерные оксиды не растворяются в воде и не реагируют с ней. Среди основных оксидов большинство нерастворимы и только оксиды, образованные кальцием, стронцием, барием, а также всеми металлами IА-подгруппы являются растворимыми.
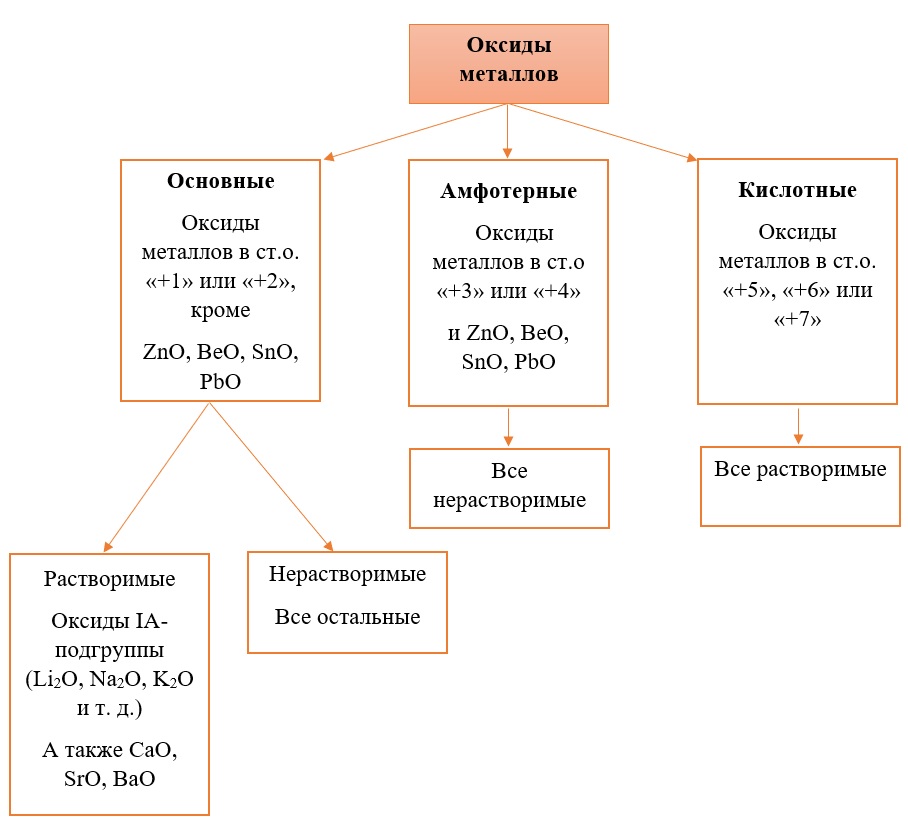
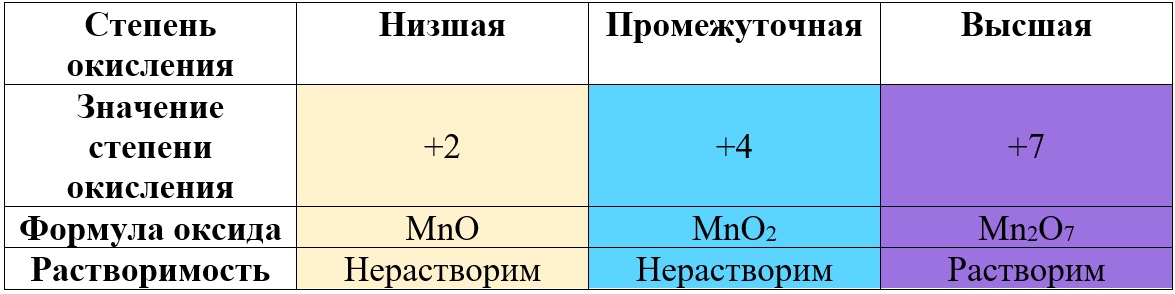
Таким образом металлы, имеющие большой диапазон возможных степеней окисления, могут образовывать совершенно разные по характеру оксиды, например оксиды марганца и хрома:
Таб. «Зависимость характера оксида от степени окисления марганца» (рассмотрены только наиболее распространённые степени)
Таб. «Зависимость характера оксида от степени окисления хрома» (рассмотрены только наиболее степени)
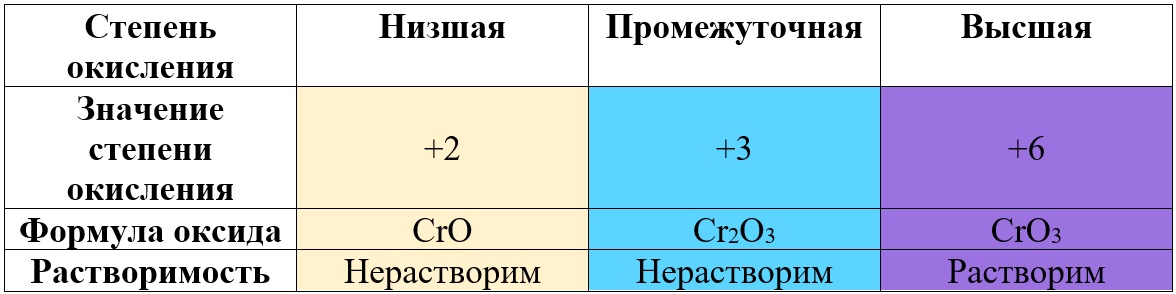
Не следует путать оксиды металлов и неметаллов: у оксидов металлов степень окисления определяет характер оксида, а у оксида неметалла – нет.
Таб. «Зависимость характера оксида от степени окисления элемента»
Обобщим всю классификацию оксидов одной схемой:
Алгоритм для определения характера оксида:
Простая таблица для определения принадлежности к группе оксидов:

