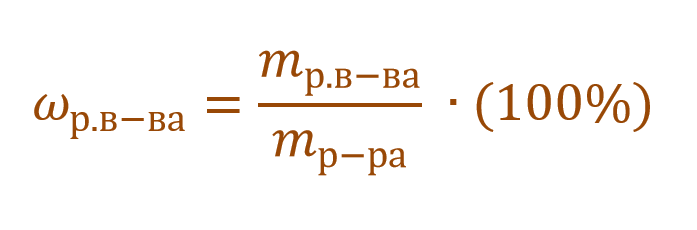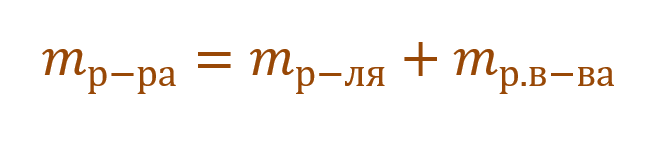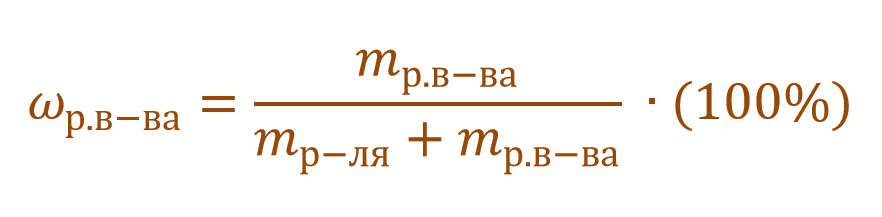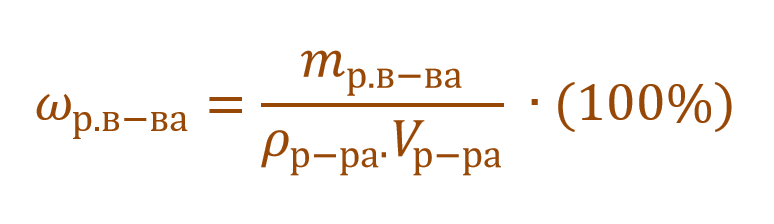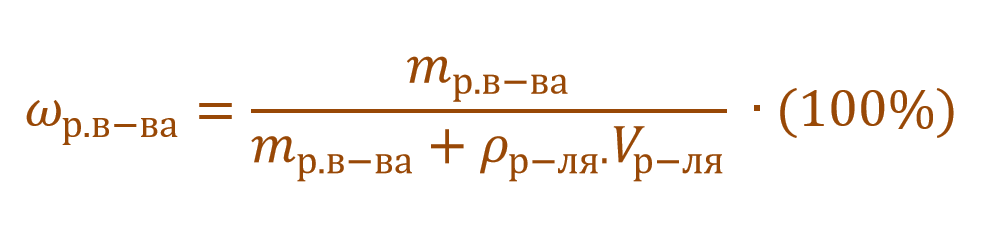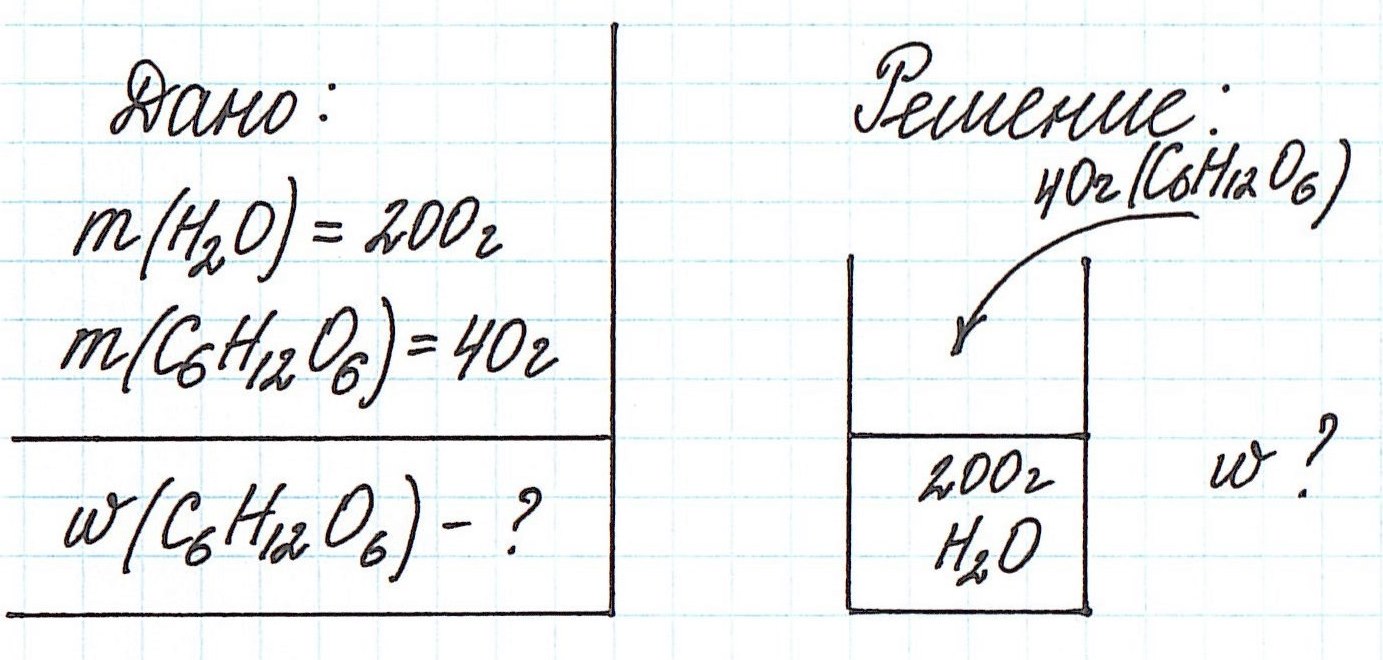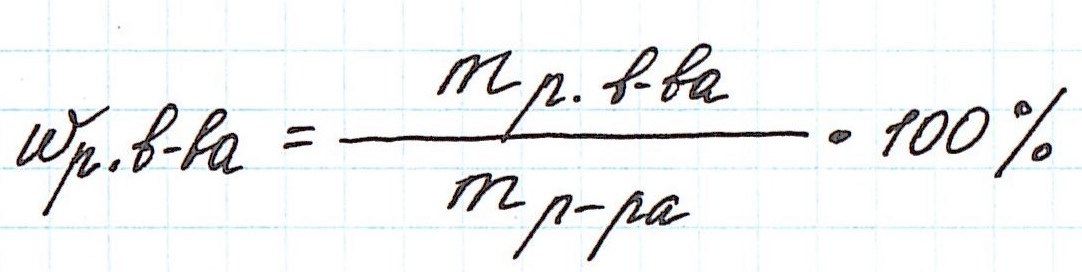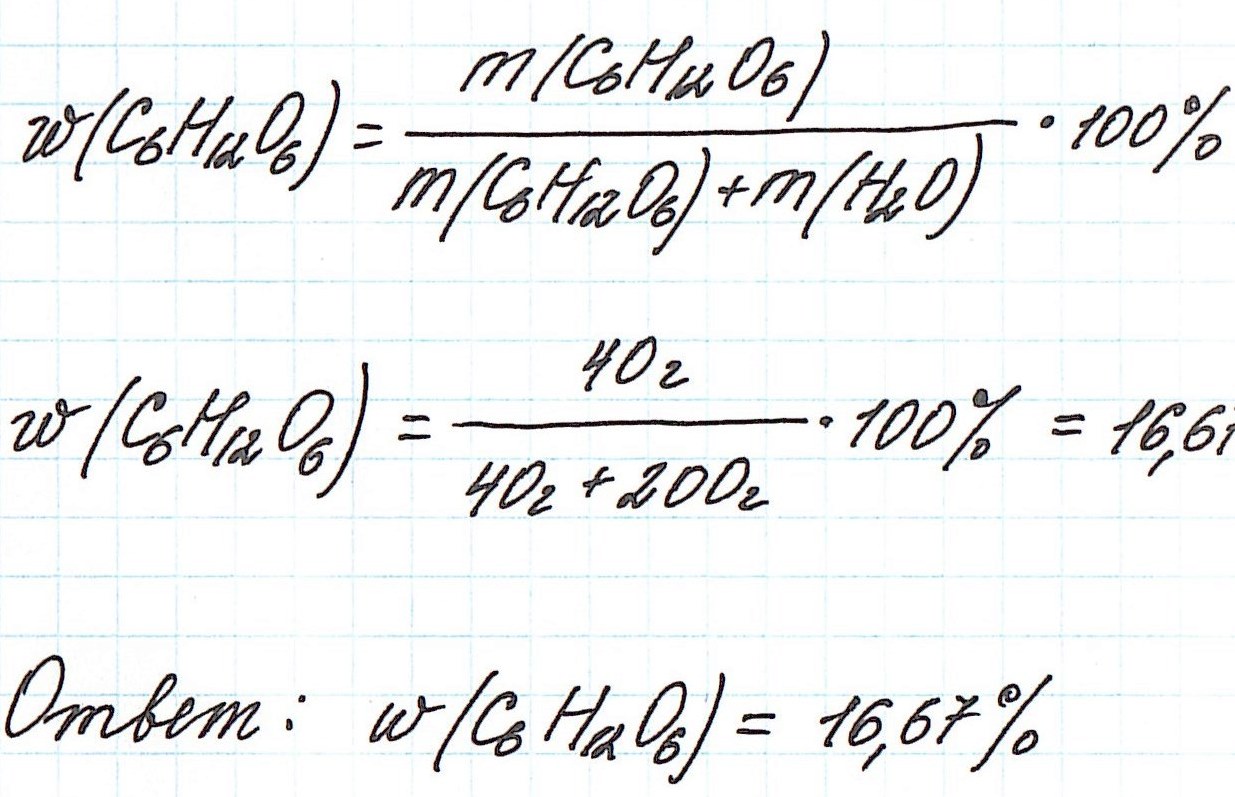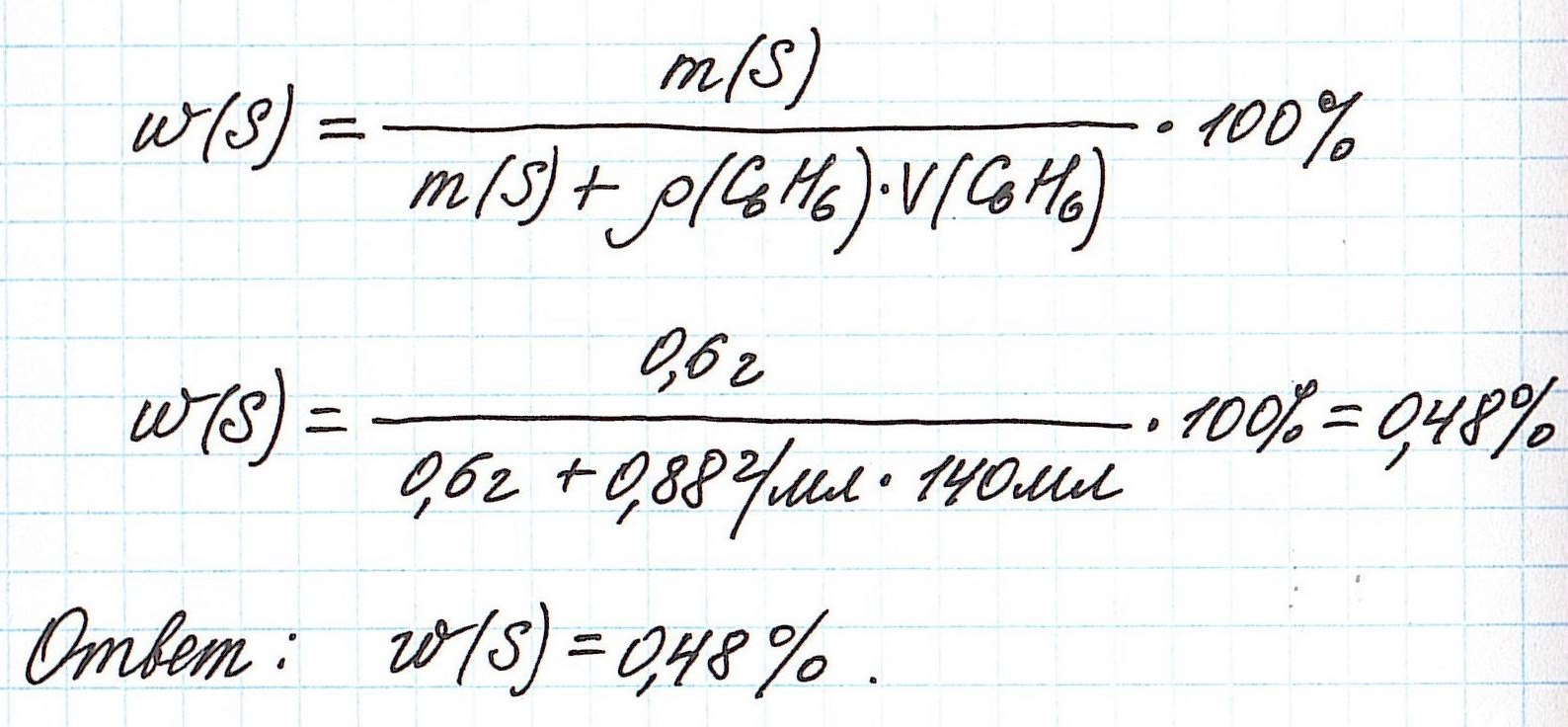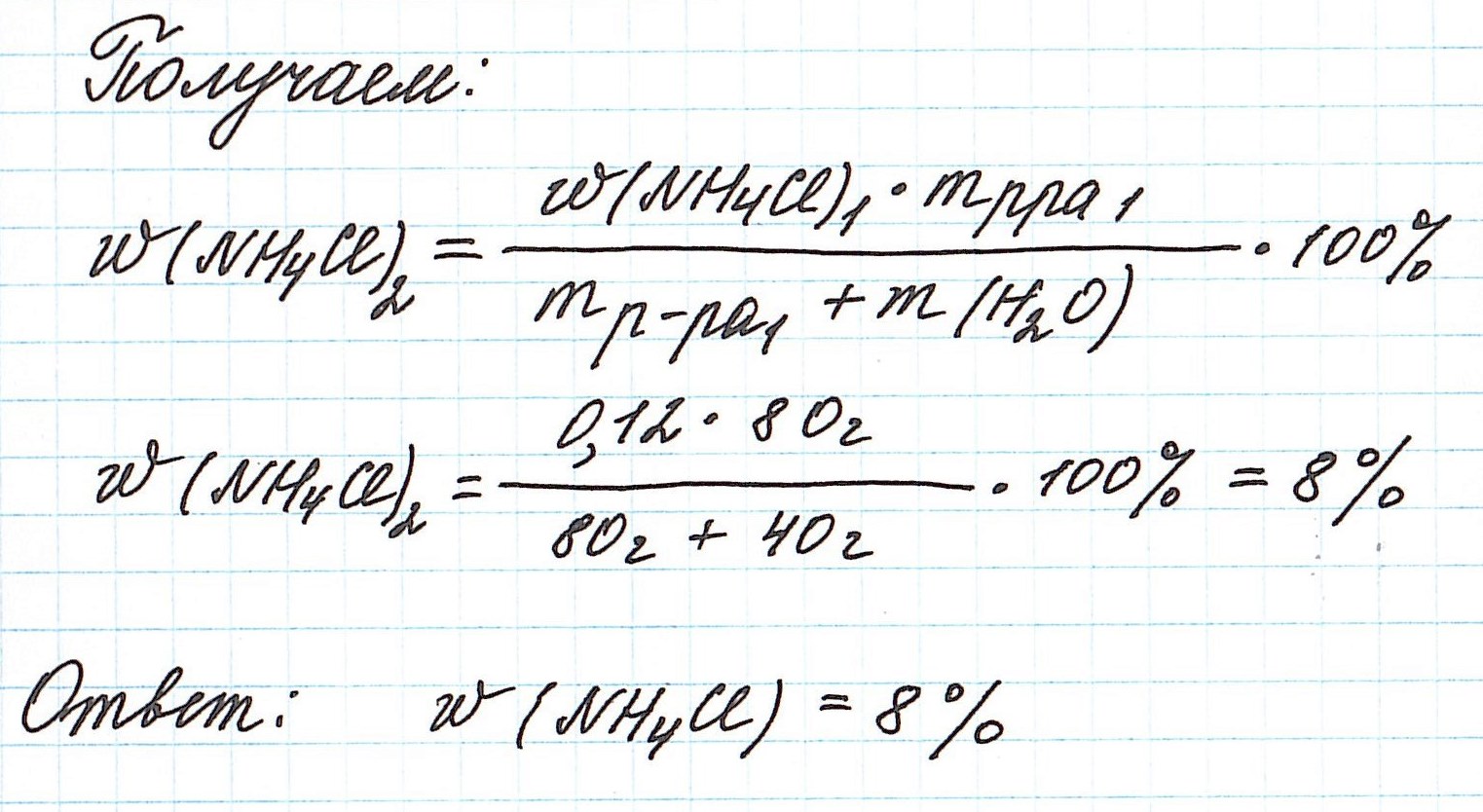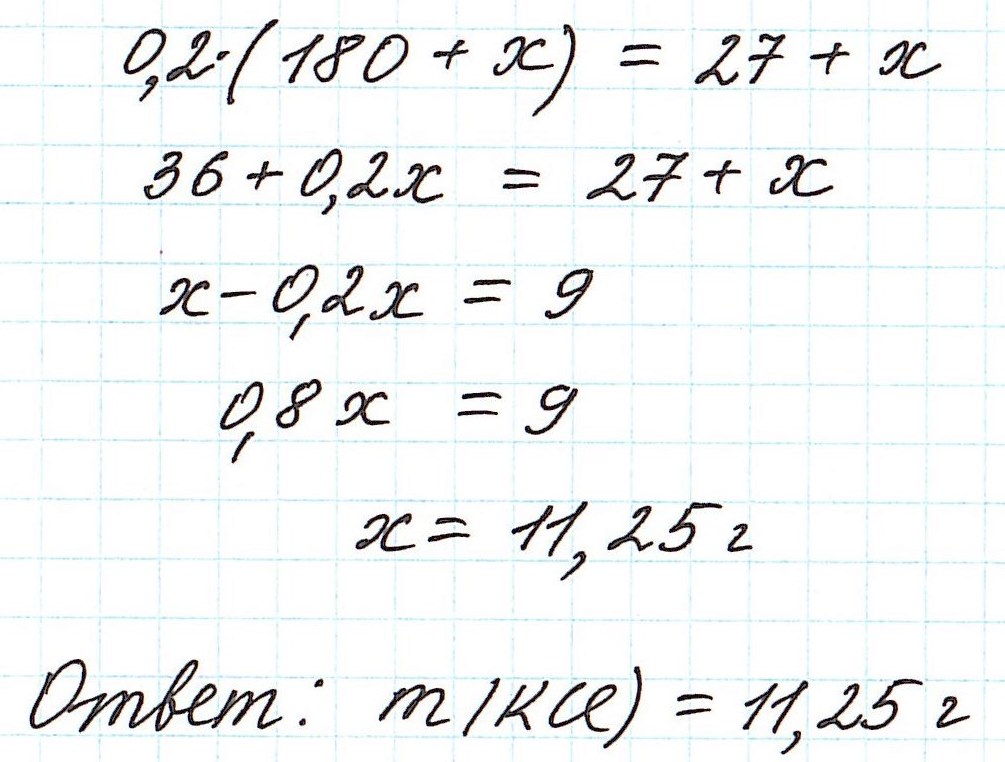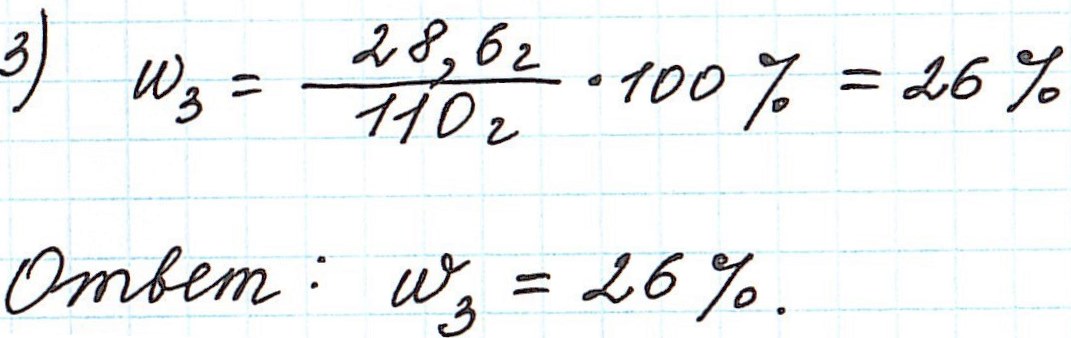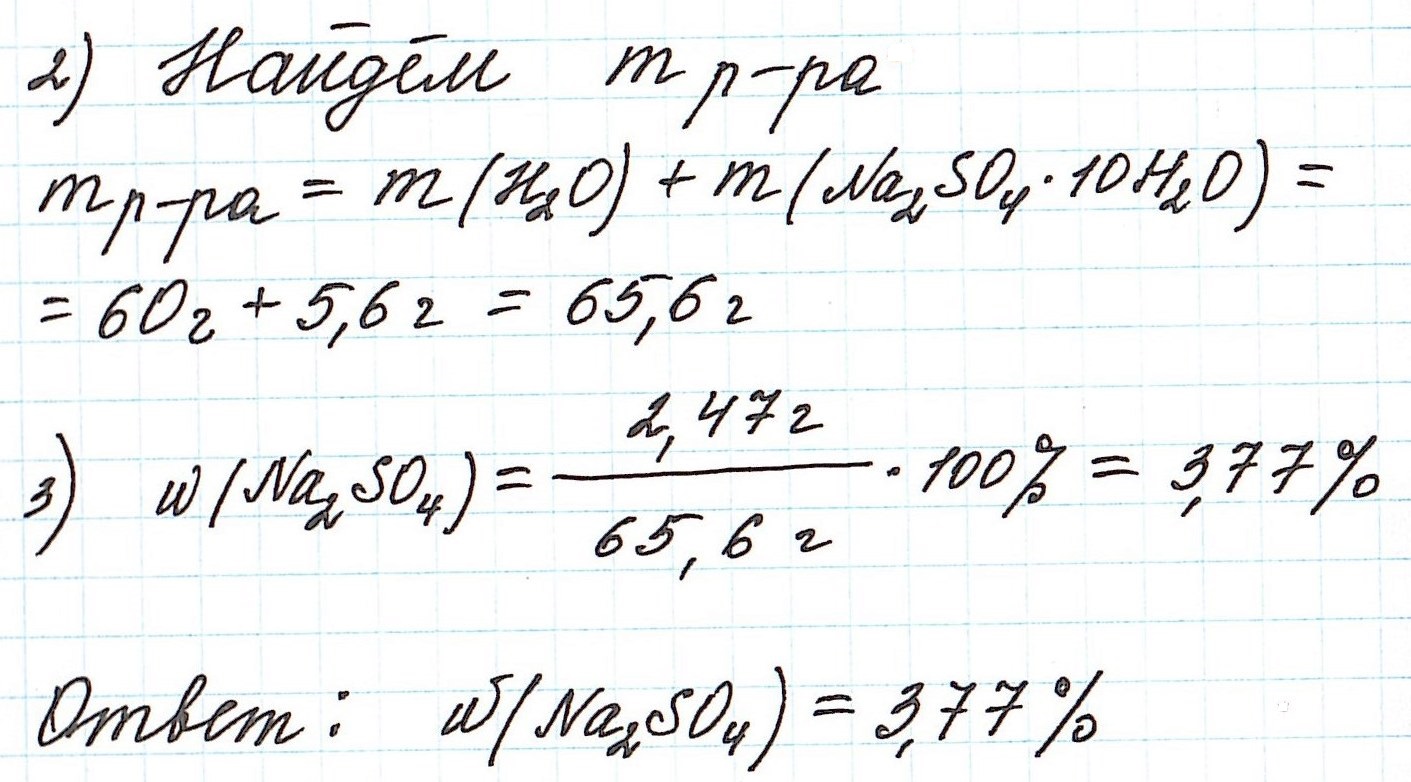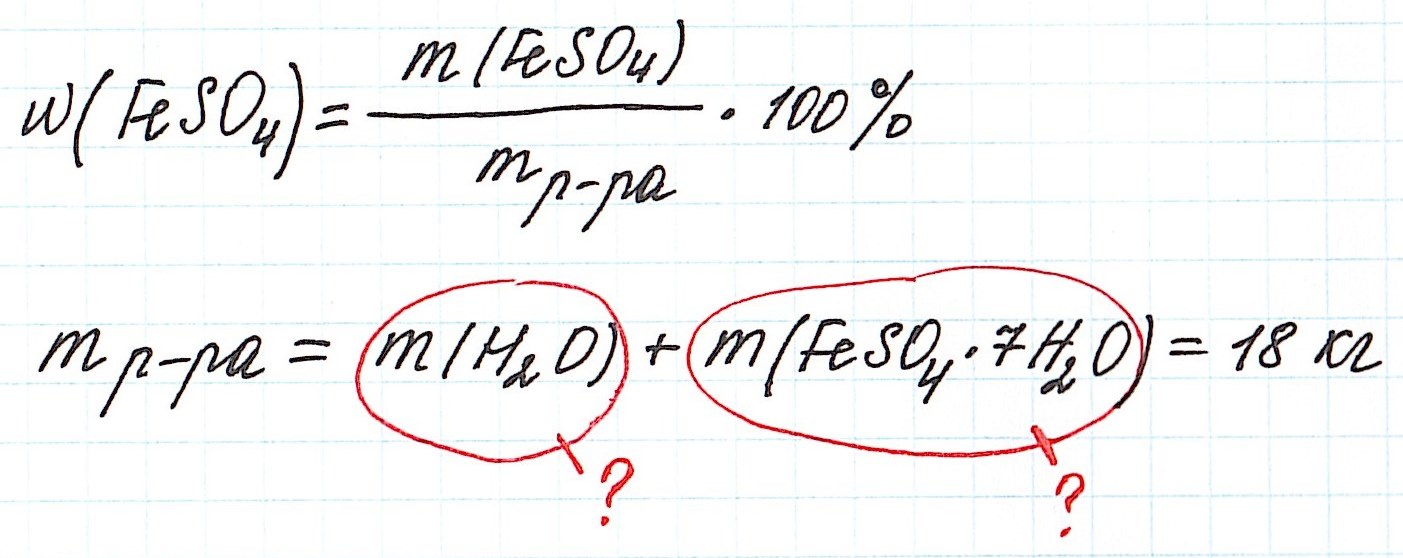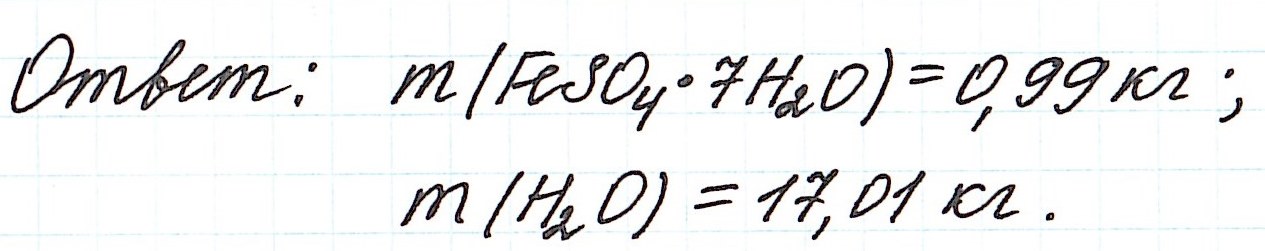Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Растворы. Способы выражения концентрации растворов
Способы выражения концентрации растворов
Существуют различные способы выражения концентрации растворов.
Массовая доля ω компонента раствора определяется как отношение массы данного компонента Х, содержащегося в данной массе раствора к массе всего раствора m. Массовая доля – безразмерная величина, её выражают в долях от единицы:
ωр.в. = mр.в./mр-ра (0 < ωр.в. < 1) (1)
Массовый процент представляет собой массовую долю, умноженную на 100:
ω(Х) = m(Х)/m · 100% (0% < ω(Х) < 100%) (2)
где ω(X) – массовая доля компонента раствора X; m(X) – масса компонента раствора X; m – общая масса раствора.
Мольная доля χ компонента раствора равна отношению количества вещества данного компонента X к суммарному количеству вещества всех компонентов в растворе.
Для бинарного раствора, состоящего из растворённого вещества Х и растворителя (например, Н2О), мольная доля растворённого вещества равна:
χ(X) = n(X)/(n(X) + n(H2O)) (3)
Мольный процент представляет мольную долю, умноженную на 100:
χ(X), % = (χ(X)·100)% (4)
Объёмная доля φ компонента раствора определяется как отношение объёма данного компонента Х к общему объёму раствора V. Объёмная доля – безразмерная величина, её выражают в долях от единицы:
φ(Х) = V(Х)/V (0 < φ(Х) < 1) (5)
Объёмный процент представляет собой объёмную долю, умноженную на 100.
φ(X), % = (φ(X)·100)%
Молярность (молярная концентрация) C или Cм определяется как отношение количества растворённого вещества X, моль к объёму раствора V, л:
Cм(Х) = n(Х)/V (6)
Основной единицей молярности является моль/л или М. Пример записи молярной концентрации: Cм(H2SO4) = 0,8 моль/л или 0,8М.
Нормальность Сн определяется как отношение количества эквивалентов растворённого вещества X к объёму раствора V:
Cн(Х) = nэкв.(Х)/V (7)
Основной единицей нормальности является моль-экв/л. Пример записи нормальной концентрации: Сн(H2SO4) = 0,8 моль-экв/л или 0,8н.
Титр Т показывает, сколько граммов растворённого вещества X содержится в 1 мл или в 1 см3 раствора:
T(Х) = m(Х)/V (8)
где m(X) – масса растворённого вещества X, V – объём раствора в мл.
Моляльность раствора μ показывает количество растворённого вещества X в 1 кг растворителя:
μ(Х) = n(Х)/mр-ля (9)
где n(X) – число моль растворённого вещества X, mр-ля – масса растворителя в кг.
Мольное (массовое и объёмное) отношение – это отношение количеств (масс и объёмов соответственно) компонентов в растворе.
Необходимо иметь ввиду, что нормальность Сн всегда больше или равна молярности См. Связь между ними описывается выражением:
См = Сн · f(Х) (10)
Для получения навыков пересчёта молярности в нормальность и наоборот рассмотрим табл. 1. В этой таблице приведены значения молярности См, которые необходимо пересчитать в нормальность Сн и величины нормальности Сн, которые следует пересчитать в молярность См.
Пересчёт осуществляем по уравнению (10). При этом нормальность раствора находим по уравнению:
Сн = См/f(Х) (11)
Результаты расчётов приведены в табл. 2.
Таблица 1. К определению молярности и нормальности растворов
| Тип химического превращения | См | Сн | Сн | См |
| Реакции обмена | 0,2 M Na2SO4 | ? | 6 н FeCl3 | ? |
| 1,5 M Fe2(SO4)3 | ? | 0,1 н Ва(ОН)2 | ? | |
| Реакции окисления-восстановления | 0,05 М KMnO4
в кислой среде |
? | 0,03 М KMnO4
в нейтральной среде |
? |
Таблица 2
Значения молярности и нормальности растворов
| Тип химического превращения | См | Сн | Сн | См |
| Реакции обмена | 0,2M Ma2SO4 | 0,4н | 6н FeCl3 | 2М |
| 1,5M Fe2(SO4)3 | 9н | 0,1н Ва(ОН)2 | 0,05М | |
| Реакции окисления-восстановления | 0,05М KMnO4 в кислой среде | 0,25н | 0,03М KMnO4
в нейтральной среде |
0,01М |
Между объёмами V и нормальностями Сн реагирующих веществ существует соотношение:
V1 Сн,1 =V2 Сн,2 (12)
Примеры решения задач
Задача 1. Рассчитайте молярность, нормальность, моляльность, титр, мольную долю и мольное отношение для 40 мас.% раствора серной кислоты, если плотность этого раствора равна 1,303 г/см3.
Решение.
Масса 1 литра раствора равна М = 1000·1,303 = 1303,0 г.
Масса серной кислоты в этом растворе: m = 1303·0,4 = 521,2 г.
Молярность раствора См = 521,2/98 = 5,32 М.
Нормальность раствора Сн = 5,32/(1/2) = 10,64 н.
Титр раствора Т = 521,2/1000 = 0,5212 г/см3.
Моляльность μ = 5,32/(1,303 – 0,5212) = 6,8 моль/кг воды.
Обратите внимание на то, что в концентрированных растворах моляльность (μ) всегда больше молярности (См). В разбавленных растворах наоборот.
Масса воды в растворе: m = 1303,0 – 521,2 = 781,8 г.
Количество вещества воды: n = 781,8/18 = 43,43 моль.
Мольная доля серной кислоты: χ = 5,32/(5,32+43,43) = 0,109. Мольная доля воды равна 1– 0,109 = 0,891.
Мольное отношение равно 5,32/43,43 = 0,1225.
Задача 2. Определите объём 70 мас.% раствора серной кислоты (r = 1,611 г/см3), который потребуется для приготовления 2 л 0,1 н раствора этой кислоты.
Решение.
2 л 0,1н раствора серной кислоты содержат 0,2 моль-экв, т.е. 0,1 моль или 9,8 г.
Масса 70%-го раствора кислоты m = 9,8/0,7 = 14 г.
Объём раствора кислоты V = 14/1,611 = 8,69 мл.
Задача 3. В 5 л воды растворили 100 л аммиака (н.у.). Рассчитать массовую долю и молярную концентрацию NH3 в полученном растворе, если его плотность равна 0,992 г/см3.
Решение.
Масса 100 л аммиака (н.у.) m = 17·100/22,4 = 75,9 г.
Масса раствора m = 5000 + 75,9 = 5075,9 г.
Массовая доля NH3 равна 75,9/5075,9 = 0,0149 или 1,49 %.
Количество вещества NH3 равно 100/22,4 = 4,46 моль.
Объём раствора V = 5,0759/0,992 = 5,12 л.
Молярность раствора См = 4,46/5,1168 = 0,872 моль/л.
Задача 4. Сколько мл 0,1М раствора ортофосфорной кислоты потребуется для нейтрализации 10 мл 0,3М раствора гидроксида бария?
Решение.
Переводим молярность в нормальность:
0,1 М Н3РО4 0,3 н; 0,3 М Ва(ОН)2 0,6 н.
Используя выражение (12), получаем: V(H3P04)=10·0,6/0,3 = 20 мл.
Задача 5. Какой объем, мл 2 и 14 мас.% растворов NaCl потребуется для приготовления 150 мл 6,2 мас.% раствора хлорида натрия?
Плотности растворов NaCl:
| С, мас.% | 2 | 6 | 7 | 14 |
| ρ, г/см3 | 2,012 | 1,041 | 1,049 | 1,101 |
Решение.
Методом интерполяции рассчитываем плотность 6,2 мас.% раствора NaCl:
6,2% =6% + 0,2(7% —6% )/(7 – 6) = 1,0410 + 0,0016 = 1,0426 г/см3.
Определяем массу раствора: m = 150·1,0426 = 156,39 г.
Находим массу NaCl в этом растворе: m = 156,39·0,062 = 9,70 г.
Для расчёта объёмов 2 мас.% раствора (V1) и 14 мас.% раствора (V2) составляем два уравнения с двумя неизвестными (баланс по массе раствора и по массе хлорида натрия):
156,39 = V1 1,012 + V2 1,101 ,
9,70 = V1·1,012·0,02 + V2·1,101·0,14 .
Решение системы этих двух уравнений дает V1 =100,45 мл и V2 = 49,71 мл.
Задачи для самостоятельного решения
3.1. Рассчитайте нормальность 2 М раствора сульфата железа (III), взаимодействующего со щёлочью в водном растворе.
12 н.
3.2. Определите молярность 0,2 н раствора сульфата магния, взаимодействующего с ортофосфатом натрия в водном растворе.
0,1 M.
3.3. Рассчитайте нормальность 0,02 М раствора KMnO4, взаимодействующего с восстановителем в нейтральной среде.
0,06 н.
3.4. Определите молярность 0,1 н раствора KMnO4, взаимодействующего с восстановителем в кислой среде.
0,02 M.
3.5. Рассчитать нормальность 0,2 М раствора K2Cr2O7, взаимодействующего с восстановителем в кислой среде.
1,2 M.
3.6. 15 г CuSO4·5H2O растворили в 200 г 6 мас.% раствора CuSO4. Чему равна массовая доля сульфата меди, а также молярность, моляльность и титр полученного раствора, если его плотность составляет 1,107 г/мл?
0,1; 0,695М; 0,698 моль/кг; 0,111 г/мл.
3.7. При выпаривании 400 мл 12 мас.% раствора KNO3 (плотность раствора 1,076 г/мл) получили 2М раствор нитрата калия. Определить объём полученного раствора, его нормальную концентрацию и титр.
255 мл; 2 н; 0,203 г/мл.
3.8. В 3 л воды растворили 67,2 л хлороводорода, измеренного при нормальных условиях. Плотность полученного раствора равна 1,016 г/мл. Вычислить массовую, мольную долю растворённого вещества и мольное отношение растворённого вещества и воды в приготовленном растворе.
0,035; 0,0177; 1:55,6.
3.9. Сколько граммов NaCl надо добавить к 250 г 6 мас.% раствору NaCl, чтобы приготовить 500 мл раствора хлорида натрия, содержащего 16 мас.% NaCl? Плотность полученного раствора составляет 1,116 г/мл. Определить молярную концентрацию и титр полученного раствора.
74,28 г; 3,05 М; 0,179 г/мл.
3.10. Определить массу воды, в которой следует растворить 26 г ВaCl2·2H2O для получения 0,55М раствора ВaCl2 (плотность раствора 1,092 г/мл). Вычислить титр и моляльность полученного раствора.
192,4 г; 0,111 г/мл; 0,56 моль/кг.
Способы выражения концентрации растворов.
Молярная концентрация См– отношение количества вещества в молях
(n) к объему раствора в
литрах:
Если вещество обозначить через Xто:
Нормальная концентрация или молярная
концентрация эквивалента Сн
– отношение количества эквивалентов
вещества к объему раствора
Молярная и нормальная концентрации
связаны между собой: См
= Сн∙f
или Сн = См
/f
Титр (Т) – часто используется на
практике. Титр раствора –это масса
вещества в граммах в 1 мл раствора (г/мл).
Если Т(HNO3) = 0,006354
г/мл, то это значит, что в 1 мл раствора
содержится 0,006354 г азотной кислоты.
Титр раствора по определяемому
веществу– это масса вещества в г,
взаимодействующая с 1 мл титранта.
Например, ТHCl/NaOHсоставляет 0,003954 г/мл, это означает, что
1 мл раствораHCl(титранта)
реагирует с 0,003954 гNaOH(определяемого вещества).
Массовая доля вещества (ω)––
отношение массы растворенного вещества
(mв-ва) к массе
раствора(mр-ра).
Массовая доля – величина безразмерная,
ее представляют либо в долях, либо в
процентах. Например, для 5%-го раствора
хлорида кальция, широко применяемого
в медицине, ω%(CaCl2)
=5% или в долях ω=0,05. И это означает, что
в 100 г раствора содержится 5 г хлорида
кальция.
ω
где ρ – плотность раствора.
Моляльная концентрация Cm– отношение количества молей растворенного
вещества к 1000 г растворителя, т.е. число
молей растворенного в-ва в 1000 г
растворителя.
Формулы для перерасчета концентраций.
(плотность (ρ) раствора дана в г/мл)
|
ω,% |
См, |
Сн, |
Т, г/мл |
|
|
ω,% |
|
|
|
|
|
См, |
|
|
|
|
|
Сн, |
|
|
|
|
|
Т, г/мл |
|
|
|
|
Приготовление рабочих растворов
Растворы
титр, которых известен, называются
титрованными. Титрованный раствор можно
приготовить, если точную навеску
растворить в мерной колбе. Например,
навеску 0,2750 г Nа2SО4поместим в колбу на 200 мл и доведем объем
дистиллированной водой до метки, то
титр приготовленного раствора точно,
конечно, известен:
Т= 0,2750/200 =0,0013750 г/мл
Вещества,
из которых готовят растворы с известным
титром, называются исходными (стандартными
веществами). Исходные вещества должны
удовлетворять следующим требованиям:
а) они
должны быть химически чистыми (примеси
не более 0,05-0,1 %);
б) состав
должен строго соответствовать химической
формуле;
в)
устойчивы при хранении в растворе и в
твердом состоянии;
г)
величина эквивалента должна быть
наибольшей.
Раствор,
приготовленный таким образом, называется
стандартными раствором с приготовленным
титром. Способ приготовления титрованных
растворов зависит от свойств вещества
и агрегатного состояния
1. Из
веществ кристаллических х.ч. готовят
по точной навеске.
Например:
приготовить 250 мл 0,1н раствораNa2CO3,
М(Na2CO3)
= 106 г/моль. Эквивалентная масса Э(Na2CO3)
= 53 г/моль,
Необходимо:
а)
рассчитать навеску, необходимую для
приготовления раствора:
m
= CH∙
M(1/z Na2CO3)∙V(л)
= 0,1∙53∙0,25 = 1,325 (г)
б)
отвесить навеску на аналитических
весах,
в)
навеску количественно перенести в
мерную колбу на 250 мл, растворить в
небольшом количестве дистиллированной
воды и долить ею до метки, тщательно
перемешивая.
2.
Приготовление из фиксанала.Готовят
раствор, сразу разбивая фиксанал в
мерную колбу нужного объема, и вымывают
из фиксанала все кристаллы дистиллированной
водой и доводят раствор до метки.
3. Из
кристаллических веществ, загрязненных,
гигроскопичных, летучих и т.д.
Необходимо
для приготовления;
а)
рассчитать навеску,
б)
отвесить ее на технических весах,
перенести в любую склянку на 250 мл,
растворить в дистиллированной воде и
долить до метки,
в)
установить точную концентрацию
приготовленного раствора по исходному
веществу (титрованному раствору).
Растворы, титр которых находят не по
точной навеске, а путем титрования
титрованным раствором, называют растворы
с установленным титром.
Примеры:
1.
Приготовить400мл 0,05 н раствора буры
из кристаллической.
Решение:
Определить
массу навески буры, она равна:
m=
Э(Nа2В4О7∙10Н2О)∙Сн∙V(л)=190,71∙0,05∙0,4=3,81
г.
Отвешиваем
на аналитических весах навеску, переносим
в мерную колбу, тщательно растворяем и
доводим до метки 400 мл.
2.Приготовить
100 мл0,15 н раствора из 3н раствора её.
Вопросы
к задаче: а) в каких объемах реагируют
растворы с одинаковой концентрацией?
б) какая зависимость между объемами
реагирующих веществ и нормальными
концентрациями?
Данную
задачу можно решить по формуле: Сн1∙V1= Сн2∙V2;
Сн1
и Сн2 – концентрации растворов
моль/л;V1иV2
– объемы исходного и конечного
раствора в мл,
V1= Сн2∙V2/ Сн1= 0,15 100 / 3 = 5 мл
Значит,
для приготовления 100 мл 0,15 н раствора
нужно взять 5 мл 3н раствора и довести
до метки 100 мл дистиллированной водой.
3.Приготовить
100г 14% раствора,хлорида натрия из 22%-
го и 10%-го растворов этой соли.
Весовое
соотношение исходных растворов находим
по правилу смешения (правило креста):
1
8 весовых частей
1
2
4 весовые части
Из
большего числа вычитаем меньшее: 22-14= 8
в.ч. 10%-го
14-10 = 4
в.ч. 22%-го
Получим
12 г 14% -го раствора
Дальше
рассуждаем:
на 12 г
14%-го раствора нужно 8 г 10%-ного
на 100 г
Х

на 12 г
14%-го раствора нужно 4 г 22%-ного
н
100 г Х
Х = 33,3 г
Измеряем ареометром плотность исходных
растворов. Разделив массы растворов на
плотность, получим объемы исходных
растворов, необходимых для приготовления
нужного раствора. Отмериваем их и
переливаем в склянку для использования
в работе.
Определить
титр раствора хлорида натрия, если
известно, что на титрование его 10 мл
расходовалось 9,2 мл 0,1 н раствора нитрата
серебра. Титр можно определить:
по
закону эквивалентов: (Cн∙V)NaCl= (Cн∙V)AgNO3
Cн
(NaCl) = (9,2∙0,1)/10 = 0,092 моль/л,
Т = (58,5∙0,092)/1000 = 0,005382 г/мл
58,5 –
это эквивалентная масса хлорида натрия.
ФИКСИРОВАНИЕ ТОЧКИ ЭКВИВАЛЕНТНОСТИ
Установление состояния эквивалентности
является очень важным моментом в
проведении анализа. Несоответствие
момента прекращения титрования (точки
эквивалентности) приводит к возникновению
индикаторных ошибок титрования, к
неправильным ответам, что чревато
последствиями. В принципе, индикаторная
ошибка неизбежна при любом определении,
но при правильном определении точки
конца реакции столь мала, что ею можно
пренебречь. Точку эквивалентности можно
определить химическими методами
(применение индикаторов) и физико-химическими
методами (потенциометрическими,
кондуктометрическими, фотоколометрическими).
В
некоторых случаях изменения в системе
титрования столь заметны, что не требуется
каких то заметных особых приемов для
обнаружения конца реакции. Проблема
выбора способа фиксирования точки
эквивалентности всегда решается
применительно к конкретной практике
(методике исследования). Чаще всего
используют индикаторы. Полученные
результаты должны быть достоверны, т.е.
должны быть подвергнуты статистической
обработке. Методику статобработки см.
в данном методическом руководстве.
Метод нейтрализации
и его применение в медико-санитарной
практике
Медико биологическое значение.
Метод кислотно-основного титрования
позволяет определять количественно в
исследуемых объектах кислые и основные
продукты.
Так, в санитарно-гигиенической практике
этим методом определяют кислотность и
щелочность многих пищевых продуктов,
питьевых и сточных вод.
В клинической практике кислотно-основное
титрование используют для определения
кислотности желудочного сока, буферной
емкости крови, спинно-мозговой жидкости,
мочи и других биологических жидкостей.
Этот метод широко используется в
фармацевтической химии при анализе
лекарственных веществ, установления
доброкачественных продуктов питания
(например,молока).
Большое значение имеет рассматриваемый
метод и при санитарно гигиенической
оценке объектов окружающей среды.
Промышленные стоки могут содержать или
кислые, или щелочные продукты. Закисление
или защелачивание природных водоемов
и почвы приводит порой к необратимым
последствиям, в связи с чем контроль
кислотно-основного баланса весьма
важен.
МЕТОД НЕЙТРАЛИЗАЦИИ
Краткое описание метода нейтрализации
сводится к следующим моментам:
а)
Реакция
В основе метода лежит реакция взаимодействия
H++ OH– →
H2O.
б)
Определяемые
вещества:
кислоты:
сильные и слабые
основания:
сильные и слабые: соли, подвергающиеся
гидролизу.
в)
Титранты:
Сильные
кислоты (соляная, серная) с концентрацией
от 0,01 до 1,0 моль/л используются для
определения концентрации оснований и
солей, гидролизующихся по аниону.
Сильные
основания: (NaOH, KOH) с концентрацией от
0,01 до 1,0 моль/л
используются
для определения концентрации кислот и
солей, гидролизующихся по катиону.
Чаще всего
титранты для метода нейтрализации
готовят из фиксаналов. Иногда растворы
сильных кислот готовят разбавлением
концентрированного раствора кислоты,
а растворы сильных оснований, растворением
навески твердой щелочи. Последние
способы приготовления растворов, требуют
экспериментального уточнения концентрации
приготовленного титранта с использованием
установочных (исходных) веществ.
Для
титрантов кислот, в качестве установочных
веществ, используют соду Na2CO3
или буру Na2B4O7•10H2O.
Для
титрантов щелочей — щавелевую кислоту
(H2C2O4•2H2O).
г)
Индикаторы
Реакция
между кислотами и основаниями не
сопровождается, как правило, какими-либо
внешними эффектами, поэтому для
фиксирования точки эквивалентности
приходится использовать специальные
вещества-индикаторы. Кислотно-основные
индикаторы это, слабые кислоты или
основания, степень ионизации которых
определяется концентрацией [H+]
ионов в растворе.
H+Ind
↔
H++Ind–
Чем больше
концентрация H+
ионов, тем меньше будет степень ионизации
индикатора. Молекулярная HInd и ионная
HInd формы индикатора имеют разные окраски.
Таким образом, концентрация ионов H+
влияет
на соотношение концентраций HInd и Ind что,
в свою очередь, определяет характер или
яркость окраски.
Для
характеристики кислотности растворов
в химии широко пользуются водородным
показателем, pH — отрицательный десятичный
логарифм молярной концентрации [H+].
В кислых
растворах pH<7, в щелочных pH>7, в
нейтральных
Все
индикаторы изменяют свою окраску не
скачкообразно, а плавно, т.е. в определенном
интервале значений pH, называемом
интервалом перехода.
Поскольку
индикаторы как кислоты или основания
отличаются друг от друга по силе, они
имеют разные интервалы перехода (см.
табл.1).
Таблица
1
|
N п/п |
Анализ вещество |
pH в точке эквивалент-ности |
Скачок титрования |
Используемые индикаторы |
Интервал перехода окраски индикатора |
|
1. |
Сильная Сильное или наоборот |
7.0 |
3-11 |
Метилоранж Метилрот Фенолфталеин |
3.1-4.4 4.2-6.3 8.3-10.0 |
|
2. |
Слабая Сильное основание |
8-10 |
6-11 |
Фенолфталеин |
8.3-10.0 |
|
3. |
Слабое Сильная кислота |
4-6 |
3-7 |
Метилоранж Метилрот |
3.1-4.4 4.2-6.3 |
Соседние файлы в предмете Химия
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Формула концентрации раствора. Их множество. И каждая соответствует тому или иному способу выражения концентрации. А в химии их применяются достаточно: массовая доля растворенного вещества, молярная, нормальная, моляльная, титр и др.
Зачем так много? Ответ на этот вопрос очень прост. Каждый вид концентрации удобен в том или ином случае, когда применение другого вида концентрации неуместно.
Например, при исследовании содержания массы вещества в очень небольшом объеме раствора удобно пользоваться титром. А в каких-то технологиях вообще концентрация заменяется другими количественными характеристиками раствора. Так, в технологии посола рыбы для расчета необходимой концентрации тузлука (раствора поваренной соли) используют не его процентную концентрацию, а плотность.
Содержание:
1. Концентрация – что это такое
2. Формула концентрации раствора: основные виды
3. Массовая доля растворенного вещества и примеры ее вычисления
- разбавление раствора водой
- концентрирование раствора путем упаривания
- концентрирование раствора путем добавления растворенного вещества
- смешивание двух растворов
- применение кристаллогидратов для приготовления раствора (задачи на кристаллогидраты)
4. Правило «креста» в химии растворов как метод решения задач на процентную концентрацию растворов
Концентрация – что это такое
Любой раствор имеет различные характеристики: качественные и количественные. Одной из важнейших количественных характеристик является концентрация раствора.
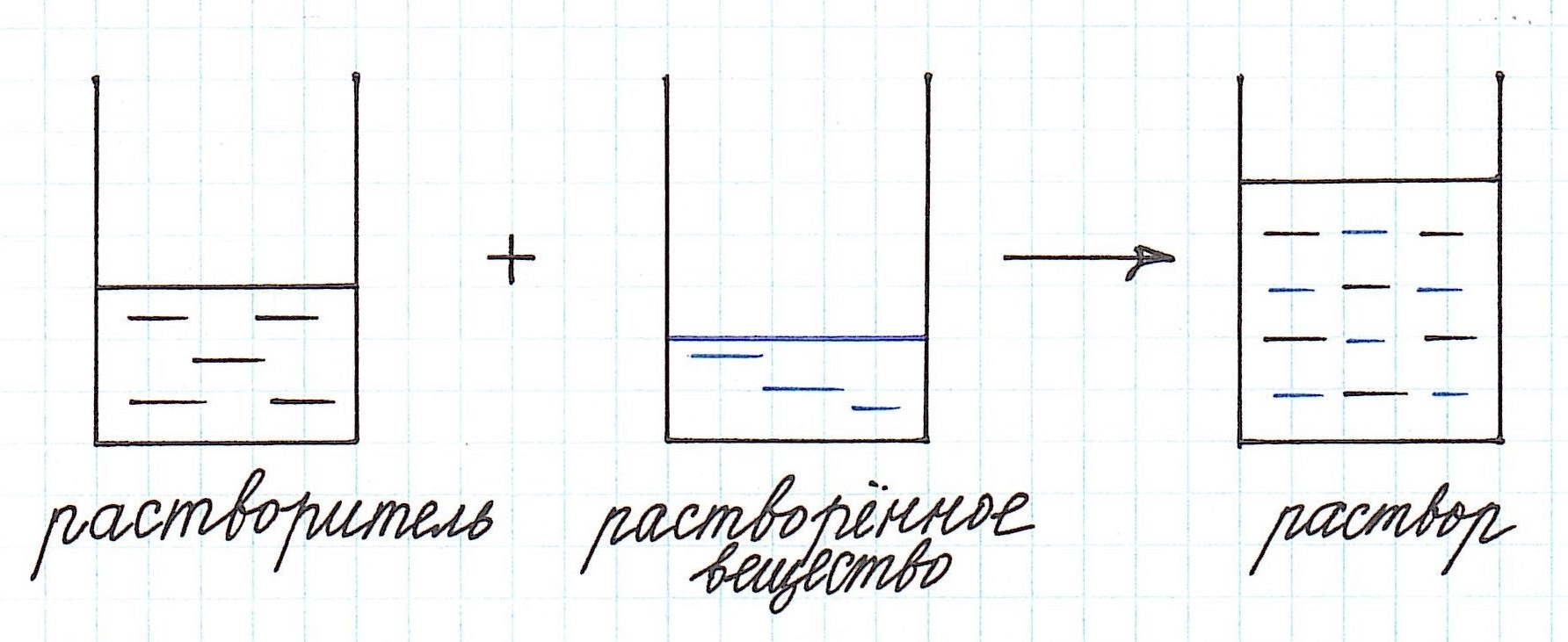
Концентрация раствора – это количество растворенного вещества, содержащееся в определенном количестве раствора.
Как видно из приведенного определения, основными компонентами раствора являются:
— растворитель;
— растворенное вещество.
Растворенного вещества в растворе всегда меньше, а растворителя больше.
И вот именно с вычислением количественного содержания растворенного вещества чаще всего и связаны все расчеты, основанные на применении формулы концентрации раствора.
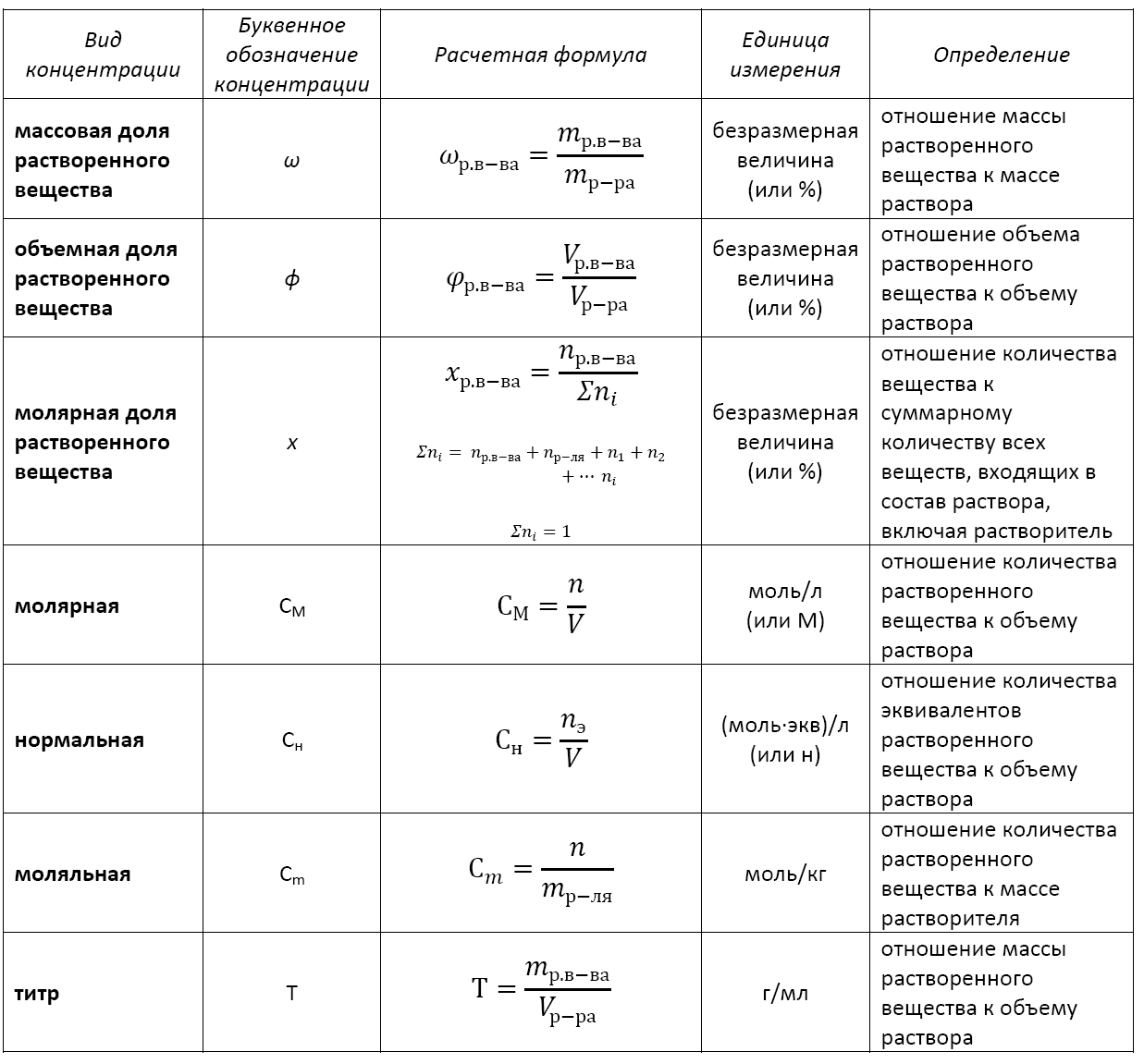
Существует несколько видов концентрации раствора:
— массовая доля растворенного вещества;
— объемная доля растворенного вещества;
— молярная доля растворенного вещества;
— молярная (или молярность);
— моляльная (или моляльность);
— нормальная (или эквивалентная);
— титр.
Формула концентрации раствора: основные виды
Применение того или иного вида концентрации уместно в каждом конкретном случае. Не существует какой-то универсальной концентрации или универсальной формулы концентрации раствора.
Кстати, с помощью математических преобразований можно перейти от одной концентрации к другой или найти взаимосвязь между разными их видами.
Основные расчетные формулы концентрации раствора приведены в таблице:
Массовая доля растворенного вещества и примеры ее вычисления
Массовая доля растворенного вещества – это отношение массы растворенного вещества к массе раствора.
Ее расчетная формула выглядит так:
где ωр.в-ва – массовая доля растворенного вещества, mр.в-ва – масса растворенного вещества, mр-ра – масса раствора.
ωр.в-ва представляет собой долю или от единицы или от 100%. Так, например, имеется двухпроцентный раствор NaCl. Его концентрация будет записана в первом случае ω(NaCl) = 0,02, а во втором – ω(NaCl) = 2%. Форма записи основной сути не меняет. Можно записывать и так, и так.
Что же означает выражение ω(NaCl) = 0,02 или ω(NaCl) = 2%? Буквально следующее: в 100 г водного раствора поваренной соли содержится 2 г этой соли и 98 г воды.
Необходимо помнить, что раствор состоит из растворителя и растворенного вещества. Поэтому масса раствора будет состоять из массы растворителя и массы растворенного вещества:
Тогда основную расчетную формулу для массовой доли растворенного вещества можно преобразовать:
Очень часто в расчетах с процентной концентрацией используются плотность и объем раствора:
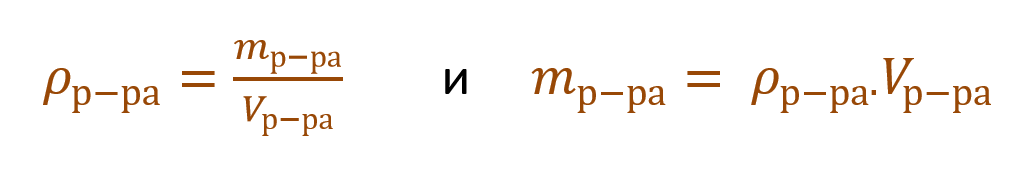
В других ситуациях могут использоваться объем и плотность не раствора, а растворителя. Тогда основная формула для расчета концентрации будет выглядеть так:
На практике бывает необходимо не только приготовить раствор с какой-либо определенной концентрацией, но и увеличить, либо уменьшить ее значение. Это достигается различными приемами:
— упариванием раствора;
— добавлением растворенного вещества;
— добавлением к раствору растворителя (например, воды).
Кроме того, приходится часто смешивать друг с другом растворы разных концентраций.
Разберем все возможные случаи.
Мы рекомендуем задачи, в которых речь идет о растворах, решать с использованием схематических рисунков. Это очень наглядно, особенно, когда речь идет о смешивании растворов.
Начнем с самого простого: вычислим концентрацию раствора.
Пример 1. В 200 г воды растворили 40 г глюкозы. Вычислите массовую долю глюкозы в полученном растворе.
Обратите внимание, что речи о каком-либо химическом взаимодействии не идет! Поэтому записывать уравнения реакций не требуется!
Запишем общую формулу для расчета массовой доли растворенного вещества:
В данной задаче глюкоза (C6H12O6) – растворенное вещество, а вода (H2O) – растворитель. Масса раствора будет складываться из массы глюкозы и массы воды:
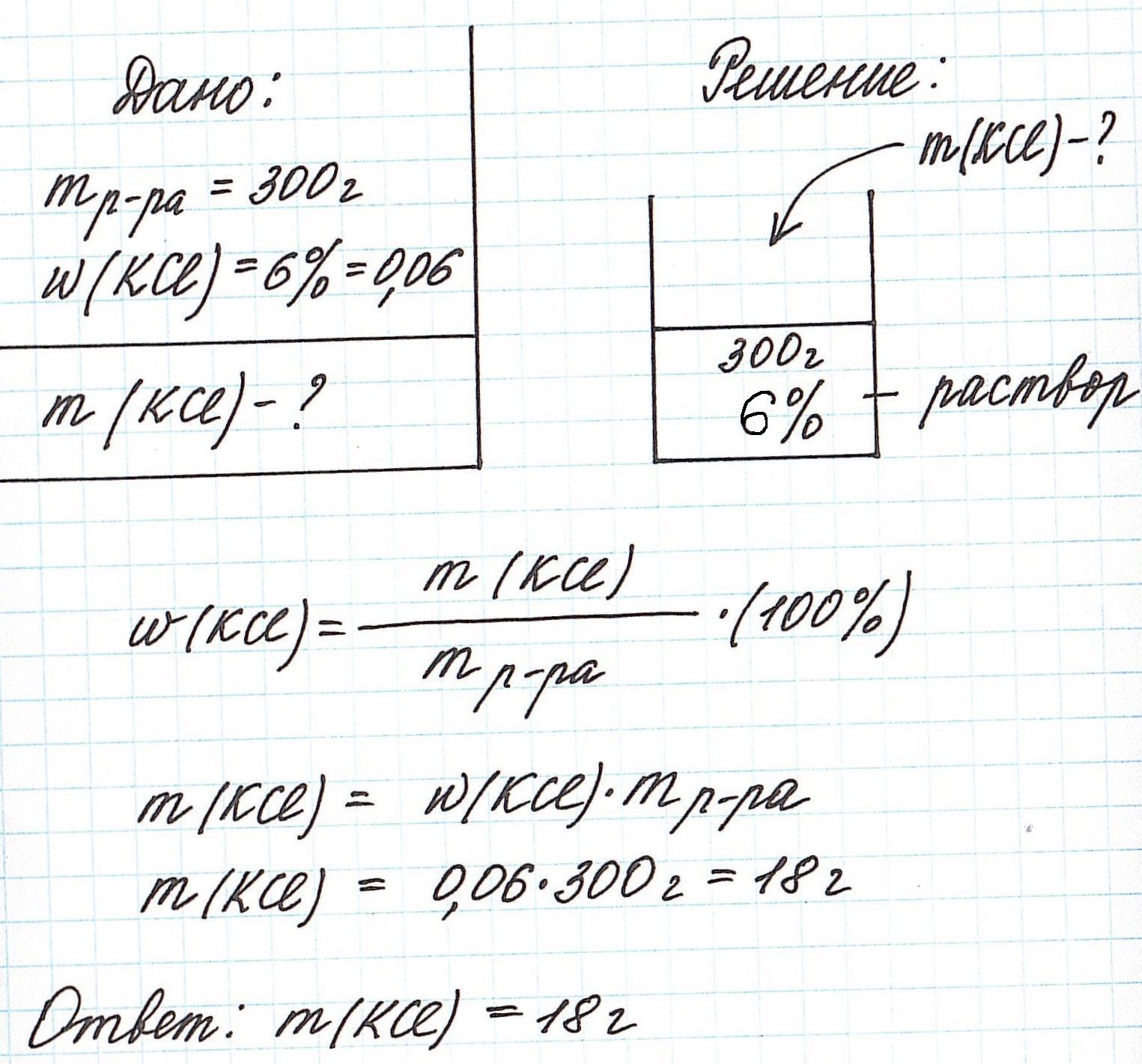
Пример 2. Рассчитайте, сколько потребуется хлорида калия, чтобы приготовить 300 г раствора с массовой долей соли 6%.
Обратите внимание, для того, чтобы расчеты были менее громоздкими, будем использовать выражение концентрации не в %, а в долях от единицы.
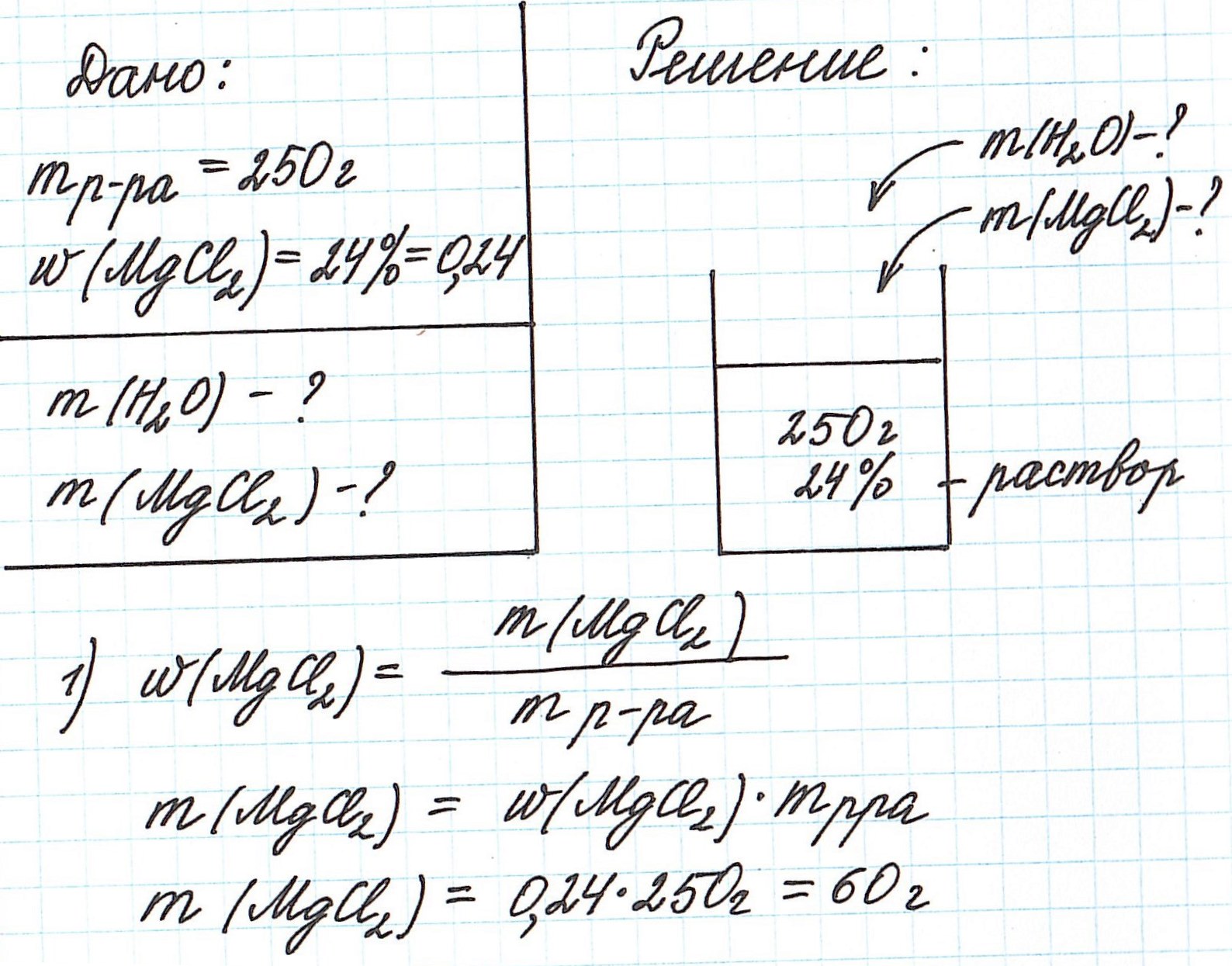
Пример 3. Необходимо приготовить 250 г раствора с массовой долей хлорида магния 24%. Рассчитайте массу требуемых воды и соли.
Так как раствор готовится из хлорида магния и воды, то и масса раствора равна сумме масс хлорида магния и воды:
Рассмотрим задачу, в которой в качестве растворителя выступает не вода, а другое вещество.
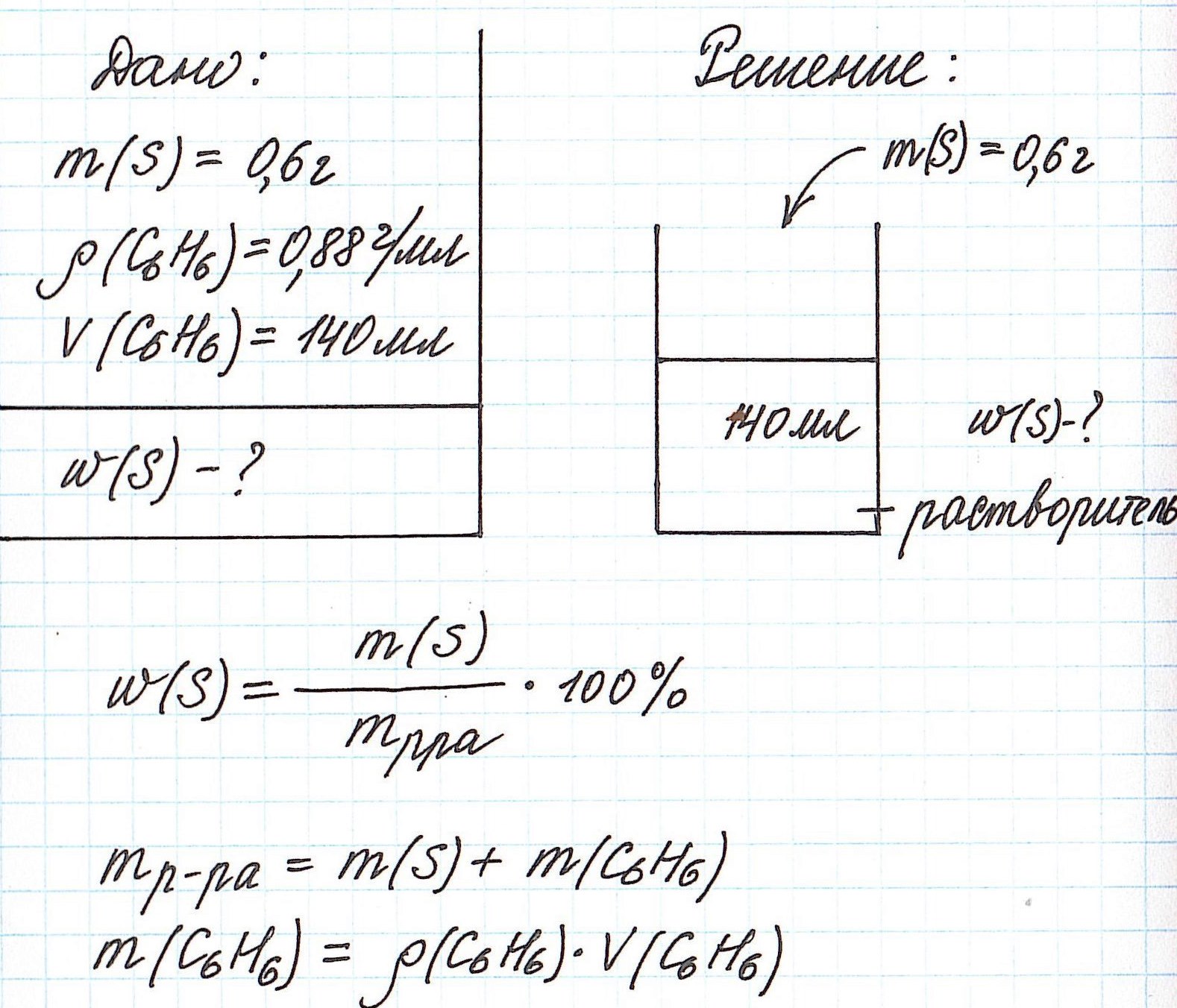
Пример 4. В органическом растворителе бензоле объемом 140 мл растворили серу массой 0,6 г. Вычислите массовую долю серы в полученном растворе, если плотность бензола составляет 0,88 г/мл.
Обратите внимание, что здесь:
— масса раствора не известна;
— масса растворителя (бензола) не известна;
— известны объем и плотность растворителя (бензола), что позволяет нам найти его массу;
— масса раствора состоит из массы растворителя (бензол) и массы растворенного вещества (сера).
Объединим все расчетные формулы в одну и подставим в нее имеющиеся численные значения:
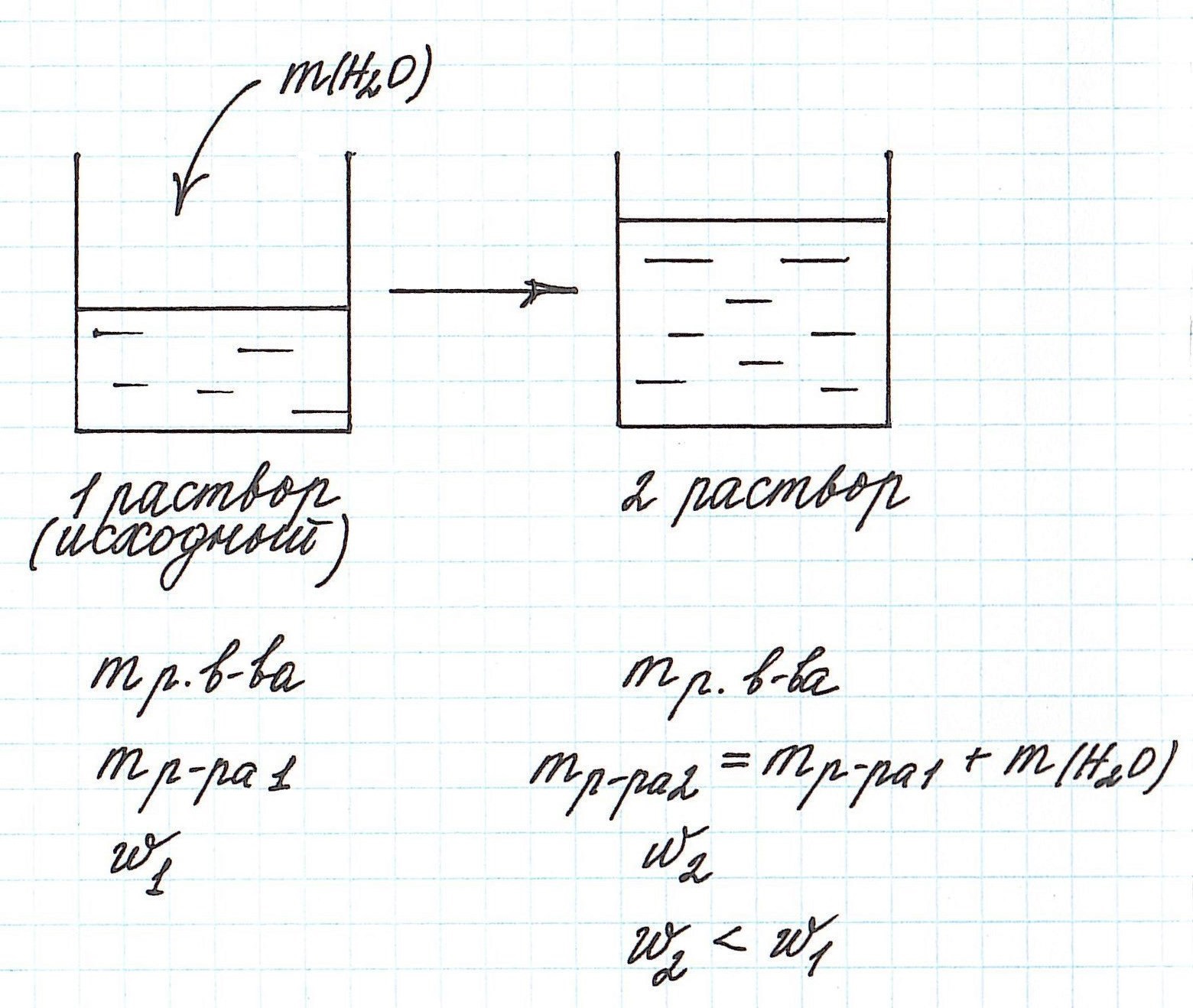
Вычисление массовой доли растворенного вещества при разбавлении раствора водой
Разбавление раствора водой приводит к уменьшению его концентрации.
Запомним, что в таких случаях:
— увеличивается масса раствора;
— увеличивается масса растворителя;
— масса растворенного вещества остается постоянной.
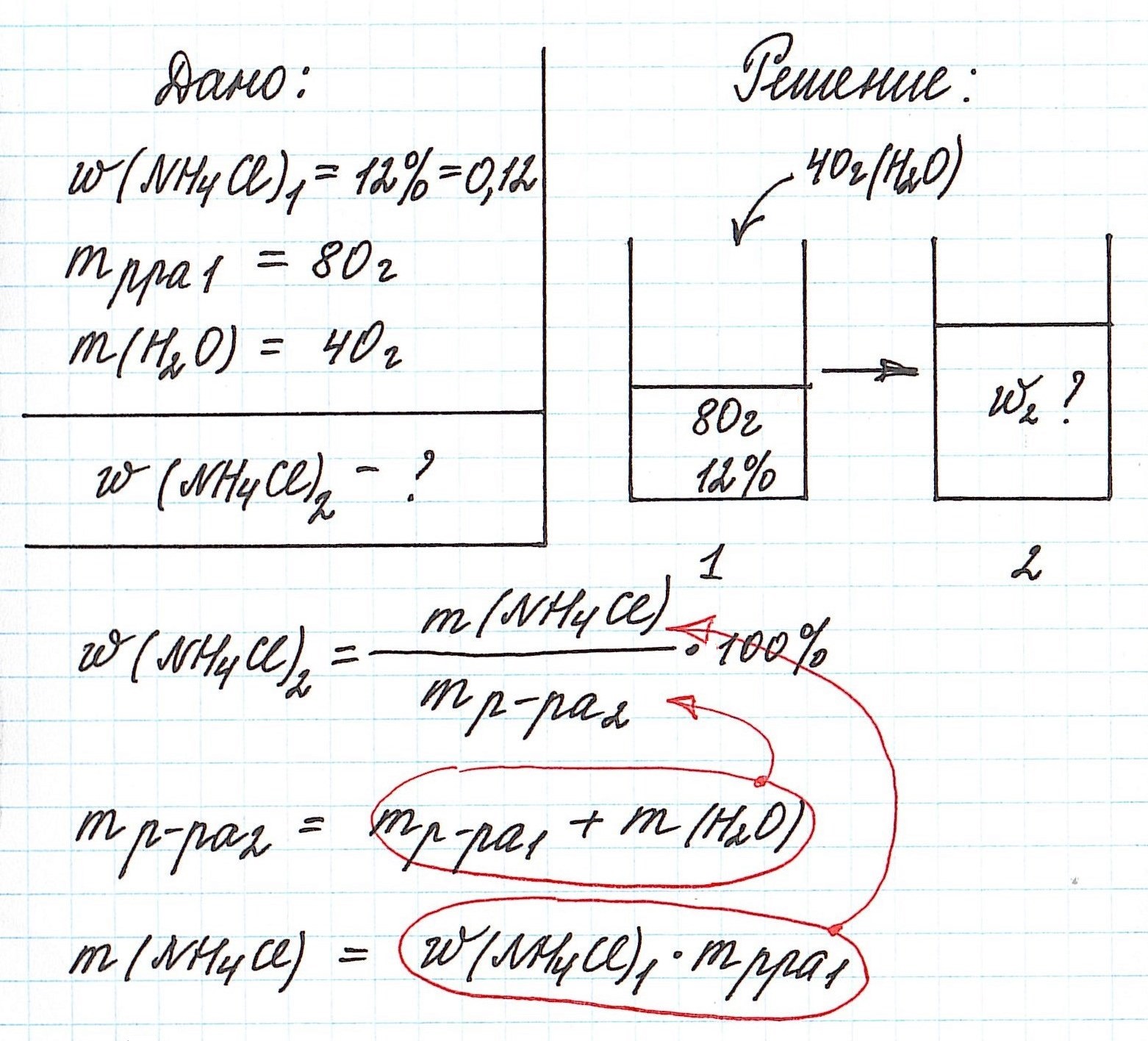
Пример 5. К 80 г раствора с массовой долей NH4Cl 12% добавили 40 г воды. Вычислите массовую долю хлорида аммония в полученном растворе.
Объединим все полученные формулы в одну и подставим имеющиеся данные:
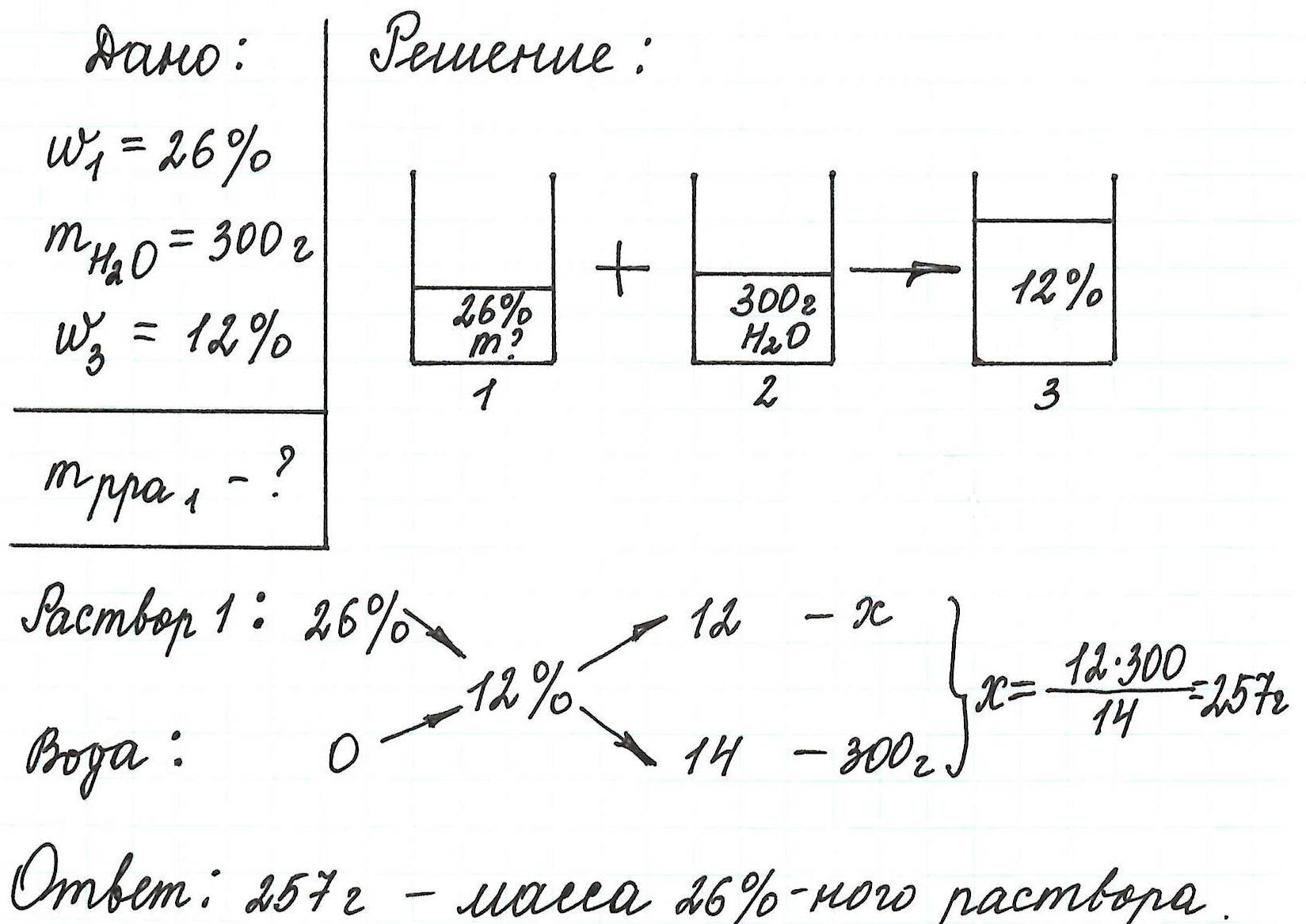
Пример 6. Рассчитайте объем раствора фосфорной кислоты (массовая доля кислоты 12%, плотность 1,065 г/мл), который потребуется для приготовления раствора с массовой долей H3РO4 4% объемом 250 мл (плотность 1,02 г/мл).
В данной задаче речь напрямую о разбавлении раствора не идет. Но судя по тому, что исходный раствор имел концентрацию 12%, а конечный – 4%, становится ясно: последний раствор можно получить путем разбавления первого водой.
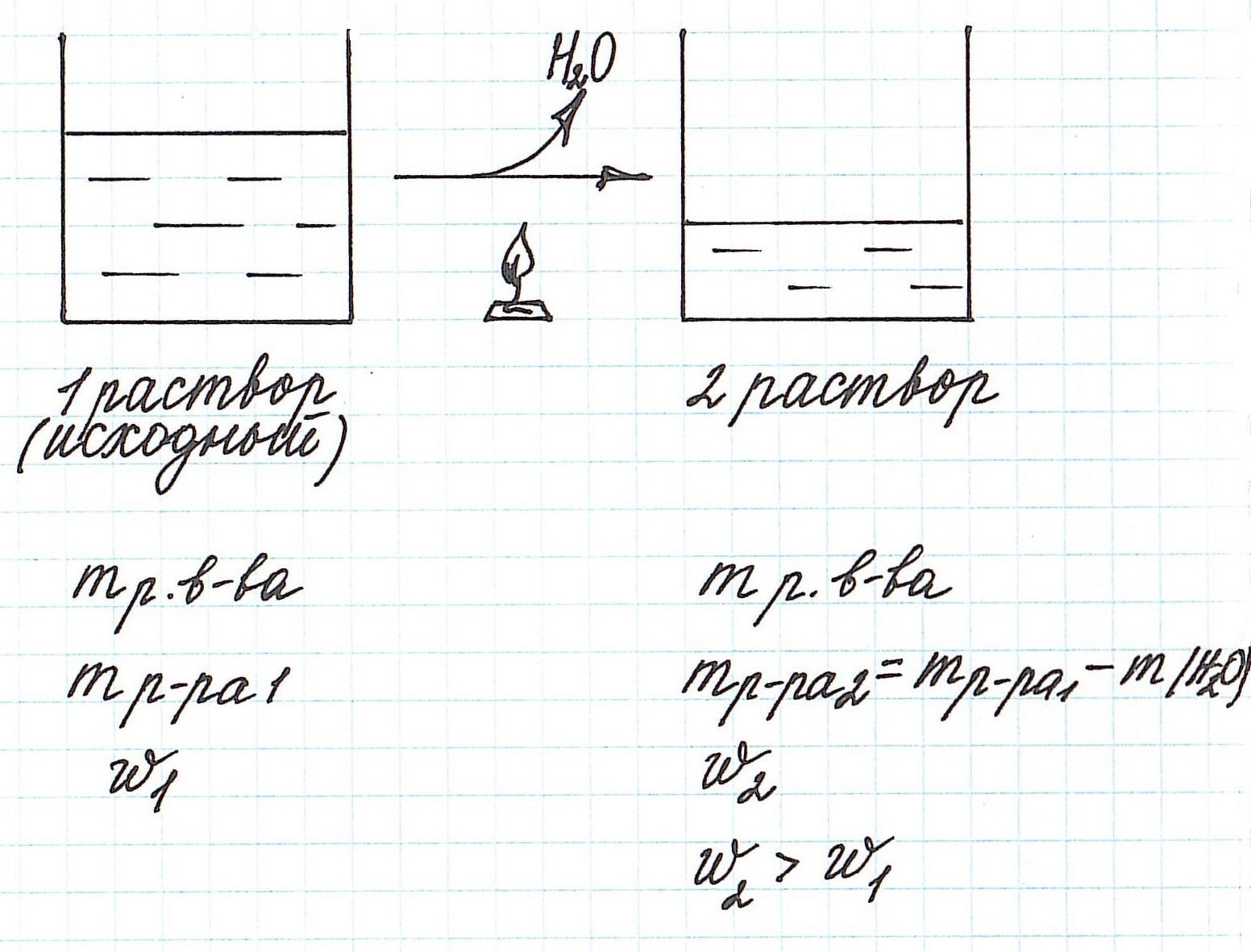
Вычисление массовой доли растворенного вещества при концентрировании раствора путем упаривания
Упаривание раствора, т.е. его нагревание, при котором происходит испарение воды, приводит к увеличению концентрации.
Учтите, что при этом:
— уменьшается масса раствора;
— уменьшается масса растворителя;
— масса растворенного вещества остается постоянной (при условии, что растворенное вещество не разлагается при данной температуре).
Пример 7. Из 200 г 27%-ного раствора глюкозы выпарили 20 г воды. Определите массовую долю глюкозы в полученном растворе.
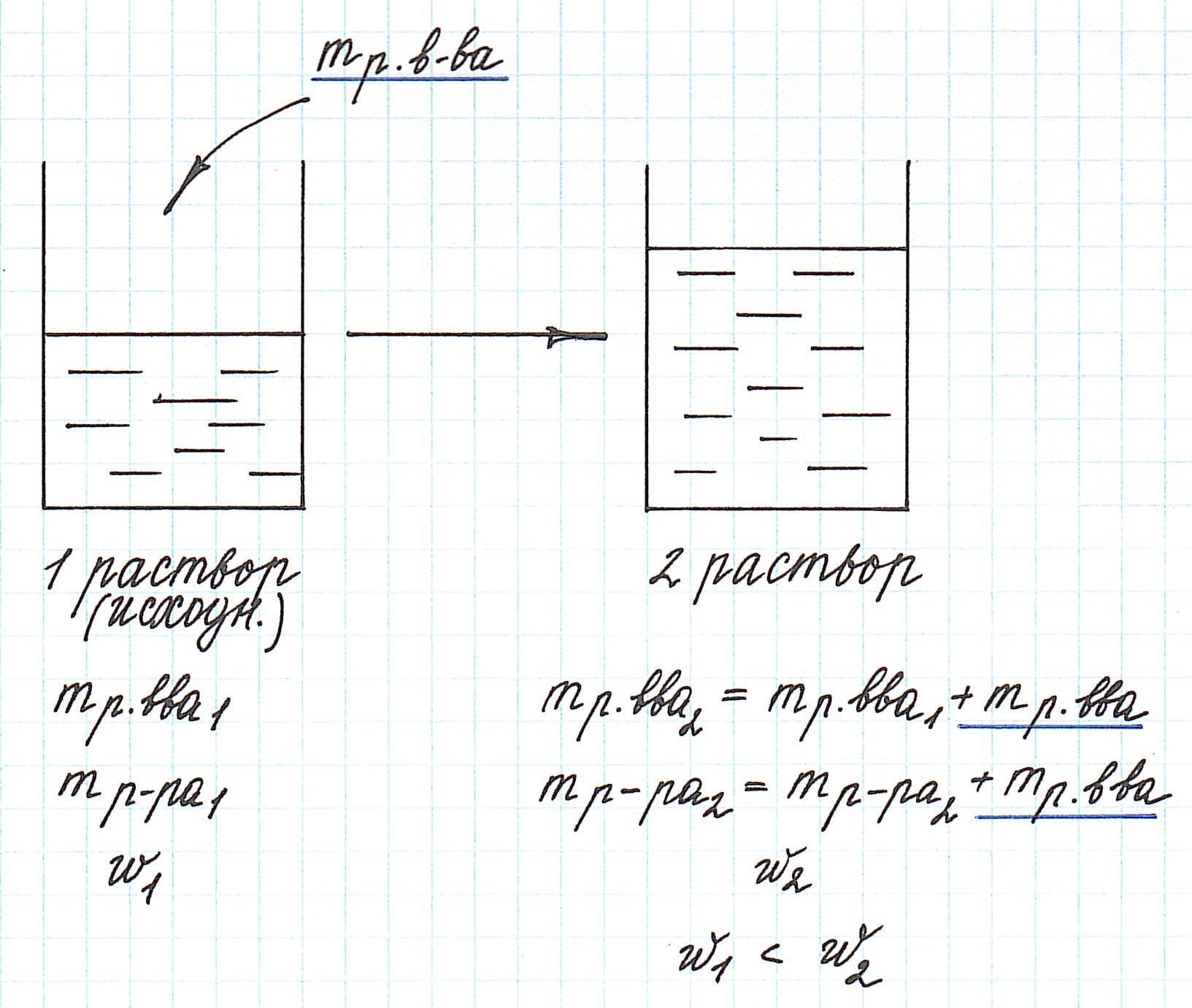
Вычисление массовой доли растворенного вещества при концентрировании раствора путем добавления растворенного вещества
Добавление к уже существующему раствору новой порции растворенного вещества приводит к увеличению концентрации раствора.
Помните, что в таких случаях:
— увеличивается масса раствора;
— увеличивается масса растворенного вещества.
Пример 8. Определите массу хлорида калия, который надо добавить к 180 г 15%-ного раствора этой соли, чтобы получить 20%-ный раствор.
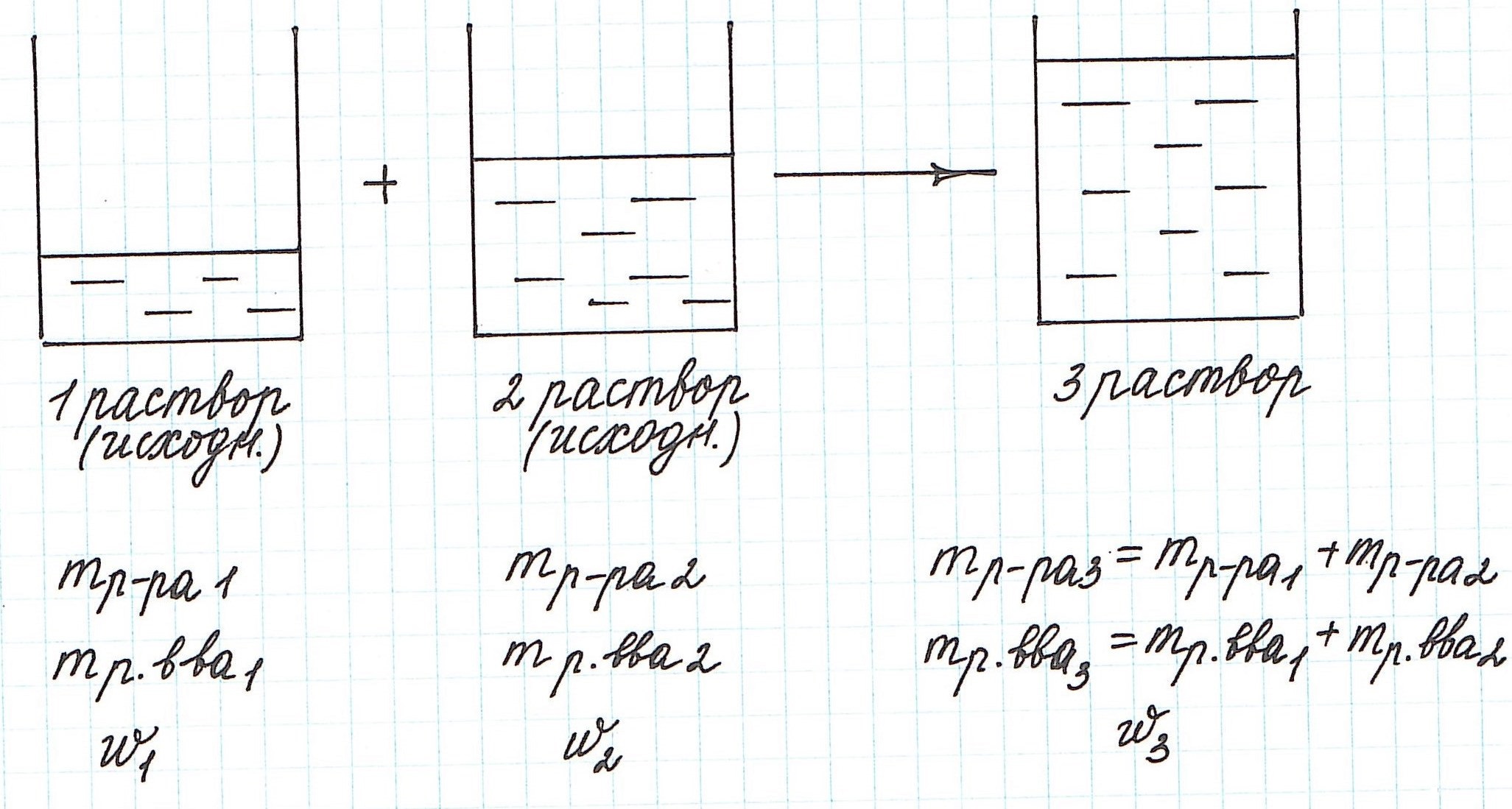
Вычисление массовой доли растворенного вещества при смешивании двух растворов
При смешивании двух растворов (речь о растворах одного и того же вещества конечно же) изменяются все количественные характеристики:
— увеличивается масса раствора;
— увеличивается масса растворенного вещества;
— изменяется массовая доля растворенного вещества.
Пример 9. Смешали 80 г 32%-ного раствора и 30 г 10%-ного раствора нитрата меди (II). Какова концентрация соли в полученном растворе?
Вычисление массовой доли растворенного вещества с применением кристаллогидратов для приготовления раствора
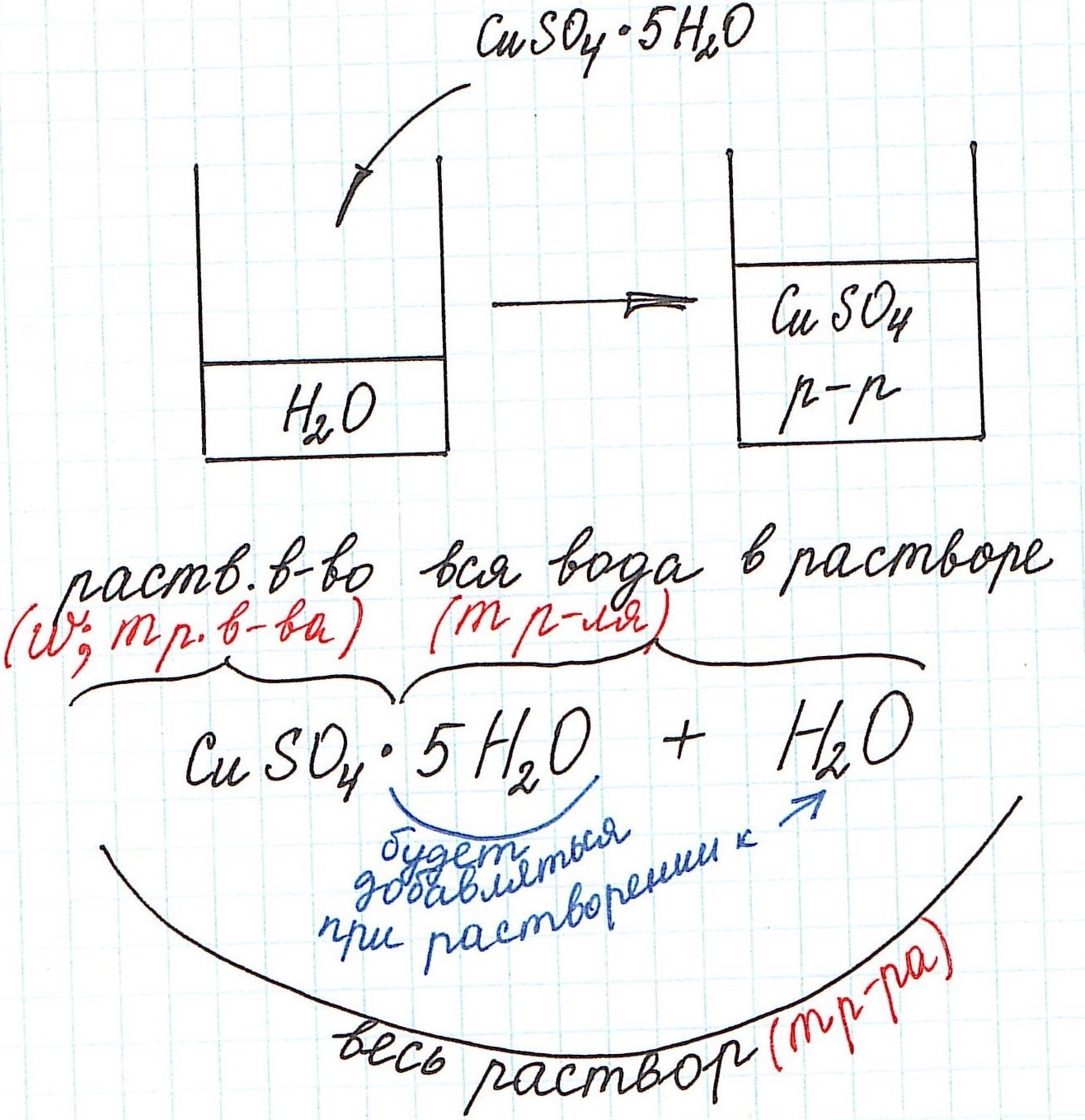
Кристаллогидраты используются для приготовления растворов довольно часто. Кристаллогидраты представляют собой вещества, в состав которых помимо основного вещества входят молекулы воды. Например:
CuSO4·5H2O – кристаллогидрат сульфата меди (II) (или медный купорос);
Na2SO4·10H2O – кристаллогидрат сульфата натрия (или глауберова соль).
Больше примеров здесь.
Вода, входящая в состав кристаллогидрата, называется кристаллизационной.
Кристаллогидраты различаются прочностью связи между основным веществом и кристаллизационной водой. Одни из них теряют воду при комнатной температуре с течением времени и перестают быть кристаллогидратами (например, Na2СO3·10H2O). Другие – обезвоживаются только при сильном нагревании (например, CuSO4·5H2O).
При расчете концентрации с использованием кристаллогидратов для получения растворов часто приходится учитывать и кристаллизационную воду.
Но сначала поясним некоторые нюансы на конкретном примере:
1) Формула CuSO4·5H2O означает, что 1 моль CuSO4·5H2O содержит 1 моль CuSO4 и 5 моль H2O. Это можно было бы записать так:
n(CuSO4) = n(CuSO4·5H2O); n(H2O) = 5n(CuSO4·5H2O)
2) Относительная молекулярная (и численно молярная) масса будет складываться из относительной молекулярной массы вещества и относительной молекулярной массы воды. Например:
Mr(CuSO4·5H2O) = Mr(CuSO4) + 5·Mr(H2O) = 160 + 5·18 = 250 и, соответственно,
M(CuSO4·5H2O) = M(CuSO4) + 5·M(H2O) = 160 + 5·18 = 250 г/моль.
3) Еще одну особенность поясним с помощью рисунка:
Итак, разберем несколько типичных задач.
Пример 10. В 60 г воды растворили глауберову соль Na2SO4·10H2O массой 5,6 г. Какова массовая доля сульфата натрия в полученном растворе?
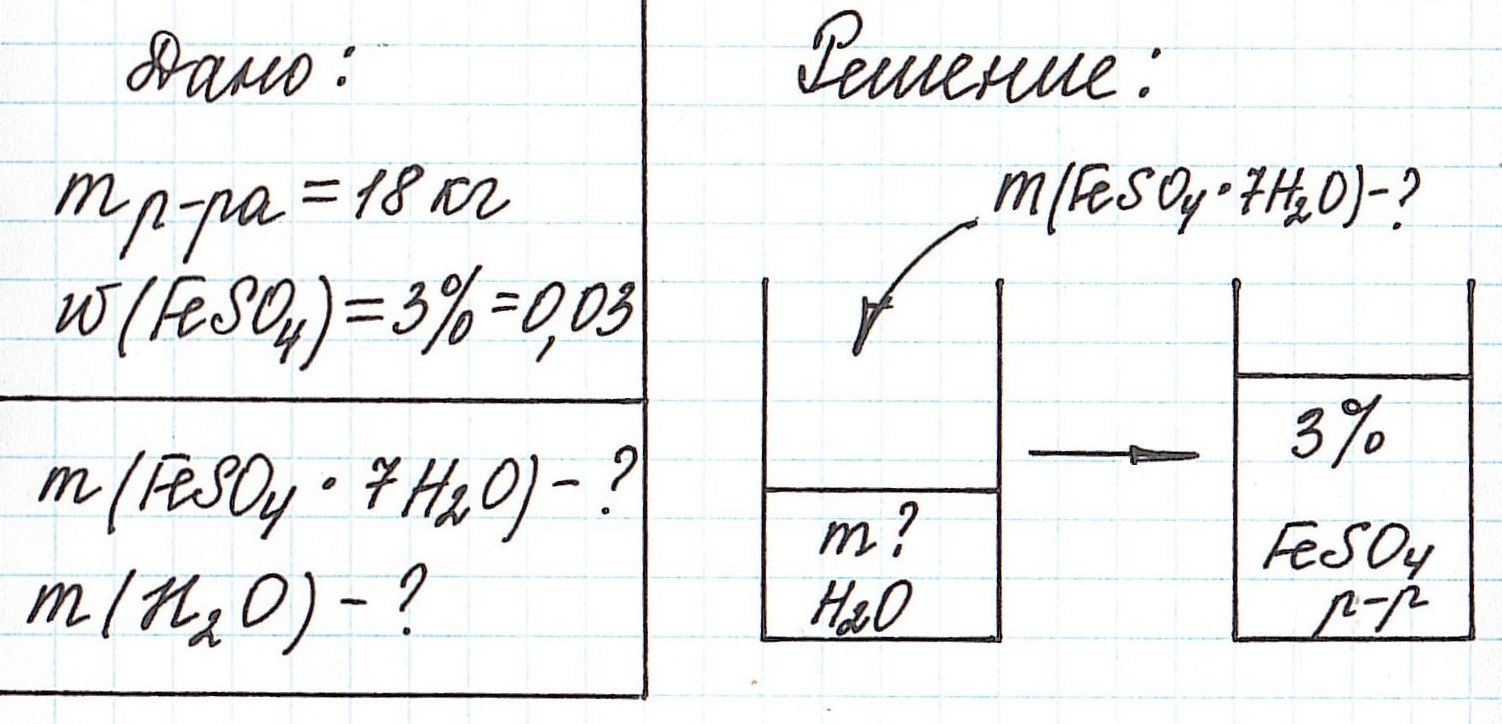
Пример 11. Какая масса железного купороса FeSO4·7H2O и воды потребуется для приготовления 18 кг раствора сульфата железа (II) с массовой долей FeSO4 3%?
Обратите внимание, что масса раствора дана не в граммах (г), а в килограммах (кг). Для того, чтобы привести в ходе расчетов все единицы измерения к единой системе, можно перевести килограммы в граммы и вычислять как обычно.
Но есть более простой способ. Можно считать количество вещества не в моль, а в киломоль (кмоль). Молярную массу вычислять не в г/моль, а в кг/кмоль. В этом случае ответ в задаче мы сразу получим в килограммах.
Пример 12. Вычислите массу кристаллогидрата сульфата никеля NiSO4·7H2O, который надо добавить к 180 г раствора с массовой долей сульфата никеля 1,5%, чтобы получить раствор с массовой долей соли 6%?
Правило «креста» в химии растворов как метод решения задач на процентную концентрацию растворов
Правилом «креста» (или «квадратом Пирсона») очень удобно пользоваться в расчетах, связанных с разбавлением или смешиванием растворов.
Общая схема вычислений выглядит так:
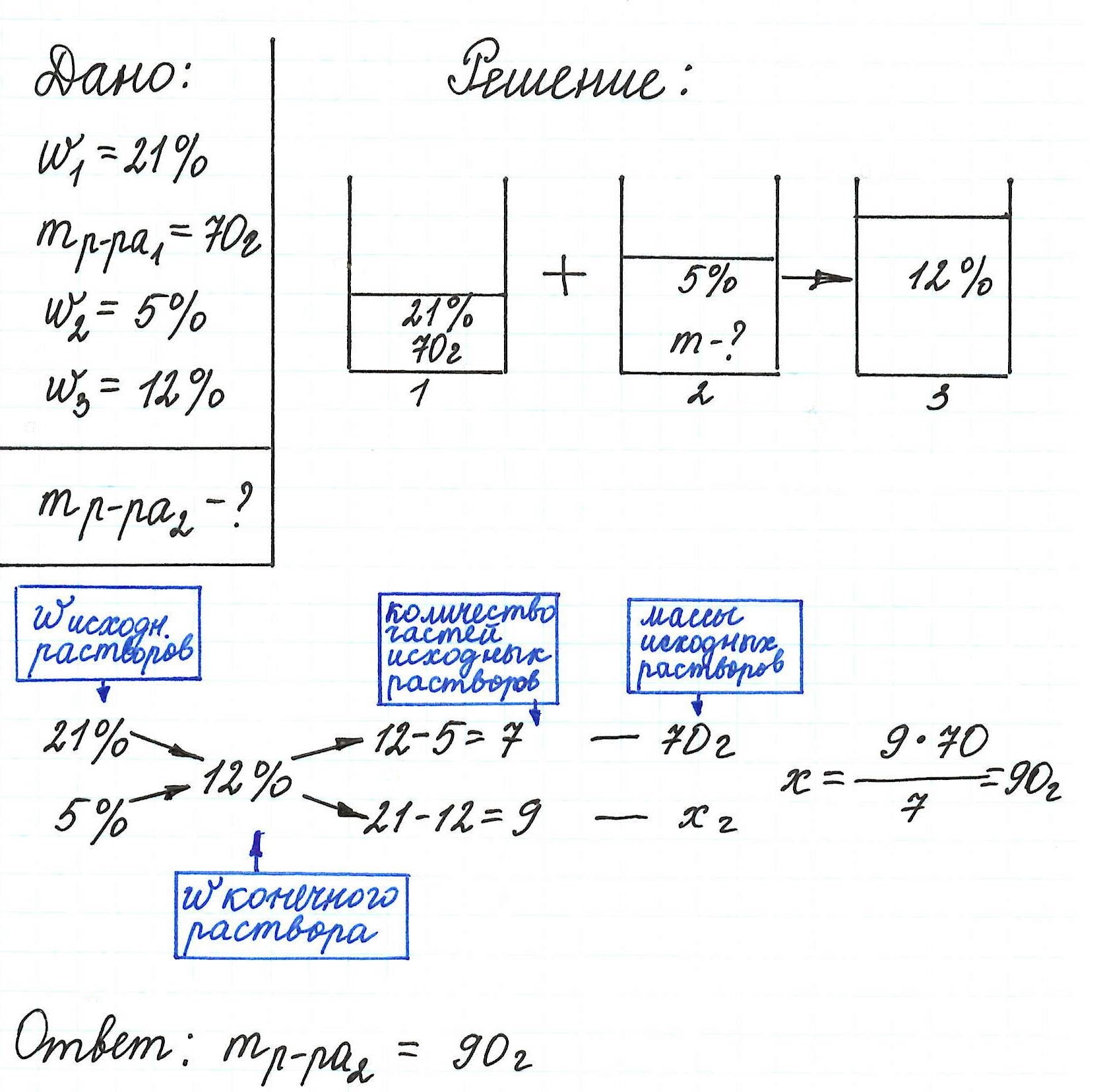
Пример 13. Какую массу 5%-ного раствора глюкозы надо добавить к 70 г 21%-ного раствора этого же вещества, чтобы получить 12%-ный раствор?
Еще примеры с применением правила «креста» можно посмотреть здесь.
Мы рассмотрели достаточно примеров расчетов, где используется формула такой концентрации раствора как массовая доля растворенного вещества. Как видим, ситуаций, в которых требуется ее применение, множество. Однако, есть достаточно случаев, когда более приемлемыми являются формулы других концентраций (молярной, нормальной, титра и т.д.). Об этом читайте в других статьях.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
или на Одноклассниках
Пожалуйста, оцените публикацию. Большая просьба, если вы оцениваете публикацию от 1 до 3 звезд, обязательно оставьте свой комментарий с указанием того, что не так с этой публикацией. Мы постараемся устранить недостатки.
Ваше мнение для нас важно!
Смесь, состоящая из частиц растворителя, растворяемого вещества и продуктов их взаимодействия, называется раствором. Это гомогенные структуры однородной консистенции, состоящие из двух либо нескольких компонентов. Решение задач на растворы – определение их концентрации, степени растворимости веществ, условий протекания растворообразующих процессов.
Задачи на растворы по химии
Чистое вещество либо смесь нескольких компонентов, попадая в растворитель, могут проявлять свойства:
- хорошей растворимости;
- малой растворимости;
- быть нерастворимыми.
При растворении в воде образуются многочисленные атомно-молекулярные связи. Их количество зависит от коэффициента растворимости – химической величины, которая рассчитывается путем деления массы растворяемого вещества на массу растворителя.
Кроме этого, в задачах могут присутствовать массовая доля вещества, растворенного в соответствующем растворителе.
Как решать задачи с процентными растворами
Растворы с выраженной концентрацией активного (растворенного) вещества носят название процентных. В задачах по химии ставятся цели определить содержание массы растворенного вещества, массы образовавшегося либо первоначального раствора, процентного содержания вещества до или после растворения.
Растворы, о которых идет речь в задачах по химии, обладают общими свойствами:
- они однородны;
- смешивание компонентов происходит за малый отрезок времени, как и изменение их концентрации;
- в результате смешивания двух (или более) растворов с различной концентрацией, происходит не только увеличение общей массы и объема раствора, но и усреднение процентного содержания растворенного вещества.
Поэтому существуют общие принципы их решения. Так, увеличение концентрации происходит в результате упаривания (испарения растворителя), а уменьшение – разбавления. В результате смешения может наблюдаться как увеличение, так и уменьшение, в зависимости от конкретных условий задачи.
В любом случае характеристики начального и конечного продуктов будут различаться, поэтому важно, данные в условии сведения не перепутать. Для этого применяется их нумерация.
Чтобы грамотно составить алгоритм решения, часто бывает полезно использовать уравнение химической реакции относительно активного вещества либо кислоты.
Концентрация растворов и способы ее выражения
На бытовом уровне понятие концентрации раствора выражается в отношении массы растворенного вещества к массе раствора, выраженном в процентах. Однако правомерно более широкое определение, охватывающее различные способы выражения концентрации.
Концентрация раствора – количественный показатель состава активного вещества в растворе, выраженное в определенных единицах и заключенное в единице массы или объема. Выражается в долях, процентах, массовых долях, молярности, мольных долях, титрах. Из них чаще применяются молярность и мольная доля.
1. О массовой доле ((omega)) идет речь в задачах, когда можно составить соотношение масс растворенного компонента и всего раствора. Для ее выражения существует формула:
(omega=M_{в-ва}div M_{р-ра})
Выражается она в процентах либо долевых частях единицы.
2. Молярность (по-другому – молярная концентрация) или (С) показывает сколько молей растворяемого компонента содержится в литре раствора. Ее формула имеет вид:
(С=ndiv V)
где (n) – это растворенное вещество в молях. Исходя из его значения, раствор может быть одномолярным (содержит 1 моль в 1 литре), децимолярным (0,1 моля в 1 л), сантимолярным (0,01 моль) и т.д.
3. Концентрация моляльная (обозначается (С_х)) – моляльность – показатель количества (n) молей растворенного компонента в 1 кг растворителя ((M_{р-ля})).
(C_x=ndiv M_{р-ля})
4. Для определения содержания (в граммах) вещества в 1 л раствора применяется понятие «титр» ((Т)).
(T=M_{в-ва}div V_{р-ра})
5. Под растворимостью ((S)) понимают максимальную массу растворяемого вещества, способного раствориться в 100 г растворителя:
(S=(M_{в-ва}div M_{р-ля})times100 {})
6. Коэффициент растворимости ((K_s)) – показатель, который определяется отношением массы вещества к массе растворителя при условии получения насыщенного раствора при обозначенной температуре:
(K_s=M_{в-ва}div M_{р-ля})
Решение задач на упаривание растворов
Выпаривание раствора происходит в результате испарения воды, что ведет за собой уменьшение общего объема и массы. В то же время масса растворенного вещества остается без изменений. Существуют случаи, когда, кроме растворителя, испаряется растворенное вещество, если оно обладает повышенной летучестью.
Пример. Водный раствор аммиака
Рассмотрим пример решения задачи на упаривание.
Условие: В наличии 800 г раствора с 15%-ной концентрацией определенного вещества. Нужно увеличить его массовую долю на 5%. Сколько г воды должно испариться?
Этапы решения:
- Какова масса вещества в первичном растворе?
(M_в=omega_вtimes M_р=0,15×800=120)г, где (M_в) – масса вещества, (M_р) – масса раствора
Найденное значение останется постоянным, поскольку при выпаривании изменения массы растворенного вещества не происходит. Значит M’=120г
2. (M_р=M_вdivomega_в= 120÷0.2=600)г
3. Теперь можно найти массу испаренной воды:
(M{исп;в}=M_р-M’=800-600=200)г
Решение задач на разбавление растворов
В результате процесса разбавления масса того вещества, которое растворено, не меняется в отличие от массы всего раствора и растворителя.
Задача
Масса имеющегося раствора NaCl 200г, его концентрация – 15%. К раствору добавлено 40г воды. Определить массовую долю NaCl в конце реакции.
Решение
1. Определение массы раствора в конце процесса:
(M’=M_{р-ра}+M_{добH2O}=240)г
2. Определение массы NaCl в начале процесса:
(M_{NaCl}=(omega_{NaCl}times M_р)div100%=15%times200гdiv100%=30 {})г
В конечном растворе (M’_ {NaCl}=M_{NaCl})
3. Определение массовой доли NaCl в конце процесса:
(omega’_{NaCl}=M_{NaCl}div M’_рtimes100%=12,5%)
Решение задач на концентрирование растворов
Повышение концентрации происходит при добавлении вещества в раствор. При этом конечная масса растворенного вещества равна сумме первоначального содержимого и того, который добавлен.
Задача. Имеется 180 г раствора с 8%-ной концентрацией соли (формула NaCl). В этот раствор всыпали еще 20 г поваренной соли. Какая массовая доля NaCl получилась в конце реакции?
Решение
1. Определение окончательной массы раствора:
(M’_р=M_р+M_{доб}=200)г
2. Определение конечной массы NaCl:
M’=M+Mдоб
Следовательно, нужно найти (M) – массу в начале процесса.
(M=(omega_{NaCl}times M_р)÷100%=14,4)г
Тогда (M’=14,4г+20г=34,4)г
3. Определение массовой доли NaCl в конечном продукте:
(omega’=M’_{NaCl}div M’_рtimes100%=17,2%)
Решение задач на смешение растворов
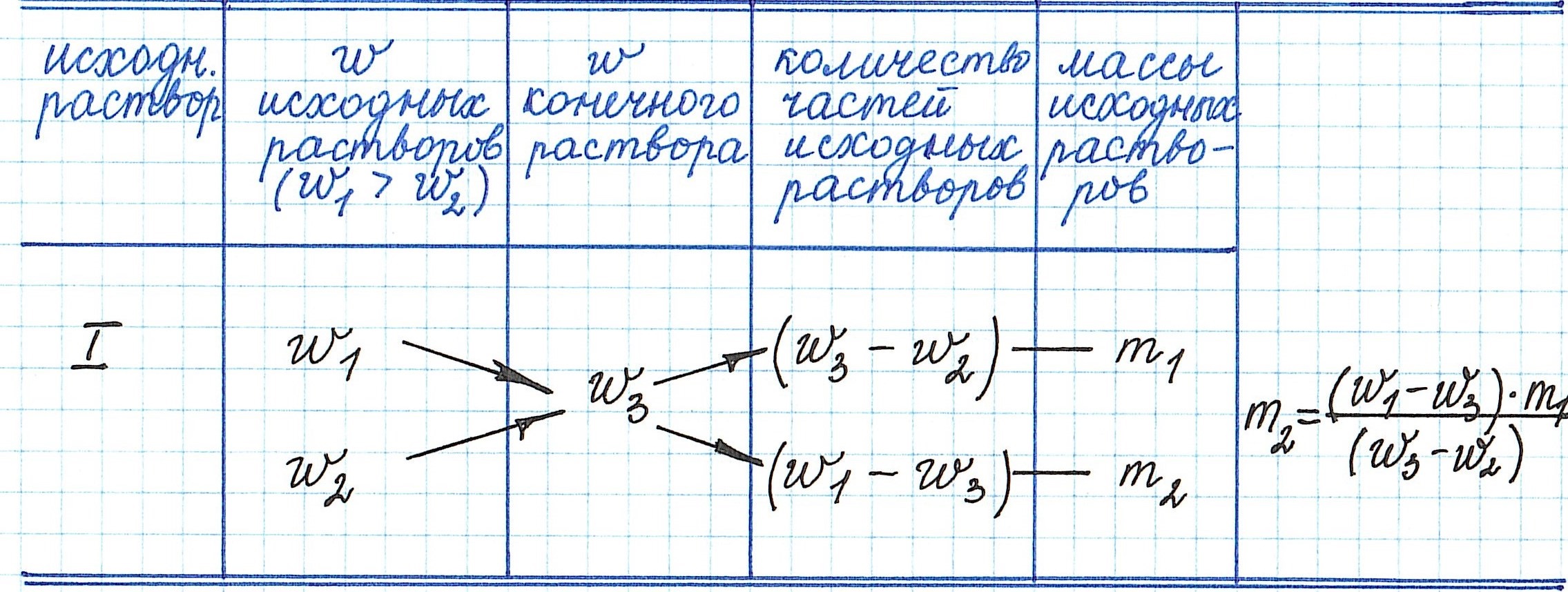
Смешение растворов с различной концентрацией растворенного вещества происходит с соблюдением «конверта Пирсона». Это – диагональная модель, при которой нельзя складывать массовые доли, а можно – лишь массы растворенных компонентов и растворов.
Задача
Дано два раствора с массами (M) и (M_1). Массовые доли растворенного вещества обозначим соответственно (ω) и (ω_1). В конечном продукте аналогичная величина – (ω_3). Необходимо приготовить третий раствор с отличной от имеющихся концентраций.
Решение
1. Определение общей массы растворенного вещества:
(M_1omega_1+M_2omega_2=omega_3(M_1+M_2))
2. Математические действия:
(M_1(omega_1-omega_3)=M_2=(omega_3-omega_2))
(M_1div M_2=(omega_3-omega_2)div(omega_1-omega_3))
Следовательно, согласно этому математическому выражению, и нужно взять соотношение растворов.
Задачи на определение процентной концентрации раствора
Задача 1
Какая процентная концентрация раствора (KNO_3), если нормальная равна (0,2) моль/л. Плотность равна (1) г/мл.
Решение:
1. Определение массы раствора объемом (1000) мл:
(M=rhotimes V=1times1000=1000)г
2. Составление и решение следующей пропорции:
(20,0)г (KNO_3) – (1000) г раствора
(Х_г) – (100) г раствора
(Х=2,02) г или (ω=2,02%)
Задача 2
Нужно приготовить (300) г 25%-ного раствора соли, имея 60%-ный и 10%-ный. Сколько нужно взять таких компонентов (m1 и m2)?
Для решения применим правило Креста:
1. Определение веса одной из 50-ти частей образуемого раствора:
(300div5=6)
2. Определение массы каждой части (m_1) и (m_2):
(m_1=6times15=90)
(m_2=6times35=210)
Задача 3
Используя 250г 45%-ного раствора соли, нужно понизить его концентрацию до 10%. Сколько воды необходимо использовать?
Концентрация соли в воде, используемой в качестве добавки, равна 0.
По методу креста образуется 45 частей раствора:
Решение
1. Масса одной части первичного раствора равна: (250div10=25)г
2. Определение массы воды, что необходима: (25times35=875)г
С целью проверки можно выполнить следующие действия:
1. Определение массы конечного продукта-раствора:
(875+25=1125г)
2. Для исходного раствора действует пропорция:
В 250г 40%-ного р-ра содержится Хг соли
в 100 г – 45г
Отсюда Х=112,5 г соли
3. Определение конечной концентрации раствора:
1125 г раствора – 112,5 соли
100г – Х
Х=10г или 10%
Следовательно, нужно взять 875 г воды.
Решать задачи на растворы – интересное занятие! Знание основных закономерностей будет полезно с теоретической и практической точек зрения. Однако бывают случаи, когда нужно быстро сдать контрольную либо перепроверить собственные решения. Тогда можно обратиться на сайт ФениксХелп.
Концентра́ция или до́ля компонента смеси — величина, количественно характеризующая содержание компонента относительно всей смеси. Терминология ИЮПАК под концентрацией компонента понимает четыре величины: соотношение молярного, или численного количества компонента, его массы, или объёма исключительно к объёму раствора[1] (типичные единицы измерения — соответственно моль/л, л−1, г/л, и безразмерная величина). Долей компонента ИЮПАК называют безразмерное соотношение одной из трёх однотипных величин — массы, объёма или количества вещества.[2] Однако в обиходе термин «концентрация» могут применять и для долей, не являющихся объёмными долями, а также к соотношениям, не описанным ИЮПАК. Оба термина могут применяться к любым смесям, включая механические смеси, но наиболее часто применяются к растворам.
Можно выделить несколько типов математического описания: массовая концентрация, молярная концентрация, концентрация частиц и объемная концентрация[3].
Эти стаканы, содержащие красный краситель, демонстрируют качественные изменения концентрации. Растворы слева более разбавлены, по сравнению с более концентрированными растворами справа.
Массовая доля[править | править код]
| определение | Массовая доля компонента — отношение массы данного компонента к сумме масс всех компонентов. |
|---|---|
| обозначение |  — по рекомендациям ИЮПАК[4]. — по рекомендациям ИЮПАК[4].
В технической литературе:
|
| единицы измерения | доли,
%масс (для выражения в %масс следует умножить указанное выражение на 100 %) |
| формула |  где: где:
|
В бинарных растворах часто существует однозначная (функциональная) зависимость между плотностью раствора и его концентрацией (при данной температуре). Это даёт возможность определять на практике концентрации важных растворов с помощью денсиметра (спиртометра, сахариметра, лактометра). Некоторые ареометры проградуированы не в значениях плотности, а непосредственно концентрации раствора (спирта, жира в молоке, сахара). Следует учитывать, что для некоторых веществ кривая плотности раствора имеет максимум, в этом случае проводят два измерения: непосредственное, и при небольшом разбавлении раствора.
Часто для выражения концентрации (например, серной кислоты в электролите аккумуляторных батарей) пользуются просто их плотностью. Распространены ареометры (денсиметры, плотномеры), предназначенные для определения концентрации растворов веществ.
Объёмная доля[править | править код]
| определение | Объёмная доля — отношение объёма компонента к сумме объёмов компонентов до смешивания. |
|---|---|
| обозначение | 
|
| единицы измерения | доли единицы,
%об (ИЮПАК не рекомендует добавлять дополнительные метки после знака %) |
| формула |
где:
|
При смешивании жидкостей их суммарный объём может уменьшаться, поэтому не следует заменять сумму объёмов компонентов на объём смеси.
Как было указано выше, существуют ареометры, предназначенные для определения концентрации растворов определённых веществ. Такие ареометры проградуированы не в значениях плотности, а непосредственно концентрации раствора. Для распространённых растворов этилового спирта, концентрация которых обычно выражается в объёмных процентах, такие ареометры получили название спиртомеров или андрометров.
Молярность (молярная объёмная концентрация)[править | править код]
| определение | Молярность — количество вещества (число молей) компонента в единице объёма смеси. |
|---|---|
| обозначение | По рекомендации ИЮПАК, обозначается буквой  или или ![{displaystyle [B]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6e6c6caf9d188e4a608dfdac98bbcd140a9ea106) , где B — вещество, концентрация которого указывается.[6] , где B — вещество, концентрация которого указывается.[6]
|
| единицы измерения | В системе СИ — моль/м³
На практике чаще — моль/л или ммоль/л. Примечание: После числа пишут «моль», подобно тому, как после числа пишут «см», «кг» и т. п., не склоняя по падежам. |
| формула |
где:
|
Нормальная концентрация (молярная концентрация эквивалента, «нормальность»)[править | править код]
| определение | Нормальная концентрация — количество эквивалентов данного вещества в 1 литре смеси. |
|---|---|
| обозначение |  , ,  , , 
|
| единицы измерения | Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов). Для записи концентрации таких растворов используют сокращения «н» или «N». Например, раствор, содержащий 0,1 моль-экв/л, называют децинормальным и записывают как 0,1 н. |
| формула |
где:
|
Нормальная концентрация может отличаться в зависимости от реакции, в которой участвует вещество. Например, одномолярный раствор H2SO4 будет однонормальным, если он предназначается для реакции со щёлочью с образованием гидросульфата калия KHSO4, и двухнормальным в реакции с образованием K2SO4.
Мольная (молярная) доля[править | править код]
| определение | Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. |
|---|---|
| обозначение | ИЮПАК рекомендует обозначать мольную долю буквой  (а для газов — (а для газов —  )[7], также в литературе встречаются обозначения )[7], также в литературе встречаются обозначения  , ,  . .
|
| единицы измерения | Доли единицы или %мольн (ИЮПАК не рекомендует добавлять дополнительные метки после знака %) |
| формула |
|
Мольная доля может использоваться, например, для количественного описания уровня загрязнений в воздухе, при этом её часто выражают в частях на миллион (ppm — от англ. parts per million). Однако, как и в случае с другими безразмерными величинами, во избежание путаницы, следует указывать величину, к которой относится указанное значение.
Моляльность (молярная весовая концентрация, моляльная концентрация)[править | править код]
| определение | Моляльная концентрация (моляльность,[5] молярная весовая концентрация) — количество растворённого вещества (число моль) в 1000 г растворителя. |
|---|---|
| обозначение |  Примечание: чтобы не путать с массой, в тех формулах где применяется моляльность, массу обозначают как Примечание: чтобы не путать с массой, в тех формулах где применяется моляльность, массу обозначают как 
|
| единицы измерения | моль/кг.
Также распространено выражение в «моляльности». Так, раствор с концентрацией 0,5 моль/кг называют 0,5-мольным. |
| формула |
где:
|
Следует обратить особое внимание, что, несмотря на сходство названий, молярная концентрация и моляльность — величины различные. Прежде всего, в отличие от молярной концентрации, при выражении концентрации в моляльности расчёт ведут на массу растворителя, а не на объём раствора. Моляльность, в отличие от молярной концентрации, не зависит от температуры.
Массовая концентрация (Титр)[править | править код]
| определение | Массовая концентрация — отношение массы растворённого вещества к объёму раствора. |
|---|---|
| обозначение |  или или  — по рекомендации ИЮПАК[8]. — по рекомендации ИЮПАК[8].
|
| единицы измерения | доли,
%масс (для выражения в %масс следует умножить указанное выражение на 100 %) |
| формула |
где:
|
В аналитической химии используется понятие титр по растворённому или по определяемому веществу (обозначается буквой 
Концентрация частиц[править | править код]
| определение | Концентрация частиц — отношение числа частиц N к объёму V, в котором они находятся |
|---|---|
| обозначение |  — по рекомендации ИЮПАК[9]. — по рекомендации ИЮПАК[9].
однако также часто встречается обозначение |
| единицы измерения | м−3 — в системе СИ,
1/л |
| формула |
где:
|
Весообъёмные (массо-объёмные) проценты[править | править код]
Иногда встречается использование так называемых «весообъёмных процентов»[10], которые соответствуют массовой концентрации вещества, где единица измерения г/(100 мл) заменена на процент. Этот способ выражения используют, например, в спектрофотометрии, если неизвестна молярная масса вещества или если неизвестен состав смеси, а также по традиции в фармакопейном анализе.[11] Стоит отметить, что поскольку масса и объём имеют разные размерности, использование процентов для их соотношения формально некорректно. Также международное бюро мер и весов[12] и ИЮПАК[13] не рекомендуют добавлять дополнительные метки (например «% (m/m)» для обозначения массовой доли) к единицам измерения.
Другие способы выражения концентрации[править | править код]
Существуют и другие, распространённые в определённых областях знаний или технологиях, методы выражения концентрации. Например, при приготовлении растворов кислот в лабораторной практике часто указывают, сколько объёмных частей воды приходится на одну объёмную часть концентрированной кислоты (например, 1:3). Иногда используют также отношение масс (отношение массы растворённого вещества к массе растворителя) и отношение объёмов (аналогично, отношение объёма растворяемого вещества к объёму растворителя).
Применимость способов выражения концентрации растворов, их свойства[править | править код]
В связи с тем, что моляльность, массовая доля, мольная доля не включают в себя значения объёмов, концентрация таких растворов остаётся неизменной при изменении температуры. Молярность, объёмная доля, титр, нормальность изменяются при изменении температуры, так как при этом изменяется плотность растворов. Именно моляльность используется в формулах повышения температуры кипения и понижения температуры замерзания растворов.
Разные виды выражения концентрации растворов применяются в разных сферах деятельности, в соответствии с удобством применения и приготовления растворов заданных концентраций. Так, титр раствора удобен в аналитической химии для волюмометрии (титриметрического анализа) и т. п.
Формулы перехода от одних выражений концентраций к другим[править | править код]
В зависимости от выбранной формулы погрешность конвертации колеблется от нуля до некоторого знака после запятой.
От молярности к нормальности[править | править код]
,
где:
От молярности к титру[править | править код]
,
где:
— молярная концентрация;
— молярная масса растворённого вещества.
Если молярная концентрация выражена в моль/л, а молярная масса — в г/моль, то для выражения ответа в г/мл его следует разделить на 1000 мл/л.
От массовой доли к молярности[править | править код]
,
где:
Если плотность раствора выражена в г/мл, а молярная масса в г/моль, то для выражения ответа в моль/л выражение следует домножить на 1000 мл/л. Если массовая доля выражена в процентах, то выражение следует также разделить на 100 %.
От массовой доли к титру[править | править код]
,
где:
От моляльности к молярности[править | править код]

где:
— моляльность,
— масса растворителя,
— суммарный объём раствора,
От моляльности к мольной доле[править | править код]
,
где:
— моляльность,
— молярная масса растворителя.
Если моляльность выражена в моль/кг, а молярная масса растворителя в г/моль, то единицу в формуле следует представить как 1000 г/кг, чтобы слагаемые в знаменателе имели одинаковые единицы измерения.
Сводная таблица[править | править код]
| ωB | φB | xB | cB | CB | mB | TB | |||
|---|---|---|---|---|---|---|---|---|---|
| массовая доля | г/г | ωB | 
|

|

|

|

|

|

|
| объёмная доля | л/л | φB | 
|

|
|||||
| мольная доля | моль/моль | xB | 
|

|

|

|
|||
| молярность | моль/л | cB | 
|

|

|

|
|||
| нормальность | моль-экв/л | c((1/z) B) | 
|

|
|||||
| концентрация частиц | 1/л | CB | 
|

|

|
||||
| моляльность | моль/кгр-ля | mB | 
|

|
|||||
| титр | г/мл | TB | 
|

|

|
— моляльность вещества B,
— масса вещества B,
— масса растворителя,
— масса раствора,
— титр (массовая концентрация) B,
— плотность вещества B,
— плотность раствора,
— суммарный объём раствора,
— постоянная Авогадро,
— количество частиц вещества В,
— количество вещества В,
— количество раствора,
— молярная масса,
Примечания[править | править код]
- ↑ International Union of Pure and Applied Chemistry. concentration (англ.) // IUPAC Compendium of Chemical Terminology. — Research Triagle Park, NC: IUPAC. — ISBN 0967855098. — doi:10.1351/goldbook.C01222. Архивировано 20 июля 2018 года.
- ↑ International Union of Pure and Applied Chemistry. fraction (англ.) // IUPAC Compendium of Chemical Terminology. — Research Triagle Park, NC: IUPAC. — ISBN 0967855098. — doi:10.1351/goldbook.F02494. Архивировано 20 августа 2018 года.
- ↑ IUPAC Gold Book internet edition: «concentration».
- ↑ International Union of Pure and Applied Chemistry. IUPAC Gold Book – mass fraction, w (англ.). goldbook.iupac.org. Дата обращения: 11 декабря 2018. Архивировано 13 декабря 2018 года.
- ↑ 1 2 3 Z. Sobecka, W. Choiński, P. Majorek. Dictionary of Chemistry and Chemical Technology: In Six Languages: English / German / Spanish / French / Polish / Russian. — Elsevier, 2013-09-24. — С. 641. — 1334 с. — ISBN 9781483284439.
- ↑ International Union of Pure and Applied Chemistry. IUPAC Gold Book – amount concentration, c (англ.). goldbook.iupac.org. Дата обращения: 11 декабря 2018. Архивировано 21 декабря 2018 года.
- ↑ International Union of Pure and Applied Chemistry. IUPAC Gold Book – amount fraction, x ( y for gaseous mixtures) (англ.). goldbook.iupac.org. Дата обращения: 11 декабря 2018. Архивировано 22 декабря 2018 года.
- ↑ International Union of Pure and Applied Chemistry. IUPAC Gold Book – mass concentration, γ, ρ (англ.). goldbook.iupac.org. Дата обращения: 16 декабря 2018. Архивировано 7 декабря 2018 года.
- ↑ International Union of Pure and Applied Chemistry. IUPAC Gold Book – number concentration, C,n (англ.). goldbook.iupac.org. Дата обращения: 11 декабря 2018. Архивировано 22 декабря 2018 года.
- ↑ Способы приготовления растворов на МедКурс. Ru. Дата обращения: 24 апреля 2012. Архивировано 29 октября 2012 года.
- ↑ Бернштейн И. Я., Каминский Ю. Л. Спектрофотометрический анализ в органической химии. — 2-е изд. — Ленинград: Химия, 1986. — с. 5
- ↑ The International System of Units (SI). www.bipm.org. Дата обращения: 23 декабря 2018. Архивировано из оригинала 14 августа 2017 года.
- ↑ Quantities, Units and Symbols in Physical Chemistry. www.iupac.org. Дата обращения: 23 декабря 2018. Архивировано из оригинала 20 декабря 2016 года.