найди число атомов каждого элемента в молекуле оксида углерода, если массовая доля углерода в нём равна (42,86) %, а массовая доля кислорода — (57,14) %.
1. Примем массу оксида равной (100) г. Масса углерода в такой порции равна (42,86) г, а масса кислорода — (57,14) г.
2. Находим относительные атомные массы элементов в Периодической таблице:
3. Обозначаем число атомов углерода как (x), а число атомов кислорода — (y), и записываем отношение масс:
.
4. Получаем выражение:
5. Находим отношение (x : y):
.
В молекуле оксида углерода на (1) атом углерода приходится (1) атом кислорода.
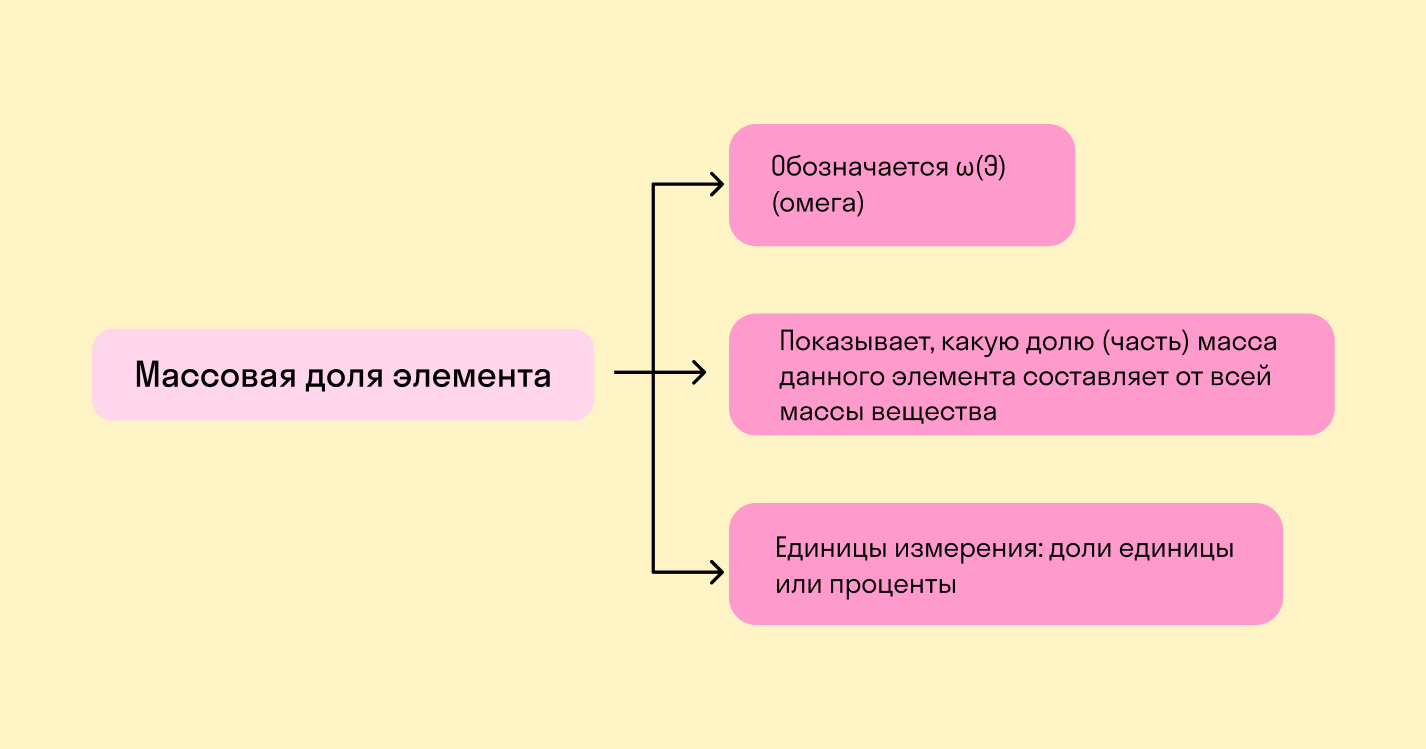
Что такое массовая доля
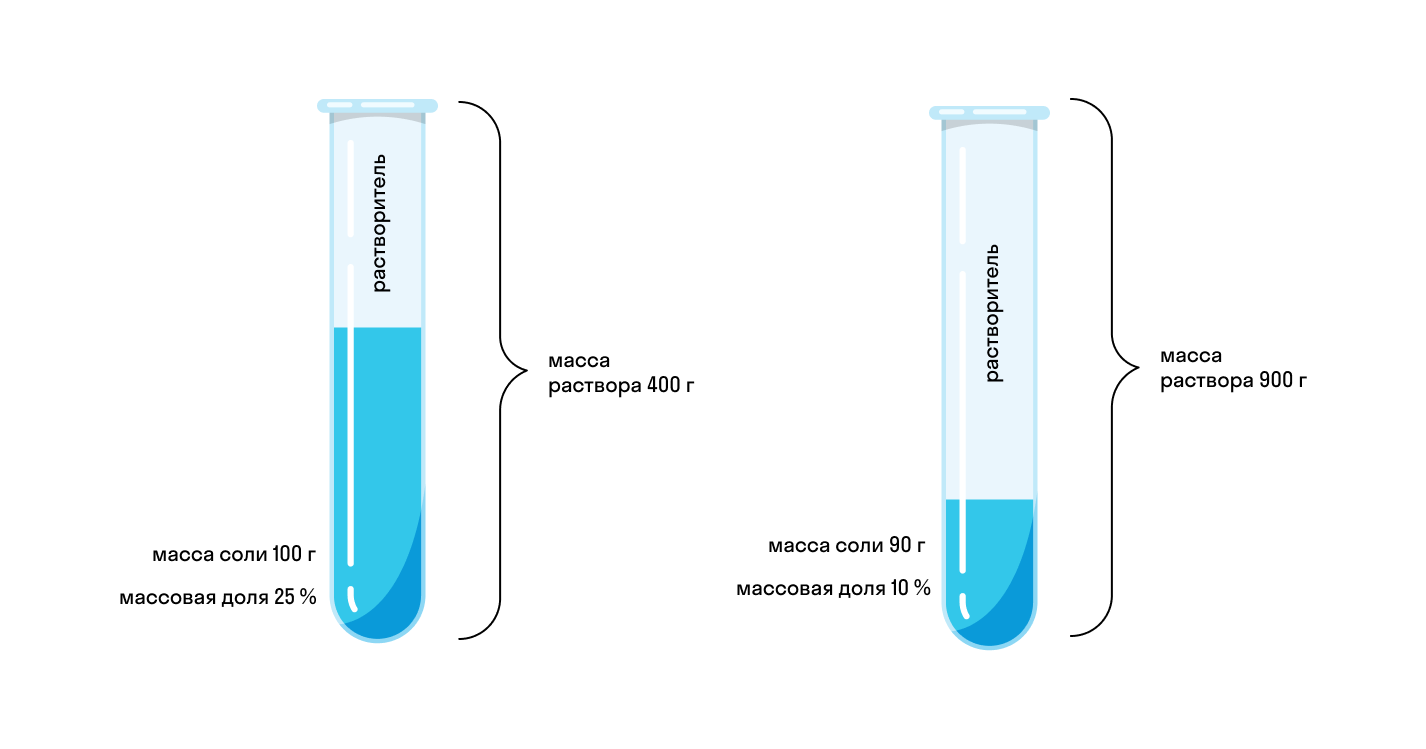
Начнем с примера: допустим, мы приготовили два раствора соли. Первый имеет массу 400 г и для него использовано 100 г соли. Масса второго 900 г и для него использовали 90 г соли. Какой раствор будет более концентрированным? Чтобы это понять, нужно выяснить процент соли в каждом растворе. Можно сказать иначе — нужно определить, какую долю в растворе занимает соль.
Массовая доля — это отношение растворенного вещества к массе раствора. Она может измеряться в процентах (от 0 до 100%) или в долях от единицы (от 0 до 1).
Как найти массовую долю растворенного вещества, расскажет формула:
где
— обозначение массовой доли;
— масса вещества;
— масса раствора.
В нашем примере и без формул понятно, что в первом растворе соль занимает 25%, а в то втором — только 10%. А что будет, если в первый раствор добавить еще столько же соли и воды? Очевидно, что на концентрацию это не повлияет. Доля соли останется прежней, пусть даже масса раствора увеличилась.
Массовая доля химического элемента — это отношение между относительной массой его атомов и относительной молекулярной массой соединения, частью которого является данный элемент.
Как видите, фактическая масса сложного вещества или его отдельного компонента не имеет значения. Если мы не знаем этих показателей, для расчетов берутся относительные величины.
Такое определение массовой доли элемента выражается формулой:
В данном случае:
-
— количество атомов искомого элемента;
-
— относительная атомная масса элемента;
-
— относительная молекулярная масса сложного вещества.
Если нужен показатель в процентах, результат надо умножить на 100%.
Получай лайфхаки, статьи, видео и чек-листы по обучению на почту
Полезные подарки для родителей
В колесе фортуны — гарантированные призы, которые помогут наладить учебный процесс и выстроить отношения с ребёнком!
Относительная атомная и молекулярная масса
В формуле нахождения массовой доли мы видим две важные составляющие: относительную массу атома элемента (Ar) и относительную массу молекулы вещества (Mr). Разберемся, что это такое. И та, и другая величина — это отношение реальной массы к эталонной единице, за которую взята 1/12 массы атома углерода.
Относительная атомная масса элемента (Ar) говорит о том, насколько масса его атома больше 1/12 массы атома углерода. Для каждого элемента эта величина является постоянной и ее можно увидеть в таблице Менделеева.
Относительная молекулярная масса соединения (Mr) складывается из относительных атомных масс всех элементов в составе его молекулы. Она показывает, насколько молекула вещества больше 1/12 массы атома углерода.
Это не измеряемые величины, то есть они не имеют единиц измерения. Буква r в обозначениях относительной атомной и молекулярной массы восходит к английскому слову relative — «относительный».
Важно
Численно относительная молекулярная масса вещества равна его молярной массе, что удобно использовать в расчетах. Но путать эти два понятия не стоит. Относительная молекулярная масса характеризует 1 молекулу вещества, в то время как молярная масса — 1 моль вещества.
Как найти массовую долю элемента в веществе
Выше мы рассмотрели формулу для вычисления массовой доли химического элемента в веществе и узнали, откуда берутся ее составляющие. Применим эти знания на практике.
Пример 1
Оксид магния массой 8 г образовался при вступлении 4,8 г магния в реакцию с кислородом. Каковы массовые доли магния и кислорода в полученном оксиде?
Решение:
Для начала вычислим массу кислорода. Согласно закону сохранения массы веществ в соединении можно воспользоваться формулой m(O) = m(MgO) − m(Mg).
m(O) = 8 − 4,8 = 3,2 г
Вспоминаем, как найти массовую долю элемента в веществе: нужно понять, какую часть соединения оно составляет.
Зная массы каждого компонента оксида, сделать расчет несложно:
или
.
или
.
Ответ: массовые доли магния и кислорода в оксиде магния составляют 60% и 40% соответственно.
Пример 2
Потренируемся находить массовую долю элемента в сложном веществе. Определим, какую часть этилового спирта С2H6O составляет водород.
Решение:
В данном случае у нас нет конкретных указаний на массы элементов или всего вещества. Но мы можем воспользоваться другой формулой массовой доли в химии, которая позволяет работать с относительными величинами:
, значит
.
Согласно таблице Менделеева относительная атомная масса водорода равна единице.
Ar(H) = 1.
Вычислим относительную молекулярную массу соединения С2H6O, которая складывается из соответствующих масс каждого элемента:
Mr(С2H6O) = 2M(C) + 6M(H) + M(O) = 212 + 6 1 + 16 = 46.
Полученные данные подставим в формулу и определим массовую долю элемента в соединении:
или
.
Ответ: в этиловом спирте массовая доля водорода составляет 13%.
Как вычислить массовую долю вещества в растворе
Вспомним, что такое концентрация раствора. Она говорит о том, в каком соотношении находятся растворенное вещество и растворитель, а другими словами — сколько растворенного вещества содержится в единице объема или массы. Концентрация может быть безразмерной величиной и выражаться в процентах, но также ее можно выразить в массовых или в молярных долях.
Важно
Указание массовой доли вещества — один из способов выражения концентрации раствора.
В случае с растворами применима та же формула:
Если нужно значение в процентах, результат надо умножить на 100%.
Пример
Требуется приготовить 0,5 л раствора карбоната натрия плотностью 1,13 г/мл. Определите массу карбоната натрия при условии, что концентрация раствора должна быть 13%.
Решение:
Вначале нам нужно узнать массу раствора, что легко сделать, когда известны его объем и плотность. Воспользуется формулой m(р–ра) = ρ × V
m(р–ра) = 500 × 1,13 = 565 г.
Дальше вспомним, как находить массовую долю растворенного вещества:
, а значит
.
Поскольку концентрация раствора — это и есть массовая доля растворенного вещества, подставим ее в уравнение:
m(Э) = 0,13 × 565 = 73,45 г.
Ответ: для раствора понадобится 73,45 г карбоната натрия.
Вопросы для самопроверки:
-
Как обозначается массовая доля и в чем она выражается?
-
В чем разница между молекулярной массой вещества и его молярной массой?
-
Как найти массовую долю элемента в веществе, если мы знаем массу элемента и массу вещества?
-
Как рассчитать массовую долю вещества в растворе?
-
В каких безразмерных и размерных величинах можно выразить концентрацию раствора?
Химическая формула соединения рассказывает нам не только о том, из каких элементов состоит вещества, но и о соотношении элементов в веществе. Давайте, например, посмотрим на серную кислоту Н2SO4 и сернистую кислоту H2SO3. Это два разных вещества, хотя оба состоят из водорода Н, серы S и кислорода О. Но из-за того, что соотношения элементов в них разное (в серной кислоте 4 атома кислорода, а в сернистой – 3), свойства у них тоже разные.
Используя химическую формулу, можно узнать и массовую доля элемента в соединении.
Массовая доля элемента в соединении показывает, какую часть составляет масса конкретного элемента от массы вещества.
Чтобы понять это сложное (на первый взгляд сложное, на самом деле оно простое) определения, представьте, что вы принесли из магазина пакет с покупками. В нём батон хлеба, пачка масла, два эскимо и упаковка чипсов. Весит пакет 1 килограмм. Какой вклад в это вносят чипсы? Пусть чипсы весят 50 граммов. Значит, от 1 килограмма (всей массы пакета с покупками) на чипсы приходится всего 50 граммов. Значит, можно посчитать, что чипсы – всего лишь 0,05 часть от всей массы пакета с покупками (50/1000=0,05).
Более удобно вычислять массовую долю в процентах, поэтому можно записать простую пропорцию:
1 килограмм (весь пакет с покупками) – 100%
50 граммов (упаковка чипсов) – Х%
Отсюда Х=50 г*100%/1000 г=5%. То есть массовая доля чипсов в пакете с покупками – 5%.
Теперь перейдём от покупок в супермаркете к химическим формулам.
Пример 1.
Определите массовую долю водорода и хлора в хлориде водорода.
Решение:
Формула хлорида водорода HCl. Чтобы определить массовые доли, нужно посчитать по таблице Менделеева молекулярную массу хлорида водорода. Она составляет 36,5 (1+35,5).
Из формулы мы видим, что в составе молекулы 1 атом водорода и 1 атом хлора. Обязательно обращайте на это внимание! Из примеров ниже будет видно, что это очень важно. Итак, составим пропорцию для определения массовой доли водорода:
36,5 (молекулярная масса соединения) – 100%
1 (атомная масса 1 атома водорода, входящего в соединение) – Х%
Отсюда Х=1*100/36,5=2,7%
Аналогично для хлора:
36,5 (молекулярная масса соединения) – 100%
35,5 (атомная масса 1 атома водорода, входящего в соединение) – Y%
Y=35,5*100/36,5=97,3%.
Таким образом, ответ: в хлориде водорода массовая доля водорода 2,7%, массовая доля хлора 97,3%.
Не лишним будет себя проверить, сложив все массовые доли. В сумме они должны давать 100 процентов. В нашем случае массовая доля водорода 2,7%+массовая доля хлора 97,3%=100%. Значит, мы всё сделали верно.
Пример 2.
Определите массовые доли углерода и кислорода в углекислом газе.
Решение:
Формула углекислого газа СО2. Обратите внимание, что здесь 2 атома кислорода. Это очень важно!
Теперь посчитаем молекулярную массу СО2, используя периодическую таблицу. Она будет равна 44: 12 (атомная масса углерода)+2*16 (атомная масса кислорода, умноженная на 2, потому что в формуле 2 атома кислорода).
Переходим к расчёту массовых долей с помощью пропорций.
Для углерода:
44 (молекулярная масса СО2) – 100%
12 (атомная масса 1 атома углерода) – Х%
Х=12*100/44=27,3%
Для кислорода:
44 (молекулярная масса СО2) – 100%
32 (масса 2 атомов кислорода, входящих в формулу) – Y%
Y=32*100/44=72,7%
Здесь мы взяли не 16 (атомная масса кислорода), а 32 потому, что в формуле СО2 2 атома кислорода. Помните, что выше я обращала на это внимание? Не упускайте это из виду, иначе будут ошибки.
Но ответ мы уже получили: в углекислом газе массовая доля углерода 27,3%, массовая доля кислорода 72,7%. (Проверим себя, сложив массовые доли: 27,3+72,7=100. Значит, всё верно).
Пример 3.
Этот пример от строгого репетитора по химии, который готовит к огэ по химии. Итак, найдите массовые доли алюминия и кислорода в оксиде алюминия.
Решение:
Формула оксида алюминия Al2O3. Не забудьте учесть число атомов алюминия и кислорода (как в примере выше)!
Сначала найдём молекулярную массу оксида алюминия, пользуясь таблицей Менделеева. Атомная масса алюминия 27, атомная масса кислорода 16. Молекулярная масса Al2O3 2*27+3*16 (потому что у нас 2 атома алюминия и 3 атома кислорода)=102.
Рассчитываем массовые доли.
Для алюминия:
102 (молекулярная масса Al2O3) – 100%
54 (масса 2 атомов алюминия, входящих в формулу) – Х%
Х=54*100/102=52,9%
Для кислорода:
102 (молекулярная масса Al2O3) – 100%
48 (масса 3 атомов кислорода, входящих в формулу) – Y%
Y=48*100/102=47,1%
Ответ: в оксиде алюминия массовая доля алюминия 52,9%, массовая доля кислорода 47,1% (проверка: 52,9+47,1=100).
А можно узнать формулу соединения, если известны массовые доли? И сделать это очень просто.
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Загрузить PDF
Загрузить PDF
Массовый процент задает процентное соотношение элементов в химическом соединении.[1]
Для нахождения массового процента необходимо знать молярную массу (в граммах на моль) входящих в соединение элементов или количество граммов каждого компонента, необходимое для того, чтобы получить заданный раствор.[2]
Массовый процент вычисляется довольно просто: достаточно поделить массу элемента (или компонента) на массу всего соединения (или раствора).
-
1
Выберите уравнение для определения массового процента химического соединения. Массовый процент находится по следующей формуле: массовый процент = (масса компонента/общая масса соединения) x 100. Для получения процентов результат деления умножается на 100.[3]
- В начале решения задачи запишите равенство: массовый процент = (масса компонента/общая масса соединения) x 100.
- Масса интересующего вас компонента должна быть в условии задачи. Если масса не дана, перейдите к следующему разделу, в котором рассказано о том, как определять массовый процент при неизвестной массе.
- Общая масса химического соединения находится путем сложения масс всех элементов (компонентов), которые входят в состав этого соединения (или раствора).
-
2
Вычислите общую массу соединения. Если вы знаете массы всех составляющих соединение компонентов, просто сложите их, и таким образом вы найдете общую массу получившегося соединения или раствора. Эту массу вы используете в качестве знаменателя в уравнении для массового процента.[4]
- Пример 1: Чему равен массовый процент 5 граммов гидроксида натрия, растворенного в 100 граммах воды?
- Общая масса раствора равна сумме количества гидроксида натрия и воды: 100 г + 5 г дают 105 г.
- Пример 2: Сколько хлорида натрия и воды необходимо для получения 175 граммов 15-процентного раствора?
- В этом примере даны общая масса и необходимый процент, и требуется найти количество вещества, которое необходимо добавить в раствор. При этом общая масса составляет 175 граммов.
- Пример 1: Чему равен массовый процент 5 граммов гидроксида натрия, растворенного в 100 граммах воды?
-
3
Определите массу заданного компонента. Если вас просят вычислить “массовый процент”, следует найти, сколько процентов от общей массы вещества составляет масса определенного компонента. Запишите массу заданного компонента. Это будет числитель в формуле для массового процента.[5]
- Пример 1: масса заданного компонента — гидрохлорида натрия — составляет 5 граммов.
- Пример 2: в этом примере масса заданного компонента неизвестна, и ее следует найти.
-
4
Подставьте значения в уравнение для массового процента. После того как вы определите все необходимые величины, подставьте их в формулу.
- Пример 1: массовый процент = (масса компонента/общая масса соединения) x 100 = (5 г/105 г) x 100.
- Пример 2: необходимо преобразовать формулу для массового процента так, чтобы можно было найти неизвестную массу химического компонента: масса компонента = (массовый процент*общая масса соединения)/100 = (15*175)/100.
-
5
Вычислите массовый процент. После подстановки всех значений в формулу для массового процента произведите необходимые вычисления. Поделите массу компонента на общую массу химического соединения или раствора и умножьте на 100. В результате у вас получится массовый процент данного компонента.
- Пример 1: (5/105) x 100 = 0,04761 x 100 = 4,761%. Таким образом, массовый процент 5 граммов гидрохлорида натрия, растворенного в 100 граммах воды, составляет 4,761%.
- Пример 2: переписанное выражение для массового процента компонента имеет вид (массовый процент*общая масса вещества)/100, откуда находим: (15*175)/100 = (2625)/100 = 26,25 граммов хлорида натрия.
- Необходимое количество воды находим путем вычитания массы компонента из общей массы раствора: 175 – 26,25 = 148,75 граммов воды.
Реклама
-
1
Выберите формулу для массового процента химического соединения. Основное уравнение для нахождения массового процента выглядит следующим образом: массовый процент = (молярная масса элемента/общая молекулярная масса соединения) x 100. Молярная масса вещества — это масса одного моля данного вещества, в то время как молекулярная масса представляет собой массу одного моля всего химического соединения.[6]
Чтобы получить проценты, результат деления умножается на 100.[7]
- В начале решения задачи запишите равенство: массовый процент = (молярная масса элемента/общая молекулярная масса соединения) x 100.
- Обе величины измеряются в граммах на моль (г/моль).
- Если вам не даны массы, массовый процент какого-либо элемента в заданном веществе можно найти, используя молярную массу.
- Пример 1: Найти массовый процент водорода в молекуле воды.
- Пример 2: Найти массовый процент углерода в молекуле глюкозы.
-
2
Запишите химическую формулу. Если в примере не даны химические формулы заданных веществ, следует записать их самостоятельно. Если же в задании даны необходимые формулы химических веществ, данный шаг можно пропустить и перейти сразу к следующему шагу (найти массу каждого элемента).
- Пример 1: запишите химическую формулу воды, H2O.
- Пример 2: запишите химическую формулу глюкозы, C6H12O6.
-
3
Найдите массу каждого элемента, входящего в соединение. Определите молярный вес каждого элемента в химической формуле по таблице Менделеева. Как правило, масса элемента указывается под его химическим символом. Выпишите молярные массы всех элементов, которые входят в рассматриваемое соединение.[8]
- Пример 1: найдите молярные массы кислорода (15,9994) и водорода (1,0079).[9]
- Пример 2: найдите молярные массы углерода (12,0107), кислорода (15,9994) и водорода (1,0079).
- Пример 1: найдите молярные массы кислорода (15,9994) и водорода (1,0079).[9]
-
4
Умножьте молярную массу каждого элемента на его мольную долю. Определите, сколько молей каждого элемента содержится в данном химическом веществе, то есть мольные доли элементов. Мольные доли даются числами, стоящими в формуле внизу символов элементов. Умножьте молярную массу каждого элемента на его молярную долю.[10]
- Пример 1: под символом водорода стоит 2, а под символом кислорода 1 (эквивалентно отсутствию числа). Таким образом, молярную массу водорода следует умножить на 2: 1,00794 X 2 = 2,01588; молярную массу кислорода оставляем прежней, 15,9994 (то есть умножаем на 1).
- Пример 2: под символом углерода стоит 6, под водородом 12 и под кислородом 6. Умножая молярные массы элементов на эти числа, находим:
- углерод: (12,0107*6) = 72,0642
- водород: (1,00794*12) = 12,09528
- кислород: (15,9994*6) = 95,9964
-
5
Вычислите общую массу соединения. Сложите найденные массы всех элементов, входящих в данное соединение. Сумма молярных масс элементов, помноженных на мольные доли, даст вам общую массу химического соединения. Это число является делителем в формуле для массового процента.[11]
- Пример 1: прибавьте к 2,01588 г/моль (масса двух молей атомов водорода) 15,9994 г/моль (масса одного моля атомов кислорода), в результате у вас получится 18,01528 г/моль.
- Пример 2: сложите найденные молярные массы: углерод + водород + кислород = 72,0642 + 12,09528 + 95,9964 = 180,156 г/моль.
-
6
Определите массу интересующего вас элемента. Если вас просят найти “массовый процент”, значит, следует вычислить массу определенного элемента, входящего в состав соединения, как процентную долю от общей массы всех элементов. Найдите массу заданного элемента и запишите ее. Для этого необходимо умножить молярную массу элемента на его мольную долю. В результате у вас получится величина, стоящая в числителе формулы для массового процента.[12]
- Пример 1: масса водорода в соединении составляет 2,01588 г/моль (масса двух молей атомов водорода).
- Пример 2: масса углерода в соединении составляет 72,0642 г/моль (масса шести молей атомов углерода).
-
7
Подставьте в уравнение для массового процента численные значения. После того, как вы определите значения всех величин, подставьте их в формулу, которая была приведена на первом шаге: массовый процент = (молярная масса элемента/общая молекулярная масса соединения) x 100.
- Пример 1: массовый процент = (молярная масса элемента/общая молекулярная масса соединения) x 100 = (2,01588/18,01528) x 100.
- Пример 2: массовый процент = (молярная масса элемента/общая молекулярная масса соединения) x 100 = (72,0642/180,156) x 100.
-
8
Вычислите массовый процент. После подстановки численных значений выполните необходимые арифметические действия. Поделите массу элемента на общую массу соединения и умножьте на 100. В результате у вас получится массовый процент элемента.
- Пример 1: массовый процент = (молярная масса элемента/общая молекулярная масса соединения) x 100 = (2,01588/18,01528) x 100 = 0,11189 x 100 = 11,18%. Таким образом, массовый процент атомов водорода в молекуле воды равен 11,18%.
- Пример 2: массовый процент = (молярная масса элемента/общая молекулярная масса соединения) x 100 = (72,0642/180,156) x 100 = 0,4000 x 100 = 40,00%. Таким образом, массовый процент атомов углерода в молекуле глюкозы составляет 40,00%.
Реклама
Об этой статье
Эту страницу просматривали 60 746 раз.
Была ли эта статья полезной?
Статьи
Линия УМК О. С. Габриеляна. Химия (8-9)
Химия
Массовая доля вещества
Ребятам, впервые пришедшим на урок химии, кажется: «Ух, какой отличный предмет. Столько разноцветных баночек и скляночек в лабораторном ящике. Вот сейчас я как нахимичу, друзья ахнут и выпадут в осадок».
Однако, при виде ровных рядков непонятных формул на доске энтузиазм у ребят испаряется быстрее, чем происходит взгонка кристаллов йода. Если подходить к химии, как к науке, которой нет места в реальной жизни, и просто заучивать ряды формул, то интерес может умереть очень быстро.
10 января 2019
Но все становится намного веселее, если поискать примеры химических реакций вокруг нас.
Костер в летнем походе, сквашивание овощей, изменение вкуса любимых блюд с помощью соли или сахара — это все химия.
Сегодня мы разберем одну из базовых тем «Массовая доля вещества в растворе».
Если хорошо изучить тему и научиться быстро решать задачи, можно не только определить, сколько ложек сахара бабушка добавила в свой чай, но и находить ответы на сложные криминалистические задачи.
Но перед тем, как приступить к практической части, стоит разобраться с теорией.
ОСНОВНЫЕ ТЕРМИНЫ
Основными терминами в этой теме будут:
-
Раствор — однородная смесь различных веществ в жидком виде.
-
Компоненты — вещества, которые подлежат смешиванию для получения раствора.
-
Растворитель — жидкий компонент, к которому добавляют субстанции для получения раствора.
-
Растворенное вещество — твердые или жидкие вещества, которые добавляют к растворителю для получения раствора.
-
Массовая доля — отношение массы вещества к массе раствора, в котором оно содержится.
-
Концентрация — отношение количества растворенного вещества к растворителю, выраженное в процентах.
Когда мы смешиваем между собой жидкости, которые идеально растворяются друг в друге, например воду и спирт, то можем любой из этих компонентов считать растворителем. Однако традиционно в водных растворах вода является растворителем, а второй ингредиент — растворенным веществом.
НЕОБХОДИМЫЕ ФОРМУЛЫ
Массовая доля вещества обозначается буквой греческого алфавита ω — омега. Чтобы ее определить, используется формула для вычисления массовой доли вещества.
ω (в-ва)= m (в-ва)/ m (р-ра) (1)
В этом равенстве массовая доля принимает значение от 0 до 1.
Однако в задачах чаще используется процентное соотношение, которое получается по следующей формуле:
ω (в-ва)= m (в-ва)/ m (р-ра)*100% (2)
Масса раствора равна сумме его компонентов.
m (р-ра)=m (в-ва)+m (р-ля) (3)
В случае двухкомпонентного раствора массовая доля растворенного вещества и массовая доля растворителя в сумме дают 100%
ω (в-ва)+ω (р-ля)=100% (4)
Масса раствора находится сложением масс компонентов, входящих в раствор
m (р-ра)=m (в-ва)+m (р-ля)(5)
Для успешного решения задачи на определение массовой доли вещества в растворе следует вспомнить еще одну формулу, которая связывает массу вещества, его объем и плотность.
m (в-ва)=p(в-ва)*V(в-ва) (6)
Напомним, что плотность воды составляет 1 г/мл. Это значит, что 100 мл воды весит ровно 100 гр.
Если возникает недопонимание теоретической части, более подробно теория изложена в учебнике «Химия. 8 класс» под редакцией О. С. Габриеляна, который можно найти на портале электронных учебников LECTA
#ADVERTISING_INSERT#