В уроке 25 «Соли» из курса «Химия для чайников» узнаем, как правильно называть соли, их состав и научимся составлять химические формулы солей.

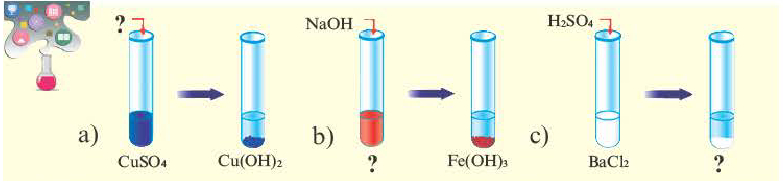
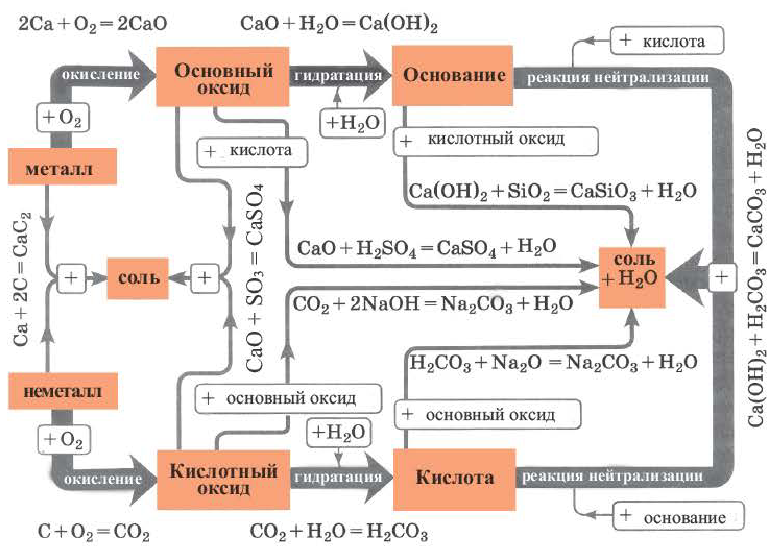
Как отмечалось в предыдущем уроке, в реакциях кислот с металлами выделяется простое вещество водород Н2. Кроме водорода, образуются и сложные вещества: ZnCl2, MgSO4 и др. Это представители класса широко распространенных в химии соединений — солей (рис. 102).

Здесь же мы рассмотрим состав солей, научимся составлять их формулы, узнаем, как называть соли.
Cостав солей
Сравним формулы кислот HCl и H2SO4 c формулами солей ZnCl2 и FeSO4. Мы видим, что в этих формулах одинаковые кислотные остатки Cl(I) и SO4(II). Но в молекулах кислот они соединены с атомами водорода Н, а в формульных единицах солей — с атомами цинка Zn и железа Fe. Значит, эти и другие соли можно рассматривать как продукты замещения атомов водорода в молекулах кислот на атомы металлов. Вещества, подобные ZnCl2 и FeSO4, относят к классу солей.
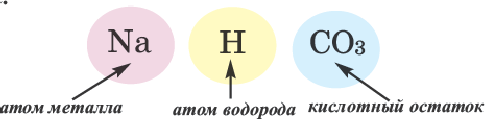
Соли — это сложные вещества, состоящие из атомов металлов и кислотных остатков.
В солях кислотные остатки соединяются с атомами металлов в соответствии с их валентностью. Для составления химической формулы соли необходимо знать валентность атома металла и валентность кислотного остатка. При этом пользуются тем же правилом, что и при составлении формул бинарных соединений. Для солей это правило следующее: сумма единиц валентности всех атомов металла должна быть равна сумме единиц валентности всех кислотных остатков.
Для примера составим формулу соли, в которую входят атомы кальция и кислотный остаток фосфорной кислоты PO4(III). Кальций проявляет постоянную валентность II, а валентность кислотного остатка PO4 равна III.

Названия солей
Соли образованы атомами разных металлов и различными кислотными остатками. Поэтому состав солей самый разнообразный. Давайте научимся давать им правильные названия.
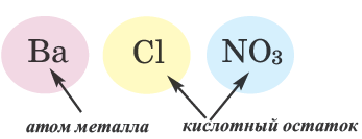
Название соли состоит из названия кислотного остатка и названия металла в родительном падеже. Например, соль состава NaCl называют «хлорид натрия».
Если входящий в формульную единицу соли атом металла имеет переменную валентность, то она указывается римской цифрой в круглых скобках после его названия. Так, соль FeCl3 называют «хлорид железа(III)», а cоль FeCl2 — «хлорид железа(II)».
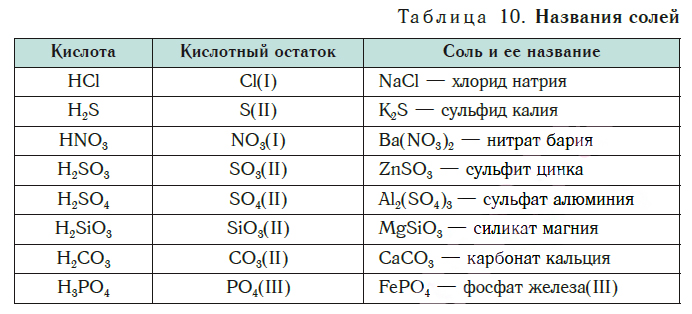
В таблице 10 приведены названия некоторых солей.
Соли — это вещества немолекулярного строения. Поэтому их состав выражают с помощью формульных единиц. В них отражено соотношение атомов металлов и кислотных остатков. Например, в формульной единице NaCl на один атом Na приходится один кислотный остаток Cl.
По химической формуле соли можно вычислить ее относительную формульную массу Mr, а также молярную массу M, например:
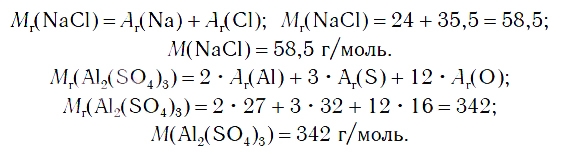
К солям относится не только поваренная соль (NaCl), но и мел, мрамор (СаСО3), сода (Na2CO3), марганцовка (KMnO4) и др.
Краткие выводы урока:
- Соли — сложные вещества, которые состоят из атомов металлов и кислотных остатков.
- Соли образуются при замещении атомов водорода в молекулах кислот на атомы металлов.
- Соли — вещества немолекулярного строения.
Надеюсь урок 25 «Соли» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Содержание:
Понятие о солях:
В предыдущем параграфе продукты замещения атомов водорода атомами металла имели формулы 
Для этого разделим каждую формулу черточкой на две части:
Легко заметить, что первая составная часть формулы представлена металлическими элементами, а вторая — кислотными остатками. Кроме рассмотренных примеров, существует много веществ, формулы которых содержат металлические и кислотные остатки. Все они относятся к классу соединений, который получил название соли.
Соли — это сложные вещества, образованные атомами металлов и кислотными остатками
В отличие от кислот, представители класса солей имеют немолекулярное строение, их структурными частями являются ионы — катионы металлов и анионы кислотных остатков.
Формулу солей в общем виде можно записать так:

Номенклатура солей
Номенклатура солей (речь пойдет о так называемых средних солях, которые соответствуют приведенной общей формуле и являются продуктами полного замещения атомов водорода в кислоте). Название солей состоит из двух слов: названия металлического элемента и названия кислотного остатка в именительном падеже, например 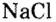 — хлорид натрия.
— хлорид натрия.
Если металл имеет переменную валентность, ее указывают в круглых скобках после его символа без интервала, например: 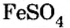 — сульфат железа
— сульфат железа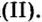
Кроме современных названий солей, которые отвечают указанным правилам, за некоторыми солями сохранились исторические названия, например: 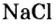 — поваренная соль.
— поваренная соль.
Определение валентности металлов в формулах солей и составление формул солей по валентности. Определяя валентность металла в формуле соли или составляя формулы солей, придерживаются общего правила, как при определении валентности элементов в бинарных соединениях и составлении их формул.
Сумма единиц валентности одной части формулы соли (атомов металла) равна сумме единиц валентности второй ее части (кислотного остатка).
Пример №
Определить валентность хрома в солях, формулы которых: 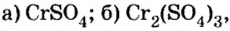 и назвать их.
и назвать их.
Решение
Обе соли содержат двухвалентный кислотный остаток серной кислоты.
Сумма единиц валентности кислотного остатка в первой формуле равна 2. Такой же должна быть и сумма валентностей атомов хрома. Поскольку атом хрома в этой формуле один, то обе валентности принадлежат ему. Следовательно, хром в формуле 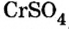 двухвалентен.
двухвалентен.
Во второй формуле кислотных остатков — три. Поэтому сумма единиц их валентностей составляет 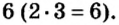 Атомов хрома в этой формуле два, а сумма единиц их валентностей также равна 6. Значит, валентность одного атома хрома в соединении составляет
Атомов хрома в этой формуле два, а сумма единиц их валентностей также равна 6. Значит, валентность одного атома хрома в соединении составляет 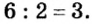
Ответ: 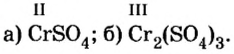
Пример №
Составить формулу нитрата алюминия.
Решение
1. Записываем символы металла и кислотного остатка: 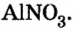
2. Над металлом и кислотным остатком проставляем валентность:
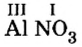
3. Для единиц валентности металла и кислотного остатка находим наименьшее общее кратное: это число 3.
4. Делением общего кратного 3 на валентность металла и кислотного остатка находим индексы:
а) 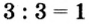 (индекс алюминия);
(индекс алюминия);
б) 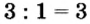 (индекс кислотного остатка).
(индекс кислотного остатка).
Полученные индексы вписываем в формулу нитрата алюминия: 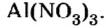
Ответ: 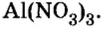
Из общей формулы солей следует, что индекс металла совпадает с валентностью кислотного остатка, а индекс кислотного остатка — с валентностью металла. Однако, как и у оксидов, в формулах кислот четных индексов нет. Поэтому при составлении формул кислот по валентности проводят сокращение четных индексов.
Физические свойства солей
При нормальных условиях соли находятся только в твердом состоянии. Это тугоплавкие кристаллические вещества, поэтому, чтобы перевести их в жидкое состояние, а тем более в парообразное, нужны высокие температуры. Так, температура плавления сульфида бария равна 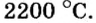
По способности растворяться в воде соли делят на растворимые (хлорид натрия, нитрат калия), малорастворимые (сульфит магния, хлорид свинца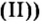 и нерастворимые (карбонат кальция, сульфат бария). Информация о растворимости солей и кислот содержится в таблице растворимости этих соединений в воде (см. Приложение).
и нерастворимые (карбонат кальция, сульфат бария). Информация о растворимости солей и кислот содержится в таблице растворимости этих соединений в воде (см. Приложение).
Соли — это вещества без запаха, разного вкуса. Может показаться, что класс веществ «Соли» получил такое название благодаря соленому вкусу его соединений. В действительности же с «чистым» соленым вкусом существует лишь одна соль, и вам она хорошо известна, это — хлорид натрия. Врачи предостерегают от избыточного употребления поваренной соли, однако в жизненно необходимых порциях хлорида натрия нуждается организм и человека, и животных. Она нужна для поддержания состава крови, а также вырабатывания желудочного сока. Физраствор, который используется для лечения больных,— ничто иное, как раствор хлорида натрия.
Соли бериллия — сладкие на вкус, соли магния — горькие, карбонат кальция (мел) — безвкусный. В большинстве своем соли имеют смешанный вкус — кисло-сладкий, горько-соленый.
Помните! В химическом кабинете соли ни в коем случае не пробуют на вкус!
Большинство солей белого цвета. Цвет перманганата калия 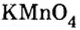 фиолетовый,хлорида железа
фиолетовый,хлорида железа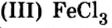 — коричнево-красный, ортофосфата серебра
— коричнево-красный, ортофосфата серебра 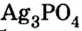 — желтый.
— желтый.
Внимательно рассмотрите образцы солей, которые учитель демонстрирует вам на урюке, и определите цвет и растворимость каждой из них.
Итоги:
- К классу солей относятся сложные вещества, образованные атомами металлов и кислотными остатками.
- В формулах солей сумма единиц валентности металла равна сумме единиц валентности кислотного остатка.
- Составляя формулу соли, необходимо знать валентность металла и кислотного остатка.
- По современной номенклатуре, названия солей образуют из названия металла и названия кислотного остатка и проставляют валентность металлов, у которых она имеет несколько значений.
Наиболее распространенной из солей угольной кислоты является карбонат кальция 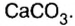 Кроме того, что эта соль — основная составляющая мрамора, мела, известняка, доломита, существует также несколько необычная форма нахождения ее в природе — из карбоната кальция и незначительного количества других веществ в теле некоторых моллюсков формируются жемчужины. Это округлые, гладкие, с перламутровым отблеском образования, в состав которых входит 86—90 % карбоната кальция, 6—12 % органического клейкого вещества конхиолина, выделяемого моллюском, когда в его раковину попадет посторонний предмет, и вода. Конхиолин крепко склеивает тоненькие пластинки карбоната кальция.
Кроме того, что эта соль — основная составляющая мрамора, мела, известняка, доломита, существует также несколько необычная форма нахождения ее в природе — из карбоната кальция и незначительного количества других веществ в теле некоторых моллюсков формируются жемчужины. Это округлые, гладкие, с перламутровым отблеском образования, в состав которых входит 86—90 % карбоната кальция, 6—12 % органического клейкого вещества конхиолина, выделяемого моллюском, когда в его раковину попадет посторонний предмет, и вода. Конхиолин крепко склеивает тоненькие пластинки карбоната кальция.
Жемчужина формируется в раковине моллюска вокруг раздражителей — чаще всего песчинок — и приблизительно за 12 лет вырастает величиной с горошину. Большие жемчужины правильной формы — чрезвычайная редкость.
Жемчуг издавна используют в качестве украшений. Особенно ценятся жемчужины правильной шарообразной формы. Они очень дорогостоящие: жемчужина диаметром 1 см стоит около 4000 долларов.
Средняя продолжительность хранения жемчужин составляет от 250 до 500 лет, после чего они теряют блеск и их легко измельчить в порошок.
Скелет других водных обитателей — коралловых полипов — по составу близок к жемчугу. Большие скопления коралловых полипов образуют коралловые рифы. В результате археологических раскопок обнаружилось, что люди издавна изготавливают украшения из кораллов (так называется скелет коралловых полипов). Благодаря несколько иному составу, чем у жемчужин, такие изделия сохраняются дольше. В зависимости от содержания органических веществ, кораллы бывают разного цвета: розовые, красные и даже черные. Изготовленные из таких кораллов украшения — ожерелья, серьги, кольца — считаются самыми дорогими. Владельцам кораллов нужно знать, что даже при легком нагревании эти драгоценности теряют свой цвет.
Что такое соли
К классу солей принадлежит соединение, которое мы употребляем ежедневно вместе с пищей. Это — поваренная соль 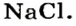 Вам известно, что она состоит из ионов
Вам известно, что она состоит из ионов 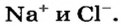
Соль — соединение, в состав которого входят катионы металлического элемента и анионы кислотного остатка.
Ион кислотного остатка имеет отрицательный заряд; его значение совпадает со значением валентности этого остатка:
- кислота
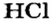
- кислотный остаток
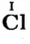
- анион кислотного остатка
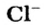
Формулы солей. Для солей, как и кислот, существуют две общие формулы — 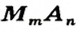 и
и 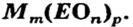 Первой формуле соответствуют соли, которые содержат анионы кислотных остатков безоксигеновых кислот, а второй — соли, анионы которых происходят от оксиген-содержащих кислот.
Первой формуле соответствуют соли, которые содержат анионы кислотных остатков безоксигеновых кислот, а второй — соли, анионы которых происходят от оксиген-содержащих кислот.
Примеры формул солей
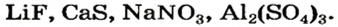
Для того чтобы составить формулу соли, необходимо знать заряды катиона и аниона, а также учитывать то, что соединение электро-нейтрально. Для выяснения значений зарядов ионов можно использовать таблицу, размещенную на форзаце 2 (так называемая таблица растворимости).
Составим формулу соли, которая содержит катионы 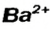 и анионы
и анионы 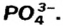 В состав соли входят ионы, значения зарядов которых не одинаковы: 2 и 3. Наименьшее число, которое делится без остатка на 2 и 3, — число 6. Делим его на значения зарядов катиона (6 : 2 = 3) и аниона (6:3 = 2). Получаем количество этих ионов в формульной единице соединения, т. е. соответствующие индексы в химической формуле соли:
В состав соли входят ионы, значения зарядов которых не одинаковы: 2 и 3. Наименьшее число, которое делится без остатка на 2 и 3, — число 6. Делим его на значения зарядов катиона (6 : 2 = 3) и аниона (6:3 = 2). Получаем количество этих ионов в формульной единице соединения, т. е. соответствующие индексы в химической формуле соли:
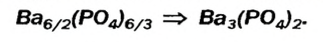
Графические формулы для солей, как и для других ионных соединений, не составляют.
Названия солей
Для каждой соли существует химическое название, а для некоторых солей — еще и тривиальные названия (табл. 2). Химическое название соли состоит из двух слов. Первое слово — название металлического элемента, а второе происходит от химического названия соответствующей кислоты.
Формулы и названия некоторых солей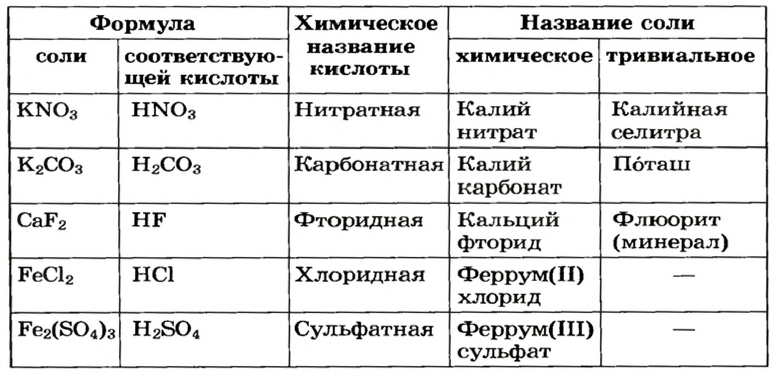
Если элемент имеет переменную валентность, то ее значение указывают после названия элемента (табл. 2, рис. 12). Склоняется только второе слово химического названия соли.

Существуют соли, образованные только неметаллическими элементами. В их состав входят катионы аммония 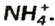 Примеры формул и названий таких соединений:
Примеры формул и названий таких соединений:
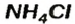 — аммоний хлорид;
— аммоний хлорид;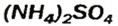 — аммоний сульфат;
— аммоний сульфат;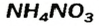 — аммоний нитрат.
— аммоний нитрат.
Два последних соединения применяют в качестве азотных удобрений.
Соли аммония происходят от основания 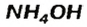 (§ 11).
(§ 11).
Распространенность в природе
В земной коре содержится много солей (рис. 13). В основном, это силикаты. Среди них встречаются и драгоценные камни: голубой топаз (алюминий силикат), золотистый циркон (цирконий силикат), бесцветный фенакит (бериллий силикат) и др.

Существует много залежей натрий хлорида NaCl (каменная соль), калий хлорида КС1, кальций карбоната СаС03 (мел, мрамор, известняк). Последнее соединение составляет основу ракушек, яичной скорлупы (рис. 14). Сульфиды 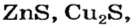
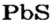 и другие являются рудами; из них получают металлы.
и другие являются рудами; из них получают металлы.

Различные соли находятся в растворенном состоянии в гидросфере. В морской воде преобладают хлориды Натрия и Магния, а в пресной — соли Кальция и Магния (в основном карбонатной и сульфатной кислот).
Выводы:
Соль — ионное соединение, в состав которого входят катионы металлического элемента и анионы кислотного остатка. Для солей существуют общие формулы 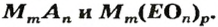
Каждая соль имеет химическое название, а некоторые соли — еще и тривиальные названия. Соли очень распространены в природе.
Свойства и применение солей
Физические свойства солей: Соли, как и другие ионные соединения, при обычных условиях являются кристаллическими веществами. Они обычно имеют высокие температуры плавления:
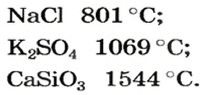
Часть солей растворяется в воде, некоторые являются малорастворимыми (рис. 31), а остальные — нерастворимые. Соответствующая информация помещена в таблице растворимости (форзац 2).

Образование растворов солей часто сопровождается тепловыми эффектами. Например, при растворении натрий карбоната выделяется небольшое количество теплоты и раствор немного нагревается. А во время приготовления раствора натрий нитрата можно зафиксировать незначительное понижение температуры.
Лишь одна соль — натрий хлорид — имеет соленый вкус. Многие другие растворимые соли горькие, а соли Плюмбума и Бериллия сладкие, но чрезвычайно ядовитые. Определяя вкус различных солей, некоторые алхимики, вероятно, поплатились за это жизнью.
Соли по-разному влияют на растения, животных, человека. Среди них есть соединения, которые содержат необходимые для растений элементы; их применяют в качестве удобрений. А поваренную соль мы ежедневно употребляем вместе с пищей, чтобы пополнить ее запасы в организме (это соединение постоянно выводится из организма вместе с потом и мочой).
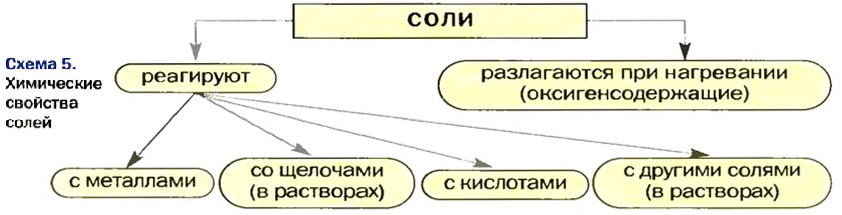
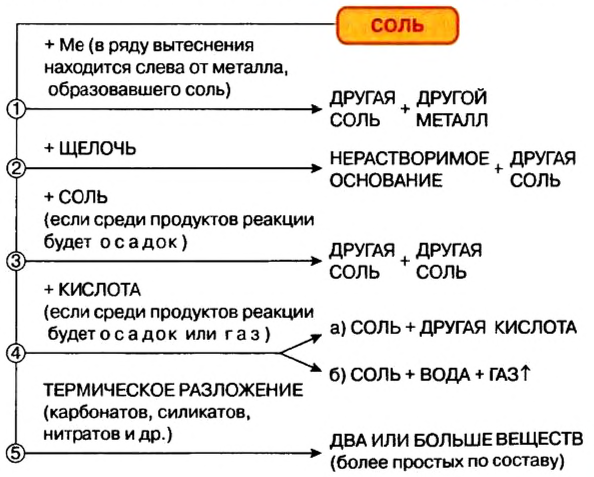
Химические свойства солей: Соли вступают в разнообразные реакции с простыми и сложными веществами.

Реакции с металлами
Соль в водном растворе может реагировать с металлом с образованием новой соли и другого металла (рис. 32). Часто говорят, что один металл «вытесняет» другой из раствора соли. Реакция происходит, если металл-реагент активнее, чем металл-продукт, т. е. находится в ряду активности слева от него (форзац 2):
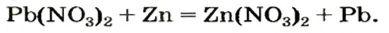
Изучая основания и кислоты, вы узнали о реакциях этих соединений с солями. Кроме того, соли также могут взаимодействовать друг с другом. Все упомянутые реакции относят к реакциям обмена.
Реакции со щелочами
Реакция между солью и щелочью происходит лишь в растворе (нерастворимые соли со щелочами не взаимодействуют). Она возможна, если один из ее продуктов — основание или соль — выпадает в осадок (рис. 33):
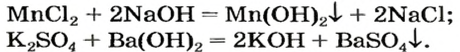
Для прогнозирования возможности таких реакций используют таблицу растворимости (форзац 2).
Если к раствору купрум(II) сульфата добавить столько раствора щелочи, сколько необходимо для полного превращения соли в купрум(II) гидроксид, то после отстаивания над осадком увидим бесцветный раствор. Он будет содержать лишь натрий сульфат (ионы 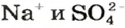 ).
).
Реакции с кислотами
Соль (как растворимая, так и нерастворимая) может взаимодействовать с кислотой с образованием новой соли и новой кислоты. Такие реакции часто сопровождаются выделением осадка (рис. 34) или газа
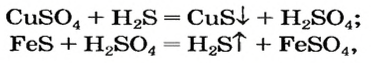
но иногда остаются незаметными:
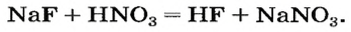
Случаи, в которых реакция между солью и кислотой возможна, указаны в §12(с. 81).


Реакции с другими солями
Взаимодействие между двумя солями происходит лишь в растворе (реагенты должны быть растворимыми в воде) с образованием двух новых солей. Реакция возможна, если один из ее продуктов выпадает в осадок (рис. 35), т. е. является нерастворимым или малорастворимым соединением.
Примеры реакций между двумя солями:
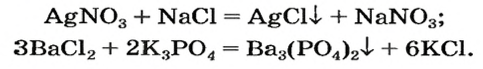
Термическое разложение солей
Оксиген-содержащие соли, образованные газообразными, летучими или неустойчивыми оксидами, при нагревании разлагаются. Продуктами этих реакций, как правило, являются два соответствующих оксида:
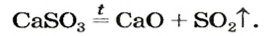
Нитраты, как и нитратная кислота, происходят от нитроген(V) оксида 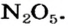 Однако при нагревании нитратов этот оксид не образуется, поскольку он термически неустойчив:
Однако при нагревании нитратов этот оксид не образуется, поскольку он термически неустойчив:
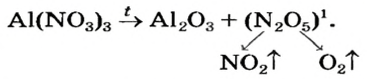
Соли щелочных элементов либо не разлагаются (карбонаты, сульфаты), либо их разложение происходит своеобразно. Некоторые из таких реакций используют в лаборатории для получения кислорода:
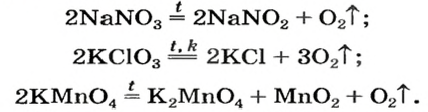
Изложенный материал обобщен в схеме 5.
1 – Так разлагаются нитраты металлических элементов от Магния до Купрума включительно (см. ряд активности металлов).
Применение солей
Многие соли применяются на практике. Натрий хлорид является сырьем для промышленного получения хлора, хлоридной кислоты, натрий гидроксида, соды. Это соединение незаменимо для приготовления пищи, консервирования. Хлорид, сульфат, нитрат Калия, фосфаты Кальция, некоторые другие соли применяют в качестве минеральных удобрений (рис. 36). Кальций карбонат в виде камня известняка используют в строительстве, а на заводах из него производят известь.

На основе искусственно полученной соли изготовляют зубную пасту. В школе пишут на доске мелом, а это — также кальций карбонат. Кальций сульфат (гипс) применяют в строительстве и медицине. Простым средством для мытья и чистки посуды, предметов домашнего обихода, смягчения воды перед стиркой является кальцинированная сода, или натрий карбонат. Кальцинированную соду вместе с мелом или известняком используют в производстве стекла.
Выводы:
Соли — ионные вещества. Они имеют высокие температуры плавления, различную растворимость в воде.
Соли взаимодействуют с металлами с образованием другой соли и другого металла. Такие реакции происходят, если металл-реагент более активный, чем металл-продукт (это определяют с помощью ряда активности металлов).
Соли вступают в реакции обмена со щелочами, кислотами, другими солями. Некоторые оксигенсодержащие соли при нагревании разлагаются на соответствующие оксиды. Многие соли используются на практике.
Кислые соли
Вы знаете, что при реакции кислоты со щелочью атомы Гидрогена каждой молекулы кислоты «заменяются» атомами (точнее — ионами) металлического элемента:
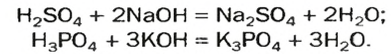
А возможна ли замена только части атомов Гидрогена в молекуле многоосновной кислоты? Да. В результате соответствующих реакций образуются так называемые кислые соли:
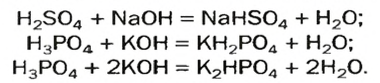
Кислые соли 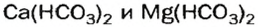 содержатся в растворенном состоянии в пресной воде. При ее кипячении эти соединения разлагаются
содержатся в растворенном состоянии в пресной воде. При ее кипячении эти соединения разлагаются
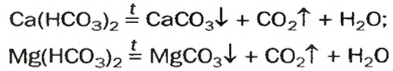
и на стенках сосуда образуется накипь — смесь карбонатов 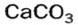 и
и 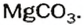
Кислые соли Кальция и ортофосфатной кислоты
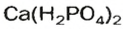 составляют основу фосфорных удобрений — преципитата и суперфосфата соответственно. Кислая соль Натрия и карбонатной кислоты
составляют основу фосфорных удобрений — преципитата и суперфосфата соответственно. Кислая соль Натрия и карбонатной кислоты  известна каждой домохозяйке, зто — питьевая (пищевая) сода (рис. 37).
известна каждой домохозяйке, зто — питьевая (пищевая) сода (рис. 37).

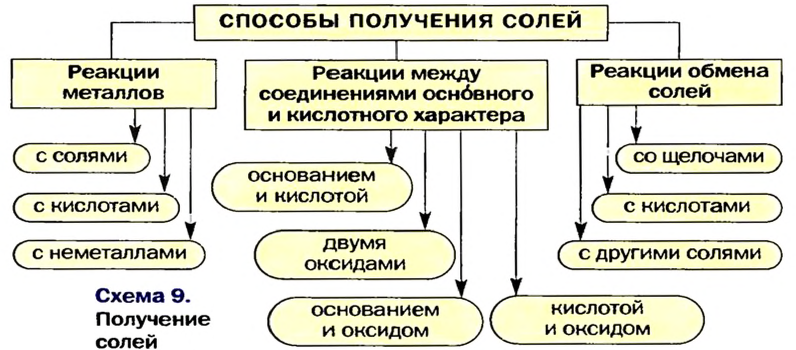
Способы получения солей
Соли можно получать значительно большим количеством способов, чем оксиды, основания или кислоты.
Три способа получения солей предполагают проведение химических реакций с участием металлов.
Способ 1: металл + неметалл 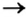 соль. Этим способом можно получать безоксиге-новые соли:
соль. Этим способом можно получать безоксиге-новые соли:
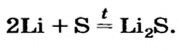
Способ 2: металл + кислота (раствор) 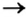 соль + водород.
соль + водород.
В такие реакции вступают сульфатная (в разбавленном растворе), хлоридная, некоторые другие кислоты и металлы, находящиеся в ряду активности слева от водорода:
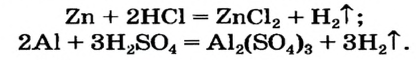
Способ 3: металл 1 + соль 1 (в растворе) 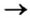 металл 2 + соль 2.
металл 2 + соль 2.
Вам известно, что такая реакция возможна, если металл 1 активнее металла 2, т. е. металл 1 находится в ряду активности слева от металла 2:
Несколько других способов получения солей предусматривают использование реакций между соединениями, которые проявляют основные и кислотные свойства (§ 9, 11 —13).
Способ 4: основание (амфотерный гидроксид) + кислота (амфотерный гидроксид) 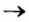 соль + вода (рис. 42):
соль + вода (рис. 42):
Способ 5: основный (амфотерный) оксид + кислотный (амфотерный) оксид 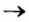 соль:
соль:
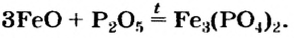
Способ 6: основание + кислотный (амфотерный) оксид 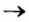 соль + вода:
соль + вода:
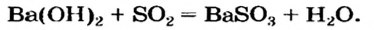
Способ 7: кислота + основный (амфотерный) оксид 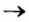 соль + вода:
соль + вода:
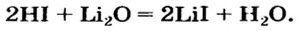
Соли также получают с помощью реакций обмена с участием солей (§ 14).
Способ 8: соль 1 + кислота 1  соль 2 + кислота 2:
соль 2 + кислота 2:
Способ 9: соль 1 + щелочь  соль 2 + основание:
соль 2 + основание:
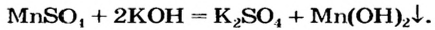
Способ 10: соль 1 -I- соль 2 —> соль 3 + соль 4 (рис. 43):
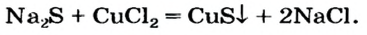
Это интересно. Солис 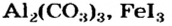 и некоторые другие до сих пор не получены.
и некоторые другие до сих пор не получены.

Способы 5 и 6 непригодны для получения солей безоксигеновых кислот, поскольку эти кислоты не имеют кислотных оксидов.
Выбирая способы 8—10, учитывают то, что реакция обмена возможна в случае образования осадка, газа или слабой кислоты (§11, 12, 14).
Вышеизложенное обобщено в схеме 9.
Пример №
Предложить максимальное количество способов получения магний сульфата 
Решение
Магний сульфат — оксигенсодержащая соль. Поэтому способ 1 для получения соединения не подходит.
Эту соль можно получить, исходя из металла (способы 2 и 3): 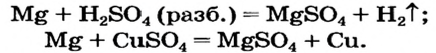
Магний сульфат может образоваться в результате реакций между соответствующими соединениями основного и кислотного характера (способы 4—7):
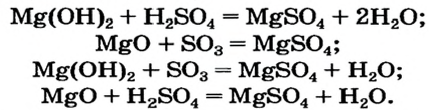
Для реакции соли с кислотой (способ 8) нужно взять соль Магния, образованную слабой или летучей кислотой либо способной разлагаться с выделением газа, и сульфатную кислоту:
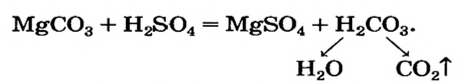
Реакция соли со щелочью (способ 9) для получения магний сульфата не подходит, поскольку одним из реагентов должен быть гидроксид 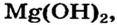 а он является малорастворимым соединением.
а он является малорастворимым соединением.
Магний сульфат растворяется в воде. Учитывая это, выберем для реакции между двумя солями (способ 10) такие реагенты:
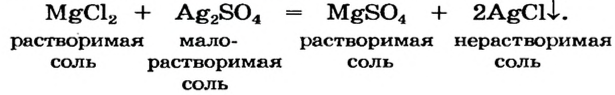
Выводы:
Соли получают несколькими способами. Часть способов основана на реакциях металлов с неметаллами, кислотами, солями. Другие способы предусматривают осуществление реакций между соединениями с основными и кислотными свойствами, а также реакций обмена с участием солей.
Химические свойства солей
Соли, как и другие классы неорганических соединений, способны участвовать в химических реакциях.
Взаимодействие солей с металлами
Соли (в растворе) взаимодействуют с металлами, расположенными в вытесни-тельном ряду до того металла, из атомов которого они образовались. В результате реакции образуются новая соль и металл.
Опыт 1. Четыре химических стакана наполним растворами солей: два — сульфатом меди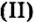 и еще два — сульфатом железа
и еще два — сульфатом железа В стакан с сульфатом меди
В стакан с сульфатом меди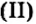 опустим железную пластину, второй оставим для сравнения. То же проделаем с растворами сульфата железа
опустим железную пластину, второй оставим для сравнения. То же проделаем с растворами сульфата железа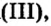 но в один из стаканов опустим медную пластину. Вскоре в стакане с железной пластиной голубой раствор станет светлее по сравнению с контрольным раствором. А в стакане с медной пластиной коричневая окраска раствора сульфата железа
но в один из стаканов опустим медную пластину. Вскоре в стакане с железной пластиной голубой раствор станет светлее по сравнению с контрольным раствором. А в стакане с медной пластиной коричневая окраска раствора сульфата железа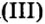 не изменится и будет одинаковой с контрольным раствором. Через 5—10 мин достанем железную пластину и увидим, что та ее часть, которая находилась в растворе сульфата меди
не изменится и будет одинаковой с контрольным раствором. Через 5—10 мин достанем железную пластину и увидим, что та ее часть, которая находилась в растворе сульфата меди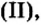 покрылась слоем меди. Достанем также медную пластину — с ней не произошло никаких изменений, и цвет растворов сульфата железа
покрылась слоем меди. Достанем также медную пластину — с ней не произошло никаких изменений, и цвет растворов сульфата железа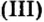 в обоих стаканах остался одинаковым. Запишем уравнения реакций:
в обоих стаканах остался одинаковым. Запишем уравнения реакций:
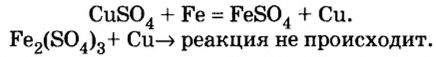
В реакции, которая состоялась, атомы простого вещества замещают атомы металлического элемента в сложном веществе. Поэтому эта реакция относится к реакциям замещения. Результаты опыта согласовываются с местом в вытеснительном ряду металлов, взятых для проведения опыта.
Взаимодействие солей с основаниями (щелочами)
В предыдущем параграфе вы узнали о том, что единственный способ, которым можно получить нерастворимое основание определенного металлического элемента,— это взаимодействие его растворенной в воде соли со щелочью. Такое взаимодействие мы рассматривали и при изучении свойств щелочей. Поэтому вспомним, что для протекания реакции вещества должны находиться в растворенном состоянии, а один из образовавшихся продуктов реакции — выпадать в осадок, например:
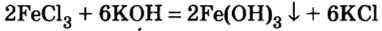
Взаимодействие солей с кислотами
Соли вступают в реакцию обмена с кислотами при условии, что среди продуктов реакции есть осадок или газ. (Вспомните взаимодействие соляной кислоты с нитратом серебра или питьевой соды — с уксусной кислотой.) Проведем соответствующие опыты.
Опыт 2. К раствору хлорида бария 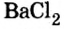 добавим раствор серной кислоты
добавим раствор серной кислоты 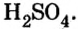 Реакция происходит быстро и завершается образованием белого осадка:
Реакция происходит быстро и завершается образованием белого осадка:
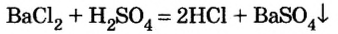
Среди образовавшихся продуктов нерастворимым веществом является сульфат бария.
Взаимодействие солей с солями
Повторим опыт 2, заменив серную кислоту на одну из ее растворимых солей.
Опыт 3. К раствору сульфата натрия 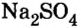 добавим раствор хлорида бария
добавим раствор хлорида бария 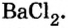 Взаимодействие происходит так же быстро, и так же образуется белый осадок:
Взаимодействие происходит так же быстро, и так же образуется белый осадок:
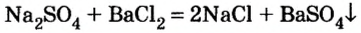
С помощью раствора хлорид бария или другого растворенного в воде соединения бария можно обнаружить в растворе серную кислоту и ее соли.
Опыт 4. К раствору карбоната натрия добавим раствор азотной кислоты. Наблюдается выделение газообразного вещества. Поднесенная к отверстию пробирки зажженная спичка гаснет. Следовательно, выделяется углекислый газ:
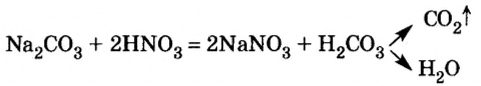
Для формулировки окончательного обоснованного вывода о химических свойствах солей проведите химический эксперимент, предусмотренный лабораторными опытами 7, 8, 9.
Итоги:
- Взаимодействие солей с другими веществами происходит в растворе.
- Одним из продуктов взаимодействия солей с другими веществами всегда является соль.
- Соли проявляют такие типичные химические свойства:
- Соли серной кислоты можно обнаружить в растворе с помощью растворов солей бария.
Соли, при образовании которых в молекуле кислоты все атомы водорода замещаются атомами металла, получили название средних солей. Средние соли не содержат ни атомов водорода, ни гидроксильных групп, а в их состав входят атомы одного металлического элемента, например: 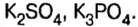
Кроме средних, существуют еще и другие соли, в частности кислые, основные, двойные.
Кислые соли являются продуктом неполного замещения атомов водорода в молекуле кислоты на металл. Поэтому кислотные остатки таких солей содержат атомы водорода, например: 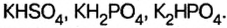
В молекулах серной и ортофосфорной кислот замещен на металл 1 атом водорода, поэтому остатки 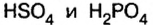 одновалентны. В формуле
одновалентны. В формуле  замещены на металл 2 атома водорода, следовательно, валентность кислотного остатка
замещены на металл 2 атома водорода, следовательно, валентность кислотного остатка  равна 2. Как видим, кислые соли образуются кислотами, которые содержат 2 и более атомов водорода. Наличие одного атома водорода в составе кислых солей обозначают, добавляя слово «гидро», двух — «дигидро»:
равна 2. Как видим, кислые соли образуются кислотами, которые содержат 2 и более атомов водорода. Наличие одного атома водорода в составе кислых солей обозначают, добавляя слово «гидро», двух — «дигидро»:  — гидросульфат калия;
— гидросульфат калия; 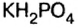 — дигидросульфат калия;
— дигидросульфат калия; 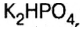 — гидрофосфат калия.
— гидрофосфат калия.
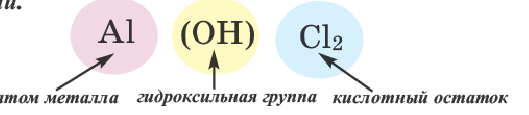
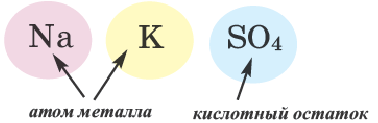
Основными называют соли, полученные частичной нейтрализацией основания кислотой (например,  — гидроксохлорид магния), двойными — соли, полученные замещением атомов водорода атомами двух металлов (например,
— гидроксохлорид магния), двойными — соли, полученные замещением атомов водорода атомами двух металлов (например, 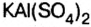 — сульфат калия алюминия).
— сульфат калия алюминия).
Какая образуется соль — средняя, кислая или основная — зависит от количества взятых для проведения реакции реагентов.
Соли в природе
По распространенности неорганических соединений в природе соли занимают второе место после оксидов. Так, горные породы и глина состоят из солей кремниевой кислоты, которые имеют сложное строение. Их формулы записывают с помощью формул оксидов, например формула полевого шпата — 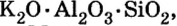 глины —
глины — 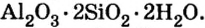
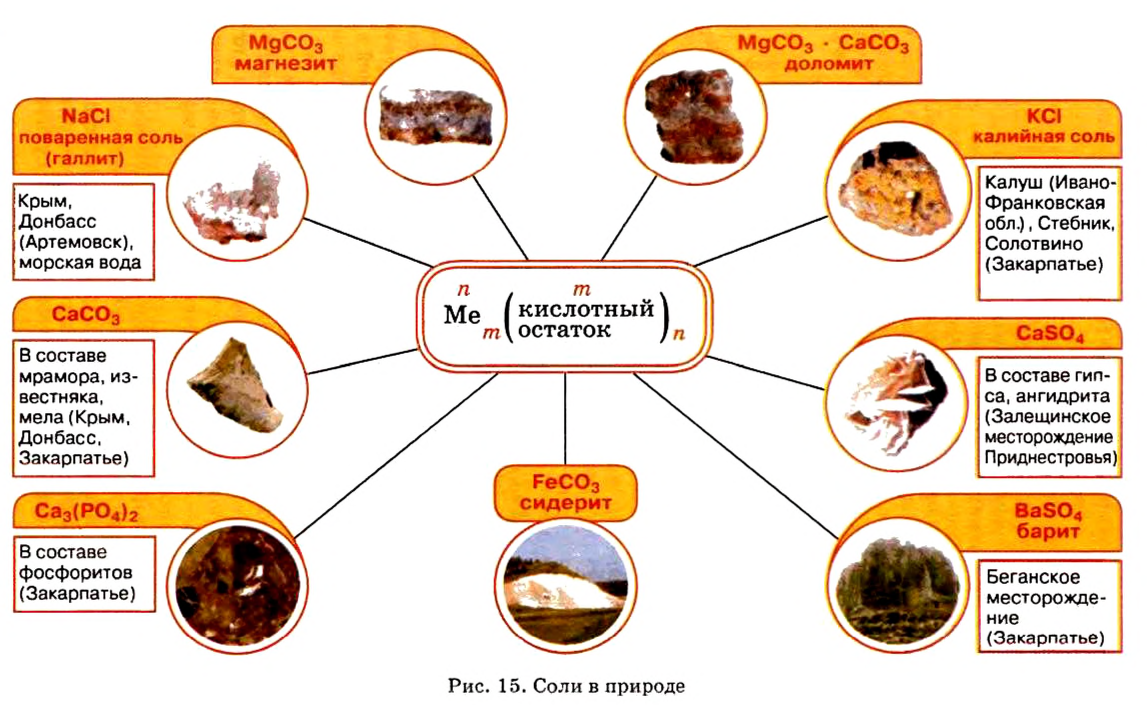
Местонахождение залежей солей в Украине представлено на рисунке 15.
Наиболее известная вам соль — хлорид натрия 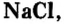 или поваренная соль (минерал такого состава называется галит). Месторождения этой соли в Украине расположены вблизи г. Артемовен Донецкой области, в Автономной Республике Крым, в Карпатах. Человек очень давно оценил значение хлорида натрия и стал использовать эту соль как пищевой продукт и консервант (соление рыбы, мяса, грибов, квашение овощей и т. п.). Было время, когда соль стоила дороже золота: еще в старину возник обычай встречать гостей хлебом-солью. Существует поговорка: «Чтобы узнать человека, нужно с ним пуд соли съесть». Пуд долгое время был распространенной единицей массы, он равен 16 кг. Человек за год потребляет около 3 кг соли. Нетрудно подсчитать, что два человека пуд соли съедят примерно за 2,5—3 года. Так жизненный опыт подтверждает мудрость этой поговорки.
или поваренная соль (минерал такого состава называется галит). Месторождения этой соли в Украине расположены вблизи г. Артемовен Донецкой области, в Автономной Республике Крым, в Карпатах. Человек очень давно оценил значение хлорида натрия и стал использовать эту соль как пищевой продукт и консервант (соление рыбы, мяса, грибов, квашение овощей и т. п.). Было время, когда соль стоила дороже золота: еще в старину возник обычай встречать гостей хлебом-солью. Существует поговорка: «Чтобы узнать человека, нужно с ним пуд соли съесть». Пуд долгое время был распространенной единицей массы, он равен 16 кг. Человек за год потребляет около 3 кг соли. Нетрудно подсчитать, что два человека пуд соли съедят примерно за 2,5—3 года. Так жизненный опыт подтверждает мудрость этой поговорки.
Как сырье хлорид натрия используется для производства гидроксида натрия, натрия, хлора, соляной кислоты, мыла, синтетических моющих средств. В пищевой, кондитерской и фармацевтической промышленности используют такие соли: хлорид натрия, карбонат натрия, нитрат натрия, сульфат магния и другие.
Карбонат кальция 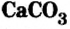 является основной составляющей известняка, мрамора, мела. Известняк используют для получения оксида кальция (негашеной извести), известкования кислых почв (уменьшение в них содержания кислот), удаления из состава чугуна (во время его производства) таких кислотных оксидов, как оксид кремния
является основной составляющей известняка, мрамора, мела. Известняк используют для получения оксида кальция (негашеной извести), известкования кислых почв (уменьшение в них содержания кислот), удаления из состава чугуна (во время его производства) таких кислотных оксидов, как оксид кремния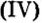 и оксид фосфора
и оксид фосфора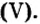 Вместе с глиной и песком известняк используют в производстве цемента.
Вместе с глиной и песком известняк используют в производстве цемента.
Кости позвоночных животных и человека содержат ортофосфат кальция 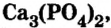 а зубы — еще и фторид кальция
а зубы — еще и фторид кальция 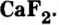 Если на зубной пасте отмечено, что она содержит фтор, в действительности это означает наличие в ней фторида кальция и других соединений фтора.
Если на зубной пасте отмечено, что она содержит фтор, в действительности это означает наличие в ней фторида кальция и других соединений фтора.
Соли входят также в состав крови, клеточного сока, нервной и мускульной тканей.
Из курсов природоведения и ботаники вам известно, что для полноценного роста и развития растениям нужны химические элементы калий, азот, фосфор. Их вносят в почву в виде минеральных удобрений. По своему составу почти все минеральные удобрения — это соли, в частности 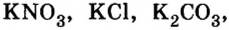
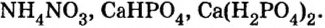
Широко применяется и соль сульфата кальция 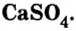 Порошок природного минерала гипса
Порошок природного минерала гипса 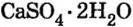 нагревают до температуры
нагревают до температуры 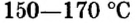 и превращают в алебастр
и превращают в алебастр 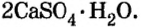 Как видно из приведенных формул, в алебастре на 1 моль сульфата кальция приходится в 4 раза меньше молей воды, чем в гипсе. Гипсовые повязки, гипсовые строительные материалы, барельефы, статуи и т. п. сделаны из алебастра, который после смешивания с водой твердеет и становится гипсом.
Как видно из приведенных формул, в алебастре на 1 моль сульфата кальция приходится в 4 раза меньше молей воды, чем в гипсе. Гипсовые повязки, гипсовые строительные материалы, барельефы, статуи и т. п. сделаны из алебастра, который после смешивания с водой твердеет и становится гипсом.
Карбонат натрия 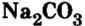 применяют для изготовления стекла, бумаги, тканей, в мыловарении.
применяют для изготовления стекла, бумаги, тканей, в мыловарении.
В плавательных бассейнах цвет воды обусловлен наличием в ней сульфата меди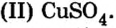 Эту соль добавляют в воду не для подкрашивания, а чтобы не допустить размножения и роста водорослей.
Эту соль добавляют в воду не для подкрашивания, а чтобы не допустить размножения и роста водорослей.
Хлорид калия 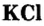 распространен в природе в виде минерала сильвина. Это вещество используют в качестве калийного удобрения, а также в производстве калия и гидроксида калия.
распространен в природе в виде минерала сильвина. Это вещество используют в качестве калийного удобрения, а также в производстве калия и гидроксида калия.
Из ортофосфата кальция 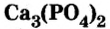 получают ортофосфорную кислоту и фосфорные удобрения.
получают ортофосфорную кислоту и фосфорные удобрения.
Сульфат бария 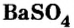 применяют как рентгеноконтрастное вещество в медицинской практике.
применяют как рентгеноконтрастное вещество в медицинской практике.
Ознакомившись с рисунком 16, вы пополните знания о применении солей новыми сведениями.
Приведенные здесь примеры — лишь небольшая часть того, как используются соли.

Итоги:
- Соли относятся к распространенным в природе сложным неорганическим веществам, среди которых больше всего хлоридов, силикатов, карбонатов, сульфатов, ортофосфатов.
- Часть солей используется непосредственно после добычи, а часть поддается химической переработке с целью получения новых веществ.
- Соли находят самое разнообразное применение в химической промышленности и многих других отраслях народного хозяйства, а также в быту.
Вода морей и океанов из-за содержащихся в ней различных солей на вкус солено-горькая. 100 г морской воды в среднем содержат 3,5 г солей, среди которых хлорида натрия почти 78 %. Моря и океаны имеют разную соленость — YaK называют содержание солей в единице объема морской воды. Однако состав солей в морской воде практически одинаков. Поэтому ученые считают, что Мировой океан в давние времена был единым.
Морские растения и животные приспособились к жизни в соленой воде. Более того, в их организмах накапливаются ионы, которые входят в состав солей морей и океанов. Морепродукты богаты кальцием, кремнием, иодом, медью, магнием, фосфором и другими элементами.
Используя сведения из географии и различных информационных источников, подготовьте рассказ (сообщение, реферат) о распространении какой-либо соли в природе и ее использовании.
Поработайте самостоятельно с дополнительной литературой, Интернетом и выясните, на каких химических свойствах солей основывается производство из них других веществ. Рассказ подтвердите примерами.
Справочный материал по солям
Соли можно получить многими способами:
1) взаимодействием металла с кислотой:
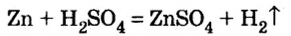
(Какой это тип реакции?)
Вспомните особенности взаимодействия кислот с металлами. Для получения солей каких металлов можно применить этот способ?
2) взаимодействием оксида металла с кислотой:
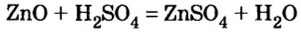
3) взаимодействием гидроксида металла с кислотой:
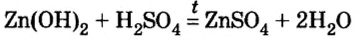
4) взаимодействием соли с кислотой:
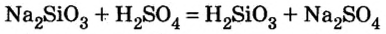
5) взаимодействием основного или амфотерного оксида с кислотным оксидом:
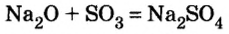
6) взаимодействием металла с раствором соли другого металла:
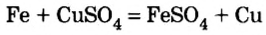
7) взаимодействием металла с неметаллом (получают соли бескислородных кислот):
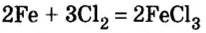
Итоги:
- В результате химических реакций образуются различные соединения. Это позволяет из соответствующих реагентов получать необходимые вещества.
- К общим способам получения оксидов относятся: окисление простых и сложных веществ, разложение нерастворимых гидроксидов при нагревании и др.
- К общим способам получения растворимых оснований (щелочей) относятся: взаимодействие металлов с водой, взаимодействие оксидов с водой и электролиз (разложение) растворов солей бескислородных кислот.
- Нерастворимые основания получают взаимодействием раствора их соли с раствором щелочи.
- Соли получают взаимодействием простого вещества (металла), сложных веществ (оксида металла, гидроксида металла, соли) с веществами, в состав которых входит кислотный остаток (кислота, соль), а также взаимодействием кислотных оксидов с основными оксидами или щелочами.
В лаборатории щелочь можно получить из металла и из оксида. Но чистых металлов натрия, калия, кальция, бария и их оксидов в природе не существует. Поэтому этими способами получают щелочи лишь в лабораториях. Чтобы обеспечить щелочами различные производства, нужны другие способы их получения из природного сырья. Впервые щелочь была получена электролизом (разложением постоянным электрическим током) раствора соли хлорида натрия. Электролиз стал основным промышленным способом производства щелочей гидроксида натрия и гидроксида калия.
Как происходит электролиз, вы будете изучать позже. А пока запишем суммарное уравнение электролиза водного раствора хлорида натрия:
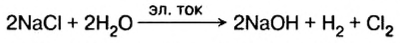
Из записи уравнения видно, что из доступных природных веществ — поваренной соли и воды — получают три новых вещества, которых в природе нет, но каждое из них используется в промышленности, а значит есть потребность в их получении.
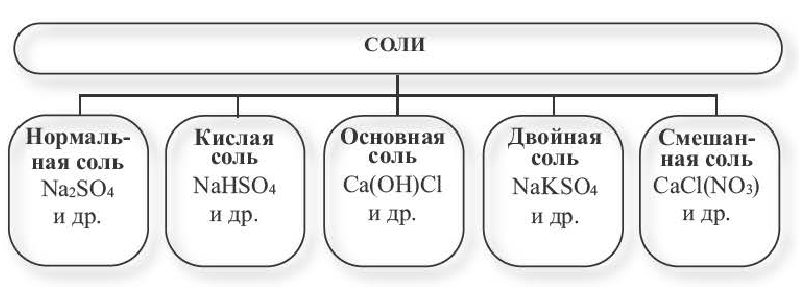
Классификация
Заполните таблицу.
| Химическая формула | Название | Тип соли |
| (CuOH)2CO3 | ? | ? |
| Fe2(SO4)3 | ? | ? |
| (NH4)2Cr2O7 | ? | ? |
| BaClNO3 | ? | ? |
| NaKSO4 | ? | ? |
Какие соли вам известны ? Как можно отличить соли друг от друга?
Соли получаются в результате замещения атомов водорода в молекуле кислоты атомами металла, а в основаниях гидроксильной группы (ОН.) кислотными остатками.
Солями называются вещества, в составе которых содержатся атомы металла (или аммония) и кислотный остаток. Соли классифицируют по их составу.
Графические формулы
Нормальные, кислые и двойные соли рассматриваются как продукты замещения атомов водорода в молекуле кислоты атомами металла.
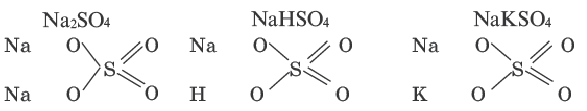
Основные же соли рассматриваются как продукты замещения гидроксильной группы кислотным остатком.

Номенклатура
Нормальные соли. Соли, полученные в результате полного замещения атомов водорода, относящихся к основности кислот, атомами металлов, называются нормальными солями.
При наименовании нормальных солей, если металл обладает постоянной валентностью, то вначале дается название кислотного остатка, а затем название металла. Если же металл имеет переменную валентность, то вначале дается название кислотного остатка, следом название металла и его валентность (в скобках римскими цифрами).
| Нормальная соль | Название | Нормальная соль | Название | |
| Ah(SO4)3 | Сульфат алюминия | FeSO4 | Сульфат железа (II) |
Кислые соли
Соли, полученные в результате частичного замещения атомов водорода, относящихся к основности кислоты, атомами металлов (или же сложными ионами, например, ионами аммония), называются кислыми солями.
При наименовании кислых солей вначале дается название кислотного остатка с указанием на греческом количества атомов водорода, относящихся к основности кислоты и не замещенных металлом, с приставкой «гидро». При одном атоме водорода приставка «моно» не употребляется.
| Кислые соли | ||||
| Гидросоли | Дигидросоли | |||
| Формула | Название | Формула | Название | |
| CaHPO4 | гидроортофосфат кальция | NH4H2PO4 | дигидроортофосфат аммония |
Основные соли
Соли, полученные в результате частичного замещения гидроксильных групп оснований кислотными остатками, называются основными солями.
Как и нормальные соли, при наименовании основных солей к кислотным остаткам здесь добавляется приставка «гидроксо» с указанием на греческом количества гидроксильных групп (ОН), не замещенных кислотным остатком. Если гидроксильная группа одна, то приставка «моно» не употребляется.
| Основные соли | ||||
| Гидросоли | Дигидросоли | |||
| Формула | Название | Формула | Название | |
| Al(OH)Cl2 | гидроксохлорид алюминия | Al(OH)2Cl | дигидроксохлорид алюминия |
Двойные соли. Соли, полученные в результате замещения атомами двух разных металлов атомов водорода, относящихся к основности кислот в многоосновных кислотах, называются двойными солями.
При наименовании двойных солей после названия кислотного остатка даются оба названия металлов.
| Двойная соль | Название | Двойная соль | Название |
| NaKCO3 | карбонат натрия-калия | Na2KPO4 | ортофосфат динатрия-калия |
Смешанные соли
Соли, полученные в результате замещения гидроксильных групп в многокислотных основаниях двумя различными кислотными остатками, называются смешанными солями.
Если в составе смешанных солей содержатся бескислородные и кислородсодержащие кислотные остатки, то вначале даются названия бескислородных, а затем кислородсодержащих кислотных остатков.
| Смешанная соль | Название | Смешанная соль | Название |
| CaCl(OCl) (или CaOC2) | Хлорид гипохлорит кальция | BaClNO3 | хлорид нитрат бария |
Получение
При взаимодействии металлов с неметаллами
2Fe + ЗСЕ  2FeCl3
2FeCl3
2Na + Cl2  2NaCl
2NaCl
При взаимодействии металлов с солями. Начиная с элемента Mg в ряду активности металлов, каждый металл вытесняет последующие металлы из растворов их солей.
Zn + CuSO4 → ZnSO4 + Cu
При взаимодействии солей с солями. Такие реакции протекают в растворе в том случае, если обе исходные соли растворимы в воде и при их взаимодействии получится нерастворимая в воде соль.
Ca(NO3)2 + Na2CO3 → CaCO3↓ + 2NaNO3
Соли не вступают в реакцию с нерастворимыми в воде солями и основаниями.
Ca(NO3)2 + Cu(OH)2  реакция не протекает
реакция не протекает
При взаимодействии однокислотных оснований с одноосновными кислотами, независимо от количества их молей, всегда получится нормальная соль.
KOH + HCI → KCl + H2O
При взаимодействии многоосновных кислот с многокислотными основаниями, в зависимости от количества молей веществ, получаются нормальная соль, кислая соль или основная соль. Для этого следует сравнить количество атомов водорода, показывающих основность кислоты, с количеством гидроксильных групп (ОН), выражающих кислотность основания.
При добавлении многоосновной кислоты к смеси двух различных оснований получится двойная соль.
NaOH + KOH + H2SO4 → 2H2O + NaKSO4
При нейтрализации одного многокислогного основания двумя различными кислотами получится смешанная соль.
Ca(OH)2+ HCl + HBr → CaClBr+ 2H2O
Физические и химические свойства солей
Определите вещества в соответствии с вопросительными знаками. Какие из представленных солей нерастворимы в воде?
Физические свойства:
Соли это твердые вещества с разной способностью к растворению и цветом. Все соли натрия (Na), калия (К) и аммония (NH ), а также кислые соли растворяются в воде. C увеличением количества атомов водорода, относящихся к основности кислых солей, увеличивается и их растворимость в воде (за исключением NaHCO3).
), а также кислые соли растворяются в воде. C увеличением количества атомов водорода, относящихся к основности кислых солей, увеличивается и их растворимость в воде (за исключением NaHCO3).
Ca3(PO4)2 → CaHPO4 → Ca(H2PQ4)2

увеличивается растворимость
Солям в основном присуща высокая температура плавления и кипения.
| Растворимость солей в воде | |
| Нерастворимые и малорастворимые | Растворимые |
| СaS04, BaS04, SrS04, PbS04, Ag2S04 | Остальные сульфаты растворяются в воде |
| AgCl, PbCl2, Hg2Cl2 | Другие хлориды растворяются в воде |
| FeS, CuS, PbS, ZnS и др. | Na2S, K2S, (NH4)2S |
| Другие ортофосфаты не растворяются вводе | Na3PO4, K3PO4, (NH4)3PO4 |
| Другие силикаты не растворяются в воде | Na2SiO3, K2SiO3 |
| Другие карбонаты не растворяются в воде | Na2CO3, K2CO3, (NH4)2CO3 |
| Все соли азотной кислоты, Na, К, NH4 растворяются в воде |
Химические свойства:
C химическими свойствами солей вы ознакомились при изучении свойств щелочей и кислот, способов получения оксидов и солей.
Кислые, основные, в том числе и двойные соли могут проявлять многие химические свойства нормальных солей. Кроме того, кислые соли легко нейтрализуются щелочами, а основные соли кислотами.
NaHSO4 + NaOH  Na2SO4 +H2O
Na2SO4 +H2O
Mg(OH)Cl + HCl → MgCl2 + H2O
Основные соли могут взаимодействовать с щелочами.
Al(OH)2Cl+ NaOH → Al(OH)3↓ +NaCl
При нагревании большинства кислых солей (кроме солей аммония) они разлагаются с образованием нормальной соли.
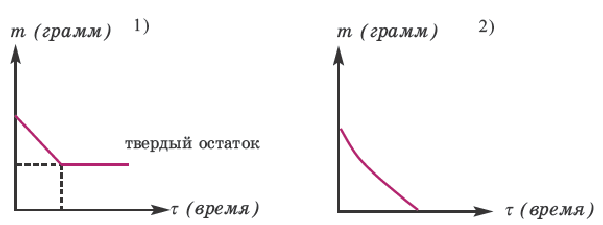
При разложении солей металлов (кроме Hg(NO3)2) всегда выделяется твердый остаток (или оксид металла, или же полученная новая соль в твердом виде). Поэтому разложение этих солей происходит как в 1-ом графике. При разложении большинства аммонийных солей твердый остаток не выделяется. Вот почему их разложение происходит как во 2-ом графике.
Некоторые соли при взаимодействии с водой образуют вещества кристаллогидраты.
Na2CO3 +10H2O → Na2CO3 . 10H2O
кристаллическая сода
При нагревании кристаллогидраты вновь обезвоживаются.
CuSO4 . 5H2O  CuSO4+ 5H2O
CuSO4+ 5H2O
синий кристалл белый кристалл
Вода, входящая в состав кристаллов в виде химических соединений, называется кристаллизационной водой. Кристаллогидрат это не просто набор из воды и соли, а вещество. Вода и соль лишь условно разделены точкой.
Многоосновные кислоты, вступая в реакцию соединения с нормальными солями, образуют кислую соль.
Применение солей
Большинство солей широко применяются в промышленности и быту. Так, например, всем хорошо известно применение поваренной соли (NaCl) в быту. В промышленности ее используют при получении гидроксида натрия, соды, хлора, натрия и др. Соли азотной и оргофосфорной кислот в основном считаются минеральными удобрениями.
Многие средства защиты растений от болезнетворных микробов и вредителей, ряд лекарственных препаратов также относятся к классу солей. Более подробные сведения о применении отдельных солей будут представлены при изучении химических элементов.
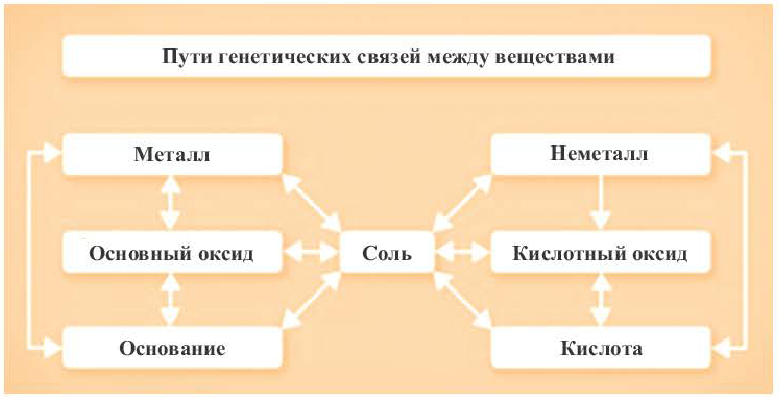
Генетическая связь между классами неорганических соединений
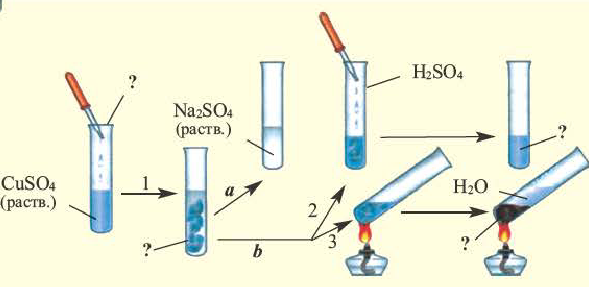
Обратите внимание на пробирки и содержащиеся в них вещества. Определите генетическую связь между этими веществами и запишите уравнения реакций.
Возможность получения из представителей одного класса неорганических соединений представителей другого класса свидетельствует о наличии между ними генетической связи. Взаимосвязь между веществами отдельных классов можно проследить по нижеприведенной схеме:
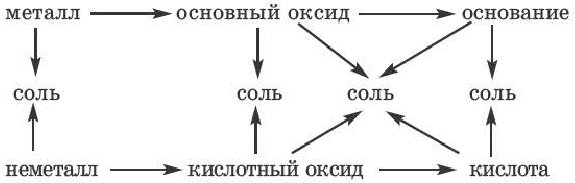
Получение одного представителя неорганических соединений из другого основывается на их химических свойствах. Приведем один пример относительно генетических связей неорганических соединений.
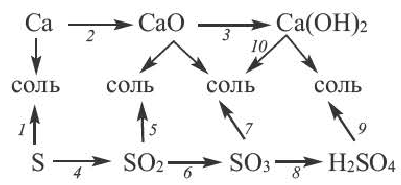
В качестве примера генетической связи между неорганическими веществами можно привести следующие схемы.
Задача:
Какие вещества взаимодействуют и с Na2CO3, и с Zn(OH)2?
1) HCl 2) MgSO4 3)K0H 4) Ca(OH)2 5) H2SO4
Решение: Na2CO3, вступая в реакцию с сильными кислотами (HC1, HBr, HI, HNO2, H2SO4, H2PO4), выделяет соль и CO2.
В таком случае:
1) Na2CO3+ 2HC1 → 2NaCl + C02↑ + H2O
2) Na2CO3+ H2SO4 → Na2SO4+ CO2↑ + H2O
Поскольку Zn(OH)2 является амфотерным основанием, оно вступает в реакцию как с сильными кислотами (HC1, HBr, HI, HNO3, H3PO4, H2SO4), так и с щелочами (NaOH, КОН, Ca(OH)2, Ba(OH)2). В таком случае:
1) Zn(OH)2+ 2HC1 → ZnCl2+ 2H2O
2) Ca(OH)2 + Zn(OH)2 → CaZnO + 2H2O
3) Zn(OH)2+ H2SO4→ ZnSO4+ 2H2O
В то время как Zn(OH)2 вступает в реакцию с КОН, Na2CO3 в эту реакцию не вступает.
C другой стороны, основание Zn(OH)2, находящееся в виде осадка, не вступает в реакцию ни с одной солью.
Ответ: 1, 4, 5
- Хлор в химии
- Сера в химии
- Азот в химии
- Фосфор в химии
- Озон как химический элемент
- Оксиды в химии
- Основания в химии
- Кислоты в химии
У этого термина существуют и другие значения, см. Соли (значения).

Со́ли — сложные вещества, состоящие из катионов металлов и анионов кислотных остатков. ИЮПАК определяет соли как химические соединения, состоящие из катионов и анионов[1]. Есть ещё одно определение: солями называют вещества, которые могут быть получены при взаимодействии кислот и оснований с выделением воды[2].
Кроме катионов металлов, в солях могут находиться катионы аммония NH4+, фосфония PH4+ и их органические производные, а также комплексные катионы и т. д. Анионами в солях выступают анионы кислотного остатка различных кислот Брёнстеда — как неорганических, так и органических, включая карбанионы и комплексные анионы[3].
М. В. Ломоносов в своих Трудах по химии и физике так описывал понятие «соль»[4][5]:
Названием солей обозначают хрупкие тела, которые растворяются в воде, причем она остается прозрачной; они не загораются, если в чистом виде подвергаются действию огня. Их виды: купорос и все другие металлические соли, квасцы, бура, винный камень, существенные соли растений, соль винного камня и поташ, летучая мочевая соль, селитра, обыкновенная соль родниковая, морская и каменная, нашатырь, английская соль и другие соли, полученные в результате химических работ.
Типы солей[править | править код]
Если рассматривать соли как продукты замены катионов в кислотах или гидроксогрупп в основаниях, то можно выделить следующие типы солей[3]:
- Средние (нормальные) соли — продукты замещения всех катионов водорода в молекулах кислоты на катионы металла (Na2CO3, K3PO4).
- Кислые соли — продукты частичного замещения катионов водорода в кислотах на катионы металла (NaHCO3, K2HPO4). Они образуются при нейтрализации основания избытком кислоты (то есть в условиях недостатка основания или избытка кислоты).
- Осно́вные соли — продукты неполного замещения гидроксогрупп основания (OH–) кислотными остатками ((CuOH)2CO3). Они образуются в условиях избытка основания или недостатка кислоты.
- Комплексные соли — это сложные вещества, в состав которых входят комплексный катион и анион, либо катион и комплексный анион (Na2[Zn(OH)4]).
По числу присутствующих в структуре катионов и анионов выделяют следующие типы солей[6]:
- Простые соли — соли, состоящие из одного вида катионов и одного вида анионов (NaCl)
- Двойные соли — соли, содержащие два различных катиона (KAl(SO4)2·12 H2O).
- Смешанные соли — соли, в составе которых присутствует два различных аниона (Ca(OCl)Cl).
Также различают гидратные соли (кристаллогидраты), в состав которых входят молекулы кристаллизационной воды, например, Na2SO4·10 H2O, и комплексные соли, содержащие комплексный катион или комплексный анион (K4[Fe(CN)6]). Внутренние соли образованы биполярными ионами, то есть молекулами, содержащими как положительно заряженный, так и отрицательно заряженный атом[7].
Номенклатура солей[править | править код]
Номенклатура солей кислородсодержащих кислот[править | править код]
Названия солей, как правило, связаны с названиями соответствующих кислот. Поскольку многие кислоты в русском языке носят тривиальные, или традиционные, названия, подобные названия (нитраты, фосфаты, карбонаты и др.) также сохраняются и для солей[8].
Традиционные названия солей состоят из названий анионов в именительном падеже и названий катионов в родительном падеже[9]. Названия анионов строятся на основе русских или латинских названий кислотообразующих элементов. Если кислотообразующий элемент может иметь одну степень окисления, то к его названию добавляют суффикс –ат:
- CO32- — карбонат,
- GeO32- — германат.
Если кислотообразующий элемент может принимать две степени окисления, то для аниона, образованного этим элементом в более высокой степени окисления, применяют суффикс –ат, а для аниона с элементом в меньшей степени окисления — суффикс –ит:
- SO42- — сульфат,
- SO32- — сульфит.
Если элемент может принимать три степени окисления, то для высшей, средней и низшей степени окисления используют соответственно суффиксы –ат, –ит и суффикс –ит с приставкой гипо-:
- NO3– — нитрат,
- NO2– — нитрит,
- N2O22- — гипонитрит.
Наконец, в случае элементов, принимающих четыре степени окисления, для высшей степени окисления применяют приставку пер– и суффикс –ат, далее (в порядке понижения степени окисления) суффикс –ат, суффикс –ит и суффикс –ит с приставкой гипо-:
- ClO4– — перхлорат,
- ClO3– — хлорат,
- ClO2– — хлорит,
- ClO– — гипохлорит[10].
Приставки мета-, орто-, поли-, ди-, три-, пероксо– и т. п., традиционно присутствующие в названиях кислот, сохраняются также и в названиях анионов[9].
Названия катионов соответствуют названиям элементов, от которых они образованы: при необходимости указывается число атомов в катионе (катион диртути(2+) Hg22+, катион тетрамышьяка(2+) As42+) и степень окисления атома, если она переменная[11].
Названия кислых солей образуются путём добавления приставки гидро– к названию аниона. Если на один анион приходится больше одного атома водорода, то его количество указывают при помощи умножающей приставки (NaHCO3 — гидрокарбонат натрия, NaH2PO4 — дигидрофосфат натрия). Аналогично, для образования названий основных солей используются приставки гидроксо– ((FeOH)NO3 — гидроксонитрат железа(II))[12].
Кристаллогидратам дают названия, добавляя слово гидрат к традиционному или систематическому названию соли (Pb(BrO3)2·H2O — гидрат бромата свинца(II), Na2CO3·10H2O — декагидрат карбоната натрия). Если известна структура кристаллогидрата, то может применяться номенклатура комплексных соединений ([Be(H2O)4]SO4 — сульфат тетрааквабериллия(II))[13].
Для некоторых классов солей существуют групповые названия, например, квасцы — для двойных сульфатов общего вида MIMIII(SO4)2·12H2O, где MI — катионы натрия, калия, рубидия, цезия, таллия или аммония, а MIII — катионы алюминия, галлия, индия, таллия, титана, ванадия, хрома, марганца, железа, кобальта, родия или иридия[14].
Для более сложных или редких солей применяются систематические названия, образующиеся по правилам номенклатуры комплексных соединений[8]. Согласно данной номенклатуре, соль подразделяется на внешнюю и внутреннюю сферы (катион и анион): последняя состоит из центрального атома и лигандов — атомов, связанных с центральным атомом. Название соли формируют следующим образом. Вначале записывают название внутренней сферы (аниона) в именительном падеже, состоящее из названий лигандов (приставок) и центрального элемента (корня) с суффиксом –ат и указанием его степени окисления. Затем к названию добавляют названия атомов внешней сферы (катионов) в родительном падеже[15].
- LiBO2 — диоксоборат(III) лития
- Na2Cr2O7 — гептаоксодихромат(VI) натрия
- NaHSO4 — тетраоксосульфат(VI) водорода-натрия
Номенклатура солей бескислородных кислот[править | править код]
Для образования названий солей бескислородных кислот пользуются общими правилами составления названий бинарных соединений: применяются либо универсальные номенклатурные правила с указанием числовых приставок, либо способ Штока с указанием степени окисления, причём второй способ является предпочтительным.
Названия галогенидов составляются из названия галогена с суффиксом –ид и катиона (NaBr — бромид натрия, SF6 — фторид серы(VI), или гексафторид серы, Nb6I11 — ундекаиодид гексаниобия). Кроме того, существует класс псевдогалогенидов — солей, которые содержат анионы с галогенидоподобными свойствами. Их названия образуются подобным образом (Fe(CN)2 — цианид железа(II), AgNCS — тиоцианат серебра(I))[16].
Халькогениды, содержащие в качестве аниона серу, селен и теллур, называют сульфидами, селенидами и теллуридами. Сероводород и селеноводород могут образовывать кислые соли, которые называют гидросульфидами и гидроселенидами соответственно (ZnS — сульфид цинка, SiS2 — дисульфид кремния, NaHS — гидросульфид натрия). Двойные сульфиды называют, указывая два катиона через дефис: (FeCu)S2 — дисульфид железа-меди[17].
Физические свойства и строение солей[править | править код]

Зависимость растворимости некоторых солей от температуры
Как правило, соли представляют собой кристаллические вещества с ионной кристаллической решёткой. Например, кристаллы галогенидов щелочных и щёлочноземельных металлов (NaCl, CsCl, CaF2) построены из анионов, расположенных по принципу плотнейшей шаровой упаковки, и катионов, занимающих пустоты в этой упаковке. Ионные кристаллы солей могут быть построены также из кислотных остатков, объединённых в бесконечные анионные фрагменты и трёхмерные каркасы с катионами в полостях (силикаты). Подобное строение соответствующим образом отражается на их физических свойствах: они имеют высокие температуры плавления, в твёрдом состоянии являются диэлектриками[18].
Известны также соли молекулярного (ковалентного) строения (например, хлорид алюминия AlCl3). У многих солей характер химических связей является промежуточным между ионным и ковалентным[7].
Особый интерес представляют ионные жидкости — соли с температурой плавления ниже 100 °С. Кроме аномальной температуры плавления ионные жидкости имеют практически нулевое давление насыщенного пара и высокую вязкость. Особые свойства этих солей объясняются низкой симметрией катиона, слабым взаимодействием между ионами и хорошим распределением заряда катиона[19].
Важным свойством солей является их растворимость в воде. По данному критерию выделяют растворимые, мало растворимые и нерастворимые соли.
Нахождение в природе[править | править код]
Многие минералы — соли, образующие залежи (например, галит 


Методы получения[править | править код]
Существуют различные методы получения солей:
- Взаимодействие кислот с металлами, основными и амфотерными оксидами / гидроксидами:



- Взаимодействие кислотных оксидов c щелочами, основными и амфотерными оксидами / гидроксидами:





- Взаимодействие солей c кислотами, другими солями (если образуется выходящий из сферы реакции продукт):


![{mathsf {2Na_{2}CO_{3}+2MgCl_{2}+H_{2}Olongrightarrow [Mg(OH)]_{2}CO_{3}+CO_{2}uparrow +4NaCl}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9b4efc15cd040e8cf0244413520d3c907b764e50)
- Взаимодействие простых веществ:

- Взаимодействие оснований с неметаллами, например, с галогенами:

Кристаллогидраты обычно получают при кристаллизации соли из водных растворов, однако известны также кристаллосольваты солей, выпадающие из неводных растворителей (например, CaBr2·3C2H5OH)[7]. Названия сольватов образуются перечислением компонентов с дальнейшим указанием количественного соотношения в скобках, например, CaBr2·3C2H5OH будет называться бромид кальция – этанол (1/3).
Химические свойства[править | править код]
Химические свойства определяются свойствами катионов и анионов, входящих в их состав.
Соли взаимодействуют с кислотами и основаниями, если в результате реакции получается продукт, который выходит из сферы реакции (осадок, газ, малодиссоциирующие вещества, например, вода):



Соли взаимодействуют с металлами, если свободный металл находится левее металла в составе соли в электрохимическом ряду активности металлов:

Соли взаимодействуют между собой, если продукт реакции выходит из сферы реакции (образуется газ, осадок или вода); в том числе эти реакции могут проходить с изменением степеней окисления атомов реагентов:



Многие соли разлагаются при нагревании:




Диссоциация в водных растворах[править | править код]
При растворении в воде соли полностью или частично диссоциируют на ионы. Если диссоциация происходит нацело, то соли являются сильными электролитами, иначе — слабыми[7]. Примером типичных сильных электролитов могут служить соли щелочных металлов, которые в растворе существуют в виде сольватированных ионов[2]. Несмотря на то, что широко распространена теория, утверждающая, что соли в водном растворе диссоциируют полностью, в реальности для большинства солей наблюдается частичная диссоциация, например, 0,1 M раствор FeCl3 содержит лишь 10 % катионов Fe3+, а также 42 % катионов FeCl2+, 40 % катионов FeCl2+, 6 % катионов FeOH2+ и 2 % катионов Fe(OH)2+[20].
Гидролиз солей[править | править код]
Некоторые соли в водном растворе способны подвергаться гидролизу[7]. Данная реакция протекает обратимо для солей слабых кислот (Na2CO3) или слабых оснований (CuCl2), и необратимо — для солей слабых кислот и слабых оснований (Al2S3).
Влияние на организм человека[править | править код]
| Название солей | Продукты содержания | Влияние на человеческий организм | Заболевания при нехватке солей |
|---|---|---|---|
| Соли кальция | Молоко, рыба, овощи | Повышение роста и прочности костей | Плохой рост скелета, разрушение зубов и.т.д. |
| Соли железа | Печень говяжья, мясо говяжье | Входят в состав гемоглобина | Анемия |
| Соли магния | Горох, курага | Улучшение работы кишечника | Ухудшение работы пищеварительной системы |
Применение солей[править | править код]
Соли повсеместно используются как в производстве, так и в повседневной жизни.
- Соли соляной кислоты. Из хлоридов больше всего используют хлорид натрия и хлорид калия.
Хлорид натрия (поваренную соль) выделяют из озерной и морской воды, а также добывают в соляных шахтах. Поваренную соль используют в пищу. В промышленности хлорид натрия служит сырьём для получения хлора, гидроксида натрия и соды.
Хлорид калия используют в сельском хозяйстве как калийное удобрение. - Соли серной кислоты. В строительстве и в медицине широко используют полуводный гипс, получаемый при обжиге горной породы (дигидрат сульфата кальция). Будучи смешан с водой, он быстро застывает, образуя дигидрат сульфата кальция, то есть гипс.
Декагидрат сульфата натрия используют в качестве сырья для получения соды. - Соли азотной кислоты. Нитраты больше всего используют в качестве удобрений в сельском хозяйстве. Важнейшим из них является нитрат натрия, нитрат калия, нитрат кальция и нитрат аммония. Обычно эти соли называют селитрами.
- Из ортофосфатов важнейшим является ортофосфат кальция. Эта соль служит основной составной частью минералов — фосфоритов и апатитов. Фосфориты и апатиты используются в качестве сырья в производстве фосфорных удобрений, например, суперфосфата и преципитата.
- Соли угольной кислоты. Карбонат кальция используют в качестве сырья для получения извести.
Карбонат натрия (соду) применяют в производстве стекла и при варке мыла.
Карбонат кальция в природе встречается и в виде известняка, мела и мрамора.
Галерея изображения солей[править | править код]
См. также[править | править код]
- Кислые соли
- Основные соли
- Двойные соли
- Кристаллогидраты
- Кристаллическая решётка
- Растворимость
- Гидролиз
- Соли (наркотики)
Примечания[править | править код]
- ↑ IUPAC Gold Book — salt. Дата обращения: 21 мая 2013. Архивировано 23 мая 2013 года.
- ↑ 1 2 СОЖ, 1999.
- ↑ 1 2 Зефиров, 1995, с. 376.
- ↑ М. В. Ломоносов. Труды по химии и физике. Историко-Мемориальный музей Ломоносова. Дата обращения: 24 октября 2013. Архивировано 29 октября 2013 года.
- ↑ М. В. Ломоносов. Введение в истинную физическую химию. Фундаментальная электронная библиотека. — Параграф 111. Дата обращения: 24 октября 2013. Архивировано 29 октября 2013 года.
- ↑ Зефиров, 1995, с. 376—377.
- ↑ 1 2 3 4 5 Зефиров, 1995, с. 377.
- ↑ 1 2 Лидин, 1983, с. 46.
- ↑ 1 2 Лидин, 1983, с. 48.
- ↑ Лидин, 1983, с. 47—48.
- ↑ Лидин, 1983, с. 13—14.
- ↑ Лидин, 1983, с. 50—51.
- ↑ Лидин, 1983, с. 53.
- ↑ Лидин, 1983, с. 54.
- ↑ Лидин, 1983, с. 65.
- ↑ Лидин, 1983, с. 28—30.
- ↑ Лидин, 1983, с. 32—33.
- ↑ Химическая энциклопедия / Под ред. И. Л. Кнунянца. — М.: Большая российская энциклопедия, 1990. — Т. 2. — ISBN 5-85270-035-5.
- ↑ Wasserscheid P., Keim W. Ionic Liquids—New “Solutions” for Transition Metal Catalysis (англ.) // Angew. Chem. Int. Ed. — 2000. — Vol. 39, no. 21. — P. 3772—3789. — doi:10.1002/1521-3773(20001103)39:21<3772::AID-ANIE3772>3.0.CO;2-5. — PMID 11091453.
- ↑ Hawkes S. J. Salts are Mostly NOT Ionized (англ.) // J. Chem. Educ. — 1996. — Vol. 75, no. 5. — P. 421—423. — doi:10.1021/ed073p421.
Литература[править | править код]
- Гиричев Г. В. Структура молекул солей кислородсодержащих кислот // Соросовский образовательный журнал. — 1999. — № 11. — С. 40—44.
- Лидин Р. А., Молочко В. А., Андреева Л. Л., Цветков А. А. Основы номенклатуры неорганических веществ / Под ред. Б. Д. Стёпина. — М.: Химия, 1983. — 112 с.
- Химическая энциклопедия / Под ред. Н. С. Зефирова. — М.: Большая российская энциклопедия, 1995. — Т. 4. — ISBN 5-85270-092-4.
Соль подвергается гидролизу, если она растворяется в воде и содержит в своём составе ион слабого электролита.
Любую соль можно рассматривать как продукт реакции основания с кислотой. Вспомним, что основания и кислоты — это электролиты. Они различаются по способности диссоциировать в водных растворах, бывают сильными и слабыми. Сильные основания и кислоты распадаются на ионы полностью, а слабые — частично. В таблице приведены примеры таких оснований и кислот.
|
Сильные основания |
NaOH, LiOH, KOH, Ca(OH)2, Ba(OH)2 |
|
Слабые основания |
NH4OH, Cu(OH)2, Fe(OH)2, Fe(OH)3, Zn(OH)2, Al(OH)3 |
|
Сильные кислоты |
HCl, HBr, HNO3, H2SO4, HClO4 |
|
Слабые кислоты |
HF, H2S, HNO2, H2SO3, H2CO3, H3PO4, CH3COOH |
Способность соли взаимодействовать с водой зависит от того, какие ионы образуются при её растворении в воде. Выделяют четыре группы солей.
Все варианты протекания гидролиза растворимых солей представлены в таблице.
Соли встречаются в химии очень часто. Состоят они из металла и кислотного остатка, образуются чаще всего в реакции нейтрализации, то есть реакции между основанием и кислотой, хотя получить соли можно и другими способами. Изучение химии в школе предполагает знакомство со средними солями, но иногда в школьной химии встречаются кислые и основные соли. О них и пойдёт речь.
Классификация солей
Средние соли
Итак, средние соли образуются, когда в кислоте все атомы водорода замещены металлом. Примеры средних солей: КCl, Li2SO4, Na3PO4.
Из примеров как раз видно, что в кислотах, использованных для получения солей, все атомы водорода заместились на металл. Посмотрите, например, на фосфат натрия Na3PO4. Эта соль фосфорной кислоты H3PO4. Видно, что все три атома водорода заместились на атомы натрия.
Средние соли. Номенклатура
Здесь нет никакой сложности:
в названии используется название кислотного остатка и металл.
Примеры:
Ca(NO3)2 – нитрат кальция (нитрат – соль азотной кислоты),
MgSO4 – сульфат магния (сульфат – соль серной кислоты),
К3PO4 – фосфат калия (фосфат – соль фосфорной кислоты).
Кислые соли
Кислые соли – продукт неполного замещения атомов водорода в кислоте атомами металла. Примеры кислых солей: NaHCO3, KHSO3.
При составлении формул кислых солей важно понимать, как они образуются, иначе будет путаница с индексами. Давайте разберём это на примере гидрокарбоната натрия NaHCO3. Для начала вспомним о карбонате натрия Na2CO3. Это соль угольной кислоты Н2СО3. При образовании карбоната натрия заместились оба атома водорода на два атома натрия, то есть вместо двух атомов водорода в кислоте H2CO3 встали два атома натрия, образовав карбонат натрия Na2CO3:
в H2CO3 заместились 2 атома водорода на 2 атома натрия с образованием Na2CO3
А вот если атомов натрия не хватило, то атом натрия заместит лишь один атом водорода, второй при этом останется, то есть:
в H2CO3 заместился 1 атом водорода на 1 атом натрия с образованием NaHCO3
Обратите внимание, что все валентности учтены! Это важно! Вы знаете, что валентность кислотного остатка угольной кислоты СО3 равна II (потому что угольная кислота двухосновная, в ней два атома водорода). Валентность атома натрия I, валентность атома водорода I, поэтому и формула гидрокарбоната выглядят так: NaHCO3.
Кислые соли. Номенклатура
Чтобы назвать кислую соль правильно,
нужно к кислотному остатку добавить часть «гидро» (если в соли два атома водорода, то нужно добавить «дигидро»).
Примеры:
NaHSO3 – гидросульфит натрия (сульфит – соль сернистой кислоты H2SO3, но у нас соль кислая, поэтому добавляем «гидро»),
Na2HPO4 – гидрофосфат натрия (фосфат – соль фосфорной кислоты H3PO4, но у нас соль кислая, поэтому добавляем «гидро»),
NaH2PO4 – дигидрофосфат натрия (фосфат – соль фосфорной кислоты H3PO4, но у нас соль кислая, причём в ней два атома водорода, поэтому добавляем «дигидро»).
Запомните, что одноосновные кислоты не образуют кислых солей. Это довольно очевидно, ведь в одноосновных кислотах всего один атом водорода, и если он не заместится, то кислота так и останется кислотой, не превратившись в соль. Например, в соляной кислоте (одноосновной) HCl атом водорода в любом случае должен заместиться на атом металла, иначе соли не получится.
Основные соли
Основные соли получаются, когда не все гидроксильные группы в основании заместились кислотным остатком. Примеры основных солей: Zn(OH)Cl, Al(OH)SO4, Fe(OH)(NO3)2.
Здесь ситуация обратна той, что имеется при образовании кислых солей. Но если в кислых солях частично замещаются атомы водорода, то в основных – частично замещаются гидроксогруппы. Давайте рассмотрим это на примере гидроксохлорида цинка Zn(OH)Cl.
В гидроксиде цинка Zn(OH)2 заместились две группы ОН на два кислотных остатка соляной кислоты Cl с получением хлорида цинка ZnCl2 (средней соли).
Но бывает, что в гидроксиде цинка Zn(OH)2 заместилась одна группа ОН на один кислотный остаток соляной кислоты Cl с получением гидроксохлорида цинка Zn(ОН)Cl (средней соли).
Составление формул основных солей тоже требует внимательности. Здесь нужно учитывать число гидроксильных групп ОН и валентность кислотного остатка. Например, в Zn(OH)Cl валентность цинка II, валентность гидроксогруппы I, валентность кислотного остатка Cl – I.
Основные соли. Номенклатура
Чтобы правильно назвать основную соль,
нужно к кислотному остатку прибавить «гидроксо» (если в соли две гидроксильные группы, то добавляют «дигидроксо»).
Al(OH)SO4 – гидроксосульфат алюминия (сульфат – соль серной кислоты H2SO4, но у нас соль основная, поэтому добавляем «гидроксо»),
Fe(OH)2(NO3) – дигидроксонитрат железа (III) (нитрат – соль азотной кислоты HNO3, но у нас соль основная, причём в ней две гидроксильные группы ОН, поэтому добавляем «дигидроксо»),
Mg(ОН)Cl – гидроксохлорид магния (хлорид – соль соляной кислоты HCl, но у нас основная соль, поэтому добавляем «гидроксо»).
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.





