Как определить состав ядра?
Анонимный вопрос
6 марта 2019 · 3,4 K
1) Массовое число атома стронция А=88. При этом он находится на 38 месте в таблице Менделеева. Значит, число протонов Z=38, а число нейтронов N=88-38=50.
2) Масса протона Mp=1,00728 а.е.м.
Масса нейтрона Mn=1,00866 а.е.м.
Масса электрона Me=0,00055 а.е.м.
Масса атома Ma=12,00000 а.е.м.
1) Масса ядра Мя=Ма-е*Мe=12-6*0,00055=11,9967 а.е.м.
2) Дефект масс Δm=Z*Мp+N*Мn-Мя=6*1,00728+6*1,00866-11,9967=0,09894
3) Энергия связи E= Δm*931,52=0,09894*931,52=92,16 МэВ (мегаэлектронвольт)
Ответ: 92,16 МэВ.
2,4 K
Комментировать ответ…Комментировать…
| Ядерная физика |
|---|
 |
| Атомное ядро · Радиоактивный распад · Ядерная реакция · Термоядерная реакция |
|
Основные термины Атомное ядро · Изотопы · Изобары · Капельная модель ядра · Период полураспада · Массовое число · Составное ядро · Цепная ядерная реакция · Ядерное эффективное сечение |
|
Распад ядер Закон радиоактивного распада · Альфа-распад · Бета-распад · Кластерный распад |
|
Сложный распад Электронный захват · Двойной бета-распад · Двойной электронный захват · Внутренняя конверсия · Изомерный переход |
|
Излучения Ионизирующее излучение · Нейтронный распад · Позитронный распад · Протонный распад · Гамма излучение · Фоторасщепление |
|
Захваты Электронный захват · Нейтронный захват (r-процесс · s-процесс) · Протонный захват (p-процесс · rp-процесс) · Нейтронизация |
|
Деление ядра Спонтанное деление |
|
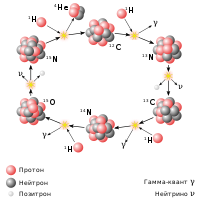
Нуклеосинтез Первичный нуклеосинтез · Протон-протонный цикл · CNO-цикл · Тройная гелиевая реакция · Гелиевая вспышка · Ядерное горение углерода · Углеродная детонация · Ядерное горение кислорода · Ядерное горение неона · Ядерное горение кремния · Реакции скалывания |
| См. также: Портал:Физика |
А́томное ядро́ — центральная часть атома, в которой сосредоточена основная его масса (более 99,9 %). Ядро заряжено положительно, заряд ядра определяет химический элемент, к которому относят атом. Размеры ядер различных атомов составляют несколько фемтометров, что более чем в 10 тысяч раз меньше размеров самого атома. Атомные ядра изучает ядерная физика.
Атомное ядро состоит из нуклонов — положительно заряженных протонов и нейтральных нейтронов, которые связаны между собой при помощи сильного взаимодействия. Протон и нейтрон обладают собственным моментом количества движения (спином), равным 
Атомное ядро, рассматриваемое как класс частиц с определённым числом протонов и нейтронов, принято называть нуклидом.
В некоторых редких случаях могут образовываться короткоживущие экзотические атомы, у которых вместо нуклона ядром служат иные частицы.
Количество протонов в ядре называется его зарядовым числом 



Как и любая квантовая система, ядра могут находиться в метастабильном возбуждённом состоянии, причём в отдельных случаях время жизни такого состояния исчисляется годами. Такие возбуждённые состояния ядер называются ядерными изомерами[1][2][3].
История[править | править код]
В 1911 году Резерфорд в своём докладе «Рассеяние α- и β-лучей и строение атома» в философском обществе Манчестера заявил[4]:
Рассеяние заряженных частиц может быть объяснено, если предположить такой атом, который состоит из центрального электрического заряда, сосредоточенного в точке и окружённого однородным сферическим распределением противоположного электричества равной величины. При таком устройстве атома α- и β-частицы, когда они проходят на близком расстоянии от центра атома, испытывают большие отклонения, хотя вероятность такого отклонения мала.
Таким образом Резерфорд открыл атомное ядро, с этого момента и ведёт начало ядерная физика, изучающая строение и свойства атомных ядер.
После обнаружения стабильных изотопов элементов, ядру самого лёгкого атома была отведена роль структурной частицы всех ядер. С 1920 года ядро атома водорода имеет официальный термин — протон. В 1921 году Лиза Мейтнер предложила[5] первую, протон-электронную, модель строения атомного ядра, согласно которой оно состоит из протонов, электронов и альфа-частиц[6]:96. Однако в 1929 году произошла «азотная катастрофа» — В. Гайтлер и Г. Герцберг установили[7], что ядро атома азота подчиняется статистике Бозе — Эйнштейна, а не статистике Ферми — Дирака, как предсказывала протон-электронная модель[8][9]:374. Таким образом, эта модель вступила в противоречие с экспериментальными результатами измерений спинов и магнитных моментов ядер[10]. В 1932 году Джеймсом Чедвиком была открыта новая электрически нейтральная частица, названная нейтроном. В том же году Иваненко[11] и, ссылаясь на работу первого[12], Гейзенберг выдвинули гипотезу о протон-нейтронной структуре ядра. В дальнейшем, с развитием ядерной физики и её приложений, эта гипотеза была полностью подтверждена[13].
Теории строения атомного ядра[править | править код]
В процессе развития физики выдвигались различные гипотезы строения атомного ядра; тем не менее, каждая из них способна описать лишь ограниченную совокупность ядерных свойств. Некоторые модели могут взаимоисключать друг друга.
Наиболее известными являются следующие:
- Капельная модель ядра — предложена в 1936 году Нильсом Бором.
- Оболочечная модель ядра — предложена в 30-х годах XX века.
- Обобщённая модель Бора — Моттельсона
- Кластерная модель ядра
- Модель нуклонных ассоциаций
- Оптическая модель ядра
- Сверхтекучая модель ядра
- Статистическая модель ядра
Ядерно-физические характеристики[править | править код]
Зарядовым числом 


Заряд[править | править код]
Число протонов в ядре 
Впервые заряды атомных ядер определил Генри Мозли в 1913 году. Свои экспериментальные наблюдения учёный интерпретировал зависимостью длины волны рентгеновского излучения от некоторой константы 
, где


Из чего Мозли сделал вывод, что найденная в его опытах константа атома, определяющая длину волны характеристического рентгеновского излучения и совпадающая с порядковым номером элемента, может быть только зарядом атомного ядра, что стало известно под названием закон Мозли[2].
Масса[править | править код]
Из-за разницы в числе нейтронов 

Кроме того, в ядерной физике часто используется энергетический эквивалент массы. Согласно соотношению Эйнштейна, каждому значению массы 
, где
— скорость света в вакууме.
Соотношение между а. е. м. и её энергетическим эквивалентом в джоулях:
,
а так как 1 электронвольт = 1,602176⋅10−19 Дж, то энергетический эквивалент а. е. м. в МэВ равен[1][3]:
.
Радиус[править | править код]
Анализ распада тяжёлых ядер уточнил оценку Резерфорда[сн 3] и связал радиус ядра 

, где
— константа.
Так как радиус ядра не является чисто геометрической характеристикой и связан прежде всего с радиусом действия ядерных сил, то значение 



Моменты ядра[править | править код]
Как и составляющие его нуклоны, ядро имеет собственные моменты.
Спин[править | править код]
Поскольку нуклоны обладают собственным механическим моментом, или спином, равным 

Несмотря на то, что число нуклонов в ядре может быть очень велико, спины ядер обычно невелики и составляют не более нескольких 
Магнитный момент[править | править код]
Измерения спинов стали возможными благодаря наличию непосредственно связанных с ними магнитных моментов. Они измеряются в магнетонах и у различных ядер равны от −2 до +5 ядерных магнетонов. Из-за относительно большой массы нуклонов магнитные моменты ядер очень малы по сравнению с магнитными моментами электронов, поэтому их измерение гораздо сложнее. Как и спины, магнитные моменты измеряются спектроскопическими методами, наиболее точным является метод ядерного магнитного резонанса.
Магнитный момент чётно-чётных пар, как и спин, равен нулю. Магнитные моменты ядер с непарными нуклонами образуются собственными моментами этих нуклонов и моментом, связанным с орбитальным движением непарного протона[10].
Электрический квадрупольный момент[править | править код]
Атомные ядра, спин которых больше или равен единице, имеют отличные от нуля квадрупольные моменты, что говорит об их не точно сферической форме. Квадрупольный момент имеет знак плюс, если ядро вытянуто вдоль оси спина (веретенообразное тело), и знак минус, если ядро растянуто в плоскости, перпендикулярной оси спина (чечевицеобразное тело). Известны ядра с положительными и отрицательными квадрупольными моментами. Отсутствие сферической симметрии у электрического поля, создаваемого ядром с ненулевым квадрупольным моментом, приводит к образованию дополнительных энергетических уровней атомных электронов и появлению в спектрах атомов линий сверхтонкой структуры, расстояния между которыми зависят от квадрупольного момента[2].
Энергия связи[править | править код]

Большая энергия связи нуклонов, входящих в ядро, говорит о существовании ядерных сил, поскольку известные гравитационные силы слишком малы, чтобы преодолеть взаимное электростатическое отталкивание протонов в ядре. Связь нуклонов осуществляется чрезвычайно короткодействующими силами, которые возникают вследствие непрерывного обмена частицами, называемыми пи-мезонами, между нуклонами в ядре.
Экспериментально было обнаружено, что для всех стабильных ядер масса ядра меньше суммы масс составляющих его нуклонов, взятых по отдельности. Эта разница называется дефектом массы или избытком массы и определяется соотношением:
,
где 


Согласно принципу эквивалентности массы и энергии дефект массы представляет собой массу, эквивалентную работе, затраченной ядерными силами, чтобы собрать все нуклоны вместе при образовании ядра. Эта величина равна изменению потенциальной энергии нуклонов в результате их объединения в ядро.
Энергия, эквивалентная дефекту массы, называется энергией связи ядра и равна:
,
где 
Другим важным параметром ядра является энергия связи, приходящаяся на один нуклон ядра, которую можно вычислить, разделив энергию связи ядра на число содержащихся в нём нуклонов:
Эта величина представляет собой среднюю энергию, которую нужно затратить, чтобы удалить один нуклон из ядра, или среднее изменение энергии связи ядра, когда свободный протон или нейтрон поглощается в нём.
Как видно из поясняющего рисунка, при малых значениях массовых чисел удельная энергия связи ядер резко возрастает и достигает максимума при 



Такой характер поведения средней энергии связи указывает на свойство ядерных сил достигать насыщения, то есть на возможность взаимодействия нуклона только с малым числом «партнёров». Если бы ядерные силы не обладали свойством насыщения, то в пределах радиуса действия ядерных сил каждый нуклон взаимодействовал бы с каждым из остальных и энергия взаимодействия была бы пропорциональна 

Общая закономерность зависимости энергии связи от массового числа описывается формулой Вайцзеккера в рамках теории капельной модели ядра[1][2][14][15].
Устойчивость ядер[править | править код]
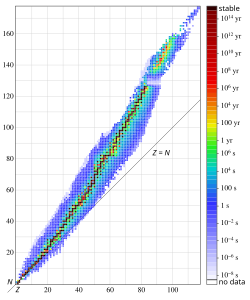
Зависимость числа нейтронов N от числа протонов Z в атомных ядрах (N=A-Z).
Из факта убывания средней энергии связи для нуклидов с массовыми числами больше или меньше 50-60 следует, что для ядер с малыми 

Детальные исследования показали, что устойчивость ядер также существенно зависит от параметра 



Если рассмотреть таблицу стабильных нуклидов, встречающихся в природе, можно обратить внимание на их распределение по чётным и нечётным значениям 







| Z | N=A-Z | A | Число нуклидов |
|---|---|---|---|
| Чётное | Чётное | Чётное | 167 |
| Чётное | Нечётное | Нечётное | 55 |
| Нечётное | Чётное | Нечётное | 53 |
| Нечётное | Нечётное | Чётное | 4 |
Таким образом, чётность числа протонов или нейтронов создаёт некоторый запас устойчивости, который приводит к возможности существования нескольких стабильных нуклидов, различающихся соответственно по числу нейтронов для изотопов и по числу протонов для изотонов. Также чётность числа нейтронов в составе тяжёлых ядер определяет их способность делиться под воздействием нейтронов[2].
Ядерные силы[править | править код]
Ядерные силы — это силы, удерживающие нуклоны в ядре, представляющие собой большие силы притяжения, действующие только на малых расстояниях. Они обладают свойствами насыщения, в связи с чем ядерным силам приписывается обменный характер (с помощью пи-мезонов). Ядерные силы зависят от спина, не зависят от электрического заряда и не являются центральными силами[2].
Уровни ядра[править | править код]
В отличие от свободных частиц, для которых энергия может принимать любые значения (так называемый непрерывный спектр), связанные частицы (то есть частицы, кинетическая энергия которых меньше абсолютного значения потенциальной), согласно квантовой механике, могут находиться в состояниях только с определёнными дискретными значениями энергий, так называемый дискретный спектр. Так как ядро — система связанных нуклонов, оно обладает дискретным спектром энергий. Обычно оно находится в наиболее низком энергетическом состоянии, называемым основным. Если передать ядру энергию, оно перейдёт в возбуждённое состояние.
Расположение энергетических уровней ядра в первом приближении:
, где:






С ростом энергии возбуждения уровни сближаются быстрее у тяжёлых ядер, также плотность уровней зависит от чётности числа нейтронов в ядре. Для ядер с чётными (особенно магическими) числами нейтронов плотность уровней меньше, чем для ядер с нечётными, при равных энергиях возбуждения первый возбуждённый уровень в ядре с чётным числом нейтронов расположен выше, чем в ядре с нечётным.
Во всех возбуждённых состояниях ядро может находиться лишь конечное время, до тех пор, пока возбуждение не будет снято тем или иным путём. Состояния, энергия возбуждения которых меньше энергии связи частицы или группы частиц в данном ядре, называются связанными; в этом случае возбуждение может сниматься лишь гамма-излучением. Состояния с энергией возбуждения, превышающей энергию связи частиц, называются квазистационарными. В этом случае ядро может испустить частицу или гамма-квант[1].
Ядерные реакции[править | править код]
Ядерная реакция — процесс превращения атомных ядер, происходящий при их взаимодействии с элементарными частицами, гамма-квантами и друг с другом.
Радиоактивность[править | править код]
Лишь небольшая часть нуклидов являются стабильными. В большинстве случаев ядерные силы оказываются неспособны обеспечить их постоянную целостность, и ядра рано или поздно распадаются. Это явление получило название радиоактивности.
Система обозначений ядер[править | править код]
Для обозначения атомных ядер используется следующая система:
Таким образом, состав ядра оказывается полностью определён, так как 
Пример такого обозначения:

Иногда, однако, для полноты вокруг обозначения элемента указывают все характеризующие ядро его атома числа:
- слева снизу — зарядовое число
, то есть, то же самое, что указано символом элемента;
- слева сверху — массовое число
;
- справа снизу — изотопическое число
[источник не указан 1368 дней (обс.)];
- если речь идёт о ядерных изомерах, к массовому числу приписывается буква из последовательности m, n, p, q, … (иногда используют последовательность m1, m2, m3, …). Иногда эту букву указывают в качестве самостоятельного индекса справа сверху.
Примеры таких обозначений:




Обозначения атомных ядер совпадают с таковыми для нуклидов.
По историческим и иным причинам, некоторые ядра имеют самостоятельные названия. Например, ядро 4He называется α-частицей, ядро дейтерия 2H (или D) — дейтроном, а ядро трития 3H (или T) — тритоном. Последние два ядра являются изотопами водорода и поэтому могут входить в состав молекул воды, давая в итоге так называемую тяжёлую воду.
Примечания[править | править код]
- Использованная литература
- ↑ 1 2 3 4 5 6 7 Бартоломей Г.Г., Байбаков В.Д., Алхутов М.С., Бать Г.А. Основы теории и методы расчета ядерных энергетических реакторов. — М.: Энергоатомиздат, 1982. — С. 512.
- ↑ 1 2 3 4 5 6 7 8 Климов А. Н. Ядерная физика и ядерные реакторы. — М.: Энергоатомиздат, 1985. — С. 352.
- ↑ 1 2 Ганев И. Х. Физика и расчёт реактора. — М.: Энергоиздат, 1981. — С. 368.
- ↑
Кудрявцев П. С. Открытие атомного ядра // Курс истории физики. — 2-е изд., испр. и доп. — М.: Просвещение, 1982. — 448 с. - ↑ Meitner, L. Über die verschiedenen Arten des radioaktiven Zerfalls und die Möglichkeit ihrer Deutung aus der Kernstruktur (нем.) // Zeitschrift für Physik : magazin. — 1921. — Bd. 4. — S. 146—156.
- ↑ Мухин К. Привлекательный мир микрофизики // Наука и жизнь. — 2015. — № 10. — С. 96—103.
- ↑ W. Heitler, G. Herzberg. Gehorchen die Stickstoffkerne der Boseschen Statistik? (нем.) // Naturwissenschaften (англ.) (рус. : magazin. — 1929. — Bd. 17. — S. 673.
- ↑ А. И. Ахиезер, М. П. Рекало. Биография элементарных частиц. — Киев: Наукова думка, 1979. — С. 18.
- ↑ Ю. А. Храмов. Физики:Биографический справочник. — 2-е изд. — М.: Наука, 1983.
- ↑ 1 2 Мухин К. Н. Экспериментальная ядерная физика. — М.: Энергоатомиздат, 1983.
- ↑ Iwanenko, D.D., The neutron hypothesis, Nature 129 (1932) 798.
- ↑ Г. А. Сарданашвили. Дмитрий Иваненко – суперзвезда советской физики. Ненаписанные мемуары. — Либроком. — 2010. — С. 12.
- ↑ Глесстон С. Атом. Атомное ядро. Атомная энергия. — М.: Изд-во иностр. лит., 1961.
- ↑ I.R.Cameron, University of New Brunswick. Nuclear fission reactors. — Canada, New Brunswick: Plenum Press, 1982.
- ↑ Камерон И. Ядерные реакторы. — М.: Энергоатомиздат, 1987. — С. 320.
- ↑ Rohlf, James William. Modern Physics from α to Z°. — John Wiley & Sons, 1994. — С. 664. — ISBN 0471572705.
Литература[править | править код]
- М. Айзенберг, В. Грайнер. Модели ядер, коллективные и одночастичные явления. — М.: Атомиздат, 1975. — 454 c.
- М. Айзенберг, В. Грайнер. Микроскопическая теория ядра. — М.: Атомиздат, 1976. — 488 с.
- К. Бракнер Теория ядерной материи. — М., Мир, 1964. — 302 с.
- О. Бор, Б. Моттельсон. Структура атомного ядра. — В 2-х т. — М.: Мир, 1971—1977.
- В. П. Крайнов. Лекции по микроскопической теории атомного ядра. — М.: Атомиздат, 1973. — 224 с.
- В. В. Маляров. Основы терии атомного ядра. 2-ое изд. — М.: Наука, 1967. — 512 с.
- Р. Натаф. Модели ядер и ядерная спектроскопия. — М.: Мир, 1968. — 404 с.
- С. М. Поликарпов. Необычные ядра и атомы. — М.: Наука, 1977. — 152 с.
- Дж. Рейнуотер. Как возникла модель сфероидальных ядер. Успехи физических наук, 1976, Том 120. Вып. 4, с. 529—541. (Нобелевская лекция по физике 1975 г.)
- А. Г. Ситенко. Теория ядерных реакций. — М.: Энергоатомиздат, 1983. — 352 с.
- А. Г. Ситенко, В. К. Тартаковский. Лекции по теории ядра. — М.: Атомиздат, 1972. — 352 с.
- Л. Слив М. И. Стрикман, Л. Л. Франкфурт. Проблемы построения микроскопической теории ядра и квантовая хромодинамика, Успехи физических наук, 1976, Том 145. Вып. 4, с. 553—592.
- В. Г. Соловьев. Теория атомного ядра. Ядерные модели. — М.: Энергоиздат, 1981. — 296с.
- В. Г. Соловьев. Теория сложных ядр. — М.: Наука, 1971. — 560 с.
- Журнал: Физика элементарных частиц и атомного ядра (ЭЧАЯ) (Архив статей с 1970 г.)
Ссылки[править | править код]
- Ядро атомное — Физическая энциклопедия
- Колебательные возбуждения ядер — Физическая энциклопедия
- Ядерные модели — Физическая энциклопедия
- Капельная модель ядра — Физическая энциклопедия
- Ядерная материя — Физическая энциклопедия
- Ядерные цепные реакции — Физическая энциклопедия
- Деформированные ядра — Физическая энциклопедия
- Б. С. Ишханов, Э. И. Кэбин, Физика ядра и частиц, XX век. МГУ, 2000.
- Ядерная энергия
Практически сразу после
открытия нейтрона советским физиком Дмитрием Иваненко и немецким учёным
Вернером Гейзенбергом была предложена протонно-нейтронная модель атомного ядра.
Согласно ей, ядра всех химических элементов (за исключением водорода) состоят
из двух видов частиц: протонов и нейтронов. Протоны и нейтроны называют
нуклонами (от латинского «нуклеус» — ядро), а ядра атомов — нуклидами.
Общее число нуклонов в ядре
называют массовым числом и обозначают
буквой А. Оно ставится вверху перед буквенным обозначением химического
элемента.
Например, массовое число
кислорода равно 16, а углерода — 12.
Мы уже говорили о том, что массовое
число принято выражать в атомных единицах массы (сокращённо, а. е. м.) и
округлять до целых чисел. Напомним также, что атомную единицу массы
выражают через массу атома углерода; она равна 1/12 части массы атома углерода:
Число протонов в ядре
соответствует порядковому или атомному номеру элемента в таблице Менделеева и
называется зарядовым числом,
поскольку оно определяет заряд ядра. Обозначается зарядовое число буквой Z.
В наших примерах, зарядовое
число кислорода равно восьми, а углерода — 6.
Как видно из приведённых
примеров, зарядовое число ставится внизу перед буквенным обозначением элемента.
Напомним, что заряд протона положителен
и равен элементарному электрическому заряду. Следовательно, зарядовое число
численно равно заряду ядра, выраженному в элементарных электрических зарядах.
Так как атом в целом
электрически нейтрален, то зарядовое число определяет одновременно и число
электронов в атоме.
Число нейтронов в ядре обозначают большой буквой N. Нетрудно
догадаться, что оно равно разнице между массовым и зарядовым числом:
Таким образом, ядро любого
атома обозначается буквенным символом элемента. Вверху указывается значение его
массового числа, а внизу — зарядового.
В общем случае любой
химический элемент периодической таблицы Дмитрия Ивановича Менделеева можно
представить в виде:
где под X
подразумевается символ химического элемента.
Ещё раз уточним, каким образом
определяется число протонов, электронов и нейтронов в ядре атома любого
химического элемента. Во-первых, необходимо посмотреть в таблице Менделеева
порядковый номер интересующего нас химического элемента. Таким образом мы
найдём зарядовое число, то есть количество протонов и электронов в ядре. Затем,
всё в той же таблице, необходимо посмотреть атомную массу этого элемента и
округлить её до целых. Тем самым мы найдём массовое число, то есть общее
количество нуклонов в ядре. И наконец, чтобы определить количество нейтронов в
ядре атома, мы должны будем вычесть из массового числа зарядовое.
На основе новой,
протонно-нейтронной модели строения атомных ядер, было дано объяснение многим
экспериментальным фактам. Так, например, ещё в 1906—1907 годах учёными было
выявлено, что продукт радиоактивного распада урана — ионий и продукт
радиоактивного распада тория — радиоторий имеют те же химические свойства, что
и торий, но отличаются от него атомной массой и характеристиками радиоактивного
распада. При этом атомы обладали одинаковыми химическими свойствами, а отделить
их друг от друга было невозможно никакими химическими методами. Впервые, на
существование таких атомов обратил внимание Фредерик Содди в 1910 году. Он
предложил называть такие разновидности атомов одного и того же химического
элемента изотопами (что по-гречески означает «равноместные»), так как по
своим химическим свойствам они должны быть помещены в одну и ту же клетку
таблицы Менделеева.
На основании многих
экспериментов, было установлено, что изотопы одинаково вступают в химические
реакции и образуют одинаковые соединения. Это говорило о том, что число
электронов в электронных оболочках, а, значит, и заряд ядра у изотопов
одинаковы. Следовательно, ядра изотопов различаются только числом нейтронов.
Иными словами, химические свойства элементов определяются не атомной массой, а
зарядовым числом ядра. Действительно, например, нуклиды водорода-три и гелия-три
имеют близкие по величине атомные массы, но принципиально разные химические
свойства.
Из всех известных на
сегодняшний день изотопов (а они есть у всех химических элементов) только изотопы
водорода имеют названия:
Протий является самым
распространённым изотопом в природе, а его ядро содержит только один протон.
Изотоп дейтерия (его ещё называют тяжёлой водой), содержит в своём ядре один
протон и один нейтрон. Соответственно, у трития — один протон и два нейтрона. В
настоящее время в лабораториях получены изотопы водорода и с большим числом
нейтронов: тремя, четырьмя, пятью и даже шестью.
Следует отметить, что у разных
атомов существует разное количество изотопов. Например, у урана их 26, но
самыми распространёнными в природе являются два — это уран-235 (около 0,7 %), и
уран-238 (чуть более 99 %). Вы, наверное, обратили внимание на то, что мы не
называли зарядового числа изотопов урана. Дело в том, что обычно изотопы
называют по их массовым числам, так как зарядовые числа у них одинаковые.
Отметим, что изотопы бывают
устойчивые (или стабильные) и неустойчивые (то есть радиоактивные). Стабильные
изотопы сохраняются сколь угодно долго.
А нестабильные изотопы со
временем превращаются в другие химические элементы в результате радиоактивных
превращений.
В настоящее время известно
около 280 стабильных изотопов химических элементов и более 2 тыс. радиоактивных
изотопов.
Как правило, природные
элементы представляют собой смесь нескольких изотопов, поэтому возникает
задача их разделения. Как мы уже знаем, магнитное поле искривляет траекторию
движения заряженных частиц. На этом свойстве магнитного поля основано действие
устройства, называемого масс-спектрографом, который используется для
разделения изотопов по массовому числу.
Закрепления материала.
В заключении отметим, что предложенная
Иваненко и Гейзенбергом протонно-нейтронная модель строения ядра впоследствии
полностью была подтверждена экспериментально. Однако оставался нерешённым ещё
один вопрос: почему ядра атомов не распадаются на отдельные нуклоны?
Действительно, ведь мы знаем, что ядра атомов являются весьма устойчивыми
образованиями, хотя в их состав входят одинаково заряженные частицы — протоны.
А поскольку размеры ядер очень малы, то между протонами должны существовать
огромные силы электрического отталкивания — порядка 230 ньютонов, что для
частиц с массой порядка 10–27 степени килограмм является очень
большой силой. Поэтому возникает вопрос: какое взаимодействие препятствует
взаимному отталкиванию между одноимённо заряженными частицами?
Мы знаем, что, кроме
электромагнитных сил, в природе существуют также гравитационные силы. Может
быть, стабилизирующую роль в ядрах играет именно гравитационное взаимодействие
между нуклонами?
Нет, так как расчёты
показывают, что сила гравитационного притяжения между двумя протонами в ядре
пренебрежимо мала по сравнению с силой электростатического отталкивания. Этот
результат позволяет сделать вывод о том, что между ядерными частицами,
по-видимому, действуют силы особой природы, радикально отличающиеся от
гравитационных и электромагнитных сил. Эти силы принято называть ядерными
силами. А так как ядерное взаимодействие во много раз превосходит
электромагнитное, то его ещё называют сильным взаимодействием.
Другой особенностью ядерных
сил является то, что они очень быстро убывают с увеличением расстояния между
ядерными частицами. Проще говоря, они действуют на расстояниях, сравнимыми с
размерами самих ядер.
Лекция
24
План
лекции
-
Состав
атомного ядра -
Характеристики
атомного ядра
-
Зарядовое
число ядра -
Размер
ядра -
Спин
ядра -
Энергия
связи нуклонов в ядре
-
Ядерные
реакции
-
Понятие
и основные типы -
Деление
ядер -
Синтез
ядер
-
Понятие
о дозиметре и защите
Состав атомного ядра.
Атомное
ядро.
Ядро
простейшего атома – атома водорода –
состоит из одной элементарной частицы,
называемой протоном. Ядра всех остальных
атомов состоят из двух видов элементарных
частиц – протонов и нейтронов. Эти частицы
носят название нуклонов.
Протон.
Протон
(p) обладает зарядом + и массой
mp=
938,28 МэВ
Для
сравнения укажем, что масса электрона
равна
me=
0,511 МэВ
Из
сопоставления и следует, что
mp=
1836me
Протон
имеет спин, равный половине (s=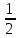 ),
),
и собственный магнитный момент
 =+2.79,
=+2.79,
Где
 =
= =5,05*
=5,05* эрг/Гс
эрг/Гс
(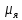 =5.05*
=5.05*
Дж/Тл) – единица магнитного момента,
называемая ядерным магнетоном. Из
сравнения масс протона и электрона
вытекает, что μя
в
1836 раз меньше магнетона Бора μб.
Следовательно, собственный магнитный
момент протона примерно в 660 раз меньше,
чем магнитный момент электрона.
Нейтрон.
Нейтрон
(n) был открыт в 1932 г. английским физиком
Д.Чедвиком. Электрический заряд этой
частицы равен нулю, а масса
mn=
939,57МэВ очень близка к массе протона.
Разность
масс нейтрона и протона (mn–mp)
составляет 1,3 МэВ, т.е. 2,5 me.
Нейтрон
обладает спином, равным половине (s= )
)
и (несмотря на отсутствие электрического
заряда) собственным магнитным моментом
μn=
– 1,91μя
(знак
минус указывает на то, что направления
собственных механического и магнитного
моментов противоположны). Объяснение
этого удивительного факта будет дано
позже.
Отметим,
что отношение экспериментальных значений
μpи
μnс
большой степенью точности равно – 3/2.
Это было замечено лишь после того, как
такое значение было получено теоретически.
В
свободном состоянии нейтрон нестабилен
(радиоактивен) он самопроизвольно
распадается, превращаясь в протон и
испуская электрон (e–)
и еще одну частицу, называемую антинейтрино
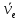 .
.
Период полураспада (т.е. время, за которое
распадается половина первоначального
количества нейтронов) равен примерно
12 мин.
Схему
распада можно написать следующим
образом:

Масса
покоя антинейтрино равна нулю. Масса
нейтрона больше массы протона на 2,5me.
Следовательно, масса нейтрона превышает
суммарную массу частиц, фигурирующих
в правой части уравнения на 1,5me,
т.е. на 0,77 МэВ. Эта энергия выделяется
при распаде нейтрона в виде кинетической
энергии образующихся частиц.
Характеристики атомного ядра.
Зарядовое
число
Одной
из важнейших характеристик атомного
ядра является зарядовое
число Z.
Оно равно количеству протонов, входящих
в состав ядра, и определяет его заряд,
который равен +Ze.
Число Z определяет порядковый номер
химического элемента в периодической
таблице Менделеева. Поэтому его также
называют атомным номером ядра.
Число
нуклонов (т.е. суммарное число протонов
и нейтронов) в ядре обозначается буквой
А и называется массовым числом ядра.
Число нейтронов в ядре равно N=A–Z.
Для
обозначения ядер применяется символ

где
под X подразумевается химический символ
данного элемента. Слева вверху ставится
массовое число, слева внизу атомный
номер (последний значок часто опускают).
Иногда массовое число пишут не слева,
а справа от символа химического элемента

Ядра
с одинаковым Z, но разными А называются
изотопами.
Большинство
химических элементов имеет по несколько
стабильных изотопов. Так, например, у
кислорода имеется три стабильных
изотопа:
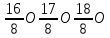 ,
,
у олова – десять.
Водород
имеет три изотопа:
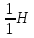
обычный
водород, или протий (Z=1, N=0),

тяжелый
водород, или дейтерий (Z=1, N=1),
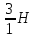
тритий
(Z=1, N=2).
Протий
и дейтерий стабильны, тритий радиоактивен.
Ядра
с одинаковым массовым числом А называются
изобарами.
В качестве примера можно привести
 .
.
Ядра с одинаковым числом нейтронов N =
A -Z носят название изотопов
 N.Наконец,
N.Наконец,
существуют радиоактивные ядра с
одинаковыми Z и A, отличающиеся периодом
полураспада. Они называются изомерами.
Например, имеются два изомера ядра,

у одного из них период полураспада равен
18 мин, у другого – 4,4 часа.
Известно
около 1500 ядер, различающихся либо Z, либо
А, либо тем и другим. Примерно 1/5 часть
этих ядер устойчивы, остальные
радиоактивны. Многие ядра были получены
искусственным путем с помощью ядерных
реакций.
В
природе встречаются элементы с атомным
номером Z от1до 92, исключая технеций (Tc,
Z = 43) и прометий (Pm, Z = 61). Плутоний (Pu, Z =
94) после получения его искусственным
путем был обнаружен в ничтожных
количествах в природном минерале –
смоляной обманке. Остальные трансурановые
(т.е. заурановые)
элементы (с Z от 93 до 107) были получены
искусственным путем посредством
различных ядерных реакций.
Трансурановые
элементы кюрий (96 Cm), эйнштейний (99Es),
фермий (100 Fm) и менделевий (101 Md) получили
название в честь выдающихся ученых
Кюри, Эйнштейна, Ферми и Менделеева.
Лоуренсий (103 Lw) назван в честь изобретателя
циклотрона Лоуренса. Курчатовий (104 Ku)
получил свое название в честь выдающегося
физика Курчатова.
Некоторые
трансурановые элементы, в том числе
курчатовий и элементы с номерами 106 и
107, были получены в Лаборатории ядерных
реакций Объединенного института ядерных
исследований в Дубне ученым Н.Н. Флеровым
и его сотрудниками.
Размеры
ядер.
В
первом приближении ядро можно считать
шаром, радиус которого довольно точно
определяется формулой R=1.3*
Acm=1.3A
Ферми (ферми – название применяемой в
ядерной физике единицы длины, равной
10-13см).
Из
формулы следует, что объем ядра
пропорционален числу нуклонов в ядре.
Таким образом, плотность вещества во
всех ядрах примерно одинакова.
Спин
ядра.
Спины
нуклонов складываются в результирующий
спин ядра. Спин нуклона равен 1/2. Поэтому
квантовое число спина ядра будет
полуцелым при нечетном числе нуклонов
А и целым или нулем при четном А. Спины
ядер не превышают нескольких единиц.
Это указывает на то, что спины большинства
нуклонов в ядре взаимно компенсируют
друг друга, располагаясь антипараллельно.
У
всех четно-четных
ядер
(т.е. ядро с четным числом протонов и
четным числом нейтронов) спин равен
нулю.
Механический
момент ядра MJ
складывается
с моментом электронной оболочки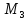
в полный момент импульса атома MF,
который определяется квантовым числом
F.
Взаимодействие
магнитных моментов электронов и ядра
приводит к тому, что состояния атома,
соответствующие различным взаимным
ориентациям MJ
и
M3
(т.е. различным F), имеют немного отличающуюся
энергию. Взаимодействием моментов μL
и
μS
обусловливается
тонкая структура спектров. Взаимодействием
μJ
и
μз
определяется
сверхтонкая структура атомных спектров.
Расщепление спектральных линий,
соответствующее сверхтонкой структуре,
настолько мало (порядка нескольких
сотых ангстрема), что может наблюдаться
лишь с помощью приборов самой высокой
разрешающей силы.
Энергия
связи нуклонов в ядре
Ядерные
силы притягивают нуклоны, находящиеся
в атомном ядре, друг к другу и не дают
ему развалиться на части. Чтобы разделить
атомное ядро на составляющие нуклоны,
необходимо совершить работу против
действия ядерных сил. Энергию, которую
необходимо затратить для расщепления
ядра на отдельные нуклоны, называют
энергией
связи
атомного
ядра. Из закона сохранения энергии
следует, что при образовании ядра из
отдельных нуклонов происходит выделение
энергии, равной по величине энергии
связи данного атомного ядра. Выделение
энергии, происходящее при образовании
атомного ядра, происходит за счёт работы
ядерных сил, притягивающих нуклоны друг
к другу.
Энергию
связи атомного ядра часто измеряют в
электрон-вольтах(эВ)
– внесистемных единицах энергии,
численно равным энергии, приобретаемой
частицей, несущей один элементарный
заряд при перемещении в ускоряющем
электрическом поле между двумя точками
с разностью потенциалов 1 В. 1 эВ = 1,60219×
 Дж.
Дж.
Применяются также кратные единицы –
килоэлектрон-вольт (кэВ), равный 103эВ
и мегаэлектрон-вольт (МэВ), равный106эВ.
Рассчитать
энергию связи ядер можно, используя
соотношение между энергией и массой,
открытое Эйнштейном в созданной им
специальной теории относительности.
Согласно теории относительности
покоящееся тело массой m
обладает
энергией E,
которая равна:
Е=
mc2,
где с–
скорость света. Из следует, что, если
масса тела изменится на Dm,
то и его энергия изменится на величину
DE,
и при этом:
DЕ=
Dmc2.
(24.1)
Измерения
показали, что масса ядра Мя всегда
меньше суммы масс нуклонов, из которых
оно состоит, что можно записать в виде:
Мя<Zmp+Nmn,
Где
mp
и mn
–
массы протона и нейтрона, а Z
и
N–
их количество в ядре, соответственно.
Превышение суммы масс нуклонов, входящих
в ядро, над массой ядра называют дефектом
масс
DM:
DM=Zmp+Nmn–Мя.
(24.2)
Дефект
масс вызван тем, что нуклоны, образуя
ядро, теряют энергию, равную энергии
связи этого ядра. Поэтому, подставляя
(24.1) в (24.2), можно найти следующее выражение
энергии связи ядра EСВ:
EСВ=
DM×с2=
(Zmp+Nmn–Мя)×с2
(24.3)
С
помощью (24.3) можно вычислить энергию
связи любых ядер. Например, энергия
связи самого простого ядра, дейтерия ,
,
состоящего из протона и нейтрона, равна
2,2 МэВ. Чтобы расщепить на нуклоны
α-частицу ( )
)
необходимо затратить 28МэВ, а энергия
связи ядра изотопа железа (
составляет
493МэВ.
Чем
больше массовое число атомного ядра,
тем больше его энергия связи. Важной
характеристикой атомного ядра является
его удельная
энергия связи
отношение энергии связи ядра к его
массовому числу. Удельная энергия связи
– это энергия связи, приходящаяся на
один нуклон.
Удельная
энергия связи ядра всегда больше энергии,
необходимой для разделения молекулы
на атомы (энергия химической связи) или
отщепления электрона от атома (энергия
ионизации). Например, энергия химической
связи молекулы водорода (4,8 эВ) и энергия
ионизации атома водорода (13, 6 эВ) в сотни
тысяч раз меньше удельной энергии связи
ядра дейтерия (1,1 МэВ/нуклон).
Зависимость
удельной энергии связи (ЕСВ/А)
от массового числа А ядра
показана на рис. 37. Видно, что с ростом
массового числа удельная энергия связи
сначала увеличивается, потом достигает
максимума (около 8,8 МэВ/нуклон), а далее
с ростом А постепенно
снижается до 7,6 МэВ/нуклон для изотопа
урана.

При этом максимальную удельную энергии
связи имеют ядра элементов с массовыми
числами от 50 до 60, т.е. ядра железа и
близких к нему элементов.
Соседние файлы в папке Физика
- #
- #
16.04.2020396.35 Кб29.docx
- #
- #
- #
- #
- #

