Насыщенный пар используется во многих областях промышленности, поэтому для работы различных устройств важно поддерживать состояние насыщения пара.
Рассмотрим, как определить насыщенный пар или нет. Также в статье даны способы определения насыщенности пара, формула и примеры расчета.
Содержание
- Данные для определения насыщенности
- Методы
- Как найти?
- Как рассчитать?
- Несколько примеров
- Где эти расчеты могут пригодиться на практике?
- Заключение
Данные для определения насыщенности
Насыщенный пар или нет, можно определить, зная условия его возникновения и зависимость от различных факторов:
- Этот тип пара образуется только в закрытых сосудах.
- Образуется только над поверхностью исходной жидкости или льдом.
- Имеет свойство конденсации.
- Насыщен влагой.
- Температура пара всегда равна температуре его жидкости.
- Плотность и давления такого пара не зависят от объема.
- Насыщенный пар имеет прямую зависимость от температуры и давления.
Насыщенный пар находится в термодинамическом равновесии с жидкостью из которой он образован. На это указывает равенство массы испарения и последующей конденсации.

Методы
Математический способ определения насыщенного пара используется при вычислении на основе имеющихся данных о его давлении, температуре, влажности и по иным параметрам.
Также есть метод определения на основе отдельных данных:
- Замер температуры пара. Указывает на состояние насыщенного пара при условии равенства температур газа и жидкости. Любое отклонение от равенства укажет на потерю динамического равновесия и уровня влажности.
- По давлению. Измеряется давление пара и сравнивается с табличной величиной при актуальной температуре.
- По степени конденсации. Рассчитывается температура конденсата и скорость его образования.
- По уровню влажности. Влажность насыщенного пара всегда равна 100%.
Также существует метод определения по точке кипения. Он основан на расчете скорости парообразования при актуальном давлении. Например, при давлении 101 кПа, точкой парообразования является температура 100 градусов.
Существуют также некоторые лабораторные методы определения:
- статический,
- динамический,
- кинетический.
Они также основаны на замерах температуры, давления, плотности, влажности и конденсации при определенных условиях и сравнении полученных данных с таблицей насыщенного пара по температуре и давлению.
Как найти?
Свойства насыщенного пара не позволяют приравнивать его к идеальному газу, поэтому для его расчета используется формула Менделеева-Клапейрона.
Как рассчитать?
Расчет выполнятся по формуле: pV=vRT.
 Уравнение состоит из:
Уравнение состоит из:
- «p» — давление насыщенного пара (Па);
- «V» — его объем (м3);
- «v» — общее количество вещества (моль);
- «R» — газовая постоянная (8,31 м2);
- «T» — температура среды (К).
Данная формула помогает рассчитать не только параметры насыщенного пара, но и их изменения при изменении плотности, объема или давления.
Несколько примеров
Задача:
- В цилиндре находится насыщенный пар и вода при постоянной температуре.
- Поршень сдвигается, уменьшая свободный объем пространства.
- Выяснить, как повлияет уменьшение объема на общую массу жидкости.
Ответ: масса жидкости увеличится, по причине обратного фазового перехода пара в жидкость.
Согласно уравнению pV=m/u*Rt, при снижении общего объема пара не последует снижения его давления, а значит пар конденсируется обратно в воду, увеличив ее общую массу.
Задача:
- Температура насыщенного пара 100 градусов.
- Давление 101 кПа.
- Плотность неизвестна.
Решение: P=pu/Rt=105*18*10-3/8,31*373=0,5 кг/м3.
Ответ: насыщенный пар при температуре 100 градусов по Цельсию и при давлении 101 кПа имеет плотность 0,5 кг/м3. При решении данной задачи использовались табличные величины молярной массы, газовой постоянной и давлении при данной температуре.
Где эти расчеты могут пригодиться на практике?
 Расчет состояния насыщенного пара используется во многих сферах:
Расчет состояния насыщенного пара используется во многих сферах:
- при проектировании бытовых систем вентиляции и кондиционирования;
- для эффективной работы отопительных систем;
- при проектировании и поддержании работы паровых турбинных установок.
На основе этих расчетов строятся «умные» датчики влажности, которые реагируют на количество молекул воды или иных веществ в воздухе. Свойства насыщенного пара также применяются при выпаривании летучих веществ с их очисткой за счет последующей конденсации их насыщенных паров.
Заключение
Свойства насыщенного пара не делают его идеальным газом, но позволяют использовать в быту и в промышленности. Этот пар является идеальным источником тепла, влажности и помогает разделять химические элементы за счет способности к конденсации.
Формула расчета по уравнению Менделеева-Клапейрона позволяет рассчитать основные параметры пара и определить степень его схожести с насыщенным.
Вода
и. водяной пар широко применяются в
энергетике, в отоплении, вентиляции,
горячем водоснабжении.
Водяной
пар – реальный газ. Он может быть влажным,
сухим насыщенным и перегретым. Уравнения
состояния реальных газов сложны, поэтому
в теплотехнических расчетах предпочитают
использовать таблицы и диаграммы.
Особое значение для технических расчетов
процессов с водяным паром имеет h,s
-диаграмма водяного пара.
В
диаграмме h,S
нанесена (рисунок 5.1 а), верхняя
пограничная кривая (степень сухости
пара X=1)
соответствующая
сухому насыщенному пару. Выше этой
кривой располагается область перегретого
пара.

а)
б)
Рисунок
5.1 Диаграмма hS
водяного пара
Ниже
влажного насыщенного пара. В область
влажного насыщенного пара нанесены
кривые сухости ( X=0,95;
Х=0,90; X=0.85
и т.д.)
В
координатных, осях hS
(рисунок 5.1 а) нанесены кривые простейших
процессов р=сonst
(изобары); v=
сonst
(изохоры); t
=сonst
(изотермы); любая вертикальная линия
(рисунок 5.1 б) изображает адиабатный
процесс (S=const
).
В
области влажного насыщенного пара
изотермы (t
=сonst
)совпадают с
кривыми
изобары (р=сonst),
так как парообразование происходит
при постоянном давлении и при постоянной
температуре. На верхней пограничной
кривой направление изотермы меняется
и в пограничной кривой направление
изотермы меняется, и
области
перегретого пара изотермы отклоняются
вправо и не совпадают с изобарами.
Практически
применяется часть диаграммы hS,
когда X![]()
0,5,
которая
заключена в рамку. Эта часть диаграммы
приведена на рисунке 5.1.
Состояние
перегретого пара на диаграмме hS
определяется двумя параметрами (р1
и
t1
или
р1
и
v1
),
а влажного насыщенного пара – одним
параметром и степенью сухости пара Х.
По двум заданным параметрам р1
и
t1
в
области перегретого пара находим точку
I
(рисунок 5.1 б), соответствующую заданному
состоянию водяного пара. Для этого
состояния из диаграммы можно найти все
другие параметры (h1,s1,v1).
Значение
внутренней энергии подсчитывается по
формуле
![]() (5.1)
(5.1)
Зная
вид термодинамического процесса,
двигаются по нему до пересечения с
заданным конечным параметром и находят
на диаграмме конечное состояние пара.
Определив параметры конечного состояния,
можно рассчитывать показатели процесса
(работу, теплоту, изменение параметров).
Изменение
внутренней энергии
![]()
и работу в любом процессе подсчитывают
по формулам
∆u
= u1
–
u2
= (h1
– h2)
– (p1v1
– p2
v2);
(5.2)
W=q
– ∆u = q –(h1
–
h2)+(p1v1-p2v2).
(5.3)
Рассмотрим
основные задачи, решаемые по hS
диаграмме.
Изохорный
процесс (v=
const).
Количество
теплоты, участвующей в процессе
определяется по формуле (5.2) для определения
изменения внутренней энергии. Работа
изохорного процесса равна нулю.
Изобарный
процесс (р=сonst).
Количество
теплоты, участвующая в процессе
определяется по формуле
![]()
(5.4)
Изменение
внутренней энергии по формуле 5.2
Работу
изобарного процесса можно сравнить
w=
p
(v2
–
v1)
(5.5)
или
по формуле (5.3).
Изотермический
процесс (T
=сonst).
Теплоту
и работу процесса находят по формуле
![]()
(5.6)
Адиабатный
процесс (рvk=const).
На рисунке 5.1б
представлен адиабатный процесс,
протекающий без теплообмена с внешней
средой. В адиабатном процессе энтропия
не изменяется и очень часто этот процесс
называется изоэнтропным.
Работа
процесса происходит за счет изменения
внутренней энергии![]() .
.
Процесс
при постоянной степени сухости (Х=сonst)
решается также по диаграмме hS
(рисунок 5.2).
Приблизительное
количество определяется по формуле
![]() .
.
(5.7)
Изменение
внутренней энергии в процессе находят
обычным способом по формуле 5.2
Работа
процесса определяется по формуле (5.3).
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Фазовые переходы: изменение агрегатных состояний вещества
Прежде чем говорить о насыщенном паре, нужно освежить знания об агрегатных состояниях и фазовых переходах между ними. Если вы забыли, какие бывают агрегатные состояния, то можете сбегать в нашу статью про них.
При изменении внешних условий (например, если внутренняя энергия тела увеличивается или уменьшается в результате нагревания или охлаждения) могут происходить фазовые переходы — изменения агрегатных состояний вещества.
Вот какие бывают фазовые переходы:
-
Переход из твердого состояния в жидкое — плавление;
-
Переход из жидкого состояния в твердое — кристаллизация;
-
Переход из газообразного состояния в жидкое — конденсация;
-
Переход из жидкого состояния в газообразное — парообразование;
-
Переход из твердого состояния в газообразное, минуя жидкое — сублимация;
-
Переход из газообразного состояния в твердое, минуя жидкое — десублимация.
На схеме — названия всех фазовых переходов:
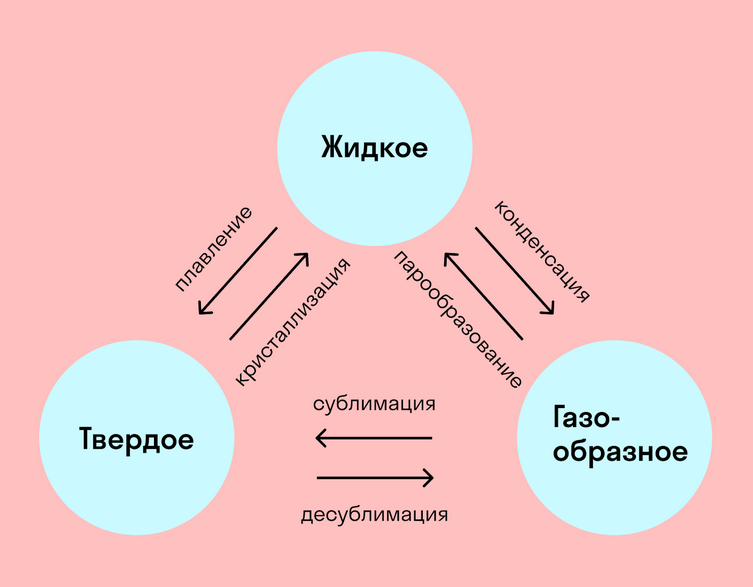
Фазовые переходы — важная штука. Все живое не Земле существует лишь благодаря тому, что вода умеет превращаться в лед или пар. С кристаллизацией, плавлением, парообразованием и конденсацией связаны многие процессы в металлургии и микроэлектронике.
Получай лайфхаки, статьи, видео и чек-листы по обучению на почту
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков

Парообразование
Итак, парообразование — это переход из жидкого состояния в газообразное.
При парообразовании всегда происходит поглощение энергии: к веществу необходимо подводить теплоту, чтобы оно испарялось. Из-за этого внутренняя энергия вещества увеличивается.
У процесса парообразования есть две разновидности: испарение и кипение.
-
Испарение — это превращение или переход жидкости в газ (пар) со свободной поверхности жидкости. Если поверхность жидкости открыта и с нее начинается переход вещества из жидкого состояния в газообразное, это будет называться испарением.
-
Кипение — процесс интенсивного парообразования, который происходит в жидкости при определенной температуре.
Например, мы заварили себе горячий чай. Над чашкой мы увидим пар, так как вода только что поучаствовала в процессе кипения.
Подождите-ка, мы ведь только что сказали, что кипение и испарение — разные вещи. 🤔 Это действительно так, но при этом оба процесса могут происходить параллельно.
Испарение может происходить и без кипения, просто тогда оно не будет для нас заметно. Например, вода в озере испаряется, хотя мы этого и не замечаем. Кипение по сути своей — это интенсивное испарение, которое вызвали внешними условиями — доведя вещество до температуры кипения.
Физика объясняет испарение тем, что жидкость обычно несколько холоднее окружающего воздуха, и из-за разницы температур происходит испарение.
Если нет каких-то внешних воздействий, испарение жидкостей происходит крайне медленно. Молекулы покидают жидкость из-за явления диффузии.
Направление тепловых потоков при испарении может идти в разной последовательности и комбинациях:
-
из глубины жидкости к поверхности, а затем в воздух;
-
только из жидкости к поверхности;
-
к поверхности из воды и газовой среды одновременно;
-
к площади поверхности только от воздуха.
Подытожим, чтобы не запутаться, в чем главная разница между испарением и кипением:
|
Испарение |
Кипение |
|---|---|
|
|
Температура кипения
При температуре кипения давление насыщенного пара становится равным внешнему давлению на жидкость — чаще всего это атмосферное давление. Значит, чем больше внешнее давление, тем при более высокой температуре начнется кипение.
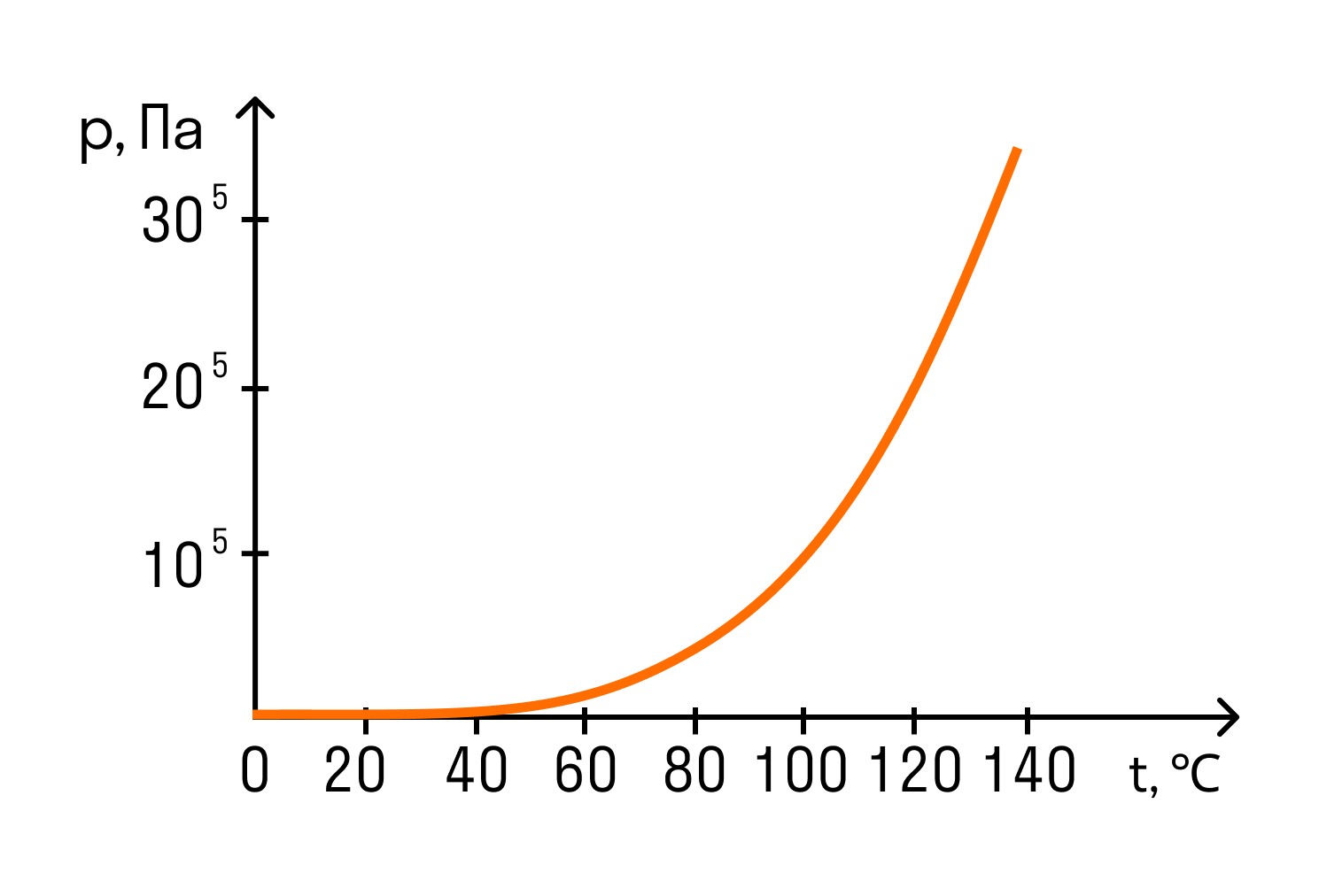
При нормальном атмосферном давлении, которое приблизительно равно 100 кПа, температура кипения воды равна 100°C. Поэтому можно сразу сказать, что давление насыщенного водяного пара при температуре 100 градусов по Цельсию равно 100 кПа. Это значение пригодится при решении задач.
Чем выше мы поднимаемся, тем меньше становится атмосферное давление, потому что масса атмосферы над нами уменьшается. Так, например, на вершине Эльбруса атмосферное давление составляет 5 × 104 Па — в два раза меньше, чем нормальное атмосферное давление. Поэтому и температура кипения на вершине Эльбруса будет ниже, чем на уровне моря. Вода там закипит при температуре 82°C.
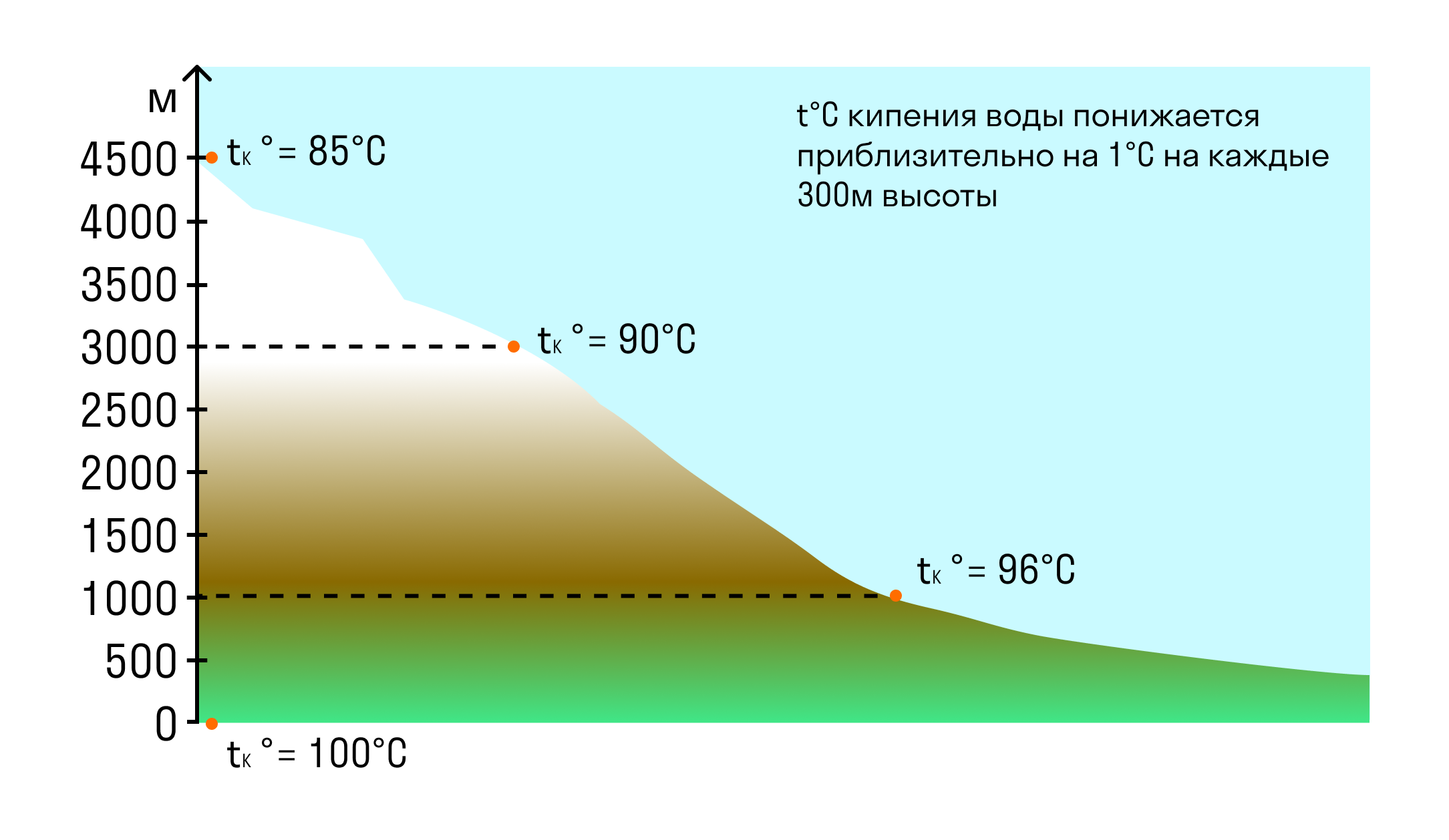
Температура кипения при нормальном атмосферном давлении — это строго определенная величина для каждой жидкости.
|
t, °C |
Вещество |
|---|---|
|
-253 -183 35 78 100 357 3050 4200 5657 |
водород кислород эфир спирт вода ртуть железо графит вольфрам |
Испарение и конденсация
Молекулы в жидкости непрерывно и хаотично движутся. Это значит, что направление движения отдельно взятых молекул — это случайные направления. При этом жидкость сохраняет свой объем. Также молекулы силами притяжения притягиваются друг к другу, из-за чего не могут покинуть Омск жидкость.
Значения скоростей молекул случайны. Из-за этого среди всех молекул обязательно есть те, что движутся очень быстро. Если такая молекула окажется вблизи поверхности раздела жидкости и окружающей среды, то ее кинетическая энергия может достигнуть большого значения, и молекула покинет жидкость.
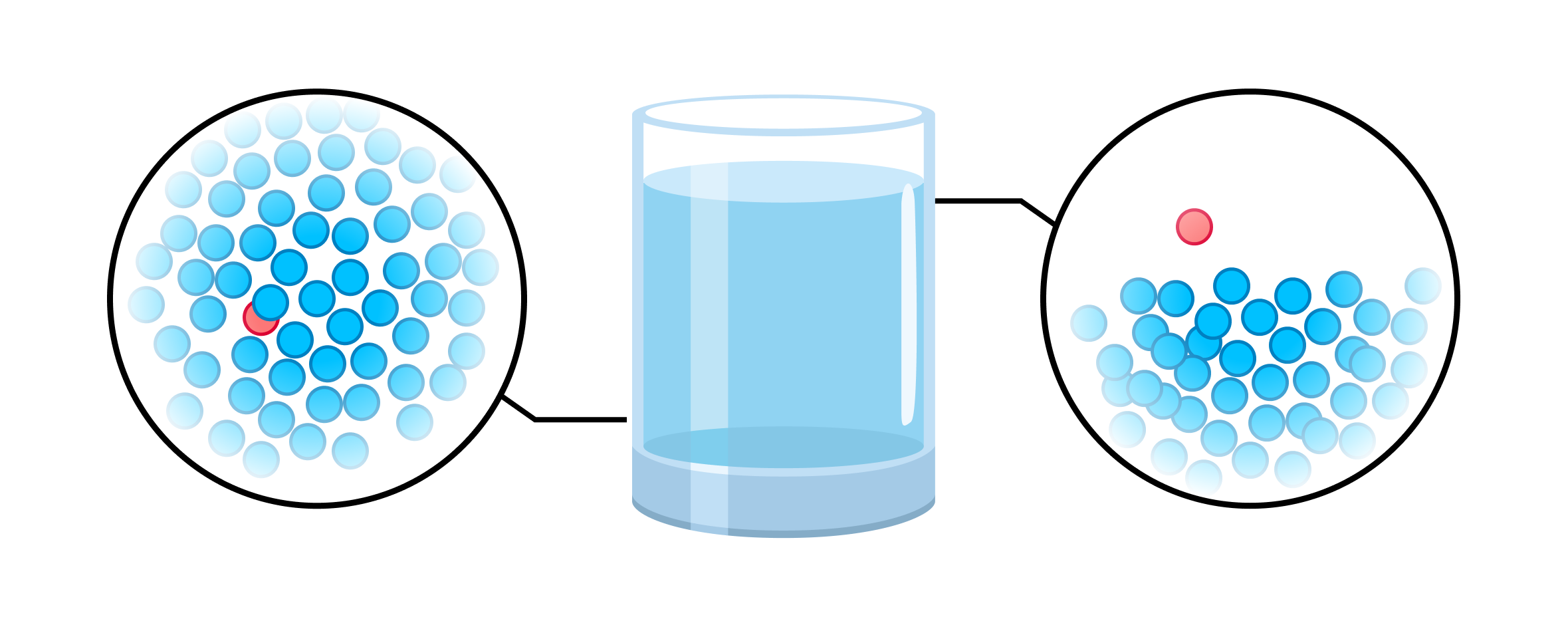
Собственно, именно так происходит процесс испарения (мы говорили о нем выше, когда речь шла о фазовых переходах). Когда испарившихся молекул становится много, образуется пар.
Обратный процесс тоже возможен: вырвавшиеся за пределы жидкости молекулы вернутся в жидкость. Это конденсация, о ней мы тоже говорили.
Если открыть сосуд с жидкостью, то испарившиеся молекулы будут покидать пространство над жидкостью и не возвращаться обратно. Количество жидкости таким образом будет уменьшаться. То есть жидкость испаряется, а пар обратно не конденсируется (потому что молекулы этого пара удаляются от жидкости) — так происходит высыхание.
Испарение может происходить с разной скоростью. Чем больше силы притяжения молекул друг к другу, тем меньшее число молекул в единицу времени окажется в состоянии преодолеть эти силы притяжения и вылететь наружу, и тем меньше скорость испарения.
Быстро испаряются такие жидкости, как эфир, ацетон, спирт. Из-за этого свойства их иногда называют летучими жидкостями. Медленнее — вода. Намного медленнее воды испаряются масло и ртуть.
Курсы подготовки к ОГЭ по физике помогут снять стресс перед экзаменом и получить высокий балл.
Определение насыщенного пара
Оставим стакан воды на столе и будем замерять уровень воды в нем каждый день. Если записать эти измерения и сравнить их, станет очевидно: уровень воды стал меньше, то есть вода испарилась.
Теперь давайте накроем стакан сверху. Молекулы пара уже не смогут покидать пространство над жидкостью, по мере испарения их количество начнет расти, а значит, будет расти и количество молекул, которые конденсируются в единицу времени.
Сначала количество конденсирующихся молекул за единицу времени будет меньше количества испаряющихся молекул. Но по мере роста концентрации пара (то есть увеличении количества молекул в единице объема пара) поток конденсирующихся молекул вырастет. Это приведет к состоянию, которое называется динамическим равновесием.
Пар, находящейся в динамическом равновесии, называют насыщенным.
Представьте себе огромный бизнес-центр с не менее огромными дверями. У сотрудников бизнес-центра разный график работы, поэтому люди одновременно заходят в здание и выходят из него в произвольном количестве. Допустим, в 6 часов вечера 100 человек заходят в здание, чтобы попасть на деловую встречу, а другие 100 человек уже закончили работать и идут домой. Количество заходящих в бизнес-центр и выходящих из него будет одинаковым — это и есть состояние насыщения.
Значение давления насыщенного пара и его плотности являются максимальными при заданном значении температуры. Если это не так, то пар ненасыщенный.
Свойства насыщенного пара
-
При постоянной температуре плотность насыщенного пара не зависит от его объема.
Представьте, что объем сосуда с насыщенным паром уменьшили, не изменив температуры.
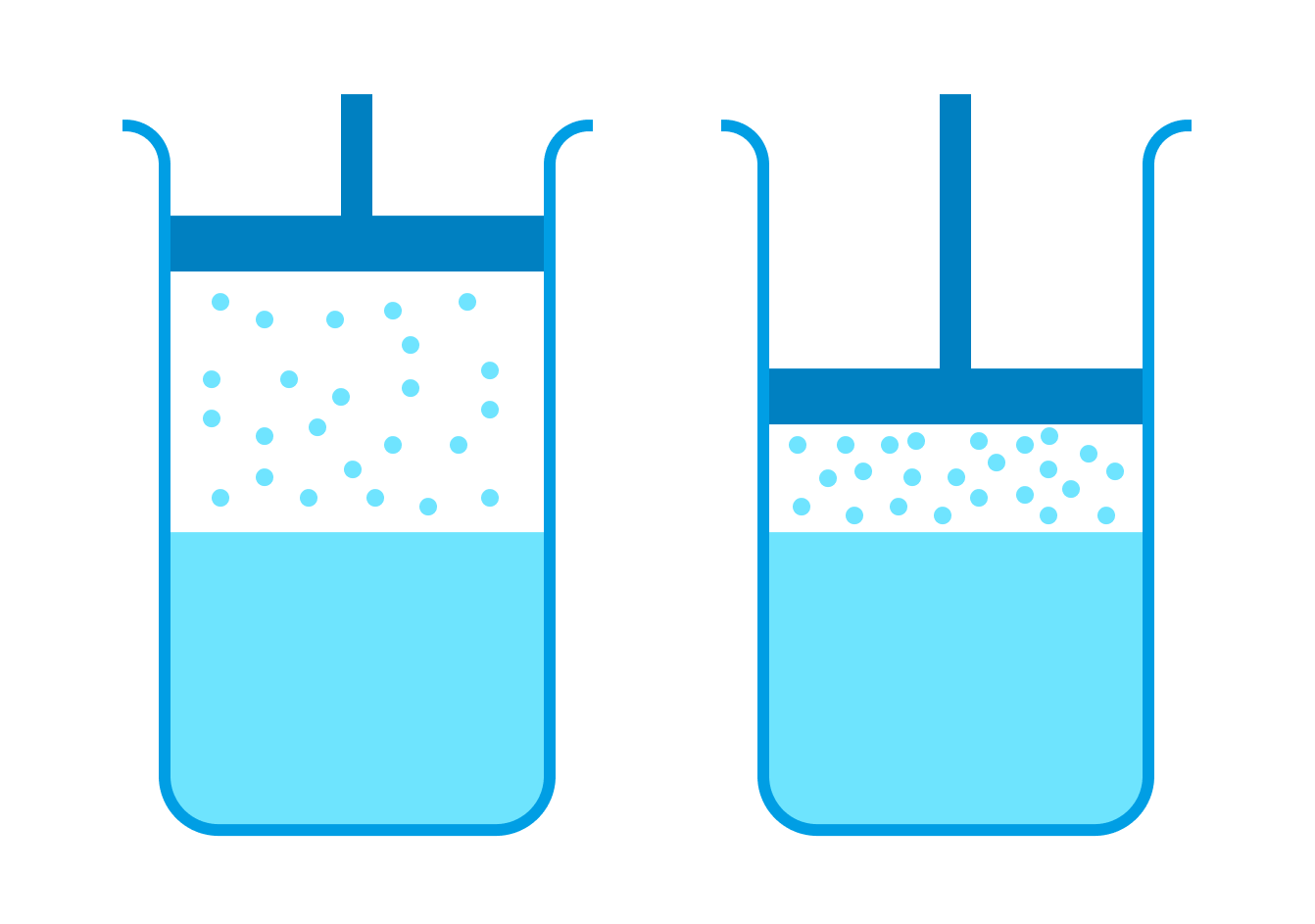
Количество молекул, переходящих от пара к жидкости, превысит количество испаряющихся молекул, но при этом часть пара сконденсируется, а оставшийся пар снова придет в динамическое равновесие. В итоге плотность этого пара будет равна начальной плотности.
-
Давление насыщенного пара не зависит от его объема.
Это связано с тем, что давление и плотность связаны через уравнение Менделеева-Клапейрона, и следует из первого свойства насыщенного пара.
Кстати, уравнение Менделеева-Клапейрона справедливо для насыщенного пара. При этом нужно быть внимательным с частными случаями. Так, например, закон Бойля-Мариотта для насыщенного пара не выполняется.
Уравнение Менделеева-Клапейрона
pV = νRT
p — давление газа [Па]
V — объем [м3]
ν — количество вещества [моль]
T — температура [К]
R — универсальная газовая постоянная
R = 8,31 м2 × кг × с-2 × К-1 × моль-1
-
При неизменном объеме плотность насыщенного пара растет с повышением температуры и уменьшается с понижением температуры.
В начальный момент испарения динамическое равновесие будет нарушено (некоторая часть жидкости испарится дополнительно). Плотность пара будет расти, пока динамическое равновесие не восстановится.
-
Давление и температура насыщенного пара растут быстрее, чем по линейному закону, который справедлив для идеального газа.
В случае идеального газа рост давления обусловлен только ростом температуры, а в случае с насыщенном паром имеют значение два фактора: температура и масса пара.
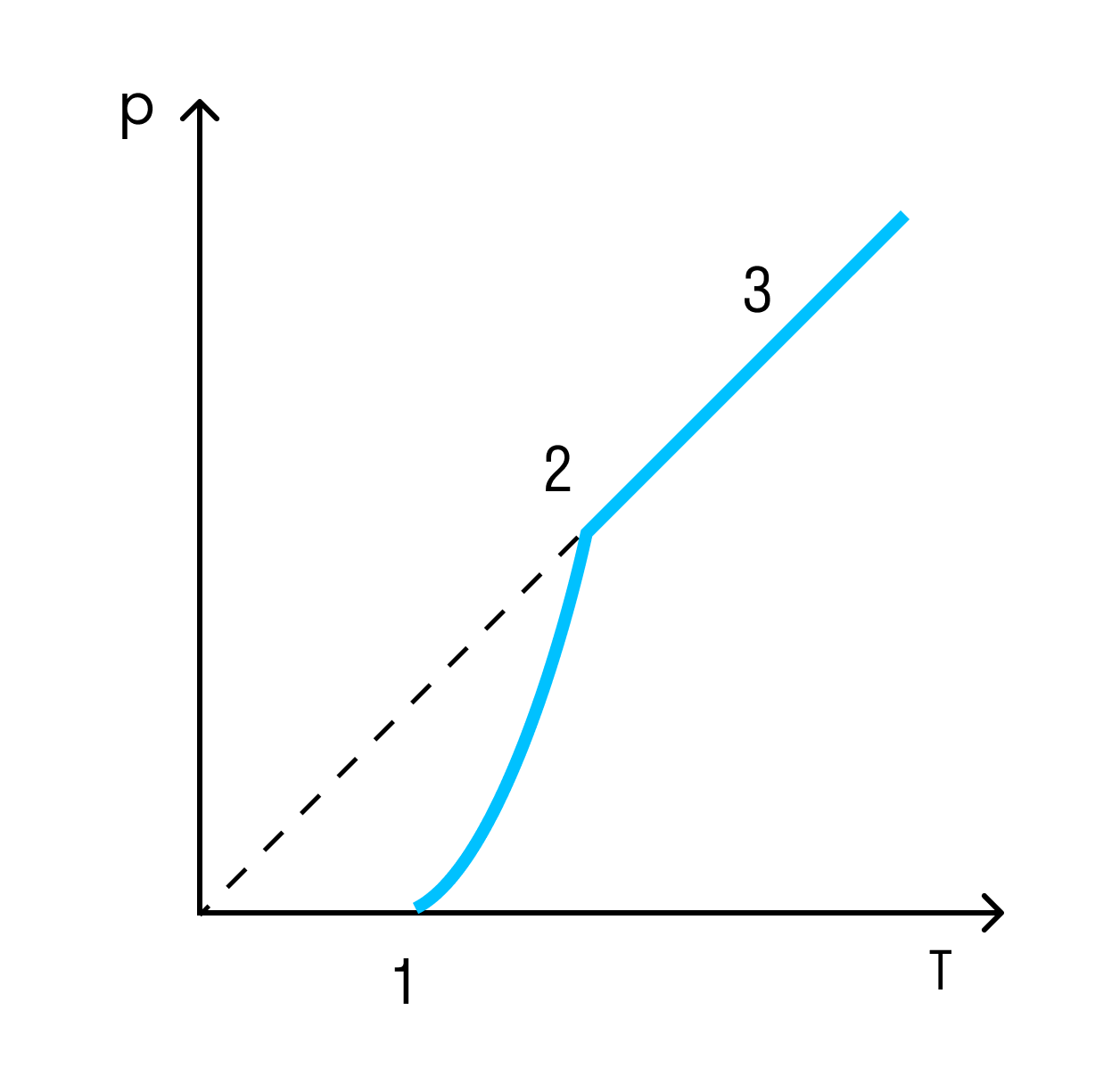
В случае нагревания насыщенного пара молекулы начинают ударяться чаще, так как их в целом стало больше, потому что пара стало больше.
Главное отличие насыщенного пара от идеального газа: пар сам по себе не является замкнутой системой, а находится в постоянном контакте с жидкостью.
Решение задач по теме «Насыщенный пар»
Применим свойства насыщенного пара при решении задач.
-
Задачка раз
В цилиндрическом сосуде под поршнем длительное время находятся вода и ее пар. Поршень начинают вдвигать в сосуд. При этом температура воды и пара остается неизменной. Как будет меняться при этом масса жидкости в сосуде? Ответ поясните.
Решение
Так как пар и вода находятся в контакте длительное время, пар является насыщенным. При уменьшении объема сосуда давление насыщенного пара не меняется. Из уравнения Менделеева-Клапейрона следует, что для того, чтобы давление пара не менялось, его количество вещества (а значит и масса) должно уменьшаться.
pV = νRT
В этом процессе происходит конденсация, часть молекул пара переходят в жидкость, поэтому масса жидкости увеличивается.
Ответ
Масса жидкости увеличивается.
-
Задачка два
Какова плотность насыщенного пара при температуре 100°С?
Решение
При нормальном давлении (p = 105 Па) 100°С — это температура кипения воды. Значит, давление насыщенного пара при этой температуре равно атмосферному давлению.
Найдем связь между давлением и плотностью через уравнение Менделеева-Клапейрона.

Подставим значение давления в уравнение состояния идеального газа, предварительно переведя температуру в Кельвины:
T = 100 + 273 = 373 K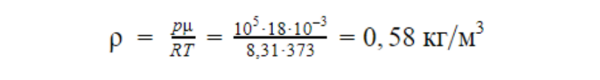

Размер: 3070х3995 пикселей
Форматы: .PDF, .JPG
Диаграмма цветная — степени сухости, температура, давление и объем выделены разными цветами, что делает работу с диаграммой очень удобной.
Большой размер позволит распечатать диаграмму на формате А3 и больше.
is-диаграмма применяется для практических расчетов процессов водяного пара. На ней теплота и энтальпия измеряются линейными отрезками.
is-диаграмма обладает рядом важных свойств: по ней можно быстро определить параметры пара и разность энтальпий в виде отрезков, наглядно изобразить адиабатный процесс, и решать другие задачи.
Так же вы можете использовать очень удобную и наглядную программу.
Описание is-диаграммы
На is-диаграмме изображены термодинамические процессы:
- Изобарный процесс (p = const) — фиолетовые линии (изобары),
- Изотермический процесс (t = const) — зеленые линии (изотермы),
- Изохорный процесс (v = const) — красные линии (изохоры).
Степень сухости и паросодержание (х) — розовые линии. Жирная розовая линия — степень сухости х=1. Все что ниже этой линии — зона влажного пара.
Подробнее о термодинамических процессах читайте в статье «Основные термодинамические процессы»
Ось «Х» — энтропия, ось «Y» — энтальпия.

Семейство изобар в области насыщения представляет собой пучок расходящихся прямых, начинающихся на нижней и оканчивающихся на верхней пограничной кривой. Чем больше давление, тем выше лежит соответствующая изобара. Переход изобар из области влажного насыщенного в область перегретого пара происходит без перелома на верхней пограничной кривой.
В i, s-диаграмме водяного пара наносятся также линии постоянного паросодержания (x = const) и линии постоянного удельного объема (v = const). Изохоры идут несколько круче, чем изобары.
Состояние перегретого пара обычно определяется в технике давлением p и температурой t. Точка, изображающая это состояние, находится на пересечении соответствующей изобары и изотермы. Состояние влажного насыщенного пара определяется давлением p и паросодержанием x.
Точка, изображающее это состояние, определяется пересечением изобары и линии x = const.
Как пользоваться is-диаграммой
Для описания воспользуемся небольшой задачей. Возьмем с потолка условие.
Пусть начальные параметры пара будут: давление пара р = 120 бар, температура пара t = 550°С. Пар адиабатно расширяется в турбине до температуры, например, 400 °С.
Для примера этого будет достаточно.
Адиабатный процесс на is-диаграмме — это вертикальная линия (горизонтальная линия — дросселирование). Это для справки.
Итак, начальное давление и температура у нас есть. Найдем эту точку на is-диаграмме:
Нам нужна изобара, соответствующая давлению 120 бар и изотерма, соответствующая температуре 550 °С. На их пересечении и будет точка, соответствующая начальным параметрам пара в нашей задаче.

Найдя эту точку, мы уже можем определить в ней энтальпию и энтропию. Опустив на оси проекции найденной точки, узнаем значения энтальпии (ось «Y») и энтропии (ось «Х»).
i = ~3480 кДж/кг, S = 6,65 кДж/(кг•К)
Далее нам нужно узнать параметры пара после адиабатного расширения. Мы знаем, что по поставленным нами условиям, пар расширился и его температура в точке 2 = 400 °С. Я уже упоминал, что на is-диаграмме адиабатный процесс изображается в виде вертикальной линии. Проведем эту линию из точки 1 (начальные параметры) до пересечения с изотермой 400 °С.

Получена точка 2. Через эту точку проходит изобара. Она соответствует давлению 50 бар. Энтропия у нас не изменилась, так как процесс адиабатный, а вот энтальпия стала равна i = 3200 кДж/кг.
Вот и все. Дальше остаются только расчеты: определение изменения внутренней энергии (Δu), работы (l, l’) и т. д. Все это считается по формулам (формулы можете найти в статье «Основные термодинамические процессы»), а значения и график процесса расширения пара у вас уже есть.
Здравствуйте! Водяной пар может быть трех видов: влажным насыщенным, сухим насыщенным, перегретым. Рассмотрим все три вида.
Влажный насыщенный пар. Удельный объем влажного насыщенного пара находится из выражения
υ = υ”x+υ'(1— х),
где υ” — удельный объем сухого насыщенного пара; υ’ — удельный объем воды при температуре парообразования и том же давлении, что и объем υ”.
Двумя штрихами в технической термодинамике принято обозначать параметры и функции состояния сухого насыщенного пара, а одним штрихом — величины, характеризующие состояние воды при температуре парообразования.
При небольших давлениях (p < 3 МПа) удельный объем υ’ воды очень мал по сравнению с удельным объемом υ” сухого насыщенного пара. Поэтому при х>0,8 объем жидкости υ'(1—х) можно не учитывать и приближенно определять удельный объем влажного насыщенного пара из соотношения υ ≈ υ”x. В процессе парообразования при постоянном давлении для получения 1 кг влажного насыщенного пара к 1 кг кипящей жидкости необходимо подвести количество теплоты
q=rx (1)
Так как в процессе при р = const количество теплоты равно изменению энтальпии, то величину энтальпии i влажного насыщенного пара можно определить из выражения
q = rx = i—i’ или i=i’+rx. (2)
Энтальпия i’ кипящей воды при температуре парообразования и теплота парообразования г соответствуют тому же давлению, что и энтальпия i. Так как величина энтальпии при 273 К принимается за нуль, то энтальпию i’ кипящей воды можно найти из выражения
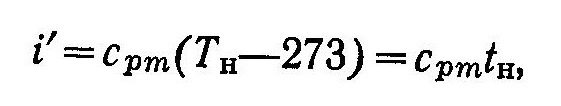 (3)
(3)
где сm — средняя массовая теплоемкость воды в интервале температур от 273 К до Тн.
Энтальпия i’ кипящей воды, как следует из выражения (3), численно равна количеству теплоты, которая затрачивается для нагревания 1 кг воды от 0° С до температуры кипения tн при р = const.
В соответствии с уравнением первого закона термодинамики q = ∆u+l имеем
r = u” — u’ + p*(u” — υ’).
Анализ этого выражения показывает, что теплота парообразования r складывается из внутренней теплоты парообразования u”- u’, затрачиваемой на изменение внутренней энергии (преодоление сил притяжения между молекулами), и внешней теплоты парообразования p (u”- u’), равной работе против внешних сил. Для давлений меньше 20 МПа внешняя теплота парообразования незначительна и не превышает 13% от величины r.
Энтропию влажного насыщенного пара найдем из выражения
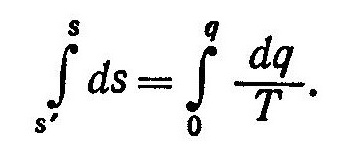
Так как в процессе парообразования при p=const T=const, то с учетом уравнения (1) получим
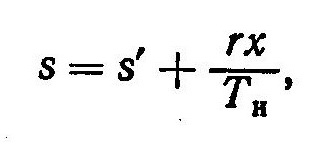
где s’— энтропия воды при температуре парообразования и том же давлении, что и величины s, г и Tн.
Величину s’ можно определить из соотношения
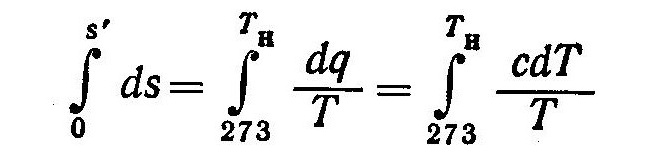 (4)
(4)
или
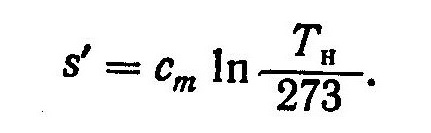
Пределы интегрирования в выражении (4) приняты в соответствии с условием, что при 273 К энтропия равна нулю.
Сухой насыщенный пар.
Состояние сухого насыщенного пара определяется значением одного параметра, например давления или температуры парообразования, так как другой параметр состояния — степень сухости — имеет определенное значение х=1. Параметры и функции состояния сухого насыщенного пара можно определить по выведенным выше формулам (1), (2) для влажного пара при условия х = 1.
Перегретый пар.
Для получения перегретого пара в котельном агрегате устанавливают специальный теплообменник (пароперегреватель), в котором происходит перегрев влажного насыщенного пара. Для характеристики состояния перегретого пара должны быть известны два любых параметра состояния пара, например давление и температура. Вместо параметров могут быть заданы функции состояния (энтальпия или энтропия).
Энтальпия перегретого пара находится из выражения
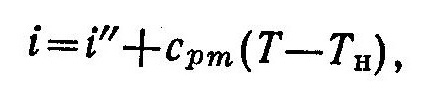 (5)
(5)
где сpm—массовая средняя изобарная теплоемкость пара в интервале температур от Tн до Т.
Энтропия перегретого пара определяется следующим образом
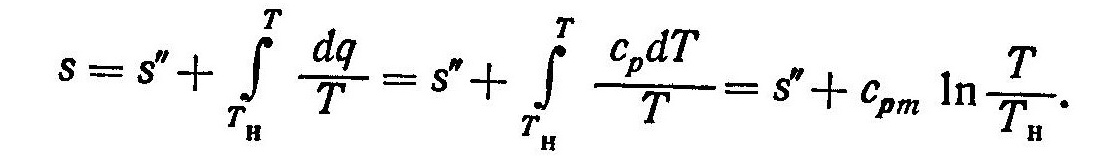 (6)
(6)
В уравнения (5) и (6) необходимо подставлять значения величин i”, s” и cpm при том же давлении, для которого определяются энтальпия i и энтропия s. Исп.литература: 1) Теплотехника и теплотехническое оборудование предприятий промышленности строительных материалов и изделий, Н.М. Никифорова, Москва, «Высшая школа», 1981. 2) Теплотехника, Бондарев В.А., Процкий А.Е., Гринкевич Р.Н. Минск, изд. 2-е,”Вышейшая школа”, 1976.
