Гидроксисоединения – это органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Гидроксисоединения делят на спирты и фенолы.
Строение, изомерия и гомологический ряд спиртов
Химические свойства спиртов
Способы получения спиртов

Если гидроксогруппа ОН соединена с бензольным кольцом, то вещество относится к фенолам.
Общая формула предельных нециклических спиртов: CnH2n+2Om, где m ≤ n.
Классификация спиртов
По числу гидроксильных групп:
- одноатомные спирты — содержат одну группу -ОН. Общая формула CnH2n+1OH или CnH2n+2O.
- двухатомные — содержат две группы ОН. Общая формула CnH2n(OH)2 или CnH2n+2O2.
- трехатомные спирты — содержат три группы ОН. Общая формула CnH2n-1(OH)3 или CnH2n+2O3.

Двухатомные спирты с двумя и тремя гидроксогруппами у одного атома углерода R‒CH(OH)2 или R-C(OH)3 неустойчивы, от них легко отрывается вода и образуется карбонильное соединение.
Классификация по числу углеводородных радикалов у атома углерода при гидроксильной группе
- Первичные спирты – группа ОН соединена с первичным атомом углерода. Например, этанол СН3–СН2–ОН.
- Вторичные спирты – группа ОН соединена с вторичным атомом углерода. Например, пропанол-2: СН3–СН(СН3)–ОН.
- Третичные спирты – группа ОН соединена с третичным атомом углерода. Например, 2-метилпропанол-2: (СН3)3С–ОН.
- Метанол не относится ни к первичным, ни к вторичным, ни к третичным спиртам.

Классификация по строению углеводородного радикала
- Предельные спирты – группа ОН соединена с предельным радикалом. Например, пропанол-1: СН3–СН2–СН2–ОН.
- Непредельные спирты – группа ОН соединена с непредельным радикалом. Например, алкенолы: СН2=СН–СН2–ОН.
Непредельные спирты, в которых гидроксильная группа соединена с атомом углерода при двойной связи (алкенолы), неустойчивы и изомеризуются в соответствующие карбонильные соединения.
- Ароматические спирты – содержат в радикале ароматическое кольцо, не связанное непосредственно с группой ОН. Например, бензиловый спирт.

Строение спиртов и фенолов
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4).
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:

Атом кислорода в спиртах находится в состоянии sp3-гибридизации.
В образовании химических связей с атомами C и H участвуют две 2sp3-гибридные орбитали, а еще две 2sp3-гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108о.

Водородные связи и физические свойства спиртов
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:

Поэтому спирты – жидкости с относительно высокой температурой кипения (температура кипения метанола +64,5оС). Температуры кипения многоатомных спиртов и фенолов значительно выше.
Таблица. Температуры кипения некоторых спиртов и фенола.
| Название вещества | Температура кипения |
| Метанол | 64 |
| Этанол | 78 |
| Пропанол-1 | 92 |
| Бутанол-1 | 118 |
| Этиленгликоль | 196 |
| Фенол | 181,8 |
Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому спирты очень хорошо растворимы в воде. Молекулы спиртов в воде гидратируются:

Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде.
Низшие спирты (метанол, этанол, пропанол, изопропанол, этиленгликоль и глицерин) смешиваются с водой в любых соотношениях.
Номенклатура спиртов
- По систематической номенклатуре к названию углеводорода добавляют суффикс «-ОЛ» и цифру, указывающую номер атома углерода, к которому присоединена гидроксильная группа.
Нумерация ведется от ближайшего к ОН-группе конца цепи.

- По радикально-функциональной номенклатуре названия спиртов составляют от названий углеводородных радикалов, соединенных с группой ОН, с добавлением слова «спирт».
Например: СН3ОН – метиловый спирт, С2Н5ОН – этиловый спирт и т.д.
- В названиях многоатомных спиртов количество групп ОН указывают суффиксами -диол в при наличии двух ОН-групп, -триол при наличии трех ОН-групп и т.д. После этого добавляют номера атомов углерода, связанных с гидроксильными группами.
Например, пропандиол-1,2 (пропиленгликоль):

Изомерия спиртов
Структурная изомерия
Для спиртов характерна структурная изомерия – изомерия углеродного скелета, изомерия положения гидроксильной группы и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета характерна для спиртов, которые содержат не менее четырех атомов углерода.
Например. Формуле С4Н9ОН соответствуют четыре структурных изомера, из них два различаются строением углеродного скелета
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Спирты являются межклассовыми изомерами с простыми эфирами. Общая формула и спиртов, и простых эфиров — CnH2n+2О.
Например. Межклассовые изомеры с общей формулой С2Н6О этиловый спирт СН3–CH2–OH и диметиловый эфир CH3–O–CH3
| Этиловый спирт | Диметиловый эфир |
| СН3–CH2–OH | CH3–O–CH3 |
Изомеры с различным положением группы ОН отличаются положением гидроксильной группы в молекуле. Такая изомерия характерна для спиртов, которые содержат три или больше атомов углерода.
Например. Пропанол-1 и пропанол-2
Химические свойства спиртов
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Химические реакции гидроксисоединений идут с разрывом одной из связей: либо С–ОН с отщеплением группы ОН, либо связи О–Н с отщеплением водорода. Это реакции замещения, либо реакции отщепления (элиминирования).
Свойства спиртов определяются строением связей С–О–Н. Связи С–О и О–Н — ковалентные полярные. При этом на атоме водорода образуется частичный положительный заряд δ+, на атоме углерода также частичный положительный заряд δ+, а на атоме кислорода — частичный отрицательный заряд δ–.
Такие связи разрываются по ионному механизму. Разрыв связи О–Н с отрывом иона Н+ соответствует кислотным свойствам гидроксисоединения. Разрыв связи С–О соответствует основным свойствам и реакциям нуклеофильного замещения.
С разрывом связи О–Н идут реакции окисления, а с разрывом связи С–О — реакции восстановления.
- слабые кислотные свойства, замещение водорода на металл;
- замещение группы ОН
- отрыв воды (элиминирование) – дегидратация
- окисление
- образование сложных эфиров — этерификация
1. Кислотные свойства
Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды.
1.1. Взаимодействие с раствором щелочей
При взаимодействии спиртов с растворами щелочей реакция практически не идет, т. к. образующиеся алкоголяты почти полностью гидролизуются водой.
![]()
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому спирты не взаимодействуют с растворами щелочей.
Многоатомные спирты также не реагируют с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Спирты взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются алкоголяты. При взаимодействии с металлами спирты ведут себя, как кислоты.
![]()
Например, этанол взаимодействует с калием с образованием этилата калия и водорода.
![]()
Видеоопыт взаимодействия спиртов (метанола, этанола и бутанола) с натрием можно посмотреть здесь.
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
Например, этилат калия разлагается водой:
CH3OH > первичные спирты > вторичные спирты > третичные спирты
Многоатомные спирты также реагируют с активными металлами:

Видеоопыт взаимодействия глицерина с натрием можно посмотреть здесь.
1.3. Взаимодействие с гидроксидом меди (II)
Многоатомные спирты взаимодействуют с раствором гидроксида меди (II) в присутствии щелочи, образуя комплексные соли (качественная реакция на многоатомные спирты).
Например, при взаимодействии этиленгликоля со свежеосажденным гидроксидом меди (II) образуется ярко-синий раствор гликолята меди:
Видеоопыт взаимодействия этиленгликоля с гидроксидом меди (II) можно посмотреть здесь.
2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии спиртов с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
Например, этанол реагирует с бромоводородом.

Видеоопыт взаимодействия этилового спирта с бромоводородом можно посмотреть здесь.
третичные > вторичные > первичные > CH3OH.
Многоатомные спирты также, как и одноатомные спирты, реагируют с галогеноводородами.
Например, этиленгликоль реагирует с бромоводородом:

2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
Например, при взаимодействии этанола с аммиаком образуется этиламин.
![]()
2.3. Этерификация (образование сложных эфиров)
Одноатомные и многоатомные спирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.

Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты):

Многоатомные спирты вступают в реакции этерификации с органическими и неорганическими кислотами.
Например, этиленгликоль реагирует с уксусной кислотой с образованием ацетата этиленгликоля:

2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
Например, при взаимодействии этанола с азотной кислотой образуется сложный эфир этилнитрат:
Например, глицерин под действием азотной кислоты образует тринитрат глицерина (тринитроглицерин):
3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.1. Внутримолекулярная дегидратация
При высокой температуре (больше 140оС) происходит внутримолекулярная дегидратация и образуется соответствующий алкен.
Например, из этанола под действием концентрированной серной кислоты при температуре выше 140 градусов образуется этилен:
В качестве катализатора этой реакции также используют оксид алюминия.
Отщепление воды от несимметричных спиртов проходит в соответствии с правилом Зайцева: водород отщепляется от менее гидрогенизированного атома углерода.
Например, в присутствии концентрированной серной кислоты при нагревании выше 140оС из бутанола-2 в основном образуется бутен-2:
3.2. Межмолекулярная дегидратация
При низкой температуре (меньше 140оС) происходит межмолекулярная дегидратация по механизму нуклеофильного замещения: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
Например, при дегидратации этанола при температуре до 140оС образуется диэтиловый эфир:
![]()
4. Окисление спиртов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
Первичный спирт → альдегид → карбоновая кислота
Метанол → формальдегид → углекислый газ
Вторичные спирты окисляются в кетоны: вторичные спирты → кетоны
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
Легкость окисления спиртов уменьшается в ряду:
метанол < первичные спирты < вторичные спирты < третичные спирты
Продукты окисления многоатомных спиртов зависят от их строения. При окислении оксидом меди многоатомные спирты образуют карбонильные соединения.
4.1. Окисление оксидом меди (II)
Cпирты можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества. Первичные спирты окисляются до альдегидов, вторичные до кетонов, а метанол окисляется до метаналя.
Например, этанол окисляется оксидом меди до уксусного альдегида

Видеоопыт окисления этанола оксидом меди (II) можно посмотреть здесь.
Например, пропанол-2 окисляется оксидом меди (II) при нагревании до ацетона

Третичные спирты окисляются только в жестких условиях.
4.2. Окисление кислородом в присутствии катализатора
Cпирты можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.). Первичные спирты окисляются до альдегидов, вторичные до кетонов, а метанол окисляется до метаналя.
Например, при окислении пропанола-1 образуется пропаналь

Видеоопыт каталитического окисления этанола кислородом можно посмотреть здесь.
Например, пропанол-2 окисляется кислородом при нагревании в присутствии меди до ацетона
Третичные спирты окисляются только в жестких условиях.
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) первичные спирты окисляются до карбоновых кислот, вторичные спирты окисляются до кетонов, метанол окисляется до углекислого газа.
При нагревании первичного спирта с перманганатом или дихроматом калия в кислой среде может образоваться также альдегид, если его сразу удаляют из реакционной смеси.
Третичные спирты окисляются только в жестких условиях (в кислой среде при высокой температуре) под действием сильных окислителей: перманганатов или дихроматов. При этом происходит разрыв углеродной цепи и могут образоваться углекислый газ, карбоновая кислота или кетон, в зависимости от строения спирта.
| Спирт/ Окислитель | KMnO4, кислая среда | KMnO4, H2O, t |
| Метанол СН3-ОН | CO2 | K2CO3 |
| Первичный спирт R-СН2-ОН | R-COOH/ R-CHO | R-COOK/ R-CHO |
| Вторичный спирт R1-СНОН-R2 | R1-СО-R2 | R1-СО-R2 |
Например, при взаимодействии метанола с перманганатом калия в серной кислоте образуется углекислый газ
![]()
Например, при взаимодействии этанола с перманганатом калия в серной кислоте образуется уксусная кислота

Например, при взаимодействии изопропанола с перманганатом калия в серной кислоте образуется ацетон

4.4. Горение спиртов
Образуются углекислый газ и вода и выделяется большое количество теплоты.
CnH2n+1ОН + 3n/2O2 → nCO2 + (n+1)H2O + Q
Например, уравнение сгорания метанола:
2CH3OH + 3O2 = 2CO2 + 4H2O
5. Дегидрирование спиртов
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования. При дегидрировании метанола и первичных спиртов образуются альдегиды, при дегидрировании вторичных спиртов образуются кетоны.
Например, при дегидрировании этанола образуется этаналь

Например, при дегидрировании этиленгликоля образуется диальдегид (глиоксаль)

Получение спиртов
1. Щелочной гидролиз галогеналканов
При взаимодействии галогеналканов с водным раствором щелочей образуются спирты. Атом галогена в галогеналкане замещается на гидроксогруппу.
Например, при нагревании хлорметана с водным раствором гидроксида натрия образуется метанол
![]()
Например, глицерин можно получить щелочным гидролизом 1,2,3-трихлорпропана:

2. Гидратация алкенов
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
Например, при взаимодействии этилена с водой образуется этиловый спирт.
![]()
Гидратация алкенов также протекает по ионному (электрофильному) механизму.
Для несимметричных алкенов реакция идёт преимущественно по правилу Марковникова.
Например, при взаимодействии пропилена с водой образуется преимущественно пропанол-2.

3. Гидрирование карбонильных соединений
Присоединение водорода к альдегидам и кетонам протекает при нагревании в присутствии катализатора. При гидрировании альдегидов образуются первичные спирты, при гидрировании кетонов — вторичные спирты, а из формальдегида образуется метанол.
Например, при гидрировании этаналя образуется этанол
Например: при гидрировании ацетона образуется изопропанол

Например, гидрирование диальдегида – один из способов получения этиленгликоля

4. Окисление алкенов холодным водным раствором перманганата калия
Алкены реагируют с водным раствором перманганата калия без нагревания. При этом образуются двухатомные спирты (гликоли).

5. Промышленное получение метанола из «синтез-газа»
Каталитический синтез метанола из монооксида углерода и водорода при 300-400°С и давления 500 атм в присутствии смеси оксидов цинка, хрома и др.
Сырьем для синтеза метанола служит «синтез-газ» (смесь CO и H2), обогащенный водородом:
CO + 2H2 ⇄ CH3OH
6. Получение этанола спиртовым брожением глюкозы
Для глюкозы характерно ферментативное брожение, то есть распад молекул на части под действием ферментов. Один из вариантов — спиртовое брожение.
![]()
7. Гидролиз жиров – способ получения многоатомных спиртов
Под действием кислоты жиры гидролизуются до глицерина и карбоновых кислот, которых входили в молекулу жира.
Например: при гидролизе тристеарата глицерина образуется глицерин и стеариновая кислота

При щелочном гидролизе жиров образуется глицерин и соли карбоновых кислот, входивших в состав жира.
Например: при щелочном гидролизе тристеарата глицерина образуется глицерин и соль стеариновой кислоты (стеарат)

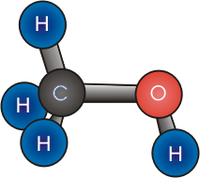
Модель молекулы простейшего спирта — метанола
Спирты́ (от лат. spiritus — дух; устар. алкого́ли, от араб. الكحول аль-кухуль — порошок[1]) — органические соединения, содержащие одну или более гидроксильных групп (гидроксил, −OH), непосредственно связанных с насыщенным (находящимся в состоянии sp³-гибридизации) атомом углерода[2]. Спирты можно рассматривать как производные воды (H−O−H), в которых один атом водорода замещён на органическую функциональную группу: R−O−H.
В номенклатуре ИЮПАК для соединений, в которых гидроксильная группа связана с ненасыщенным (sp²-гибридным) атомом углерода, рекомендуются названия «енолы» (гидроксил связан с винильной C=C-связью)[3] и «фенолы» (гидроксил связан с бензольным или другим ароматическим циклом)[4].
Спирты представляют собой обширный и разнообразный класс соединений: они весьма распространены в природе![]() и часто выполняют важные функции в живых организмах
и часто выполняют важные функции в живых организмах![]() . Спирты являются важными соединениями с точки зрения органического синтеза, не только представляя интерес как целевые продукты, но и как промежуточные вещества, имеющие ряд уникальных химических свойств
. Спирты являются важными соединениями с точки зрения органического синтеза, не только представляя интерес как целевые продукты, но и как промежуточные вещества, имеющие ряд уникальных химических свойств![]() . Кроме того, спирты являются промышленно важными продуктами
. Кроме того, спирты являются промышленно важными продуктами![]() и находят широчайшее применение как в промышленности, так и в повседневных приложениях
и находят широчайшее применение как в промышленности, так и в повседневных приложениях![]() .
.
Этимология[править | править код]
Слово алкого́ль происходит от араб. الكحل (al-kuḥl) — «порошкообразная сурьма». Понятие берёт начало от алхимической методики восстановления химических веществ до «порошка», являющегося, как предполагалось, чистой эссенцией вещества. Подобным образом, и этиловый спирт является эссенцией вина, от чего и произошло его название[1].
В русский язык слово пришло через нем. Alkohol, нидерл. alkohol или порт., исп. alcohol[5]. Однако в русском языке сохранился в виде архаизма, по всей видимости, и омоним слова «алкоголь» в значении «мелкий порошок»[6].
Слово спирт появилось в русском языке во времена Петра I через английское слово spirit, которое, в свою очередь, произошло от латинского spīritus — «дыхание, дух, душа»[7].
Классификация спиртов[править | править код]
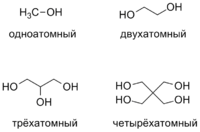
Примеры спиртов с различным числом гидроксильных групп

Насыщенный, ненасыщенный и ароматический спирты
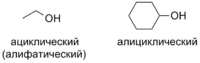
Ациклический и циклический спирты

Первичный, вторичный и третичный спирты
Спирты классифицируются следующим образом (в скобках приведены примеры)[8]:
- По числу гидроксильных групп:
- одноатомные спирты (метанол);
- двухатомные спирты (этиленгликоль);
- трёхатомные спирты (глицерин);
- четырёхатомные спирты (пентаэритрит);
- многоатомные спирты (пятиатомный спирт: ксилит).
- В зависимости от насыщенности углеводородного заместителя:
- предельные (насыщенные) спирты (бутанол);
- непредельные (ненасыщенные) спирты (аллиловый спирт, пропаргиловый спирт);
- ароматические спирты (бензиловый спирт).
- В зависимости от наличия или отсутствия цикла в углеводородном заместителе:
- ациклические (алифатические) спирты (этанол);
- алициклические спирты (циклогексанол).
- В зависимости от числа заместителей при α-углеродном атоме:
- первичные спирты (этанол);
- вторичные спирты (пропанол-2);
- третичные спирты (2-метилпропанол-2).
Номенклатура спиртов[править | править код]
Систематическая номенклатура[править | править код]
По номенклатуре ИЮПАК названия простых спиртов образуются от названий соответствующих алканов с добавлением суффикса «-ол», положение которого указывается арабской цифрой.
Правила построения названий спиртов[9]:
- Выбирают родительский углеводород по самой длинной непрерывной углеводородной цепи, содержащей гидроксильную группу. Он формирует базовое название (по числу атомов углерода).
- Родительский углеводород нумеруют в таком направлении, чтобы гидроксильная группа получила наименьший номер в названии. (Если в соединении имеются функциональные группы старше гидроксильной, то это правило применяется к старшей функциональной группе.)
- Старшая функциональная группа обозначается в виде суффикса (для гидроксильной — -ол), а остальные заместители — в виде приставок в алфавитном порядке. Их положение в углеводородной цепи обозначается при помощи цифр — локантов, помещаемых после суффиксов и перед приставками[10]. Для многоатомных спиртов перед суффиксом -ол указывается число гидроксильных групп (-диол, -триол, -тетраол и т. д.).
- Если при различных вариантах нумерации цепи гидроксильная группа получает один и тот же локант, то цепь нумеруют в том направлении, при котором другой заместитель получает наименьший локант.
Другие номенклатуры[править | править код]
- Радикало-функциональная номенклатура. В рамках данной номенклатуры название образуется от названия класса соединения (спирт) с добавлением названий радикалов, присоединённых к гидроксильной группе, например: этиловый спирт C2H5OH, гексиловый спирт C6H13OH, аллиловый спирт СH2=CH−CH2OH.
- Рациональная номенклатура (карбинольная номенклатура) спиртов рассматривает их как производные метанола CH3OH, называемого в данном случае карбинолом: диметилкарбинол (СH3)2СНOH, трифенилкарбинол (С6H5)3COH.
- Тривиальная номенклатура. В популярной и научной литературе можно нередко встретить исторические, или тривиальные, названия спиртов, которые вследствие сложившейся традиции используются вместо систематических названий[11]. Тривиальные названия обычно происходят от названия природного источника получения того или иного спирта. Так, например, метанол называют древесным спиртом, этанол — винным спиртом, гераниол содержится в гераниевом масле, а цетиловый спирт ранее получали из жира кашалотов[12] (лат. cetus — кит). Некоторые спирты получили тривиальные названия из-за своих физических свойств (глицерин от др.-греч. glykeros, сладкий)[1]. Спирты, производные от природных углеводов, сохраняют корень тривиального названия соответствующих углеводов (маннит, ксилит, сорбит).
История открытия спиртов[править | править код]
Хмельной растительный напиток, содержащий этанол, был известен человечеству с глубокой древности. Считается, что не менее чем за 8000 лет до нашей эры люди были знакомы с действием перебродивших фруктов, а позже — с помощью брожения получали хмельные напитки, содержащие этанол, из фруктов и мёда[13]. Археологические находки свидетельствуют, что в Западной Азии виноделие существовало ещё в 5400—5000 годах до н. э., а на территории современного Китая, провинция Хэнань, найдены свидетельства производства ферментированных смесей из риса, мёда, винограда и, возможно, других фруктов, в эпоху раннего неолита: от 6500 до 7000 гг. до н. э.[14]
Важное открытие, о котором впервые свидетельствует одно из произведений, приписываемых Джабиру ибн Хайяну (IX век н. э.), заключалось в том, что добавление соли в кипящее вино[en] увеличивает относительную летучесть[en] вина, и может повысить воспламеняемость образующихся паров[15].
Впервые спирт из вина получили в VI—VII веках арабские химики; способ получения спирта содержится в записях персидского алхимика Ар-Рази[16].
В Европе этиловый спирт был получен из продуктов брожения в XI—XII веке, в Италии[17].
В Россию спирт впервые попал в 1386 году, когда генуэзское посольство привезло его с собой под названием «аква вита» и презентовало великокняжескому двору[18].
В 1661 году английский химик Роберт Бойль впервые получил метанол перегонкой древесины[19]. Абсолютированный этанол из его водного раствора был впервые получен в 1796 году русским химиком Т. Е. Ловицем при перегонке над поташом[17][20].
В 1842 году немецкий химик Я. Г. Шиль открыл, что спирты образуют гомологический ряд, отличаясь на некоторую постоянную величину. Однако, он ошибся, описав её как C2H2. Спустя два года, другой химик Шарль Жерар установил верную гомологическую разницу CH2 и предсказал формулу и свойства неизвестного в те годы пропилового спирта[21]. В 1850 году английский химик Александр Вильямсон, исследуя реакцию алкоголятов с этилиодидом, установил, что этиловый спирт является производным воды с одним замещённым атомом водорода, экспериментально подтвердив формулу C2H5OH[22]. Впервые синтез этанола действием серной кислоты на этилен осуществил в 1854 году французский химик Марселен Бертло[22].
Первое исследование метилового спирта было сделано в 1834 году французскими химиками Жаном-Батистом Дюма и Эженом Пелиго. Они назвали его «метиловым или древесным спиртом», так как он был обнаружен в продуктах сухой перегонки древесины[23]. Синтез метанола из метилхлорида осуществил французский химик Марселен Бертло в 1857 году[24]. Им же в 1855 году был открыт изопропиловый спирт, полученный действием серной кислоты на пропилен[25].
Впервые третичный спирт (2-метилпропанол-2) синтезировал в 1863 году известный русский химик А. М. Бутлеров, положив начало целой серии экспериментов в этом направлении[22].
Двухатомный спирт этиленгликоль впервые был синтезирован французским химиком А. Вюрцем в 1856 году[21]. Глицерин был обнаружен в природных жирах ещё в 1783 году шведским химиком Карлом Шееле, однако его состав был открыт только в 1836 году, а синтез осуществлён из ацетона в 1873 году Шарлем Фриделем[26].
Нахождение в природе[править | править код]
Спирты широко распространены в природе как в свободном виде, так и в составе сложных эфиров.
Метиловый спирт в небольшом количестве содержится в некоторых растениях, например: борщевике (Heracleum)[24].
Этиловый спирт является естественным продуктом анаэробного брожения органических продуктов, содержащих углеводы, под действием дрожжей рода Saccharomyces и бактерий Zimomonas и часто образуется в прокисших ягодах и фруктах. При этом углеводы через последовательность ферментативных реакций, именуемую гликолизом, превращаются в пируват, который далее под действием пируватдекарбоксилазы переходит в ацетальдегид. Последний затем в присутствии алкогольдегидрогеназы акцептирует восстановительный эквивалент от восстановленной формы NAD (восстановление NAD происходит на одной из стадий гликолиза), что даёт этанол в качестве конечного продукта. Данный процесс не только является причиной накопления этанола в природных объектах, но и активно используется в виноделии, пивоварении и хлебопекарной промышленности[27]. В ходе брожения могут образовываться также и другие спирты, например, изопропанол,[28] бутанол-1[29], бутандиол-2,3[30].
В эфирных маслах зелёных частей многих растений содержится (Z)-гексен-3-ол-1 («спирт листьев»), придающий им характерный запах[31].
Также в растительном мире очень широко представлены терпеновые спирты, многие из которых являются душистыми веществами, например: борнеол (компонент древесины борнеокамфорного дерева), ментол (в мяте, герани)[32], гераниол[33] и цитронеллол[34] (компоненты цветочных эфирных масел), фенхол (в смоле хвойных деревьев и плодах фенхеля) и др.
В животном и растительном мире распространены конденсированные тетрациклические спирты (производные гонана), обладающие высокой биологической активностью и входящие в класс стероидов, например, холестерин, содержащийся в клетках практически всех живых организмов, особенно животных[35]. Отдельную группу стероидов составляют жёлчные многоатомные спирты, находящиеся в жёлчи животных и человека: буфол, холестантетрол, холестанпентол, миксинол, сцимнол, химерол и др.[36]
В природе встречаются разнообразные спиртовые производные углеводов, например, сорбит (содержится в ягодах вишни и рябины)[37], маннит (в ясене)[38] и др.
В 1959 году немецким химиком Адольфом Бутенандтом при изучении экстракта самки тутового шелкопряда был открыт половой аттрактант, названный бомбиколом[39].
Дальнейшее изучение феромонов насекомых показало, что значительная часть этих феромонов представлена спиртами[39].
Метаболизм спиртов в организме человека[править | править код]
Физиологическая роль спиртов[править | править код]
Многие спирты являются участниками важных биохимических процессов, происходящих в живом организме. Так, некоторые витамины относятся к классу спиртов, например, витамин А (ретинол)[41], витамин D (эргокальциферол и др.)[42].
Стероидные гормоны, среди которых имеются и спирты (эстрадиол, кортизол и др.), участвуют в регуляции обмена веществ и некоторых физиологических функциях организма[43].
Глицерин является основой более чем половины природных липидов, которые представляют собой его сложные эфиры с жирными кислотами и являются источниками энергии для организма[44]. Также глицерин участвует в глюконеогенезе — процессе образования глюкозы в печени. При этом глицерин под действием ферментов превращается в глицеральдегид-3-фосфат, который далее попадает в метаболический путь глюконеогенеза[45]. Физиологически важным полиолом является мио-инозитол.
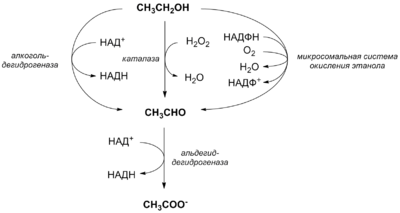
Среди низших спиртов с точки зрения физиологии наибольший интерес представляет, несомненно, этанол. В организме человека этанол является естественным метаболитом и в норме присутствует в крови в очень низких концентрациях. Также этанол может поступать в организм с пищей. Этанол в организме человека метаболизируется преимущественно в печени. Под действием цитозольного фермента алкогольдегидрогеназы этанол окисляется в ацетальдегид, который далее перерабатывается митохондриальной альдегиддегидрогеназой в ацетат. Ацетат после активации короткоцепочечной ацил-коэнзим А-синтетазой может далее разрушаться в цикле Кребса[46]. В утилизации этанола второстепенную роль играет также микросомальная этанол-окисляющая система, представленная цитохромом P450 и каталазой[40]. При высокой концентрации алкоголя в крови ферменты не справляются с оксилением ацетальдегида до ацетата, и в организме происходит накопление ацетальдегида, который в 10—30 раз токсичнее этанола[47], за счёт чего происходит отравление организма, т. н. похмелье. По энергетической ценности для организма этанол (7 ккал/г) занимает промежуточное положение между углеводами (4,1 ккал/г) и жирами (9,3 ккал/г). Вклад этанола в общую калорийность пищи у не страдающих алкоголизмом взрослых людей может достигать 12 %. Однако потребление этанола в качестве пищевого продукта и источника энергии имеет ряд недостатков с биохимической точки зрения. Кроме образования токсичного ацетальдегида, к таким недостаткам следует причислить тот факт, что избыточные калории, поступившие в организм в форме этанола, могут запасаться только в жирах, так как возможность преобразования этанола в углеводы в организме человека отсутствует[46]. Кроме того, этанол нарушает другие метаболические процессы: ингибирует глюконеогенез (это является причиной гипогликемии при приёме больших доз алкоголя), ускоряет производство цитокинов, изменяет концентрацию гормонов[48]. Алкогольные напитки содержат очень мало витаминов и минеральных веществ, что также может оказать негативное влияние на здоровье. Также пищевой этанол сам по себе намного дороже, чем энергетически эквивалентное количество сахара[46].
Токсичность спиртов[править | править код]
Одноатомные предельные спирты вводят организм в наркозоподобное состояние, а также оказывают токсическое действие[49].
Метиловый спирт — сильный яд (особенно при приёме внутрь) нервного и сердечно-сосудистого действия с выраженным кумулятивным эффектом; поражает органы зрения вплоть до полной слепоты. В больших дозах (30 г и более) вызывает смерть[50].
Этиловый спирт обладает токсическим эффектом. Быстро всасывается через слизистую оболочку желудка и тонкого кишечника, достигая максимальной концентрации в крови через 60—90 минут после его приёма[51]. Этанол вызывает сначала возбуждение, а затем резкое угнетение центральной нервной системы (в том числе разрушает мозговую оболочку); его употребление приводит к нарушению важнейших функций организма, тяжёлому поражению органов и систем. Оказывает эмбриотоксическое и тератогенное действие.
Изопропиловый спирт по своему токсическому воздействию напоминает этанол, вызывая угнетение центральной нервной системы и поражая внутренние органы. В высокой концентрации приводит к коме, конвульсиям и летальному исходу (около 3—4 г/кг)[52].
В связи с широким использованием простейших спиртов в различных отраслях промышленности![]() и, в частности, в качестве растворителей, опасным является их ингаляционное воздействие. Острое токсичное воздействие спиртов, испытанное на крысах, проявилось в следующих ингаляционных концентрациях:
и, в частности, в качестве растворителей, опасным является их ингаляционное воздействие. Острое токсичное воздействие спиртов, испытанное на крысах, проявилось в следующих ингаляционных концентрациях:
- метиловый спирт: 3,16 % в течение 18—21 часов — 100 % летальность; 2,25 % в течение 8 часов — наркотический эффект; 0,8 % в течение 8 часов — летаргия;
- этиловый спирт: 3,2 % в течение 8 часов — частичная летальность; 2,2 % в течение 8 часов — глубокий наркоз; 0,64 % в течение 8 часов — летаргия;
- изопропиловый спирт: 1,2 % в течение 8 часов — 50 % летальность; 1,2 % в течение 4 часов — наркотический эффект[53].
Этиленгликоль очень токсичен при пероральном попадании в организм, поражает ЦНС и почки. Смертельная доза составляет 1,4 г/кг массы тела[54].
Физические свойства и строение спиртов[править | править код]

Геометрия связи C−O−H в молекуле метанола

Молекулы спиртов, подобно молекуле воды, имеют угловое строение. Угол R−O−H в молекуле метанола равен 108,5°[55]. Атом кислорода гидроксильной группы находится в состоянии sp³-гибридизации. Спирты имеют существенно более высокие температуры плавления и кипения, чем можно было бы предполагать на основании физических свойств родственных соединений. Так, из ряда монозамещённых производных метана, метанол имеет необычно высокую температуру кипения, несмотря на относительно небольшую молекулярную массу[56]:
Молекулярные массы и температуры кипения метана и некоторых его производных[57]
| Метан CH4 |
Метанол CH3OH |
Хлорметан CH3Cl |
Нитрометан CH3NO2 |
Бромметан CH3Br |
|
|---|---|---|---|---|---|
| Молярная масса, г/моль | 16,04 | 32,04 | 50,48 | 61,04 | 94,94 |
| Температура кипения, °С | −161,5 | 64,5 | −24,2 | 101,2 | 3,6 |
Высокие температуры кипения спиртов объясняются наличием межмолекулярных водородных связей[55]. Энергия водородной связи значительно ниже, чем энергия ковалентной химической связи. Так, например, для метанола энергия водородной связи составляет 16,7 кДж/моль[58]
, тогда как связи C−H, C−O и O−H имеют энергию 391,7, 383,5 и 428,8 кДж/моль соответственно[59].
Тем не менее, влияние водородных связей на физические свойства спиртов весьма значительное.
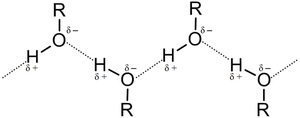
Межмолекулярные водородные связи в спиртах
Молекулы спирта, имея две полярных связи C−O и O−H, обладают дипольным моментом (~5,3—6,0⋅10−30 Кл·м)[55]. Электростатические заряды в молекуле метанола составляют: на атоме углерода 0,297 e; на атоме гидроксильного водорода 0,431 e; на атоме кислорода −0,728 e[60]. Вместе с тем, энергия ионизации спиртов ниже, чем у воды (10,88 эВ для метанола против 12,61 эВ для воды)[61], что объясняется электронодонорным эффектом алкильной группы.
Влияние гидроксильной группы особенно велико на соединения с небольшой углеводородной цепочкой. Так, например, метанол и этанол неограниченно смешиваются с водой и имеют довольно высокие плотности и температуры кипения для своей молекулярной массы, в то время как высшие спирты гидрофобны и мало отличаются по свойствам от соответствующих углеводородов[62].
Некоторые физические константы алифатических предельных спиртов[63]
| Название | Формула | Т. кип., °С | Т. пл., °С | Плотность, кг/м3 (20 °С) | Показатель преломления, nD20 |
|---|---|---|---|---|---|
| Метанол | CH3OH | 64,7 | −97,78 | 791,5 | 1,32855 |
| Этанол | C2H5OH | 78,3 | −114,65 | 789,5 | 1,36139 |
| Пропанол-1 | C3H7OH | 97,2 | −124,10 | 803,5 | 1,38556 |
| Пропанол-2 | CH3CH(CH3)OH | 82,5 | −87,95 | 786,2 | 1,37711 |
| Бутанол-1 | C4H9OH | 117,8 | −88,64 | 808,6 | 1,39929 |
| 2-Метилпропанол-1 | (СН3)2СНСН2ОН | 108,0 | −101,97 | 802,1 | 1,39549 |
| Бутанол-2 | СН3СН2СН(ОН)СН3 | 99,5 | −114,70 | 806,0 | 1,39240[К 1] |
| 2-Метилпропанол-2 | (СН3)2С(OH)СН3 | 82,9 | 25,82 | 765,2[К 2] | 1,38779 |
| Пентанол-1 | C5H11OH | 138,0 | −77,59 | 813,3 | 1,40999 |
| Гексанол | C6H13OH | 157,1 | -47,40 | 821,7 | 1,41816 |
| Гептанол | C7H15OH | 176,3 | −32,80 | 824,0 | 1,42351 |
| Октанол | C8H17OH | 195,1 | −16,30 | 822,7 | 1,42920 |
| Нонанол | C9H19OH | 213,5 | −5,00 | 827,0 | 1,43325 |
| Деканол | C10H21OH | 231,0 | 6,00 | 826,0 | 1,43660 |
Некоторые физические константы алициклических, ароматических и непредельных спиртов[64]
| Название | Формула | Т. кип., °С | Т. пл., °С | Плотность, кг/м3 (20 °С) | Показатель преломления, nD20 |
|---|---|---|---|---|---|
| Пропен-2-ол-1 | CH2=CHCH2OH | 96,9 | −129 | 852,0 | 1,4133 |
| Пропин-2-ол-1 | CH≡CCH2OH | 113,6 | −48 | 948,5 | 1,4322 |
| Циклогексанол | C6H11OH | 161,1 | 25,15 | 941,6 | 1,4648 |
| Фенилкарбинол | C6H5CH2OH | 205,0 | −15,3 | 1041,9 | 1,5396 |
| 2-Фенилэтанол | C6H5CH2CH2OH | 218,2 | −27,0 | 1020,2 | 1,5325 |
| 3-Фенилпропен-2-ол-1 | C6H5CH=CHCH2OH | 256—258 | 34 | 1044,0 | 1,5819 |
| 2-Фурилкарбинол | (C4H3O)CH2OH | 155 | — | 1131,9 | 1,5324 |
Некоторые физические константы многоатомных спиртов[57]
| Название | Формула | Т. кип., °С | Т. пл., °С | Плотность, кг/м3 (20 °С) | Показатель преломления, nD20 |
|---|---|---|---|---|---|
| Глицерин | HOCH2CH(OH)CH2OH | 290 | 20 | 1260,4 | 1,4729 |
| Пентаэритрит | C (CH2OH)4 | 263,5 | 1397 | 1,548 | |
| Этиленгликоль | OHCH2CH2OH | 197,85 | –12,6 | 1115,5 | 1,432 |
Получение спиртов[править | править код]
Общие химические методы получения спиртов[править | править код]
Спирты могут быть получены из самых разных классов соединений, таких как углеводороды, галогеналканы, амины, карбонильные соединения, эпоксиды. В основном, все методы сводятся к реакциям окисления, восстановления, присоединения и замещения.
Спирты получают, окисляя алканы и циклоалканы под действием сильных неорганических окислителей: озона, перманганата калия, оксида хрома (VI), хромовой кислоты, диоксида селена, пероксида водорода, а также некоторых надкислот. Из-за возможности дальнейшего окисления получаемых спиртов, метод имеет значение только для получения третичных спиртов[65].
Окисление алкенов значительно более распространено в лабораторной практике, особенно для получения двухатомных спиртов — диолов. В зависимости от выбора реагента окисление можно провести с различной стереоселективностью: при действии на алкены тетраоксида осмия, перманганата калия, хлората натрия, иода с карбоксилатом серебра протекает син-гидроксилирование; для проведения анти-гидроксилирования используют пероксид водорода и надкислоты, оксиды молибдена (VI) и вольфрама (VI), оксид селена (IV) и пр[66].
Спирты образуются также при восстановлении альдегидов или кетонов под действием борогидрида натрия в протонном растворителе, а также алюмогидрида лития. Восстановление сложных эфиров и карбоновых кислот также производится под действием комплексных гидридов, обычно, алюмогидрида лития и приводит к спиртам[67].
Кислотно-катализируемое присоединение воды к алкенам приводит к образованию спиртов. В соответствии с правилом Марковникова, в данной реакции образуются более замещённые спирты. В лабораторной практике чаще используют аналогичную, но более мягкую реакцию оксимеркурирования — демеркурирования, а также реакцию гидроборирования — окисления, приводящую к продуктам, не согласующимся с правилом Марковникова[68].
Реакции нуклеофильного присоединения металлорганических соединений (ацетиленидов, реактивов Гриньяра, медь- и литийорганических соединений и т. д.) к карбонильным соединениям также приводят к спиртам, причём если присоединение происходит к формальдегиду HCHO, то образуются первичные спирты, если к другим альдегидам, то образуются вторичные спирты. Присоединение к кетонам даёт третичные спирты. Третичные спирты можно получить также путём присоединения двух эквивалентов металлорганического соединения к сложным эфирам.
Спирты можно получать при обработке галогеналканов раствором щёлочи. Реакция протекает как нуклеофильное замещение и сопровождается рацемизацией (при мономолекулярном механизме) или обращением конфигурации (при бимолекулярном механизме).
Важным препаративным методом является окисление алкилгалогенидов надпероксидом калия[69].
Промышленные методы получения спиртов[править | править код]
В промышленности спирты получают при помощи химических методов либо биохимических методов производства.
Единственным промышленно важным методом синтеза метанола является каталитическая реакция между оксидом углерода (II) и водородом. Сырьём в производстве метанола служит природный газ, который на первой стадии процесса подвергают очистке от соединений серы (сера является ядом для катализаторов, используемых на следующей стадии). Далее происходит паровая конверсия природного газа в синтез-газ (смесь СО и водорода), который после конденсации паров воды превращают в метанол на смешанном медно-цинко-хромовом катализаторе при температуре 250 °С и давлении до 10 МПа. Получаемый таким образом метанол содержит воду и примеси других спиртов (этанола, пропанола и более высших) и может быть очищен ректификацией. Мировое потребление метанола в 2015 году составило порядка 70 млн тонн[70].
Этанол и пропанол-2 получают методом гидратации соответствующих алкенов — этилена и пропилена. В промышленности используют два варианта гидратации: сернокислотную и каталитическую. Сернокислотная гидратация включает в себя абсорбцию этилена концентрированной серной кислотой (94—98 %) при температуре 80 °С и давлении 1,3—1,5 МПа и последующий гидролиз образующихся сульфоэфиров водой. Второй метод гидратации основан на использовании фосфорной кислоты, нанесённой на силикагель или другую подложку, в качестве катализатора. Смесь деионизированной воды и этилена нагревают до температуры 300 °С под давлением 6—8 МПа, а полученный этанол очищают ректификацией. Данные методы позволяют получить этанол, содержащий 5 % воды по массе. Получение безводного этанола (99,9 %) основано на азеотропном удалении воды с бензолом[71]. По данным на 2003 год, мировое производство этанола только гидратацией этилена составляет 6 млн тонн в год[72].
Мировое производство топливного этанола в 2015 году по данным Renewable Fuel Association составило около 77 млн тонн[73].
Для гидратации пропилена требуются более мягкие условия. Сернокислотный процесс проводят при комнатной температуре и концентрации серной кислоты, равной 70—75 %, а каталитическая гидратация протекает при 180 °С и 4 МПа. Иногда для гидратации пропилена используют вольфрамовый катализатор (WO3·SiO2, 250 °C и 25 МПа)). Мировое производство пропанола-2 в 2008 году составляло 1,8 млн тонн[74][75][76][77].
Также реакцией гидратации в промышленности получают этиленгликоль — один из важнейших продуктов химической промышленности, производимый в количестве 19,9 млн тонн ежегодно[78] и используемый в больших количествах для производства антифриза и волокон. Сырьём для данного синтеза служит окись этилена, получаемая прямым окислением этилена кислородом воздуха. Превращение окиси этилена в этиленгликоль происходит при нагревании её смеси с 20-кратным мольным избытком воды до 200 °С без катализатора. Этиленгликоль затем отделяется от воды и продуктов олигомеризации в результате последовательных ректификаций[79].
Промышленное получение пропанола-1 основано на реакции гидроформилирования этилена и последующем гидрировании полученного пропаналя. Гидроформилирование проводится при температуре 90—130 °С, общем давлении пропилена, оксида углерода(II) и водорода, равном 2,8 МПа, и в присутствии 500 мд родиевого катализатора. Вторая стадия протекает при 110—150 °С в избытке водорода на различных металлических катализаторах (используются комбинации соединений меди, цинка, никеля и хрома)[74]. Объёмы мирового производства пропанола-1 на 2003 год составили 0,14 млн тонн[80].
Глицерин получают как побочный продукт превращения жиров в жирные кислоты и метиловые эфиры жирных кислот. Данный процесс лежит в основе получения биодизеля, при этом на каждую тонну биодизеля образуется 100 кг глицерина. Таким методом синтезируют 1,5 млн тонн глицерина ежегодно (2004 год), причём по прогнозам эти объёмы будут расти в связи с увеличением интереса к альтернативным видам топлива. Жиры гидролизуют при 220—260 °С и давлении 2—6 МПа либо переэтерифицируют метанолом. Расщепление жиров под действием щёлочи либо карбонатов применяется в ограниченном масштабе, например, при производстве мыла[81][82][83].
Высшие жирные спирты производят несколькими способами, среди которых гидрогенолиз метиловых эфиров жирных кислот, получаемых переэтерификацией жиров, а также гидроформилирование алкенов и олигомеризация этилена с последующим окислением (метод Циглера). Ежегодно в мире производится 2,15 млн тонн высших жирных спиртов (2003 год)[84][85].
Для некоторых спиртов более важную роль в промышленном синтезе играют биохимические методы. В частности, объёмы производимого биоэтанола значительно превышают объёмы синтетического этанола. В основе биохимического получения этанола лежит кислотный или ферментативный гидролиз растительного сырья с последующей анаэробной спиртовой ферментацией (сбраживанием) образующихся углеводов дрожжевыми грибами (Saccharomyces) или некоторыми видами бактерий. В частности, дрожжи являются весьма удобными микроорганизмами для широкого промышленного использования. Ферментация под действием дрожжей характеризуется высокой селективностью, низким накоплением побочных продуктов, высоким выходом этанола, высокой скоростью процесса, хорошей толерантностью дрожжей к повышенным концентрациям этанола и субстрата. Сырьём в данном процессе могут служить легко ферментируемые углеводы, а также крахмал и другие органические субстраты, которые необходимо предварительно гидролизовать до ферментируемой формы. Обычно используют сельскохозяйственные культуры (сахарная свёкла, картофель, зерновые культуры), продукты лесного хозяйства (древесина, солома) либо сельскохозяйственные отходы[86].
Производство биобутанола основано на ферментации углеводного сырья с использованием бактерий Clostridium acetobutylicum[87].
Химические свойства спиртов[править | править код]
Химические свойства спиртов определяются наличием в них гидроксильной группы. Поскольку гидроксильная группа является полярной, она может гетеролитически диссоциировать, особенно, под действием сильных оснований. Таким образом, спирты проявляют свойства слабых кислот. Кроме того, высокая электроотрицательность кислорода обуславливает наличие электрофильного атома углерода и, соответственно, способность спиртов подвергаться реакциям нуклеофильного замещения под действием ряда нуклеофилов. Наконец, атом кислорода гидроксильной группы имеет нуклеофильный характер, поэтому спирты могут выступать нуклеофилами в реакциях замещения и присоединения. Также для спиртов характерны реакции окисления.
Диссоциация и кислотно-основные свойства спиртов[править | править код]
Кислотные свойства спиртов[править | править код]
Спирты способны проявлять как кислотные, так и основные свойства. Как слабые кислоты, спирты диссоциируют по связи O−H с образованием алкоксид-иона. Кислотные характеристики спиртов оценивают по константе кислотности Ka.
В водном растворе кислотность спиртов снижается с увеличением молекулярной массы и разветвлённости углеводородной цепи. Это связывают с увеличением положительного индуктивного эффекта алкильных заместителей в данном ряду и уменьшением устойчивости образующегося алкоксид-иона за счёт локализации отрицательного заряда на атоме кислорода[88].
В целом, электроноакцепторные заместители (−NO2, −CN, −F, −Cl, −Br, −I, −OR и др.) увеличивают кислотность спиртов (уменьшают pKa). Напротив, электронодонорные заместители (например, алкильные заместители) уменьшают кислотность спиртов (увеличивают pKa). Так, pKa 2,2,2-трифторэтанола имеет значение 12,43 (против 15,9 у этанола), а полностью фторированного трет-бутанола — 5,4 (против 17,7 у трет-бутанола)[89].
Сравнительная кислотность спиртов и соединений других классов схематически представлена на рисунке[90].
Как слабые кислоты, спирты вступают в реакции с щелочными, щелочноземельными и некоторыми другими металлами, и с сильными основаниями, например, гидридами или амидами металлов, реактивами Гриньяра[91].
Осно́вные свойства спиртов[править | править код]
Спирты могут также вести себя как слабые основания Льюиса, образовывая с сильными минеральными кислотами соли алкоксония, а также давая донорно-акцепторные комплексы с кислотами Льюиса. Обычно подобные реакции не останавливаются на указанной стадии и ведут к нуклеофильному замещению гидроксильной группы или отщеплению воды.
Количественно основность спиртов оценивают по константе основности pKb или связанной с ней константе кислотности сопряжённой кислоты pKaH+:
Спирты являются слабыми основаниями, и их основность возрастает с увеличением длины или разветвлённости углеводородного радикала при гидроксильной группе. Данный эффект наблюдается из-за роста положительного индуктивного эффекта радикала в данном ряду, за счёт которого увеличивается отрицательный заряд на атоме кислорода гидроксильной группы[92].
Нуклеофильное замещение[править | править код]
Атом углерода, непосредственно соединённый с гидроксильной группой, имеет частичный положительный заряд, что делает возможной атаку нуклеофильной частицы (галогенид-иона, аммиака, спирта и др.) по этому атому углерода с замещением гидроксильной группы на эту частицу. Гидроксильная группа является плохой уходящей группой, поэтому обычно необходима её дополнительная активация.
- Реакции нуклеофильного замещения в спиртах легче протекают в кислой среде, поскольку гидроксильная группа спирта протонируется, и фактической уходящей частицей является не гидроксид-ион OH−, а молекула воды H2O. Кислотными свойствами может обладать сам реагент (часто используют галогеноводородные кислоты), так и специально добавленная неорганическая кислота, например, серная кислота[93].
- Замещение гидроксильной группы также протекает под действием галогенидов серы и фосфора (SOCl2, PBr3, PBr5, POCl3 и др.). В данном случае ключевую роль выполняет соединение серы или фосфора, образующее активированный интермедиат с молекулой спирта[94].
- Гидроксильную группу также превращают в сульфонатную группу, которая является хорошей уходящей группой. Для этих целей спирт сначала превращают в сульфонат, который затем подвергают реакции нуклеофильного замещения. В качестве реагентов для модификации гидроксильной группы обычно используют метансульфонилхлорид или п-толуолсульфонилхлорид (англ.) (рус.[95].
Дегидратация[править | править код]
В присутствии кислотных катализаторов (оксид алюминия, серная кислота, фосфорная кислота и др.) спирты могут подвергаться дегидратации с образованием алкенов. Например, дегидратация этилового спирта приводит к образованию этилена. Реакция протекает в соответствии с правилом Зайцева, согласно которому при дегидратации образуется более устойчивый, более замещённый при двойной связи алкен[96].
Окисление[править | править код]
- Под действием различных окислителей первичные спирты окисляются до альдегидов и далее — до карбоновых кислот, причём остановить реакцию на стадии образования альдегидов, предотвратив их дальнейшее окисление удаётся только за счёт использования специальных реагентов (хлорхромата пиридиния PCC и дихромата пиридиния PDC).
- Вторичные спирты окисляются до кетонов. Реакцию обычно проводят под действием реагента Джонса (CrO3—серная кислота). Дальнейшее окисление кетонов протекает только в жёстких условиях с разрушением углеродного скелета.
- Третичные спирты окисляются только в весьма жёстких условиях с разрушением углеродного скелета[97].
Идентификация спиртов[править | править код]
Химические методы идентификации спиртов[править | править код]
Качественный анализ гидроксильных групп[править | править код]
Наличие гидроксильной группы в соединении можно выявить несколькими распространёнными химическими реакциями.
- Проба Лукаса заключается в действии на спирт смеси соляной кислоты и хлорида цинка. При этом происходит образование алкилхлорида, который сначала образует эмульсию со спиртом, а затем отслаивается в виде второй фазы. Проба позволяет различить спирты с разным строением углеродной цепи: третичные спирты реагируют практически мгновенно, вторичные — примерно через 5 минут, а первичные реагируют очень медленно. Некоторые первичные спирты, активные в реакциях нуклеофильного замещения (аллиловый, бензиловый), также дают положительную реакцию с реактивом Лукаса[98].
- Иодоформная проба предназначена для идентификации метилкетонов и метилкарбинолов (RCH (OH)СH3) по реакции с йодом в щелочной среде. При этом происходит образование желтоватого осадка иодоформа, имеющего характерный запах[99].
- Проба Мейера позволяет дифференцировать первичные, вторичные и третичные спирты по реакции получаемых из них нитропроизводных с азотистой кислотой. На первой стадии спирты превращают в галогенопроизводные, а затем — в нитроалканы. При взаимодействии нитросоединений с HNO2 раствор приобретает красную окраску при подщелачивании, если исходный спирт был первичным; раствор в хлороформе становится синим, если спирт был вторичным. Третичные спирты дают отрицательную реакцию (бесцветный раствор)[100].
- Цератная проба заключается во взаимодействии спиртов с азотнокислым раствором гексанитратоцерата (IV) аммония, имеющим жёлтую окраску. При этом образуются переходные комплексы красного цвета, которые затем обесцвечиваются вследствие окисления спирта и перехода Ce (IV) в Ce (III)[101].
- Окислительная проба: при взаимодействии первичных или вторичных спиртов с реактивом Джонса, имеющим оранжевую окраску, образуются продукты окисления, а сам реактив меняет цвет на зелёный или голубой, благодаря солям восстановленного хрома (III). Важной особенностью теста является время фиксации изменения окраски — 2 секунды, по истечении которого любые дальнейшие изменения в структуре или цвете раствора не принимаются во внимание[101].
Количественный анализ спиртов[править | править код]
Для количественного анализа спиртов обычно используют методы, основанные на реакции этерификации ангидридами карбоновых кислот, например, уксусным, фталевым, а также пиромеллитовым диангидридом. Содержание спирта определяется титрованием образующейся в результате реакции кислоты гидроксидом натрия[102].
Другой метод анализа заключается в определении количества гидроксильных групп, способных реагировать с метилмагнийиодидом. В данном случае расчёт ведут по количеству выделившегося метана (метод Чугаева — Церевитинова).
Для гликолей применим окислительно-восстановительный метод, где в качестве окислителя используется иодная кислота. Анализ проводят по реакции образующейся иодноватой кислоты HIO3 с иодидом калия и последующим титрованием выделившегося иода тиосульфатом натрия[102].
Спектральные методы анализа спиртов[править | править код]
Масс-спектрометрические методы анализа спиртов[править | править код]
Масс-спектры алифатических спиртов имеют слабые пики молекулярного иона, а для высших и разветвлённых спиртов эти пики практически отсутствуют, поскольку в существенной степени происходит фрагментация молекулы. Фрагментация, как правило, связана с потерей молекулы воды, а также элиминированием этилена. Для длинноцепочечных спиртов преобладает отщепление воды, поэтому их масс-спектры похожи на масс-спектры алкенов. Для первичных спиртов наблюдаются пики m/z 31, для вторичных — m/z 45, 59, 73, …, для третичных — m/z 59, 73, 87, …[103].
ИК-спектроскопические методы анализа спиртов[править | править код]
ИК-спектры спиртов характеризуются двумя типами интенсивных характеристических полос поглощения:
- полосы поглощения, связанные с валентными колебаниями связи O−H: 3650—3200 см−1;
- полосы поглощения, связанные с валентными колебаниями связи С−O: 1210—1000 см−1.
Также выделяют полосы поглощения средней интенсивности, как правило, не имеющие определяющего значения: в диапазоне 1450—1250 см−1 (плоскостные деформационные колебания O−H) и 750—650 см−1 (внеплоскостные деформационные колебания O−H)[104].
Характеристические полосы поглощения спиртов в инфракрасной области[104]
| Типы связей и колебания | Диапазон, см−1 | Описание полосы поглощения |
|---|---|---|
| O−H, валентные колебания | ||
| ROH, неассоциированные | 3650—3580 | Узкая полоса, наблюдаемая в разбавленных растворах или парах |
| ROH···HOR, димеры (водородная связь) | 3550—3400 | Широкая полоса, теряющая интенсивность при разбавлении |
| ROH···HOR···, полимеры | 3400—3200 | Широкая полоса или ряд полос |
| С−O, валентные колебания | ||
| R3COH, третичные спирты | 1210—1100 | Полосы высокой интенсивности, уменьшающейся при разбавлении |
| R2CHOH, вторичные спирты | 1125—1000 | |
| RCH2OH, первичные спирты | 1075—1000 | |
| O−H, деформационные колебания | ||
| ROH | 1450—1250 750—650 |
Широкие полосы средней интенсивности, не имеющие практического значения |
ЯМР-спектроскопические методы анализа спиртов[править | править код]
ЯМР-спектроскопия ядер 1H широко используются для анализа спиртов, однако на величины химических сдвигов протонов гидроксильной группы (δ, м. д.) существенно влияет природа растворителя и другие внешние факторы. Для алифатических и алициклических спиртов δ составляет 0,5—3,0 (в ДМСО-d6: 4—6)[105].
Также для изучения спиртов применяют спектроскопию на ядрах 17O. Значительная разница в сдвигах для первичных (этанол: δ 5,9 м д.), вторичных (пропанол-2: δ 39,8 м д.) и третичных спиртов (2-метилпропанол-2: δ 62,3 м д.) относительно воды H217O позволяет установить или подтвердить структуру исследуемого соединения[106].
-
-

ИК-спектр этанола
Применение спиртов[править | править код]
Экономическое значение[править | править код]
Области использования спиртов многочисленны и разнообразны, особенно учитывая широчайший спектр соединений, относящихся к этому классу. Вместе с тем, с промышленной точки зрения, только небольшой ряд спиртов вносит заметный вклад в глобальную мировую экономику.
В TOP 50 за 2002 год соединений[К 3], выпускаемых химической промышленностью США, из спиртов входят только метанол (14-е место) и этиленгликоль (29-е место)[107]. В следующие 50 важнейших химических соединений, по данным за 1999 год, включены изопропиловый спирт, н-бутиловый спирт, синтетический этанол, пропиленгликоль, диэтиленгликоль, 2-этилгексанол, бутандиол-1,4, сорбит и глицерин[108].
Самым распространённым и используемым спиртом в мире является этанол. Его мировой объём потребления составляет около 65 млн тонн[К 4]. Совокупный мировой объём потребления прочих спиртов (кроме этанола) по различным направлениям использования составляет около 70 млн тонн (по состоянию на 2009 год)[К 5].
Применение в органическом синтезе[править | править код]
Основная доля метилового спирта используется в промышленном синтезе формальдегида методом высокотемпературного каталитического окисления метанола[К 6][109]. Кроме того, из метанола получают трет-бутилметиловый эфир, уксусную кислоту (процесс Монсанто (англ.) (рус.)[110], N,N-диметиланилин[111], метиламины[112] и хлорметан[113].
Из этанола в промышленности производят диэтиловый эфир (методом дегидратации при 250 °С над Al2O3)[114], хлораль[115], ацетальдегид[116] и этилацетат[117].
Изопропиловый спирт при каталитическом жидкофазном дегидрировании на никеле Ренея при 150 °С превращают в ацетон[118]. Основным продуктом, получаемым из бутанола, является бутилакрилат[119].
Применение в качестве топлива[править | править код]
Для топливных целей в настоящий момент используются в промышленных объёмах три спирта: метанол, этанол и бутанол-1, что связано, прежде всего, с их коммерческой доступностью и возможностью массового производства из растительного сырья (кроме метанола[К 7]).
При этом возможно использование спиртов в виде горючего в чистом виде, в виде различных смесей с бензином или дизельным топливом[120], а также в качестве оксигенирующих добавок (до 10 %) с целью повышения октанового числа и снижения токсичности отработанных газов[К 8][121][122]. Отдельным направлением является использование метанола для переэтерификации жиров в производстве биодизеля[123].
Преобладающим топливным спиртом является этанол. По оценкам экспертов, на 2009 год 80—90 % всего производимого в мире этилового спирта было использовано в этих целях и составило 73,9 млрд литров (≈ 58 млн тонн)[124][125].
Основными причинами, послужившими активному изучению спиртов в качестве альтернативного горючего, являются[126]:
- рост цен на нефть и газ, а также исчерпаемость этих ресурсов в будущем;
- спирты обладают высокими эксплуатационными характеристиками, а продукты сгорания содержат меньше вредных веществ;
- спирты могут изготавливаться биохимическим методом из отходов пищевой, деревообрабатывающей и целлюлозно-бумажной промышленности, что попутно решает проблему утилизации.
Вместе с тем, массовое использование вышеуказанных спиртов в качестве моторного топлива, помимо чисто экономических причин, имеет ряд недостатков[127]:
- метанол и этанол обладают по сравнению с бензином меньшей энергоэффективностью и, соответственно, обеспечивают больший расход;
- низкие температуры кипения спиртов могут служить причиной образования паровых пробок, что может существенно усложнить работу двигателя;
- гигроскопичность спиртов, а также их растворимость в воде может привести к резкому снижению мощности при попадании влаги в топливную систему;
- спирты обладают существенно более высокими коррозионными характеристиками по сравнению с углеводородами;
- относительно высокая скрытая теплота сгорания метанола и этанола может служить причиной проблемы при смешении этих спиртов с воздухом и дальнейшей транспортировки через впускной коллектор двигателя.
Промышленное применение спиртов[править | править код]
Растворители[править | править код]
Среди растворителей широкое распространение имеют самые разные типы спиртов: одноатомные (метанол, пропанол-2) и многоатомные (этиленгликоль, глицерин); алифатические (этанол, бутанол-1) и циклические (циклогексанол). Спирты относятся к полярным растворителям и применяются в различных отраслях промышленности[128]. Мировой объём потребления спиртов в качестве растворителей (по данным на 2013 год) составил порядка 6,5 млн тонн
[129].
Самым распространённым спиртом среди растворителей является этанол — его мировой объём потребления для этих целей (по данным на 2009 год) превышает 3,5 млн тонн в год[130]. Другими популярными растворителями являются метанол и изопропанол[76] с объёмами потребления более 1 млн тонн в год.
Использование спиртов в качестве растворителей включает в себя следующие направления[131]:
- Технологический растворитель: экстракция и очистка натуральных продуктов (жиры и масла, смолы, воск, природные красители и ароматизаторы, альгинаты, витамины, алкалоиды, водоросли), носитель в пищевой промышленности, очистка, кристаллизация и осаждение органических химических веществ.
- Растворитель в производстве красок и покрытий: растворение синтетических полимерных материалов (лаки, смолы, клеи и т. п.), компонент цементов, красок и чернил.
- Очиститель: производство электронных компонентов, металлических поверхностей, фотоплёнок и фотобумаг, стеклоочиститель и пр., компонент жидкого мыла и моющих средств.
- Растворитель в производстве фармацевтической продукции, парфюмерии и косметики.
- Растворитель в аэрозолях (бытовых и медицинских).
Поверхностно-активные и моющие вещества[править | править код]
Важнейшим сырьём в производстве современных поверхностно-активных веществ (ПАВ) для синтетических моющих средств являются высшие жирные спирты, из которых в зависимости от реагента получают неионогенные или анионные ПАВ[132].
Мировой объём использования высших жирных спиртов в производстве ПАВ в 2000 году составил 1,68 млн тонн[132]. В 2003 году около 2,5 млн тонн ПАВ было произведено на основе высших жирных спиртов[133].
Полимерные материалы и их компоненты[править | править код]
Спирты имеют важное применение в качестве исходных мономеров для синтеза полимерных материалов методом поликонденсации. В основном, на основе спиртов синтезируют полиэфиры и полиуретаны. Важнейшими примерами таких синтетических полимеров являются полиэтилентерефталат, полибутилентерефталат, получаемые из терефталевой кислоты и этиленгликоля или 1,4-бутандиола соответственно. Поликонденсацией гликолей, глицерина или пентаэритрита с фталевым ангидридом получают алкидные смолы, которые широко используются для изготовления лаков и красок. Полиуретаны получают поликонденсацией изоцианатов с гликолями или многоатомными спиртами[134].
Спирты также используются для производства сложноэфирных и диэфирных пластификаторов для полимеров[135].
Гидравлические жидкости и смазочные материалы[править | править код]
Для получения негорючих гидравлических жидкостей применяют водные растворы, содержащие глицерин и этанол. В производстве тормозных жидкостей широко используют этиленгликоль и эфиры на его основе[136].
Многие современные смазочные материалы имеют в своём составе высшие жирные спирты и их эфиры, благодаря их низкой токсичности, высокой температуре вспышки и бесследному испарению при нагревании. Эти свойства используются для бытового применения, а также для случаев, когда эффект охлаждения поверхности более важен, чем антифрикционные свойства (например, при сверлении, пилении или другой слесарной обработке металлов)[137].
Пестициды[править | править код]

Дикопол — препарат для борьбы с клещами — ароматический спирт, аналог ДДТ.
Несмотря на то, что незамещённые предельные алифатические спирты обладают фунгицидной или гербицидной активностью, их прямое использование в качестве пестицидов не находит широкого практического применения. Одним из немногих направлений является их использование в качестве регулятора роста растений. Подобными свойствами обладают этанол, этиленгликоль и другие гликоли, некоторые высшие жирные спирты[138].
Галогензамещённые спирты проявляют значительно большую активность и обладают ратицидной, гербицидной и фунгицидной активностью. Так, например, препарат глифтор, представляющий смесь 1,3-дифторпропанола-2 и 1-фтор-3-хлорпропанола-2, используется для борьбы с мышевидными грызунами и сусликами[139].
Более высокая биологическая активность наблюдается у непредельных и ароматических спиртов. Аллиловый спирт находит применение в качестве гербицида, многие высшие непредельные спирты являются феромонами насекомых. Активными акарицидами являются некоторые ароматические бифениловые спирты: дикофол, хлорфенетол, проклонол[139][140].
Многие спирты являются полупродуктами для синтеза различных пестицидов[141]. Например, в производстве глифосата используется метанол[142], кротоксифоса — α-метилбензиловый спирт[143], пиретроидов третьего поколения — 3-феноксибензиловый спирт[144].
Также спирты широко используются в качестве неводного носителя для создания товарных композиций пестицидов[145].
Применение спиртов в производстве потребительской продукции[править | править код]
Пищевая промышленность[править | править код]

Годовое потребление алкоголя на душу населения (15+) в литрах в пересчёте на чистый этанол (2004)[146]
Основой всех алкогольных напитков является этанол, который получается при сбраживании пищевого сырья — винограда, картофеля, пшеницы и прочих крахмало- или сахаросодержащих продуктов. Кроме того, этиловый спирт используется в качестве компонента некоторых пищевых и ароматических эссенций (ароматизаторов), широко используемых в кулинарии, при выпечке кондитерских изделий, производстве шоколада, конфет, напитков, мороженого, варений, желе, джемов, конфитюров и пр. Однако этанолом список спиртов, используемых в индустрии продуктов питания, не ограничивается. Спирты можно встретить среди самых разных пищевых добавок, например, глицерин (E422) используется как — влагоудерживающий агент, растворитель, загуститель, разделитель[К 9], плёнкообразователь[К 10], средство для капсулирования. Ряд спиртов находит применение в качестве сахарозаменителей (ксилит, маннит, сорбит, эритрит), ароматизаторов (ментол), красителей (лютеин) и т. д.[147]
Парфюмерия, косметика и бытовая химия[править | править код]
Спирты довольно широко используются в качестве душистых веществ для составления композиций в парфюмерно-косметической промышленности и производстве отдушек для бытовой химии и прочей потребительской продукции (гераниол, нерол, цитронеллол, ментол и др.). Помимо придания аромата, в парфюмерно-косметической продукции спирты используются и в других целях[148]:
- антивспениватели: этанол, пропанол-1, пропанол-2, гексанол;
- антикоррозионые вещества: 2-диметиламино-2-метилпропанол-1;
- антимикробные препараты: 2,4-дихлорбензиловый спирт, (этилендиокси)диметанол;
- антиоксиданты: тиодигликоль;
- антистатики: высшие жирные спирты (С12—С16);
- гидротропные вещества: гексанол;
- маскирующие средства: бутандиол-2,3, 2-бензилгептанол-1, борнеол, 3,7-диметилнонадиен-1,6-ол-3;
- консерванты: 2-бром-2-нитропропандиол-1,3, бензиловый спирт, 1,1,1-трихлор-2-метилбутанол-2;
- охлаждающие агенты: ментол, 3-метоксипропандиол-1,2;
- пластификаторы: октандиол-1,8, 2,2-диметилпропандиол-1,3;
- противосеборейные средства: ундеканол-1;
- связующие: докозанол-1, высшие жирные спирты (С20—С22);
- смягчители: высшие жирные спирты (С9—С16); высшие гликоли (С15—С30);
- средства для завивки или распрямления волос: дитиотреитол, 3-меркаптопропандиол-1,2;
- стабилизаторы эмульсий: 7-дегидрохолестерин, 3-(октадецилокси)пропандиол-1,2, высшие жирные спирты (С9—С50);
- стабилизаторы пены: деканол-1, миристиловый спирт, цетиловый спирт, стеариловый спирт;
- увлажнители: гексантриол-1,2,6, бутандиол-1,2, бутандиол-2,3, 2-бутилоктанол-1, глицерин;
- фиксаторы волос: 2-(2-аминоэтокси)этанол;
- эмульгаторы: высшие жирные спирты (С40—С60).
Применение спиртов в медицине[править | править код]
Основным спиртом, применяющимся в медицинских целях, является этанол. Его используют в качестве наружного антисептического и раздражающего средства для приготовления компрессов и обтираний. Ещё более широко применяется этиловый спирт для приготовления различных настоек, разведений, экстрактов и прочих лекарственных форм[149].
Применение спиртов в качестве собственно лекарственных средств не столь заметно, однако многие препараты по формальному наличию гидроксильной группы можно отнести к рассматриваемому классу органических соединений (кленбутерол, хлорбутанол, маннит, эстрадиол и др.). Например, в перечне 10 наиболее важных рецептурных препаратов США в 2000 году 6-ю строчку занимает альбутерол, содержащий гидроксильную группу[150].
Прочие направления использования[править | править код]
В настоящее время трудно найти область практической деятельности человека, где бы не использовались спирты в той или иной роли. Можно выделить следующие малозначительные направления использования:
- пенообразователи для флотореагентов[151];
- исходные продукты для получения взрывчатых веществ, а также их компоненты (глицерин применяется для синтеза нитроглицерина, этиленгликоль — этиленгликольдинитрата, пентаэритрит — пентаэритриттетранитрата[152]);
- исходные продукты для получения отравляющих веществ, а также компоненты для их дегазации (низшие спирты применяются для синтеза фосфорорганических боевых отравляющих веществ: табуна или диизопропилфторфосфата[153]; моноэтаноламин и метилцеллозольв используются для дегазации[154]).
Примечания[править | править код]
- Комментарии
- ↑ Показатель измерен при 22 °C.
- ↑ Показатель измерен при 40 °C.
- ↑ Первые три места в списке занимают серная кислота, азот и кислород соответственно. В список не входят соединения, получаемые биохимическими методами, например, этанол, получаемый из растительного сырья.
- ↑ По данным на 2009 год. Рассчитано исходя из данных потребления топливного этанола (биоэтанола) и примерных объёмов производства синтетического этанола.
- ↑ Значение рассчитано исходя из данных по объёмам мирового промышленного производства наиболее распространённых спиртов в промышленности.
- ↑ Существуют два основных технологических метода получения формальдегида из метанола:
- окисление с частичным дегидрированием (катализатор: серебро; температура: 400—720 °С):
CH3OH → HCHO + H2
2H2+ O2 → 2H2O - прямое окисление (катализатор: оксидный железо-молибденовый; температура: 300—400 °С):
2CH3OH + O2 → 2HCHO + 2H2O
- окисление с частичным дегидрированием (катализатор: серебро; температура: 400—720 °С):
- ↑ Так называемый биометанол, как и обычный метанол, производятся из синтез-газа, который в свою очередь продуцируется из метана. При этом, при получении биометанола используется так называемый биометан, образующийся из биологических отходов в процессе жизнедеятельности специальных бактерий. Для топливных нужд может быть использован метанол любой технологии производства.
- ↑ В качестве оксигенирующих добавок помимо метанола, этанола и бутанола, могут использоваться изопропанол, пропанол, изобутанол и другие алифатические спирты.
- ↑ Разделители — вещества, облегчающие выемку продуктов из форм, противней или иных жарочных или формующих поверхностей, а также, препятствующих плотному контакту или слипанию частей продукта друг с другом.
- ↑ Плёнкообразователи — вещества, наносящиеся на поверхность пищевых продуктов с защитной целью.
- Использованная литература и источники
- ↑ 1 2 3 Senning A. Elsevier’s Dictionary of Chemoetymology. The whies and whences of chemical nomenclature and terminology. — Elsevier, 2007. — 434 p. — ISBN 978-0-444-52239-9.
- ↑ Alcohols (англ.). IUPAC. Compendium of Chemical Terminology, 2nd ed. (the “Gold Book”). doi:10.1351/goldbook.A00204. Дата обращения: 2 сентября 2010. Архивировано 21 августа 2011 года.
- ↑ Enols (англ.). IUPAC. Compendium of Chemical Terminology, 2nd ed. (the «Gold Book»). doi:10.1351/goldbook.E02124. Дата обращения: 2 сентября 2010. Архивировано 21 августа 2011 года.
- ↑ Phenols (англ.). IUPAC. Compendium of Chemical Terminology, 2nd ed. (the «Gold Book»). doi:10.1351/goldbook.P04539. Дата обращения: 2 сентября 2010. Архивировано 21 августа 2011 года.
- ↑ Алкоголь // Этимологический словарь русского языка = Russisches etymologisches Wörterbuch : в 4 т. / авт.-сост. М. Фасмер ; пер. с нем. и доп. чл.‑кор. АН СССР О. Н. Трубачёва, под ред. и с предисл. проф. Б. А. Ларина [т. I]. — Изд. 2-е, стер. — М. : Прогресс, 1986—1987.
- ↑ Алкоголь // Толковый словарь живого великорусского языка : в 4 т. / авт.-сост. В. И. Даль. — 2-е изд. — СПб. : Типография М. О. Вольфа, 1880—1882.
- ↑ Спирт // Этимологический словарь русского языка = Russisches etymologisches Wörterbuch : в 4 т. / авт.-сост. М. Фасмер ; пер. с нем. и доп. чл.‑кор. АН СССР О. Н. Трубачёва, под ред. и с предисл. проф. Б. А. Ларина [т. I]. — Изд. 2-е, стер. — М. : Прогресс, 1986—1987.
- ↑ Спирты / Фросин В. Н. // Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров. — 3-е изд. — М. : Советская энциклопедия, 1969—1978.
- ↑ IUPAC Nomenclature of Organic Chemistry (англ.). ACD/Labs. Дата обращения: 24 августа 2009. Архивировано 21 августа 2011 года.
- ↑ Кан Р., Дермер О. Введение в химическую номенклатуру = Introduction to Chemical Nomenclature / Пер. с англ. Н. Н. Щербиновской, под ред. В. М. Потапова, Р. А. Лидина. — М.: Химия, 1983. — С. 129.
- ↑ Леенсон И. А. Откуда твоё имя? (недоступная ссылка — история). Журнал «Химия и жизнь – XXI век». Всякая всячина. Дата обращения: 24 августа 2009. Архивировано 29 июня 2013 года.
- ↑ Спермацет // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- ↑ John Roach for National Geographic News. 9,000-Year-Old Beer Re-Created From Chinese Recipe. Дата обращения: 9 марта 2013. Архивировано 10 марта 2013 года.
- ↑ Mousdale D. M. Biofuels: Biotechnology, Chemistry, and Sustainable Development. — Boca Raton: CRC Press, Taylor & Francis Group, 2008. — P. 1—2. — ISBN 978-1-4200-5124-7.
- ↑ al-Hassan, Ahmad Y. Alcohol and the Distillation of Wine in Arabic Sources from the 8th Century // Studies in al-Kimya’: Critical Issues in Latin and Arabic Alchemy and Chemistry. — Hildesheim : Georg Olms Verlag, 2009. — P. 283–298. (same content also available on the author’s website).
- ↑ Григорьева В. З. Водка известная и неизвестная. XIV-XX века. — Эннеагон Пресс, 2007. — С. 12. — ISBN 9785910510108.
- ↑ 1 2
Этиловый спирт // Химическая энциклопедия / Главный редактор H. C. Зефиров. — М.: Научное Издательство «Большая Российская Энциклопедия», 1999. — Т. 5. — С. 994—997. — ISBN 5-85270-310-9. - ↑ Похлёбкин В.В. Терминология русских спиртных напитков в XIV – XV веках. История водки. vkus.narod.ru. Дата обращения: 25 августа 2009. Архивировано 24 февраля 2010 года.
- ↑ Myers R. L. The 100 Most Important Chemical Compounds: A Reference Giude. — Greenwood Press, 2007. — P. 174. — ISBN 978-0-313-33758-1.
- ↑ Forbes R. J. A Short History of the Art of Distillation: From the Beginnings Up to the Death of Cellier Blumenthal. — Brill, 1970. — С. 107—108.
- ↑ 1 2 Соловьёв Ю. И. История химии: Развитие химии с древнейших времен до конца XIX в. Пособие для учителей. — 2-е изд., перераб. — М.: «Просвещение», 1983. — С. 32, 174—175, 240.
- ↑ 1 2 3
Фигуровский Н. А. История химии: Учеб. пособие для студентов пед. ин-тов по хим. и биол. спец. — М.: «Просвещение», 1979. — С. 132, 145, 176. - ↑ Метиловый спирт // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- ↑ 1 2 Химическая энциклопедия, 1992, т. 3, с. 118—119.
- ↑
Андреас Ф., Грабе К. Химия и технология пропилена = Propylenchemie / Под редакцией Полякова З.Н.. — Л.: «Химия», 1973. — С. 53. - ↑
Рахманкулов Д. Л., Кимсанов Б. X., Чанышев Р. Р. Физические и химические свойства глицерина. — М.: «Химия», 2003. — С. 8. — ISBN 5-7245-1228-9. - ↑ Химическая энциклопедия, 1992, т. 1, с. 316—317.
- ↑ Гусев М. В., Минеева Л. А. Микробиология / Рецензенты: кафедра микробиологии Ленинградского государственного университета. — 2-е изд. — М.: Издательство Московского университета, 1985. — 376 с. — 10 200 экз.
- ↑ Химическая энциклопедия, 1992, т. 1, с. 337.
- ↑ Шлегель Г. Общая микробиология = Allgemeine Mikrobiologie / Перевод с немецкого Л. В. Алексеевой, Г. А. Куреллы, Н. Ю. Несытовой. — Перевод 6-го изд. — М.: Мир, 1987. — 567 с. — 22 300 экз.
- ↑ Васильев А. А., Черкаев Г. В., Никитина М. А. Новый подход к душистым веществам с запахом зелени (pdf). Англо-русскоязычный общественный химический журнал
«Бутлеровские сообщения». Дата обращения: 11 сентября 2009. Архивировано из оригинала 4 марта 2016 года. - ↑ Химическая энциклопедия, 1992, т. 3, с. 59.
- ↑ Химическая энциклопедия, 1992, т. 1, с. 1024.
- ↑
Цитронеллол // Химическая энциклопедия / Главный редактор H.C. Зефиров. — М.: Научное Издательство «Большая Российская Энциклопедия», 1999. — Т. 5. — С. 774. — ISBN 5-85270-310-9. - ↑ Химическая энциклопедия, 1992, т. 5, с. 229.
- ↑ Химическая энциклопедия, 1992, т. 2, с. 280.
- ↑ Спирты // Энциклопедия «Кругосвет».
- ↑ Химическая энциклопедия, 1992, т. 5, с. 362.
- ↑ 1 2 Лебедева К. В., Миняйло В. А., Пятнова Ю. Б. Феромоны насекомых. — М.: «Наука», 1984. — С. 6—7, 79—82.
- ↑ 1 2 Bullock C. The biochemistry of alcohol metabolism — A brief review (англ.) // Biochemical Education. — 1990. — Vol. 18, no. 2. — P. 62—66. — doi:10.1016/0307-4412 (90)90174-M.
- ↑ Химическая энциклопедия / Под ред. И. Л. Кнунянца. — М.: Большая Российская энциклопедия, 1992. — Т. 1. — С. 382. — ISBN 5-85270-039-8.
- ↑ Химическая энциклопедия, 1992, т. 1, с. 385.
- ↑ Химическая энциклопедия, 1992, т. 4, с. 436—437.
- ↑ Овчинников Ю. А. Биоорганическая химия. — М.: Просвещение, 1987. — С. 516.
- ↑ Кольман Я., Рём К.-Г. Наглядная биохимия / Пер. с нем.. — М.: Бином. Лаборатория знаний, 2011. — С. 156. — ISBN 978-5-9963-0620-6.
- ↑ 1 2 3 Ленинджер А. 26.3 Этанол также служит источником энергии // Основы биохимии = Principles of Biochemistry / Перевод с английского канд. биол. наук В. Г. Горбулева, канд. биол. наук М. Д. Гроздовой и канд. мед. наук С. Н. Преображенского, под редакцией акад. В. А. Энгельгардта и проф. Я. М. Варшавского. — М.: «Мир», 1985. — Т. 3. — С. 821—822. — 1056 с. — 25 000 экз.
- ↑ Sprince H., Parker C. M., Smith G. G., Gonzales L. J. Protection against acetaldehyde toxicity in the rat by L-cysteine, thiamin and L-2-methylthiazolidine-4-carboxylic acid (англ.) // Agents Actions (англ.) (рус. : journal. — 1974. — April (vol. 4, no. 2). — P. 125—130. — doi:10.1007/BF01966822. — PMID 4842541. (недоступная ссылка)
- ↑ Wiese J. G., Shlipak M. G., Browner W. S. The Alcohol Hangover (англ.) // Annals of Internal Medicine. — 2000. — Vol. 132, no. 11. — P. 897—902. — PMID 10836917.
- ↑ Ковтуненко В. А. Лікарські засоби з дією на центральну нервову систему. — Киев, 1997. — С. 46. — 464 с. — ISBN 966-569-170-8.
- ↑ Бухгалтер Э. Б. Метанол и его использование в газовой промышленности. — М.: Недра, 1986. — С. 180.
- ↑ Метаболизм этанола. Дата обращения: 8 мая 2013. Архивировано 12 апреля 2012 года.
- ↑ The Clinical Toxicology Laboratory: Contemporary Practice of Poisoning Evaluation / Edired by Shaw L. M.. — Amer. Assoc. for Clinical Chemistry, 2001. — P. 173—174, 186. — ISBN 1-890883-53-0.
- ↑ Daniel C., Nachtman J. P. Toxicology of Alcohols, Ketones and Esters–Inhalation // Review of Inhalants: Euphoria to Dysfunction / Editors: Charles Wm. Sharp, Ph.D., Mary Lee Brehm, Ph.D.. — National Institute of Drug Abuse, 1977. — P. 112—116. — (Research Monograph (15)). Архивная копия от 15 октября 2011 на Wayback Machine Архивированная копия. Дата обращения: 14 октября 2010. Архивировано 15 октября 2011 года.
- ↑ Химическая энциклопедия, 1992, т. 5, с. 497.
- ↑ 1 2 3 Нейланд О. Я. Органическая химия: Учеб. для хим. вузов. — М.: «Высшая школа», 1990. — С. 286—287. — ISBN 5-06-001471-1.
- ↑ Термодинамические показатели органических соединений. Новый справочник химика и технолога. Общие сведения. Строение вещества. Физические свойства важнейших веществ. Ароматические соединения. Химия фотографических процессов. Номенклатура органических соединений. Техника лабораторных работ. Основы технологии. Интеллектуальная собственность. ChemAnalitica.com (1 апреля 2009). Дата обращения: 27 августа 2009. Архивировано 8 июля 2011 года.
- ↑ 1 2 Рабинович В. А., Хавин З. Я. Краткий химический справочник. — Изд. 2-е, испр. и доп. — Ленинград: Химия, 1978.
- ↑ Maréchal Y. The Hydrogen Bond and the Water Molecule: The Physics and Chemistry of Water, Aqueous and Bio-Media. — Elsevier, 2007. — С. 18. — ISBN 0-444-51957-2.
- ↑ Глава I. Энергии разрыва связей // Энергии разрыва химических связей. Потенциалы ионизации и сродство к электрону / Отв. редактор В. Н. Кондратьев. — М.: «Наука», 1974. — С. 83.
- ↑ Бушуев Ю. Г., Дубинкина Т. А. Компьютерное моделирование структур метанола и жидкого метана // Журнал физической химии. — 1996. — Т. 70, № 9. — С. 1629.
- ↑ Глава III. Потенциалы ионизации // Энергии разрыва химических связей. Потенциалы ионизации и сродство к электрону / Отв. редактор В. Н. Кондратьев. — М.: Наука, 1974. — С. 247—248, 276.
- ↑ Робертс Дж., Касерио М. Основы органической химии = Basic principles of organic chemistry / Под редакцией академика Несмеянова А. Н.. — 2-е, дополненное. — М.: Мир, 1978. — Т. 1. — С. 401.
- ↑ Глава XIV. Физико-химические свойства жирных спиртов // Высшие жирные спирты (области применения, методы производства, физико-химические свойства) / Под редакцией С. М. Локтева. — М.: Химия, 1970. — С. 283—295.
- ↑ Химическая энциклопедия, 1992, т. 4, с. 800—804.
- ↑ Hudlický M. Oxidation in Organic Chemistry. — ACS monograph 186. — Washington: American Chemical Society, 1990. — P. 57—59. — ISBN 0-8412-1780-7.
- ↑ Хейнс А. Методы окисления органических соединений: Алканы, алкены, алкины и арены = Methods for the oxidation of organic compounds: Alkanes, Alkenes, Alkynes and Arenes / Перевод с англ., под редакцией И.П.Белецкой. — М.: Мир, 1988. — С. 82—108. — 400 с. — ISBN 5-03-000149-2.
- ↑ Титце Л., Айхер Т. Препаративная органическая химия: Реакции и синтезы в практикуме органической химии и научно-исследовательской лаборатории / Пер. с нем.. — М.: «Мир», 1999. — С. 73—75. — 704 с. — ISBN 5-03-002940-0.
- ↑ Реутов и др., 2010, с. 232—233.
- ↑ Corey E. J., Nicolaou K. C., Shibasaki M., Machida Y., Shiner C. S. Superoxide ion as a synthetically useful oxygen nucleophile (англ.) // Tetrahedron Letters. — 1975. — Vol. 16, no. 37. — P. 3183—3186.
- ↑ The changing face of the global methanol industry. CHEMWEEK’S LAB. IHS Chemical Week. Дата обращения: 18 января 2017. Архивировано 18 января 2017 года.
- ↑ Chauvel A., Lefebvre G. Petrochemical processes 2. Major Oxygenated, Chlorinated and Nitrated Derivatives. — 2nd ed. — Paris: Editions Technip, 1989. — P. 69—74. — ISBN 2-7108-0563-4.
- ↑ Berg Ch. World Fuel Ethanol – Analysis and Outlook (англ.). The Online Distillery Network for Distillers & Fuel Ethanol Plants Worldwide (апрель 2004). Дата обращения: 7 декабря 2020. Архивировано 21 августа 2011 года.
- ↑ World Fuel Ethanol Production (англ.). Renewable Fuel Association. Дата обращения: 18 января 2017. Архивировано 18 января 2017 года.
- ↑ 1 2 Papa A. J. Propanols // Ullmann’s Encyclopedia of Industrial Chemistry. — Wiley, 2000. — doi:10.1002/14356007.a22_173.pub2.
- ↑ Isopropanol (IPA) CAS No: 67-63-0 (англ.). Chemical intelligence. ICIS.com. Дата обращения: 25 мая 2010. Архивировано 21 августа 2011 года.
- ↑ 1 2 Isopropyl Alcohol (IPA) (англ.). WP Report. SRI Consulting (январь 2010). Дата обращения: 25 мая 2010. Архивировано 21 августа 2011 года.
- ↑ Chauvel, Lefebre, 1989, с. 76—79.
- ↑ Ethylene Glycol (англ.). WP Report. SRI Consulting (январь 2010). Дата обращения: 25 мая 2010. Архивировано 21 августа 2011 года.
- ↑ Rebsdat S., Mayer D. Ethylene Glycol // Ullmann’s Encyclopedia of Industrial Chemistry. — Wiley, 2000. — doi:10.1002/14356007.a10_101.
- ↑ Product Safety Assessment DOW n-Propanol (англ.) (pdf). The Dow Chemical Company. Дата обращения: 25 мая 2010. Архивировано из оригинала 16 июля 2017 года.
- ↑ Christoph R., Schmidt B., Steinberner U., Dilla W., Karinen R. Glycerol // Ullmann’s Encyclopedia of Industrial Chemistry. — Wiley, 2000. — doi:10.1002/14356007.a12_477.pub2.
- ↑ Speight J. G. Chemical Process and Design Handbook. — McGraw-Hill, 2002. — P. 2.251. — ISBN 0-07-137433-7.
- ↑ Chenier Ph. J. Survey of Industrial Chemistry. — Third Edition. — New York: Kluwer Academic / Plenum Publishers, 2002. — P. 242. — ISBN 0-306-47246-5.
- ↑ Ланге К. Р. Поверхностно-активные вещества: синтез, свойства, анализ, применение = Surfactants. A Practical Handbook / Пер. с англ. — СПб.: «Профессия», 2004. — С. 18—20. — ISBN 5-93913-068-2.
- ↑ Brackmann B., Hager C.-D. The Statistical World of Raw Materials, Fatty Alcohols and Surfactants (англ.). CESIO 6th World Surfactants Congress, Berlin, June 20–23, 2004. Laboratory of Formulation, Interfaces, Rheology and Processes FIRP (Venezuela). Дата обращения: 20 сентября 2010. Архивировано 21 августа 2011 года.
- ↑ Kosaric N., Duvnjak Z., Farkas A., Sahm H., Bringer-Meyer S., Goebel O., Mayer D. Ethanol // Ullmann’s Encyclopedia of Industrial Chemistry. — Wiley, 2000. — doi:10.1002/14356007.a09_587.pub2.
- ↑ Hahn H.-D., Dämbkes G., Rupprich N., Bahl H., Frey G. D. Butanols // Ullmann’s Encyclopedia of Industrial Chemistry. — Wiley, 2000. — doi:10.1002/14356007.a04_463.pub3.
- ↑ Курц А. Л., Брусова Г. П., Демьянович В. М. Раздел III. Свойства одноатомных спиртов. Одно- и двухатомные спирты, простые эфиры и их сернистые аналоги. ChemNet. Химический факультет МГУ (1999). Дата обращения: 28 августа 2009. Архивировано 17 ноября 2009 года.
- ↑ McMurry J. Organic chemistry. — Seven edition. — Thomson, 2008. — P. 604, 658. — ISBN 0-495-11258-5.
- ↑ Evans D. A. Evans pKa Table. Дата обращения: 14 марта 2013. Архивировано из оригинала 2 октября 2013 года.
- ↑ Реутов и др., 2010, с. 243.
- ↑ Общая органическая химия. Кислородсодержащие соединения = Comprehensive Organic Chemistry / Под ред. Д. Бартона и В. Д. Оллиса. — М.: «Химия», 1982. — Т. 2. — С. 20.
- ↑ Реутов и др., 2010, с. 244—248.
- ↑ Реутов и др., 2010, с. 248—252.
- ↑ Реутов и др., 2010, с. 258—260.
- ↑ Реутов и др., 2010, с. 260—261.
- ↑ Реутов и др., 2010, с. 265—269.
- ↑ Терней А. Л. Современная органическая химия / Под ред. Н. Н. Суворова. — 2-е, переработанное. — М.: Мир, 1981. — Т. 1. — С. 418—421.
- ↑ Химическая энциклопедия, 1992, т. 1, с. 497—498.
- ↑ Williams D. L. H. Nitrosation Reactions and The Chemistry of Nitric Oxide. — First edition. — Elsevier, 2004. — С. 86. — ISBN 0-444-51721-9.
- ↑ 1 2 Шрайнер Р., Фьюзон E., Кёртин Д., Моррилл Т. Идентификация органических соединений / Пер. с англ.. — М.: Мир, 1983. — С. 167—185.
- ↑ 1 2 Сиггиа С., Ханна Дж. Г. Количественный органический анализ по функциональным группам / Пер. с англ.. — М.: «Химия», 1983. — С. 16—19.
- ↑ Преч Э., Бюльманн Ф., Аффольтер К. Определение строения органических соединений. Таблицы спектральных данных / Пер. с англ. — М.: «Мир», 2006. — С. 336. — (Методы в химии). — ISBN 5-03-003586-9.
- ↑ 1 2 Браун Д., Флойд А., Сейнзбери М. Спектроскопия органических веществ / Пер. с англ.. — М.: «Мир», 1992. — С. 59—60. — ISBN 5-03-002111-6.
- ↑ Преч и др., 2006, с. 208.
- ↑ Ионин Б. И., Ершов Б. А., Кольцов А. И. ЯМР-спектроскопия в органической химии / Под ред. Б. А. Ершова. — 2-е изд., переработанное. — Л.: «Химия», 1983. — С. 177.
- ↑ Chenier, 2002, с. 17—18.
- ↑ Chenier, 2002, с. 217—219.
- ↑ Chauvel A., Lefebvre G. Petrochemical processes 1. Synthesis-gas Derivatives and Major Hydrocarbons. — 2nd ed. — Paris: Editions Technip, 1989. — P. 95—97. — ISBN 2-7108-0562-5.
- ↑ Chauvel, Lefebre, 1989, с. 53.
- ↑ Speight, 2002, с. 1.3.
- ↑ Химическая энциклопедия, 1992, т. 3, с. 106—107.
- ↑ Лебедев Н. Н. Химия и технология основного органического и нефтехимического синтеза: Учебник для вузов. — 4-е изд., перераб. и доп. — М.: Химия, 1988. — С. 132. — ISBN 5-7245-0008-6.
- ↑ Лебедев, 1988, с. 188.
- ↑ Лебедев, 1988, с. 133.
- ↑ Chauvel, Lefebre, 1989, с. 31—33.
- ↑ Speight, 2002, с. 2.212.
- ↑ Chauvel, Lefebre, 1989, с. 127—133.
- ↑ Chenier, 2002, с. 234.
- ↑ Использование этилового спирта в качестве компонента автомобильного бензина. Анализ нормативной документации. Законы и практика. Аналитический портал химической промышленности Newchemistry.ru. Дата обращения: 12 сентября 2010. Архивировано 21 декабря 2010 года.
- ↑ Карпов С. А., Кунашев Л. Х., Царев А. В., Капустин В. М. Применение алифатических спиртов в качестве экологически чистых добавок в автомобильные бензины // Нефтегазовое дело. — 2006. — № 2. Архивировано 23 сентября 2010 года.
- ↑ Использование спиртов как добавок к нефтяным топливам. Альтернативные топлива, энергетика. Аналитический портал химической промышленности Newchemistry.ru. Дата обращения: 12 сентября 2010. Архивировано 4 ноября 2011 года.
- ↑ Биодизель. Российская Национальная Биотопливная Ассоциация. Дата обращения: 12 сентября 2010. Архивировано из оригинала 21 августа 2010 года.
- ↑ Linak E., Inoguchi Y., Janshekar H. Ethanol (англ.). CEH Report. SRI Consulting (апрель 2009). Дата обращения: 18 августа 2010. Архивировано 21 августа 2011 года.
- ↑ Global ethanol production to reach 85.9 billion litres in 2010: Global Renewable Fuels Alliance releases 2010 biofuels production forecast (недоступная ссылка — история). Press Release. Global Renewable Fuels Alliance (21 марта 2010). Дата обращения: 25 мая 2010. Архивировано 2 февраля 2012 года.
- ↑ Карпов С. А. Актуальные аспекты применения топливного этанола в России и США // Нефтегазовое дело. — 2006. — № 2. Архивировано 15 июля 2007 года.
- ↑ Smith J. L., Workman J. P. Alcohol for Motor Fuels (англ.). Colorado State University Extension (декабрь 2004). Дата обращения: 12 сентября 2010. Архивировано 21 августа 2011 года.
- ↑ Дринберг С. А., Ицко Э. Ф. Растворителя для лакокрасочных материалов: Справочное пособие. — 2-е изд., перераб. и доп. — Л.: «Химия», 1986. — С. 51.
- ↑ Market Study: Solvents (3rd edition) (англ.). Chemicals. Ceresana. Дата обращения: 7 ноября 2017. Архивировано 7 ноября 2017 года.
- ↑ Ethanol Uses and Market Data (англ.). Chemical Intelligence. ICIS.com. Дата обращения: 14 сентября 2010. Архивировано 21 августа 2011 года.
- ↑ 2-Propanol (англ.). Environmental Health Criteria (EHC) Monographs. International Programme on Chemical Safety (IPCS) INCHEM. Дата обращения: 18 августа 2010. Архивировано 21 августа 2011 года.
- ↑ 1 2 Chemistry and Technology of Surfactants / Edited by Richard J. Farn. — Blackwell Publishing Ltd, 2006. — 5—6 p. — ISBN 978-14051-2696-0.
- ↑ Dierker M., Schäfer H. J. Surfactants from oleic, erucic and petroselinic acid: Synthesis and properties (англ.) // European Journal of Lipid Science and Technology. — 2010. — Vol. 112, no. 1. — P. 122. Архивировано 6 марта 2014 года.
- ↑ Chanda M., Roy S. K. Industrial Polymers, Specialty Polymers, and Their Applications. — Boca Raton: CRC Press, Taylor & Francis Group, 2009. — P. 1—55—1-58, 1-97—1-98. — ISBN 978-1-4200-8058-2.
- ↑ Барштейн Р. С., Кирилович В. И., Носовский Ю. Е. Пластификаторы для полимеров. — М.: «Химия», 1982. — С. 19—20.
- ↑ Химическая энциклопедия, 1992, т. 1, с. 546.
- ↑ Lubricants and Lubrication / Edited by Theo Mang and Wilfried Dresel. — 2nd edition. — Weinheim: Wiley-VCH GmbH, 2007. — P. 516—517. — ISBN 978-3-527-31497-3.
- ↑ Мельников, 1987, с. 106—110.
- ↑ 1 2 Мельников Н. Н. Пестициды. Химия, технология и применение. — М.: «Химия», 1987. — 710 с.
- ↑ Proclonol (англ.). Compendium of Pesticide Common Names. Alan Wood’s Web site. Дата обращения: 26 сентября 2010. Архивировано 21 августа 2011 года.
- ↑ Unger T. A. Pesticide Synthesis Handbook. — New Jersey: Noyes Publications, 1996. — 1080 p. — ISBN 0-8155-1401-8.
- ↑ Unger, 1996, с. 277.
- ↑ Unger, 1996, с. 294.
- ↑ Мельников, 1987, с. 181—182.
- ↑ Guidance Manual for Selecting Protective Clothing for Agricultural Pesticide Operations / Contract No. 68-C9-0037. — Work Assignment 0-20. — Cincinatti: U.S. EPA, 1994. — P. 45. Архивная копия от 31 июля 2013 на Wayback Machine
- ↑ Всемирная организация здравоохранения. Global Status Report on Alcohol 2004. Дата обращения: 22 марта 2013. Архивировано 27 марта 2013 года.
- ↑ Сарафанова Л. А. Пищевые добавки: Энциклопедия. — 2-е изд., испр. и доп. — СПб.: ГИОРД, 2004. — 808 с. — ISBN 5-901065-79-4.
- ↑ List of Functions (англ.). Cosmetics CosIng. European Commission. Health and Consumers. Дата обращения: 8 сентября 2010. Архивировано 21 августа 2011 года.
- ↑ Машковский М. Д. Лекарственные средства: В 2 томах. — 14-е изд., перераб., исправ. и доп. — М.: ООО «Издательство Новая Волна»: Издатель С. Б. Дивов, 2002. — Т. 2. — С. 382. — ISBN 5-7864-0129-4.
- ↑ Chenier, 2002, с. 421.
- ↑
Флотация // Химическая энциклопедия / Главный редактор H. C. Зефиров. — М.: Научное Издательство «Большая Российская Энциклопедия», 1999. — Т. 5. — С. 207—208. — ISBN 5-85270-310-9. - ↑ Орлова Е. Ю. Химия и технология бризантных взрывчатых веществ: Учебник для вузов. — 3-е изд., перераб. — Л.: «Химия», 1981. — С. 263, 278, 281.
- ↑
Франке З. Химия отравляющих веществ / Пер. с нем.. — М.: Химия, 1973. — Т. 1. — С. 271, 288. - ↑
Франке З., Франц П., Варнке В. Химия отравляющих веществ / Пер. с нем., под редакцией акад. И. Л. Кнунянца и д-ра хим. наук Р. Н. Стерлина. — М.: Химия, 1973. — Т. 2. — С. 317.
Литература[править | править код]
- Англоязычная
- Alcoholic Fuels / Edited by Shelley Minteer. — Boca Raton: CRC Press / Taylor & Francis, 2006. — 273 p. — ISBN 978-0-8493-3944-8.
- Alcohols / Volume Editor: Prof. Jonathan Clayden. — Science of Synthesis: Houben-Weyl Methods of Molecular Transformations. — Georg Thieme Verlag, 2008. — 1294 p. — (Category 5: Compounds with One Carbon-Heteroatom Bonds). — ISBN 978-1-588-90527-7.
- Catalytic Conversions of Synthesis Gas and Alcohols to Chemicals / Editor: Richard G. Herman. — Plenum Press, 1984. — 475 p. — (American Chemical Society, Middle Atlantic Regional Meeting). — ISBN 0-30-641614-X.
- Mellan I. Polyhydric Alcohols. — Spartan Books. — 1962. — 208 p.
- Monick J. A. Alcohols: Their Chemistry, Properties, and Manufacture. — Reinhold, 1968. — 594 p. — ISBN 0-442-15601-4.
- Monohydric Alcohols: Manufacture, Applications, and Chemistry: based on a symposium / Editor: Edward J. Wickson. — American Chemical Society, 1981. — 222 p. — (ACS symposium series (volume 159)). — ISBN 0-841-20637-6.
- Otera J., Nishikido J. Esterification: Methods, Reactions, and Applications. — Second edition. — Weinheim: Wiley-VCH, 2010. — 374 p. — ISBN 978-3-527-32289-3.
- Tojo G., Fernández M. Oxidation of Alcohols to Aldehydes and Ketones. — First Edition. — New York: Springer, 2006. — 375 p. — ISBN 0-387-23607-4.
- Weissermel K., Arpe H-J. Alcohols // Industrial organic chemistry. — 4th ed. — Weinheim: Wiley-VCH, 2003. — P. 193—266. — ISBN 978-3-527-30578-0.
- Русскоязычная
- Спирты // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Высшие жирные спирты (области применения, методы производства, физико-химические свойства) / Под редакцией С. М. Локтева. — М.: «Химия», 1970. — 329 с.
- Курц А. Л., Брусова Г. П., Демьянович В. М. Одно- и двухатомные спирты, простые эфиры и их сернистые аналоги. Учебные материалы. Органическая химия. ChemNet. Химический факультет МГУ (1999). Дата обращения: 10 июля 2010. Архивировано из оригинала 4 марта 2016 года.
- Маркизова Н. Ф., Гребенюк А. Н., Башарин В. А., Бонитенко Е. Ю. Спирты. — СПб.: «Фолиант», 2004. — 112 с. — (Токсикология для врачей). — ISBN 5-93929-089-2.
- Реутов О. А., Курц А. Л., Бутин К. П. Органическая химия. — 3-е изд.. — М.: Бином. Лаборатория знаний, 2010. — Т. 2. — ISBN 978-5-94774-614-9.
- Спирты. Энциклопедия по охране и безопасности труда. Том IV. Раздел XVIII. Справочники. Обзор химических соединений. Институт промышленной безопасности, охраны труда и социального партнёрства. Дата обращения: 27 декабря 2010. Архивировано из оригинала 4 марта 2016 года.
Ссылки[править | править код]
- Алкоголи // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Спирты. Фенолы (недоступная ссылка — история). Органическая химия. Видеоопыты. Единая коллекция цифровых образовательных ресурсов. Дата обращения: 6 июля 2010. Архивировано 21 августа 2011 года.
Спирты – кислородсодержащие органические соединения, функциональной группой которых является гидроксогруппа (OH) у
насыщенного атома углерода.
Спирты также называют алкоголи. Первый член гомологического ряда – метанол – CH3OH.
Общая формула их гомологического ряда – CnH2n+1OH.
Классификация спиртов
По числу OH групп спирты бывают одноатомными (1 группа OH), двухатомными (2 группы OH – гликоли), трехатомными (3 группы
OH – глицерины) и т.д.
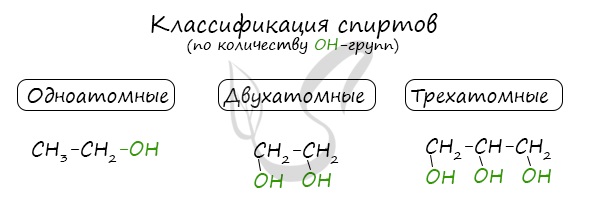
Одноатомные спирты также подразделяются в зависимости от положения OH-группы: первичные (OH-группа у первичного атома углерода),
вторичные (OH-группа у вторичного атома углерода) и третичные (OH-группа у третичного атома углерода).
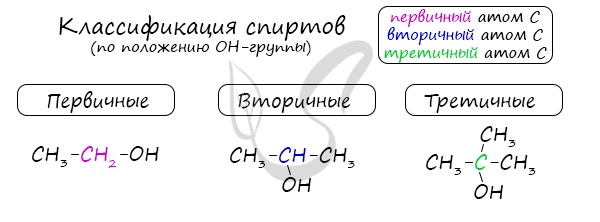
Номенклатура и изомерия спиртов
Названия спиртов формируются путем добавления суффикса “ол” к названию алкана с соответствующим числом атомов углерода: метанол,
этанол, пропанол, бутанол, пентанол и т.д.
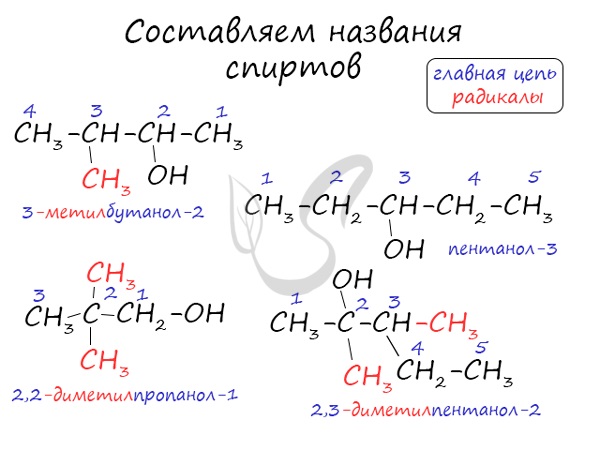
Для спиртов характерна изомерия углеродного скелета (начиная с бутанола), положения функциональной группы и межклассовая изомерия с
простыми эфирами, которых мы также коснемся в данной статье.
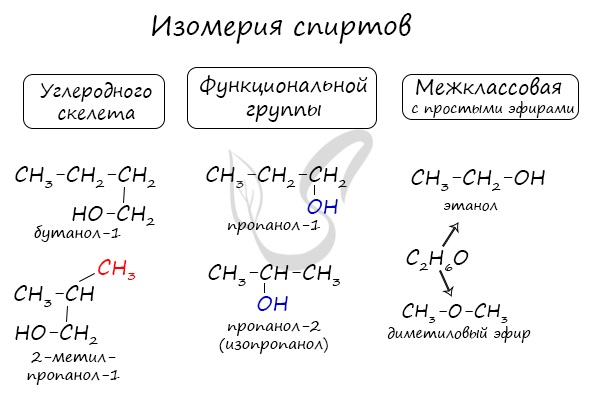
Получение спиртов
- Гидролиз галогеналканов водным раствором щелочи
- Гидратация алкенов
- Восстановление карбонильных соединений
- Получение метанола из синтез-газа
- Получение этанола брожением глюкозы
- Окисление алкенов KMnO4 в нейтральной (водной) среде
Помните, что в реакциях галогеналканов со сПИртовым раствором щелочи получаются Пи-связи (π-связи) – алкены, а в реакциях с водным раствором
щелочи образуются спирты.

Присоединения молекулы воды (HOH) протекает по правилу Марковникова. Атом водорода направляется к наиболее гидрированному атому углерода,
а гидроксогруппа идет к соседнему, наименее гидрированному, атому углерода.
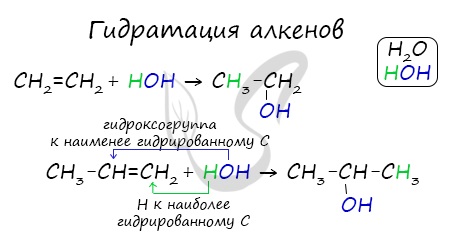
В результате восстановления альдегидов и кетонов получаются соответственно первичные и вторичные спирты.
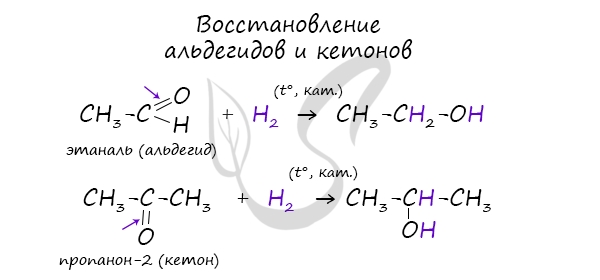
Синтез газом в промышленности называют смесь угарного газа и водорода, которая используется для синтеза различных
химических соединений, в том числе и метанола.
CO + 2H2 → (t,p,кат.) CH3-OH
В ходе брожения глюкозы выделяется углекислый газ и образуется этанол.
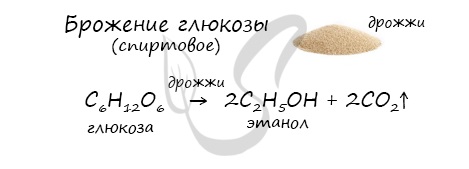
В результате такой реакции у атомов углерода, прилежащих к двойной связи, формируются гидроксогруппы – образуется двухатомный спирт (гликоль).
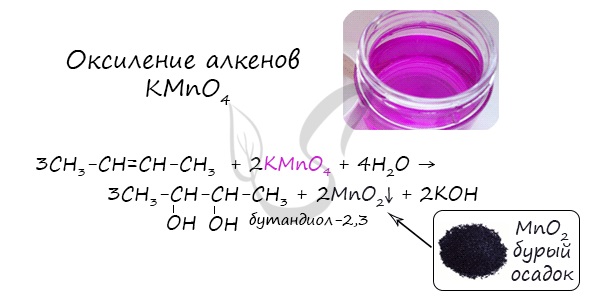
Химические свойства спиртов
Предельные спирты (не содержащие двойных и тройных связей) не вступают в реакции присоединения, это насыщенные кислородсодержащие соединения.
У спиртов проявляются новые свойства, которых мы раньше не касались в органической химии – кислотные.
- Кислотные свойства
- Реакция с галогеноводородами
- Реакции с кислотами
- Дегидратация спиртов
- Диметиловый эфир – CH3-O-CH3
- Метилэтиловый эфир – CH3-O-C2H5
- Диэтиловый эфир – C2H5-O-C2H5
- Окисление спиртов
- Качественная реакция на многоатомные спирты
- Кислотные свойства многоатомных спиртов
Щелочные металлы (Li, Na, K) способны вытеснять водород из спиртов с образованием солей: метилатов, этилатов, пропилатов и т.д.

Необходимо особо заметить, что реакция с щелочами (NaOH, KOH, LiOH) для предельных одноатомных спиртов невозможна, так как образующиеся
алкоголяты (соли спиртов) сразу же подвергаются гидролизу.
Реакция с галогеноводородами протекают как реакции обмена: атом галогена замещает гидроксогруппу, образуется молекула воды.
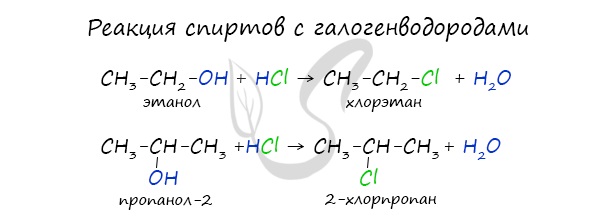
В результате реакций спиртов с кислотами образуются различные эфиры.

Дегидратация спиртов (отщепление воды) идет при повышенной температуре в присутствии серной кислоты (водоотнимающего) компонента.
Возможен межмолекулярный механизм дегидратации (при t < 140°С), в результате которого образуются простые эфиры. При более
высокой температуре (t > 140°С) механизм дегидратации становится внутримолекулярный – образуются алкены.
Названия простых эфиров формируются проще простого – по названию радикалов, входящих в состав эфира. Например:

Качественной реакцией на спирты является взаимодействие с оксидом меди II. В ходе такой реакции раствор приобретает характерное фиолетовое
окрашивание.
Замечу, что в обычных условиях третичные спирты окислению не подвергаются. Для них необходимы очень жесткие условия, при
которых углеродный скелет подвергается деструкции.
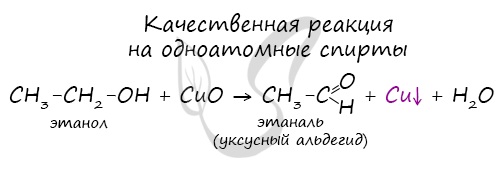
Вторичные и третичные спирты определяются другой качественной реакцией с хлоридом цинка II и соляной кислотой. В результате такой
реакции выпадает маслянистый осадок.
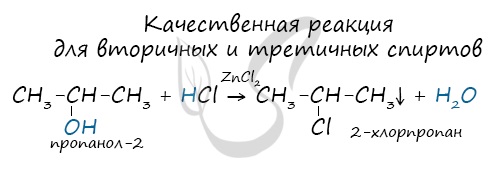
Первичные спирты окисляются до альдегидов, а вторичные – до кетонов. Альдегиды могут быть окислены далее – до карбоновых кислот, в отличие
от кетонов, которые являются “тупиковой ветвью развития” и могут только снова стать вторичными спиртами.
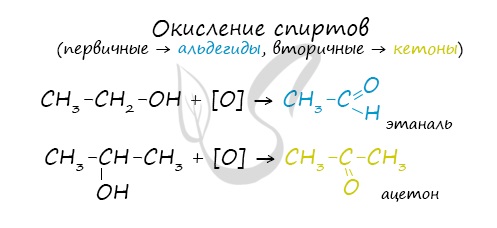
Такой реакцией является взаимодействие многоатомного спирта со свежеприготовленным гидроксидом меди II. В результате реакции раствор
окрашивается в характерный синий цвет.
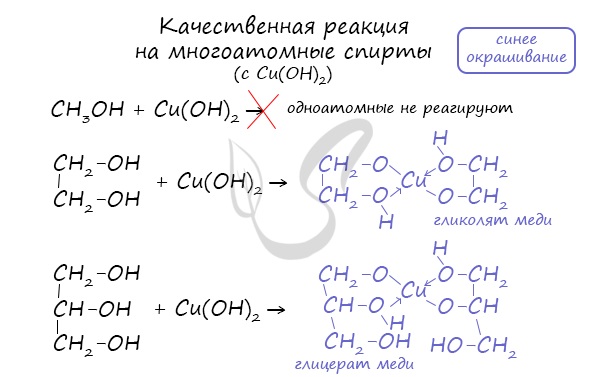
Важным отличием многоатомных спиртов от одноатомных является их способность реагировать со щелочами (что невозможно для одноатомных спиртов).
Это говорит об их более выраженных кислотных свойствах.
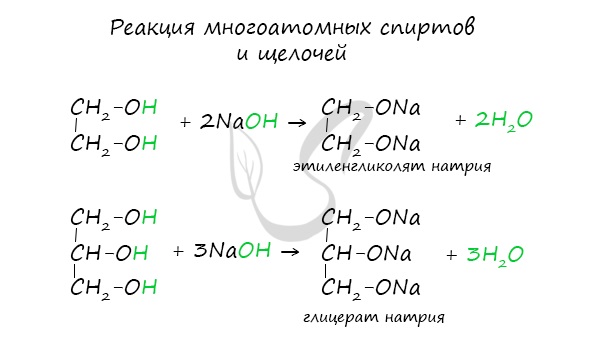
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
План урока:
Формула и строение спиртов
Классификация спиртов
Номенклатура спиртов
Изомерия спиртов
Методы получения спиртов
Физические свойства
Химические свойства
Применение спиртов
Формула и строение спиртов
Спирты из-за наличия функциональной группы -ОН можно рассматривать как производное воды Н-О-Н. Геометрическое строение воды и спиртов схоже. Угол связи R-O-H равен 109˚, при этом гидроксильный кислород находится в состоянии sp3-гибридизации.

Строение молекулы спирта
У спиртов особенное электронное строение. Алкоголи – дипольные молекулы, которые содержат связи C-H, C-O, O-H. Атом кислорода имеет частично отрицательный заряд, а атомы углерода и водорода – частично положительный. Связь О-Н имеет большую полярность, по сравнению со связью С-О. Это явление связано с разностью электроотрицательности кислорода и водорода. Но полярность связей недостаточна для диссоциации и образования ионов Н+. Поэтому можно сделать вывод, что спирты – неэлектролиты.

Формула спиртов: CnH2n+1OH
Классификация спиртов
В классификации спиртов заключены особенности строения молекул. По числу гидроксильных групп различают одноатомные, двухатомные, трехатомные и многоатомные спирты.

Также спирты классифицируют в зависимости от положения гидроксильной группы на первичные, вторичные и третичные.

Номенклатура спиртов
Для спиртов свойственно несколько типов номенклатуры.
- Тривиальная (историческая) номенклатура. Для простых спиртовых соединений свойственны упрощенные названия. В этом случае название радикала переводят в прилагательное с помощью окончания «овый» и добавляют слово «спирт». Например, CH3-CH2-CH2-OH – пропановый спирт.
У первых двух представителей гомологического ряда есть особенные исторические названия. Метанол – древесный спирт, а этанол – винный. Такие названия обусловлены историческим методом получения. Опьяняющие свойства этанола были известны не менее чем за 8000 лет до н.э.
- Систематическая номенклатура спиртов. Как правило, в химии используют именно этот вид номенклатуры. В одноатомных спиртах к названию радикала добавляется суффикс «ол», в двухатомных – «диол», в трехатомных – «триол». Положение гидроксигруппы обозначается наименьшим значением, если в составе спирта отсутствует карбонильная и/или карбоксильная группа.

Алгоритм названия спиртов
Систематическая номенклатура подчиняется определенному алгоритму.
- Выбор главной цепи в соединении.
- Нумерация начинается с того конца, к которому ближе функциональная группа.
- Название углеводородного радикала.
- Прибавление окончания «ол» и указание номера атома углерода, с которым связана гидроксогруппа.

Изомерия спиртов
Для спиртов свойственно несколько видов изомерии – изомерия углеродного скелета, положения заместителя и межклассовая (с простыми эфирами). Изомерия углеродного скелета начинается с бутанола.

Типы изомерии спиртов
Способы получения спиртов
Существует несколько реакций получения спиртов.

Реакция проходит по правилу Марковникова, т.е. атом водорода присоединяется к более гидрированному атому углерода, а гидроксильная группа – к менее. Например, в молекуле CH3-CH2-CH=CH2 атом водорода Н+ примыкает к атому углерода, стоящему в СН2 у кратной связи, а гидроксильная группа ОН– – к СН.

Физические свойства
Физические свойства определяются особенностями строения молекулы спирта. Алкоголи – бесцветные жидкости с характерным запахом. Температуры плавления и кипения спиртов выше, чем у соответствующих представителей других классов веществ. По гомологическому ряду они увеличиваются.
Все алкоголи имеют плотность ниже единицы, т.е. они плавают на поверхности воды. Спирты растворимы в большинстве органических растворителях.
Особенность алкоголей заключается в том, что в гомологическом ряде нет газов. Агрегатное состояние спиртов – жидкое или твердое. Это связано с тем, что атом кислорода в гидроксильной группе обладает частично отрицательным зарядом, а атом водорода – частично положительным. Кислород притягивает положительно заряженные атомы и образует с ними водородные связи. Большое количество таких связей обеспечивает «прилипание» молекул спирта между собой и обуславливает особенное строение.

Из этилового спирта изготавливают алкогольные напитки. Несмотря на относительную безопасность употребления этанола, его систематическое употребление пагубно влияет на организм:
- 100 мл пива – гибель 3000 клеток головного мозга,
- 100 мл вина – гибель 5000 клеток головного мозга,
- 100 мл водки – гибель 7500 клеток головного мозга.
В алкогольные напитки вместо этанола могут добавлять метанол, который опасен для жизни. Эти два спирта отличаются по характеру пламени:
- метиловый горит зеленым пламенем,
- этиловый – синим.
Но при наличии примесей в метаноле, зеленое пламя может и не появиться.
Химические свойства
Реакции замещения
- Замещение водорода в гидроксильной группе
- Взаимодействие с активными металлами (например, с натрием)
Реакция проводится в безводной среде. В воде алкоголяты металлов полностью гидролизуются.
2CH3-CH2-O[H] + 2Na → 2CH3-CH2-ONa + H2
- Взаимодействие с кислотами (этерификация)
CH3-O[H + HO]-NO2→ CH3-O-NO2 + H2O
- Замещение гидроксигруппы
- Взаимодействие с галогеноводородами при нагревании
CH3-CH2-[OH + H]Br→ CH3-CH2-Br + H2O
- Взаимодействие с аммиаком
Реакция идет при пропускании смеси паров спирта с аммиаком при 300˚С над оксидом алюминия.
CH3-CH2-[OH +H]-NH2→CH3-CH2-NH2 + H2O
При избытке в спирте алкильных радикалов в молекуле аммиака могут замещаться два или три атома водорода.
2CH3-CH2-[OH + H]-NH2 → C2H5-NH-C2H5 + 2H2O
Реакции отщепления
- Дегидратация
- Межмолекулярная дегидратация в присутствии концентрированной серной кислоты и при 140˚С
CH3-CH2-O[H + НО]-СН2-СН3→С2Н5-О-С2Н5 + Н2О
CH3-O[H + HO]-CH2-CH3→ CH3-O-C2H5 + H2O
- Внутримолекулярная дегидратация в присутствии концентрированной серной кислоты и при 170˚С
OH]-CH2-CH2-[H →CH2=CH2 + H2O
Для метанола не характерна внутримолекулярная дегидратация. Реакция вторичных и третичных спиртов проходит по правилу Зайцева. Т.е. при отщеплении воды от спирта атом водорода отрывается от соседнего менее гидрированного атома углерода. Например, в молекуле CH3-CH2-CH(OH)-CH3 атом водорода Н+ отщепляется от атома углерода в СН3, находящегося вблизи гидроксильной группы.
CH3-CH(OH)-CH2-CH3→CH3-CH=CH-CH3 + H2O
- Дегидрирование в присутствии катализатора меди и под действием нагревания

Реакции окисления
- Полное окисление (горение)
CH3-CH2-OH + 3О2→ 2СО2 + 3Н2О
Неполное окисление

Качественная реакция на многоатомные спирты
Качественная реакция – химическое превращение, которое сопровождается характерными признаками. С ее помощью можно распознать определенное вещество.Строение многоатомных спиртов, т.е. присутствие в молекуле нескольких гидроксильных групп, обуславливает образование при взаимодействии со свежеполученным осадком гидроксида меди (II) растворимых в воде комплексов василькового цвета.

Строение одноатомных спиртов такая качественная реакция не подтверждает.
Применение спиртов
Метанол, или древесный спирт, опасен для употребления. Он был получен путем перегонки твердых древесных пород. Этот одноатомный спирт недобросовестные производители алкогольных напитков применяют вместо этанола, что провоцирует гибель потребителей. Древесный спирт в организме под влиянием фермента алкогольдегидрогеназы преобразуется в формальдегид и муравьиную кислоту, которые провоцируют слепоту. 50 мл метанола – смертельная доза. Метанол непросто отличить от этанола, т.к. они имеют схожий запах и вид.

Применение метилового спирта
Области применения этилового спирта разнообразны. Этиловый спирт используют в получении синтетического каучука, лекарственных препаратов и применяют как растворитель. Этанол используется в изготовлении алкоголя. При попадании в организм он снижает болевые ощущения, уменьшает торможения в коре головного мозга, ускоряет мочеобразование, провоцирует расширение кровеносных сосудов. При больших количествах этанола происходит его окисление до ацетальдегида, что вызывает тяжелые отравления.
При систематическом употреблении алкоголя снижается работоспособность головного мозга, а клетки печени погибают. Дети и подростки, употребляющие алкоголь, подвержены инфекционным заболеваниям. Продолжительность жизни пьющих людей меньше на 10-12 лет по сравнению с людьми, ведущих здоровый образ жизни.

Применение этилового спирта.
Практическое применение трехатомный спирт глицерин нашел в косметической, медицинской и пищевой промышленности. Он смягчает и успокаивает кожу. Также глицерин входит в состав зубной пасты, что предотвращает ее высыхание.

Применение глицерина
Многоатомный спирт глицерин также применяют в промышленной отрасли для предотвращения кристаллизации продуктов. Его используют как увлажнитель для табака. Он входит в состав клеев и предохраняет их от слишком быстрого высыхания.

Содержание
- Определение
- Гомологический ряд, номенклатура, изомерия
- Строение молекул
- Свойства одноатомных спиртов
- Физические свойства
- Химические свойства
- Получение и применение спиртов (на примере этилового спирта)
- Многоатомные спирты
- Понятие о фенолах
- Выводы
Определение
Спирты — это производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на гидроксогруппу ОН.
Если углеводородный радикал обозначить буквой R, то в общем виде формулу молекулы спирта можно изобразить так:
У атома углерода, который соединен с гидроксогруппой, все связи должны быть простыми:
Соединения, у которых гидроксогруппа находится рядом с двойной связью, неустойчивы:
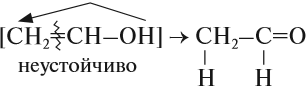
По строению углеводородного радикала спирты делят на:
- предельные
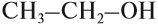
в углеводородном радикале, все связи простые;
- непредельные
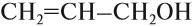
в углеводородном радикале, есть кратная связь;
- ароматические
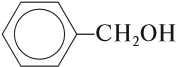
имеется бензольное кольцо, т. е. в углеводородном радикале есть ароматическая связь.
По числу гидроксогрупп спирты делят на:
- одноатомные
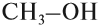
в состав молекулы входит одна гидроксогруппа ОН;
- многоатомные
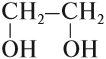
в состав молекул входит две или более (много) гидроксогрупп.
Рассмотрим строение молекул и свойства предельных одноатомных спиртов.

Гомологический ряд, номенклатура, изомерия
Для того чтобы вывести общую формулу гомологического ряда предельных одноатомных спиртов, сравним их состав и состав алканов:
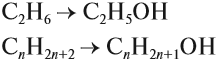
В названиях спиртов гидроксогруппа обозначается суффиксом ОЛ. Этот суффикс прибавляется к названию исходного углеводорода:
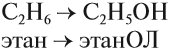
Кроме этих названий (по ИЮПАК) для простейших спиртов используют рациональные названия, которые происходят от названия радикала:

Начиная с n = 3, для спиртов возможна изомерия. Она связана с положением группы ОН в молекуле:

Вопрос. Как обозначить положение группы ОН в молекуле?
Как всегда, положение группы ОН обозначают цифрой, которая соответствует номеру атома углерода, соединённому с группой ОН. Нумерацию основной цепи начинают с того конца, к которому ближе группа ОН.
Таким образом: название спирта (1) пропанол-1; название спирта (2) пропанол-2.
Поскольку спирты называют «по радикалам», эти спирты можно назвать и так: пропиловый спирт (1) и изопропиловый спирт (2).
Задание 22.1. Составьте молекулярные формулы этих спиртов и убедитесь, что это — изомеры.
Спирты изомерны простым эфирам, в молекулах которых атом кислорода соединяет два углеродных радикала (это изомерия между разными классами веществ):

Простые эфиры — это вещества, в молекулах которых два радикала соединены атомом кислорода. Поэтому их называют, исходя из названий радикалов. Например, простой эфир (3) — это диметиловый эфир.
Задание 22.2. Составьте графическую формулу изомера пропиловых спиртов, который является простым эфиром. Назовите его.

Строение молекул
Если при помощи графической формулы показать строение молекулы этилового спирта, то легко можно увидеть, что атомы водорода в ней неравноценны:
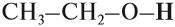
Действительно, пять атомов водорода соединены с атомами углерода, а один — с атомом кислорода. Теория Бутлерова утверждает, что «атомы в молекуле взаимно влияют друг на друга». Поэтому можно ожидать, что этот атом водорода будет отличаться от остальных пяти. Это отличие заключается в том, что связь О–Н гораздо более полярна, чем связи С–Н. Дело в том, что атом кислорода имеет бОльшую электроотрицательность, чем атом углерода, т. е. способен сильнее смещать к себе общую пару электронов. В результате, на атомах кислорода и водорода связи О–Н появляются значительные заряды (+) и (–).
Вопрос. На каком атоме появляется (+), а на каком (–)?
Величина этих зарядов меньше единицы, но они способны притягивать к себе молекулы других реагирующих веществ, т. е. активнее участвовать в химических реакциях будут наиболее полярные связи.
Вывод. Самыми полярными связями в молекуле спирта являются связи О–Н и О–С. За счёт их разрыва происходят химические реакции (спирт функционирует). Поэтому ОH — функциональная группа спиртов.

Свойства одноатомных спиртов
Физические свойства
Поскольку в молекуле спирта появились полярные связи, он, в отличие от углеводородов, будет иметь более высокие температуры кипения и плавления (если сравнивать соединения с одинаковым числом атомов углерода). Это связано с тем, что полярные молекулы сильнее притягиваются друг к другу, и для того чтобы оторвать их друг от друга (перевести жидкость в газ), нужно затратить много энергии — дополнительно нагреть. Кроме того, между молекулами спиртов возникают водородные связи (а), которые дополнительно притягивают молекулы друг к другу. Поэтому этиловый спирт — бесцветная жидкость (а этан и диметиловый эфир — газы!) с т. кип. 78 °C. Спирт хорошо растворим в воде, так как и с молекулами воды спирт образует водородные связи (б).
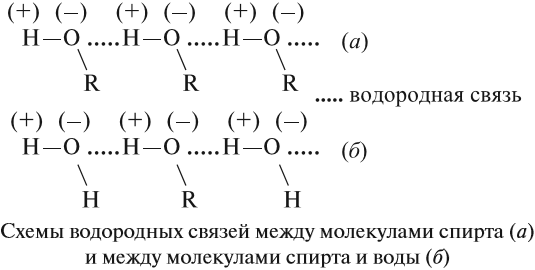
Водородные связи непрочные, поэтому низшие одноатомные спирты (мало атомов углерода в молекуле) — летучие жидкости с характерным запахом.
Химические свойства
Спирты могут реагировать с натрием и другими щелочными металлами. При этом атом водорода ОН-группы замещается на атом металла:
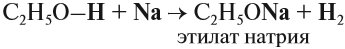
Вопрос. Неорганические вещества какого класса способны вступать в реакции замещения с металлами, в результате чего выделяется водород?
Аналогичную реакцию дают кислоты, поэтому в этой реакции спирт проявляет кислотные свойства. Но это очень слабые свойства, так как растворы спиртов не изменяют окраску индикаторов и не реагируют с растворами щелочей.
Спирты реагируют с неорганическими кислотами:
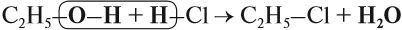
В этой реакции отщепляется молекула воды, — значит, это реакция дегидратации. При записи таких реакций формулы исходных веществ записывайте так, чтобы функциональные группы были рядом, причём атомы водорода функциональных групп ОН «смотрели» друг на друга. Так, в результате реакции дегидратации, в которой участвуют две молекулы спирта, образуется простой эфир (дегидратация межмолекулярная):
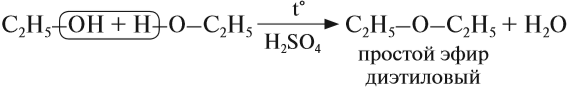
Эта реакция происходит в присутствии концентрированной серной кислоты. Если смесь спирта и концентрированной серной кислоты нагреть сильнее, то молекула воды отщепляется от одной молекулы спирта (дегидратация внутримолекулярная):
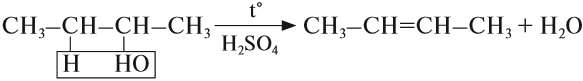
Спирты, у которых ОН-группа соединена с первым (последним) атомом углерода углеродной цепочки (первичные спирты) легко окисляются нагретым оксидом меди CuO, превращаясь в альдегиды:
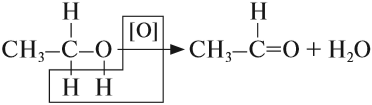
При составлении этой реакции рекомендуется выделить (подчеркнуть) те атомы, которые образуют воду, и записать новую формулу без этих атомов. Спирты горят, образуя, как и углеводороды, углекислый газ и воду.
Задание 22.3. Составьте уравнение реакции горения этилового спирта.
Таким образом, для спиртов характерны реакции:
- замещения атома водорода ОН-группы;
- дегидратации (отщепления воды);
- окисления.
Все эти реакции идут с участием ОН-группы функциональной группы спиртов.
Задание 22.4. Составьте уравнения таких реакций для пропанола-1 (пропилового спирта). Уравнения реакций составляйте по аналогии с вышеперечисленными.
Получение и применение спиртов (на примере этилового спирта)
Этанол и другие спирты можно получить из алкенов.
Вопрос. При помощи какой реакции можно это осуществить (при затруднении см. урок 19.3)?
Задание 22.5. Составьте уравнение этой реакции.
Полученный таким способом спирт используют в технических целях: в качестве растворителя, для получения каучука, пластмасс и др. Кроме того, спирт используют как горючее.
Пищевой и медицинский спирты получают брожением глюкозы:
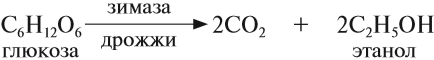
В лаборатории этиловый спирт можно получить гидролизом (взаимодействием с водой) хлорэтана:
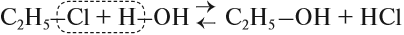
Для того чтобы эта реакция стала необратимой, используют водный раствор щёлочи.
Задание 22.6. Составьте уравнения реакций:
- пропен + вода;
- 1-хлорпропан + NaOH (водный).
Назовите полученные вещества.

Многоатомные спирты
Многоатомные спирты содержат две и более гидроксогруппы в молекуле. При этом каждый атом углерода в молекулах спиртов может соединяться только с одной гидроксогруппой ОН, в противном случае образуются неустойчивые соединения:
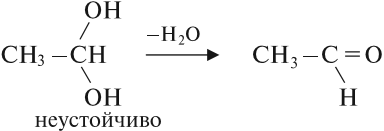
Задание 22.7. Составьте формулы многоатомных спиртов, в молекуле которых:
- два атома углерода и две гидроксогруппы;
- три атома углерода и три гидроксогруппы.
У вас получились формулы простейших многоатомных спиртов:

Вопрос. Как в названии спирта обозначить число гидроксогрупп?
Названия по IUPAC этих спиртов составляют, используя уже известные правила, т. е. к названию углеводорода добавляют суффикс ОЛ, а перед ним указывают число ОН-групп при помощи префиксов ди- или три-. Например, этиленгликоль получит название: этандиол.
Задание 22.8. Назовите по правилам IUPAC глицерин.
Вопрос. Как вы считаете, какой из спиртов будет иметь большую температуру кипения — глицерин или пропанол-1? А растворимость в воде?
Многоатомные спирты за счёт многочисленных ОН-групп образуют многочисленные водородные связи и друг с другом, и с водой. Поэтому они имеют бОльшие температуры кипения и бОльшую растворимость в воде по сравнению с соответствующими одноатомными спиртами. Так, глицерин — бесцветная, густая жидкость, без запаха; он смешивается с водой в любых соотношениях и способен поглощать влагу из воздуха. Более того, безводный глицерин может отнимать воду из живых клеток кожи, вызывая ожоги. Растворы глицерина, наоборот, смягчают кожу.
Химические свойства глицерина и других многоатомных спиртов очень похожи на свойства одноатомных спиртов: они реагируют с натрием и НСl, образуют эфиры, могут окисляться. Например, глицерин реагирует с азотной кислотой:
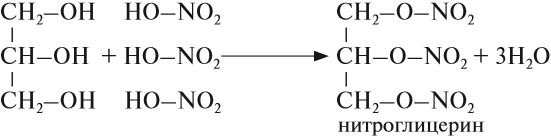
Нитроглицерин входит в состав сильнейшей взрывчатой смеси динамита. Его раствор используется как лекарство.
Но в химических свойствах многоатомных спиртов есть и существенные отличия. Так, они могут растворять осадок гидроксида меди II, образуя ярко-синий раствор:
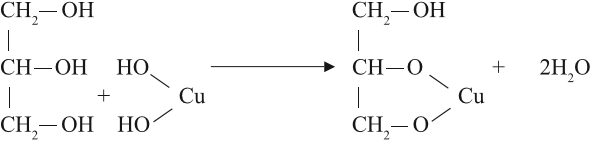
Реакция происходит при обычных условиях, причём полученное соединение очень прочное: не изменяет свой цвет даже при кипячении. Одноатомные спирты такую реакцию не дают.
Вывод. Реакция растворения голубого осадка гидроксида меди II с образованием ярко-синего раствора — это качественная реакция на многоатомные спирты.
Задание 22.9. Составьте уравнения реакций этиленгликоля:
- с азотной кислотой;
- с Сu(ОН)2.
Подсказка. При составлении уравнений этих реакций записывайте формулы многоатомных спиртов так, чтобы цепочки атомов углерода располагались вертикально, а группы ОН были рядом, причём атомы водорода функциональных групп ОН «смотрели» друг на друга.
Глицерин находит широкое применение в кожевенной промышленности (смягчает кожу), используется в медицине, входит в состав невысыхающих красок. Кроме того, глицерин, точнее, остаток его молекулы входит в состав любого жира. Поэтому глицерин часто получают из природных жиров (уравнение реакции в уроке 25).

Понятие о фенолах
К фенолам относятся вещества, в молекулах которых гидроксогруппа ОН непосредственно связана с бензольным кольцом:
В этой молекуле ОН-группа и бензольное кольцо взаимно влияют друг на друга. Поэтому фенол по свойствам отличается и от спиртов, и от бензола. Рассмотрим примеры такого влияния.
Бензольное кольцо влияет на ОН-группу, делая её более полярной, чем у спиртов. Поэтому фенол, в отличие от спиртов, реагирует с растворами щелочей:
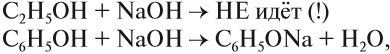
или
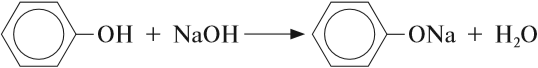
В данной реакции фенол проявляет свойства кислоты. Отсюда его второе название — карболовая кислота («карболка»). Растворы фенола изменяют окраску индикатора.
Гидроксогруппа влияет на бензольное кольцо. Фенол очень легко вступает в реакции замещения, причём, как и для толуола, реакция происходит в положениях 2, 4, 6 по отношению к гидроксогруппе:
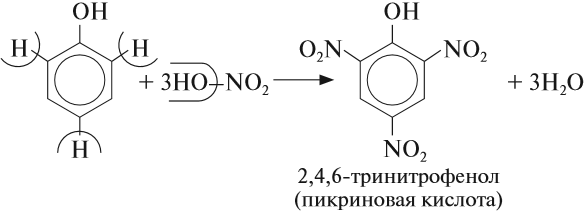
В отличие от спиртов и бензола фенол обесцвечивает бромную воду даже при нормальных условиях. Реакция протекает аналогично предыдущей.
Задание 22.9. Составьте уравнение реакции фенола с бромом и сравните эту реакцию с реакцией толуола с бромом.
Фенол легко окисляется на воздухе, при этом его белые кристаллы розовеют. Фенол сильно ядовит, так как изменяет структуру и свойства белков — основу всего живого. Кроме того, попадая в воду, он окисляется растворённым в ней кислородом. В результате содержание кислорода в водоёме уменьшается, и обитатели его погибают. Для того чтобы обнаружить фенол в водоёме и любом растворе, используют качественную реакцию с FeCl3: при добавлении этого реактива к смеси, содержащей фенол, появляется фиолетовое окрашивание.
Фенол получают из производных бензола и каменноугольной смолы. В любом случае вначале исходное вещество или смесь превращают в фенолят, а затем выделяют чистый фенол при помощи кислоты:

Фенол применяют для дезинфекции и получения красителей и полимеров.

Выводы
Спирты и фенолы — это производные углеводородов, содержащие функциональную группу ОН. Для таких веществ характерны реакции замещения атома водорода в гидроксогруппе.
Спирты за счёт функциональной группы ОН образуют простые и сложные эфиры (см. урок 25), а фенолы реагируют и за счёт функциональной группы ОН, и за счёт ароматического ядра.





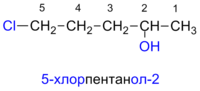
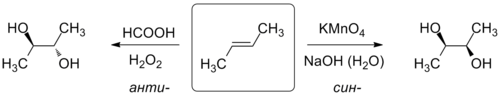
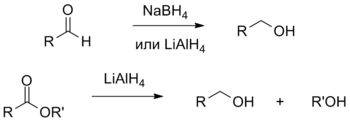
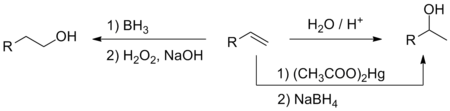
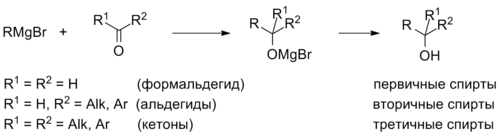
![{displaystyle {ce {CO{}+2H2->[{text{250 °C, 10 МПа}}][{text{кат.}}]CH3OH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ecfde5cecf66910d49f80549005be858413514ed)
![{displaystyle {ce {C2H4{}+H2SO4->[][{text{80 °C, 1,3—1,5 МПа}}]C2H5OSO3H{},(C2H5O)2SO2->[{ce {H2O}}]C2H5OH{}+H2SO4}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/15d5d101b5131f1ae1c1924f298f926b1e8e6f93)
![{displaystyle {ce {C2H4{}+H2O->[{ce {H2SO4/SiO2}}][{text{300 °C, 6—8 МПа}}]C2H5OH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e4b0cbcd380e857d957c5a680a0cfc67bdc2ed30)
![{displaystyle {ce {C2H4{}+CO{}+H2->[{ce {Rh}}~{text{кат.}}][{text{90—130°C, 2,8 МПа}}]CH3CH2CHO->[{ce {H2}},~{text{кат.}}][{text{110—150°C, 0,14—1,0 МПа}}]CH2CH2CH2OH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f690fc97f3e4df1bf90a486db34999cd0d0387a6)


![{displaystyle K_{text{a}}={frac {[{ce {RO-}}]cdot [{ce {H3O+}}]}{[{ce {ROH}}]}},}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fac70f186da28a50ea783a0cfb2a61e3a39a0d43)

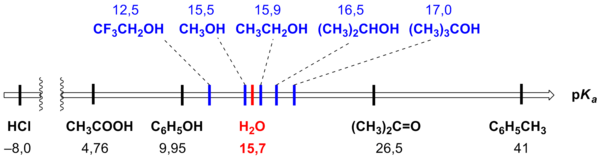



![{displaystyle K_{{text{a}}{ce {H+}}}={frac {[{ce {ROH}}]cdot [{ce {H+}}]}{[{ce {ROH2+}}]}},}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6cc6d8f9e60cbd9aec63306c1862e112bbb27dc3)

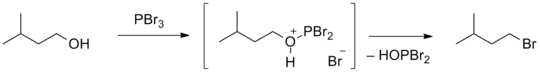
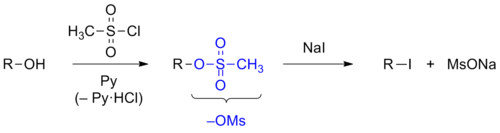


![{displaystyle {ce {R-OH ->[{ce {HCl}}][{ce {ZnCl2}}] R-Cl{}+ H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6802902c2d30c80b3542df1497df4aacb17baa3f)


![{displaystyle {ce {[Ce(NO3)6]^{2-}{}+ ROH -> [Ce(OR)(NO3)5]^{2-}{}+ HNO3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5fdd8c9ab10027985f8173ed8fd95179ff2cf8d0)
![{displaystyle {ce {R-OH->[{ce {(CH3CO)2O}}][{text{пиридин}}]R-OCOCH3{}+CH3COOH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8c91ea16f7f3ecb10b63d37e17bd3adac4c76319)
![{displaystyle {ce {R-OH ->[{ce {CH3MgI}}] R-OMgI{}+ CH4 ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a7e91d21ff92a2f3e50cc4006f5d7cbcbda9dd33)



