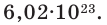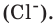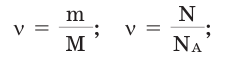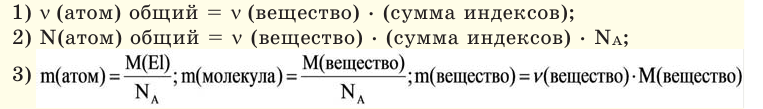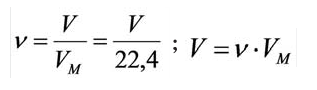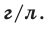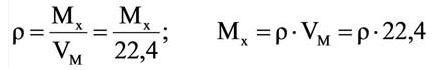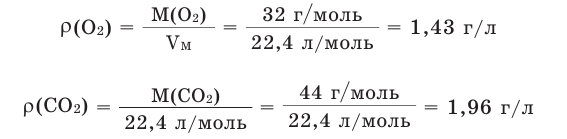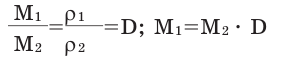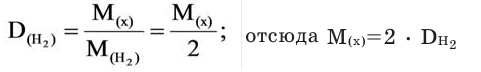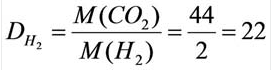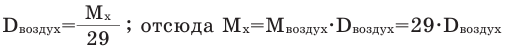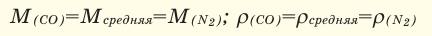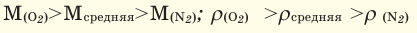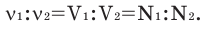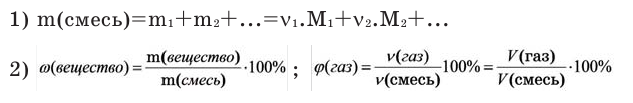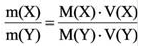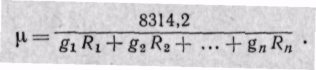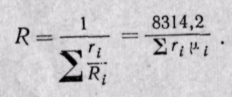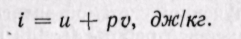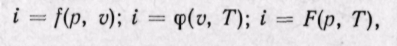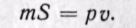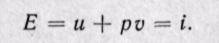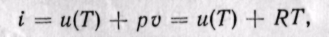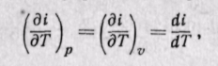Определение кажущейся молекулярной массы и параметров состояния смеси
В
теорию газовых смесей введено понятие
о средней
(кажущейся) молекулярной массе смеси
см,
т.е. о молекулярной массе такого
воображаемого однородного газа, который
по своим свойствам аналогичен
рассматриваемой смеси.
Находится
кажущаяся молекулярная масса следующим
образом. Из определения киломоля вытекает
равенство, справедливое для любого
однородного газа:
, (24)
где n
– количество вещества компонента, моль.
Для смеси по
аналогии можно записать:
. (25)
Отсюда, из равенства:
(26)
следует,
что:

где ;
;
…;– мольные доли компонентов смеси,моль.
Поскольку
то среднюю молекулярную массу можно
выразить:
. (28)
Если
известен массовый состав смеси, то
кажущуюся молекулярную массу смеси
вычисляют по уравнению:

Если
известен объемный состав смеси (объемная
доля компонентов), то плотность смеси
газов можно вычислить из соотношений:
. (30)
Если
газовая смесь задана массовыми долями,
то плотность смеси можно определить из
соотношения:

Удельный
объем смеси представляет величину,
обратную плотности смеси:
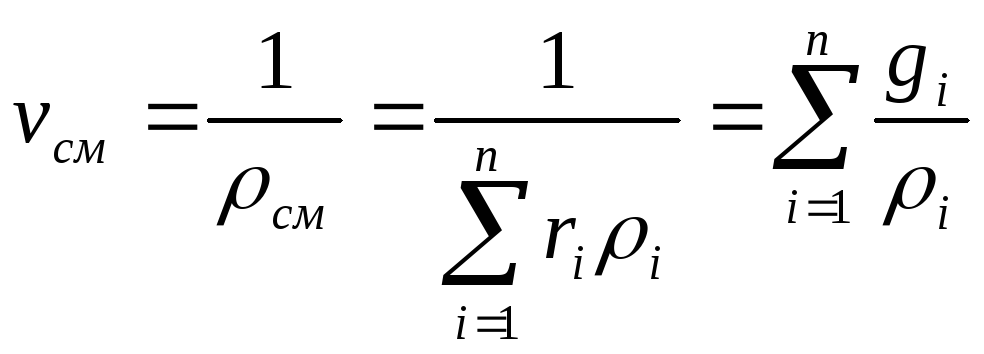
Объемные
доли компонентов смеси удобно использовать
для вычисления парциальных давлений
ее составных частей. Из уравнения:
, (33)
следует,
что:
, (34)
т.е.
для любого компонента смеси можно
записать:
. (35)
24 Теплоемкость
Теплоемкостью
называется количество теплоты, которое
необходимо подвести к какой-либо
количественной единице рабочего тела,
чтобы нагреть ее на
1 градус (1
°С или 1
К).
Истинная
теплоемкость
– производная количества теплоты по
температуре, она определяется в виде
отношения:
, (36)
откуда:

Теплоемкость
зависит от характера процесса, при
котором подводится или отводится
теплота, поэтому при экспериментальном
определении ее значения обычно используют
два термодинамических процесса,
протекающих при постоянном объеме
и давлении
.
Значения теплоемкостейи
для различных веществ сведены в таблицы.
Подведенная
при постоянном объеме теплота, когда
dl=0,
расходуется только на изменение
внутренней энергии. При постоянном
давлении некоторое количество теплоты
идет также на совершение работы, поэтому
для изменения температуры рабочего
тела на 1 градус при P
= const
требуется большее количество теплоты,
чем при v
= const
и, следовательно
.
В
зависимости от способа определения
количества рабочего тела (т.е. от
количественной единицы измерения
рабочего тела, которую необходимо
нагреть) теплоемкости делят на:
Все
они связаны м/у собой соотношениями:
; (38)
; (39)
. (40)
Теплоемкости
и
газа не зависят ни от объема, ни от
давления, и являются однозначными
функциями температуры. Иногда, в
приближенных расчетах, зависимостью
от температуры пренебрегают и значения
теплоемкости принимают постоянными.
Тогда в соответствии с выражением (37):
. (41)
В
большинстве случаев функцию С=f(Т)
(см. рисунок 3) приходится учитывать и
использовать для определения количества
подведенной или отведенной теплоты,
которая численно равна площади под
характеристикой 1-2 процесса. Количество
теплоты можно найти, если использовать
средние значения теплоемкости Сср,
при V = const
или Р = const
определяются отношением:
. (42)
Рисунок 3 –
Зависимость теплоемкости от температуры
В
этом случае площадь а34в, равна площади
а12в. С помощью Сср,
можно рассчитать количество теплоты
по формуле аналогичной выражению (42).
Если
необходимо получить количество
подведенной теплоты в интервале
температур T1
– T2
, то
поступают следующим образом: сначала
определяют количество теплоты
,
,
а затем:
. (43)
Для
многих теплотехнических расчетов
зависимость С=f(Т)
принимают линейной, тогда:
. (44)
В этом случае
, (45)
тогда:
. (46)
Если
рабочим телом является смесь газов, то
ее теплоемкость зависит от состава
смеси:

Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Команда “Газы!” была объявлена еще две недели назад. И что?! Легкие задачи порешали и расслабились?! Или вы думаете, что задачи на газы касаются только 28-х заданий ЕГЭ?! Как бы не так! Если газов пока еще не было в 34-х заданиях, это ничего не значит! Задач на электролиз тоже не было в ЕГЭ до 2018 года. А потом как врезали, мама не горюй! Обязательно прочитайте мою статью “Тайны задач по химии? Тяжело в учении – легко в бою!”. В этой статье очень подробно рассказывается о новых фишках на электролиз. Статья вызвала шквал самых разных эмоций у преподавателей химии. До сих пор мне и пишут, и звонят, и благодарят, и бьются в конвульсиях. Просто цирк с конями, в котором я – зритель в первом ряду.
Однако, вернемся к нашим баранам, вернее, Газам. Я прошла через огонь и воду вступительных экзаменов и знаю точно – хочешь завалить абитуриента, дай ему задачу на Газы. Почитайте на досуге сборник задач И.Ю. Белавина. Я процитирую одну такую “мозгобойню”, чтобы вам жизнь медом не казалась. Попробуйте решить.
И.Ю. Белавин, 2005, задача 229
“Два из трех газов (сероводород, водород и кислород) смешали и получили газовую смесь, плотность которой оказалась равной плотности оставшегося газа. Полученную газовую смесь вместе с равным ей объемом третьего газа под давлением поместили в замкнутый сосуд емкостью 4 л, содержавший азот при н.у. и нагревали при 600 С до окончания химических реакций, затем постепенно охладили. Определите массы веществ, содержавшихся в сосуде после охлаждения, если плотность газовой смеси в сосуде перед нагреванием равнялась 9,25г/л. (Ответ: m(S) = 7,5 г, m(SO2) = 15 г, m(Н2О) = 9 г)”
Ну как, решили? Нет?! А ваши репетиторы?! Извините, это был риторический вопрос. Кстати, мои ученики, абитуриенты 2003-2008 гг. такие задачи щелкали, как семечки, на экзаменах во 2-й медицинский (теперь РНИМУ им. Н.И. Пирогова). Надеюсь, вам понятно, что 34-м задачам ЕГЭ еще есть куда усложняться, perfectio interminatus est (нет предела совершенству), с газами нужно работать, работать и работать. Поэтому команду “Газы!” отменять рано. Итак, поехали!
Сегодня мы поговорим о газовых смесях, затронем понятие плотности газа (абсолютной и относительной), средней молярной массы, решим задачи: определение средней молярной массы и плотности газа по компонентам смеси и наоборот.
• Газовая смесь – смесь отдельных газов НЕ вступающих между собой в химические реакции. К смесям газов относятся: воздух (состоит из азота, кислорода, углекислого газа, водяного пара и др.), природный газ (смесь предельных и непредельных углеводородов, оксида углерода, водорода, сероводорода, азота, кислорода, углекислого газа и др.), дымовые газы (содержат азот, углекислый газ, пары воды, сернистый газ и др.) и др.
• Объемная доля – отношение объема данного газа к общему объему смеси, показывает, какую часть общего объема смеси занимает данный газ, измеряется в долях единицы или в процентах.
• Мольная доля – отношение количества вещества данного газа к общему количеству вещества смеси газов, измеряется в долях единицы или в процентах.
• Плотность газа (абсолютная) – определяется как отношение массы газа к его объему, единица измерения (г/л). Физический смысл абсолютной плотности газа – масса 1 л, поэтому молярный объем газа (22,4 л при н.у. t° = 0°C, P = 1 атм) имеет массу, численно равную молярной массе.
• Относительная плотность газа (плотность одного газа по другому) – это отношение молярной массы данного газа к молярной массе того газа, по которому она находится
• Средняя молярная масса газа – рассчитывается на основе молярных масс составляющих эту смесь газов и их объемных долей
Настоятельно рекомендую запомнить среднюю молярную массу воздуха Мср(в) = 29 г/моль, в заданиях ЕГЭ часто встречается.
Обязательно посетите страницу моего сайта “Изучаем Х-ОбХ-04. Закон Авогадро. Следствия из закона Авогадро. Нормальные условия. Молярный объем газа. Абсолютная и относительная плотность газа. Закон объемных отношений” и сделайте конспекты по теории. Затем возьмите бумагу и ручку и решайте задачи вместе со мной.
ВАНГУЮ: чует мое сердце, что ЕГЭ по химии 2019 года устроит нам газовую атаку, а противогазы не выдаст!
Задача 1
Определить плотность по азоту газовой смеси, состоящей из 30% кислорода, 20% азота и 50% углекислого газа.
Задача 2
Вычислите плотность по водороду газовой смеси, содержащей 0,4 моль СО2, 0,2 моль азота и 1,4 моль кислорода.
Задача 3
5 л смеси азота и водорода имеют относительную плотность по водороду 12. Определить объем каждого газа в смеси.
Несколько задач со страницы моего сайта
Задача 4
Плотность по водороду пропан-бутановой смеси равна 23,5. Определите объемные доли пропана и бутана
Задача 5
Газообразный алкан объемом 8 л (н.у.) имеет массу 14,28 г. Чему равна его плотность по воздуху
Задача 6
Плотность паров альдегида по метану равна 2,75. Определите альдегид
Ну как? Пошло дело? Если туго, вернитесь к задачам и решайте их самостоятельно до тех пор, пока не щелкнет! А для стимуляции – десерт в виде еще одной задачи И.Ю. Белавина на газы. Наслаждайтесь ее решением самостоятельно!
И.Ю. Белавин, 2005, задача 202
“Сосуд емкостью 5,6 л при н.у. заполнили метаном, затем нагрели до высокой температуры, в результате чего произошло частичное разложение метана. Определите массу образовавшейся сажи, если известно, что после приведения к нормальным условиям объем полученной газовой смеси оказался в 1,6 раза больше объема исходного метана, эта газовая смесь обесцвечивает бромную воду и имеет плотность по воздуху 0,2931. (Ответ: m(C) = 0,6 г)”
Задачи И.Ю. Белавина – это крутой драйв! Попробуйте порешать, и вы откажетесь от просмотра любых ужастиков, поскольку запасетесь адреналином надолго! Но нам нужно спуститься на землю к ЕГЭ, простому и надежному, как первый советский трактор. Кстати, у меня в коллекции припасено немало сюрпризов с газовыми фишками, собранными за все годы работы и бережно хранимыми. Думаю, пришло время сказать им: “И снова здравствуйте!”, поскольку ЕГЭ с каждым годом становится “все чудесатее и чудесатее”. Но это уже совсем другая история. Читайте мои статьи – и вы подстелите соломку под свою ЕГЭшную попу.
Вы готовитесь к ЕГЭ и хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии http://repetitor-him.ru. Здесь вы найдете огромное количество задач, заданий и теоретического материала, познакомитесь с моими учениками, многие из которых уже давно работают врачами. Позвоните мне +7(903)186-74-55, приходите ко мне на курс, на бесплатные Мастер-классы “Решение задач по химии”. Я с удовольствием вам помогу.
Репетитор по химии и биологии кбн В.Богунова
Средняя молекулярная масса – смесь
Cтраница 1
Средняя молекулярная масса смеси равна сумме произведении молекулярной массы каждого компонента на его долю в смеси.
[1]
Средняя молекулярная масса смеси газов выражается через массо вую концентрацию и относительную молекулярную массу компонентов.
[2]
Средняя молекулярная масса смеси газов равна сумме произведений объемных долей на молекулярные массы отдельных газов, составляющих смесь.
[3]
Средняя молекулярная масса смеси газов выражается через массовую концентрацию и относительную молекулярную массу компонентов.
[4]
Среднюю молекулярную массу смеси можно определить, если известны массовые или объемные доли смеси.
[5]
Среднюю молекулярную массу смеси полимерных молекул, которая отвечает некоторой точке реакционной массы, находят делением. Таким образом, решая систему уравнений, описывающих изменение концентраций концевых групп и связей во времени и в пространстве, теоретически находят увеличение параметра Z в зависимости от смещения реакции вправо и от сдвига химического равновесия за счет диффузии небольших молекул продукта А к открытой поверхности полимеризующейся среды. Наоборот, аналогичным образом можно найти постепенное уменьшение молекулярной массы полимерной смеси, поверхность которой доступна для молекул А.
[6]
Знание средней молекулярной массы смеси дает возможность все расчеты газовых смесей производить так, как будто вместо смеси имеется один однородный газ, что, естественно, упрощает эти расчеты.
[7]
Определяем среднюю молекулярную массу смеси без метана.
[8]
Определим среднюю молекулярную массу смеси газов.
[9]
Как определяется средняя молекулярная масса смеси газов.
[10]
Расчетные соотношения средней молекулярной массы смеси (2.9) используются при определении характеристической постоянной смеси идеальных газов.
[11]
Так определяют среднюю молекулярную массу смеси, если известны молекулярная масса и мольные концентрации компонентов. Если известны массовые концентрации компонентов, среднюю молекулярную массу смеси выражают по-другому.
[12]
Так определяют среднюю молекулярную массу смеси, если известны молекулярная масса и мольные концентрации компонентов.
[13]
Формулы для определения средней молекулярной массы смеси и парциального давления смеси по массовому составу здесь не приводятся ввиду того, что в теплотехнических расчетах ими не пользуются.
[14]
По каким формулам определяется средняя молекулярная масса смеси при задании ее массовым или.
[15]
Страницы:
1
2
3
4
Содержание:
Количество вещества:
В чём разница между понятиями «масса» и «количество»
Если мы будем производить подобные расчеты, соответствующие этому заданию, для простых веществ, образованных различными элементами, то всякий раз получим одно и то же число —
Например, в 1 моле водородного газа содержится 

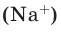

Количество частиц, содержащихся в 1 моле химических веществ ( 
Количество вещества можно вычислить по следующей формуле:
Здесь 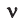
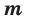
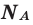
Молярная масса
Молярной массой называют массу 1 моля вещества, выраженного в граммах. Молярная масса обозначается
буквой М, единицей измерения является г/моль.
При выражении молярной массы вещества в граммах, она численно бывает равна его относительной молекулярной массе (если состоит из молекул). Для сравнения запишем (таблица 1):
Как видно из сравнений, молярная масса веществ по своей единице отличается от относительной молекулярной массы. То есть молярная масса – измеряемая величина.
Как видно из вышесказанного, понятие молярная масса применяется как к химическим элементам, так и к простым и сложным веществам с молекулярным и немолекулярным строением.
На основе количества вещества (моль) можно производить следующие вычисления. Если известно мольное количество вещества:
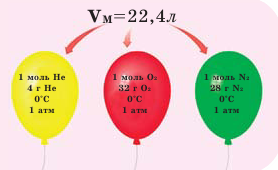
Закон Авогадро и молярный объём газов
Обратите внимание на рисунки. Почему, несмотря на разные массы газов, они занимают одинаковый объём?
В начале XIX века итальянский ученый Авогадро, проведя наблюдения над свойствами газов в различных условиях и проанализировав открытые прежде законы о газах (Бойля-Мариотта, Гей-Люссака и др.) в 1811 году сформулировал новый закон о газах. Закон Авогадро звучит следующим образом: в равных объемах различных газов при одинаковых условиях (одинаковых температуре и давлении) содержится одинаковое число молекул.
Итальянский ученый. В 1811 году им был открыт закон о газах, который впоследствии был назван его именем.
Мы уже знаем, что 1 моль любого вещества содержит 
Было вычислено, что при нормальных условиях объем 1 моля любого газа или смеси газов составляет примерно 22,4 л. Объем 1 моля газа при нормальных условиях (н.у.) называют молярным объемом данного газа, выраженным знаком 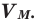
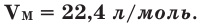
Здесь 
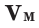
На основе закона Авогадро и молярного объёма газов можно вычислить плотность газов при нормальных условиях и относительную плотность одного газа по отношению к другому газу. Плотность обозначается буквой 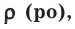
измерения –
Нормальные условия означают: температура 0°С, 1 атм давления 1атм — 101,3 кПа
Для вычисления плотности какого-либо газа X в нормальных условиях (н.у.), следует его молярную массу разделить на молярный объем:
Например, вычислим плотности кислорода и углекислого газа при нормальных условиях:
Плотность твёрдых и жидких веществ при н.у. вычисляется по формуле 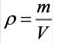
Для того, чтобы определить, масса какого из газов с одинаковыми объемами и при одинаковых условиях бывает тяжелее, пользуются понятием относительной плотности. Отношение плотностей различных газов при одинаковых условиях равно отношению их молярных масс. Относительная плотность обозначается буквой D и не имеет единицы измерения. Формула относительной плотности следующая:
Относительную плотность газов в большинстве случаев вычисляют по самому легкому газу – водороду и воздуху:
В таком случае, относительная плотность углекислого газа по водороду вычисляется следующим образом:
Так как средняя молярная масса воздуха, состоящего из смеси газов, примерно равна 29 г/моль, то формула его относительной плотности следующая:
Способы вычисления средней молярной массы газовой смеси
Здесь: 
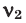
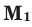
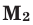

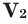
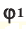
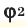
Среднюю молярную массу 1 моля смеси из двух различных газов можно вычислить по следующей формуле: 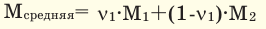
При смешивании газов с одинаковыми молярными массами, которые при одинаковом давлении не вступают друг с другом в реакцию, плотность газовой смеси (при н.у.), а также их средняя молярная масса остаются неизменными. Например, при смешивании 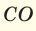
При смешивании газов с различными молярными массами, при одинаковом давлении, средняя молярная масса (при н.у.) и плотность полученной газовой смеси приобретают значение между молярными массами и плотностями смешиваемых газов. Например, при смешивании 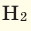
При добавлении газа с большей молярной массой в тот или иной газ при постоянном давлении плотность газовой смеси увеличивается, а при добавлении газа с меньшей молярной массой — уменьшается.
Закон объемных отношений
В химических реакциях соотношение объемов, вступающих в реакцию, и полученных газов равно соотношению их коэффициентов. Например:
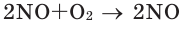
Численное соотношение объемов, молей и молекул газов равно друг другу.
Можно производить следующие вычисления по смесям:
3) Массовое соотношение двух газов:
- Физические и химические явления
- Растворы в химии
- Периодический закон Д. И. Менделеева
- Химические связи
- Состав и строение веществ в химии
- Простые и сложные вещества в химии
- Химическая формула
- Относительная атомная и относительная молекулярная масса
2.1. Основные понятия и формулы
Количество вещества — число структурных элементов (молекул, атомов, ионов и т. п.), содержащихся в теле или системе. Количество вещества выражается в молях. Моль равен количеству вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в 0,012 кг изотопа углерода 12 C. Количество вещества тела (системы)
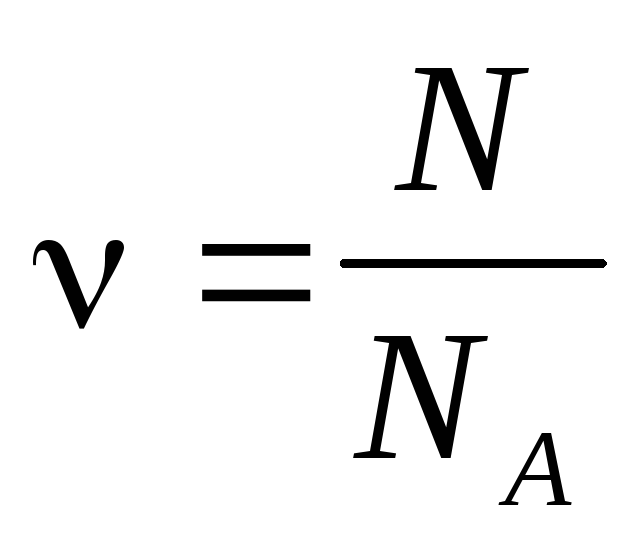
где N — число структурных элементов (молекул, атомов, ионов и т.п.), составляющих тело (систему). Постоянная Авогадро NА=6,0210 23 моль -1 .
Молярная масса вещества ,
где m—масса однородного тела (системы); —количество вещества (число молей) этого тела (системы). Выражается в единицах г/моль (или кг/моль).
Единица массы, равная 1/12 массы атома углерода 12 C, называется атомной единицей массы (а.е.м.). Массы атомов или молекул выраженные в атомных единицах массы называют соответственно относительной атомной или относительной молекулярной массой вещества. Относительная молекулярная масса вещества состоит из относительных атомных масс химических элементов, составляющих молекулу вещества. Относительные атомные массы химических элементов приводятся в таблице Д. И. Менделеева (см. также таблицу 8 приложения данного пособия).
Молярная масса вещества численно равна относительной атомной или молекулярной массе данного вещества, если размерность а.е.м. заменить на размерность г/моль.
Количество вещества смеси n газов
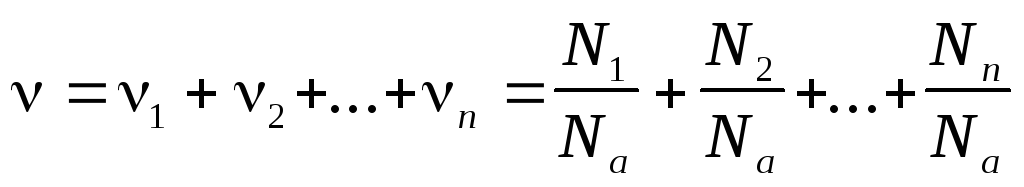
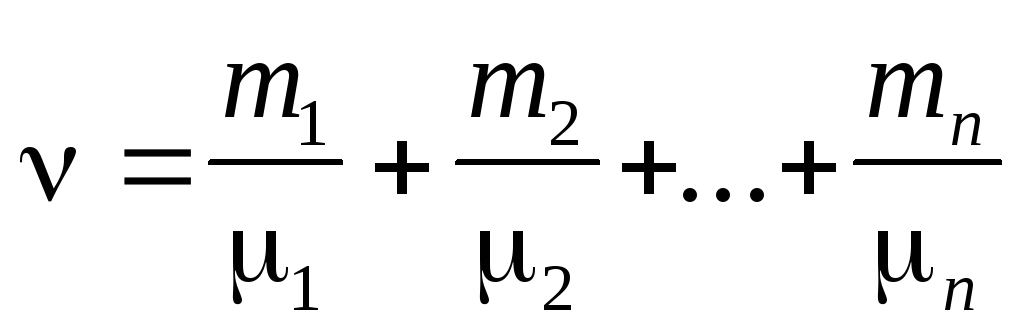
Уравнение Менделеева — Клапейрона (уравнение состояния идеального газа)

где т — масса газа, — молярная масса газа, R — универсальная газовая постоянная, ν — количество вещества, Т — термодинамическая температура.
Опытные газовые законы, являющиеся частными случаями уравнения Менделеева — Клапейрона для изопроцессов:
а) закон Бойля—Мариотта (изотермический процесс: T=const, m=const)
или для двух состояний газа, обозначенных цифрами 1 и 2,
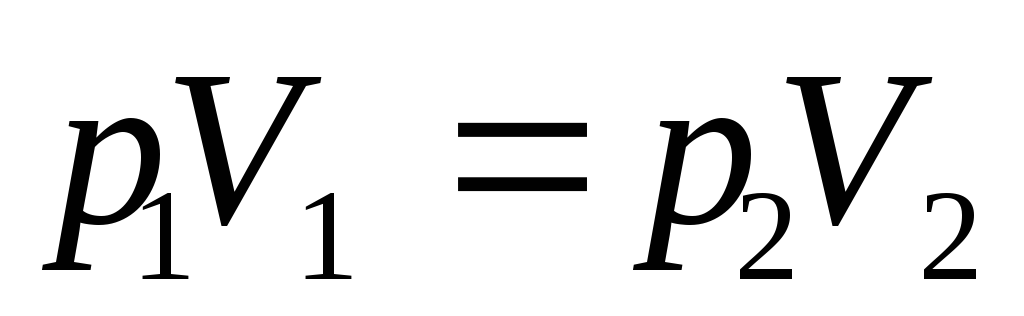
б) закон Гей-Люссака (изобарический процесс: р=const, m=const)
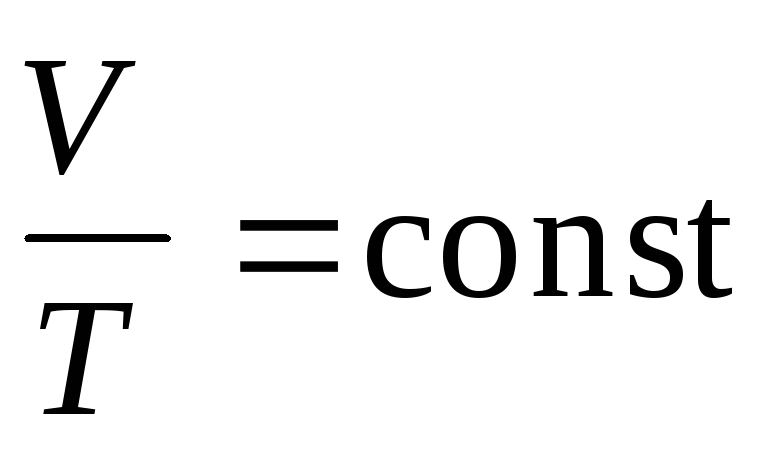
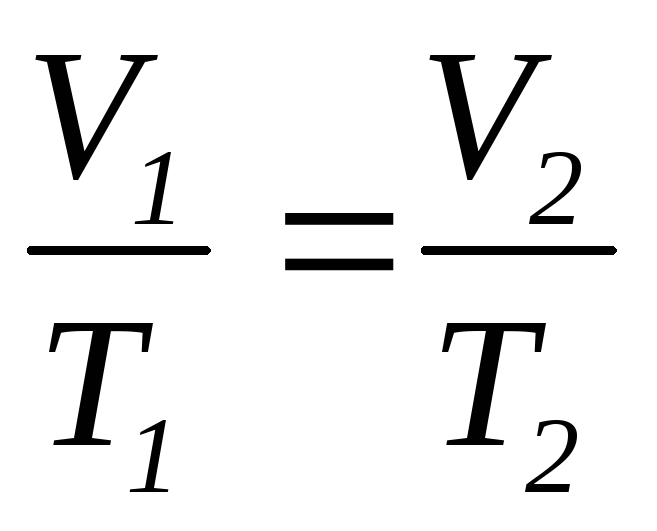
в) закон Шарля (изохорический процесс: V=const, m=const)
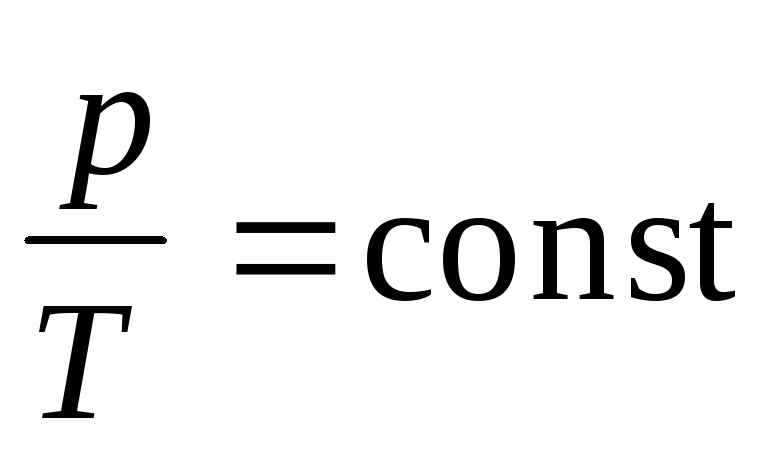
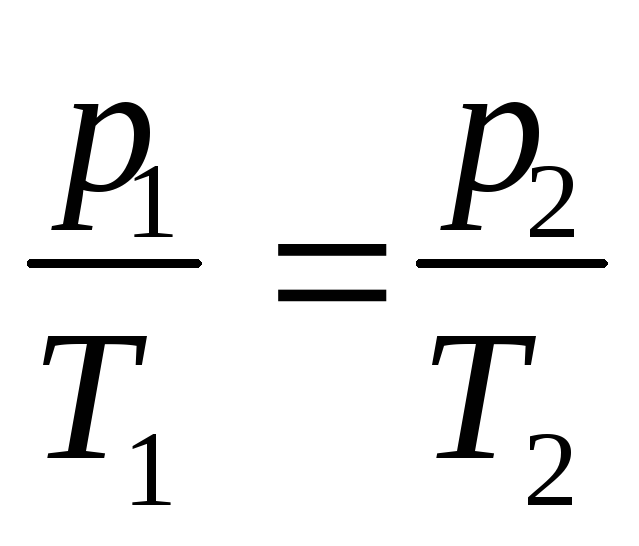
г) объединенный газовый закон (m=const)

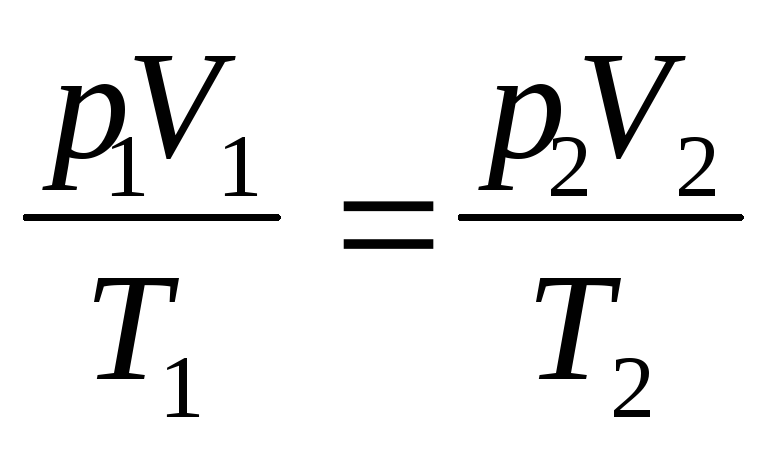
Под нормальными условиями понимают давление po=1 атм (1,01310 5 Па), температуру 0 о С (T=273 K).
Закон Дальтона, определяющий давление смеси n газов.
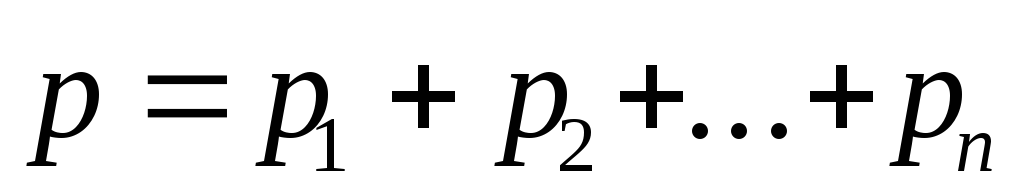
где pi — парциальные давления компонентов смеси (i=1,2,…,n). Парциальным давлением называется давление газа, которое производил бы этот газ, если бы только он один находился в сосуде, занятом смесью.
Молярная масса смеси n газов
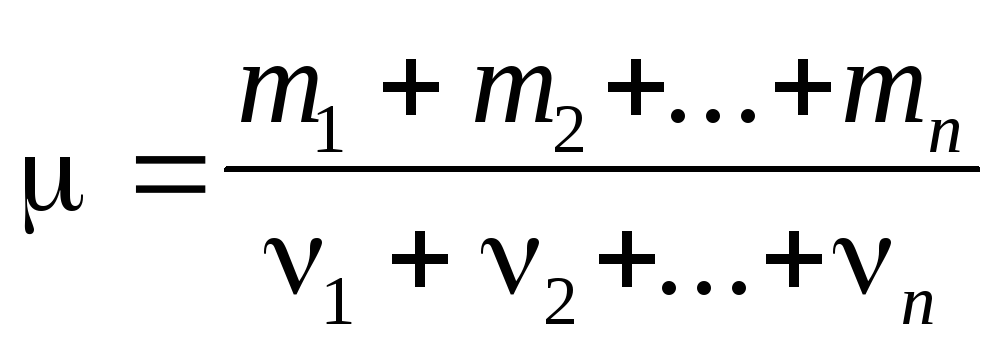
Массовая доля i-го компонента смеси газа (в долях единицы или процентах)
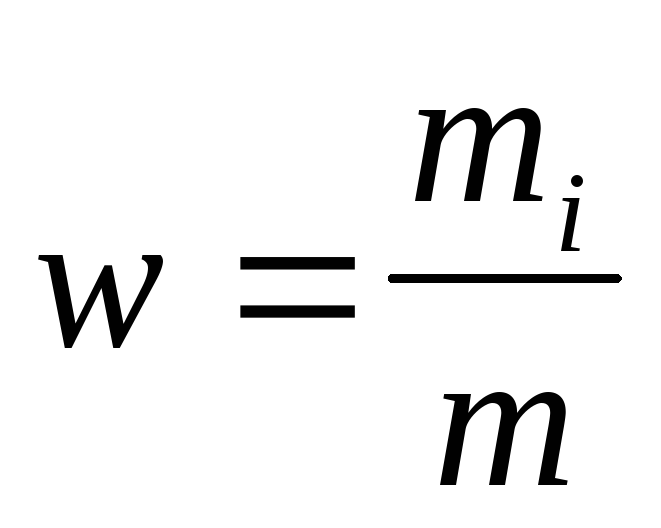
Концентрация молекул
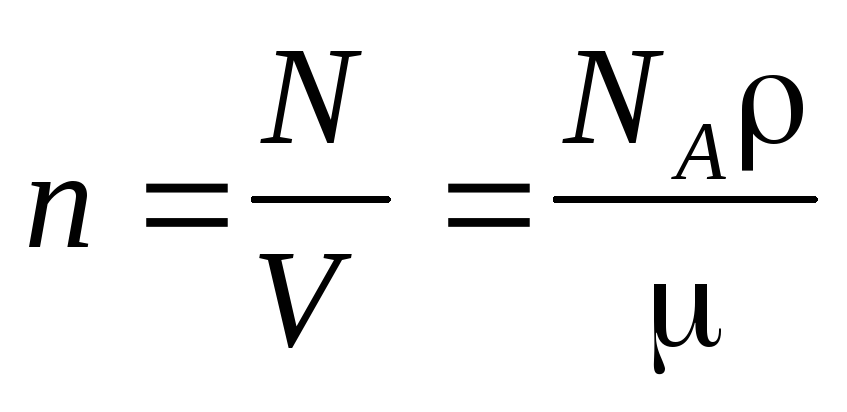
где N — число молекул, содержащихся в данной системе; — плотность вещества в системе; V — объем системы. Формула справедлива не только для газов, но и для любого агрегатного состояния вещества.
Уравнение Ван-дер-Ваальса для реального газа
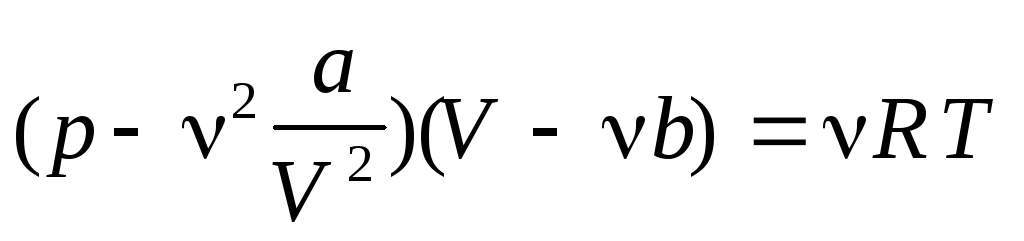
где a и b — коэффициенты Ван-дер-Ваальса
Для идеального газа уравнение Ван-дер-Ваальса переходит в уравнение Менделеева — Клапейрона.
Основное уравнение молекулярно — кинетической теории газов
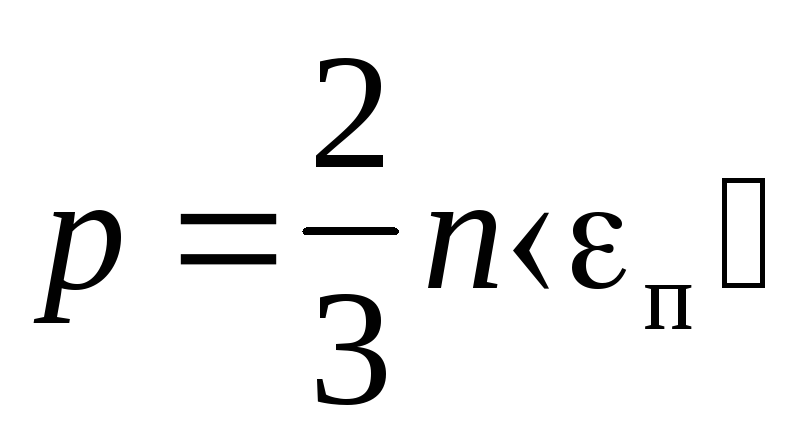
где п — средняя кинетическая энергия поступательного движения молекулы.
Средняя молекулярная масса представляет собой условную величину и относится к такому однородному газу, у которого число молекул и общая масса равны числу молекул и массе смеси газов.
Если известна величина газовой постоянной смеси, то
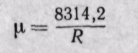
Заменяя газовые постоянные R1, R2, . Rn их значениями из уравнения Клапейрона, получаем выражение для средней молекулярной массы, если смесь задана массовыми долями:
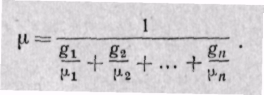
Если смесь задана объемными долями, то, как следует из уравнения (3-6),
Поскольку 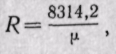
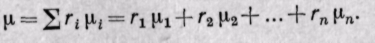
Средняя молекулярная масса смеси газов равна сумме произведений объемных долей на молекулярные массы отдельных газов, составляющих смесь.
Парциальные давления
Парциальное давление газа может быть определено через массовые доли из уравнения Клапейрона, если известны основные параметры газа:
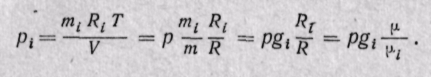
Для нахождения парциального давления каждого газа при задании смеси объемными долями можно воспользоваться законом Бойля — Мариотта, из которого следует, что при постоянной температуре
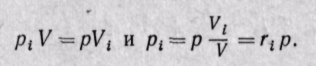
Парциальное давление каждого газа равно произведению общего давления смеси газов на его объемную долю.
Уравнением (3-11) обычно пользуются при технических расчетах и при испытаниях тепловых установок. Объемные доли газов определяют специальными аппаратами — газоанализаторами.
Удельная энтальпия, т. е. энтальпия, отнесенная к 1 кг, обозначается буквой i и представляет собой по определению сложную функцию вида
Дифференциал энтальпии di есть элементарное количество теплоты, участвующее в процессе при постоянном давлении. Вся теплота в процессе при постоянном давлении расходуется на изменение энтальпии:
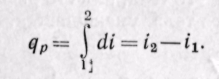
Из уравнения (5-12) следует, что
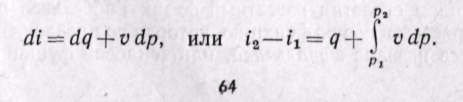
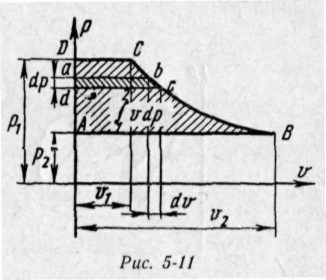
Энтальпия больше внешней теплоты на величину работы vdp, которая на рv-диаграмме изображается элементарной площадкой abed (рис. 5-11). Очевидно, вся пл. ABCD определяется выражением
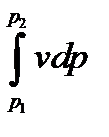
Изменение энтальпии полностью определяется начальным и конечным состоянием рабочего тела и не зависит от промежуточных состояний. Изменение энтальпии газа в циклах равно нулю, т. е.
Поскольку энтальпия является функцией основных параметров состояния, то di есть полный дифференциал этой функции при любых независимых переменных, характеризующих состояние 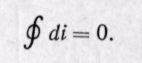
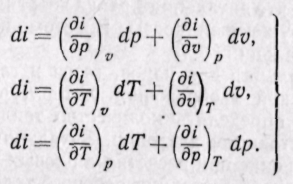
Изменение энтальпии во всех процессах, протекающих между двумя точками А и В, будет одинаковым (рис. 5-12).
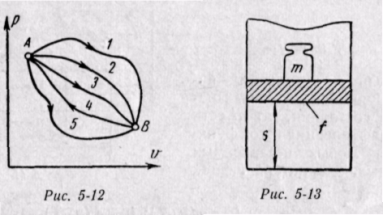
Физический смысл энтальпии будет понятен из рассмотрения следующего примера. На перемещающийся поршень в цилиндре с 1 кг газа помещена гиря массой т кг (рис. 5-13). Площадь поршня /; внутренняя энергия рабочего тела и. Потенциальная энергия гири равна произведению массы гири т на высоту S. Так как давление газа р уравновешивается массой гири, то потенциальную энергию ее можно 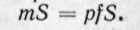
Произведение /S есть удельный объем газа. Отсюда
Произведение давления на объем есть работа, которую надо затратить, чтобы ввести газ объемом v во внешнюю среду с давлением р. Таким образом, работа pv есть потенциальная энергия газа, зависящая от сил, действующих на поршень. Чем больше эти внешние силы, тем больше давление р и тем больше потенциальная энергия давления pv.
Если рассматривать газ, находящийся в цилиндре и поршень с грузом как одну систему, которую будем называть расширенной системой, то полная энергия Е этой системы складывается из внутренней энергии газа и и потенциальной энергии поршня с грузом, равной pv:
Значения энтальпий для паров, газов и газовых смесей приводятся в технической и справочной литературе. Пользуясь этими данными, можно определять количество теплоты, участвующее в процессе при постоянном давлении. Энтальпия получила большое значение и применение при расчетах тепловых и холодильных установок и, как параметр состояния рабочего тела, значительно упрощает тепловые расчеты. Она позволяет [применять графические методы при исследовании всевозможных термодинамических процессов и циклов.
Энтальпией особенно целесообразно пользоваться тогда, когда в качестве основных параметров принимают р и Т. Это наглядно можно видеть, если энтальпию i сравнить с внутренней энергией и. При v = const уравнение первого закона термодинамики dq = = du + pdv превращается в dqv = du, или qv — u2—u1 а при р = const qp = i3 — i1.
Энтальпия идеального газа,’ так же как и внутренняя энергия, является функцией температуры и не зависит от других параметров. Действительно, для идеального газа
следовательно (поскольку оба слагаемых зависят только от температуры), i = f(T).
Тогда по аналогии с внутренней энергией будем иметь
т. е. в любом процессе изменения состояния идеального газа производная от изменения энтальпии по температуре будет полной производной.
Численные значения энтальпий идеальных газов приведены в приложении, табл. XIII.
Дата добавления: 2018-02-15 ; просмотров: 1423 ; ЗАКАЗАТЬ РАБОТУ
Электронное учебное пособие
Москва 2013
2. Ocновные понятия и законы химии. Атомно-молекулярное учение
2.10. Примеры решения задач
2.10.1. Расчет относительных и абсолютных масс атомов и молекул
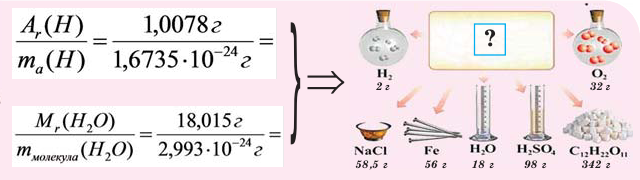
Относительные массы атомов и молекул определяются с использованием приведенных в таблице Д.И. Менделеева величин атомных масс. При этом, при проведении расчетов для учебных целей значения атомных масс элементов обычно округляются до целых чисел (за исключением хлора, атомная масса которого принимается равной 35,5).
Пример 1. Относительная атомная масса кальция Аr(Са)=40; относительная атомная масса платины Аr(Pt)=195.
Относительная масса молекулы рассчитывается как сумма относительных атомных масс составляющих данную молекулу атомов с учетом количества их вещества.
Пример 2. Относительная молярная масса серной кислоты:
Величины абсолютных масс атомов и молекул находятся делением массы 1 моль вещества на число Авогадро.
Пример 3. Определите массу одного атома кальция.
Решение. Атомная масса кальция составляет Аr(Са)=40 г/моль. Масса одного атома кальция окажется равной:
m(Ca)= Аr(Ca) : NA =40 : 6,02·10 23 = 6,64·10 -23 г.
Пример 4. Определите массу одной молекулы серной кислоты.
Решение. Молярная масса серной кислоты равна Мr(H2SO4) = 98. Масса одной молекулы m(H2SO4) равна:
2.10.2. Расчет количества вещества и вычисление числа атомных и молекулярных частиц по известным значениям массы и объема
Количество вещества определяется путем деления его массы, выраженной в граммах, на его атомную (молярную) массу. Количество вещества, находящегося в газообразном состоянии при н.у., находится делением его объема на объем 1 моль газа (22,4 л).
Пример 5. Определите количество вещества натрия n(Na), находящегося в 57,5 г металлического натрия.
Решение. Относительная атомная масса натрия равна Аr(Na)=23. Количество вещества находим делением массы металлического натрия на его атомную массу:
Пример 6 . Определите количество вещества азота, если его объем при н.у. составляет 5,6 л.
Решение. Количество вещества азота n(N 2) находим делением его объема на объем 1 моль газа (22,4 л):
Число атомов и молекул в веществе определяется умножением количества вещества атомов и молекул на число Авогадро.
Пример 7. Определите число молекул, содержащихся в 1 кг воды.
Решение. Количество вещества воды находим делением ее массы (1000 г) на молярную массу (18 г/моль):
Число молекул в 1000 г воды составит:
N(Н2О) = 55,5·6,02·10 23 = 3,34·10 24 .
Пример 8. Определите число атомов, содержащихся в 1 л (н.у.) кислорода.
Решение. Количество вещества кислорода, объем которого при нормальных условиях составляет 1 л равно:
n(О2) = 1 : 22,4 = 4,46·10 -2 моль.
Число молекул кислорода в 1 л (н.у.) составит:
N(О2) = 4,46·10 -2 · 6,02·10 23 = 2,69·10 22 .
Следует отметить, что 26,9·10 22 молекул будет содержаться в 1 л любого газа при н.у. Поскольку молекула кислорода двухатомна, число атомов кислорода в 1 л будет в 2 раза больше, т.е. 5,38·10 22 .
2.10.3. Расчет средней молярной массы газовой смеси и объемной доли
содержащихся в ней газов
Средняя молярная масса газовой смеси рассчитывается на основе молярных масс составляющих эту смесь газов и их объемных долей.
Пример 9. Полагая, что содержание (в объемных процентах) азота, кислорода и аргона в воздухе соответственно составляет 78, 21 и 1, рассчитайте среднюю молярную массу воздуха.
Решение.
Мвозд = 0,78·Мr(N2)+0,21·Мr (O2)+0,01·Мr(Ar)= 0,78·28+0,21·32+0,01·40 = 21,84+6,72+0,40=28,96
или приблизительно 29 г/моль.
Пример 10. Газовая смесь содержит 12 л NH3, 5 л N2 и 3 л Н2, измеренных при н.у. Рассчитать объемные доли газов в этой смеси и ее среднюю молярную массу.
Решение. Общий объем смеси газов равен V=12+5+3=20 л. Объемные доли j газов окажутся равными:
Средняя молярная масса рассчитывается на основе объемных долей составляющих эту смесь газов и их молекулярных масс:
М=0,6·М(NH3)+0,25·M(N2)+0,15·M(H2) = 0,6·17+0,25·28+0,15·2 = 17,5.
2.10.4. Расчет массовой доли химического элемента в химическом соединении
Массовая доля ω химического элемента определяется как отношение массы атома данного элемента Х, содержащегося в данной массе вещества к массе этого вещества m. Массовая доля – безразмерная величина. Ее выражают в долях от единицы:
ω(X) = m(X)/m (0 Пример 11. Рассчитайте массовую долю марганца в оксиде марганца (VII).
Решение. Молярные массы веществ равны: М(Mn) = 55 г/моль, М(О) = 16 г/моль, M(Mn2O7)=2М(Mn)+7М(О)= 222 г/моль. Следовательно, масса Mn2O7 количеством вещества 1 моль составляет:
Из формулы Mn2O7следует, что количество вещества атомов марганца в два раза больше количества вещества оксида марганца (VII). Значит,
m(Mn)= n(Mn)·M(Mn) = 2·55 = 110 г.
Таким образом, массовая доля марганца в оксиде марганца(VII) равна:
2.10.5. Установление формулы химического соединения по его элементному составу
Простейшая химическая формула вещества определяется на основании известных величин массовых долей входящих в состав этого вещества элементов.
Допустим имеется образец вещества NaxPyOz массой mo г. Рассмотрим как определяется его химическая формула, если известны количества вещества атомов элементов, их массы или массовые доли в известной массе вещества. Формула вещества определяется отношением:
x : y : z = N(Na) : N(P) : N(O).
Это отношение не изменится, если каждый его член разделить на число Авогадро:
Таким образом, для нахождения формулы вещества необходимо знать соотношение между количествами веществ атомов в одной и той же массе вещества:
Если разделить каждый член последнего уравнения на массу образца mo, то получим выражение, позволяющее определить состав вещества:
Пример 12. Вещество содержит 85,71 масс. % углерода и 14,29 масс. % водорода. Молярная его масса равна 28 г/моль. Определите простейшую и истинную химические формулы этого вещества.
Решение. Соотношение между количеством атомов в молекуле СхНу определяется делением массовых долей каждого элемента на его атомную массу:
х : у = 85,71/12 : 14,29/1 = 7,14:14,29 = 1 : 2.
Таким образом простейшая формула вещества — СН2. Простейшая формула вещества не всегда совпадает с его истинной формулой. В данном случае формула СН2 не соответствует валентности атома водорода. Для нахождения истинной химической формулы необходимо знать молярную массу данного вещества. В данном примере молярная масса вещества равна 28 г/моль. Разделив 28 на 14 (сумму атомных масс, отвечающих формульной единице СН2), получаем истинное соотношение между числом атомов в молекуле:
Получаем истинную формулу вещества: С2Н4— этилен.
Вместо молярной массы для газообразных веществ и паров в условии задачи может быть указана плотность по какому-либо газу или по воздуху.
В рассматриваемом случае плотность газа по воздуху составляет 0,9655. На основании этой величины может быть найдена молярная масса газа:
М = Мвозд·Dвозд = 29·0,9655 = 28.
В этом выражении М – молярная масса газа СхНу, Мвозд – средняя молярная масса воздуха, Dвозд — плотность газа СхНу по воздуху. Полученная величина молярной массы используется для определения истинной формулы вещества.
В условии задачи может не указываться массовая доля одного из элементов. Она находится вычитанием из единицы (100%) массовых долей всех остальных элементов.
Пример 13. Органическое соединение содержит 38,71 масс. % углерода, 51,61 масс. % кислорода и 9,68 масс. % водорода. Определить истинную формулу этого вещества, если плотность его паров по кислороду составляет 1,9375.
Решение. Рассчитываем соотношение между количеством атомов в молекуле СхНyОz:
х : у : z = 38,71/12 : 9,68/1 : 51,61/16 = 3,226 : 9,68 : 3,226= 1:3:1.
Молярная масса М вещества равна:
М = М(O2)·D(O2) = 32·1,9375 = 62.
Простейшая формула вещества СН3О. Сумма атомных масс для этой формульной единицы составит 12+3+16=31. Делим 62 на 31 и получаем истинное соотношение между количеством атомов в молекуле:
х : у : z = 2 : 6 : 2.
Таким образом, истинная формула вещества С2Н6О2. Эта формула отвечает составу двухатомного спирта – этиленгликоля: СН2(ОН)-СН2(ОН).
2.10.6. Определение молярной массы вещества
Молярная масса вещества может быть определена на основе величины плотности его паров по газу с известной величиной молярной массы.
Пример 14 . Плотность паров некоторого органического соединения по кислороду равна 1,8125. Определите молярную массу этого соединения.
Решение. Молярная масса неизвестного вещества Мx равна произведению относительной плотности этого вещества D на молярную массу вещества M, по которому определено значение относительной плотности:
Мx = D·M = 1,8125·32 = 58,0.
Веществами с найденным значением молярной массы могут быть ацетон, пропионовый альдегид и аллиловый спирт.
Молярная масса газа может быть рассчитана с использованием величины молярного его объема при н.у.
Пример 15. Масса 5,6 л газа при н.у. составляет 5,046 г. Рассчитайте молярную массу этого газа.
Решение. Молярный объем газа при н.у равен 22,4 л. Следовательно, молярная масса искомого газа равна
М = 5,046·22,4/5,6 = 20,18.
Искомый газ – неон Ne.
Уравнение Клапейрона–Менделеева используется для расчета молярной массы газа, объем которого задан при условиях, отличающихся от нормальных.
Пример 16. При температуре 40 о С и давлении 200 кПа масса 3,0 л газа составляет 6,0 г. Определите молярную массу этого газа.
Решение. Подставляя известные величины в уравнение Клапейрона–Менделеева получаем:
М = mRT/PV = 6,0·8,31·313/(200·3,0)= 26,0.
Рассматриваемый газ – ацетилен С2Н2.
Пример 17. При сгорании 5,6 л (н.у.) углеводорода получено 44,0 г углекислого газа и 22,5 г воды. Относительная плотность углеводорода по кислороду равна 1,8125. Определите истинную химическую формулу углеводорода.
Решение. Уравнение реакции сгорания углеводорода можно представить следующим образом:
Количество углеводорода составляет 5,6:22,4=0,25 моль. В результате реакции образуется 1 моль углекислого газа и 1,25 моль воды, которая содержит 2,5 моль атомов водорода. При сжигании углеводорода количеством вещества 1 моль получается 4 моль углекислого газа и 5 моль воды. Таким образом, 1 моль углеводорода содержит 4 моль атомов углерода и 10 моль атомов водорода, т.е. химическая формула углеводорода С4Н10. Молярная масса этого углеводорода равна М=4·12+10=58. Его относительная плотность по кислороду D=58:32=1,8125 соответствует величине, приведенной в условии задачи, что подтверждает правильность найденной химической формулы.



© Факультет естественных наук РХТУ им. Д.И. Менделеева. 2013 г.