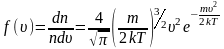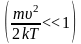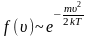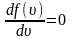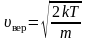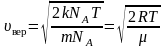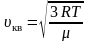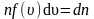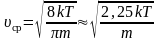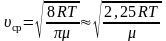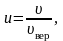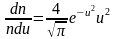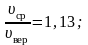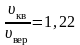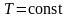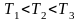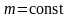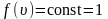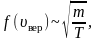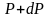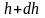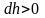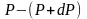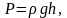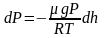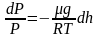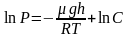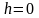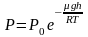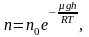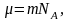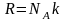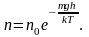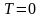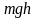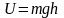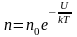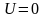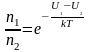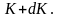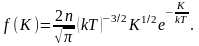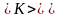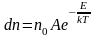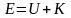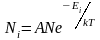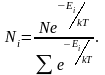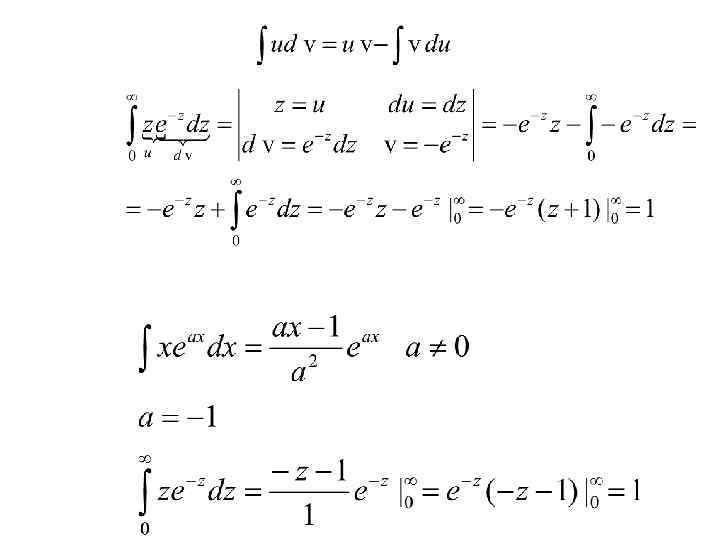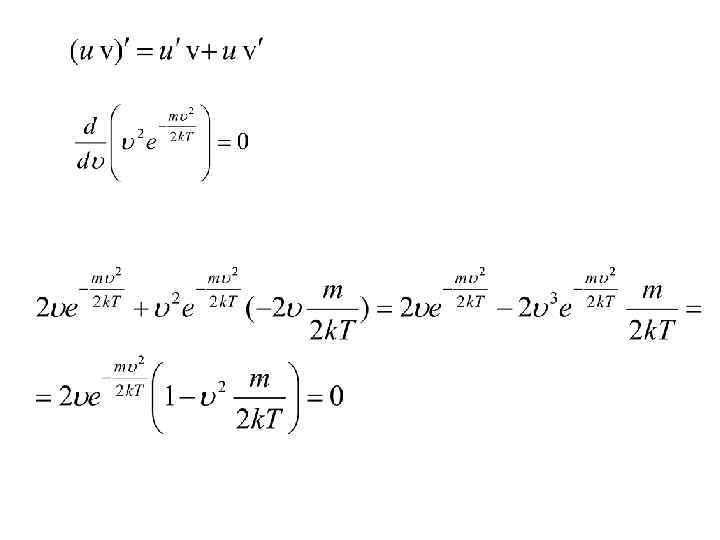Наиболее вероятная, среднеквадратичная и средняя арифметическая скорости молекул газа
Рассмотрим, как изменяется с абсолютной
величиной скорости число частиц,
приходящихся на единичный интервал
скоростей, при единичной концентрации
частиц.
График функции распределения Максвелла
,
приведен
на рисунке 2.6.

Рис.
2.6
Из
графика видно, что при «малых» υ,
т.е. при
,
имеем
;
затем
достигает максимума А
и далее экспоненциально спадает
.
Величину
скорости, на которую приходится максимум
зависимости
,
называют
наиболее вероятной скоростью.
Найдем
эту скорость из условия равенства
производной
.
, (2.3.6)
– наиболее
вероятная скорость одной молекулы.
Для
одного моля газа:
. (2.3.7)
Среднюю
квадратичную скорость
найдем, используя соотношение
:
– для одной молекулы. (2.3.8)
– для одного моля газа. (2.3.9)
Средняя
арифметическая скорость:
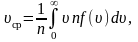
где
– число молекул со скоростью от υ
до
.
Если подставить сюда f(υ)
и вычислить, то получим:
–
для одной молекулы. (2.3.10)
–
для одного моля газа. (2.3.11)
Все
три скорости незначительно отличаются
друг от друга множителем порядка единицы,
причем
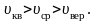
Формула Максвелла для относительных скоростей
Для
решения многих задач удобно использовать
формулу Максвелла, где скорость выражена
в относительных единицах.
Относительную
скорость обозначим через u:
(2.3.13)
где
.
Тогда из (2.3.3), получим
. (2.3.14)
Это
уравнение универсальное. В
таком виде функция
распределения
не зависит ни от рода газа, ни от
температуры.
На
рисунке 2.7 показано максвелловское
распределение частиц f(υ),
имеющих скорости от υ до
За единицу скорости здесь взята наиболее
вероятная скорость.
Полезно
знать, что
.
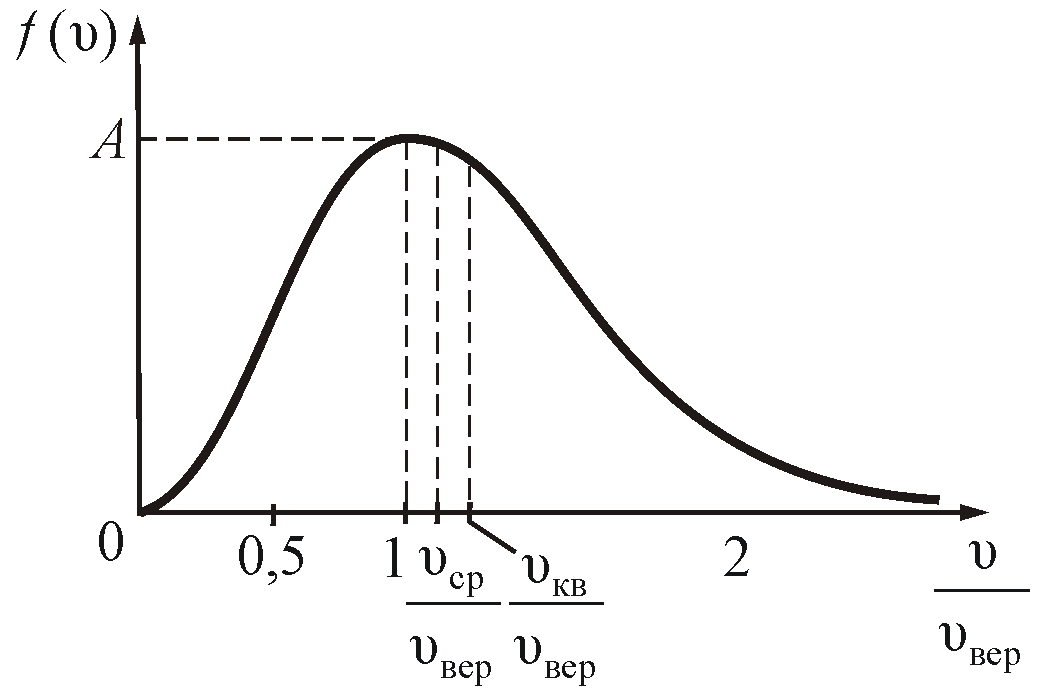
Рис.
2.7
Зависимость функции распределения Максвелла от массы молекул и температуры газа
На
рисунке 2.8 показана зависимость
при различных температурах и массах
молекул газа.
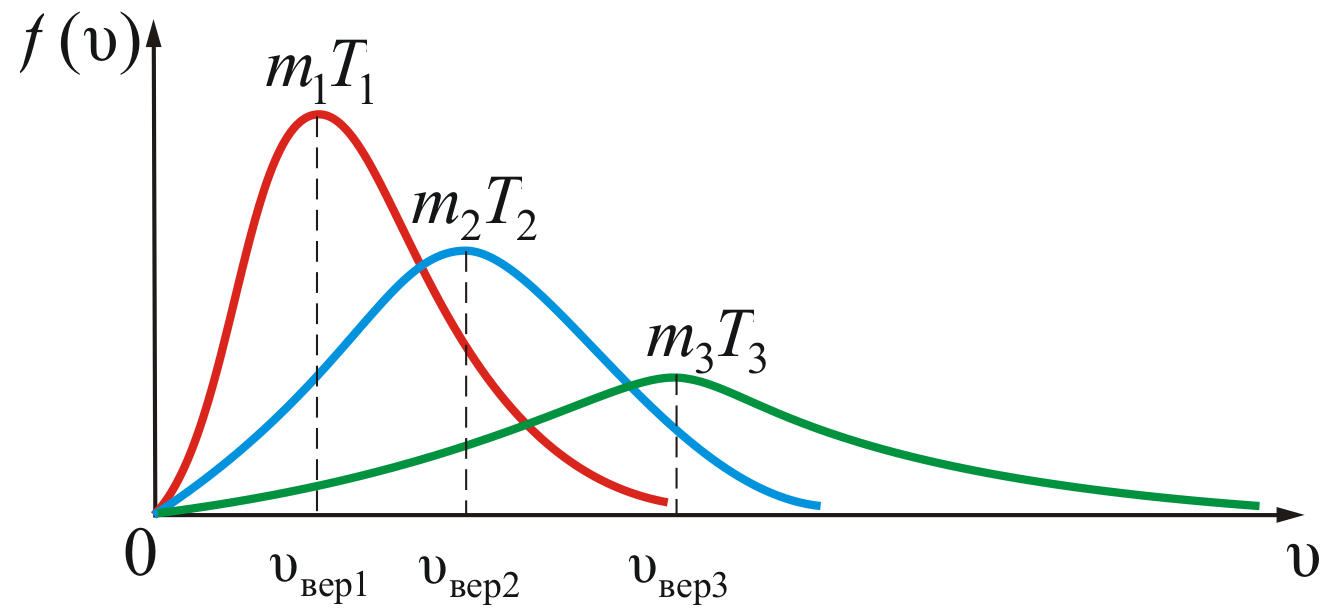
Рис.
2.8
Из
рисунка 2.8 можно проследить за изменением
при изменении m
и T.
В данном случае
(при
)
или
(при
).
Площадь
под кривой величина постоянная,
равная единице (
),
поэтому важно знать как будет изменяться
положение максимума кривой:
кроме
того
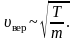
Максвелловский
закон распределения по скоростям и все
вытекающие следствия справедливы только
для газа в равновесной системе. Закон
статистический, и выполняется тем лучше,
чем больше число молекул.
Барометрическая формула
Рассмотрим
ещё один очень важный закон.
Атмосферное
давление на какой-либо высоте h
обусловлено весом слоёв газа, лежащих
выше. Пусть P
– давление на высоте h,
а
–
на высоте
(рис. 2.9).
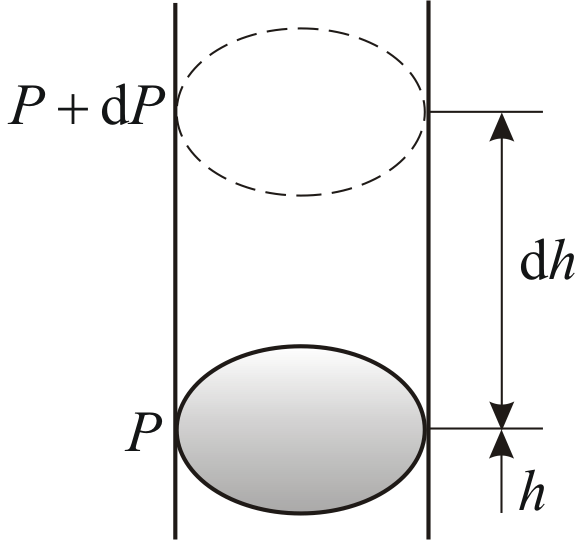
Рис.
2.9
Причём
,
а dР
< 0, так как на большей высоте давление
меньше. Разность давления
равна весу газа, заключённого в объёме
цилиндра с площадью основания равного
единице и высотой dh.
Т.к.
где
плотность газа на высоте h,
медленно убывающая с высотой, то можно
записать:
.
или
.
Проинтегрировав
это выражение, получим:
,
где
С
– произвольная постоянная.
В
силу произвольности, примем, что С
= Р0
– давление на высоте
.
Отсюда, после потенцирования, получаем
барометрическую формулу:
(2.4.1)
Из
формулы (2.4.1) следует, что P
убывает с высотой тем быстрее, чем
тяжелее газ (чем больше μ) и чем ниже
температура (например, на больших высотах
концентрация легких газов Не и Н2
гораздо больше, чем у поверхности Земли).
На
рисунке 2.10 изображены две кривые, которые
можно трактовать, либо как соответствующие
разным μ (при одинаковой Т),
либо как отвечающие разным Т,
при одинаковых μ.
Таким
образом, чем тяжелее
газ (больше μ) и чем ниже
температура, тем быстрее
убывает давление.
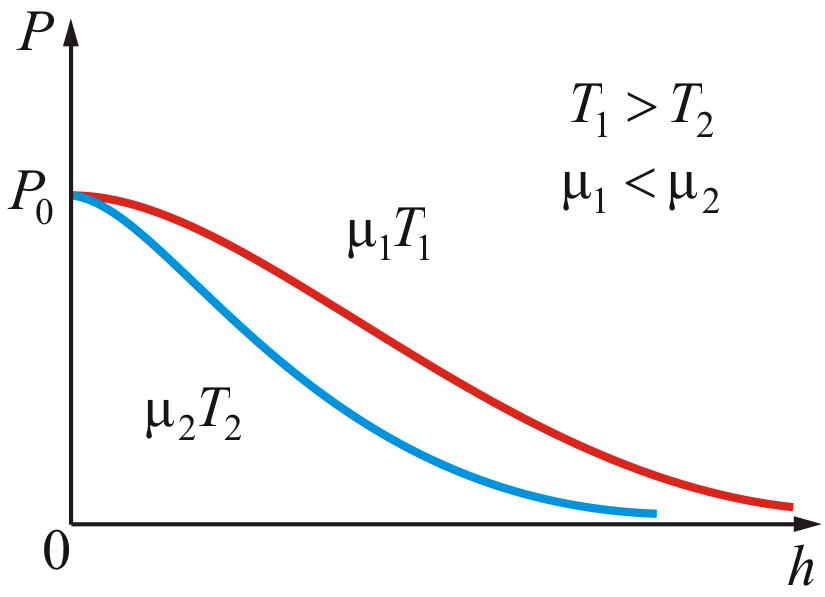
Рис.
2.10
Пусть идеальный газ находится в поле
консервативных сил в условиях теплового
равновесия. При этом концентрация газа
будет различной в точках с различной
потенциальной энергией, что необходимо
для соблюдения условий механического
равновесия. Так, число молекул в единичном
объеме n убывает с
удалением от поверхности Земли, и
давление, в силу соотношения
,
падает.
Если известно число молекул в единичном
объеме, то известно и давление, и наоборот.
Давление и плотность пропорциональны
друг другу, поскольку температура в
нашем случае постоянна. Давление с
уменьшением высоты должно возрастать,
потому что нижнему слою приходится
выдерживать вес всех расположенных
сверху атомов.
Исходя
из основного уравнения молекулярно-кинетической
теории:
,
заменим P
и P0
в барометрической формуле (2.4.1) на n
и n0
и получим распределение
Больцмана
для молярной массы газа:
(2.5.1)
где
n0
и n
число молекул в единичном объёме на
высоте h
= 0 и h.
Так
как
а
,
то (2.5.1) можно представить в виде
(2.5.2)
С
уменьшением температуры число молекул
на высотах, отличных от нуля, убывает.
При
тепловое движение прекращается, все
молекулы расположились бы на земной
поверхности. При высоких температурах,
наоборот, молекулы оказываются
распределёнными по высоте почти
равномерно, а плотность молекул медленно
убывает с высотой. Так как
– это потенциальная энергия U,
то на разных высотах
– различна. Следовательно, (2.5.2)
характеризует распределение частиц по
значениям потенциальной энергии:
, (2.5.3)
– это
закон распределения частиц по потенциальным
энергиям – распределение Больцмана.
Здесь n0
– число молекул в единице объёма там,
где
.
На
рисунке 2.11 показана зависимость
концентрации различных газов от высоты.
Видно, что число более тяжелых молекул
с высотой убывает быстрее, чем легких.
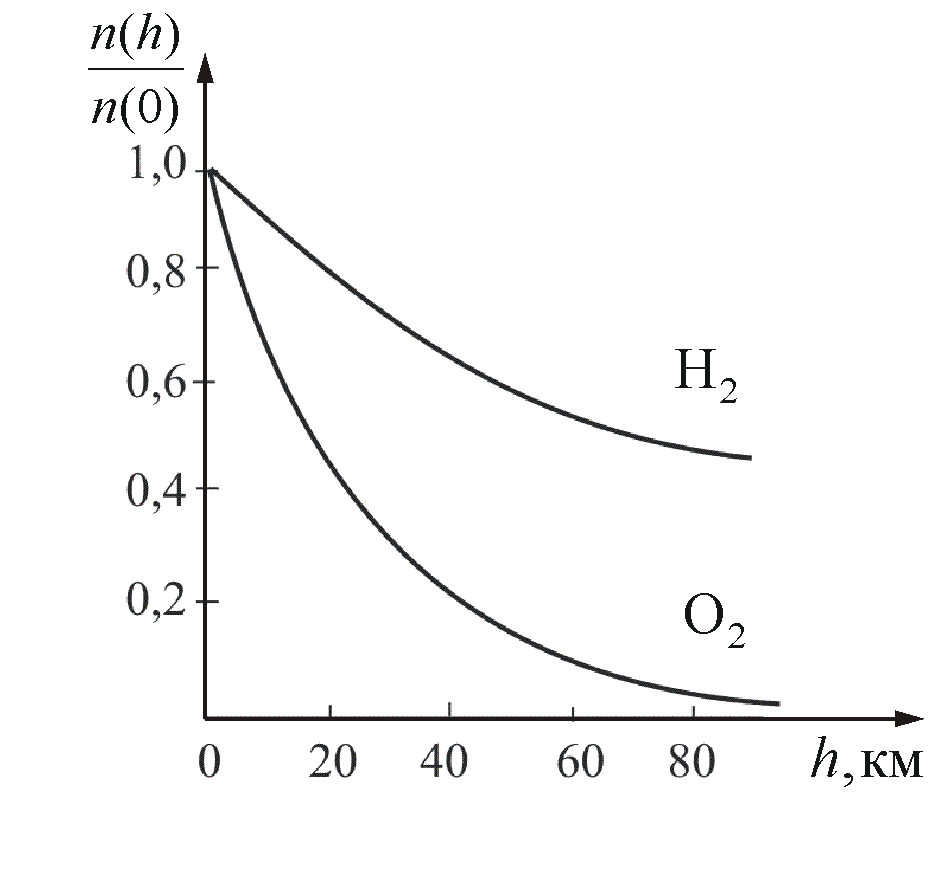
Рис.
2.11
Из
(2.5.3) можно получить, что отношение
концентраций молекул в точках с U1
и U2
равно:
. (2.5.4)
Больцман
доказал, что соотношение (2.5.3) справедливо
не только в потенциальном поле сил
гравитации, но и в любом потенциальном
поле, для совокупности любых одинаковых
частиц, находящихся в состоянии
хаотического теплового движения.
В
п. 2.3 мы получили выражение для распределения
молекул по скоростям (распределение
Максвелла):
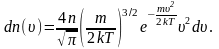
Из
этого выражения легко найти
распределение молекул газа по значениям
кинетической энергии
K.
Для этого перейдём от переменной υ
к переменной
:
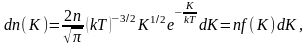
где
dn(K)
– число молекул, имеющих кинетическую
энергию поступательного движения,
заключённую в интервале от K
до
Отсюда получим функцию
распределения молекул по энергиям
теплового движения:
(2.6.1)
Средняя
кинетическая энергия
молекулы идеального газа:
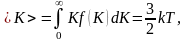
то
есть получаем результат, совпадающий
с прежним результатом, полученным в п.
1.3.
Итак,
закон Максвелла даёт распределение
частиц по значениям кинетической
энергии, а закон Больцмана – распределение
частиц по значениям потенциальной
энергии. Оба распределения можно
объединить в единый закон
Максвелла – Больцмана:
. (2.6.2)
Здесь
n0
– число молекул в единице объёма в той
точке, где
,
– полная энергия.
В
последнем выражении, потенциальная и
кинетическая энергии, а следовательно
и полная энергия Е,
могут принимать непрерывный ряд значений.
Если же энергия частицы может принимать
лишь дискретный ряд значений Е1,
Е2…,
(как это имеет место, например, для
внутренней энергии атома), то в этом
случае распределение Больцмана имеет
вид:
, (2.6.3)
где
Ni
– число частиц, находящихся в состоянии
с энергией Еi,
а А
– коэффициент пропорциональности,
который должен удовлетворять условию
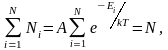
где
N
– полное число частиц в рассматриваемой
системе.
Тогда
окончательное выражение распределения
Максвелла – Больцмана для случая
дискретных значений энергий
будет иметь вид:
(2.6.4)
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Измерение скоростей газовых молекул. Опыт Штерна. Распределение Максвелла
Из формул (~mathcal h W_K mathcal i = frac 32 kT) и (~mathcal h W_K mathcal i = frac{m_0 mathcal h upsilon^2 mathcal i}{2}) получаем формулу для расчета средней квадратичной скорости движения молекул одноатомного газа:
(~mathcal h upsilon_{KB} mathcal i = sqrt{mathcal h upsilon^2 mathcal i} = sqrt{frac{3kT}{m_0}} = sqrt{frac{3RT}{M}} , qquad (1))
так как (~m_0 = frac{M}{N_A}) и (~kN_A = R), где R — универсальная газовая постоянная.
Таким образом (~mathcal h upsilon_{KB} mathcal i) зависит от температуры и природы газа. Так, при 0 °С для водорода она равна 1800 м/с. для азота — 500 м/с.
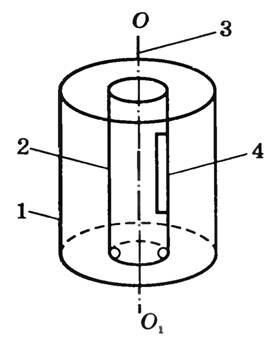
Впервые на опыте определил скорость молекул О. Штерн. В камере, из которой откачан воздух, находятся два коаксиальных цилиндра 1 и 2 (рис. 1), которые могут вращаться вокруг оси OO1 с постоянной угловой скоростью ω.
Рис. 1
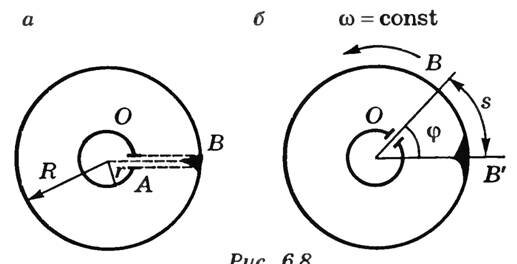
Вдоль оси OO1 натянута платиновая посеребренная проволока, через которую пропускают электрический ток. Она нагревается, и серебро испаряется. Атомы серебра через щель 4 в стенке цилиндра 2 попадают в цилиндр 1 и оседают на его внутренней поверхности, оставляя след в виде узкой полоски, параллельной щели. Если цилиндры неподвижны, то полоска расположена напротив щели (точка В на рис. 2, а) и имеет одинаковую толщину.
Рис. 2
При равномерном вращении цилиндра с угловой скоростью ω полоска смещается в сторону, противоположную вращению, на расстояние s относительно точки В (рис. 2, б). На такое расстояние сместилась точка В цилиндра 1 за время t, которое необходимо, чтобы атомы серебра прошли расстояние, равное R – r, где R и r — радиусы цилиндров 1 и 2.
(~s = upsilon_1 t = omega Rt ,)
где υ1 — линейная скорость точек поверхности цилиндра 1. Отсюда
(~t = frac{s}{omega R} .)
Скорость атомов серебра
(~upsilon = frac{R – r}{t} = frac{omega(R – r)R}{s} .)
Зная R, r, ω и измерив экспериментально s, по этой формуле можно рассчитать среднюю скорость движения атомов серебра. В опыте Штерна υ ~ 650 м/с. Это значение совпадает с теоретическим значением средней квадратичной скорости молекул. Это служит экспериментальным доказательством справедливости формулы (1), а следовательно, и формулы (3).
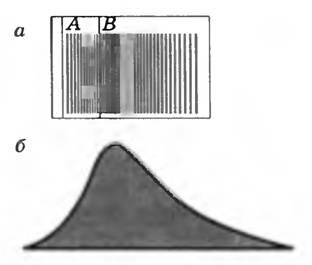
В опыте Штерна было обнаружено, что ширина полоски на поверхности вращающегося цилиндра гораздо больше геометрического изображения щели и толщина ее в разных местах неодинакова (рис. 3, а). Это можно объяснить только тем, что атомы серебра движутся с различными скоростями. Атомы, летящие с некоторой скоростью, попадают в точку В’. Атомы, летящие быстрее, попадают в точку, лежащую на рисунке 2 выше точки В’, а летящие медленнее, — ниже точки В’. Таким образом, каждой точке изображения соответствует определенная скорость, которую достаточно просто определить из опыта. Этим и объясняется то, что толщина слоя атомов серебра, осевших на поверхности цилиндра, не везде одинакова. Наибольшая толщина в средней части слоя, а по краям толщина уменьшается.
Рис. 3
Изучение формы сечения полоски осевшего серебра с помощью микроскопа показало, что она имеет вид, примерно соответствующий изображенному на рисунке 3, б. По толщине отложившегося слоя можно судить о распределении атомов серебра по скоростям.
Разобьем весь интервал измеренных на опыте скоростей атомов серебра на малые Δυ. Пусть υ — одна из скоростей этого интервала. По плотности слоя подсчитаем число ΔN атомов, имеющих скорость в интервале от υ до υ + Δυ, и построим график функции (~f(upsilon) = frac{Delta N}{N Delta upsilon}) , где Ν — общее число атомов серебра, осевших на поверхности цилиндра. Получим кривую, изображенную на рисунке 4. Она называется функцией распределения молекул по скоростям.
Рис. 4
Площадь заштрихованной площадки равна (~frac{Delta N}{N Delta upsilon} Delta upsilon = frac{Delta N}{N}) , т.е. равна относительному числу атомов, имеющих скорость в пределах υ + Δυ. Мы видим, что числа частиц, имеющих скорость из разных интервалов υ1 + Δυ1, υ2 + Δυ2, υ3 + Δυ3, резко различны. Существует какая-то скорость, около значения которой находятся скорости, с которыми движется наибольшее число молекул. Она называется наиболее вероятной скоростью υB, и ей соответствует максимум на рисунке 4. Эта кривая хорошо соответствует кривой, полученной Дж. Максвеллом, который, пользуясь статистическим методом, теоретически доказал, что в газах, находящихся в состоянии термодинамического равновесия, устанавливается некоторое, не меняющееся со временем, распределение молекул по скоростям, которое подчиняется вполне определенному статистическому закону, графически изображаемому кривой f(υ). Наиболее вероятная скорость, как показал Максвелл, зависит от температуры газа и массы его молекул по формуле (~mathcal h upsilon_B mathcal i = sqrt{frac{2RT}{M}}).
Такому распределению подчиняются молекулы всевозможных веществ в различных состояниях при данной температуре. Если увеличить температуру (T2 > T1), то кривая (рис. 5) сместится вправо, наиболее вероятная скорость возрастет, появится больше быстрых частиц, уменьшится число медленных частиц и даже тех, которые движутся со скоростями, близкими к наиболее вероятной. Площади под кривыми будут одинаковыми, так как общее число частиц N не изменяется.
Зная закон изменения функции распределения молекул по скоростям f(υ), можно рассчитать среднюю, или среднюю арифметическую, скорость молекулы:
(~mathcal h upsilon mathcal i = frac 1N int upsilon dN = int^{infty}_0 upsilon F(upsilon) d upsilon .)
Подставляя сюда значение F(υ) и интегрируя (в виду сложности F(υ) мы ее не приводим), получают
(~mathcal h upsilon mathcal i = sqrt{frac{8kT}{pi m_0}} = sqrt{frac{8RT}{pi M}} .)
Среднее значение квадрата скорости
(~mathcal h upsilon^2 mathcal i = frac 1N int upsilon^2 dN = int^{infty}_0 upsilon^2 F(upsilon) d upsilon .)
Средняя квадратичная скорость
(~mathcal h upsilon_{KB} mathcal i = sqrt{mathcal h upsilon^2 mathcal i} = sqrt{frac{3RT}{M}} .)
Литература
Аксенович Л. А. Физика в средней школе: Теория. Задания. Тесты: Учеб. пособие для учреждений, обеспечивающих получение общ. сред, образования / Л. А. Аксенович, Н.Н.Ракина, К. С. Фарино; Под ред. К. С. Фарино. — Мн.: Адукацыя i выхаванне, 2004. — C. 134-136.
В этом разделе приводятся некоторые следствия, вытекающие из формул ( 3.29 

Рис. 3.3. Распределение молекул кислорода по скоростям при разных температурах T1 = 300 К и T2 = 1 300 К
Наиболее вероятная скорость. При бесконечно малых и неограниченно больших значениях скоростей функция распределения стремится к нулю
то есть такие предельные значения скоростей маловероятны в системе. Следовательно, при каком-то значении скорости функция f(v) достигает своего максимума.
Наиболее вероятная скорость vВЕР — это скорость, отвечающая максимальному значению функции распределения.
Ее можно найти, решая уравнение
откуда следует, что
Иными словами, наиболее вероятной называется скорость, вблизи которой на единичный интервал приходится наибольшее число молекул. В этой точке f(v) принимает максимальное значение:
Соотношения (3.31), (3.32) могут быть полезны для анализа изменения функции распределения при изменении температуры газа или при изменении рода газа, то есть массы молекул. Отметим, что как следует из (3.26) – (3.29), распределение Максвелла зависит не отдельно от массы молекул и отдельно от температуры газа, а от их отношения 






С ростом температуры наиболее вероятная скорость vВЕР (3.31) увеличивается, то есть максимум функции f(v) сдвигается вправо (см. рис. 3.3), Т2 > Т1. При этом f(vВЕР) уменьшается, то есть кривая становится более пологой. Так же деформируется кривая, если температура постоянна, но масса молекул уменьшается. Напомним, что при любых деформациях функции распределения f(v) площадь под кривыми постоянна и равна единице в соответствии с формулой ( 3.30 
Относительное количество молекул, скорость которых превышает некоторое значение v, определяется выражением
На графике (см. рис. 3.3) этому интегралу соответствует лежащая справа от v часть площади (отмечена штриховкой), ограниченная кривой f(v) и осью скоростей. Как видно из рис. 3.3, относительное количество молекул, имеющих скорости, превышающие v, растет с повышением температуры.
В заключение этого раздела заметим, что во всех формулах для функции распределения и характерных скоростей входит отношение массы молекулы к постоянной Больцмана
Умножая числитель и знаменатель на число Авогадро NA и учитывая, что
— молярная масса газа, a
— универсальная газовая постоянная, мы всюду можем использовать это отношение в наиболее удобной для конкретной задачи форме
Распределение молекул по величинам безразмерной скорости. Если при графическом изображении функции распределения Максвелла (3.29) по оси абсцисс откладывать скорости молекул v, то форма кривой и положение максимума будут зависеть от массы молекул и от температуры газа. Но если по горизонтальной оси откладывать отношение скорости к наиболее вероятной скорости, то есть безразмерную скорость
то для всех температур и любых масс молекул (любых газов) получится одна и та же кривая (рис. 3.4).
Рис. 3.4. Распределение Максвелла по величинам безразмерной скорости
Сделав замену переменной
в ( 3.29 
получим распределение Максвелла в форме
Эта формула и соответствующий ей график (см. рис. 3.4) удобны для решения многих задач.
Пример. Найдем, какая часть общего числа молекул кислорода имеет при температуре 27 °С скорости, отличающиеся от наиболее вероятной не более, чем на 1 %; а также скорости в интервале 562–572 м/с.
Произведем необходимые вычисления. Чтобы ответить на первый вопрос задачи, учтем, что u = 1 при v = vВЕР. Величина интервала du = 0,02. Следовательно,
Вычислим наиболее вероятную скорость:
Найдем отношение v = 562 м/с к vВЕР = 395 м/с
Определим по кривой (см. рис. 3.4) значение функции f(u) при u = 1,42. Получаем f(u) = 0,62. Ширина интервала Dv = 10 м/с (Du = 10/395 = 0,0253). Следовательно, доля молекул в этом интервале
Интересно отметить, что молекула кислорода проходит за секунду путь, равный в среднем 0,4 км. Но не нужно забывать о соударениях молекул. Из-за них молекула по прямой движется очень недолго, и ее путь представляет собой ломаную линию. Поэтому молекула, двигаясь с огромной скоростью по отдельным звеньям ломаной траектории, передвигается от слоя к слою газа со сравнительно небольшой скоростью.
Средняя арифметическая скорость. Знание функции распределения молекул по скоростям f(v) дает возможность найти среднее значение скорости, а также любой величины, являющейся функцией скорости, например квадрата скорости v 2 или кинетической энергии молекулы mv 2 /2.
Средняя арифметическая скорость — это отношение суммы абсолютных величин скоростей всех молекул в системе к числу этих молекул.
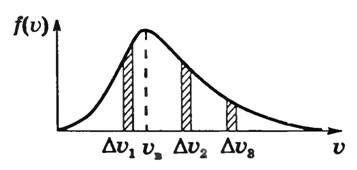
Разобьем интервал всех возможных значений скорости от до бесконечности на малые интервалы Dvi. Каждому интервалу соответствует количество молекул
Так как интервалы Dvi, малы, то можно приближенно считать скорости молекул данного интервала одинаковыми и равными vi. Сумма значений скоростей молекул интервала
Сумма значений скоростей всех молекул
Разделив эту сумму на число молекул, получим выражение для средней арифметической скорости
Переходя от суммы к интегралу, получаем
Вычисляя интеграл, получаем среднюю арифметическую скорость молекул
Среднеквадратичная скорость. Чтобы найти среднее значение произвольной функции L(v) скорости, нужно эту функцию умножить на функцию распределения и проинтегрировать по всем возможным значениям скорости:
В частности, при L(v) = v отсюда находится .
Среднее значение квадрата скорости равно отношению суммы квадратов скоростей всех молекул системы к общему числу молекул. Таким образом,
Среднеквадратичная скорость — это корень квадратный из среднего значения квадрата скорости молекул
Следует отметить, что характерные скорости отличаются друг от друга лишь численными множителями, причем
а зависимость от Т и m (или m) у них одинаковая.
Через среднеквадратичную скорость выражается средняя кинетическая энергия поступательного движения молекул
Этот результат находится в согласии с формулой (1.14) кинетической теории идеальных газов и с законом о равнораспределении энергии, который гласит, что на каждую степень свободы молекулы приходится энергия kBТ/2. Три степени свободы поступательного движения молекулы как раз соответствуют полученному здесь результату (3.44). В сущности, именно для того, чтобы получить такое соответствие, мы выбрали должным образом коэффициент α в ( 3.26 
Эксперимент по проверке распределения Максвелла. Необходимо еще раз подчеркнуть, что установленный Максвеллом закон распределения молекул по скоростям и все вытекающие из него следствия справедливы только для газа, находящегося в равновесии.
Закон справедлив для любого числа молекул N, если только это число достаточно велико. Закон Максвелла — статистический, а законы статистики выполняются тем точнее, чем к большему числу одинаковых объектов они применяются. При малом числе объектов могут наблюдаться значительные отклонения от предсказанной статистики — флуктуации.
Экспериментальное определение распределения скоростей молекул было осуществлено впервые О. Штерном в 1920 г. Исследовалось распределение по скоростям одноатомных молекул паров металлов (Ag или Pt), из которых была изготовлена нить, расположенная на оси двух цилиндров. Нить нагревалась электрическим током, и металл испарялся (см. рис 3.5).
Рис. 3.5 Схема опыта Штерна: 1 — вид установки сбоку; 2 — вид установки сверху
Молекулы, прошедшие через щель во внутреннем цилиндре, летели по прямой и оседали на стенке холодного внешнего цилиндра. Если привести всю установку во вращение (щель все время против точки В), то молекулы, обладающие большой скоростью v, попадут в некоторую точку вблизи В, а более медленные затратят на путь больше времени и попадут в точки, отстоящие дальше от В. Следует обратить внимание, что вылетающие молекулы движутся по прямой, они не участвуют во вращательном движении. Поскольку молекулы в зависимости от скорости попадают в разные точки внешнего цилиндра, то исследуя толщину слоя металла, осевшего на его стенку, можно составить представление о распределении молекул по скоростям.
Найдем распределение молекул по расстояниям S от точки В до места их попадания на стенку цилиндра. Если R и r — радиусы большого и малого цилиндров, соответственно (см. рис.), то время полета от щели до стенки цилиндра
За это время цилиндр повернется на угол
где ω — угловая скорость вращения установки. Соответственно, точка попадания будет смещена относительно В на расстояние
Подставляя сюда время полета, получаем связь скорости молекулы с расстоянием S:
Подставляя, в свою очередь, полученное выражение в распределение Максвелла и учитывая, что
находим распределение молекул по расстояниям S:
(мы опускаем выражение для нормировочной постоянной С).
Опыты Штерна подтвердили справедливость закона, установленного Максвеллом.
Выведем формулу расчёта средней арифметической скорости (v’j. Пусть число молекул газа равно N, из них A N] молекул
имеют скорость в пределах от у/ до у2 = у2 + А у, а А N2 — скорости в пределах от у2 до У; = у2 + /1 у и т. д., где А у малый интервал скоростей. Тогда среднее значение скорости молекул равно
где п — общее число интервалов скоростей.

3. Средняя арифметическая скорость
Отсюда следует, что скорости , v в, v кв отличаются друг от друга множителями, имеющих порядок единицы, причём средняя арифметическая скорость теплового движения молекул идеального газа по величине лежит между наиболее вероятной скоростью и средней квадратичной
Все рассмотренные скорости движения молекул вычисляются с помощью распределения Максвелла.
Распределение молекул идеального газа по кинетическим
энергиям определяет долю молекул кинетические энергии
которых заключены в интервале от W кин до W кин + d W кин. Кинетическая энергия W кин молекулы равна
Формула для функции распределения / (у) молекул газа по скоростям имеет вид
Аналогично, функция распределения молекул идеального кинетическим энергиям определяется формулой
подставив в формулу (6.40) значение d v из формулы (6.39) и сократив обе части уравнения на т ? v, получим
Формула (6.41) описывает функцию распределения молекул идеального газа по кинетическим энергиям. Из формулы следует, что распределение молекул по кинетической энергии не зависит от их массы и определяется только температурой газа Т. Поэтому формула (6.41) применима, как к газу, состоящему из одинаковых молекул, так и к смеси газов.
Средняя кинетическая энергия (ей)поступательного движения одной молекулы идеального газа равна
Решение задач, контрольных работ по физике.
Найти среднюю квадратичную, среднюю арифметическую и наиболее вероятную скорости молекул водорода. Вычисления выполнять для температуры 300 К.
Найти: 

Средняя арифметическая скорость молекул выражается формулой


где Т- температура газа ; R- молярная газовая постоянная [R=8,31 Дж/(моль К)] ; M- моляр- ная масса газа (для водорода М=0,002 кг/моль).
Средняя квадратическая скорость молекулы газа выражается формулой:


Наиболее вероятная скорость молекул газа:
Vв = 
Находим:



Vв=
Определить молярную массу газа, если при температуре Т=300 К и давлении p=0,2 МПа он имеет плотность ρ=2,41 кг/м 3 .
Для решения задачи воспользуемся уравнением Менделеева-Клапейрона, записанного в виде:
P= 
Выражая из (1) молярную массу μ, получим :
= 
Подставляя, заданные числовые значения физических величин в формулу (3) и вычисляя, получим :
=
Ответ : =0,03 кг/моль.
Найти отношения теплоёмкостей Cp/Cv для газовой смеси, состоящей из 10 г гелия и 25 г водорода?
Молярную теплоёмкость смеси Cv при постоянном объёме найдём следующим. Теплоты, необходимую для нагревания смеси на ΔТ, выразим двумя способами :
где Cv1 – молярная теплоёмкость гелия ; Cv2 – молярная теплоёмкость кислорода.
Приравняв правые части (1) и (2) и разделив обе части полученного равенства на ΔТ, получим :
Рассуждая так же, получим формулу для вычисления молярной теплоёмкости при постоянном давлении :
Вычислим отношение формул (4) и (3), получим :
Молярные теплоёмкости газа при постоянном объёме и давлении выражаются соответственно :
Используя эти выражения запишем формулы для молярных теплоёмкостей гелия и кислорода. Помощь на экзамене онлайн .
Подставляя, полученные выражения (6), (7), (8) и (9) в формулу (5), получим :
Произведя вычисления, получим :
Найти среднюю длину свободного пробега молекулы азота в сосуде объемом 6 л. Масса газа 0,5 г.
Дано : d=3×10 -8 см=3×10 -11 см
Найти : 
Средняя длина свободного пробега молекул газа выражается формулой :


где d – диаметр молекулы ; n – концентрация молекул.
Концентрация молекул связана с давлением и температурой газа выражением:
где к – постоянная Больцмана (к=1.38×10 -23 Дж/К)
Из уравнения Менделеева-Клайперона можем записать:

, где V – объем газа, R – молярная газовая постоянная, m и M – масса и молярная масса газа соответственно.
Подставляя (3) в (2), а затем в выражение (1), получим:


Вычисления по формуле (4) дают


Ответ: 
Газ, для которого γ=Cp/Cv=4/3, находится под давлением P=2×10 5 Па и занимает объём V=3 дм 3 . В результате изобарического нагревания объём увеличился в 3 раза. Определить количество теплоты, переданное газу.
V=3 дм 3 =3×10 -3 м 3
Количество теплоты, участвующее в изобарном процессе выражается формулой :
Q= 
Изменение температуры газа :
Начальную Т1 и конечную Т2 температуры газа найдём из уравнения Менделеева-Клапейрона :
T1= 

где V и V2 – объёмы газа до нагревания и после, соответственно.
С учётом выражений (3) и (4), формула (2) примет вид :
ΔT= 
Подставляя полученное выражение для ΔТ согласно (5) в уравнение (1), получим :
Q= 
С учётом уравнения : R=Cp-Cv выражение (6) примет вид :
Q=
Разделив числитель и знаменатель последнего выражения на Cv и, учитывая, что V2=3V, получим :
Q= 
Произведя вычисления по формуле (7), найдём количество теплоты, подведённое к газу :
Q=
Во сколько раз необходимо увеличить объём ν=5 моль идеального газа при изотермическом расширении, если его энтропия увеличилась на ΔS=57.6 Дж/К?
Как известно, изменение энтропии выражается общей формулой :
ΔS=S2-S1= 
При вычислении по формуле (1) вынесем температуру Т за знак интеграла (при изотермическом процесс T=const). Помощь на экзамене онлайн . Вычислив интеграл, найдём :
ΔS= 
где Q – количество теплоты.
Количество теплоты при изотермическом процессе выражается формулой :
С учётом (2) уравнение (3) примет вид :
ΔS=
Отсюда изменение объёма газа :
V2/V1= 
Вычисления по формуле (4) дают :
V2/V1=
Ответ : объём газа необходимо увеличить в 4 раза.
Молекулярная физика 7 б
1. Средние скорости молекул. 2. Средняя арифметическая скорость 3. Средняя квадратичная скорость молекул 4. Наивероятнейшая скорость молекул
Средняя арифметическая скорость • Пользуясь функцией распределения Максвелла, можно вычислить ряд величин, важных для молекулярной физики. В качестве примеров мы приведем вычисления средней арифметической скорости , средней квадратичной скорости и наивероятнейшей скорости. Начнем со средней арифметической скорости молекул. • Средняя арифметическая скорость по определению равна отношению суммы всех скоростей всех молекул в единице объема к числу молекул в единице объема.
Средняя арифметическая скорость • Число молекул в единице объема, скорости которых заключены в интервале от до , равно, очевидно, . Сумма скоростей всех таких молекул равна. Чтобы найти сумму скоростей всех молекул, обладающих любыми скоростями, нужно эту функцию проинтегрировать по всем возможным скоростям от нуля до бесконечности. Следовательно, сумма всех скоростей равна • а средняя арифметическая скорость равна
Средняя арифметическая скорость • Подставив сюда полученное раньше выражение для • получим: • Чтобы вычислить входящий в это выражение интеграл, преобразуем подинтегральное выражение: • Так как то
Средняя арифметическая скорость • Введя новую переменную получим: • Интегрирование по частям даёт: • Таким образом, для интеграла в формуле получаем выражение: • Находим для выражение:
• • Средняя квадратичная скорость молекул Чтобы найти среднюю квадратичную скорость молекул , нужно вычислить отношение суммы квадратов скоростей молекул единицы объема к числу молекул в этом объеме. • Повторяя предыдущие рассуждения, получаем:
Средняя квадратичная скорость • Интеграл, входящий сюда, находим интегрированием по частям и получаем: • Отсюда и • Такое выражение мы получили и раньше.
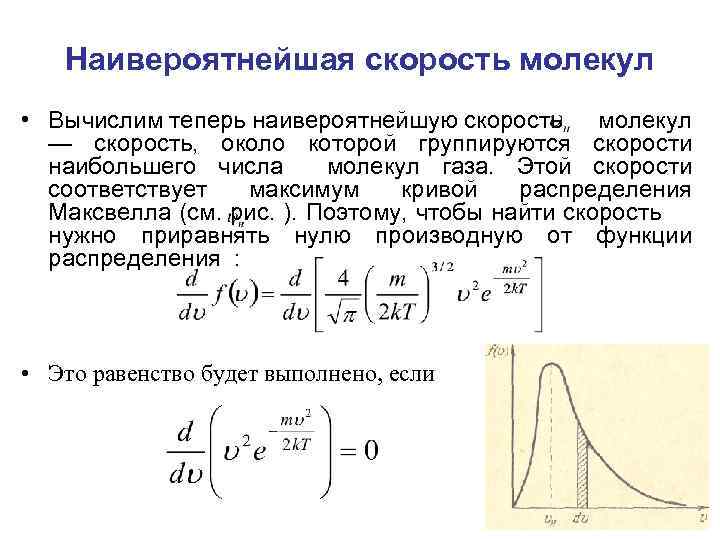
Наивероятнейшая скорость молекул • Вычислим теперь наивероятнейшую скорость молекул — скорость, около которой группируются скорости наибольшего числа молекул газа. Этой скорости соответствует максимум кривой распределения Максвелла (см. рис. ). Поэтому, чтобы найти скорость нужно приравнять нулю производную от функции распределения : • Это равенство будет выполнено, если
Наивероятнейшая скорость молекул • Проведя дифференцирование, получим: • Это равенство выполняется либо при , либо при • либо при условии, что. Ясно, что первые два условия не соответствуют максимуму кривой распределения.
Наивероятнейшая скорость молекул • Следовательно, значение условия определяется из • Отсюда • Сравнивая полученные выражения, находим соотношение между тремя вычисленными значениями скоростей: • Как видно, различие между этими тремя значениями не очень велико: и средняя арифметическая, и средняя квадратичная скорости близки к наивероятнейшей скорости.