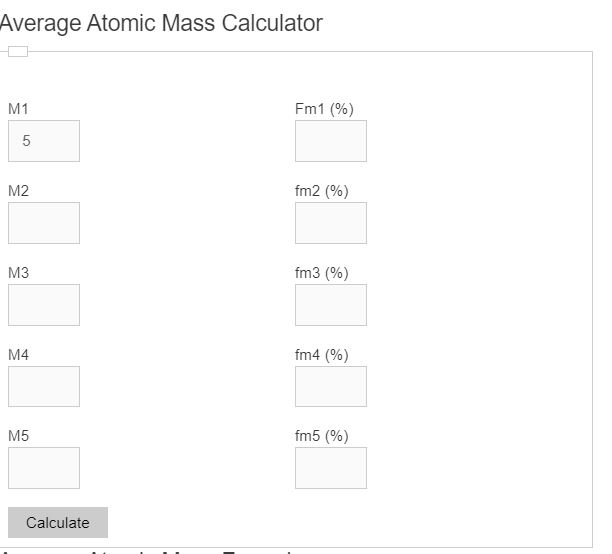
Unit Converter
Enter the percentage abundance and mass of up to 5 different isotopes into the average atom mass calculator. The calculator will display the average atomic mass of the isotopes.
- All Mass Calculators
- Grams to Moles calculator
- Mole Fraction Calculator
- Gibbs Free Energy Calculator
- Bond Order Calculator
Average Atomic Mass Formula
The following formula is used to calculate the average atomic mass of a substance.
AM = f1M1 + f2M2 +… + fnMn
- Where AM is the average atomic mass
- fn is the fractional percent of the isotope
- M is the mass of the isotope
Average Atomic Mass Definition
An average atomic mass is defined as the average mass of all isotopes within a given substance.
How to calculate average atomic mass?
How to calculate average atomic mass?
- First, determine the fractional percent of each isotope in the substance
For example, chlorine has two major isotopes. 1 with 75.77 percent of atoms and 1 with 24.23 percent of atoms. These two percentages would be the fractional percents of those isotopes.
- Next, determine the masses of each isotope
Using the same example above, this would be 35 and 37 amu respectively.
- Finally, calculate the average atomic mass
Calculate the average atomic mass using the information from steps 1 and 2 and the formula above.
FAQ
What is average atomic mass?
The average atomic mass is the average mass of all of the isotopes that make up a substance.
What is the fractional percent?
The fractional percent is the total percentage of a particular isotope in a substance.

“““““““““““““““““““““““““““““““““““““““““““““““`
Важной характеристикой отдельно взятого атома является его масса. Масса атома складывается из масс входящих в его состав протонов, нейтронов и электронов с учётом дефекта массы. Массой электронов в расчётах можно пренебрегать, так как она несоизмеримо мала по сравнению с массами покоя протона и нейтрона. Поэтому, вполне можно пользоваться понятием масса нуклида.
Напомним, что нуклид – это ядро атома с конкретным числом протонов и нейтронов.
Дефект массы – потеря ядром атома части массы при его синтезе из отдельных протонов и нейтронов.
Данная формула свидетельствует, что при ядерном синтезе ядро теряет часть массы с выделяющейся энергией. Поэтому масса ядра атома всегда меньше суммы масс покоя входящих в состав ядра протонов и нейтронов.
Разность между суммой масс покоя нуклонов (протонов и нейтронов), входящих в состав ядра и массой ядра и есть дефект массы.
Масса нуклида выраженная в килограммах называется абсолютной массой нуклида.
Во многих учебниках можно встретить информацию о том, что в расчётах величиной абсолютной массы, якобы, пользоваться не удобно, поэтому вводят величину относительной атомный массы. Но это заблуждение. Причина использования относительной атомной массы совершенно другая. Корни её кроются в истории.
Абсолютная масса очень маленькая величина. Для химиков и физиков 16-17 веков экспериментально её измерить было невозможно. Но даже в то время было важно проводить химические расчёты.
Первым учёным, решившим эту проблему, был Джон Дальтон, он предложил ввести величину относительной атомной массы (Аr). Относительной она называется потому, что вычисляется по отношению к массе произвольно выбранного эталона. Дальтон выбрал за эталон массу самого лёгкого атома – атома водорода и, принял её равной 1.
Относительные атомные массы известных на то время элементов рассчитывались Дальтоном на основе открытым им закона кратных отношений.
В настоящее время за эталон выбрана 1/12 часть абсолютной массы нуклида 12С. Этот эталон принято называть атомной единицей массы, сокращённо а.е.м.
Относительная масса нуклида – безразмерная величина, равная отношению абсолютной массы нуклида к 1/12 части массы нуклида 12C (атомной единице массы – а.е.м.).
Химический элемент представляет из себя смесь изотопов с определенной массовой долей каждого, поэтому можно вычислить усреднённую массу атома данного химического элемента, такая величина называется средней абсолютной массой атома элемента.
Средняя абсолютная масса атома элемента – масса атома элемента, выраженная в кг., вычисленная с учётом его изотопного состава.
Понятие относительной массы нуклида, не следует путать с понятием относительной атомной массы химического элемента. Не забываем, что элемент – это смесь изотопов. Поэтому относительная атомная масса элемента – величина средняя.
Относительная атомная масса элемента – безразмерная величина, равная отношению средней абсолютной массы атома элемента к 1/12 части массы нуклида 12С.
С учётом того, что отношение абсолютной массы нуклида к атомной единице массы есть ни что иное как относительная масса нуклида, выражение можно привести в виду:
Приведенную формулу мы будем использоваться для решения расчетных задач.
Задания по теме “Относительная атомная масса”
- Природный магний состоит из изотопов 24Mg, 25Mg и 26Mg. Вычислить среднюю атомную массу природного магния, если содержание отдельных изотопов в процентах по массе соответственно равно 78,6; 10,1 и 11,3.
- Природный галлий состоит из изотопов 71Ga и 69Ga. В каком количественном соотношении находятся между собой числа атомов этих изотопов, если средняя атомная масса галлия равна 69,72.
- Определите относительную атомную массу бора, если известно, что молярная доля изотопа 10В составляет 19,6%, а изотопа 11B – 80,4%.
- Медь имеет два изотопа: 63Cu и 65Cu. Молярные доли их в природной меди составляют 73 и 27% соответственно. Определите среднюю относительную атомную массу меди.
- Определите относительную атомную массу элемента кремния, если он состоит из трёх изотопов: 28Si (молярная доля 92,3%), 29Si (4,7%) и 30Si (3,0%).
- Природный хлор содержит два изотопа 35Cl и 37Сl. Относительная атомная масса хлора равна 35,45. Определите молярную долю каждого изотопа хлора.
- Относительная атомная масса неона равна 20,2. Неон состоит из двух изотопов: 20Ne и 22Ne. Рассчитайте молярную долю каждого изотопа в природном неоне.
- Природный бром содержит два изотопа. Молярная доля изотопа 79Br равна 55%. Какой ещё изотоп входит в состав элемента брома, если его относительная атомная масса равна 79,9.
- Природный таллий представляет собой смесь изотопов 203Tl и 205Tl. На основании относительной атомной массы природного таллия Ar(Tl) = 204,38 определите изотопный состав таллия в % по массе.
- Природный иридий представляет собой смесь изотопов 191Ir и 193Ir. На основании относительной атомной массы природного иридия Ar(Ir) = 192,22 определите изотопный состав иридия в % по массе.
- Природный рений представляет собой смесь изотопов 185Re и 187Re. На основании относительной атомной массы природного рения Ar(Re) = 186,21 определите изотопный состав рения в % по массе.
- Природный галлий представляет собой смесь изотопов 69Ga и 71Ga. На основании относительной атомной массы природного галлия Ar(Ga) = 69,72 определите изотопный состав галлия в % по массе.
- Природный хлор состоит из двух стабильных изотопов 35Cl и 37Cl. Исходя из средней относительной атомной массы хлора, равной 35,45, рассчитайте изотопный состав хлора в процентах по массе.
- Природное серебро состоит из двух стабильных изотопов 107Ag и 109Ag. Исходя из средней относительной атомной массы серебра, равной 107,87, рассчитайте изотопный состав серебра в процентах по массе.
- Природная медь состоит из двух стабильных изотопов 63Cu и 65Cu. Исходя из средней относительной атомной массы меди, равной 63,55, рассчитайте изотопный состав меди в процентах по массе.
- Природный бром состоит из двух стабильных изотопов 79Br и 81Br. Исходя из средней относительной атомной массы брома, равной 79,90, рассчитайте изотопный состав брома в процентах по массе.
- Природный кремний состоит из 3,1% (по молям) изотопа 30Si (с атомной массой 29,9738), а также изотопов 29Si (с атомной массой 28,9765) и 28Si (с атомной массой 27,9770). Рассчитайте содержание в % (по молям) 29Si и 28Si.
Запись символов изотопов элементов. Расчет количественного соотношения изотопов
Задача 206.
Символ одного из изотопов элемента 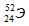 . Указать: а) название элемента; б) число протонов и нейтронов в ядре; в) число электронов в электронной оболочке атома.
. Указать: а) название элемента; б) число протонов и нейтронов в ядре; в) число электронов в электронной оболочке атома.
Решение:
Заряд ядра атома искомого элемента 24 численно совпадает с порядковым номером элемента в периодической системе химических элементов. Элемент №24 – хром (Cr).
Число нейтронов в ядре данного элемента равно 28:
N = A – Z = 28, где
N – число нейтронов в ядре, A – массовое число элемента (округленная масса атома), Z – заряд ядра.
Число электронов равно заряду ядра; в данном случае число электронов равно 24.
Ответ: Cr
Задача 207.
Ядро атома некоторого элемента содержит 16 нейтронов, а электронная оболочка этого атома — 15 электронов. Назвать элемент, изотопом которого является данный атом. Привести запись его символа с указанием заряда ядра и массового числа.
Решение:
Количество электронов в атоме численно равно заряду атома. В данном случае заряд ядра атома равен +15. Заряд ядра атома искомого элемента 15 численно совпадает с номером элемента в периодической системе химических элементов. Элемент №15 – фосфор – символ – Р.
Массовое число данного изотопа фосфора равно:
A = N + Z = 16 + 15 + 31
Символ изотопа фосфора будет иметь вид: 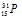
Ответ: 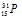 .
.
Задача 208.
Массовое число атома некоторого элемента равно 181, в электронной оболочке атома содержится 73 электрона. Указать число протонов и нейтронов в ядре атома и название элемента.
Решение:
Количество электронов в атоме равно количеству протонов. В данном случае число протонов равно 73. Число нейтронов в данном ядре равно 108:
N = A – Z = 181 – 73 = 108, где
N – число нейтронов, A – массовое число атома, Z – заряд ядра.
Заряд ядра атома искомого элемента 73 численно совпадает с порядковым номером элемента в периодической системе химических элементов. Элемент №73 –тантал, символ – +73Ta.
Ответ: +73Та.
Задача 209.
В природных соединениях хлор находится в виде изотопов 35Cl [75,5% (масс.)] и 37Cl [24,5% (масс.)]. Вычислить среднюю атомную массу природного хлора.
Решение:
Рассчитаем содержание 35Cl в природном хлоре, т.е. долю его в атомной массе из пропорции:
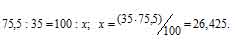
Теперь рассчитаем массу 37Cl, содержащуюся в природном хлоре из пропорции:
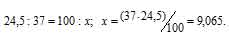
Вычисляем среднюю массу природного хлора, состоящего из двух изотопов
214,5 + 9,065 = 35,49.
Ответ: 35,49.
Задача. 210.
Природный магний состоит из изотопов: 24Mg, 25Mg, 26Mg. Вычислить среднюю атомную массу природного магния, если содержание отдельных изотопов в атомных процентах соответственно равно 78,6, 10,1 и 11,3.
Решение:
Вычислим атомную массу изотопов, содержащихся в природном магнии
а) (24 . 78,6)/100 = 18,864;
б) (25 . 10,1)/100 = 2,525;
в) (26 . 11,3)/100 = 2,938.
Находим среднюю массу атома магния:
18,864 + 2,525 + 2,938 = 24, 327.
Ответ: Ar(Mg) = 24,327.
Задача 211.
Природный галлий состоит из изотопов 71Ga, 69Ga. В каком количественном соотношении находятся между собой числа атомов этих изотопов, если средняя атомная масса галлия равна 69,72.
Решение:
Для решения задач применим алгебраический метод расчёта:
Обозначим процентное содержание изотопа 69Ga через x. Тогда процентное содержание изотопа 71Ga будет равно 100 – x. масса изотопа 69Ga в атоме будет составлять 69 . (x/100). Масса изотопа 71Ga будет составлять 71 . (x/100).
В сумме масса обоих изотопов будет равняться атомной массе галлия:
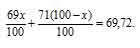
Освобождаемся от знаменателя и получим уравнение:
69x – 71x + 7100 = 69,72
Решаем его и, получаем:
-2x = -128x; x = 64
Значит, процент изотопа 69Ga составляет 64%, а процент изотопа 71Ga – 36% (100 – 64 = 100).
Теперь находим, в каком количественном соотношении находятся эти изотопы в природном галлии:
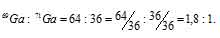
Ответ: 1,8 : 1.
Задача 212.
Найти массу изотопа 81Sr(T1/2 = 8,5ч), оставшуюся через 25,5 ч хранения, если первоначальная масса его составляла 200 мг.
Решение:
За время хранения радиоактивного изотопа прошло 3 периода полураспада (25,5/8,5 = 32). Массу нераспавшегося изотопа, оставшаяся после 25,5ч хранения, рассчитаем из уравнения:
mi = 2-n – m0, где
mi – масса изотопа, оставшаяся после хранения, m0 – исходная масса изотопа, n – период полураспада.
Тогда
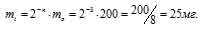
Ответ: 25мг.
Задача 213.
Вычислить процент атомов изотопа 128I(T1/2 = 25ч), оставшихся не распавшимися после его хранения в течение 2,5 ч.
Решение:
За время хранения радиоактивного изотопа прошло 6 периодов полураспада [(2,5 . 60)/25 = 6)]. Тогда процент атомов изотопа, оставшихся после радиоактивного распада, находим из формулы:
N% = 2-n . N0 . 100%, где
N% – процент атомов изотопа, N0 – первоначальное число ядер изотопа, n – число периодов полураспада.
Отсюда
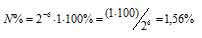
Ответ: 1,56%.
Задача 214.
Период полураспада 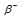 – радиоактивного изотопа 24Na равен 14,8 ч. Написать уравнение реакции распада и вычислить, сколько граммов дочернего продукта образуется из 24г 24Na за 29,6 ч.
– радиоактивного изотопа 24Na равен 14,8 ч. Написать уравнение реакции распада и вычислить, сколько граммов дочернего продукта образуется из 24г 24Na за 29,6 ч.
Решение:
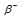 – распаду предшествует процесс
– распаду предшествует процесс 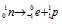 , протекающий в ядре; таким образом,
, протекающий в ядре; таким образом,
при испускании электрона заряд ядра увеличивается на единицу, а массовое число не изменяется. Дочернее ядро – изобар исходного – принадлежит элементу, стоящему следующим после исходного в таблице периодической системы химических элементов:
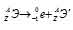
Уравнение радиоактивного распада должны удовлетворять правилу равенства сумм индексов.
Запишем уравнение реакции распада:
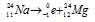
За время хранения 24Na прошло 2 периода полураспада (29,6/14,2 = 2). Массу не распавшегося изотопа, оставшуюся после 14,8ч хранения находим по формуле:
mi = 2-n – m0, где
mi – масса изотопа, оставшаяся после хранения, m0 – исходная масса изотопа, n – период полураспада.
Тогда
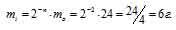
Таким образом, радиоактивному распаду подверглось 18г 24Na и столько же образовалось 24Mg (24 – 6 = 18).
Ответ: 18 г.
Когда вы смотрите на атомную массу элемента, скажем углерода, вы переходите к периодической таблице и смотрите под символом элемента. Это фактически средняя атомная масса элемента. Но в среднем из чего?
Большинство природных элементов имеют более одного изотопа. Изотопы элемента имеют разные массы, потому что они содержат разное количество нейтронов. При измерении атомной массы ученые останавливаются на использовании в среднем масса встречающейся в природе смеси изотопов.
Расчет средней атомной массы
Взгляните на углерод: естественное содержание углерода-12 и углерода-13 составляет 98,90% и 1,10% соответственно. Атомная масса углерода-12 составляет 12,00000 а.е.м. (атомная единица массы), а атомная масса углерода-13 составляет 13,00335 а.е.м.
Чтобы вычислить среднюю атомную массу, необходимо сначала перевести процентное содержание в десятичные дроби. Это означает, что при сложении содержания должны равняться единице. Чтобы преобразовать процентное содержание в десятичную дробь, разделите на 100.
Относительное содержание углерода-12 составляет 0,9890, а относительное содержание углерода-13 составляет 0,0110.
Затем вы умножаете дробное содержание на массу и складываете их вместе.
Так,
Средняя атомная масса углерода составляет 12,01 а.е.м. Это число указано в таблице Менделеева. Имеет смысл, что средняя атомная масса ближе к 12, поскольку относительное содержание углерода-12 намного больше, чем углерода-13.
Формула средней атомной массы
Вышеописанный процесс можно обобщить следующей формулой:
Здесь, м – масса конкретного изотопа, а ж – дробная численность. Пока все значения ж сложите до одного, все готово. Это хорошая проверка, чтобы убедиться, что вы делаете математику правильно.
Взгляните на этот пример расчета средней атомной массы магния. В таблице ниже содержится информация об изотопе, массе и содержании.
| Изотоп | Масса | Избыток |
|---|---|---|
|
24Mg |
23.98504 |
78.99% |
|
25Mg |
24.98583 |
10.00% |
|
26Mg |
25.98259 |
11.01% |
Вы можете использовать приведенную выше формулу, чтобы найти среднюю атомную массу.
Начните с преобразования процентов в дробную численность, разделив каждое число на 100. После этого таблица будет выглядеть следующим образом:
| Изотоп | Масса | Дробное изобилие |
|---|---|---|
|
24Mg |
23.98504 |
0.7899 |
|
25Mg |
24.98583 |
0.1000 |
|
26Mg |
25.98259 |
0.1101 |
Чтобы убедиться, что вы правильно выполнили математические расчеты и значения, которые у вас есть, верны, рекомендуется убедиться, что все дробные содержания в сумме равны единице.
Хорошо, в сумме получается один. Вы можете продолжить расчет.
Затем вы можете подставить массу и соответствующее относительное содержание в уравнение, описанное выше:
Ввод значений из таблицы дает:
Вместе это означает, что средняя атомная масса Mg составляет:
Очень важно отметить, что, хотя средняя атомная масса магния составляет 24,31 а.е.м., а средняя атомная масса углерода составляет 12,01 а.е.м., это не масса отдельного атома. Например, если вы собираетесь взять индивидуальный атом углерода (представьте, что это возможно!), тогда это будет либо 12.00 а.е.м., либо 13.000335 а.е.м. Было бы нет быть 12.01 а.е.м.
Таким же образом, когда вы берете любой отдельный атом магния, это будет 23,98504 а.е.м., 24,98583 а.е.м. или 25,98259 а.е.м. Средняя атомная масса – это просто способ для ученых определить стабильные изотопы элемента, существующие на Земле. Он не обозначает массу отдельного атома, если этот элемент не имеет только один стабильный изотоп.
Понимание определения атомной массы, атомного номера и атомного веса. Узнайте, как найти атомную массу, и узнайте, что представляет собой атомный номер.
Что такое атомный номер?
Атомный номер является наиболее важной частью информации, которая существует об атоме. Что означает атомный номер? Атомный номер атома всегда равен числу протонов, которые находятся в этом атоме. Это число обычно можно найти в периодической таблице над символом в поле элемента. Количество протонов в атоме аналогично ДНК человека; он отвечает за придание атому его наиболее заметных характеристик.
Атомные номера некоторых из самых известных атомов – водород (1), кислород (8), углерод (6), азот (7) и золото (79), как показано на рисунке. Число в скобках — это атомный номер, а также число протонов, которые были бы в одном атоме этого элемента.
Изотопы
Атомный номер (протоны) элемента никогда не изменится, но количество нейтронов определенно может измениться. В тех случаях, когда атом имеет неравное количество протонов и нейтронов, полученное вещество известно как изотоп. Любой элемент может иметь несколько версий существующих изотопов. Это происходит из-за количества протонов, остающихся постоянными, но либо приобретающих, либо теряющих нейтроны, чтобы сделать альтернативные версии исходного элемента. В результате альтернативных версий не все версии каждого элемента будут иметь одинаковую атомную массу. Однако электроны как в атомах, так и в изотопах будут иметь такое же количество, как и число протонов в этом атоме.
На изображении модели Бора только черно-белые частицы, обнаруженные в ядре атома, будут частью расчета, выполненного для определения массового числа.

Модель Бора, показывающая ядро
Изотопы различаются по количеству нейтронов, которые находятся в ядре того или иного элемента. Это приводит к атомам, которые имеют различные массовые числа. Массовое число отдельного атома находится путем сложения числа протонов и числа нейтронов в этом атоме. Например, если атом водорода содержит один протон и один нейтрон, он имеет массовое число 2 (водород-2). Другой изотоп водорода все еще должен иметь такое же количество протонов, но он имеет другое количество нейтронов. Например, атом с 1 протоном и 2 нейтронами имеет массовое число 3 (водород-3).
Изотоп элемента часто представлен так называемой дефисной нотацией, в которой за именем элемента следует дефис, а затем массовое число. Примером этого может быть углерод-14, где углерод имеет 6 протонов и 8 нейтронов.
Атомная масса
Атомная масса — это сумма протонов и нейтронов в атоме. Единица, которая часто ассоциируется с атомной массой, называется единицей атомной массы (amu). Из-за крошечной природы измеряемых масс субатомных частиц была создана единица, которая могла бы количественно оценить массу таким образом, чтобы ее можно было легко представить. Говорят, что и протоны, и нейтроны весят 1. Атомная масса является синонимом термина атомный вес, поэтому они могут использоваться взаимозаменяемо.
Как найти атомную массу
Периодическая таблица элементов
Атомная масса — это десятичное число, которое находится в каждой отдельной коробке периодической таблицы.
В периодической таблице, показанной здесь, несколько примеров атомной массы элементов из этой таблицы можно найти ниже:
- Водород = 1,00794
- Железо = 55.845
- Кислород = 15,9994
- Неон = 20.1797
Каждый элемент таблицы имеет свою атомную массу. Атомная масса определяется как средневзвешенное значение всех встречающихся в природе изотопов элемента. Средневзвешенное значение учитывает процентное содержание каждого изотопа. Например, если 80% элемента имеет массовое число 1, а 20% имеет массовое число 2, то массовое число 1 будет учитываться в 4 раза больше, чем массовое число 2, прежде чем они будут усреднены вместе.
Атомный вес: Атомная масса и изотопы
Атомная масса и атомный вес – это термины, которые часто используются взаимозаменяемо. В определениях этих двух терминов нет заметной разницы, хотя термины “вес” и “масса” не совсем синонимичны. Необходимость понимания средневзвешенных значений становится первостепенной при изучении концепции атомного веса.
Пример 1:
Вот теоретический пример того, как определить значение атомного веса элемента из периодической таблицы:
95% изотопов водорода составляют водород-1
3 % изотопов водорода составляют водород-2
2% изотопов водорода составляют водород-3
Средневзвешенное значение, известное как атомный вес, может быть рассчитано на основе этой информации путем умножения каждого процента на соответствующее массовое число, а затем суммирования полученных продуктов. В этом случае это выглядело бы как следующее уравнение:
(0,95 х 1) + ( 0,03 х 2) + (0,02 х 3) = 1,07 аме
Пример 2:
Если элемент натрий имеет 3 основных изотопа, которые встречаются в природе, средняя атомная масса будет рассчитана исходя из процентного содержания каждого изотопа, указанного здесь:
Содержание натрия-23 составляет 91%
Натрий-22 содержится в количестве 8%
Натрий-24 присутствует в количестве 1%
Чтобы определить среднюю атомную массу, необходимо выполнить следующие математические расчеты:
(23 x .91) + (22 x .08) + (24 x .01) = средняя атомная масса
средняя атомная масса = 20.93 + 1.76 + 0.24
Краткое содержание урока
Элементы состоят из протонов и нейтронов в ядре, которые составляют большую часть массы атома. Масса конкретного атома, которая является результатом суммы этих двух субатомных частиц, известна как массовое число. Все изотопы одного и того же элемента содержат одинаковое количество протонов, известных как . Все изотопы одного и того же элемента содержат одинаковое количество протонов, известных как the, и одинаковое количество электронов, но эти атомы могут не иметь одинакового количества нейтронов. Каждая различная форма атома, которая существует с различным числом нейтронов, известна как изотоп этого элемента. Изотопы элементов часто представляются через дефисные обозначения, которые фокусируются на массовом числе элемента. Название элемента, за которым следует дефис, а затем число, является традиционным способом представления конкретного изотопа и его массового числа.
Среднюю массу всех изотопов конкретного элемента можно найти в периодической таблице под символом каждого элемента. Это число известно как атомная масса или атомный вес. Это число представляет собой средневзвешенное значение, учитывающее процентное содержание каждого встречающегося в природе изотопа любого конкретного элемента. Элемент водород имеет атомную массу 1,01 аме, но представлен двумя разными изотопами, один из которых имеет массовое число 1, а другой – 2. Он имеет гораздо более высокое содержание изотопа с массовым числом 1. Это можно определить, сравнив массовое число каждого изотопа со средней атомной массой.
