Загрузить PDF
Загрузить PDF
Энергия связи является важным понятием в химии. Она определяет количество энергии, которое необходимо для разрыва ковалентной связи между двумя атомами газа.[1]
Данное понятие неприменимо по отношению к ионным связям.[2]
Когда два атома соединяются в молекулу, можно определить, насколько крепка связь между ними — достаточно найти энергию, которую необходимо затратить для разрыва этой связи. Помните, что единичный атом не обладает энергией связи, эта энергия характеризует силу связи двух атомов в молекуле. Чтобы рассчитать энергию связи для какой-либо химической реакции, просто определите общее количество разорванных связей и вычтите из него количество образовавшихся связей.
-

1
Запишите уравнение для вычисления энергии связи. Согласно определению, энергия связи представляет собой сумму разорванных связей за вычетом суммы сформированных связей: ΔH = ∑H(разорванные связи) – ∑H(образовавшиеся связи). ΔH обозначает изменение энергии связи, которое называют также энтальпией связи, а ∑H соответствует сумме энергий связи для обеих частей уравнения химической реакции.[3]
- Данное равенство выражает закон Гесса.
- Энергия связи измеряется в килоджоулях на моль (кДж/моль).[4]
-

2
Запишите химическое уравнение и обозначьте все связи между отдельными элементами. Если дано уравнение реакции в виде химических символов и цифр, полезно переписать его и обозначить все связи между атомами. Такая наглядная запись позволит вам легко посчитать связи, которые разрываются и образуются в ходе данной реакции.
- Помните, что в левой части уравнения расположены реагенты, а в правой — продукты реакции.
- Одинарные, двойные и тройные связи обладают разной энергией, поэтому будьте внимательны и правильно обозначайте связи между различными элементами.[5]
- К примеру, рассмотрим следующую реакцию: H2(газ) + Br2(газ) —> 2 HBr(газ)
- H-H + Br-Br —> 2 H-Br
-

3
Изучите правила подсчета разорванных и образовавшихся связей. В большинстве случаев при расчетах используются средние значения энергии связи.[6]
Одна и та же связь может иметь немного разную энергию, в зависимости от конкретной молекулы, поэтому обычно используют средние значения энергии связи.[7]
.- Разрывы одинарной, двойной и тройной химической связи рассматриваются как одна разорванная связь. Хотя эти связи обладают разными энергиями, в каждом случае считается, что разрывается одна связь.
- То же самое относится и к образованию одинарной, двойной или тройной связи. Каждый такой случай рассматривается как формирование одной новой связи.
- В нашем примере все связи являются одинарными.
-

4
Определите, какие связи разрываются в левой части уравнения. Левая часть химического уравнения содержит реагирующие вещества, и в ней представлены все связи, которые разрываются в результате реакции. Это эндотермический процесс, то есть для разрыва химических связей необходимо затратить определенную энергию.[8]
- К нашем примере левая часть уравнения реакции содержит одну связь H-H и одну связь Br-Br.
-

5
Подсчитайте количество образовавшихся связей в правой части уравнения. Справа указаны продукты реакции. В этой части уравнения представлены все связи, которые образуются в результате химической реакции. Это экзотермический процесс, и он протекает с выделением энергии (обычно в виде тепла).[9]
- В нашем примере в правой части уравнения содержатся две связи H-Br.
Реклама
-

1
Найдите необходимые значения энергии связи. Есть множество таблиц, в которых приведены значения энергии связи для самых разных соединений. Такие таблицы можно найти в интернете или справочнике по химии. Следует помнить, что значения энергии связи всегда приводятся для молекул в газообразном состоянии.[10]
- Для нашего примера необходимо найти значения энергии связей H-H, Br-Br и H-Br.
- H-H = 436 кДж/моль; Br-Br = 193 кДж/моль; H-Br = 366 кДж/моль.[11]
- Чтобы вычислить энергию связи для молекул в жидком состоянии, необходимо также найти энтальпию испарения данной жидкости. Это количество энергии, которое необходимо для перевода вещества из жидкого в газообразное состояние.[12]
Данное значение прибавляется к общей энергии связи.- Например, в случае воды необходимо добавить в уравнение энтальпию испарения воды (+41 кДж).[13]
- Например, в случае воды необходимо добавить в уравнение энтальпию испарения воды (+41 кДж).[13]
-

2
Умножьте значения энергии связи на число разорванных связей. В ряде реакций одна связь может разрываться несколько раз.[14]
Например, если молекула состоит из 4 атомов водорода, то энергию связи водорода следует учесть 4 раза, то есть умножить на 4.- В нашем примере каждая молекула имеет по одной связи, поэтому значения энергии связи просто умножаются на 1.
- H-H = 436 x 1 = 436 кДж/моль
- Br-Br = 193 x 1 = 193 кДж/моль
-

3
Сложите все энергии разорванных связей. После того как вы умножите значения энергий связи на соответствующее количество связей в левой части уравнения, необходимо найти общую сумму.[15]
- Найдем суммарную энергию разорванных связей для нашего примера: H-H + Br-Br = 436 + 193 = 629 кДж/моль.
-

4
Умножьте значения энергии связи на количество образовавшихся связей. Как и в случае с разорванными связями в левой части уравнения, следует взять значения энергий связи в правой части уравнения и умножить их на соответствующее число этих связей.[16]
Например, если образуется четыре связи между атомами водорода, необходимо умножить энергию данной связи на 4.- В нашем примере образуется две связи H-Br, поэтому энергию связи H-Br (366 кДж/моль) следует умножить на 2: 366 x 2 = 732 кДж/моль.
-

5
Сложите все энергии образовавшихся связей. Как и в случае разорванных связей, следует сложить все энергии образовавшихся связей, которые представлены в правой части уравнения.[17]
Если в результате реакции образуется лишь одно вещество, данный шаг можно пропустить.- В нашем примере образуется одно вещество, поэтому энергия сформировавшихся связей равна удвоенной энергии связи H-Br, то есть 732 кДж/моль.
-

6
Вычтите энергию образовавшихся связей из энергии разорванных связей. После того как вы сложите все связи в левой и правой частях уравнения, просто отнимите от разорванных связей образовавшиеся связи. Вспомните приведенное выше уравнение: ΔH = ∑H(разорванные связи) – ∑H(образовавшиеся связи). Подставьте вычисленные значения и найдите разность.
- Для нашего примера имеем: ΔH = ∑H(разорванные связи) – ∑H(образовавшиеся связи) = 629 кДж/моль – 732 кДж/моль = -103 кДж/моль.
-

7
Определите, является ли реакция эндотермической или экзотермической. Последний шаг при вычислении энергии связи состоит в том, чтобы выяснить, поглощается или выделяется энергия в ходе данной реакции. При эндотермических реакциях энергия поглощается, и итоговая энергия связи имеет положительное значение, в то время как при экзотермических реакциях энергия выделяется, и энергия связи принимает отрицательные значения.[18]
- В нашем примере общая энергия связи отрицательна, то есть рассмотренная реакция является экзотермической.
Реклама
Об этой статье
Эту страницу просматривали 26 406 раз.
Была ли эта статья полезной?
Энергия связи
Важное значение
имеет энергетическая характеристика
химической связи. При образовании
химической связи общая энергия системы
(молекулы) меньше энергии составных
частей (атомов), т.е. Е(AB)<Е(А)+Е(B).
Энергия связи
– это энергия, которая выделяется при
образовании молекулы из атомов. Энергию
связи обычно выражают в кДж/моль (или
ккал/моль). Это одна из важнейших
характеристик химической связи. Более
устойчива та система, которая содержит
меньше энергии. Известно, например, что
атомы водорода стремятся объединиться
в молекулу. Это означает, что система,
состоящая из молекул Н2содержит
меньше энергии, чем система, состоящая
из такого же числа атомов Н, но не
объединенных в молекулы.
Для
двухатомных молекул энергия связи равна
энергии диссоциации. Для многоатомных
молекул с одним типом связи средняя
энергия связи равна 1/n
части распада молекулы на атомы. Энергия
распада метана на атомы равна 1649 кДж/моль.
В молекуле метана имеются четыре
равноценные связи С-Н поэтому средняя
энергия такой связи равна Ес-н = 1649/4 =
412 кДж/моль. оль.
Таблица
3 Длина
и энергия разрыва связей
|
d |
E |
d |
E |
||
|
C-H |
109 |
416 |
C=O |
116 |
695 |
|
C-F |
138 |
485 |
O-H |
96 |
467 |
|
C-Cl |
176 |
327 |
O-O |
148 |
146 |
|
C-Br |
194 |
285 |
S-H |
135 |
347 |
|
C-I |
214 |
213 |
N-H |
101 |
391 |
|
C-C |
154 |
356 |
As-H |
152 |
247 |
|
C=C |
134 |
528 |
|||
|
C≡C |
813 |
При переходе от одинарной связи двойной и тройной (между одними и теми же атомами) энергия связи возрастает, однако связь укрепляется непропорцианально увеличению её кратности.
Таблица
3 показывает:
а)закономерное
изменение энергии для однотипных
связей(C-F>C-Cl>C-Br>C-I),
Б)что длина связи уменьшается с возрастанием порядка или кратности связи, а прочность увеличивается с уменьшением длины связи.
Металлическая связьвозникает в
результате частичной делокализации
валентных электронов, которые достаточно
свободно движутся в решетке металлов,
электростатически взаимодействуя с
положительно заряженными ионами. Силы
связи не локализованы и не направлены,
а делокализированные электроны
обусловливают высокую тепло- и
электропроводность.
Химическая
связь в твердых телах.Свойства
твердых веществ определяются природой
частиц, занимающих узлы кристаллической
решетки и типом взаимодействия между
ними.
Твердые
аргон и метан образуют атомные и
молекулярные кристаллы соответственно.
Поскольку силы между атомами и молекулами
в этих решетках относятся к типу слабых
ван-дер-ваальсовых, такие вещества
плавятся при довольно низких температурах.
Большая часть веществ, которые при
комнатной температуре находятся в
жидком и газообразном состоянии, при
низких температурах образуют молекулярные
кристаллы.
Температуры плавления ионных кристаллов
выше, чем атомных и молекулярных,
поскольку электростатические силы,
действующие между ионами, намного
превышают слабые ван-дер-ваальсовы
силы. Ионные соединения более твердые
и хрупкие. Такие кристаллы образуются
элементами с сильно различающимися
электроотрицательностями (например,
галогениды щелочных металлов). Ионные
кристаллы, содержащие многоатомные
ионы, имеют более низкие температуры
плавления; так для NaCl tпл.= 801 °C,
а для NaNO3tпл= 306,5 °C.
Пример
1.Каким типом гибридизации АО бериллия
описывается образование молекулы
хлорида бериллия? Какова конфигурация
этой молекулы?
Решение:
Возбужденный
атом бериллия имеет конфигурацию 2s12p1.
Поэтому можно считать, что в образовании
химических связей могут участвовать
не одинаковые, а различные атомные
орбитали. В молекуле BeCl2должны
быть неравноценные по прочности и
направлению связи, причем σ-связи из
p-орбиталей должны быть более прочными,
чем связи из s-орбиталей, т.к. для
p-орбиталей имеются более благоприятные
условия для перекрывания. Однако опыт
показывает, что в молекулах, содержащих
центральные атомы с различными валентными
орбиталями (s, p, d), все связи равноценны
– это объясняет метод гибридизации. В
данном случае имеет местоsp-
гибридизация
При
образовании молекулы одна s- и одна
р-орбиталь образуют две гибридные
sp-орбитали под углом 180о.
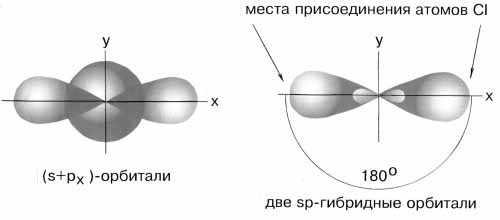
sp-гибридные орбитали
Экспериментальные
данные показывают, что все галогениды
Be, а также Zn, Cd и Hg (II) линейны и обе связи
имеют одинаковую длину.
Пример
2. Определите тип гибридизации орбиталей
центрального атома в молекулеBF3.
Какова конфигурация этой молекулы?
Решение:
Возбуждённый
атом бора имеет конфигурацию 2s12p2.
В результате
гибридизации одной s-орбитали и двух
p-орбиталей образуются три гибридные
sp2-орбитали, расположенные в одной
плоскости под углом 120одруг к
другу.
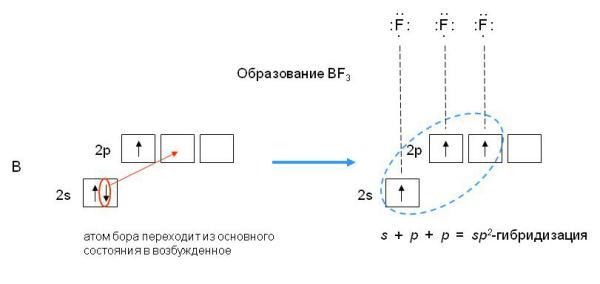
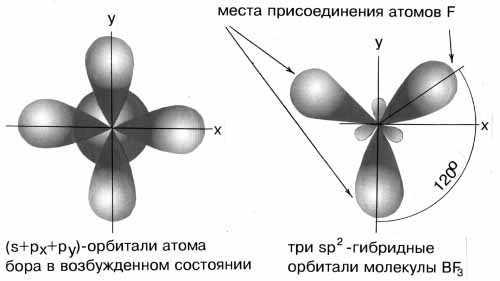
sp2-гибридизация
Пример
3. Каким типом гибридизации АО азота
описывается образование молекулы
аммиака?
Решение:
В результате
гибридизации 2sи трёх 2pорбиталей азота образуются четыре
гибридные орбиталиsp
3 . Конфигурация молекулы
представляет из себя искажённый тетраэдр,
в котором три гибридных орбитали
участвуют в образовании химической
связи, а четвёртая с парой электронов
– нет. Углы между связямиN-Hне равны 90 о как в пирамиде, но и
не равны 109,5 о , соответствующие
тетраэдру.
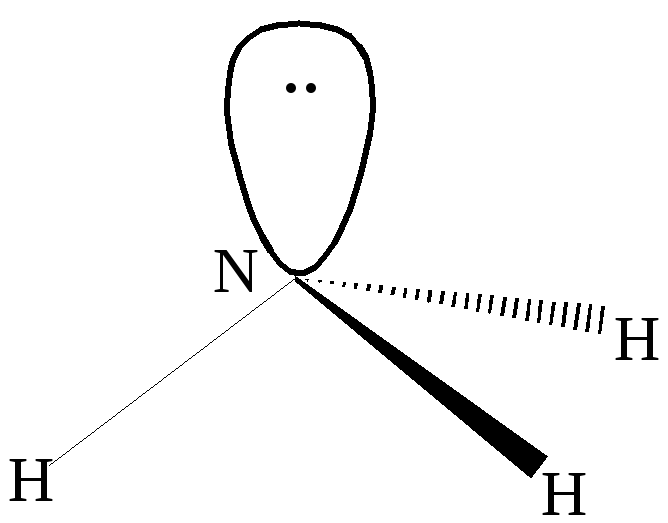
sp3–
гибридизация в молекуле аммиака
При взаимодействии
аммиака с ионом водорода в результате
донорно-акцепторного взаимодействия
образуется ион аммония, конфигурация
которого представляет собой тетраэдр.
Пример
4.Объяснить с позиций метода МО
возможность существования молекулярного
иона Не2+
Решение:
В
молекулярном ионе Не2 + имеется три электрона.На связывающей
орбитали размещены два электрона,а на
разрыхляющей –один. Следовательно
кратность связи равна 0, и он должен быть
энергетически устойчивым.
Пример
5.Определите энергию связи
кислород-водород в молекуле Н2О
если энергия связи Н-Н и
О-О
соответственно равны -435,9 и -498,7 кДж/моль
а при сгорании 2 моль кислорода выделяется
483,68 кДж теплоты.
Решение:
Процесс
образования молекулы воды можно
представить следующим образом: рвутся
связи водород-водород и кислород-кислород
а образовавшиеся атомы соединяются в
молекулы Н2О каждая из которых
содержит две связи кислород-водород:
4Н(г) =
2Н2(г) – 435,9∙2
2О(г) =
О2(г) – 498,7
2Н2(г)
+ О2(г) = 2Н2О(г) – 483,68
—————————————————-
4Н(г) +
2О(г) = 2Н2О(г) – 1854,18 кДж
В двух
молекулах Н2О четыре связи
кислород-водород; средняя энергия связи
кислород – водород равна: -1854,18 / 4 = –
463,54 кДж/моль
ЗАДАЧИ
ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1.Определите
тип гибридизации орбиталей центрального
атома в следующих молекулах и укажите
геометрическую форму этих молекул:
AlBr3,
BeF2,
CF4,
BBr3,
H2O,
SF6,
SiCl4,
NH3,
CH4,
AlCl3,
BCl3
Полярны
ли эти молекулы?
2.Определите
тип гибридизации орбиталей центрального
атома в следующих частицах и укажите
геометрическую форму этих частиц:
NH4+,
GaCl4–,
H3O+,BF4–,
SiF62-,
AlF63-,
SO42-,
PO43-.
3.Составьте
энергетическую диаграмму МО для следующих
частиц и определите порядок связи в
них:
H2,H2+,H2–,He2,
HeH, He2+,
Li2,
Be2,
B2,
N2,
N2+,
O2,
O2–,
O2+,
CO, CO+,
NO, NO+,
NO–.
4.
Пользуясь
таблицей относительных электроотрицательностей,
определите,какая
из связей является наиболее полярной:Са-Н,
I-C1.C-S.
5.
В
каком из приведенных соединений:LiF,
BeF
,BF
,CF
связь
Э-F будет
больше всего
приближаться
к ковалентной?
6.
Как
изменяется прочность связи в
ряду:НF-НСl-НВг-Н1?
7.
При
переходе от NaF
к Nal
температура плавления кристаллов
уменьшается. Объясните наблюдаемый ход
изменения температур плавления.
8.
BaCl2
в водных растворах -сильный электролит,a
HgCl2-слабый
электролит. Объясните это различие в
свойствах солей.
9.
Сероводород при обычной температуре
–
газ, а вода- жидкость. Чем можно объяснить
это различие в свойствах?
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
12.02.20151.51 Mб20POSOBIE_DLQ_PODGOTOVKI_K_EKZAMENU.rtf
- #
12.02.20153.69 Mб1918Posobie_dlya_10kl_gl_var.doc
- #
- #
- #
- #
- #
- #
- #
Виктор Матвеевич Скоков
Эксперт по предмету «Физика»
Задать вопрос автору статьи
Количество независимых переменных, которыми определяется состояние системы, называют числом степеней свободы. Для полной характеристики энергетического состояния движения материальной точки в момент времени t требуется задать три компоненты скорости для того, чтобы определить кинетическую энергию и три координаты, чтобы определить потенциальную энергию, получается всего необходимо шесть переменных. В случае динамического рассмотрения движения материальной точки эти переменные являются зависимыми. Статистическая система, которая состоит из n точек, имеет 6n степеней свободы. Из них 3n степеней свободы — носители кинетической энергии и 3n — носители потенциальной энергии, если система находится в поле внешних сил или частицы взаимодействуют между собой.
Степени свободы
Степени свободы делят на: поступательные, вращательные и колебательные. Три степени свободы материальной точки – поступательные. Система из n материальных точек, между которыми нет жестких связей имеет 3 n степени свободы. Каждая жесткая связь уменьшает число степеней свободы на единицу. Рассмотрим молекулу, состоящую из двух атомов, если считать, что между атомами существует одна жесткая связь, то такая молекула имеет пять степеней свободы, три поступательные и две вращательные. Если связь квазиупругая, то степеней свободы будет шесть, причем из них три поступательные, две вращательные и одна колебательная. Трехатомной нелинейной молекуле с жесткой связью между атомами нужно приписать шесть степеней свободы – три поступательные, три вращательные. Поступательные степен свободы не имеют преимуществ друг перед другом.

Сдай на права пока
учишься в ВУЗе
Вся теория в удобном приложении. Выбери инструктора и начни заниматься!
Получить скидку 3 000 ₽
Средняя энергия молекулы
Согласно закону равномерного распределения энергии по степеням свободы на каждую степень свободы в среднем приходится одинаковая кинетическая энергия равная $leftlangle {varepsilon }_irightrangle =frac{1}{2}kT$. В таком случае можно сказать, что средняя энергия молекулы $leftlangle {varepsilon } rightrangle$ равна:
где $i=m_{post}+m_{vr}+2m_{kol}$- сумма числа поступательных, вращательных и удвоенного количества колебательных степеней свободы, $k$ — постоянная Больцмана, T- термодинамическая температура. Возникновение коэффициента 2 при подсчёте энергии колебаний объясняется просто: При колебаниях частица имеет как кинетическую, так и потенциальную энергии. Если колебания гармонические, то эти энергии в среднем равны друг другу. Соответственно, $leftlangle {varepsilon }_{kol}rightrangle =kT$.
Закон равномерного распределения энергии по степеням свободы является приближенным, так как получен на основе классической механики и нарушается, если существенными становятся квантовые эффекты.
«Энергия молекул» 👇
Необходимо отметить, что поступательно могут двигаться только молекулы газов.
Из(1) следует, что одноатомные молекулы имеют среднюю кинетическую энергию:
Полную энергию i частицы можно представить:
[{varepsilon }_i=frac{1}{2}m_i{v_i}^2+frac{1}{2}left(J_{i1}{w_{i1}}^2+J_{i2}{w_{i2}}^2+J_{i3}{w_{i3}}^2right)+sumlimits_j{frac{m_{ij}{{eta }_{ij}}^2}{2}}+sumlimits_j{frac{k_{ij}{{xi }_{ij}}^2}{2}}+U_ileft(x_i,y_i,z_iright) left(3right),]
где $U_ileft(x_i,y_i,z_iright)$- потенциальная энергия сложной частицы во внешних полях, ${xi }_{ij}$- отклонение от положения равновесия частицы при колебаниях, ${eta }_{ij}$- скорость колебательных движений частицы, первый индекс обозначает номер сложной частицы, второй определяет номер частицы внутри сложной, $v_i$ — скорость центра масс сложной частицы, $m_i$- масс частицы, $J_1,J_2,J_3$- моменты инерции вращения частицы, $w_1,w_2,w_3$ — угловые скорости вращения частицы относительно ее главных осей. Индекс j принимает столько значений, сколько необходимо, чтобы исчерпать все степени свободы сложной частицы.
Пример 1
Задание: Сравните средние энергии молекул кислорода и азота при одинаковых температурах.
Решение:
Кислород имеет двухатомную молекулу ($O_2)$, предположим, что связь между атомами жесткая, следовательно, молекула кислорода обладает пятью степенями свободы (тремя поступательными и двумя вращательными). Из закона равномерного распределения энергии по степеням свободы имеем средняя энергия молекулы:
[leftlangle varepsilon rightrangle =frac{i}{2}kTto leftlangle {varepsilon }_{O_2}rightrangle =frac{5}{2}kT left(1.1right)]
Азот имеет двухатомную молекулу ($N_2)$, предположим, что связь между атомами жесткая, следовательно, молекула азота также обладает пятью степенями свободы. Соответственно:
[leftlangle {varepsilon }_{N_2}rightrangle =frac{5}{2}kTleft(1.2right).]
Ответ: Средние энергии молекул кислорода и азота при одинаковых температурах одинаковы.
Пример 2
Задание: Водород находится в сосуде при температуре T=300K. Определите среднюю энергию вращательного движения молекул.
Решение:
Основой для решения задачи является закон равномерного распределения энергии по степеням свободы. Из него известно, что на каждую степень свободы приходится в среднем энергия $leftlangle {varepsilon }_irightrangle $, равная:
[leftlangle {varepsilon }_irightrangle =frac{1}{2}kT left(2.1right).]
Следовательно, чтобы решить задачу, осталось определить, сколько вращательных степеней свободы имеет молекула водорода. Для этого вспомним химическую формулу водорода:
[H_2.]
В молекуле имеется два атома, если молекула жесткая, то общее число степеней свободы такой молекулы будет равно пяти. Из них три приходятся на поступательные степени свободы, на вращательные степени свободы остается две степени. Соответственно:
[leftlangle {varepsilon }_{vr}rightrangle =frac{2}{2}kT=kTleft(2.2right)]
Проведем расчет:
[leftlangle {varepsilon }_{vr}rightrangle =1,38cdot {10}^{-23}cdot 300=4,14cdot {10}^{-21}(Дж)]
Ответ: Средняя энергия вращательного движения молекул водорода при заданных условиях равна $4,14cdot {10}^{-21}Дж$.
Пример 3
Задание: Чему равна суммарная средняя кинетическая энергия молекул двухатомного газа, заключенного в объеме 4 л при давлении 1,47 $cdot {10}^5$Па? Молекулы считать жесткими.
Решение:
Жесткие двухатомные молекулы имеют пять степеней свободы. Средняя энергия движения молекулы определяет формула:
[leftlangle varepsilon rightrangle =frac{i}{2}kTto leftlangle varepsilon rightrangle =frac{5}{2}kTleft(3.1right).]
Следовательно кинетическая энергия всех N молекул газа может быть найдена, как:
[leftlangle Erightrangle =frac{5}{2}NkT left(3.2right).]
Из уравнения состояния идеального газа:
[p=nkT, где n=frac{N}{V}to pV=NkTleft(3.3right).]
Подставим в (3.2) уравнение из (3.3), получим:
[leftlangle Erightrangle =frac{5}{2}pV left(3.4right).]
Переведем данные в СИ: V=4 л=4$cdot {10}^{-3}м^3$
Проведем расчет:
[leftlangle Erightrangle =frac{5}{2}1,47 cdot {10}^5cdot 4cdot {10}^{-3}=1470 (Дж)]
Ответ: Суммарная средняя кинетическая энергия молекул двухатомного газа при заданных условиях равна $1470 Дж.$
Находи статьи и создавай свой список литературы по ГОСТу
Поиск по теме




Энергия химической связи
- Энергия химических связей. Мера прочности химической связи Энергия связи. Его ценность определяется работой, необходимой для разрушения Приобретение энергии при образовании веществ из связей, или отдельных атомов. Например, энергия связи H-H молекулы водорода составляет 435 кДж / mol. It есть При образовании газообразного водорода 1 моль、 Атомы по уравнению H + H = H2 + 435 кДж / моль 435 кДж-это assigned.
- It необходимо потратить такое же количество энергии 1. распад моля на атомное состояние H2(атомная энергия молекулы). Образование многоатомных молекул, содержащих одинаковые связи(пример: Метан (SS или молекула воды), средняя энергия связи в единице 1 моль Вещество определяется путем деления энергии образования этого вещества от изолятора Атомы числа bonds. Она определяется уравнением C + 4H = CH4 + 1647 кДж / моль、 2H + O = H20 + 924 кДж / моль
In приведенный выше пример, Энергия образования
Людмила Фирмаль
Таким образом, средняя энергия связей C-H и O — H составляет 1647, соответственно.4= 412 кДж / моль и 924: 2 = 462 кДж / mol. To определите энергию одной связи Необходимо разделить Среднюю энергию на число Авогадро. Каждое сообщение Является молекулярным эквивалентом, подлежащим рассмотрению. Понятие энергии связи универсально и одинаково Он может быть применен как к молекулярным, так и к кристаллическим состояниям. Но Величина энергии связи при переходе от молекулы к Кристаллу изменяется、
Номер регулировки и состояние энергии от Атомы. Когда кристалл формируется из молекулы газа、 Получение энергии путем регулярного расположения атомов Кристалл lattice. To оцените этот выигрыш, нужно сравнить следующее Энергия разрыва связи между кристаллом и молекулой газа.
Разъединить Среди молекул могут быть выполнены гумолитически (с образованием нейтральности Атомов) и гетеролитов (с образованием ионов).О первой молекуле NaCl С помощью равенств NaCl (g)= Na (g)+ C1 (g) −414 кДж / моль、 Необходимо потратить 414 кДж / mol. In неравномерный коллапс NaCl (g)= Na +(g)+ C1 «(g)-548 кДж / моль Эта энергия увеличивается на 134 кДж / моль. Связи внутри кристалла также разрушаются. По механизмам гемолиза и гетерогенным системам: NaCl (tv)= Na (g)+ C1 (g) −644 кДж / моль, (I) NaCl (tv)= Na +® v + C1 «(g) −778 кДж / моль.(ВТОРОЙ)
- Уравнение (I) представляет собой процесс сублимации кристаллического NaCl и、 Низкий моноатомный компонент пара. Совместимость энергетической пулемет F44 кДж / моль) Она называется атомной энергией кристаллической compounds. In образование Энергия свободного Иона газа, требуемая по формуле (II) Размер, разрешенный для реализации этого виртуального процесса, равен、
Так называемый энергетический знак противоположен положению Кристалла. Энергия кристаллической соли NaCl представляют гобой Рывки, взятые в противоположном знаке, составляют более 230 кДж / моль Молекула газа F44-414 = 778-548).Э
нергия разрушения связывания в Homo Как в молекуле, так и в Кристалле растворение и неоднородность Начните с того же значения 134 кДж / моль.
Людмила Фирмаль
Представлять Разница между энергией ионизации натрия (-495.3 кДж / моль) и энергии сродства Хлор до C61. 5 кДж / моль электронов) и определить необходимую энергию Для образования газообразных ионов Na *и C1 «из изолированных атомов. Поэтому природа химического вещества такова Из газообразных молекул Кристаллические твердые тела главным образом влияют на энергию скрепления В разных агрегатных состояниях.
Энергия связи рядов однотипных соединений Как для молекул газа, так и для кристаллов законы меняются Мы будем измерять его. На рис. 24, c, b показано изменение энергии связи галогенидного столба Газообразные молекулы и кристаллические щелочные металлы.3 в основном. закон nary: во-первых, энергия связи уменьшается по мере ее увеличения Атомный номер элемента. Во-вторых, энергия связи кристаллов всегда высока、
Чем соответствующая молекула; в-третьих, энергия диссоциации путем гемолиза Как молекулярный, так и кристаллический механизмы ниже, чем гетеролитный механизм Поэтому при нагревании эти соединения не разлагаются и распадаются на атомы С ионами. Отмеченная закономерность универсальна、 Нью-Йорк имеет другой тип взаимодействия и общения.
Смотрите также:
Решение задач по химии

прочность химической связи
В химии, энергия связи (BE), также называемая средняя энтальпия связи или средняя энтальпия связи – это мера прочности связи в химической связи. IUPAC определяет энергию связи как среднее значение энергии диссоциации связи в газовой фазе (обычно при температуре 298,15 К) для всех связей одного типа в пределах одного и того же химического соединения. Чем больше средняя энергия связи, приходящаяся на одну электронную пару связи, в молекуле, тем более устойчива и с меньшей энергией молекула.
Энергия диссоциации связи (энтальпия) также называется энергией разрыва связи, связью энергия, прочность связи или энергия связи (сокращение: BDE, BE или D). Он определяется как стандартное изменение энтальпии следующего деления: R – X → R + X. BDE, обозначаемый Dº (R – X), обычно выводится с помощью термохимического уравнения,
- D ∘ (R – X) Знак равно △ ЧАС е (R) + △ ЧАС е ∘ (X) – △ H е (RX) { displaystyle { begin {array} {lcl} mathrm {D ^ { circ} (R-} X) = bigtriangleup H_ {f} ^ { circ} mathrm {(R)} + bigtriangleup H_ {f} ^ { circ} (X) – bigtriangleup H_ {f} ^ { circ} ( mathrm {R} X) end {array}}}
энтальпия образования ΔHfº большого количества атомов, свободных радикалов, ионов, кластеров и соединений доступна на сайтах NIST, NASA, CODATA и IUPAC. Большинство авторов предпочитают использовать значения BDE при 298,15 К.
Например, энергия связи углерод – водород в метане BE (C – H) – изменение энтальпии (∆H) разрушения одной молекулы метана на атом углерода и четыре радикала водорода , деленное на четыре. Точное значение для определенной пары связанных элементов несколько варьируется в зависимости от конкретной молекулы, поэтому приведенные в таблице энергии связи обычно являются средними для ряда выбранных типичных химических соединений, содержащих этот тип связи.
Энергия связи (BE) представляет собой среднее значение всех энергий диссоциации связи одного типа связи в данной молекуле. Энергии диссоциации связи нескольких различных связей одного и того же типа могут различаться даже в пределах одной молекулы. Например, молекула воды состоит из двух связей O – H, связанных как H – O – H. Энергия связи для H 2 O – это средняя энергия, необходимая для разрыва каждой из двух связей O – H в последовательности:
- H – O – H → H ⋅ + ⋅ O – HBDE 1 ⋅ O – H → ⋅ O ⋅ + ⋅ HBDE 2 H – O – H → H ⋅ + ⋅ O ⋅ + ⋅ HBE = (BDE 1 + BDE 2) / 2 { displaystyle { begin {array} {lcl} mathrm {HOH} rightarrow mathrm {H cdot + cdot OH} BDE_ {1} \ mathrm { cdot OH} rightarrow mathrm { cdot O cdot + cdot H} BDE_ { 2} \ mathrm {HOH} rightarrow mathrm {H cdot + cdot O cdot + cdot H} BE = (BDE_ {1} + BDE_ {2}) / 2 \ end { array}}}
Хотя эти две связи эквивалентны в исходной симметричной молекуле, энергия диссоциации связи кислород-водород незначительно меняется в зависимости от того, есть ли другой атом водорода, связанный с атомом кислорода.
Когда связь разорвана, пара связывающих электронов разделится на продукты поровну. Этот процесс называется гомолитическим разрывом связи (гомолитический разрыв; гомолиз) и приводит к образованию радикалов.
Содержание
- 1 Как предсказать прочность связи по радиусу
- 2 Факторы, влияющие на энергию ионной связи
- 3 См. Также
- 4 Ссылки
Как предсказать прочность связи по радиусу
Металлический радиус, ионный радиус и ковалентный радиус каждого атома в молекуле можно использовать для оценки прочности связи. Например, ковалентный радиус бора оценивается в 83,0 пм, но длина связи B – B в B 2Cl4составляет 175 пм, что является значительно большим значением. Это указывало бы на то, что связь между двумя атомами бора является довольно слабой одинарной связью. В другом примере металлический радиус рения составляет 137,5 пм, а длина связи Re-Re составляет 224 пм в соединении Re 2Cl8. Из этих данных можно сделать вывод, что облигация является очень прочной или четверной облигацией. Этот метод определения наиболее применим для ковалентно связанных соединений.
Факторы, влияющие на энергию ионной связи
электроотрицательность двух связанных вместе атомов влияет на энергию ионной связи. Чем дальше электроотрицательность двух атомов, тем сильнее связь в целом. Например, у цезия самое низкое, а у фтора самое высокое, и они образуют самую прочную ионную связь (по крайней мере, одинарную связь). Предполагается, что самой сильной полярной ковалентной связью является связь углерод-фтор. И в большинстве случаев ионные связи сильнее ковалентных. Посредством проверки точек плавления ионные соединения имеют высокие точки плавления, а ковалентные соединения – низкие точки плавления.
См. Также
- Энергия связи
- Энергия ионизации
- Изодесмическая реакция
- Энергия решетки


