Физическую величину, являющуюся мерой взаимодействия материи, то есть перехода из одного состояния в другое, называют энергией. Кинетическая средняя величина определяет перемещение материальной точки. Это понятие было введено Готфридом Вильгельмом Лейбницем, который и сформулировал закон сохранения силы. Фактически это работа движения, зависящая от направления и скорости. Важное значение здесь имеет выбранная система отсчёта.
Оглавление:
- Общие сведения
- Движение частиц
- Температура и энергия
- Решение задач
Общие сведения
В природе есть два закона сохранения: импульса и момента. Они являются следствием свойств пространства. Другими словами, описываются однородностью какого-либо выделенного места и изотропностью. Все направления в пространстве считаются равноправными.
В седьмом классе изучают силу, характеризующуюся работой. Если на тело оказывается воздействие, приводящее к движению, то возникает действие. Например, пусть имеется спица, на которую нанизана бусинка. Она может свободно перемещаться по ней, если к телу приложена сила. Её направление по касательной к спице можно обозначить как F1. Угол, образованный между направлением силы и движения, пусть будет J1.
Чтобы бусинка двигалась по прямой, на неё должны действовать другие силы. Это воздействие определяется реакцией спицы. Представить её можно в виде упругости F2 и трения F3. Углы, которые образуются после перемещения S, можно обозначить так: между F2 и вектором — J2, S и F3 — J3.
Второй закон Ньютона в векторной форме записывается как F1 + F2 + F3 = m * a. Это уравнение можно рассмотреть в проекции вдоль спицы на ось икс. Она имеет следующий вид: F1 * cos (J1) + F2 * cos (J2) + F3 * cos (J3) = m * ax. Пусть силы будут постоянные по направлению и модулю. Справа и слева стоит постоянное число, следовательно, движение будет равноускоренным.
Проекцию вектора перемещения можно записать так: Sa = (Vx2- Vox2) / 2ax. Отсюда: ax = (Vx2- Vox2) / 2 Sx, где Vx — конечная скорость, V0 — начальная. Полученную формулу можно подставить во второй закон Ньютона. В результате получится: F1 * cos (J1) + F2 * cos (J2) + F3 * cos (J3) = m * (Vx2 — V02) / 2 Sx.
Проекция перемещения равна модулю. Левую и правую часть можно умножить на него. В дроби равенства стоят квадраты проекции, поэтому: Sx = S; Vx2 = V2; Vox2 = V02. Учитывая соотношения и разбив дробь на слагаемые, умноженные на массу, можно получить выражение: F1 * cos (J1) + F2 * cos (J2) + F3 * cos (J3) = (m * Vx 2) / 2 — (mV0 2) / 2.
В левой части есть три однотипных слагаемых F * S * cos (J). Эту физическую величину называют работой и обозначают буквой A. Но справедливо равенство только для постоянной силы. Измеряется она в ньютонах, умноженных на метр, или в джоулях. Справа стоит величина, которая является работой, связанной с движением тела. Следовательно, это какая-то средняя кинетическая энергия молекул, формула которой будет иметь вид Ech = mv2 /2.
Движение частиц
Молекулы — это частицы, которые подчиняются законам классической механики. В системе они совершают беспорядочное движение. Отсюда следует, что число микросостояний будет определяться интенсивностью перемещений. Для определения этого значения было введено понятие термодинамическая вероятность — мера хаотичности движения молекул (энтропия). Если рассматривать твёрдые тела, то величина параметра будет небольшой. Это связано с тем, что скорости атомов невелики, а сами частицы имеют устойчивые связи.
В газе же взаимодействие проявляется в короткие моменты при столкновении молекул. Этот процесс сопровождается резким изменением скорости. Все законы рассматривают для так называемой идеальной среды. Для неё предполагается, что расстояние между молекулами намного больше, чем радиус воздействия межмолекулярных сил.
Так, если размер частицы имеет примерное значение, равное d = 3·10-8 см, то для идеального газа физики считают, что число молекул в единице объёма не должно превышать 3·1022 см-3.
Для рассматриваемого состояния установлено три закона:
- произведение объёма на постоянную температуру определяется таким изменением давления, что выражение p * V будет постоянным значением;
- при определённом давлении величина объёма газа к его температуре является постоянной V / T = const;
- давление связано с температурой формулой pV = n RT, где R — газовая постоянная, n — число молей.
Последнее уравнение с учётом постоянной Больцмана (k = p / nT) является основой кинетической теории газов. Средняя величина давления находится как усреднённое значение квадрата скорости всех групп молекул: p = n * m (V2) / 3. Эта формула получена с учётом того, что каждая молекула имеет приблизительно одинаковую скорость. Её можно переписать так: p = (2 / 3) * n * Ek. Отсюда получается усреднённая кинетическая энергия молекул: Ek = 1 / 2 *(m * V2).
Поступательное движение атомов и молекул, взятое по большему числу хаотично перемещающихся частиц, является мерилом температуры. Если она измеряется в градусах Кельвина, то её связь c энергией описывается отношением Ek = (3 * k T) / 2.
Следует отметить, что выражение справедливо только при расчёте для одной частицы. Такой энергией обладает каждая молекула, так как она находится в тепловом хаотическом движении.
Температура и энергия
Если взять два тела с разной температурой и обеспечить между их поверхностями контакт, то через время произойдёт выравнивание температуры. Ранее считалось, что существует некая субстанция, которая, хаотично смешиваясь, уравновешивает показатели. Но на самом деле происходит просто изменение кинетической энергии. Именно она и определяет состояние равновесия.
Это свойство позволило связать энергию с температурой через коэффициент пропорциональности Больцмана: T = (2 * m 0 * V 2) / 3 * K * 2. Если при расчётах использовать это выражение, в ответе получится так называемая абсолютная температура. Её значение служит мерой кинетической энергии теплового движения молекул идеального газа. В качестве единиц измерения взят Кельвин.
Идеальный газ описывается уравнением Клайперона — Менделеева: p * V = (m * R * T) / µ. В то же время газовую постоянную можно определить как произведение постоянной Больцмана на число Авогадро (Na). Это значение равняется 6,02 * 1023. Измеряется в молях и показывает количество структурных частиц на один моль вещества. Формулу для хаотического движения молекул можно вывести следующим образом:
- Поскольку концентрация этих веществ определяется как (m * Na) / µ * V, выражение для давления легко представить в виде p = n * k * T.
- Подставив в формулу давления для одноатомного газа полученное равенство, можно получить p = (1 / 3) ∗ (n ∗ m ∗ v2c) = (n ∗ k ∗ T).
- После сокращения обеих частей на три вторых и концентрацию молекул получится равенство: m * V2 / 2 = (3 * k * T) / 2.
- В правой части стоит значение полной кинетической работы, поэтому формулу можно записать как Ek = (3 * k * T) / 2.
Таким образом, газовая температура зависит от среднекинетической энергии. Эти две величины связаны прямо пропорционально. Температура имеет абсолютное значение, поэтому её физический смысл заключается в определении средней кинетической энергии, приходящейся на молекулу. Но температура характеризует систему в целом. Значит, с помощью формулы можно установить связь параметров макромира и микромира.
Следует отметить, что средняя суммарная тепловая энергия перемещения молекул определяется только температурой газа. То есть кинетическая энергия поступательного хаотичного движения частиц не зависит от химического состава, массы, давления или занимаемого объёма.
Решение задач
Самостоятельное решение примеров позволяет закрепить теоретические знания. Существуют определённые типы заданий, с помощью которых можно проработать весь изученный материал и наглядно увидеть практическое применение знаний. Вот некоторые из них:
- Выяснить, какова средняя кинетическая энергия поступательного движения молекулы газа неона, если созданное давление при концентрации 2, 65 * 1025 м-3 составляет 98,8 кПа. Решение примера следует начать с записи уравнения для идеального газа: p = (m 0 * n * V2) / 3. Так как энергию молекулы можно вычислить из выражения E = (m 0 V2) / 2, то нужная формула примет вид p = (2 * n * E) / 3. Отсюда искомая величина равняется E = 3 p / 2 n. Теперь нужно подставить исходные данные и выполнить количественный расчёт: Ek = (3 * 98,8 * 103) / (2 * 2,65 * 1025) = 5,6 * 10-21 джоулей.
- Средняя энергия поступательного движения частицы гелия равняется 60 Дж, а давление составляет 2 * 105 Па. Необходимо найти концентрацию частиц газа. В основе решения лежит уравнение идеальной системы: p = n * k * T. Добавив к нему формулу связи движения и температуры E = (3 / 2) * kT, можно выразить искомую концентрацию: kT = (2 * E) / 3. Отсюда: n = 3p / 2E = 3 * 2 * 105 / 2 * 60 = 6 * 105 / 60 = 105 / 10 = 104 м-3.
- Найти работу, которая выполняется телом в течение трёх секунд после воздействия, если изменение энергии происходит по графику в виде параболы. Трем секундам соответствует энергия, равная 2 Дж, шести — 4 Дж. Для выяснения работы нужно воспользоваться определением кинетической энергии. Так как существует силовое взаимодействие, то А = ΔEk. В соответствии с графиком энергия изменяется от четырёх джоулей до двух. Значит, работа равна A = 2 — 4 = -2 Дж.
Решать задачи по исследованию кинетической работы несложно. Нужно лишь знать несколько формул и внимательно следить за размерностью величин при выполнении вычислений.
Термодинамика –
наука о наиболее общих свойствах
физических макросистем, находящихся в
состоянии термодинамического равновесия,
и о процессах перехода между этими
состояниями [5]. Термодинамика построена
на основе фундаментальных начал
(законов), которые являются обобщением
большого числа наблюдений и выполняются
независимо от конкретной природы тел,
образующих систему. Однако рассматривая
основные понятия термодинамики, мы
будем использовать и статистическую
интерпретацию.
Основными
понятиями термодинамики являются
такие понятия как состояние, процесс,
цикл, внутренняя энергия, работа,
количество теплоты, теплоёмкость,
энтропия, свободная энергия, энтальпия,
функция Гиббса. Начнём рассмотрение
основ термодинамики с внутренней
энергии, предварительно вспомнив основы
МКТ.
4.1 Средняя кинетическая энергия частицы. Распределение тепловой энергии по степеням свободы
Среднюю
кинетическую энергию движения молекулы
идеального газа можно определить по
формуле:
(4.1)
Число
степеней свободы
i
определяется
числом независимых координат и осей,
описывающих движение частицы в
пространстве. На каждую степень свободы
статистической системы приходится одна
и та же энергия, равная
.
В этом состоит суть теоремы
о равнораспределении тепловой энергии
по степеням свободы.
Для сложных молекул, состоящих из
нескольких атомов, число степеней
свободы увеличивается за счёт вращательных
и колебательных. Если пренебречь
изменением потенциальной энергии
взаимодействия частиц, то молекулы
можно рассматривать как «жёсткие». Для
жестких двухатомных
молекул число степеней свободы i
равно 5 ,
из них 3 – поступательных ( три независимые
координаты х,y,z,
описывающие положение частицы в
пространстве) и 2 вращательных. (две
независимых оси вращения). Для жёстких
трёхатомных
и многоатомных
молекул число степеней свободы равно
6, из них 3 поступательных и 3 вращательных.
Для жёстких одноатомных молекул число
степеней свободы равно 3 и все они
поступательные.
Энергия
– величина аддитивная. Поэтому среднюю
кинетическую энергию одного моля молекул
можно определить, усреднив энергии всех
частиц одного моля:
,
где
–
число молекул в одном моле вещества
(число Авогадро). Учитывая, что произведение
числа Авогадро и постоянной Больцмана
равно универсальной газовой постоянной,
получим энергию одного моля молекул :
(4.2)
Среднюю
кинетическую энергию любого количества
идеального газа можно определить,
усреднив энергии всех рассматриваемых
частиц. Учитывая, что количество молекул
в одном моле вещества очень велико,
следовательно, средние кинетические
энергии разных молей молекул практически
одинаковы. Тогда средняя кинетическая
энергия любого количества вещества
может быть определена по формуле:
(4.3)
4.2 Внутренняя энергия идеального газа как функция состояния
Под
внутренней
энергией системы
понимают полную суммарную энергию всех
её структурных элементов.
Внутренняя
энергия идеального газа складывается
только из кинетических энергий молекул,
так как потенциальной энергией их
взаимодействия можно пренебречь.
Внутренняя
энергия идеального газа U
для любого количества молей
может быть определена через среднюю
кинетическую энергию, определяемую
формулой (4.3). Так как средняя кинетическая
энергия идеального газа зависит только
от температуры и числа степеней свободы
молекулы, то и внутренняя энергия
идеального газа также зависит от
температуры и числа степеней свободы
молекулы:
(4.4)
Таблица
4.1 Внутренняя энергия
идеального газа
|
Газ |
Число |
Средняя |
Средняя |
Полная |
Полная |
|
|
Поступательных |
вращательных |
|||||
|
Одноатомный (жёсткие |
3 |
0 |
|
|
|
|
|
Двухатомный |
3 |
2 |
|
|
|
|
|
Многоатомный |
3 |
3 |
|
|
|
|
Изменение
внутренней энергии идеального газа
определяется только изменением
температуры и не зависит ни от давления,
ни от объёма:
(4.5)
Изменить
внутреннюю энергию газа можно, например,
совершив над ним работу. Но независимо
от того, каким способом совершают работу,
изменение внутренней энергии идеального
газа зависит только от изменения
температуры. Другими словами, изменение
внутренней энергии зависит только от
параметров начального и конечного
состояния, а именно от температуры
начального Т1
и конечного состояния Т 2
, и не зависит
от процесса перехода из начального в
конечное состояние. Поэтому внутренняя
энергия – функция состояния.
Если газ вернули в первоначальное
состояние, то изменение внутренней
энергии равно нулю.
Для
элементарного процесса
.
Можно внести постоянные ν
и R
под знак дифференциала
.
Таким образом, изменение внутренней
энергии является полным дифференциалом
величины, стоящей в скобках, и этот факт
может служить признаком функции
состояния.
Внутренняя
энергия не единственная функция
состояния. Существуют и другие функции
состояния, которые будут рассмотрены
позднее.
Средняя кинетическая энергия хаотического движения молекул

4.5
Средняя оценка: 4.5
Всего получено оценок: 83.
4.5
Средняя оценка: 4.5
Всего получено оценок: 83.
Согласно молекулярно-кинетической теории в неподвижном теле, находящемся в состоянии механического покоя, молекулы и атомы находятся в постоянном хаотическом (несогласованном) движении. Кинетическая энергия молекул, движущихся внутри вещества, определяет то, что все называют температурой вещества. Можно ли, зная температуру, найти кинетическую энергию хаотического теплового движения молекул?
Кинетическая энергия движущейся частицы
Формула для кинетической энергии Ек движущегося со скоростью v тела массой m была получена в разделе механики. Это соотношение справедливо не только для поведения тел видимых размеров, но и для микрочастиц (молекул, атомов, электронов и т.п.):
$Ек = {m * v^2over 2}$ (1),
Полная кинетическая энергию вещества Епк получается сложением энергий всех отдельных частиц:
$Е^п_к = Е_1+ Е_2 + Е_3 +…. Е_N$ (2),
где N — полное число частиц в веществе.
Найти суммарную кинетическую энергию всего вещества с помощью формул (1) и (2), конечно, невозможно: ведь для этого необходимо знать массы и скорости всех частиц, а также их общее количество. Если учесть, что только в одном моле вещества находится огромное число молекул (6,023*1023!), то становится понятно, что для решения этой задачи требуется другой подход.
Наблюдениями и исследованиями процессов передачи тепла ученые занимались задолго до нахождения формул молекулярно-кинетической теории. Для того чтобы придать понятиям “теплый”, “холодный” и т.п. более четкий, числовой вид, были изобретены термометры. Один из первых термометров придумал знаменитый Галилео Галилей, живший в Италии с 1564 г. по 1642 г.
Эксперименты показывали, что чем горячее вещество, тем быстрее (“энергичнее”) двигаются частицы. После изобретения микроскопа появилась возможность визуально наблюдать броуновское движение частиц, которые начинали перемещаться быстрее при нагревании.
Оказывается в 1 см3 при 00С и 760 мм.рт.ст. находится 2,7*1019 молекул. Чтобы ощутить насколько велико это число приведем такой пример. Предположим, что газ удаляется из крохотного сосуда объемом 1 см3 с такой скоростью, что в каждую секунду “убегает” миллион молекул. Нетрудно подсчитать, что сосуд опустеет через миллион лет!
Молекулярно-кинетический подход
Уже к середине ХIX века стало понятно, что пытаться описывать движение каждого атома — дело безнадежное, т.к. ни один прибор не сможет отследить все молекулы и атомы. Вместо такого, “лобового”, подхода системы, состоящие из большого числа частиц стали рассматривать, не пытаясь учесть свойства отдельных атомов, а усредняя эти свойства по большой их совокупности.
В 1859 г. английский физик Максвелл с помощью такого подхода получил для давления p одноатомного газа формулу:
$p = {1over 3} * n * m * v^2_c$ (3),
где: n — концентрация молекул, m — масса молекул, v2c = <v2>ср — среднее арифметическое квадратов скоростей молекул.
Температура вещества — мера кинетической энергии
Ранее для идеального газа был открыт закон Клапейрона-Менделеева, связавший в единое уравнение такие физические параметры, как давление p, объем V и температуру T (по шкале Кельвина):
$p * V = {mover μ} * R * T$ (4),
где:
μ — молярная масса газа, R = 8,3157 джоуль/моль/градус — универсальная газовая постоянная.
В то же время газовая постоянная R равна:
$R = k * N_a$ (5),
где: k =1,38*10-23 Дж/К — постоянная Больцмана, Na — число Авогадро.
Тогда, подставив в уравнение (4) R из уравнения (5), разделив обе части уравнения (4) на объем V и воспользовавшись тем, что:
${mover μ} * {Naover V } = n$ — концентрация молекул, получим из формулы (4) выражение для давления в виде:
$p = n * k * T$ (6).
Из формул для величины давления p (3) и (6) получаем:
$p = {1over 3} * n * m * v^2_c = n * k * T$ (7).
Далее, сократив обе части уравнения на n, и умножив обе части на 3/2, получим:
${m * v^2over 2} = { 3 over 2} * k * T$ (8).
В левой части уравнения, пользуясь формулой (1), получаем выражение для средней кинетической энергии хаотического движения молекул:
$Е_к = { 3 over 2} * k * T$ (9).
Последняя формула (9) демонстрирует, что температура является мерой кинетической энергии молекул. Если газ одноатомный, то вся его энергия — это энергия поступательного движения.
Из формулы (9) следует еще один важный вывод: средняя кинетическая энергия поступательного движения для разных газов будет одинаковой не зависимо от массы молекул, и будет зависеть только от величины температуры.
Что мы узнали?
Итак, мы узнали что суммарная кинетическая энергия вещества складывается из кинетических энергий отдельных частиц. Кинетическая энергия движения частиц, усредненная по их числу, определяет температуру вещества. С помощью уравнения Менделеева-Клапейрона (4) и формулы для давления (3) получили соотношение, связывающее среднюю кинетическую энергию хаотического движения молекул с температурой вещества T.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-
Кристина Тараканова
11/11
Оценка доклада
4.5
Средняя оценка: 4.5
Всего получено оценок: 83.
А какая ваша оценка?
Тепловое движение α-пептида. Сложное дрожащее движение атомов, составляющих пептид, случайно, и энергия отдельного атома флуктуирует в широких пределах, но с помощью закона равнораспределения вычисляют как среднюю кинетическую энергию каждого атома так и среднюю потенциальную энергию многих колебаний. Белые, красные и синие шарики обозначают атомы водорода, кислорода и азота соответственно; серые шарики представляют метильные/метиленовые группы.
Теорема о равнораспределении кинетической энергии по степеням свободы, закон равнораспределения, теорема о равнораспределении — связывает температуру системы с её средней энергией в классической статистической механике. В первоначальном виде теорема утверждала, что при тепловом равновесии энергия разделена одинаково между её различными формами, например, средняя кинетическая энергия поступательного движения молекулы должна равняться средней кинетической энергии её вращательного движения.
С помощью теоремы о равнораспределении можно делать количественные предсказания. Как и вириальная теорема, она даёт полные средние кинетические и потенциальные энергии для системы при данной температуре, из которых можно вычислить теплоёмкость системы. Однако теорема о равнораспределении также позволяет определить средние значения отдельных компонентов энергии, такие как кинетическая энергия одной частицы или потенциальная энергия отдельной пружины. В теореме утверждается, что каждая молекула одноатомного идеального газа, находящегося в термодинамическом равновесии (или в состоянии, близком к термодинамически равновесному), обладает средней кинетической энергией равной (3/2)kBT, где kB — постоянная Больцмана, T — температура. В общем случае её можно применять к любой классической системе, находящейся в состоянии теплового равновесия, независимо от того, насколько она сложна. Теорема о равнораспределении может использоваться для вывода уравнения состояния идеального газа и закона Дюлонга — Пти, для определения удельной теплоёмкости твёрдых тел. Её также используют в предсказании свойств звёзд, даже таких как белые карлики и нейтронные звезды, поскольку закон равнораспределения остаётся верен даже когда следует учитывать релятивистские эффекты.
Хотя теорема о равнораспределении делает очень точные предсказания при определённых условиях, она теряет применимость, когда квантовые эффекты начинают играть существенную роль. Равнораспределение действительно только тогда, когда тепловая энергия kBT намного больше, чем интервал между соседними квантовыми уровнями энергии, потому что в противном случае средние значения энергии и теплоёмкости, приходящиеся на некоторые степени свободы, меньше, чем величины, полученные с использованием теоремы о равнораспределении. Говорят, что степень свободы выморожена, если тепловая энергия намного меньше, чем этот интервал (это означает, что практически такую степень свободы при данных условиях можно не учитывать, при таком условии переход в возбужденные состояния по данной степени свободы практически невозможен). Например, теплоёмкость твёрдого тела уменьшается при низких температурах — поскольку различные типы движения становятся вымороженными — вместо того, чтобы остаться постоянной, как это должно было бы быть в соответствии с классической теоремой о равнораспределении. Такое уменьшение теплоёмкости было первым знаком физикам XIX века, что классическая физика теряет применимость при низкой температуре, и должны быть сформулированы новые законы для объяснения реально наблюдаемого поведения теплоемкости в зависимости от температуры. Наряду с другим противоречием, несостоятельностью закона равнораспределения для описания электромагнитного излучения — также известного как ультрафиолетовая катастрофа — привели Макса Планка к идее, что свет излучается и поглощается квантами. Эта революционная гипотеза положила начало квантовой теории, давшей при дальнейшей разработке квантовую механику и квантовую теорию поля.
Основная идея и простые примеры[править | править код]
Распределение плотности вероятности скоростей молекул для четырёх благородных газов при температуре 298,15 К (25 °C). Показаны гелий (4He), неон (20Ne), аргон (40Ar) и ксенон (132Xe) (индекс обозначает их массовые числа). Функции распределения плотности вероятности имеют размерность вероятности, деленной на скорость, а поскольку вероятность — величина безразмерная, то результирующую размерность можно выразить в единицах секунда на метр.
Первоначально термин «равнораспределение» означал, что полная кинетическая энергия системы разделена одинаково среди всех её независимых частей в среднем, как только система достигла теплового равновесия. Теорема о равнораспределении также даёт количественные предсказания для этих энергий. Например, она предсказывает, что каждый атом благородного газа, находящегося в тепловом равновесии при температуре T, обладает средней кинетической энергией поступательного движения равной (3/2)kBT. Как следствие, более тяжёлые атомы ксенона обладают более низкой средней скоростью, чем лёгкие атомы гелия при той же самой температуре. Рисунок показывает распределение Максвелла для скоростей атомов четырёх газов.
В этом примере важно отметить, что кинетическая энергия является квадратичной функцией скорости. Теорема о равнораспределении утверждает, что при тепловом равновесии, любая степень свободы (компоненты векторов положения или скорость частицы)[1], которая появляется только как квадратичная функция в энергии, обладает средней энергией равной ½kBT и поэтому вносит вклад ½kB в теплоёмкость системы. У этого утверждения существует много практических приложений.
Энергия поступательного движения частиц идеальных газов[править | править код]
Кинетическая энергия частицы газа с массой m и обладающая скоростью v задаётся в виде
где vx, vy и vz — декартовы компоненты вектора скорости v. Здесь символ H обозначает функцию Гамильтона системы и используется как символ энергии в гамильтоновом формализме. Он играет центральную роль в большинстве обобщений закона равнораспределения.
Поскольку кинетическая энергия является квадратичной функцией компонент скорости, из закона равнораспределения следует, что каждая из этих компонент вносит одинаковый вклад ½kBT в среднюю кинетическую энергию газа, находящегося в тепловом равновесии. Отсюда следует, что средняя кинетическая энергия частицы равна (3/2)kBT, как в примере для благородных газов сверху.
В общем случае, полная энергия идеального газа состоит из (поступательной) кинетической энергии отдельных частиц, в соответствии с предположением, что частицы не имеют никаких внутренних степеней свободы и перемещаются независимо от друг друга. Равнораспределение означает, что средняя полная энергия идеального газа из N частиц равна (3/2)N kBT.
Отсюда следует, что теплоёмкость газа составляет (3/2)N kB и, в частности, теплоёмкость одного моля газа таких частиц равна (3/2)NAkB=(3/2)R, где NA — число Авогадро и R — газовая постоянная. Поскольку R ≈ 2 кал/(моль·К), закон равнораспределения предсказывает что молярная теплоёмкость идеального газа приблизительно равна 3 кал/(моль·К). Это предсказание проверено экспериментально.[2]
Средняя кинетическая энергия позволяет оценить корень квадратный из среднего квадрата скорости vrms частиц в газе:
где M = NAm — молярная масса газа. Этот результат полезен для многих практических приложений, таких как закон Грэхема для эффузии, который используется в методе обогащения урана[3]
Энергия вращательного движения[править | править код]
Похожий пример можно найти при рассмотрении вращающейся молекулы с главными моментами инерции I1, I2 и I3. Вращательная энергия такой молекулы задана выражением
где ω1, ω2, и ω3 — главные компоненты угловой скорости. Точно по тем же самым рассуждениям как и в случае поступательного движения равнораспределение подразумевает, что при тепловом равновесии средняя вращательная энергия каждой частицы: (3/2)kBT. Аналогично, теорема о равнораспределении позволяет вычислить среднюю (более точно, корень квадратный из среднего квадрата) угловую скорость молекул.[4]
Потенциальная энергия и гармонические осцилляторы[править | править код]
Равнораспределение применимо не только к кинетической энергии, но и к потенциальной энергии. Важные примеры включают гармонические осцилляторы такие как пружина, которая обладает квадратичной по координатам потенциальной энергией
где постоянная a описывает жёсткость пружины и q — отклонение от равновесного положения. Если такая одномерная система имеет массу m, тогда её кинетическая энергия Hkin: ½mv² = p²/2m, где v и p = mv обозначают скорость и импульс осциллятора. Суммируя эти вклады получим полную энергию системы[5]
Равнораспределение подразумевает, что при тепловом равновесии осциллятор обладает средней энергией, которая равна
где угловые скобки 
Этот результат остаётся верен для любых типов гармонического осциллятора, таких как маятник, колеблющаяся молекула или пассивный электрический генератор. Системы таких осцилляторов возникают во многих случаях. По закону равнораспределения, каждый такой осциллятор обладает средней полной энергией kBT и следовательно даёт вклад kB в теплоёмкость системы. Этот вывод можно использовать для вывода формулы для теплового шума[7] и закона Дюлонга — Пти для удельной теплоёмкости твёрдых тел. Последнее сыграло важную роль в истории теоремы о равнораспределении.
Атомы в кристалле могут колебаться около их равновесных положений в решётке. Такие колебания считаются (наряду c электронами) в значительной степени ответственными за теплоёмкость кристаллических диэлектриков и металлов
Теплоёмкость твёрдых тел[править | править код]
Закон равнораспределения применяется для определения удельной теплоёмкости кристаллических тел. Поскольку каждый атом из такого тела может колебаться в трёх независимых направлениях, то кристалл можно рассматривать как систему 3N независимых гармонических осцилляторов, где N обозначает число атомов в решётке. Каждый гармонический осциллятор обладает средней энергией kBT, поэтому средняя полная энергия тела равна 3NkBT, а его удельная теплоёмкость 3NkB.
Если взять за N — число Авогадро (NA), то, используя соотношение R = NAkB между газовой постоянной (R) и постоянной Больцмана (kB), получим выражение для закона Дюлонга — Пти, который описывает молярную теплоёмкость твёрдых тел. Он гласит, что удельная теплоёмкость одного моля атомов кристаллической решётки составляет 3R ≈ 6 кал/(моль·К).
Следует отметить, что этот закон неверен при низких температурах, где важно принять во внимание квантовые эффекты. Он также вступает в противоречие с экспериментально подтверждённым третьим началом термодинамики, согласно которому удельная теплоёмкость любого вещества стремится к нулю при стремлении температуры к абсолютному нулю.[7] Более точные теории, которые принимают во внимание квантовые эффекты, были разработаны Альбертом Эйнштейном (1907 год) и Петером Дебаем (1911 год).[8]
Многие физические системы можно смоделировать в виде системы связанных гармонических осцилляторов. Движения таких осцилляторов можно разложить на нормальные моды, которые можно представить как вибрационные моды струны фортепьяно или резонансы трубы органа. С другой стороны, теорема о равнораспределении становится неприменимой для таких систем из-за отсутствия обмена энергии между нормальными модами. В предельном случае моды независимы и, таким образом, их энергии сохраняются независимо. Это означает, что смешивание энергий, формально называемое эргодичностью, важно для выполнения закона равнораспределения.
Седиментация частиц[править | править код]
Потенциальная энергия не всегда является квадратичной функцией координат, но теорема о равнораспределении утверждает, что если степень свободы x входит с множителем xs (для фиксированной постоянной s) в полную энергию, то при тепловом равновесии средняя энергия этой части равна kBT/s.
Это обобщение используется при рассмотрении седиментации частиц под действием гравитации.[9] Например, взвесь, иногда заметная в пиве, может быть вызвана кусочками белков, которые рассеивают свет.[10] В течение долгого времени, эти кусочки скапливаются на дне под действием силы тяжести, приводя к более сильному рассеянию света около основания бутылки, чем у её вершины. Однако, благодаря диффузии работающей в противоположном направлении, частицы движутся вверх к вершине бутылки. Как только равновесие достигнуто, теорема о равнораспределении может использоваться, чтобы определить среднее положение определённого кусочка плавучей массы mb. Для бесконечно высокой бутылки пива гравитационная потенциальная энергия задана в виде
где z — положение белкового кусочка в бутылке по высоте и g — ускорение вызванное гравитацией. Поскольку s=1, то средняя потенциальная энергия белкового кусочка равна kBT. Если масса белкового кусочка составляет около 10 МДа (грубо это размер вируса), то при равновесии возникнет взвесь со средней высотой около 2 см. Процесс седиментации к равновесному положению описывается уравнением Масона — Вивера.[11]
История[править | править код]
- В этой статье используются отличные от СИ единицы измерения кал/(моль·К) для удельной теплоёмкости из-за точности десятичной записи.
Для преобразования в единицы СИ Дж/(моль·К), эти значения нужно домножить на 4.2 Дж/кал.
Равнораспределение кинетической энергии по степеням свободы предложил в 1843 году (правильнее говорить о 1845 годе) Джон Джеймс Уотерстон.[12][13][14][15][16] В 1859 Джеймс Клерк Максвелл утверждал, что кинетическая энергия при высокой температуре газа одинаково разделена между энергией поступательного движения и вращательной энергией.[17] В 1876 году Людвиг Больцман показал, что средняя энергия разделена одинаково между всеми независимыми компонентами движения в системе.[18][19] Больцман применил закон равнораспределения, чтобы теоретически объяснить эмпирический закон Дюлонга — Пти для теплоёмкости твёрдых тел.
Идеализированный график теплоёмкости двухатомного газа в зависимости от температуры. Значение (7/2)R согласуется с предсказанной из закона равнораспределения теплоёмкостью для высоких температур (где R —газовая постоянная), но уменьшается до (5/2)R и затем до (3/2)R при более низких температурах, поскольку колебательные и вращательные степени свободы вымораживаются. Нарушение закона равнораспределения привело к парадоксу, который был разрешён только в квантовой механике. Для большинства молекул переходная температура Trot много меньше комнатной температуры, в то время как Tvib может быть в десять раз больше. (Типичный пример: монооксид углерода, CO, для которого Trot ≈ 2.8 К, а Tvib ≈ 3103 К.) Для молекул с длинными или слабыми связями между атомами Tvib может быть близка к комнатной температуре (около 300 K); например, Tvib ≈ 308 К для газа йода, I2.[20]
История теоремы о равнораспределении переплетена с исследованиями теплоёмкости, которые были проведены в XIX веке. В 1819 году французские физики Пьер Дюлонг и Алексис Пти обнаружили, что удельные молярные теплоёмкости для твёрдых тел практически равны при комнатной температуре, и составляют приблизительно 6 кал/(моль·К).[21] Их закон использовался многие годы для измерения атомных весов.[8] Однако последующие исследования Джеймса Дьюара и Генриха Вебера показали, что закон Дюлонга-Пти выполняется только при больших температурах,[22][23][24] а при низких температурах или для очень твёрдых кристаллов, таких как алмаз, теплоёмкость меньше.[25][26][27]
Экспериментальные значения теплоёмкости газов также поставили вопросы о правильности теоремы о равнораспределении. Теорема предсказывает, что молярная удельная теплоёмкость одноатомных газов должна быть примерно 3 кал/(моль·К), а для двухатомных газов приблизительно 7 кал/(моль·К). Эксперименты подтвердили первое предсказание,[2] но для двухатомных газов эксперимент показал, что удельная молярная теплоёмкость составляет только 5 кал/(моль·К),[28] и падает до 3 кал/(моль·К) при очень низких температурах.[29] Максвелл заметил в 1875, что расхождение между экспериментом и законом равнораспределения даже хуже, если брать эти значения;[30] поскольку атомы имеют внутреннюю структуру, то тепловая энергия должна пойти на движение этих внутренних частей, приводя к предсказаниям для удельных молярных теплоёмкостей одноатомных и двухатомных газов много больших чем 3 кал/(моль·К) и 7 кал/(моль·К), соответственно.
Третье разногласие связано с теплоёмкостью металлов.[31] Согласно классической модели Друде, электроны в металле ведут себя как идеальный газ и соответственно должны давать вклад (3/2)Ne kB, где Ne — число электронов, в теплоёмкость металла по теореме о равнораспределении. Экспериментально, однако, вклад электронов в теплоёмкость невелик: молярные теплоёмкости различных проводников и диэлектриков практически совпадают.[31] (См. также раздел «Ограничения, накладываемые квантовой механикой»).
Были предложены несколько объяснений неточности теоремы о равнораспределении при определении теплоёмкостей. Больцман защищал доказательство своей теоремы как правильное, но предположил, что газы могут не быть в тепловом равновесии из-за их взаимодействия с эфиром.[32] Лорд Кельвин предположил, что вывод теоремы о равнораспределении должен быть неверен, поскольку её выводы расходятся с экспериментом, но не смог указать ошибку.[33] Лорд Рэлей вместо этого выдвинул более радикальную гипотезу, заключающуюся в том что и теорема о равнораспределении и экспериментальное предположение о тепловом равновесии верны, но чтобы согласовать их, он высказался о потребности нового принципа, который обеспечит побег от разрушительной простоты теоремы о равнораспределении.[34] Альберт Эйнштейн показал путь для разрешения этого противоречия, когда в 1907 году показал, что эти аномалии в теплоёмкости возникают из-за квантовых эффектов, в частности квантования энергии упругих колебаний твёрдого тела.[35][36][37][38][39] Эйнштейн использовал неточность закона равнораспределения как довод в пользу того, что требуется новая квантовая теория вещества.[8] Эксперименты Нернста в 1910 году по измерению теплоёмкости при низких температурах[40] подтвердили теорию Эйнштейна и привели к широкой поддержке квантовой теории среди физиков.[41]
Общая формулировка теоремы о равнораспределении[править | править код]
Наиболее общая формулировка теоремы о равнораспределении[4][6][9] гласит, что при определённых условиях (смотрите ниже) для физической системы с гамильтонианом H и степенями свободы xn выполняется следующее соотношение для любых индексов m и n:
Здесь δmn — символ Кронекера, который равен единице если m=n и нулю в других случаях. Угловые скобки обозначают усреднение 
Общая формулировка теоремы верна как в случае микроканонического ансамбля,[6] когда полная энергия системы постоянна, так и в случае канонического ансамбля,[4][42] когда система связана с тепловым резервуаром, с которым она может обмениваться энергией. Вывод общей формулы приведён ниже.
Общая формула эквивалентна следующим выражениям:
для всех n.
для всех m≠n.
Если степень свободы xn появляется только в виде квадратичного слагаемого anxn² в гамильтониане H, то первая формула утверждает, что
в два раза больше вклада этой степени свободы в среднюю энергию 
Степени свободы xn — координаты в фазовом пространстве системы, и поэтому они обычно разделяются на обобщённые координаты qk и обобщённые импульсы pk, где pk — импульс, сопряжённый к qk. В этом случае формула 1 означает, что для всех k
Используя уравнения гамильтоновой механики,[5] эти формулы можно также переписать в виде
Формула 2 утверждает, что средние
и
равны нулю для j≠k.
Связь с вириальной теоремой[править | править код]
Общая теорема о равнораспределении является обобщением теоремы о вириале (предложена в 1870[43]) и гласит
где t обозначает время.[5] Два ключевых различия между ними заключаются в том, что вириальная теорема связывает «суммированные», а не «индивидуальные» средние друг с другом, и первая не связывает их с температурой «T». Другое различие — то, что традиционные доказательства вириальной теоремы используют усреднение в течение длительного периода времени, тогда как теорема о равнораспределении также использует усреднение по фазовому пространству.
Применения[править | править код]
Уравнение состояния идеального газа[править | править код]
Теорема о равнораспределении используется для вывода уравнения состояния идеального газа из классической механики.[4]. Формула для средней кинетической энергии на одну частицу, принимая во внимание только три поступательных степени свободы, запишется в виде
Если q = (qx, qy, qz) и p = (px, py, pz) обозначают координаты и импульс частицы в газе, а F — сила, действующая на эту частицу, тогда
где первое равенство представляет собой второй закон Ньютона, а вторая строчка использует уравнения Гамильтона и равнораспределение. Суммирование по системе из N частиц приводит к выражению
Используя третий закон Ньютона и предположение об идеальности газа, получим полную силу в системе — силу, которая действует со стороны стенок контейнера на систему, и эта сила задаётся давлением P газа. Следовательно
где dS — бесконечно малый элемент площади стенок контейнера. Поскольку дивергенция радиус-вектора q равняется
то из теоремы о дивергенции получаем
где dV — бесконечно малый объём внутри контейнера, V — его полный объём.
Собирая уравнения вместе, получаем
которое приводит к уравнению состояния для идеального газа для N частиц:
где n=N/NA — число молей газа и R=NAkB — газовая постоянная.[44]
Двухатомные газы[править | править код]
Двухатомный газ можно представить как две массы m1 и m2, соединённые между собой посредством пружины с жёсткостью a.[20] Классическая энергия этой системы записывается в виде суммы кинетических энергий движения отдельных масс и потенциальной энергии деформации пружины:
где p1 и p2 — импульсы двух атомов, q — отклонение от положения равновесия. Каждая степень свободы является квадратичной функцией, и поэтому должна давать вклад равный ½kBT в полную среднюю энергию и ½kB в удельную теплоёмкость. Таким образом, удельная теплоёмкость газа из N двухатомных молекул должна равняться 7N · ½kB: импульсы p1 и p2 дают каждый по три степени свободы и отклонение q добавляет седьмую. Отсюда следует, что удельная теплоёмкость одного моля газа двухатомных молекул без каких-либо отличных от упомянутых выше степеней свободы должна составить (7/2)NAkB=(7/2)R и, таким образом, предсказанная молярная удельная теплоёмкость составит 7 кал/(моль·К). В то же время, как показали измерения, молярная удельная теплоёмкость газа двухатомных молекул равняется 5 кал/(моль·К)[28] и уменьшается до 3 кал/(моль·К) при очень низких температурах.[29] Это расхождение между предсказанным значением по закону равнораспределения и экспериментом нельзя объяснить, используя более сложную структуру молекулы, поскольку с добавлением степеней свободы увеличивается и предсказанное значение теплоёмкости.[30] Это разногласие было одним из ключевых, которые требовали более правильных, а именно квантовых представлений о структуре материи.
Совмещённое рентгеновское и оптическое изображения крабовидной туманности. В центре этой туманности находится быстро вращающаяся нейтронная звезда, которая в полтора раза тяжелее нашего Солнца, но только 25 км в диаметре. Теорема о равнораспределении оказывается полезной для изучения свойств таких звёзд
Ультрарелятивистские идеальные газы[править | править код]
Закон равнораспределения использовался выше, чтобы получить классическое уравнение состояния идеального газа из ньютоновской механики. Однако релятивистские эффекты становятся доминирующими в некоторых системах, таких как белые карлики и нейтронные звезды,[6] и уравнение состояния идеального газа нужно изменить. Теорема о равнораспределении даёт удобный способ получить соответствующие законы для ультрарелятивистского идеального газа.[4] В этом случае, кинетическая энергия отдельной частицы задана формулой
Дифференцируя H по компоненте импульса px, получим
и аналогично для компонент py и pz. Складывая три компоненты вместе придём к выражению для средней кинетической энергии
где последнее равенство следует из равнораспределения. Таким образом, средняя полная энергия ультрарелятивистского газа в два раза больше полной энергии газа в нерелятивистском случае: для N частиц, получим 3 N kBT.
Неидеальные газы[править | править код]
В идеальном газе частицы взаимодействуют только через соударения. Закон равнораспределения можно использовать для получения выражения для давления и энергии «неидеальных газов», в которых частицы взаимодействуют друг с другом посредством консервативных сил. Потенциал взаимодействия U(r) этих частиц зависит только от расстояния r между частицами.[4] Эта ситуация описывается в модели одной частицы, где остальные частицы в газе образуют сферически-симметричное распределение. Удобно ввести радиальную функцию распределения g(r), такую что плотность вероятности найти частицу на расстоянии r от данной равна 4πr²ρ g(r), где ρ=N/V — средняя плотность газа.[45] Отсюда следует, что средняя потенциальная энергия взаимодействия частицы с её окружением равна
Полная средняя потенциальная энергия газа равна 
После суммирования потенциальной и кинетической энергии и применения равнораспределения получим энергетическое уравнение
Похожие рассуждения[4] приводят к уравнению для давления
Ангармонические осцилляторы[править | править код]
Для ангармонического осциллятора (в противоположность простому гармоническому осциллятору) потенциальная энергия не является квадратичной функцией смещения q (обобщённая координата, которая показывает отклонение от положения равновесия). Такие осцилляторы позволяют более широко взглянуть на закон равнораспределения.[46][47] В качестве простого примера рассмотрим функции потенциальной энергии вида
где C и s произвольные реальные постоянные. В этом случае закон равнораспределения приводит к выыражению
Таким образом, средняя потенциальная энергия равна kBT/s, а не kBT/2 как для квадратичного потенциала гармонического осциллятора (где s=2).
В более общем случае типичная функция энергии одномерной системы представима в виде разложения Тейлора по q:
для неотрицательных целых чисел n. Слагаемое с n=1 отсутствует, поскольку в точке равновесия отсутствует результирующая сила и первая производная энергии обращается в ноль. Слагаемое с n=0 нужно включить, поскольку потенциальная энергия в точке равновесия может быть выбрана произвольным образом (ноль для простоты). В этом случае из закона равнораспределения следует что[46]
В противоположность другим примерам, приведённым здесь, закон равнораспределения
для средней потенциальной энергии не может быть записан в терминах известных постоянных.
Броуновское движение[править | править код]
Типичное броуновское движение частицы в трёх измерениях
Закон равнораспределения используют для вывода среднеквадратичного отклонения броуновской частицы, используя уравнение Ланжевена.[4] Согласно этому уравнению движение частицы с массой m и скоростью v подчиняется второму закону Ньютона
где Frnd — случайная сила, которая описывает случайные соударения частицы с окружающими молекулами, и где постоянная времени 



Скалярное произведение этого уравнения и вектора местоположения частицы 
для броуновского движения (поскольку случайная сила Frnd нескоррелирована с вектором r). Используя математические соотношения
и
основное уравнение для броуновского движения можно записать в виде
где последнее равенство следует из закона равнораспределения для кинетической энергии поступательного движения:
Тогда дифференциальное уравнение для 
Если время мало по сравнению с постоянной времени (
При временах много больших постоянной времени (
Это выражение описывает диффузию частицы во времени. Аналогичное уравнение для вращательной диффузии жёсткой молекулы выводится аналогичным методом.
Теорема о равнораспределении даёт правильную оценку для температуры внутри ядра Солнца
Физика звёзд[править | править код]
Теорема о равнораспределении и вириальная теорема давно используется в астрофизике.[48] Например, вириальную теорему используют для оценки температур звёзд или предела Чандрасекара для массы белых карликов.[49][50]
Средняя температура звезды оценивается из теоремы о равнораспределении.[51] Поскольку большинство звёзд сферически симметричны, то полная гравитационная потенциальная энергия оценивается интегралом
где M(r) — масса внутри радиуса r, ρ(r) — звёздная плотность на радиусе r, G — гравитационная постоянная, R — полный радиус звезды. В случае постоянной плотности звезды интегрирование по радиусу приводит к выражению
где M — полная масса звезды. Отсюда следует, что средняя потенциальная энергия одной частицы равна
где N — число частиц в звезде. Большинство звёзд состоит главным образом из ионизированного водорода, тогда N равно приблизительно (M/mp), где mp — масса протона. Применение закона о равнораспределении даёт оценку температуры звезды
Если подставить в это выражение массу и радиус Солнца, то оценочная солнечная температура T составит 14 миллионов кельвинов, очень близко к температуре ядра Солнца (15 миллионов кельвинов). Правда здесь надо отметить, что Солнце по структуре гораздо сложнее, чем принято в этой упрощённой модели и её температура как и плотность изменяются сильно как функция радиуса, а такое хорошее согласие (≈7 % относительная ошибка) частично наше везение.[52]
Звездообразование[править | править код]
Полученные выше формулы можно использовать для определения условий для звездообразования из гигантских молекулярных облаков.[53]
Местные колебания плотности в таких облаках могут привести к нестабильному состоянию, в котором облако сожмётся под собственной тяжестью. Такой коллапс происходит, когда теорема о равнораспределении или, эквивалентно, теорема о вириале больше не применимы, то есть, когда гравитационная потенциальная энергия в два раза превышает кинетическую энергию
Предполагая, что плотность облака 
можно получить оценку минимальной массы для зарождения звезды, которая называется массой Джинса MJ
Подстановка значений типичных масс в таких наблюдаемых облаках (T=150 К, ρ = 2⋅10−16 г/см³) даёт оценку минимальной массы равную 17 солнечным массам, которая согласуется с наблюдаемым звездообразованием. Этот эффект известен как нестабильность Джинса. Он назван в честь британского физика Джеймса Джинса, который опубликовал описание этой нестабильности в 1902 году.[54]
Выводы[править | править код]
Кинетическая энергия и распределение Максвелла — Больцмана[править | править код]
Первоначальная формулировка теоремы о равнораспределении гласит, что в физической системе при термодинамическом равновесии каждая частица обладает одинаковой средней кинетической энергией, (3/2)kBT.[55] Это можно показать, используя распределение Максвелла — Больцмана (см. выше рисунок распределения плотности вероятности скоростей молекул), которое является распределением вероятности
для скорости частицы с массой m в системе, где скорость v — амплитуда 

Распределение Максвелла — Больцмана применимо для системы, состоящей из атомов, и предполагает только, что система частиц представляет собой канонический ансамбль, в частности, что кинетические энергии распределены в соответствии с множителем Больцмана при температуре T.[55] Средняя кинетическая энергия для частицы массы m задаётся интегральной формулой
как и гласит теорема о равнораспределении. Тот же результат можно получить, усредняя энергии частиц и используя вероятность найти частицу в некотором энергетическом квантовом состоянии[44].
Квадратичные энергии и статистическая сумма[править | править код]
В более общей формулировке теорема о равнораспределении гласит, что любая степень свободы 







в формуле для 
как гласит теорема о равнораспределении.
Общие доказательства[править | править код]
Общие выводы теоремы о равнораспределении можно найти во многих учебниках по статистической механике как для микроканонического ансамбля[4][6], так и для канонического ансамбля[4][42].
Эти методы предполагают усреднение системы в фазовом пространстве, которое представляет собой симплектическое многообразие.
Для объяснения этих выводов нужно ввести следующие обозначения. Во первых, фазовое пространство описано в терминах обобщённых координат qj вместе с их сопряжёнными импульсами pj. Величины qj полностью описывают конфигурацию системы, в то же время величины (qj,pj) вместе полностью описывают её состояние.
Во вторых, вводят бесконечно малый объём
фазового пространства и используют его как объём Γ(E, ΔE) той части фазового пространства, где энергия системы H принимает значение в диапазоне энергий между E и E+ΔE:
В этом выражении, ΔE очень мало, ΔE<<E. Аналогично, Σ(E) определён как полный объём фазового пространства, где энергия меньше чем E:
Из-за малости ΔE, следующие интегрирования эквивалентны
где точки представляют собой интегрируемое выражение. Из этого следует, что Γ пропорционален ΔE
где ρ(E) — плотность состояний. По обычным определениям из статистической механики, энтропия S равна kB log Σ(E), и температура T определена как
Канонический ансамбль[править | править код]
В каноническом ансамбле система находится в тепловом равновесии с бесконечным тепловым резервуаром при температуре T (в кельвинах).[4][42] Вероятность каждого состояния в фазовом пространстве задаётся её множителем Больцмана, умноженным на нормирующий множитель 
где β = 1/kBT. Интегрирование по частям для переменной в фазовом пространстве xk (которая может быть либо qk либо pk) между двумя пределами a и b приводит к уравнению
где dΓk = dΓ/dxk, то есть, первое интегрирование не производится по xk. Первое слагаемое обычно равно нулю, потому что xk равен нулю на пределах, или потому что энергия расходится на пределах. В этом случае теорема о равнораспределении немедленно следует из этого уравнения
Здесь усреднение 
Микроканонический ансамбль[править | править код]
В микроканоническом ансамбле система изолирована от остального мира или, по крайней мере, слабо связана.[6] Отсюда следует, что её полная энергия постоянная величина. Пусть для определённости полная энергия H находится между E и E+ΔE. Для данной энергии E и неопределённости ΔE, имеется область в фазовом пространстве Γ, когда система имеет эту энергию, и вероятности каждого состояния в этой области фазового пространства равны, по определению микроканонического ансамбля. Из этих определений следует, что усреднение по переменным в фазовом пространстве xm (которые могут быть либо qk или pk) и xn задано в виде
где последнее равенство следует из того, что E не зависит от xn. Интегрирование по частям приводит к соотношению
поскольку первое слагаемое справа в первой строчке равно нулю (его можно записать как интеграл H — E по гиперпространству, где H = E).
Подставляя этот результат в предыдущее уравнение, получаем
Поскольку 
Таким образом, мы получили общую формулировку теоремы о равнораспределении
которая была использована в применениях, приведённых выше.
Применимость[править | править код]
Требование эргодичности[править | править код]
Закон равнораспределения выполняется только для эргодичных систем, находящихся в термодинамическом равновесии, что подразумевает, что все состояния с равной энергией должны быть заполнены с равной вероятностью.[6] Следовательно, должен быть возможен обмен энергией между различными её формами в пределах системы, или с внешним тепловым резервуаром в каноническом ансамбле. Число физических систем, для которых известно строгое доказательство эргодичности, мало. Наиболее известный пример — система твёрдых шаров Якова Синая.[57] Изученные требования для изолированных систем с гарантированной эргодичностью и, таким образом, равнораспределение, обеспечили предпосылки для современной теории хаоса динамических систем. Хаотическая гамильтонова система не обязательно должна быть эргодичной, хотя это обычно хорошее приближение.[58]
Система связанных гармонических осцилляторов — обычно цитируемый контрпример, поскольку энергия не делится между различными её формами и равнораспределение не выполняется в микроканоническом ансамбле.[58] Если система изолирована от остального мира, энергия в каждой нормальной моде постоянна и энергия не передаётся от одной моды к другой. Следовательно, закон равнораспределения не выполняется для такой системы, поскольку количество энергии в каждой нормальной моде определяется её начальным значением. Если присутствуют достаточно сильные нелинейные слагаемые в энергии, то она может перераспределяться между нормальными модами, приводя к тому что закон равнораспределения выполняется. Однако, теорема Колмогорова — Арнольда — Мозера утверждает, что нелинейные возмущения должны быть достаточно сильны для перераспределения энергии; в противном случае, когда они малы, энергия останется сконцентрирована в, по крайней мере, некоторых из мод.
Другим простым примером является идеальный газ конечного числа частиц, помещенный в сосуд круглой формы. Вследствие симметрии сосуда, у такого газа сохраняется его полный момент импульса. Поэтому не все состояния с равной энергией оказываются заполнены. В результате, у такого газа средняя энергия частицы оказывается зависящей от её массы, а также от масс всех остальных частиц газа.[59]
Ограничения, накладываемые квантовой механикой[править | править код]
Закон равнораспределения нарушается, когда тепловая энергия kBT становится значительно меньше, чем расстояние между энергетическими уровнями. Равнораспределение не работает, потому что предположение о непрерывном спектре энергетических уровней, которое использовалось выше при выводе закона равнораспределения, больше не является хорошим приближением.[4][6] Исторически, невозможность объяснить с помощью классической теоремы о равнораспределении удельную теплоёмкость и излучение абсолютно чёрного тела послужила основной причиной осознания того факта, что необходимы новые теории материи и излучения, а именно квантовая механика и квантовая теория поля.[8]
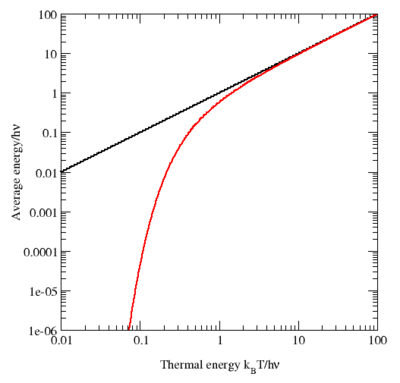
График средней энергии квантовомеханического осциллятора (красная кривая) в зависимости от температуры в логарифмическом масштабе. Для сравнения: значения, предсказанные теоремой о равнораспределении, показаны чёрным. При высокой температуре две кривые имеют очень хорошее согласие, но при низких температурах, когда kBT << hν, квантовомеханическое значение уменьшается намного быстрее. Это приводит к решению проблемы ультрафиолетовой катастрофы: для данной температуры энергия высокочастотных мод (когда hν >> kBT) почти обращается в ноль.
Для иллюстрации нарушения теоремы о равнораспределении, рассмотрим среднюю энергию одиночного (квантового) гармонического осциллятора, который обсуждался выше для классического случая. Его квантовые уровни заданы в виде En = nhν, где h — постоянная Планка, ν — фундаментальная частота осциллятора, и n — целое положительное число. Вероятность того, что заданный уровень энергии окажется заполнен, в каноническом ансамбле задаётся его множителем Больцмана:
где β = 1/kBT и знаменатель Z — статистическая сумма, здесь геометрический ряд
Его средняя энергия задаётся в виде
Подставляя формулу для Z, приходим к искомому результату[6]
При высоких температурах, когда тепловая энергия kBT много больше расстояния hν между энергетическими уровнями, экспоненциальный показатель βhν оказывается много меньше единицы и средняя энергия становится равной kBT, в соответствии с законом о равнораспределении (см. график). Однако, при низких температурах, когда hν >> kBT, средняя энергия стремится к нулю — высокочастотные уровни энергии «вымораживаются» (см. график). Другой пример, возбуждённые электронные состояния атома водорода не вносят вклада в удельную теплоёмкость газа при комнатной температуре, потому что тепловая энергия kBT (приблизительно 0.025 эВ) много меньше, чем расстояние между основным состоянием и первым возбуждённым уровнем (приблизительно 10 эВ).
Аналогичные рассмотрения применимы вне зависимости от того, больше ли расстояние между энергетическими уровнями, чем тепловая энергия. Например, эта посылка была использована Альбертом Эйнштейном, чтобы разрешить ультрафиолетовую катастрофу излучения абсолютно чёрного тела.[60] Парадокс возникает из-за того, что имеется бесконечное число независимых мод электромагнитного поля в замкнутом контейнере, каждая из которых трактуется как гармонический осциллятор. Если каждая электромагнитная мода обладает средней энергией kBT, тогда в контейнере будет содержаться бесконечная энергия.[60][61] Однако, по причине обсуждаемой выше, средняя энергия в высокочастотных модах стремится к нулю, когда частота стремится к бесконечности; более того, планковский закон излучения абсолютно чёрного тела, который следует из экспериментально найденного распределения энергии по модам следует из этой же причины.[60]
Есть более тонкие квантовые эффекты, которые могут привести к коррекциям теоремы равнораспределения, такие как тождественность частиц и непрерывные симметрии. Эффекты неразличимости частиц могут доминировать при больших концентрациях и низких температурах. Например, валентные электроны в металле могут иметь среднюю кинетическую энергию несколько электронвольт, которая соответствует температуре в десятки тысяч градусов. Эти электроны в состоянии, в котором их плотность настолько высока, что принцип запрета Паули делает неприменимым классический подход, образуют вырожденный ферми-газ. Такие газы важны в структуре белых карликов и нейтронных звёзд. При низких температурах формируется фермионный аналог конденсата Бозе — Эйнштейна (в котором много тождественных частиц занимают основное энергетическое состояние); такие сверхтекучие электроны ответственны за сверхпроводимость.
См. также[править | править код]
- Молекулярно-кинетическая теория
- Статистическая механика
- Квантовая статистика
Примечания[править | править код]
- ↑ Здесь, как можно видеть, термин степень свободы используется в том «термодинамическом» смысле, который несколько отличается от обычного в физике, а именно (в варианте, приведенном в данной статье): отдельными степенями свободы рассматриваются координатные (ответственные за потенциальную энергию) и скоростные (ответственные за кинетическую), тогда как обычно координату и соответствующую ей скорость относят к одной и той же степени свободы. Легко видеть, что в данном контексте такое изменение смысла термина оправдано простотой формулировки теоремы. Заметим, что координаты, потенциальная энергия от которых не зависит (хотя бы в первом приближении) квадратично (а это координаты, соответствующие поступательному и вращательному движению молекулы), дают пренебрежимый вклад в потенциальную энергию, хотя обычный вклад ½kBT в кинетическую энергию. Выделенность колебательных степеней свободы, потенциальная энергия которых квадратична (хотя бы приближенно), состоит в том, что в колебательных системах, близких к гармоничности, потенциальная энергия равна кинетической при свободных колебаниях.
- ↑ 1 2 Kundt, A.; Warburg E. Über die specifische Wärme des Quecksilbergases (On the specific heat of mercury gases) (англ.) // Annalen der Physik : journal. — 1876. — Vol. 157. — P. 353—369. Архивировано 13 апреля 2013 года. (нем.)
- ↑ Fact Sheet on Uranium Enrichment Архивная копия от 25 февраля 2021 на Wayback Machine U.S. Nuclear Regulatory Commission. Accessed 30th April 2007
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 Pathria, R. K. Statistical Mechanics. — Pergamon Press (англ.) (рус., 1972. — С. 43—48, 73—74. — ISBN 0-08-016747-0.
- ↑ 1 2 3 Goldstein, H. Classical Mechanics. — 2nd. ed. — Addison-Wesley, 1980. — ISBN 0-201-02918-9.
- ↑ 1 2 3 4 5 6 7 8 9 Huang, K. Statistical Mechanics. — 2nd ed.. — John Wiley and Sons, 1987. — С. 136—138.
- ↑ 1 2 Mandl, F. Statistical Physics. — John Wiley and Sons, 1971. — С. 213—219.
- ↑ 1 2 3 4 Pais, A. Subtle is the Lord (англ.). — Oxford University Press, 1982. — ISBN 0-19-853907-X.
- ↑ 1 2 Tolman, R. C. A General Theory of Energy Partition with Applications to Quantum Theory (англ.) // Physical Review : journal. — 1918. — Vol. 11. — P. 261—275.
- ↑ Miedl M., Garcia M., Bamforth C. Haze formation in model beer systems (англ.) // J. Agric. Food Chem. (англ.) (рус. : journal. — 2005. — Vol. 53, no. 26. — P. 10161—10165. — doi:10.1021/jf0506941. — PMID 16366710.
- ↑ Mason, M; Weaver W. The Settling of Small Particles in a Fluid (англ.) // Physical Review : journal. — 1924. — Vol. 23. — P. 412—426. — doi:10.1103/PhysRev.23.412.
- ↑ Brush, S. G. The Kind of Motion We Call Heat, Volume 1 (англ.). — Amsterdam: North Holland, 1976. — P. 134—159. — ISBN 978-0444870094.
- ↑ Brush, S. G. The Kind of Motion We Call Heat, Volume 2 (англ.). — Amsterdam: North Holland, 1976. — P. 336—339. — ISBN 978-0444870094.
- ↑ Waterston, JJ. On the physics of media that are composed of free and elastic molecules in a state of motion (англ.) // Roy. Soc. Proc. : journal. — 1846/1893. — Vol. 5. — P. 604.(абстракт). Полностью не опубликован до {{{заглавие}}} // Philos. Trans. R. Soc. London. — 1893. — Т. A183. — С. 1—79. Переиздан The collected scientific papers of John James Waterston (англ.) / J. S. Haldane. — Edinburgh: Oliver & Boyd, 1928.
- ↑ Waterston, J. J. Thoughts on the Mental Functions. — 1843. (перепечатано в его Papers, 3, 167, 183.)
- ↑ Waterston, J. J. {{{заглавие}}} // British Association Reports. — 1851. — Т. 21. — С. 6.
Основная статья Уотерстона была написана и подана в 1845 году в Королевское общество. После отказа напечатать работу общество также отказалось от возврата манускрипта и сохранило его среди других статей в архиве. Манускрипт был найден в 1891 году Лордом Рэлеем, который раскритиковал референта за то, что тот не распознал значительность работы Уотерстона. Уотерстону удалось опубликовать свои идеи в 1851 году, и поэтому он опередил Максвелла в изложении первой версии теоремы равнораспределения.
- ↑ Maxwell, J. C. Illustrations of the Dynamical Theory of Gases // The Scientific Papers of James Clerk Maxwell (англ.) / W. D. Niven. — New York: Dover, 2003. — P. Vol.1, pp. 377—409. — ISBN 978-0486495606. Read by Prof. Maxwell at a Meeting of the British Association at Aberdeen on 21 September 1859.
- ↑ Boltzmann, L. Einige allgemeine Sätze über Wärmegleichgewicht (Some general statements on thermal equilibrium) (нем.) // Wiener Berichte : magazin. — 1871. — Bd. 63. — S. 679—711. (нем.) В этой предварительной работе Больцман показал, что средняя полная кинетическая энергия равна средней полной потенциальной энергии, когда на систему действуют внешние гармонические силы.
- ↑ Boltzmann, L. Über die Natur der Gasmoleküle (On the nature of gas molecules) // Wiener Berichte. — 1876. — Т. 74. — С. 553—560. (нем.)
- ↑ 1 2 McQuarrie, D. A. Statistical Mechanics. — revised 2nd ed.. — University Science Books, 2000. — С. 91—128.
- ↑ Petit, A. T.; Dulong P. L. Recherches sur quelques points importants de la théorie de la chaleur (Studies on key points in the theory of heat) (фр.) // Annales de Chimie et de Physique (англ.) (рус. : magazine. — 1819. — Vol. 10. — P. 395—413. Архивировано 22 января 2009 года. (фр.)
- ↑ Dewar, J. The Specific Heat of Carbon at High Temperatures (англ.) // Philosophical Magazine : journal. — 1872. — Vol. 44. — P. 461.
- ↑ Weber, HF. Die specifische Wärme des Kohlenstoffs (The specific heat of carbon) (англ.) // Annalen der Physik : journal. — 1872. — Vol. 147. — P. 311—319. Архивировано 10 декабря 2006 года. (нем.)
- ↑ Weber, H. F. Die specifische Wärmen der Elemente Kohlenstoff, Bor und Silicium (The specific heats of elemental carbon, boron, and silicon) (англ.) // Annalen der Physik : journal. — 1875. — Vol. 154. — P. 367—423, 553—582. (недоступная ссылка) (нем.)
- ↑ de la Rive, A.; Marcet F. Quelques recherches sur la chaleur spécifique (Some research on specific heat) (фр.) // Annales de Chimie et de Physique (англ.) (рус. : magazine. — 1840. — Vol. 75. — P. 113—144. Архивировано 27 апреля 2021 года. (фр.)
- ↑ Regnault, H. V. Recherches sur la chaleur spécifique des corps simples et des corps composés (deuxième Mémoire) (Studies of the specific heats of simple and composite bodies) (фр.) // Annales de Chimie et de Physique (англ.) (рус. : magazine. — 1841. — Vol. 1 (3me Série). — P. 129—207. Архивировано 13 апреля 2013 года. (фр.) Read at l’Académie des Sciences on 11 January 1841.
- ↑ Wigand, A. Über Temperaturabhängigkeit der spezifischen Wärme fester Elemente (On the temperature dependence of the specific heats of solids) (англ.) // Annalen der Physik : journal. — 1907. — Vol. 22. — P. 99—106. (нем.)
- ↑ 1 2 Wüller, A. Lehrbuch der Experimentalphysik (Textbook of Experimental Physics) (англ.). — Leipzig: Teubner, 1896. — P. Vol. 2, 507ff. (нем.)
- ↑ 1 2 Eucken, A. Die Molekularwärme des Wasserstoffs bei tiefen Temperaturen (The molecular specific heat of hydrogen at low temperatures) (англ.) // Sitzungsberichte der königlichen Preussischen Akademie der Wissenschaften : journal. — 1912. — Vol. 1912. — P. 141—151. (нем.)
- ↑ 1 2 Maxwell, J. C. On the Dynamical Evidence of the Molecular Constitution of Bodies // The Scientific Papers of James Clerk Maxwell (англ.) / WD Niven. — Cambridge: At the University Press, 1890. — P. Vol.2, pp.418—438. Лекция прочитанная профессором Максвеллом Химическому обществу 18 февраля 1875 года.
- ↑ 1 2 Kittel, C. Introduction to Solid State Physics. — New York: John Wiley and Sons, 1996. — С. 151—156.
- ↑ Boltzmann, L. On certain Questions of the Theory of Gases (англ.) // Nature. — 1895. — Vol. 51. — P. 413—415.
- ↑ Thomson, W. Baltimore Lectures. — Baltimore: Johns Hopkins University Press, 1904. — С. Sec. 27. Перепечатана в 1987 году издательством MIT Press под названием Kelvin’s Baltimore Lectures and Modern Theoretical Physics: Historical and Philosophical Perspectives (Robert Kargon and Peter Achinstein, editors). ISBN 978-0-262-11117-1
- ↑ Rayleigh, J. W. S. The Law of Partition of Kinetic Energy (англ.) // Philosophical Magazine : journal. — 1900. — Vol. 49. — P. 98—118.
- ↑ Einstein, A. Die Plancksche Theorie der Strahlung und die Theorie der spezifischen Wärme (The Planck theory of radiation and the theory of specific heat) // Annalen der Physik. — 1907. — Т. 22. — С. 180—190. (нем.)
- ↑ Einstein, A. Berichtigung zu meiner Arbeit: ‘Die Plancksche Theorie der Strahlung und die Theorie der spezifischen Wärme’ (Correction to previous article) (нем.) // Annalen der Physik : magazin. — 1907. — Bd. 22. — S. 800. (нем.)
- ↑ Einstein, A. Eine Beziehung zwischen dem elastischen Verhalten and der spezifischen Wärme bei festen Körpern mit einatomigem Molekül (A connection between the elastic behavior and the specific heat of solids with single-atom molecules) // Annalen der Physik. — 1911. — Т. 34. — С. 170—174. Архивировано 20 мая 2020 года. (нем.)
- ↑ Einstein, A. Bemerkung zu meiner Arbeit: ‘Eine Beziehung zwischen dem elastischen Verhalten and der spezifischen Wärme bei festen Körpern mit einatomigem Molekül’ (Comment on previous article) (нем.) // Annalen der Physik : magazin. — 1911. — Bd. 34. — S. 590. Архивировано 20 мая 2020 года. (нем.)
- ↑ Einstein, A. Elementare Betrachtungen über die thermische Molekularbewegung in festen Körpern (Elementary observations on the thermal movements of molecules in solids) // Annalen der Physik. — 1911. — Т. 35. — С. 679—694. Архивировано 27 апреля 2021 года. (нем.)
- ↑ Nernst, W. Untersuchungen über die spezifische Wärme bei tiefen Temperaturen. II. (Investigations into the specific heat at low temperatures) (англ.) // Sitzungsberichte der Königlich Preussischen Akademie der Wissenschaften : journal. — 1910. — Vol. 1910. — P. 262—282. (нем.)
- ↑ Hermann, Armin. The Genesis of Quantum Theory (1899–1913) (англ.). — original title: Frühgeschichte der Quantentheorie (1899–1913), translated by Claude W. Nash. — Cambridge, MA: The MIT Press, 1971. — P. 124—145. — ISBN 0-262-08047-8, LCCN 73-151106.
- ↑ 1 2 3 Tolman, R. C. The Principles of Statistical Mechanics. — New York: Dover Publications, 1938. — С. 93—98. — ISBN 0-486-63896-0.
- ↑ Clausius, R. Ueber einen auf die Wärme anwendbaren mechanischen Satz (нем.) // Annalen der Physik : magazin. — 1870. — Bd. 141. — S. 124—130. Архивировано 8 марта 2021 года. (нем.)
Clausius, R. J. E. On a Mechanical Theorem Applicable to Heat // Philosophical Magazine, Ser. 4. — 1870. — Т. 40. — С. 122—127. - ↑ 1 2 L. Vu-Quoc, Configuration integral (statistical mechanics) Архивировано 11 октября 2008 года., 2008.
- ↑ McQuarrie, D. A. Statistical Mechanics. — revised 2nd ed.. — University Science Books, 2000. — С. 254—264. — ISBN 978-1891389153.
- ↑ 1 2 Tolman, R. C. Statistical Mechanics, with Applications to Physics and Chemistry (англ.). — Chemical Catalog Company, 1927. — P. 76—77.
- ↑ Terletskii, Y. P. Statistical Physics. — translated: N. Fröman. — Amsterdam: North-Holland, 1971. — С. 83—84. — ISBN 0-7204-0221-2, LCCN 70-157006.
- ↑ Collins, G. W. The Virial Theorem in Stellar Astrophysics (англ.). — Pachart Press, 1978. Архивная копия от 4 декабря 2010 на Wayback Machine
- ↑ Chandrasekhar, S. An Introduction to the Study of Stellar Structure (англ.). — Chicago: University of Chicago Press, 1939. — P. 49—53.
- ↑ Kourganoff, V. Introduction to Advanced Astrophysics. — Dordrecht, Holland: D. Reidel (англ.) (рус., 1980. — С. 59—60, 134—140, 181—184.
- ↑ Chiu, H.-Y. Stellar Physics, volume I. — Waltham, MA: Blaisdell Publishing, 1968.
- ↑ Noyes, R. W. The Sun, Our Star. — Cambridge, MA: Harvard University Press, 1982. — ISBN 0-674-85435-7.
- ↑ Ostlie, D. A.; Carroll B. W. An Introduction to Modern Stellar Astrophysics (англ.). — Reading, MA: Addison-Wesley, 1996. — ISBN 0-201-59880-9.
- ↑ Jeans, J. H. The Stability of a Spherical Nebula (англ.) // Phil. Trans. A (англ.) (рус. : journal. — 1902. — Vol. 199. — P. 1—53. — doi:10.1098/rsta.1902.0012.
- ↑ 1 2 McQuarrie, D. A. Statistical Mechanics. — revised 2nd ed.. — University Science Books, 2000. — С. 121—128. — ISBN 978-1891389153.
- ↑ Callen, H. B. Thermodynamics and an Introduction to Thermostatistics (англ.). — New York: John Wiley and Sons, 1985. — P. 375—377. — ISBN 0-471-86256-8.
- ↑ Arnold, V. I.; Avez A. Théorie ergodique des systèms dynamiques. — Gauthier-Villars, Paris. (фр.) (English edition: Benjamin-Cummings, Reading, Mass. 1968), 1967.
- ↑ 1 2 Reichl, L. E. A Modern Course in Statistical Physics. — 2nd ed.. — Wiley Interscience, 1998. — С. 326—333. — ISBN 978-0471595205.
- ↑ Dmitry M. Naplekov, Vladimir V. Yanovsky. Distribution of energy in the ideal gas that lacks equipartition (англ.) // Scientific Reports. — 2023-02-28. — Vol. 13, iss. 1. — P. 3427. — ISSN 2045-2322. — doi:10.1038/s41598-023-30636-6.
- ↑ 1 2 3 Einstein, A. Über einen die Erzeugung und Verwandlung des Lichtes betreffenden heuristischen Gesichtspunkt (A Heuristic Model of the Creation and Transformation of Light) (нем.) // Annalen der Physik : magazin. — 1905. — Bd. 17. — S. 132—148. — doi:10.1002/andp.19053220607. (недоступная ссылка) (нем.). An English translation is available from Wikisource.
- ↑ Rayleigh, J. W. S. Remarks upon the Law of Complete Radiation (англ.) // Philosophical Magazine : journal. — 1900. — Vol. 49. — P. 539—540.
Литература[править | править код]
- K. Huang. Statistical Mechanics. — 2nd ed. — John Wiley and Sons, 1987. — P. 136—138. — ISBN 0-471-81518-7.
- A. I. Khinchin. Mathematical Foundations of Statistical Mechanics / Пер. G. Gamow. — New York: Dover Publications, 1949. — P. 93—98. — ISBN 0-486-63896-0.
- L. D. Landau, E. M. Lifshitz. Statistical Physics, Part 1. — 3rd ed. — Pergamon Press, 1980. — P. 129—132. — ISBN 0-08-023039-3.
- F. Mandl. Statistical Physics. — John Wiley and Sons, 1971. — P. 213—219. — ISBN 0-471-56658-6.
- F. Mohling. Statistical Mechanics: Methods and Applications. — John Wiley and Sons, 1982. — P. 137—139, 270—273, 280, 285—292. — ISBN 0-470-27340-2.
- R. K. Pathria. Statistical Mechanics. — Pergamon Press, 1972. — P. 43—48, 73—74. — ISBN 0-08-016747-0.
- W. Pauli. Pauli Lectures on Physics: Volume 4. Statistical Mechanics. — MIT Press, 1973. — P. 27—40. — ISBN 0-262-16049-8.
- R. C. Tolman. Statistical Mechanics, with Applications to Physics and Chemistry. — Chemical Catalog Company, 1927. — P. 72—81.
- R. C. Tolman. The Principles of Statistical Mechanics. — New York: Dover Publications, 1938. — P. 93—98. — ISBN 0-486-63896-0.
Ссылки[править | править код]
- Апплет Архивная копия от 6 августа 2020 на Wayback Machine, демонстрирующий закон равнораспределения в реальном времени для смеси одноатомных и двухатомных газов
- The equipartition theorem in stellar physics, written by Nir J. Shaviv, an associate professor at the Racah Institute of Physics in the Hebrew University of Jerusalem.
Как найти среднюю кинетическую энергию молекул
Молекула является объектом микромира. Поэтому непосредственное измерение ее кинетической энергии невозможно. Средняя кинетическая энергия является статистическим понятием. Это усредненное значение кинетических энергий всех молекул, входящих в вещество.
Вам понадобится
- – периодическая таблица химических элементов;
- – термометр;
- – калькулятор.
Инструкция
Найдите среднюю кинетическую энергию, используя значение средней скорости молекул вещества. Рассчитайте массу одной молекулы вещества. Для этого определите его молярную массу в килограммах на моль при помощи периодической таблицы химических элементов. Для этого найдите относительные атомные массы всех элементов, входящих в состав молекулы вещества. Они указаны в соответствующих ячейках таблицы. Сложите их, и получите относительную молекулярную массу молекулы. Поделите это число на 1000 и получите молярную массу вещества в килограммах на моль.
Поделите молярную массу на число Авогадро (NA=6,022∙10^23 1/моль) и получите массу одной молекулы вещества m0 в килограммах. Посчитайте среднюю кинетическую энергию молекул, умножив массу одной молекулы m0 на квадрат ее скорости v, а результат поделите на 2 (Ek=m0∙v²/2).
Пример. Рассчитайте среднюю кинетическую скорость молекул азота, если их средняя скорость равна 100 м/с. Молярная масса двухатомной молекулы азота равна 0,028 кг/моль. Найдите массу одной молекулы 0,028/(6,022∙10^23)≈4,6∙10^(-25) кг. Определите среднюю кинетическую энергию молекул Ek= 4,6∙10^(-25)∙100²/2=2,3∙10^(-21) Дж.
Найдите среднюю кинетическую энергию молекул газа через значение температуры. Измерьте эту величину термометром. Если прибор измеряет в градусах Цельсия, переведите значение температуры в Кельвины по абсолютной шкале. Для этого к значению температуры в градусах Цельсия прибавьте число 273. Например, если температура газа 23ºС, то по абсолютной шкале его температура будет равна Т=23+273=296 К.
Определите степень свободы молекулы i. Эта величина для одноатомной молекулы равна 3. Для двухатомной частицы – 5, трехатомной и более – 6. Рассчитайте среднюю кинетическую энергию, умножив степень свободы молекулы на абсолютную температуру газа и постоянную Больцмана (k=1,38∙10^(-23)). Результат поделите на число 2 (Ek=i∙k∙T/2).
Пример. Найдите среднюю кинетическую энергию молекул двухатомного газа при температуре 85ºС. Определите температуру газа по абсолютной шкале Т=85+273=358К. Степень свободы двухатомной молекулы i=5. Произведите расчет Ek=5∙1,38∙10^(-23)∙358/2≈1,24∙10^(-20) Дж.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.



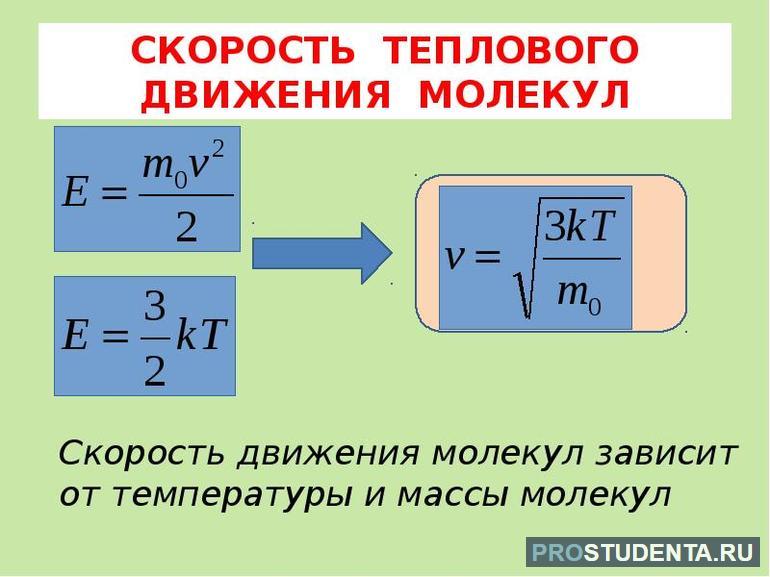



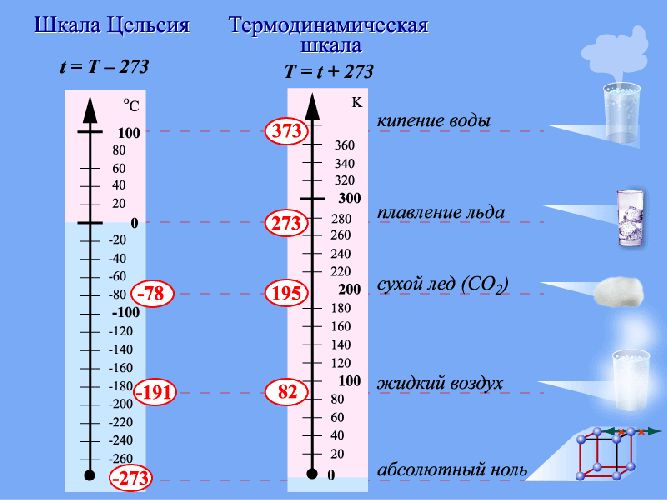
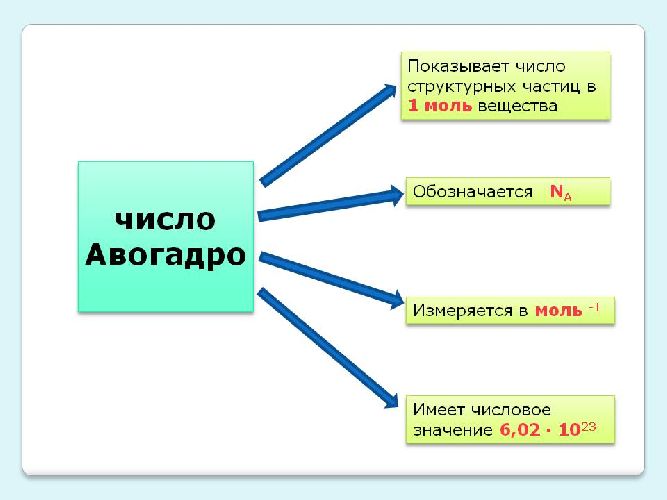

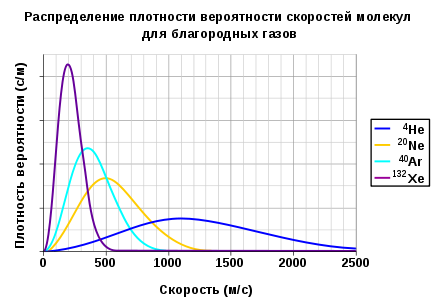






























































![{displaystyle Gamma (E,Delta E)=int _{Hin left[E,E+Delta Eright]}dGamma .}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c1d30011a6e9f81ffb1ec8d5f853eb11512962c8)

![{displaystyle int _{Hin left[E,E+Delta Eright]}ldots dGamma =Delta E{frac {partial }{partial E}}int _{H<E}ldots dGamma ,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/dacf6f8ccd4ccf04ffa00683a62e9327772e5f0f)



![{displaystyle {mathcal {N}}int left[e^{-beta H(p,q)}x_{k}right]_{x_{k}=a}^{x_{k}=b}dGamma _{k}+{mathcal {N}}int e^{-beta H(p,q)}x_{k}beta {frac {partial H}{partial x_{k}}}dGamma =1,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4e941a978fe3d56ab99364c732bd077bb21eee1e)

![{displaystyle {begin{aligned}{Bigl langle }x_{m}{frac {partial H}{partial x_{n}}}{Bigr rangle }&={frac {1}{Gamma }},int _{Hin left[E,E+Delta Eright]}x_{m}{frac {partial H}{partial x_{n}}},dGamma \&={frac {Delta E}{Gamma }},{frac {partial }{partial E}}int _{H<E}x_{m}{frac {partial H}{partial x_{n}}},dGamma \&={frac {1}{rho }},{frac {partial }{partial E}}int _{H<E}x_{m}{frac {partial left(H-Eright)}{partial x_{n}}},dGamma ,end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/aaed7c2b326b93b2548e32655ffc2945954a1b23)