Физика, 10 класс
Урок 18. Основное уравнение МКТ
Перечень вопросов, рассматриваемых на уроке:
1) средняя кинетическая энергия молекулы;
2) давление газа;
3) основное уравнение МКТ;
Глоссарий по теме:
Давление идеального газа пропорционально произведению концентрации молекул и средней кинетической энергии поступательного движения молекул.
Средняя кинетическая энергия молекул – усреднённая величина, равная половине произведения массы молекулы на среднюю величину квадрата её скорости.
Концентрация – число молекул в единице объёма.
Масса молекулы (или атома) – чрезвычайно маленькая величина в макроскопических масштабах (граммах и килограммах), вычисляется через отношение массы вещества к количеству содержащихся в ней молекул (или атомов).
Изменение импульса тела – произведение силы на время действия силы. Импульс силы всегда показывает, как изменяется импульс тела за данное время.
Основная и дополнительная литература по теме урока:
- Мякишев Г.Я., Буховцев Б.Б., Сотский Н.Н. Физика.10 класс. Учебник для общеобразовательных организаций М.: Просвещение, 2017. С. 188 – 192.
- Кирик Л.А., Генденштейн Л.Э., Гельфгат И.М.. Задачи по физике. 10-11 классы для профильной школы. – М.: Илекса, 2010. С. 111.
- Рымкевич А.П. Физика. Задачник. 10-11 классы. – М.: Дрофа, 2013. С. 65 – 67.
Открытые электронные ресурсы по теме урока:
- http://kvant.mccme.ru/1991/09/idealnyj_gaz_-_universalnaya_f.htm
- http://kvant.mccme.ru/1983/10/davlenie_idealnogo_gaza.htm
- http://kvant.mccme.ru/1987/09/davlenie_gaza_v_sosude.htm
Теоретический материал для самостоятельного изучения
Основная задача молекулярно-кинетической теории газа заключается в том, чтобы установить соотношение между давлением газа и его микроскопическими параметрами – массой молекул, их средней скоростью и концентрацией. Это соотношение называется основным уравнением молекулярно-кинетической теории газа.
Давление газа на стенку сосуда обусловлено ударами молекул, давление газа пропорционально концентрации молекул: чем больше молекул в единице объема, тем больше ударов молекул о стенку за единицу времени. Каждая молекула при ударе о стенку передает ей импульс, пропорциональный импульсу молекулы m0v.
Давление пропорционально второй степени скорости, так как, чем больше скорость молекулы, тем чаще она бьется о стенку сосуда. Расчеты показывают, что основное уравнение молекулярно-кинетической теории идеального газа имеет вид:
 , где m0 – масса одной молекулы газа,
, где m0 – масса одной молекулы газа,
n– концентрация молекул,
 – среднее значение квадрата скорости молекул.
– среднее значение квадрата скорости молекул.

Коэффициент  обусловлен трёхмерностью пространства – во время хаотического движения молекул все три направления равноправны.
обусловлен трёхмерностью пространства – во время хаотического движения молекул все три направления равноправны.
Средняя кинетическая энергия поступательного движения

тогда уравнение примет вид:

Давление идеального газа пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы.
Примеры и разбор решения заданий.
1. К каждой позиции первого столбца подберите соответствующую позицию второго:
|
ФИЗИЧЕСКИЕ ВЕЛИЧИНЫ |
ФОРМУЛЫ |
|
1) импульс тела |
А) |
|
2) средняя кинетическая энергия молекул |
Б) |
|
3) давление газа на стенку сосуда |
В) |
|
4) концентрация молекул |
Г) |
Правильный ответ: вспомнив формулы величин, устанавливаем соответствие:
|
ФИЗИЧЕСКИЕ ВЕЛИЧИНЫ |
ФОРМУЛЫ |
|
1) импульс тела |
В) |
|
2) средняя кинетическая энергия молекул |
А) |
|
3) давление газа на стенку сосуда |
Г) |
|
4) концентрация молекул |
Б) |
2. Кислород находится при нормальных условиях. Средняя квадратичная скорость молекул кислорода в этом случае равна ___ м/с.
Решение:


Ответ: 460 м/с.
Уравнение состояния идеального газа в форме (p=frac 13nm_0overline {v^2}) или (p=frac 23noverline E) может быть обосновано и методами кинетической теории газов. На основе кинетического подхода сравнительно просто выводится выражение для давления идеального газа в сосуде, которое получается как результат усреднения импульсов молекул, передаваемых стенке сосуда при многочисленных соударениях молекул со стенкой. Величина получаемого при этом давления определяется как
(p=frac 13nmbig (v^2big)),
где (v^2) – среднее значение квадрата скорости молекул, (m) – масса молекулы.
Средняя кинетическая энергия молекул газа (в расчете на одну молекулу) определяется выражением
(E_k=frac 12mbig (v^2big)).
Кинетическая энергия поступательного движения атомов и молекул, усредненная по огромному числу беспорядочно движущихся частиц, является мерилом того, что называется температурой. Если температура T измеряется в градусах Кельвина (К), то связь ее с (E_k) дается соотношением
(E_k=frac 32 kT).
Это соотношение позволяет, в частности, придать более отчетливый физический смысл постоянной Больцмана (k = 1,38·10^{–23}) Дж/K, которая фактически является переводным коэффициентом, определяющим, какая часть джоуля содержится в градусе.
Используя (6) и (7), находим, что (frac 13m v^2 = kT). Подстановка этого соотношения в формулу для энергии приводит к уравнению состояния идеального газа в форме
(p = nkT,) которое уже было получено из уравнения Клапейрона – Менделеева.
Также из уравнений можно определить значение среднеквадратичной скорости молекул:
((v)_{ке}=sqrt{(v^2)}=big (frac {3kT}{m}big )^{frac 12}=big (frac{3RT}Mbig )^{frac 12}).
Расчеты по этой формуле при (T = 273) K дают для молекулярного водорода (v_{кв} = 1838 ) м/с, для азота – (493 ) м/с, для кислорода – (461) м/с и т. д.
Напомним, что газообразное состояние возникает тогда, когда энергия теплового движения молекул вещества превышает энергию их взаимодействия. Молекулы вещества в этом состоянии приобретают прямолинейное поступательное движение, а индивидуальные свойства веществ теряются, и они подчиняются общим для всех газов законам. Газообразные тела не имеют собственной формы и легко изменяют свой объем при воздействии внешних сил или при изменении температуры.
-
Плотность идеального газа в сосуде – (1,2) кг/м(^3). Если средняя квадратичная скорость молекул газа равна (500) м/с, то газ находится под давлением
-
Давление кислорода и водорода при одинаковых концентрациях молекул и равных средних квадратичных скоростях их движения находятся в соотношении (М((O_2)) (= 0,032) кг/моль; М((H_2)) (= 0,002) кг/моль)
-
В вакуумном диоде электроны ускоряются до энергии (140) эВ. Их минимальная скорость у анода лампы равна
(e (= 1,6 ⋅ 10^{-19}) Кл; (m_e) (= 9 ⋅ 10^{-31}) кг; (1) эВ (= 1,6 ⋅ 10^{-19})Дж)
-
Объем одноатомного газа уменьшили в (2) раза, а среднюю кинетическую энергию молекул увеличили в (3) раза. Определите изменение давления.
-
Найдите среднюю кинетическую энергию атома аргона, если температура газа равна (117^{circ}C) ((k = 1,38 ⋅ 10^{-23})(frac{Дж}{К})).
-
Чему равна энергия покоя электрона? ((c = 3 ⋅ 10^8)м/с; (m = 9,1 ⋅ 10^{-31})кг)
-
Во сколько раз отличаются средние квадратичные скорости молекул диоксида серы и гелия при одинаковой температуре?
(M(_{SO_2}) (= 64 ⋅ 10^{-3})(frac{кг}{моль}); M(_{He}) (= 4 ⋅ 10^{-3})(frac{кг}{моль}))
-
Во сколько раз изменится среднеквадратичная скорость движения частиц одноатомного идеального газа (υ), если, не меняя его плотности, увеличить давление в (9) раз?
-
Среднеквадратичная скорость молекул идеального одноатомного газа, заполняющего закрытый сосуд, равна (0,25) км/с. Газ охладили, уменьшив при этом давление на (19%). Как и на сколько изменилась среднеквадратичная скорость молекул этого газа?
-
Одноатомный газ находится при давлении в (400) кПа. Чему будет равна средняя кинетическая энергия молекул этого газа, если в (1) м(^3) содержится примерно (2·10^{27}) молекул?
-
Маленькая частичка массой (19,2cdot10^{-12}) кг находится в воздухе. Во сколько раз ее средняя квадратичная скорость будет отличаться от средней квадратичной скорости движения молекул воздуха? (Молярная масса воздуха – (0,029) кг/моль)
-
Вычислите среднюю квадратичную скорость молекул газа, находящегося под давлением (10) кПа, если его масса равна (3) кг, объем – (16) м(^3).
-
Можно ли получить температуру ниже или равную абсолютному нулю?
-
При нагревании ртуть в градуснике расширилась. Что это означает?
-
Найдите давление углекислого газа в сосуде, если концентрация его молекул равна (2,7 · 10^{20}) м(^{–3}), а среднее значение квадрата их скорости – (3 · 10^4) м(^2)/с(^2). (Масса молекулы углекислого газа равна (7,3 · 10^{–26}) кг)
Средняя кинетическая энергия теплового движения молекул газа.
Уравнение состояния
идеального газа в форме pV
= nRT
или p
= nkT может
быть обосновано и методами кинетической
теории газов. На основе кинетического
подхода сравнительно просто выводится
выражение для давления идеального газа
в сосуде, которое получается как результат
усреднения импульсов молекул, передаваемых
стенке сосуда при многочисленных
соударениях молекул со стенкой. Величина
получаемого при этом давления определяется
как
![]() ,
,
Где бv
2с – среднее
значение квадрата скорости молекул, m
– масса молекулы.
Средняя кинетическая
энергия молекул газа (в расчете на одну
молекулу) определяется выражением
![]()
Кинетическая
энергия поступательного движения атомов
и молекул, усредненная по огромному
числу беспорядочно движущихся частиц,
является мерилом того, что называется
температурой. Если температура T
измеряется в градусах Кельвина (К), то
связь ее с Ek
дается соотношением
![]()
Это соотношение
позволяет, в частности, придать более
отчетливый физический смысл постоянной
Больцмана
-
Внутренняя
энергия идеального газа.
В теории идеального газа потенциальная
энергия взаимодействия молекул считается
равной нулю. Поэтому внутренняя энергия
идеального газа определяется кинетической
энергией движения всех его молекул.
Средняя энергия движения одной молекулы
равна
![]()
Так как в одном киломоле содержится
![]() молекул,
молекул,
то внутренняя энергия одного киломоля
газа будет
![]() Учитывая,
Учитывая,
что![]() ,
,
получим![]()
Для любой массы m газа, т.е. для любого
числа киломолей
![]() внутренняя
внутренняя
энергия
|
|
(10.12) |
Из этого выражения следует, что внутренняя
энергия является однозначной функцией
состояния и, следовательно, при совершении
системой любого процесса, в результате
которого система возвращается в исходное
состояние, полное изменение внутренней
энергии равно нулю. Математически это
записывается в виде тождества
![]()
-
Распределение
Максвелла
Распределение
Ма́ксвелла—распределение
вероятности, встречающееся вфизикеихимии.
Оно лежит в основаниикинетической
теории газов, которая объясняет
многие фундаментальные свойства газов,
включаядавлениеидиффузию.
Распределение Максвелла также применимо
для электронных процессов переноса и
других явлений. Распределение Максвелла
применимо к множеству свойств
индивидуальных молекул в газе. О нём
обычно думают как о распределении
энергий молекул в газе, но оно может
также применяться к распределению
скоростей, импульсов, и модуля импульсов
молекул. Также оно может быть выражено
как дискретное распределение по множеству
дискретных уровней энергии, или как
непрерывное распределение по некоторому
континууму энергии.
Распределение Максвелла может и должно
быть получено при помощи статистической
механики(см. происхождениестатсуммы).
Как распределение энергии, оно
соответствует самому вероятному
распределению энергии, в
столкновительно-доминируемой системе,
состоящей из большого количества
невзаимодействующих частиц, в которой
квантовые эффекты являются незначительными.
Так как взаимодействие между молекулами
в газе является обычно весьма небольшим,
распределение Максвелла даёт довольно
хорошее приближение ситуации, существующей
в газе.
Во многих других случаях, однако, даже
приблизительно не выполнено условие
доминирования упругих
соударенийнад всеми другими
процессами. Это верно, например, в физикеионосферыи космическойплазмы,
где процессы рекомбинации и столкновительного
возбуждения (то есть излучательные
процессы) имеют большое значение, в
особенности для электронов. Предположение
о применимости распределения Максвелла
дало бы в этом случае не только
количественно неверные результаты, но
даже предотвратило бы правильное
понимание физики процессов на качественном
уровне. Также, в том случае где квантоваяде
Бройлева длина волнычастиц
газа не является малой по сравнению с
расстоянием между частицами, будут
наблюдаться отклонения от распределения
Максвелла из-за квантовых эффектов.
Распределение энергии Максвелла может
быть выражено как дискретное распределение
энергии:
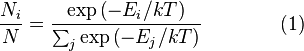 ,
,
где
![]() является
является
числом молекул имеющих энергию![]() при
при
температуре системы![]() ,
,![]() является
является
общим числом молекул в системе и![]() —постоянная
—постоянная
Больцмана. (Отметьте, что иногда
вышеупомянутое уравнение записывается
с множителем![]() ,
,
обозначающим степень вырождения
энергетических уровней. В этом случае
сумма будет по всем энергиям, а не всем
состояниям системы). Поскольку скорость
связана с энергией, уравнение (1) может
использоваться для получения связи
между температурой и скоростями молекул
в газе. Знаменатель в уравнении (1)
известен как каноническаястатистическая
сумма.
-
Распределение
Больцмана.
Распределение Больцмана—
распределение вероятностей различных
энергетических состоянийидеальной
термодинамической системы (идеальный
газ атомов или молекул)в условияхтермодинамического
равновесия; открытоЛ.
Больцманомв1868—1871.
Согласно распределению Больцманасреднее число частиц с полной энергией![]() равно
равно
![]()
где
![]() —
—
кратность состояния частицы с энергией![]() —
—
число возможных состояний частицы с
энергией![]() .
.
Постоянная![]() находится
находится
из условия, что сумма![]() по
по
всем возможным значениям![]() равна
равна
заданному полному числу частиц![]() в
в
системе (условие нормировки):
![]()
В случае, когда движение частиц подчиняется
классической механике, энергию
![]() можно
можно
считать состоящей из
-
кинетической энергии
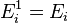 (кин)
(кин)
частицы (молекулы или атома), -
внутренней энергии
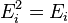 (вн)
(вн)
(например, энергии возбуждения электронов)
и -
потенциальной энергии
 (пот)
(пот)
во внешнем поле, зависящей от положения
частицы в пространстве:
![]()
-
Явление переноса.
Диффузия
В термодинамически
неравновесных системах происходят
особые необратимые процессы, называемые
явлениями
переноса, в
результате которых осуществляется
пространственный перенос массы, импульса,
энергии. К явлениям переноса относятся
теплопроводность
(перенос энергии), диффузия
(перенос массы) и внутреннее
трение
(перенос импульса). Ограничимся одномерными
явлениями переноса. Систему отсчета
будем выберать так, чтобы ось х была
направлена в сторону в направления пер
Диффузия.
При происходит самопроизвольное
проникновение и перемешивание частиц
двух соприкасающихся газов, жидкостей
и даже твердых тел; диффузия есть обмен
масс частиц этих тел, при этом явление
возникает и продолжается, пока существует
градиент плотности. Во времена становления
молекулярно-кинетической теории по
вопросу явления диффузии возникли
противоречия. Поскольку молекулы
перемещаются в пространстве с огромными
скоростями, то диффузия должна происходить
очень быстро. Если же открыть в комнате
крышку сосуда с пахучим веществом, то
запах распространяется довольно
медленно. Но здесь нет противоречия.
При атмосферном давлении молекулы
обладают малой длиной свободного пробега
и, при столкновениях с другими молекулами,
приемущественно «стоят» на месте.
Явление диффузии для химически
однородного газа подчиняется закону
Фика:
![]() (3)
(3)
где jm
— плотность
потока массы
— величина, определяемая массой вещества,
диффундирующего в единицу времени через
единичную площадку, перпендикулярную
оси х, D — диффузия
(коэффициент
диффузии),
dρ/dx — градиент плотности, который равен
скорости изменения плотности на единицу
длины х в направлении нормали к этой
площадке. Знак минус говорит о том, что
перенос массы происходит в направлении
убывания плотности (поэтому знаки jmи dρ/dx противоположны). Диффузия D численно
равна плотности потока массы при
градиенте плотности, равном единице.
Согласно кинетической теории газов,![]() (4)
(4)
-
Явление переноса.
Теплопроводность
В термодинамически
неравновесных системах происходят
особые необратимые процессы, называемые
явлениями
переноса, в
результате которых осуществляется
пространственный перенос массы, импульса,
энергии. К явлениям переноса относятся
теплопроводность
(перенос энергии), диффузия
(перенос массы) и внутреннее
трение
(перенос импульса). Ограничимся одномерными
явлениями переноса. Систему отсчета
будем выберать так, чтобы ось х была
направлена в сторону в направления
переноса.
Теплопроводность.
Если в первой области газа средняя
кинетическая энергия молекул больше,
чем во второй, то вследствие постоянных
столкновений молекул с течением времени
происходит процесс выравнивания средних
кинетических энергий молекул, т. е.,
выравнивание температур. Перенос энергии
в форме теплоты подчиняется закону
Фурье:
![]() (1)
(1)
где jE
— плотность
теплового потока
— величина, которая определяется
энергией, переносимой в форме теплоты
в единицу времени через единичную
площадку, перпендикулярную оси х, λ —
теплопроводность,
— градиент температуры, равный скорости
изменения температуры на единицу длины
х в направлении нормали к этой площадке.
Знак минус говорит о том, что во время
теплопроводности энергия перемещается
в направлении убывания температуры
(поэтому знаки jE
и – противоположны). Теплопроводность
λ равна плотности теплового потока при
градиенте температуры, равном единице.
Можно показать, что
![]() (2)
(2)
где сV
— удельная
теплоемкость
газа при постоянном объеме (количество
теплоты, которое необходимо для нагревания
1 кг газа на 1 К при постоянном объеме),
ρ — плотность газа, <ν>
— средняя скорость теплового движения
молекул, <l>
— средняя длина свободного пробега.
-
Явление переноса.
Вязкость
В термодинамически
неравновесных системах происходят
особые необратимые процессы, называемые
явлениями
переноса, в
результате которых осуществляется
пространственный перенос массы, импульса,
энергии. К явлениям переноса относятся
теплопроводность
(перенос энергии), диффузия
(перенос массы) и внутреннее
трение
(перенос импульса). Ограничимся одномерными
явлениями переноса. Систему отсчета
будем выберать так, чтобы ось х была
направлена в сторону в направления
переноса.
Внутреннее
трение
(вязкость).
Суть механизма возникновения внутреннего
трения между параллельными слоями газа
(жидкости), которые движущутся с различными
скоростями, есть в том, что из-за
хаотического теплового движения
осуществляется обмен молекулами между
слоями, в результате чего импульс слоя,
который движется быстрее, уменьшается,
который движется медленнее — увеличивается,
что приводит к торможению слоя, который
движется быстрее, и ускорению слоя,
который движется медленнее.
Как
известно, сила внутреннего трения между
двумя слоями газа (жидкости) подчиняется
закону
Ньютона:
![]() (5)
(5)
где η — динамическая вязкость
(вязкость), dν/dx
— градиент скорости, который показывает
быстроту изменения скорости в направлении
х, перпендикулярном направлению движения
слоев, S — площадь, на которую действует
сила F.
Согласно второму закону
Ньютона взаимодействие двух слоев можно
рассматривать как процесс, при котором
в единицу времени от одного слоя к
другому передается импульс, который по
модулю равен действующей силе. Тогда
выражение (5) можно записать в виде
![]() (6)
(6)
где jp
— плотность
потока импульса
— величина, которая определяется
определяемая полным импульсом, переносимым
в единицу времени в положительном
направлении оси х через единичную
площадку, перпендикулярную оси х, dν/dx
— градиент скорости. Знак минус говорит
о том, что импульс переносится в
направлении убывания скорости (поэтому
знаки jp
и dν/dx
противоположны).
Динамическая
вязкость η
численно равна плотности потока импульса
при градиенте скорости, равном единице;
она вычисляется по формуле
![]() (7)
(7)
Из сопосавления формул (1), (3) и (6),
которые описывают явления переноса,
следует, что закономерности всех явлений
переноса сходны между собой. Эти законы
были известны еще задолго до того, как
они были обоснованы и получены из
молекулярно-кинетической теории, которая
позволила установить, что внешнее
сходство их математических выражений
является следствием общностью лежащего
в основе явлений теплопроводности,
диффузии и внутреннего трения молекулярного
механизма перемешивания молекул в
процессе их хаотического движения и
столкновений друг с другом.
Рассмотренные
законы Фурье, Фика и Ньютона не вскрывают
молекулярно-кинетической сути
коэффициентов λ, D и η. Выражения для
коэффициентов переноса получаются из
кинетической теории. Они записаны без
вывода, поскольку строгое и формальное
рассмотрение явлений переноса довольно
громоздко, а качественное — не имеет
смысла. Формулы (2), (4) и (7) дают связь
коэффициентов переноса и характеристики
теплового движения молекул. Из этих
формул следуют простые зависимости
между λ, D и η:![]() и
и![]()
-
Реальный газы.
Уравнение Ван-дер-Ваальса. Изотермы
реального газа.
Реальный газ—газ,
который не описывается уравнением
состояния идеального газа Клапейрона —
Менделеева.
Зависимости между
его параметрами показывают, что молекулы
в реальном газе взаимодействуют между
собой и занимают определенный объём.
Состояние реального газа часто на
практике описывается обобщённым
уравнением Менделеева — Клапейрона:
![]()
где p — давление;
V — объем; T — температура; Zr
= Zr
(p,T) — коэффициент
сжимаемости
газа; m — масса; М — молярная
масса;
R — газовая
постоянная.
Уравнение
состояния газа Ван-дер-Ваальса—уравнение,
связывающее основные термодинамические
величины
в модели газа Ван-дер-Ваальса.
Хотя модель
идеального
газа
хорошо описывает поведение реальных
газов
при низких давлениях
и высоких температурах,
в других условиях её соответствие с
опытом
гораздо хуже. В частности, это проявляется
в том, что реальные
газы
могут быть переведены в жидкое
и даже в твёрдое
состояние,
а идеальные — не могут.
Для более точного
описания поведения реальных газов при
низких температурах была создана модель
газа Ван-дер-Ваальса, учитывающая силы
межмолекулярного взаимодействия. В
этой модели внутренняя
энергия
![]() становится
становится
функцией не толькотемпературы,
но и объёма.
Уравнение
Ван-дер-Ваальса — это одно из широко
известных приближённых уравнений
состояния, имеющее компактную форму и
учитывающее основные характеристики
газа с межмолекулярным взаимодействием[1].
-Поскольку весь
процесс происходит при постоянной
температуре T,
кривую, что изображает зависимость
давления р от объёма V,
называют изотермой.
При объёме V1
начинается конденсация
газа, а при объёме V2
она заканчивается. Если V > V1
то вещество будет в газообразном
состоянии, а при V < V2 —
в жидком.
-
Твёрдое тело.
Закон Дюлонга и Пти. Тепловое расширение
твердых тел. Плавление.
Твёрдое тело —
это одно из четырёх агрегатных
состояний вещества,
отличающееся от других агрегатных
состояний (жидкости,
газов,
плазмы)
стабильностью формы и характером
теплового
движения
атомов,
совершающих малые колебания
около положений равновесия[1].
Различают
кристаллические
и аморфные
твёрдые тела. Раздел физики,
изучающий состав и внутреннюю структуру
твёрдых тел, называется физикой
твёрдого тела.
То, как твёрдое тело меняет форму при
воздействиях и движении, изучается
отдельной дисциплиной — механикой
твёрдого (деформируемого) тела.
Движением абсолютно твёрдого тела
занимается третья наука — кинематика
твёрдого тела.
Технические
приспособления, созданные человеком,
используют различные свойства твёрдого
тела. В прошлом твёрдое тело применялось
как конструкционный материал и в основе
употребления лежали непосредственно
ощутимые механические свойства как то
твёрдость,
масса,
пластичность,
упругость,
хрупкость.
В современном мире применение твёрдого
тела основывается на физических
свойствах, которые зачастую обнаруживаются
только при лабораторных исследованиях.
Закон Дюлонга —
Пти
(Закон
постоянства теплоёмкости) —
эмпирический
закон,
согласно которому молярная
теплоёмкость
твёрдых тел при комнатной температуре
близка к 3R[1]:
![]()
где R —
универсальная
газовая постоянная.
Закон выводится
в предположении, что кристаллическая
решетка тела состоит из атомов, каждый
из которых совершает гармонические
колебания
в трех направлениях, определяемыми
структурой решетки, причем колебания
по различным направлениям абсолютно
независимы друг от друга. При этом
получается, что каждый атом представляет
три
осциллятора
с энергией E,
определяемой следующей формулой:
![]()
Формула вытекает
из теоремы о равнораспределении энергии
по степеням свободы. Так как каждый
осциллятор имеет одну степень
свободы,
то его средняя кинетическая
энергия
равна
![]() ,
,
а так как колебания происходят
гармонически, то средняяпотенциальная
энергия
равна средней кинетической, а полная
энергия — соответственно их сумме.
Число осцилляторов в одном моле вещества
составляет
![]() ,
,
их суммарная энергия численно равна
теплоемкости тела — отсюда и вытекает
закон Дюлонга-Пти.
Приведем таблицу
экспериментальных значений теплоемкости
ряда химических элементов для нормальных
температур:
|
Элемент |
|
Элемент |
|
|
C |
1,44 |
Pt |
6,11 |
|
B |
2,44 |
Au |
5,99 |
|
Al |
5,51 |
Pb |
5,94 |
|
Ca |
5,60 |
U |
6,47 |
|
Ag |
6,11 |
– |
– |
Тепловое
расширение—изменение
линейных размеров и формы тела при
изменении его температуры.
Количественно тепловое расширение
жидкостей и газов при постоянном давлении
характеризуется изобарным
коэффициентом
расширения
(объёмным коэффициентом теплового
расширения). Для характеристики теплового
расширения твёрдых тел дополнительно
вводят коэффициент линейного теплового
расширения.
Раздел физики
изучающий данное свойство называется
дилатометрией.
Тепловое расширение
тел учитывается при конструировании
всех установок, приборов и машин,
работающих в переменных температурных
условиях.
Основной закон
теплового расширения
гласит, что тело с линейным размером
![]() в
в
соответствующем измерении при увеличении
его температуры на![]() расширяется
расширяется
на величину![]() ,
,
равную:
![]() ,
,
где
![]() —
—
так называемыйкоэффициент
линейного теплового расширения.
Аналогичные формулы имеются для расчета
изменения площади и объема тела. В
приведенном простейшем случае, когда
коэффициент теплового расширения не
зависит ни от температуры, ни от
направления расширения, вещество будет
равномерно расширяться по всем
направлениям в строгом соответствии с
вышеприведенной формулой.
Плавле́ние—это процесс перехода
тела из кристаллического
твёрдого состояния в жидкое, то есть
переход вещества из одного агрегатного
состояния
в другое. Плавление происходит с
поглощением удельной
теплоты плавления
и является фазовым
переходом
первого рода, которое сопровождается
скачкообразным
изменением теплоёмкости
в конкретной для каждого вещества
температурной точке превращения —
температура
плавления.
Способность
плавиться
относится к физическим
свойствам
вещества[1]
При нормальном
давлении, наибольшей температурой
плавления
среди металлов
обладает вольфрам
(3422 °C), среди простых
веществ —
углерод
(по разным данным 3500 — 4500 °C[2])
а среди произвольных веществ — карбид
тантала-гафния
Ta4HfC5
(4216 °C). Можно считать, что самой низкой
температурой плавления обладает гелий:
при нормальном давлении он остаётся
жидким при сколь угодно низких
температурах.
Многие вещества
при нормальном давлении не имеют жидкой
фазы. При нагревании они путем сублимации
сразу переходят в газообразное состояние.
-
Жидкости.
Поверхностное плавление. Смачивание.
Жи́дкость—
вещество, находящееся в жидком агрегатном
состоянии,
занимающем промежуточное положение
между твёрдым и газообразным состояниями[1].
Основным свойством жидкости, отличающим
её от веществ, находящихся в других
агрегатных состояниях, является
способность неограниченно менять форму
под действием касательных механических
напряжений, даже сколь угодно малых,
практически сохраняя при этом объём.
Поверхностные
явления,физико-химические
явления, которые обусловлены особыми
(по сравнению с объемными) свойствами
поверхностных слоев жидкостей
и твердых тел. Наиболее общее и важное
свойство этих слоев – избыточная свободная
энергия F = sS,
где s-поверхностное (межфазное) натяжение,
для твердых тел – удельная свободная
поверхностная
энергия.
S-площадь
поверхности раздела фаз. Поверхностные
явления протекают наиболее выраженно
в гетерогенных системах с сильно развитой
поверхностью раздела фаз, т. е. в дисперсных
системах. Изучение
закономерностей поверхностных явлений
является составной частью коллоидной
химии
и чрезвычайно важно для всех ее
практических приложений.
Самопроизвольные
поверхностные явления происходят
вследствие уменьшения поверхностной
энергии системы.
Они могут быть обусловлены уменьшением
общей поверхности системы либо уменьшением
поверхностного натяжения на границе
раздела фаз. К поверхностным явлениям,
связанным с уменьшением общей поверхности,
относят: 1) капиллярные
явления.
в частности приобретение каплями (в
туманах) и газовыми пузырьками (в жидкой
среде) сферич. формы, при которой
поверхность капли (пузырька) минимальна.
2) Коалесценция
– слияние капель в эмульсиях
(или газовых пузырьков в пенах)при
их непосредств. контакте. 3) Спекание
мелких твердых частиц в порошках
при достаточно высоких температурах.
4) Собирательная рекристаллизация –
укрупнение зерен поликристаллического
материала при повышении температуры.
5) Изотермическая перегонка
– увеличение объема крупных капель за
счет уменьшения мелких. При этом
вследствие повышенного давления
паров
жидкости с более высокой кривизной
поверхности происходит испарение
мелких капель и последующая их конденсация
на более крупных каплях. Для жидкости,
находящейся на твердой подложке,
существенная роль в переносе вещества
от мелких капель к крупным играет
поверхностная диффузия.
Изотермическая перегонка
твердых частиц может происходить через
жидкую фазу вследствие повышенной
растворимости более мелких частиц.
При определенных
условиях в системе могут происходить
самопроизвольные поверхностные явления,
сопровождающиеся увеличением общей
поверхности раздела фаз. Так,
самопроизвольное диспергирование и
образование устойчивых лиофильных
коллоидных
систем
(например, критических эмульсий)
происходит в условиях, когда увеличение
поверхностной энергии, вызываемое
измельчением
частиц, компенсируется их вовлечением
в тепловое движение и соответствующим
возрастанием энтропии
(см. Микроэмульсии).
При гомогенном
образовании зародышей новой фазы при
конденсации паров, кипении.
кристаллизации
из растворов и расплавов
увеличение энергии системы вследствие
образования новой поверхности
компенсируется уменьшением хим.
потенциала вещества при фазовом
переходе.
Критические размеры зародышей, при
превышении которых выделение новой
фазы идет самопроизвольно, зависят от
поверхностного натяжения, а также от
величины перегрева (переохлаждения,
пересыщения). Связь между этими параметрами
определяется уравнением Гиббса (см.
Зарождение
новой фазы).
Сма́чивание—физическое
взаимодействие жидкости
с поверхностью твёрдого
тела
или другой жидкости. Смачивание бывает
двух видов:
-
Иммерсионное
(вся поверхность твёрдого тела
контактирует с жидкостью) -
Контактное
(состоит из трёх фаз — твердая,
жидкая, газообразная)
Смачивание зависит
от соотношения между силами сцепления
молекул
жидкости с молекулами (или атомами)
смачиваемого тела (адгезия)
и силами взаимного сцепления молекул
жидкости (когезия).
Если жидкость
контактирует с твёрдым телом, то
существуют две возможности:
-
молекулы жидкости
притягиваются друг к другу сильнее,
чем к молекулам твёрдого тела. В
результате силы притяжения между
молекулами жидкости собирают её в
капельку. Так ведёт себя ртуть
на стекле,
вода
на парафине
или «жирной» поверхности. В этом случае
говорят, что жидкость не
смачивает
поверхность; -
молекулы жидкости
притягиваются друг к другу слабее, чем
к молекулам твёрдого тела. В результате
жидкость стремится прижаться к
поверхности, расплывается по ней. Так
ведёт себя ртуть на цинковой
пластине, вода на чистом стекле или
дереве. В этом случае говорят, что
жидкость смачивает
поверхность.
Степень смачивания
характеризуется углом смачивания. Угол
смачивания (или краевой угол смачивания)
— это угол, образованный касательными
плоскостями к межфазным поверхностям,
ограничивающим смачивающую жидкость,
а вершина угла лежит на линии раздела
трёх фаз. Измеряется методом лежащей
капли[1].
В случае порошков надёжных методов,
дающих высокую степень воспроизводимости,
пока (по состоянию на 2008 год) не разработано.
Предложен весовой метод определения
степени смачивания, но он пока не
стандартизован.
Измерение степени
смачивания весьма важно во многих
отраслях промышленности (лакокрасочная,
фармацевтическая, косметическая
и т. д.). К примеру, на лобовые стёкла
автомобилей наносят особые покрытия,
которые должны быть устойчивы против
разных видов загрязнений. Состав и
физические свойства покрытия стёкол и
контактных линз можно сделать оптимальным
по результатам измерения контактного
угла[2].
К примеру, популярный
метод увеличения добычи нефти при помощи
закачки воды в пласт исходит из того,
что вода заполняет поры и выдавливает
нефть.
В случае мелких пор и чистой воды это
далеко не так, поэтому приходится
добавлять специальные ПАВ.
Оценку смачиваемости горных пород при
добавлении различных по составу растворов
можно измерить различными приборами.
Идеальный газ — газ, удовлетворяющий трем условиям:
- Молекулы — материальные точки.
- Потенциальная энергия взаимодействия молекул пренебрежительно мала.
- Столкновения между молекулами являются абсолютно упругими.
Реальный газ с малой плотностью можно считать идеальным газом.
Измерение температуры
Температуру можно измерять по шкале Цельсия и шкале Кельвина. По шкале Цельсия за нуль принимается температура, при которой происходит плавление льда. По шкале Кельвина за нуль принимается абсолютный нуль — температура, при котором давление идеального газа равно нулю, и его объем тоже равен нулю.
Обозначение температуры
- По шкале Цельсия — t. Единица измерения — 1 градус Цельсия (1 oC).
- По шкале Кельвина — T. Единица измерения — 1 Кельвин (1 К).
Цена деления обеих шкал составляет 1 градус. Поэтому изменение температуры в градусах Цельсия равно изменению температуры в Кельвинах:
∆t = ∆T
При решении задач в МКТ используют значения температуры по шкале Кельвина. Если в условиях задачи температура задается в градусах Цельсия, нужно их перевести в Кельвины. Это можно сделать по формуле:
T = t + 273
Если особо важна точность, следует использовать более точную формулу:
T = t + 273,15
Пример №1. Температура воды равна oC. Определить температуру воды в Кельвинах.
T = t + 273 = 2 + 273 = 275 (К)
Основное уравнение МКТ идеального газа
Давление идеального газа обусловлено беспорядочным движением молекул, которые сталкиваются друг с другом и со стенками сосуда. Основное уравнение МКТ идеального газа связывает давление и другие макропараметры (объем, температуру и массу) с микропараметрами (массой молекул, скоростью молекул и кинетической энергией).
Основное уравнение МКТ
Давление идеального газа пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы.
p=23n−Ek
p — давление идеального газа, n — концентрация молекул газа, −Ek — средняя кинетическая энергия поступательного движения молекул.
Выражая физические величины друг через друга, можно получить следующие способы записи основного уравнения МКТ идеального газа:
|
p=13m0n−v2 |
m0— масса одной молекулы газа; n — концентрация молекул газа; −v2 — среднее значение квадрата скорости молекул газа. Среднее значение квадрата скорости не следует путать со среднеквадратичной скоростью v, которая равна корню из среднего значения квадрата скорости: v=√−v2 |
|
p=13ρ−v2 |
ρ — плотность газа |
|
p=nkT |
k — постоянная Больцмана (k = 1,38∙10–3 Дж/кг) T — температура газа по шкале Кельвина |
Пример №2. Во сколько раз уменьшится давление идеального одноатомного газа, если среднюю кинетическую энергию теплового движения молекул и концентрацию уменьшить в 2 раза?
Согласно основному уравнению МКТ идеального газа, давление прямо пропорционально произведению средней кинетической энергии теплового движения молекул и концентрации его молекул. Следовательно, если каждая из этих величин уменьшится в 2 раза, то давление уменьшится в 4 раза:

Следствия из основного уравнения МКТ идеального газа
Через основное уравнение МКТ идеального газа можно выразить скорость движения молекул (частиц газа):
v=√3kTm0=√3RTM
R — универсальная газовая постоянная, равная произведения постоянной Авогадро на постоянную Больцмана:
R=NAk=8,31 Дж/К·моль
Температура — мера кинетической энергии молекул идеального газа:
−Ek=32kT
T=2−Ek3k
Полная энергия поступательного движения молекул газа определяется формулой:
E=N−Ek
Пример №3. При уменьшении абсолютной температуры на 600 К средняя кинетическая энергия теплового движения молекул неона уменьшилась в 4 раза. Какова начальная температура газа?
Запишем формулу, связывающую температуру со средней кинетической энергией теплового движения молекул, для обоих случаев, с учетом что:

Следовательно:

Составим систему уравнений:

Отсюда:

Задание EF19012
 На графике представлена зависимость объёма постоянного количества молей одноатомного идеального газа от средней кинетической энергии теплового движения молекул газа. Опишите, как изменяются температура и давление газа в процессах 1−2 и 2−3. Укажите, какие закономерности Вы использовали для объяснения.
На графике представлена зависимость объёма постоянного количества молей одноатомного идеального газа от средней кинетической энергии теплового движения молекул газа. Опишите, как изменяются температура и давление газа в процессах 1−2 и 2−3. Укажите, какие закономерности Вы использовали для объяснения.
Алгоритм решения
1.Указать, в каких координатах построен график.
2.На основании основного уравнения МКТ идеального газа и уравнения Менделеева — Клапейрона выяснить, как меняются указанные физические величины во время процессов 1–2 и 2–3.
Решение
График построен в координатах (V;Ek). Процесс 1–2 представляет собой прямую линию, исходящую из начала координат. Это значит, что при увеличении объема растет средняя кинетическая энергия молекул. Но из основного уравнения МКТ идеального газа следует, что мерой кинетической энергии молекул является температура:
T=2−Ek3
Следовательно, когда кинетическая энергия молекул растет, температура тоже растет.
Запишем уравнение Менделеева — Клапейрона:
pV=νRT
Так как количество вещества одинаковое для обоих состояния 1 и 2, запишем:
νR=p1V1T1=p2V2T2
Мы уже выяснили, что объем и температура увеличиваются пропорционально. Следовательно, давление в состояниях 1 и 2 равны. Поэтому процесс 1–2 является изобарным, давление во время него не меняется.
Процесс 2–3 имеет график в виде прямой линии, перпендикулярной кинетической энергии. Так как температуры прямо пропорциональна кинетической энергии, она остается постоянной вместе с этой энергией. Следовательно, процесс 2–3 является изотермическим, температура во время него не меняется. Мы видим, что объем при этом процессе уменьшается. Но так как объем и давление — обратно пропорциональные величины, то давление на участке 2–3 увеличивается.
Ответ:
• Участок 1–2 — изобарный процесс. Температура увеличивается, давление постоянно.
• Участок 2–3 — изотермический процесс. Температура постоянно, давление увеличивается.
pазбирался: Алиса Никитина | обсудить разбор
Задание EF17560
Первоначальное давление газа в сосуде равнялось р1. Увеличив объём сосуда, концентрацию молекул газа уменьшили в 3 раза, и одновременно в 2 раза увеличили среднюю энергию хаотичного движения молекул газа. В результате этого давление р2 газа в сосуде стало равным
Ответ:
а) 13p1
б) 2p1
в) 23p1
г) 43p1
Алгоритм решения
1.Записать исходные данные.
2.Записать основное уравнение МКТ идеального газа.
3.Составить уравнения для состояний 1 и 2.
4.Выразить искомую величину.
Решение
Исходные данные:
• Начальное давление: p0.
• Начальная концентрация молекул: n1 = 3n.
• Конечная концентрация молекул: n2 = n.
• Начальная средняя энергия хаотичного движения молекул: Ek1 = Ek.
• Конечная средняя энергия хаотичного движения молекул: Ek2 = 2Ek.
Основное уравнение МКТ:
p=23n−Ek
Составим уравнения для начального и конечного состояний:
p1=23n1−Ek1=233n−Ek=2n−Ek
p2=23n2−Ek2=23n2−Ek=43n−Ek
Отсюда:
n−Ek=p12=3p24
p2=4p16=23p1
Ответ: в
pазбирался: Алиса Никитина | обсудить разбор
Задание EF18416
Цилиндрический сосуд разделён неподвижной теплоизолирующей перегородкой. В одной части сосуда находится кислород, в другой – водород, концентрации газов одинаковы. Давление кислорода в 2 раза больше давления водорода. Чему равно отношение средней кинетической энергии молекул кислорода к средней кинетической энергии молекул водорода?
Алгоритм решения
1.Записать исходные данные.
2.Записать основное уравнение МКТ идеального газа.
3.Составить уравнения для обоих газов.
4.Найти отношение средней кинетической энергии молекул кислорода к средней кинетической энергии молекул водорода.
Решение
Анализируя условия задачи, можно выделить следующие данные:
• Концентрации кислорода и водорода в сосуде равны. Следовательно, n1 = n2 = n.
• Давление кислорода вдвое выше давления водорода. Следовательно, p1 = 2p, а p2 = p.
Запишем основное уравнение идеального газа:
p=23n−Ek
Применим его для обоих газов и получим:
p1=23n1−Ek1 или 2p=23n−Ek1
p2=23n2−Ek2 или p=23n−Ek2
Выразим среднюю кинетическую энергию молекул газа из каждого уравнения:
−Ek1=3pn
−Ek2=3p2n
Поделим уравнения друг на друга и получим:
−Ek1−Ek2=3pn·2n3p=2
Ответ: 2
pазбирался: Алиса Никитина | обсудить разбор
Задание EF18824
В одном сосуде находится аргон, а в другом – неон. Средние кинетические энергии теплового движения молекул газов одинаковы. Давление аргона в 2 раза больше давления неона. Чему равно отношение концентрации молекул аргона к концентрации молекул неона?
Алгоритм решения
1.Записать исходные данные.
2.Записать основное уравнение МКТ идеального газа.
3.Составить уравнения для обоих газов.
4.Найти отношение концентрации молекул аргона к концентрации молекул неона.
Решение
Анализируя условия задачи, можно выделить следующие данные:
• Средние кинетические энергии теплового движения молекул газов одинаковы. Следовательно, −Ek1=−Ek2=−Ek.
• Давление аргона в 2 раза больше давления неона. Следовательно, p1 = 2p, а p2 = p.
Запишем основное уравнение идеального газа:
p=23n−Ek
Применим его для обоих газов и получим:
p1=23n1−Ek1 или 2p=23n1−Ek
p2=23n2−Ek2 или p=23n2−Ek
Выразим концентрации молекул газа из каждого уравнения:
n1=3p−Ek
n2=3p2−Ek
Поделим уравнения друг на друга и получим:
n1n2=3p−Ek·2−Ek3p=2
Ответ: 2
pазбирался: Алиса Никитина | обсудить разбор
Алиса Никитина | Просмотров: 10.6k








