Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Растворы. Способы выражения концентрации растворов
Способы выражения концентрации растворов
Существуют различные способы выражения концентрации растворов.
Массовая доля ω компонента раствора определяется как отношение массы данного компонента Х, содержащегося в данной массе раствора к массе всего раствора m. Массовая доля – безразмерная величина, её выражают в долях от единицы:
ωр.в. = mр.в./mр-ра (0 < ωр.в. < 1) (1)
Массовый процент представляет собой массовую долю, умноженную на 100:
ω(Х) = m(Х)/m · 100% (0% < ω(Х) < 100%) (2)
где ω(X) – массовая доля компонента раствора X; m(X) – масса компонента раствора X; m – общая масса раствора.
Мольная доля χ компонента раствора равна отношению количества вещества данного компонента X к суммарному количеству вещества всех компонентов в растворе.
Для бинарного раствора, состоящего из растворённого вещества Х и растворителя (например, Н2О), мольная доля растворённого вещества равна:
χ(X) = n(X)/(n(X) + n(H2O)) (3)
Мольный процент представляет мольную долю, умноженную на 100:
χ(X), % = (χ(X)·100)% (4)
Объёмная доля φ компонента раствора определяется как отношение объёма данного компонента Х к общему объёму раствора V. Объёмная доля – безразмерная величина, её выражают в долях от единицы:
φ(Х) = V(Х)/V (0 < φ(Х) < 1) (5)
Объёмный процент представляет собой объёмную долю, умноженную на 100.
φ(X), % = (φ(X)·100)%
Молярность (молярная концентрация) C или Cм определяется как отношение количества растворённого вещества X, моль к объёму раствора V, л:
Cм(Х) = n(Х)/V (6)
Основной единицей молярности является моль/л или М. Пример записи молярной концентрации: Cм(H2SO4) = 0,8 моль/л или 0,8М.
Нормальность Сн определяется как отношение количества эквивалентов растворённого вещества X к объёму раствора V:
Cн(Х) = nэкв.(Х)/V (7)
Основной единицей нормальности является моль-экв/л. Пример записи нормальной концентрации: Сн(H2SO4) = 0,8 моль-экв/л или 0,8н.
Титр Т показывает, сколько граммов растворённого вещества X содержится в 1 мл или в 1 см3 раствора:
T(Х) = m(Х)/V (8)
где m(X) – масса растворённого вещества X, V – объём раствора в мл.
Моляльность раствора μ показывает количество растворённого вещества X в 1 кг растворителя:
μ(Х) = n(Х)/mр-ля (9)
где n(X) – число моль растворённого вещества X, mр-ля – масса растворителя в кг.
Мольное (массовое и объёмное) отношение – это отношение количеств (масс и объёмов соответственно) компонентов в растворе.
Необходимо иметь ввиду, что нормальность Сн всегда больше или равна молярности См. Связь между ними описывается выражением:
См = Сн · f(Х) (10)
Для получения навыков пересчёта молярности в нормальность и наоборот рассмотрим табл. 1. В этой таблице приведены значения молярности См, которые необходимо пересчитать в нормальность Сн и величины нормальности Сн, которые следует пересчитать в молярность См.
Пересчёт осуществляем по уравнению (10). При этом нормальность раствора находим по уравнению:
Сн = См/f(Х) (11)
Результаты расчётов приведены в табл. 2.
Таблица 1. К определению молярности и нормальности растворов
| Тип химического превращения | См | Сн | Сн | См |
| Реакции обмена | 0,2 M Na2SO4 | ? | 6 н FeCl3 | ? |
| 1,5 M Fe2(SO4)3 | ? | 0,1 н Ва(ОН)2 | ? | |
| Реакции окисления-восстановления | 0,05 М KMnO4
в кислой среде |
? | 0,03 М KMnO4
в нейтральной среде |
? |
Таблица 2
Значения молярности и нормальности растворов
| Тип химического превращения | См | Сн | Сн | См |
| Реакции обмена | 0,2M Ma2SO4 | 0,4н | 6н FeCl3 | 2М |
| 1,5M Fe2(SO4)3 | 9н | 0,1н Ва(ОН)2 | 0,05М | |
| Реакции окисления-восстановления | 0,05М KMnO4 в кислой среде | 0,25н | 0,03М KMnO4
в нейтральной среде |
0,01М |
Между объёмами V и нормальностями Сн реагирующих веществ существует соотношение:
V1 Сн,1 =V2 Сн,2 (12)
Примеры решения задач
Задача 1. Рассчитайте молярность, нормальность, моляльность, титр, мольную долю и мольное отношение для 40 мас.% раствора серной кислоты, если плотность этого раствора равна 1,303 г/см3.
Решение.
Масса 1 литра раствора равна М = 1000·1,303 = 1303,0 г.
Масса серной кислоты в этом растворе: m = 1303·0,4 = 521,2 г.
Молярность раствора См = 521,2/98 = 5,32 М.
Нормальность раствора Сн = 5,32/(1/2) = 10,64 н.
Титр раствора Т = 521,2/1000 = 0,5212 г/см3.
Моляльность μ = 5,32/(1,303 – 0,5212) = 6,8 моль/кг воды.
Обратите внимание на то, что в концентрированных растворах моляльность (μ) всегда больше молярности (См). В разбавленных растворах наоборот.
Масса воды в растворе: m = 1303,0 – 521,2 = 781,8 г.
Количество вещества воды: n = 781,8/18 = 43,43 моль.
Мольная доля серной кислоты: χ = 5,32/(5,32+43,43) = 0,109. Мольная доля воды равна 1– 0,109 = 0,891.
Мольное отношение равно 5,32/43,43 = 0,1225.
Задача 2. Определите объём 70 мас.% раствора серной кислоты (r = 1,611 г/см3), который потребуется для приготовления 2 л 0,1 н раствора этой кислоты.
Решение.
2 л 0,1н раствора серной кислоты содержат 0,2 моль-экв, т.е. 0,1 моль или 9,8 г.
Масса 70%-го раствора кислоты m = 9,8/0,7 = 14 г.
Объём раствора кислоты V = 14/1,611 = 8,69 мл.
Задача 3. В 5 л воды растворили 100 л аммиака (н.у.). Рассчитать массовую долю и молярную концентрацию NH3 в полученном растворе, если его плотность равна 0,992 г/см3.
Решение.
Масса 100 л аммиака (н.у.) m = 17·100/22,4 = 75,9 г.
Масса раствора m = 5000 + 75,9 = 5075,9 г.
Массовая доля NH3 равна 75,9/5075,9 = 0,0149 или 1,49 %.
Количество вещества NH3 равно 100/22,4 = 4,46 моль.
Объём раствора V = 5,0759/0,992 = 5,12 л.
Молярность раствора См = 4,46/5,1168 = 0,872 моль/л.
Задача 4. Сколько мл 0,1М раствора ортофосфорной кислоты потребуется для нейтрализации 10 мл 0,3М раствора гидроксида бария?
Решение.
Переводим молярность в нормальность:
0,1 М Н3РО4 0,3 н; 0,3 М Ва(ОН)2 0,6 н.
Используя выражение (12), получаем: V(H3P04)=10·0,6/0,3 = 20 мл.
Задача 5. Какой объем, мл 2 и 14 мас.% растворов NaCl потребуется для приготовления 150 мл 6,2 мас.% раствора хлорида натрия?
Плотности растворов NaCl:
| С, мас.% | 2 | 6 | 7 | 14 |
| ρ, г/см3 | 2,012 | 1,041 | 1,049 | 1,101 |
Решение.
Методом интерполяции рассчитываем плотность 6,2 мас.% раствора NaCl:
6,2% =6% + 0,2(7% —6% )/(7 – 6) = 1,0410 + 0,0016 = 1,0426 г/см3.
Определяем массу раствора: m = 150·1,0426 = 156,39 г.
Находим массу NaCl в этом растворе: m = 156,39·0,062 = 9,70 г.
Для расчёта объёмов 2 мас.% раствора (V1) и 14 мас.% раствора (V2) составляем два уравнения с двумя неизвестными (баланс по массе раствора и по массе хлорида натрия):
156,39 = V1 1,012 + V2 1,101 ,
9,70 = V1·1,012·0,02 + V2·1,101·0,14 .
Решение системы этих двух уравнений дает V1 =100,45 мл и V2 = 49,71 мл.
Задачи для самостоятельного решения
3.1. Рассчитайте нормальность 2 М раствора сульфата железа (III), взаимодействующего со щёлочью в водном растворе.
12 н.
3.2. Определите молярность 0,2 н раствора сульфата магния, взаимодействующего с ортофосфатом натрия в водном растворе.
0,1 M.
3.3. Рассчитайте нормальность 0,02 М раствора KMnO4, взаимодействующего с восстановителем в нейтральной среде.
0,06 н.
3.4. Определите молярность 0,1 н раствора KMnO4, взаимодействующего с восстановителем в кислой среде.
0,02 M.
3.5. Рассчитать нормальность 0,2 М раствора K2Cr2O7, взаимодействующего с восстановителем в кислой среде.
1,2 M.
3.6. 15 г CuSO4·5H2O растворили в 200 г 6 мас.% раствора CuSO4. Чему равна массовая доля сульфата меди, а также молярность, моляльность и титр полученного раствора, если его плотность составляет 1,107 г/мл?
0,1; 0,695М; 0,698 моль/кг; 0,111 г/мл.
3.7. При выпаривании 400 мл 12 мас.% раствора KNO3 (плотность раствора 1,076 г/мл) получили 2М раствор нитрата калия. Определить объём полученного раствора, его нормальную концентрацию и титр.
255 мл; 2 н; 0,203 г/мл.
3.8. В 3 л воды растворили 67,2 л хлороводорода, измеренного при нормальных условиях. Плотность полученного раствора равна 1,016 г/мл. Вычислить массовую, мольную долю растворённого вещества и мольное отношение растворённого вещества и воды в приготовленном растворе.
0,035; 0,0177; 1:55,6.
3.9. Сколько граммов NaCl надо добавить к 250 г 6 мас.% раствору NaCl, чтобы приготовить 500 мл раствора хлорида натрия, содержащего 16 мас.% NaCl? Плотность полученного раствора составляет 1,116 г/мл. Определить молярную концентрацию и титр полученного раствора.
74,28 г; 3,05 М; 0,179 г/мл.
3.10. Определить массу воды, в которой следует растворить 26 г ВaCl2·2H2O для получения 0,55М раствора ВaCl2 (плотность раствора 1,092 г/мл). Вычислить титр и моляльность полученного раствора.
192,4 г; 0,111 г/мл; 0,56 моль/кг.
Download Article
Download Article
In chemistry, a solution’s concentration is how much of a dissolvable substance, known as a solute, is mixed with another substance, called the solvent. The standard formula is C = m/V, where C is the concentration, m is the mass of the solute dissolved, and V is the total volume of the solution. If you have a small concentration, find the answer in parts per million (ppm) to make it easier to follow. In a lab setting, you may be asked to find the molarity, or molar concentration, of the solution instead.
-
1
Find the mass of the solute mixed in with the solvent. The solute is the substance that you’re mixing in to form your solution. If you’re given the mass of the solute in your problem, write it down and be sure to label it with the correct units. If you need to find the mass of the solute, then weigh it on a lab scale and record the measurement.[1]
- If the solute you’re using is a liquid, then you can also calculate the mass using the density formula, where density D = m/V, where m is the mass of the liquid and V is the volume. To find the mass, multiply the density of the liquid by the volume.
Tip: If you need to use a scale, subtract the mass of the container you’re using to hold the solute or else your calculations will be off.
-
2
Record the total volume of the solution. The total volume of the solution is the amount of solvent plus the amount of solute added to it. If you’re finding the volume in a lab, mix the solution in a graduated cylinder or beaker and look at the measurement. Measure the volume from the curve at the top of the solution, or the meniscus, to get the most accurate reading. Record the volume of the solution.[2]
- If you aren’t measuring the volume yourself, you may need to convert the mass of the solute into volume using the density formula.
- For example, if you’re finding the concentration of 3.45 grams of salt in 2 liters of water, you would find the volume of salt using the density formula. Look up the density of salt either in a textbook or online and solve the formula for m. In this case, the density of salt is 2.16 g/mL. The formula would read 2.16 g/mL = (3.45 g)/V. Multiply each side by V to get V(2.16 g/mL) = 3.45 g. Then divide the each side by 2.16 to find the volume, or V = (3.45 g)/(2.16 g/mL) = 1.60 mL.
- Add the volume of the solute to the volume of your solvent, ma. So in this example, 2 L + 1.6 mL = 2,000 mL + 1.6 mL = 2,001.6 mL. You can either leave the measurement in milliliters or convert it back to liters to get 2.002 L.
Advertisement
-
3
Divide the mass of the solute by the total volume of the solution. Write out the equation C = m/V, where m is the mass of the solute and V is the total volume of the solution. Plug in the values you found for the mass and volume, and divide them to find the concentration of your solution. Don’t forget to label to label your answer with the correct units.[3]
- In our example for the concentration of 3.45 grams of salt in 2 liters of water, your equation would be C = (3.45 g)/(2.002 L) = 1.723 g/L.
- Certain problems may ask for your concentration in specific units. Be sure to convert the units before putting them in your final formula.
Advertisement
-
1
Find the mass of the solute in grams. Measure out the mass of the solute that you plan on mixing with your solution. Be sure to subtract the weight of the container you’re using to measure the solute or else your concentration will be inaccurate.[4]
- If your solute is a liquid, you may need to calculate the mass using the formula D = m/V, where D is the liquid’s density, m is the mass, and V is the volume. Look up the density of the liquid in a textbook or online and then solve the equation for the mass.
-
2
Determine the total mass of the solution in grams. The total mass of the solution is the mass of the solvent plus the mass of the solute. Weight the masses using a lab scale or convert the volume of the solvent to mass by using the density formula D = m/V. Add the mass of the solute to the mass of the solvent to find your final volume.[5]
- For example, if you want to find the concentration of 10 g of cocoa powder mixed with 1.2 L of water, you would find the mass of the water using the density formula. The density of water is 1,000 g/L, so your equation would read 1,000 g/L = m/(1.2 L). Multiply each side by 1.2 L to solve the mass in grams, so m = (1.2 L)(1,000 g/L) = 1,200 g. Add the mass of the cocoa powder to get 1,210 g.
-
3
Divide the mass of the solute by the total mass of the solution. Set up your equation so the concentration C = mass of the solute/total mass of the solution. Plug in your values and solve the equation to find the concentration of your solution.[6]
- In our example, C = (10 g)/(1,210 g) = 0.00826.
-
4
Multiply your answer by 100 if you want to find the percent concentration. If you’re asked to list the concentration in a percentage, take the answer you just found and multiply it by 100. Label your final answer with a percentage sign.[7]
- In this example, the percent concentration is (0.00826)(100) = 0.826%.
-
5
Multiply the concentration by 1,000,000 to find the parts per million. Use the number you found for your concentration and multiply it by 1,000,000 or 106. The number will be how many parts per million the solute is. Label your final answer in ppm.[8]
- In our example, the ppm = (0.00826)(1,000,000) = 8,260 ppm.
Tip: Parts per million is usually used for very small concentrations since it’s easier to write and understand than a percentage.
Advertisement
-
1
Add the atomic masses of the solute together to find the molar mass. Look at the elements in the chemical formula for the solute you’re using. List the atomic mass for each element in the solute since atomic and molar mass are the same. Add together the atomic masses from your solute to find the total molar mass. Label the final measurement in g/mol.[9]
- For example, if your solute is potassium hydroxide (KOH), find the atomic masses for potassium, oxygen, and hydrogen and add them together. In this case molar mass = 39 +16 + 1 = 56 g/mol.
- Molarity is used mainly in chemistry when you know the chemical makeup of the solute you’re using.
-
2
Divide the mass of the solute by the molar mass to find the number of moles. Find the mass of the solute you’re adding into your solution using a lab scale if you need to.[10]
Be sure to subtract the mass of the container so you have an accurate reading. Divide the mass you found by the molar mass so you can find how many moles of the solute you’re using. Label your answer with “mol.”[11]
- For example, if you want to find the number of moles in 25 g of potassium hydroxide (KOH), then the equation is mol = (25 g)/(56 g/mol) = 0.45 mol
- Convert the mass of your solute to grams if it isn’t already listed in grams.
- Moles are used to represent the number of atoms in the solution.
-
3
Convert the volume of the solution to liters. Find the volume of the solvent before you mix in the solute.[12]
Use a flask or a graduated cylinder to find the measurement if you aren’t given it. If your measurement is in milliliters, then divide it by 1,000 to convert it to liters.[13]
- In this example, if you’re using 400 mL of water, then divide it by 1,000 to convert it to liters, which is 0.4 L.
- If your solvent is already listed in liters, then you can skip this step.
Tip: You don’t need to include the volume of the solute since it doesn’t usually affect the volume that much. If there is a visible change in volume when you mix the solute with the solvent, then use the total volume instead.
-
4
Divide the moles of solute by the volume of the solution in liters. Set up your equation so the molarity M = mol/V, where mol is the number of moles of the solute and V is the volume of the solvent. Solve the equation and label the answer M.[14]
[15]
- In this example, M = (0.45 mol)/(0.4 L) = 1.125 M.
Advertisement
Calculator, Practice Problems, and Answers
Add New Question
-
Question
How do I convert milligrams to moles?
First, calculate the molar mass of your substance. (Add the atomic masses of the constituent elements.) Then, convert milligrams to grams by dividing by 1000. Finally, divide the grams of your substance by the Molar Mass.
-
Question
If I have a solution with unknown mass, how do I calculate concentration?
Calculate the number of moles using the equation c=n/v for the first given solution.Then using the no of moles calculate the mass using equation n=m/Mr.
-
Question
If I am given two solutions, what is one way of knowing which one is more/less concentrated?
You can perform titrations. Under the Le Chatelier’s principle, the more concentrated one will have faster reacting time due to the fact that the more concentrated one has more molecules of that substance, leading to the ultimate truth that the chances of molecules meeting each other is bigger. Note that this method will not work if you are dropping Transition Metals into room-temperature, concentrated HNO3 or H2SO4 since Iron (and other metals) has the property called passivation. It happens when the metal reacts w/ the acid so quickly that the metal forms a salt, preventing the further reaction to the acid.
See more answers
Ask a Question
200 characters left
Include your email address to get a message when this question is answered.
Submit
Advertisement
-
If you are in a lab and don’t know how much of a solute was added, you can perform a titration test using other reactive chemicals. You do need to learn how to balance chemical equations with stoichiometry.
Advertisement
About This Article
Article SummaryX
To calculate the concentration of a solution, start by converting the solute, or the substance being dissolved, into grams. If you’re converting from milliliters, you may need to look up the solute’s density and then multiply that by the volume to convert to grams. Next, convert the solvent to liters. Finally, divide the solvent by the solute to find the concentration of the solution. To learn how to calculate the concentration of a solution as a percentage or parts per million, scroll down!
Did this summary help you?
Thanks to all authors for creating a page that has been read 1,976,018 times.
Did this article help you?
В реальности, химики редко работают с чистыми веществами. В большинстве своем для работы, при проведении химических реакций, расчетов по ним используются различные растворы.
Раство́р — гомогенная (однородная) смесь, состоящая из частиц растворенного вещества, растворителя и продуктов их взаимодействия
Подробнее о процессе растворения мы поговорим в следующих статьях.
При решении расчетных задач нам нудно уметь находить количество чистого вещества, находящегося в растворе. Это необходимо затем, что, как правило, в химическое взаимодействие вступает вещество, а не дополнительные продукты, которое оно содержит: примеси, если это не чистое вещество, компоненты растворителя, или инертные для данного химического процесса компоненты смеси (если это смесь веществ).
Если мы работаем с 500 граммами раствора, в котором всего 10 грамм чистого вещества, то в расчеты мы берем 10 грамм, а не 500! – пример, почему необходимо уметь вычислять количественные характеристики чистого вещества.
Способы выражения концентрации растворов
Существуют различные способы выражения концентраций растворов. В задачах могут встретиться любые из них. Рассмотрим основные из них более подробно.
I. Массовая доля вещества
Массовая доля – отношение массы чистого вещества к массе всего раствора. Данная величина безразмерная (говорят доля от единицы, всегда меньше 1, или равна единице для чистого вещества), или выражается в %.
Очень часто можно встретить запись запись, например NaOH, 15% – это значит, что из всей массы раствора на долю гидроксида натрия (NaOH) приходится только 15 %.
Следует не забывать, что масса раствора = масса растворителя + масса чистого вещества.
Зная массовую долю вещества, нетрудно выразить формулу для расчета массы чистого вещества:
В некоторых задачах масса раствора может быть не дана в условии. В этом случае мы сами можем её задать. Как правило в таких случаях, мы задаём массу раствора как 100 г. Дальнейший расчет ведется уже исходя из заданной массы (если требуется перевести одну концентрацию в другую).
Приведем примеры задач:
Мы специально делаем подробное решение, чтобы отследить ход мыслей.
Решим аналогичную задачу:
Более часто встречаются задачи, в которых требуется приготовить раствор из другого раствора путем добавления чистого вещества (в этом случае концентрация увеличится), растворителя (концентрация уменьшится) или другого раствора (концентрация займёт промежуточное значение).
Рассчитайте массу соли, которую необходимо добавить к 150 г 10% -го раствора, чтобы концентрация полученного раствора стала 15%?
Данную задачу можно решать различными способами. В настоящий момент приведем только один (более длинный, но более понятный). Для решения таких задач другим способом мы подготовим видео.
Задачи, в которых добавляется растворитель – решаются проще.
Какое количество воды необходимо добавить к 200 г 15%-го раствора, чтобы его концентрация стала 10%?
Для решения задач, в которых смешиваются два раствора, имеющих различные концентрации, можно использовать следующий алгоритм:
1. Рассчитать количество чистого вещества в обоих растворах и сложить их.
2. Поделить полученное число на сумму масс растворов. Домножить на 100 %.
Решим для примера следующую задачу
Смешали 200 г 10%-го раствора серной кислоты и 100 г 20-% го. Какая массовая доля стала у получившегося раствора?
II. Молярная концентрация вещества
Молярная концентрация вещества – отношение количества вещества к объему раствора. Данная величина показывает нам, сколько (моль) вещества растворено в 1 литре раствора. Единица измерения – моль/л.
Обозначается молярная концентрация заглавной буквой C
В химической лаборатории очень часто для обозначения концентрации используется именно данная величина.
Очень часто, на химических склянках можно увидеть следующие обозначения:
Таким способом также обозначается молярная концентрация. Число перед буквой М обозначает концентрацию: 1 моль/л; 0,1 моль/л; 0,02 моль/л; 3 моль/л; 0,5 моль/л.
Можно также встретить в задачах такое обозначение, связанное с данной формой записи: молярный раствор (1 М) – раствор, концентрация которого составляет 1 моль/л. Децимолярный раствор (0,1 М) – 0,1 моль/л; сантимолярный раствор (0,01 М) – 0,01 моль/л.
Решим некоторые задачи, в которых используется молярная концентрация:
Для приготовления раствора сульфата натрия навеску, содержащую 14,2 г соли растворили в 500 мл воды и довели до метки.
Доведение до метки обозначает, что объем приготовленного раствора составляет (в данном случае) 500 мл.
Часто требуется рассчитать количество вещества:
Прежде чем проводить расчет по уравнению химических реакций, необходимо найти количество вещества.
III. Моляльная концентрация
Моляльная концентрация – отношение количества (моль) растворенного вещества к массе растворителя. Данная концентрация показывает нам, сколько моль вещества необходимо добавить к 1 кг растворителя (воды, например), чтобы получить нужную концентрации. Обозначается данная концентрация См, а измеряется в моль/кг(растворителя).
IV. Мольная доля
Мольная доля – отношение количества вещества к сумме количеств всех компонентов раствора. Данная физическая величина не имеет размерности.
Сумма всех мольных долей раствора равна “1”.
Данная физическая величина нашла широкое применение в химической химии для описания равновесных термодинамических процессов.
V. Титр
Титр – отношение массы вещества к единице объема (выраженного в миллилитрах). Титр показывает, сколько грамм вещества находится в каждом миллилитре раствора. обозначается как “Т” и измеряется в г/мл.
Титр – очень маленькая величина, так как в в 1 миллилитре раствора может находиться незначительное количество вещества.
Титр нашел широкое применение в аналитической химии.
В заключении
По данной теме существует огромное количество расчетных задач. Многие из них мы рассмотрим в следующих статьях. О пока…
Проверьте, как Вы усвоили материал.
Задание №1. Перейдите к гугл-форме и ответьте на вопросы (базовый уровень):
https://forms.gle/7u32uLfxRk1Yug7a8
Задание №2. Решите расчетные задачи: https://vk.com/page-205267346_56951920 (повышенный уровень)
Задание №3. Решите следующую задачу:
Какова молярная концентрация 12%-ного раствора серной кислоты (H2S04) с плотностью р = 1,08 г/см3. Рассчитайте титр данного вещества, моляльную концентрацию, мольную долю.
Отчет о решении задач пришли в беседу “Учебный класс”:
https://vk.me/join/DKsyQe2p0hJ2Wdoch1XOTwi_qZEJow1udOM=
Рассмотрим особенности расчета среднесуточных концентраций загрязняющих веществ в атмосферном воздухе и использования результатов такого расчета при разработке нормативов допустимых выбросов (далее — НДВ), для оценки эффективности воздухоохранных мероприятий и при подготовке проектов санитарно-защитных зон (далее — СЗЗ).
С 01.03.2021 вступили в силу СанПиН 1.2.3685-21 «Гигиенические нормативы и требования к обеспечению безопасности и (или) безвредности для человека факторов среды обитания» (далее — СанПиН 1.2.3685-21), в разделе I которых приведены предельно допустимые концентрации (далее — ПДК) и ориентировочно безопасные уровни воздействия (далее — ОБУВ) загрязняющих веществ в атмосферном воздухе городских и сельских поселений.
СанПиН 1.2.3685-21 для 69 загрязняющих веществ установлена среднегодовая ПДК (ПДКс.г.). Из 69 веществ, для которых установлены ПДКс.г., максимальные разовые ПДК (ПДКм.р.) не установлены для 18 веществ, а ПДК среднесуточные (ПДКс.с.) — для 11 веществ; 58 веществ имеют теперь одновременно и ПДКс.г., и ПДКс.с.. Среди таких веществ есть и очень распространенные вещества (к примеру, диоксид азота).
Согласно Методам расчетов рассеивания выбросов вредных (загрязняющих) веществ в атмосферном воздухе, утвержденным Приказом Минприроды России от 06.06.2017 № 273 (далее — Методы № 273), для таких веществ расчетные концентрации сопоставляются с ПДК, относящимися к тому же времени осреднения. Таким образом, наряду с хорошо освоенным расчетом максимальных разовых и среднегодовых концентраций загрязняющих веществ в атмосферном воздухе добавляется расчет среднесуточных концентраций.
Расчет среднесуточных концентраций
Среднесуточные концентрации ссс загрязняющего вещества определяются по формуле (170) Методов № 273 (п. 12.12):
ссс = смр0,6 × Ссг0,4,
где смр и Ссг — максимальная разовая и среднегодовая концентрации загрязняющего вещества, рассчитанные по формулам, приведенным в Методах № 273. При этом максимальные разовые концентрации рассчитываются исходя из их выброса, осредненного за 20–30 минут, среднегодовые — из выброса, осредненного за год. А среднесуточные концентрации согласно формуле (170) — из этих двух величин одновременно.
В Методах № 273 приведены два алгоритма расчета среднегодовых концентраций — основной (пп. 10.1–10.5.7) и упрощенный (п. 10.6). При этом в п. 10.6 подчеркивается, что если недоступны необходимые для расчета долгопериодных средних концентраций функции распределения метеорологических параметров, а также информация о прочих характеристиках режима, определяющих среднегодовые концентрации метеопараметров, то допускается проводить упрощенный расчет среднегодовых концентраций по формуле (144), при этом «результаты упрощенного расчета среднегодовых концентраций дают их оценку сверху». Фактически это означает, что расчеты по формуле (144) допускается проводить только в случае, когда завышение среднегодовых концентраций не является критичным.
Прямого запрета на использование результатов упрощенного расчета среднегодовых концентраций загрязняющих веществ при расчете среднесуточных концентраций нет. Однако Минприроды России указывает[1], что использование результатов расчетов упрощенных годовых концентраций по формуле (144) (п. 10.6 Методов № 273) для расчета среднесуточных концентраций по формуле (170) (п. 12.12 Методов № 273) положениями Методов № 273 не предусмотрено.
Использование результатов расчета среднесуточных концентраций…
…при разработке НДВ
При определении НДВ загрязняющих веществ (за исключением радиоактивных) в атмосферный воздух применяются методы расчетов рассеивания выбросов вредных (загрязняющих) веществ в атмосферном воздухе, правила проведения сводных расчетов загрязнения атмосферного воздуха, а также методика разработки (расчета) и установления НДВ загрязняющих веществ в атмосферный воздух, утверждаемые Минприроды России[2].
Методика разработки (расчета) и установления нормативов допустимых выбросов загрязняющих веществ в атмосферный воздух (далее — Методика № 581) утверждена Приказом Минприроды России от 11.08.2020 № 581.
Перечень загрязняющих веществ, в отношении которых разрабатываются НДВ, включает наименования и коды загрязняющих веществ с указанием класса опасности, вида (ПДКм.р., ОБУВ, ПДКс.с., ПДКс.г.) и значения гигиенического норматива качества атмосферного воздуха каждого загрязняющего вещества (п. 22 Методики № 581).
Значения выбросов рассчитываются исходя из требования п. 33 Методики № 581 таким образом, чтобы суммарная концентрация загрязняющего вещества не превышала соответствующей ПДК.
Обратите внимание
Обобщая положения Методики № 581 и Методов № 273, это требование можно раскрыть следующим образом:
• максимальная разовая концентрация рассчитывается, если у вещества установлена ПДКм.р. или ОБУВ, и не должна превышать ПДКм.р. (ОБУВ);
• долгопериодная средняя (среднегодовая) концентрация рассчитывается, если у вещества установлена ПДКс.с. или ПДКс.г., и не должна превышать ПДКс.г. (если таковая установлена) или ПДКс.с. (если ПДКс.г. не установлена);
• среднесуточная концентрация рассчитывается, если у вещества установлены одновременно ПДКс.с. и ПДКс.г., и не должна превышать ПДКс.с..
…для оценки эффективности воздухоохранных мероприятий
Указом Президента РФ от 19.04.2017 № 176 утверждена Стратегия экологической безопасности Российской Федерации на период до 2025 года (далее — Стратегия).
Для уменьшения уровня загрязнения атмосферного воздуха в городах и иных населенных пунктах Стратегия предусматривает применение системы сводных расчетов загрязнения атмосферного воздуха с учетом расположенных на этих территориях стационарных и передвижных источников загрязнения окружающей среды.
Оценка состояния экологической безопасности осуществляется с использованием следующих основных индикаторов (показателей):
• доля территории РФ, не соответствующей экологическим нормативам, в общей площади территории РФ;
• доля населения, проживающего на территориях, на которых состояние окружающей среды не соответствует нормативам качества, в общей численности населения РФ и др.
Применительно к воздухоохранной деятельности на территории городов поименованные индикаторы могут быть перефразированы следующим образом:
• доля территории города со сверхнормативным уровнем загрязнения атмосферного воздуха в общей площади территории города;
• доля населения, проживающего на селитебной территории со сверхнормативным уровнем загрязнения атмосферного воздуха, в общей численности населения города.
Атмосферный воздух должен отвечать гигиеническим нормативам по предельно допустимым концентрациям максимальных разовых, среднесуточных и среднегодовых загрязняющих веществ.
К сведению
Не допускается превышение гигиенических нормативов содержания загрязняющих веществ в атмосферном воздухе[3]:
• в жилой зоне — ≤ 1,0 ПДК (ОБУВ);
• на территории, выделенной в документах градостроительного зонирования, решениях органов местного самоуправления для организации курортных зон, размещения санаториев, домов отдыха, пансионатов, туристских баз, организованного отдыха населения, в т.ч. пляжей, парков, спортивных баз и их сооружений на открытом воздухе, а также на территориях размещения лечебно-профилактических учреждений длительного пребывания больных и центров реабилитации — ≤ 0,8 ПДК (ОБУВ).
До сих пор для оценки уровня загрязнения атмосферного воздуха на территории городов использовались сводные расчеты полей среднегодовых концентраций загрязняющих веществ, которые характеризуют уровень хронического (среднегодового) загрязнения атмосферного воздуха на территории города. При этом расчетные среднегодовые концентрации сопоставлялись со среднесуточными ПДК.
Как уже говорилось, СанПиН 1.2.3685-21 для 69 загрязняющих веществ установлена среднегодовая ПДК, а среди них для 58 веществ установлена среднесуточная ПДК. Для этих веществ необходим расчет среднегодовых и среднесуточных концентраций загрязняющих веществ в атмосферном воздухе, а расчетные концентрации должны сопоставляться с ПДК, относящимися к тому же времени осреднения.
Динамика уменьшения площадей с превышением ПДК среднегодовой и ПДК среднесуточной в атмосферном воздухе на территории города будет являться индикатором эффективности воздухоохранной политики, проводимой властями.
…при разработке проектов СЗЗ
Вопросу расчетного обоснования размеров СЗЗ в Методах № 273 посвящен п. 12.13. В нем указывается на необходимость обоснования ориентировочного размера СЗЗ расчетами ожидаемого загрязнения атмосферного воздуха с учетом фона. Расчеты ожидаемого загрязнения атмосферного воздуха проводятся по формулам, приведенным в Методах № 273, для загрязняющих веществ и групп веществ комбинированного вредного действия, по которым объект является источником воздействия на среду обитания и здоровье человека.
Извлечение
из Методов № 273
[…]
12.13. Расчетное обоснование размеров санитарно-защитной зоны
[…]
По ЗВ, для которых установлены значения максимальных разовых, среднесуточных и среднегодовых ПДК, расчетные концентрации сопоставляются с ПДК, относящимися к тому же времени осреднения.
Для ЗВ, по которым среднегодовые ПДК не установлены, расчетные максимальные разовые концентрации сопоставляются с максимальными разовыми ПДК, а расчетные среднегодовые концентрации сопоставляются со среднесуточными ПДК.
Для ЗВ, по которым установлены только среднесуточные ПДК, проводится только расчет среднегодовых концентраций, которые сопоставляются со среднесуточными ПДК.
Для каждого ЗВ и группы веществ комбинированного вредного действия по результатам расчетов, проведенных при соответствующих временах осреднения определяется предварительное положение границы СЗЗ, на которой должны соблюдаться установленные гигиенические нормативы. Окончательная расчетная граница СЗЗ определяется, как огибающая всех предварительных границ.
Для предприятий I и II класса опасности положение этой границы корректируется в соответствии с законодательством Российской Федерации в области санитарно-эпидемиологического благополучия населения с тем, чтобы обеспечить на границе СЗЗ величины приемлемого риска для здоровья населения.
Таким образом, расчет среднесуточных концентраций загрязняющих веществ в атмосферном воздухе при разработке проектов СЗЗ является обязательным.
Вывод
Приведенный анализ показывает, что расчет среднесуточных концентраций загрязняющих веществ в атмосферном воздухе является обязательным при разработке НДВ и проектов СЗЗ, а также может использоваться для оценки эффективности воздухоохранных мероприятий по результатам сводных расчетов.
[1] См. письмо Минприроды России от 16.08.2021 № 12-50/11323-ОГ «О методах расчетов рассеивания».
[2] Пункт 6 Положения о предельно допустимых выбросах, временно разрешенных выбросах, предельно допустимых нормативах вредных физических воздействий на атмосферный воздух и разрешениях на выбросы загрязняющих веществ в атмосферный воздух, утвержденного Постановлением Правительства РФ от 09.12.2020 № 2055.
[3] Пункт 70 СанПиН 2.1.3684-21 «Санитарно-эпидемиологические требования к содержанию территорий городских и сельских поселений, к водным объектам, питьевой воде и питьевому водоснабжению, атмосферному воздуху, почвам, жилым помещениям, эксплуатации производственных, общественных помещений, организации и проведению санитарно-противоэпидемических (профилактических) мероприятий».
Статья опубликована в журнале «Справочник эколога» № 11, 2021.

6. РАСТВОРЫ
Способы выражения концентрации растворов
Важнейшей характеристикой раствора является концентрация, т.е. относительное содержание каждого компонента в растворе. Концентрация раствора выражается количеством растворенного вещества, содержащегося в определенной массе или в определенном объеме раствора или растворителя.
Наиболее часто употребляемые способы выражения концентрации раствора: массовая доля, моляльная, молярная, молярная концентрация эквивалента, титр, мольная доля.
Массовой долей называется количество граммов растворенного вещества, находящегося в 100 г раствора:
|
ω(х) = |
m(x) |
100 , |
|
|
m |
|||
|
где ω(x) |
– массовая доля, %; |
||
|
m(x) |
– масса растворенного вещества, г; |
m– масса раствора, равная сумме масс растворенного вещества (m(x)) и растворителя, г.
Или: ω(х) = mρ(Vx) ,
где ρ – плотность раствора, г/мл;
V– объем раствора, мл.
6.1.Какова будет массовая доля соли в растворе, если в 450 мл воды растворить 50 г соли?
|
ω(х) = |
m(x) |
100; |
m(x) = 50 |
г; |
m = m(x) + mр-ля ; |
|
|
m |
||||||
|
причем, mр-ля = 450 г, т.к. ρН2О = 1 |
г/мл, |
|||||
|
ω(х) = |
50 |
100 =10% |
||||
|
50 |
+450 |
|||||
Моляльная концентрация (моляльность) раствора определяется чис-
лом молей растворенного вещества, содержащегося в 1000 г ( 1 кг) растворителя.
|
b (x ) = |
m (x ) 1000 |
, |
|
|
M (x ) m р − ля |
|||
|
где b(x) |
– моляльная концентрация, моль/кг; |
||
|
m(x) |
– масса растворенного вещества, г; |
||
|
mр-ля |
– масса растворителя, г; |
||
|
М(х) |
– молярная масса растворенного вещества, г/моль. |
35

|
6.2. Какова моляльность раствора KI , полученного растворе- |
|
|
нием 3,32 г КI в 250 мл воды? |
|
|
b (x ) = |
m (x ) 1000 |
|
M (x ) m р− ля |
MKI = 39 + 127 = 166 г/моль mр-ля = 250 г (т.к. ρН2О = 1 г/мл)
|
b(KI ) = |
3,32 |
1000 |
= 0,08 моль/г |
|
|
166 |
250 |
|||
|
Молярная концентрация (молярность) определяется числом молей |
||||
|
растворенного вещества, содержащихся в 1 л раствора. |
||||
|
С (х ) = |
m (x ) |
, |
||
|
M |
(x ) V |
|||
|
где С(х) |
– молярная концентрация, моль/л; |
|||
|
m(x) |
– масса растворенного вещества, г; |
|||
|
M(x) |
– молярная масса растворенного вещества, г/моль; |
|||
|
V |
– объем раствора, л. |
6.3. В 200 мл раствора содержится 12 г хлорида магния. Вы-
|
числите молярную концентрацию раствора. |
||||||
|
С (х ) = |
m (x ) |
, |
||||
|
M |
(x ) V |
|||||
|
М(MgCl2) = 24 + 71 = 95 г/моль |
||||||
|
С(MgCl2) = |
12 |
= 0,63 |
моль/л |
|||
|
95 0,2 |
||||||
Молярная концентрация эквивалента (нормальная) определяется числом моль эквивалентов растворенного вещества, содержащихся в 1
лраствора:
Сэ(х) = Эm(х()x)V , моль экв/л
|
где Сэ(х) |
– молярная концентрация эквивалента, моль экв/л; |
|
Э(х) |
– молярная масса эквивалента, г/моль экв; |
|
V |
– объем раствора, л. |
|
6.4. Сколько граммов карбоната калия содержится в 2 л рас- |
||||
|
твора Сэ = 0,3 моль/л? |
||||
|
Сэ(х) = |
m(x) |
|||
|
Э(х) V |
||||
|
Отсюда: m(x) = Cэ(х)·Э(х)·V |
||||
|
ЭК2СО3 |
= |
39 2 +12 + 48 |
= 69 г/моль экв |
|
|
2 |
36

m(K2CO3) = 0,3·69·2 = 41,4 г
Титр показывает массу растворенного вещества в граммах в 1 мл раствора: Т(х) = mV(x),
|
где Т(х) |
– титр, г/мл; |
|
m(x) |
– масса растворенного вещества, г; |
|
V |
– объем раствора, мл. |
6.5. Из 5 г медного купороса CuSO4·5H2O приготовили 100 мл раствора. Рассчитайте титр раствора медного купороса.
TCuSO4 5H2O = 1005гмл = 0,05 г/мл
Мольная доля – отношение числа молей растворенного вещества к общему числу молей в растворе.
|
Х(хi ) = ν(xi ) |
, |
|||||||||
|
∑ν |
||||||||||
|
где Х(хi) |
– мольная доля растворенного вещества; |
|||||||||
|
ν(xi) |
– число молей растворенного вещества; |
|||||||||
|
∑ν |
– число молей всех компонентов раствора. |
|||||||||
|
6.6. Какова мольная доля хлорида натрия, если 5,85 г его рас- |
||||||||||
|
творено в 180 мл воды? |
||||||||||
|
5,85 |
0,1 |
|||||||||
|
Х( NaCl ) = |
58 ,5 |
= |
= 0,009 |
|||||||
|
5,85 |
+ |
180 |
0,1 + 10 |
|||||||
|
58 ,5 |
18 |
Задач расчетного характера, в которых использовались бы различные способы выражения концентрации раствора, множество. Среди них можно выделить следующие основные типы задач: приготовление растворов определенной концентрации из заданной навески растворенного вещества; переход от одного способа выражения концентрации к другому; приготовление растворов путем разведения; состояние эквивалентности при взаимодействии растворов.
Приготовление растворов определенной концентрации
Этот тип задач сводится к расчету концентрации раствора по заданной навеске (массе) растворенного вещества или к расчету навески для получения раствора заданной концентрации по известным формулам.
6.7. Сколько уксусной кислоты и воды нужно взять, чтобы
|
приготовить 1 кг раствора с ω = 2 %? |
|||||
|
ω(х) = |
m(x) |
100 = |
m(x) |
100 |
|
|
m |
|||||
|
m(x)+mр−ля |
37

m (x ) = 1002 1 = 0 ,02 кг mр-ля = 1 – 0,02 = 0,98 кг
Переход от одного способа выражения концентрации к другому
При решении задач такого типа следует выразить массу растворенного вещества через исходную (известную) концентрацию и подставить полученное выражение в формулу для расчета определяемой концентрации.
|
6.8. Плотность 40 % раствора HNO3 |
равна 1,25 г/мл. Рассчи- |
||||||||
|
тайте молярность этого раствора. |
m (x ) 100 |
||||||||
|
ω (х ) = |
, |
||||||||
|
ρ V (мл ) |
|||||||||
|
m (x ) = ω(x ) ρ V (мл ), |
|||||||||
|
100 |
|||||||||
|
C(x ) = |
m (x ) |
= |
ω(x ) ρ V (мл) |
. |
|||||
|
M (x ) V (л) |
|||||||||
|
100 М(х) V (л) |
Задаемся произвольным объемом раствора, например, 1 л, но представляем его в таких единицах, в каких «требует» данное выражение концентрации (для массовой доли – в мл; для молярности – в л и т.д.).
|
C ( HNO 3 ) = |
40 1000 |
1,25 |
= 7,94 моль / л |
|
|
100 1 |
63 |
|||
Приготовление растворов путем разведения
В результате разведения (разбавления) объем раствора увеличивается за счет добавления растворителя; масса растворенного вещества остается неизменной. Именно это условие лежит в основе решения задач данного типа.
m(x) в конц.р-ре = m(x) в разбавл. р-ре
6.9. Сколько литров 0,1 н H2SO4 можно приготовить из 20 мл
90 % H2SO4 (ρ = 1,82 г/мл)?
Индексация «к» и «р» обозначает величины для концентрированного и разбавленного растворов, соответственно.
Масса вещества в концентрированном растворе:
mk = ωk Vk (мл) ρk
100
Масса вещества в разбавленном растворе: mp = CЭ р·Vp(л)·ЭH2SO4
|
ωк Vк(мл) ρк = С |
Эр |
V (л) Э |
H2SO4 |
|
100 |
р |
||
38

ЭСН3СООН
|
Отсюда: |
V |
(л)= |
ωк Vк(мл)ρк |
= |
90 |
20 1,82 |
= 6,7 |
||
|
p |
100 |
СЭр ЭH2SO4 |
100 |
0,1 49 |
|||||
Состояние эквивалентности при взаимодействии растворов
По закону эквивалентов вещества взаимодействуют друг с другом равным числом моль эквивалентов: ν1э = ν2э, где ν1э и ν2э – числа моль эквивалентов.
Число моль эквивалентов вещества νэ можно рассчитать по следую-
|
щим формулам (1-3): νэ = |
m |
, |
(1) |
|||
|
Э |
||||||
|
где m |
– масса вещества, г; |
Э – молярная масса эквивалента вещества, |
||||
|
г/моль. |
νэ = |
Т V |
, |
(2) |
||
|
Э |
||||||
|
где Т – титр раствора, г/мл; |
V – объем раствора, мл. |
|||||
|
νэ = Сэ V , |
(3) |
где СЭ – молярная концентрация эквивалента, моль экв/л; V – объем раствора, л.
С использованием указанных формул состояние эквивалентности при взаимодействии растворов можно записать следующим образом:
|
m1 |
= |
m 2 |
; |
Т1 V1 |
= |
T2 V2 |
; |
С |
Э |
V = C |
Э |
V |
||
|
Э1 Э2 |
Э1 |
Э2 |
1 |
1 |
2 |
2 |
||||||||
6.10. На нейтрализацию раствора уксусной кислоты израсходовано 29 мл раствора КОН Сэ = 0,1 моль/л. Сколько уксусной кислоты содержалось в растворе?
Ре ш е н и е: СН3СООН + КОН = СН3СООК + Н2О,
νЭСН3СООН = νЭКОН
Число νСН3СООН удобнее выразить через массу, т.е. именно эта вели-
чина требуется по условию задачи, а число νКОН – через известную молярную концентрацию эквивалента этого раствора.
mCH3COOH = СЭ(КОН) V(KOH)
Отсюда: mCH3COOH = CЭ(КОН) V(KOH) ЭСН3СООН
ЭСН3СООН = М = 60 г/моль; mCH3COOH = 0,1·0,029·60 = 0,174 г.
39
7. СВОЙСТВА РАСТВОРОВ ЭЛЕКТРОЛИТОВ
Ионное произведение воды. Водородный показатель
Вода, будучи очень слабым электролитом, в незначительной степени
ионизирует, образуя ионы водорода и гидроксид-ионы: Н2О ↔ Н+ + ОН–
Этому процессу соответствует константа ионизации:
|
Кион, = |
[H + ] [OH − ] |
= 1,8 10 −16 |
(1) |
|||||||
|
[H 2O] |
||||||||||
|
[Н2О]= |
СН2 О = |
m1лН2 |
О |
= |
1000 г |
= 55,55 |
моль/л |
(2) |
||
|
МН2 О |
18г/ моль |
|||||||||
Подставляя в уравнение (1) значение Кион. и СН2О, получаем:
Кион.· СН2О = СН+ ·СОН– ; 1,8·10-16·55,55 = СН+ ·СОН– КН2О или КW = CH+ ·COH– = 10-14 при 20-25оС,
т.е. произведение концентраций ионов водорода и гидроксид-ионов представляет собой постоянную при данной температуре величину и называется ионным произведением воды.
Поскольку ионизация воды – эндотермический процесс, то с повышением температуры он усиливается, и значение КН2О возрастает; напри-
мер, при 37оС: КН2О = СН+ ·СОН– = 2,47·10-14.
В чистой воде концентрации ионов водорода и гидроксид-ионов одинаковы и при 22-25оС составляют 10-7 моль/л.
Растворы, в которых концентрации ионов водорода и гидроксид-ионов
одинаковы, называются нейтральными растворами: СН+ = СОН– = 10-7 моль/л.
В кислых растворах СН+ > СОН–. В щелочных растворах СН+ < COH–. Вместо концентраций ионов Н+ и гидроксид-ионов удобно пользоваться их десятичными логарифмами, взятыми с обратным знаком. Эти величины обозначаются символами рН и рОН и называются, соответ-
ственно, водородным и гидроксильным показателями.
|
pН = – lgCH+ ; |
pOH = – lgCOH– |
|
|
Логарифмируя соотношения СН+ ·СОН– = КН2О и меняя знаки на обрат- |
||
|
ные, получаем: рН + рОН = рКН2О |
22-25оС; |
|
|
рН + рОН = 14 |
при |
|
|
рН + рОН = 13,61 |
при |
37оС. |
При температуре 22-25оС в нейтральных растворах рН = 7, в кислых – рН < 7, в щелочных – рН > 7. Для организма, т.е. при 37оС, рН = 6,805 – среда нейтральная.
40
|
Задачи и упражнения |
|
|
7.1. Рассчитайте рН при 25оС, если: |
|
|
а) СН+ = 10-5 моль/л; |
б) СОН– = 10-8 моль/л. |
|
Р е ш е н и е: |
а) рН = -lgCH+ = – lg10-5 = 5 (среда кислая, т.к. |
рН < 7),
б) рОН = – lgCOH– = – lg 10-8 = 8, pH = 14 – pOH = 14 – 8 = 6 (среда кислая, т.к. рН < 7).
7.2. Концентрация ионов водорода в растворе равна 4·10-3 моль/л. Определите рН раствора.
Ре ш е н и е: рН = – lg (4·10-3) = – (lg 10-3 + lg 4) = 3 – 0,6 = 2,4
(среда кислая).
7.3. Концентрация гидроксид-ионов в растворе равна 6,4·10-8 моль/л. Определите рН раствора.
Ре ш е н и е: рОН = – lg COH– = – lg (6,4·10-8) = – (lg 10-8 + lg 6,4)
=8 – 0,806 = 7,193.
pH = 14 – pOH = 14 – 7,193 = 6,806 (среда кислая).
7.4.Определите концентрацию ионов водорода в растворе, рН
которого равен 4.
Р е ш е н и е: Согласно условию задачи -lg CH+ = 4, следовательно, lgCH+ = -4, отсюда СН+ = 10-4 моль/л.
7.5.Определите концентрацию ионов водорода в растворе, рН
которого равен 4,60.
Р е ш е н и е: Согласно условию задачи (-lg CH+) = 4,60, следовательно, lgCH+ = -4,60, или lgCH+ = -5 + 0,4 , отсюда по таблице логарифмов находим СН+ = 2,5·10-5 моль/л.
7.6.Чему равна концентрация гидроксид-ионов в растворе, рН которого равен 10,80?
Р е ш е н и е: Из соотношения рН + рОН = 14 находим:
рОН = 14 – рН = 14 – 10,80 = 3,20. Отсюда, (-lg COH–) = 3,20 или lg COH–
= -3,20 или -lg COH– = -4 + 0,8. Этому значению логарифма соответствует значение СОН– = 6,31·10-4 моль/л.
Степень и константа ионизации слабых электролитов
По степени ионизации в водных растворах электролиты делятся на слабые и сильные. Согласно теории Аррениуса сильные электролиты полностью диссоциированы на ионы, т.е.: КА → К+ + А–.
К сильным электролитам относятся все растворимые соли, многие минеральные кислоты, гидроксиды щелочных и щелочноземельных металлов.
Слабые электролиты при растворении лишь частично ионизируют на ионы. В отличие от сильных электролитов, их ионизация протекает обратимо с установлением равновесия: КА↔ К+ + А– .
41
К слабым электролитам относятся органические кислоты, некоторые минеральные кислоты, амфотерные гидроксиды.
Количественно процесс ионизации может быть охарактеризован степенью и константой ионизации.
Константой ионизации называется константа равновесия процесса ионизации слабого электролита. Например, в водном растворе уксусной кислоты устанавливается равновесие:
СН3СООН ↔ Н+ + СН3СОО–.
|
Кион . = |
[H + ] [CH 3COO |
− ] |
– константа ионизации. |
|
[СН 3 |
СООН ] |
||
Степенью ионизации (α) электролита называется отношение числа молекул, подвергнувшихся ионизации, к общему числу молекул электролита в растворе.
В случае электролита КА, ионизирующего на ионы К+ и А–, константа и степень ионизации связаны соотношением (закон разбавления
|
Оствальда): К = |
α2 С , |
|
1 − α |
где С – молярная концентрация электролита, моль/л;
К– константа ионизации;
α– степень ионизации.
Если степень ионизации значительно меньше единицы, то при приближенных вычислениях можно принять 1- α ~ 1, тогда выражение закона
К = α2С, отсюда α = КС , т.е. степень ионизации слабых электроли-
тов обратно пропорциональна корню квадратному из концентрации раствора или прямо пропорциональна корню квадратному из разведения раствора;
С = V1 , где V – разбавление или разведение раствора, тогда:
α = 
Если в растворе электролита КА степень его ионизации равна α, то концентрация ионов К+ и А– в растворе одинакова и составляет:
СК+ = СА– = αС. Подставив сюда значение α из предыдущего соотношения, находим: СК+ =СА− =С

ионов водорода для слабой кислоты и концентрация ионов гидроксида
для слабого основания равны соответственно:
СН+ = Ск-ты· α, СОН– = Сосн.· α, или, переходя к рН, -lgCH+ = -lgCк-ты – lg α, pH = pCк-ты + р α.
42

-lgCOH– = lgCосн. – lg α, pOH = pCосн + р α.
Для сильных электролитов, когда α = 1, концентрация ионов Н+ и ОН– в растворе сильных кислот и щелочей равна СН+ = Ск-ты, -lgCH+ = -lgCк-ты,
рН = рСк-ты ; СОН– = Сосн. , -lgCOH– = -lgCосн. , рОН = рСосн.
Задачи и упражнения
7.7. Определите концентрацию ионов водорода и рН 0,001 М раствора азотной кислоты при температуре 25оС, считая ионизацию
полной.
Р е ш е н и е: HNO3 → H+ + NO3–
Из уравнения диссоциации азотной кислоты видно, что при условии полной ее диссоциации, концентрация ионов Н+ (моль/л) равна концентрации кислоты.
СН+ = 0,001 моль/л = 10-3 моль/л
рН = -lgCH+ = -lg10-3 = 3.
7.8. Вычислите константу ионизации уксусной кислоты, зная, что в 0,1 М растворе она ионизирована на 1,3 %. Рассчитайте концентрацию ионов водорода и рН этого раствора.
Ре ш е н и е: СН3СООН ↔ СН3СОО– + Н+
1)СН+ = Ск-ты· α; СН+ = 0,1·0,013 = 1,3·10-3 моль/л,
2)рН = -lg(1,3·10-3) = 3 – 0,1139 = 2,886,
|
3) α = |
К ; K = α2C = (0,013)2·0,1 = 0,0000169 = 1,69·10-5. |
|
С |
|
|
7.9. Степень ионизации уксусной кислоты в 0,1 М растворе |
равна 1,32·10-2. Найдите константу ионизации кислоты и значение рК.
|
Р е ш е н и е: |
Подставим данные задачи в уравнение закона |
||||||||
|
разбавления Оствальда: |
К = |
α |
2 С |
= |
(1,32 10−2 )2 0,1 |
=1,77 |
10−5 |
, |
|
|
1 |
−α |
1−0,0132 |
|||||||
Откуда рК = -lg(1,77·10-5) = 5 – lg1,77 = 5 – 0,25 = 4,75.
Расчет по приближенной формуле К = α2С приводит к близкому зна-
чению К: К = (1,32·10-2)2·0,1 = 1,74·10-5, откуда рК = 4,75.
7.10. Константа ионизации синильной кислоты равна 7,9·10-10 (приложение, табл. 4). Найдите степень ионизации HCN в 0,001М рас-
творе.
Р е ш е н и е: HCN ↔ H+ + CN–
Поскольку константа ионизации HCN очень мала, то для расчета можно воспользоваться приближенной формулой:
|
α = |
К |
= |
7,9 10 |
−10 |
= 8,9 10 |
−4 |
|
|
С |
10 −3 |
||||||
43
Сильные электролиты. Активность ионов
Концентрированные растворы сильных электролитов не подчиняются теории Аррениуса. Для них характерны межионные взаимодействия, в результате чего количество свободных ионов снижается. Поэтому для описания состояния ионов в растворе используется, наряду с концентрацией ионов, их активностью, т.е. условной (эффективной) концентрацией ионов, в соответствии с которой они действуют в химических процессах. Активность иона а (моль/л) связана с его молярной концентрацией в растворе (С) соотношением: а = f·C, где f – коэффициент активности.
Коэффициенты активности ионов зависят от состава и концентрации раствора, заряда и природы иона. Приближенно можно считать, что в разбавленных растворах ионная сила раствора равна полусумме произведений концентраций каждого иона на квадрат его заряда:
J = 12(C1 Z12 +C2 Z22 +…+Cn Zn2)= 12 ∑(Ci Zi )
Коэффициент активности иона в разбавленном растворе можно вычислить по формуле или воспользоваться табл.10:
|
lg f = |
− 0,5Z 2 |
J |
. |
|
|
1 |
+ |
J |
||
7.11. Вычислите ионную силу и активность ионов в растворе,
содержащем 0,01 моль/л MgSO4 и 0,01 моль/л MgCl2.
Р е ш е н и е: MgSO4 → Mg2+ + SO42- MgCl2 → Mg2+ + 2Cl–
Ионная сила раствора равна:
J = 0,5(CMg2+·22 + CSO42-(-2)2 + CCl–(-1)2) = 0,5(0,02·4 + 0,01·4 + 0,02·1) = = 0,07.
Коэффициент активности иона Mg2+ и равный ему коэффициент активности иона SO42- найдем по формуле:
|
− 0,5 Z 2 |
J |
− 0,5 4 0,07 |
− |
||||||
|
lg f = |
= |
= −0,42 |
= 1,58 |
||||||
|
1 |
+ |
J |
1 + |
0,07 |
|||||
или (-1+0,58), отсюда f = 0,38.
Аналогично находим коэффициент активности хлорид-иона:
|
lg f |
= |
− 0,5 1 0,07 |
= |
− 0,5 1 0,27 |
= −0,107 = −1 + 0,893 |
|
1 + 0,27 |
|||||
|
1 + 0,07 |
|||||
|
f = |
0,782 |
Теперь, пользуясь соотношением, находим активность каждого иона:
аMg2+ = 0,02·0,38 = 0,0076 моль/л,
44
|
аSO42- = 0,01·0,38 = 0,0038 моль/л, |
|
|
аС1– = 0,02·0,782 = 0,01564 моль/л. |
|
|
7.12. Вычислите показатель активности ионов водорода (аН+) в |
|
|
растворе, содержащем 0,01 моль/л А1С13 и 0,1 моль/л НС1. |
|
|
Р е ш е н и е: |
НС1 → Н+ + С1– |
А1С13 → А13+ + 3С1–
Находим ионную силу раствора:
J = 0,5(CH+·(+1)2 + CCl–·(-1)2 + CAl3+·(3)2 = 0,5(0,1·12 + 0,13·12 + 0,01·9) =
= 0,16
CH+ = CHCl = 0,1 моль/л
СС1– = 0,1 + 3·0,01 = 0,1 + 0,03 = 0,13 моль/л
СА13+ = 0,01 моль/л Коэффициент активности Н+ найдем по формуле:
|
lg f = |
− 0,5Z2 |
J |
= |
− 0,5 (1)2 |
0,16 |
= |
− 0,5 0,4 |
= −0,14 = −1 + 0,86; |
|
1 + J |
1 + 0,16 |
1 + 0,4 |
f = 0,725 .
аН+ = СНС1·f = 0,1·0,725 = 0,0725 моль/л
paH+ = -lgaH+ = -lg0,0725 = -lg7,25·10-2 = -(lg7,25 + lg10-2) = -0,86 + 2 = = 1,14.
|
Задачу можно решить и другим способом, воспользовавшись логариф- |
|||||||
|
мическим выражением формулы aH+ = CHCl·f |
|||||||
|
paH+ = pH + pf |
pH = -lgCH+ = -lg10-1 = 1 |
||||||
|
pf = |
0,5 Z 2 |
J |
= |
0,5 1 |
2 0,16 |
= 0,14 |
|
|
1 + |
J |
1 + |
0,16 |
||||
paH+ = 1 + 0,14 = 1,14
45

8.ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ
Внасыщенном растворе малорастворимого сильного электролита устанавливается равновесие между осадком (твердой фазой) электролита и ионами электролита в растворе, например:
|
BaSO4 |
↔ Ba2+ + SO42- |
|
в осадке |
в растворе |
Константа равновесия этого процесса выразится следующим уравнением
K = [Ba 2+ ] [SO 42−] [BaSO 4(к) ]
Знаменатель этой дроби, т.е. концентрация твердого сульфата бария, есть величина постоянная, так что произведение К·[BaSO4(к)] тоже является при данной температуре константой. Отсюда следует, что произведение концентраций ионов Ва2+ и SO42- также представляет собой постоянную величину, называемую произведением растворимости и обозначаемую ПР: [Ba2+]·[SO42-] = ПРBaSO4 .
Произведение концентраций ионов малорастворимого электролита, содержащихся в его насыщенном растворе (произведение растворимости), есть величина постоянная при данной температуре (см. табл. 12). Если в растворе электролита образуется два или несколько одного сорта ионов, то в выражении для ПР концентрации этих ионов должны быть возведены в соответствующие степени, например:
|
1) |
CaF2 ↔ Ca2+ + 2F– ; |
ПРCaF = [Ca2+]·[F–]2 |
|
тв.ф. |
2 |
|
|
2) |
Са3(РО4)2 ↔ 3Са2+ + 2РО43- ; |
ПРCa3 (PO4 )2 = [Ca2+]3[PO43-]2 |
тв.ф.
При увеличении концентрации одного из ионов электролита в его насыщенном растворе (например, путем введения другого электролита, содержащего тот же ион) произведение концентраций ионов электролита становится больше ПР. При этом равновесие между твердой фазой и раствором смещается в сторону образования осадка.
Напротив, если в насыщенном растворе электролита уменьшить концентрацию одного из ионов (например, связав его каким-либо другим ионом), произведение концентраций ионов будет меньше значения ПР, раствор станет ненасыщенным, равновесие между жидкой фазой и осадком сместится в сторону растворения осадка.
46
Исходя из значений ПР, можно вычислить растворимость малорастворимых электролитов в воде и растворах, содержащих другие электролиты.
Задачи и упражнения
8.1. Растворимость гидроксида магния Mg(OH)2 при 18оС равна 1,7·10-4 моль/л. Найдите произведение растворимости Mg(OH)2 при этой температуре.
Р е ш е н и е: При растворении каждого моля Mg(OH)2 в раствор переходит 1 моль ионов Mg2+ и вдвое больше ионов ОН–. Следовательно, в насыщенном растворе Mg(OH)2:
[Mg2+] = 1,7·10-4 моль/л; [OH–] = 3,4·10-4 моль/л.
Отсюда: ПРMg(OH)2 = [Mg2+][OH–]2 = 1,7·10-4(3,4·10-4)2 = 1,96·10-11.
8.2. Произведение растворимости иодида свинца при 20оС равно 8·10-9. Вычислите растворимость соли в (моль/л и г/л) при указанной температуре.
Р е ш е н и е: Обозначим искомую растворимость через Х (моль/л). Тогда в насыщенном растворе PbI2 содержится Х моль/л ионов Pb2+ и 2Х моль/л ионов I–. Отсюда:
ПРPbI2 = [Pb2+][I–]2 = X·(2X)2 = 4X3
|
Отсюда: Х = 3 |
ПРPbI |
2 |
= 3 |
8 10 |
−9 |
−3 |
|
= 1,3 10 |
||||||
|
4 |
4 |
|||||
Поскольку молярная масса PbI2 равна 461 г/моль, то растворимость PbI2, выраженная в г/л, составит 1,3·10-3·461 = 0,6 г/л.
8.3. Смешаны равные объемы 0,01 М растворов хлорида кальция и сульфата натрия. Образуется ли осадок сульфата кальция?
Р е ш е н и е: Найдем произведение концентраций ионов Са2+ и SO42- и сравним его с произведением растворимости сульфата кальция. Исходные молярные концентрации растворов СаС12 и Na2SO4 одинаковы и равны 0,01 моль/л. Поскольку при смешении исходных растворов общий объем раствора вдвое возрастает, то концентрации ионов Са2+ и SO42- вдвое уменьшатся по сравнению с исходными. Таким образом,
ССа2+ = CSO24− = 0,005 = 5·10-3 моль/л.
Находим произведение концентраций ионов:
ПК = ССа2+· CSO24− = (5·10-3)2 = 2,5·10-5.
По данным табл. 5 произведений растворимости ПРCfSO4 = 2,4·10-5.
Найденное значение произведения концентраций ионов примерно равно этой величине, следовательно, раствор будет насыщенным относительно сульфата кальция, и осадок образуется.
47

8.4. Произведение растворимости при некоторой температуре Ag2CrO4 = 4,05·10-12. Вычислите концентрацию ионов Ag+ в насыщенном растворе Ag2CrO4.
Р е ш е н и е: Ag2CrO4 (к) ↔ 2Ag+ + CrO42- ПР = [Ag+]2·[CrO42-] = 4,5·10-12.
Т.к. при диссоциации Ag2CrO4 ионов CrO42- получается в 2 раза мень-
ше, чем ионов Ag+, то [CrO42-] = ½ [Ag+]
Выражая в произведении растворимости [CrO42-] через [Ag+] получаем: [Ag+]2· 1/2 [Ag+] = 4,05·10-12,
отсюда ½ [Ag+]3 = 4,05·10-12
[Ag+] = 3 8,1 10−12 = 2,008 10−4 моль/л.
8.5. Объясните с точки зрения теории ПР, почему гидроксид
алюминия растворяется при добавлении щелочей? А1(ОН)3 ↔ А13+ + 3ОН–
тв.ф. ионы насыщ. раствора
КОН → К+ + ОН–
__________________
[Al(OH)4]– p-p
Связывание ионов А13+ в комплекс приводит к нарушению равновесия и смещению его вправо, вплоть до полного растворения А1(ОН)3.
48
9.ГИДРОЛИЗ СОЛЕЙ
Вобщем случае под гидролизом понимают реакции разложения вещества водой. Гидролизу могут подвергаться химические соединения различных классов: белки, жиры, углеводы, эфиры, соли и т.д. В неорганической химии чаще всего встречаются с гидролизом солей.
Гидролизом соли называют взаимодействие соли с молекулами воды, приводящее к образованию малоионизированных соединений. Следст-
вием гидролиза является изменение характера среды в результате нарушения равновесия ионизации воды Н2О ↔ Н+ + ОН–.
Возможны четыре варианта гидролиза в зависимости от типа соли:
1.Соль, образованная сильной кислотой и сильным основанием, гидролизу не подвергается. Реакция среды нейтральная.
KNO3 + H2O ≠
Ионы К+ и NO3– не образуют с водой малоионизированных продуктов (КОН и HNO3 – сильные электролиты).
2.Соль, образованная сильным основанием и слабой кислотой, подвергается гидролизу по аниону. Реакция среды щелочная (рН > 7).
|
1 ступень |
СО32- + НОН ↔ НСО3– + ОН– |
|
гидролиза |
Na2CO3 + H2O ↔ NaHCO3 + NaOH |
3.Соль, образованная слабым основанием и сильной кислотой, под-
|
вергается |
гидролизу |
по катиону. |
Реакция |
среды кислая |
|
(рН < 7). |
||||
|
Cu(NO3)2 → Cu2+ + 2NO3– |
||||
|
гидратация Cu2+ + 4H2O → [Cu(H2O)4]2+ |
||||
|
H+ |
||||
|
1 ступень |
[Cu(H2O)4]2+ |
+ HOH ↔ [Cu(H2O)3OH]+ + H3O+ |
||
|
гидролиза |
к-та 1 |
осн.2 |
осн.1 |
к-та 2 |
или в упрощенном виде: Cu2+ + HOH ↔ CuOH+ + H+
Cu(NO3)2 + H2O ↔ CuOHNO3 + HNO3
4.Соль, образованная слабым основанием и слабой кислотой, подвергается гидролизу по катиону и аниону. Характер среды определяется степенью диссоциации (ионизации) образовавшихся соеди-
нений
CH3COO– + NH4+ + HOH ↔ CH3COOH + NH4OH
CH3COONH4 + H2O ↔ CH3COOH + NH4OH
Гидролиз можно усилить, если: а) разбавить раствор;
б) нагреть раствор, т.к. процесс гидролиза – эндотермический (тепло расходуется на разрыв водородных связей между молекулами воды);
49

в) связать один из продуктов гидролиза; обычно это ионы Н+ или ОН–, которые накапливаются при гидролизе, и связывание их в молекулы воды приводит к смещению равновесия.
Количественно процесс гидролиза характеризуется константой (Кгидр.) и степенью гидролиза (h).
Степень гидролиза h – это отношение концентрации гидролизованной соли к общей концентрации ее. Чем слабее кислота или основание, тем больше степень гидролиза. Так для 0,1 М CH3COONa h = 0,08 %
αСН3СООН = 1,3 %, а для 0,1 М Na2CO3 h = 2,9 % αН2СО3 = 0,02 %.
Константа гидролиза (Кгидр.) является постоянной при данной температуре и показывает полноту гидролиза:
|
Н+ |
|||||
|
СН3СОО– + НОН ↔ СН3СООН + |
ОН– |
||||
|
осн.2 |
к-та 1 |
к-та 2 |
осн. 1 |
||
|
СН3COONa + H2O ↔ CH3COOH + NaOH |
|||||
|
Кгидр. = |
Кw |
, где Кw |
– ионное произведение воды, |
||
|
Кион.СН3 |
СООН |
||||
или в общем виде:
Кгидр. соли, образованной сильным основанием и слабой кислотой:
|
Кгидр. = |
Кw |
|
|
Кион.слаб.к−ты |
||
Кгидр. Соли, образованной слабым основанием и сильной кислотой:
Кгидр. = К Кw ион.слаб.осн.
Кгидр. Соли, образованной слабым основанием и слабой кислотой:
Кгидр. = w
Кион.слаб.осн. Кион.слаб.к−тыК
Исходя из значений Кион. слабых кислот или оснований (табл. 9, приложение), можно рассчитать Кгидр. соответствующих солей.
Задачи и упражнения
9.1. Напишите математическое выражение константы гидролиза соли NH4NO3. Рассчитайте константу гидролиза, если константа ионизации гидрата аммиака равна 1,8·10-5.
Р е ш е н и е: Пишем уравнение гидролиза данной соли. Соль образована слабым основанием и сильной кислотой, поэтому механизм
гидролиза следующий:
NH4+ + HOH ↔ NH3·H2O + H+
50
NH4NO3 + H2O ↔ NH3·H2O + HNO3
Пишем выражение для константы гидролиза соли, образованной слабым основанием и сильной кислотой, и рассчитываем Кгидр.:
|
Кгидр.NH |
NO |
= |
Kw |
= |
Кw |
= |
1 10−14 |
= 5,6 10−10 |
||
|
Kион.слаб.осн. |
Kион.NH3 H2O |
|||||||||
|
4 |
3 |
1,8 10−5 |
9.2. Какая из солей подвергается гидролизу: KI, CrCl3? Напишите ионные уравнения гидролиза, раскрыв механизм гидролиза. Укажите реакцию среды.
Р е ш е н и е: а) Соль KI образована сильным основанием (КОН) и сильной кислотой (HI), поэтому гидролизу не подвергается.
б) Соль CrCl3 образована слабым основанием и сильной кислотой, гидролиз идет по катиону. Ион Cr3+ в аквакомплексе обладает высоким поляризующим действием и «выталкивает» во внешнюю среду из координированной молекулы воды два протона. В результате аквакомплекс является протолитической кислотой, а молекулы воды внешней среды, принимая протоны, являются протолитическим основанием.
|
Реакция среды кислая (рН < 7). |
→ Cr3+ + 3Cl– |
||
|
CrCl3 |
|||
|
Гидратация Сr3+ |
+ 6H2O → [Cr(H2O)6]3+ |
||
|
2H+ |
|||
|
Гидролиз [Cr(H2O)6]3+ + 2HOH |
= [Cr(H2O)5O]+ + 2H3O+ |
||
|
к-та 1 |
осн. 2 |
осн. 1 |
к-та 2 |
9.3. Как протекает гидролиз соли KNO2? Дайте мотивированный ответ. Рассчитайте константу гидролиза, если константа ионизации азотистой кислоты 5,1·10-4.
Р е ш е н и е: Соль нитрит калия образована сильным основанием и слабой кислотой, поэтому механизм гидролиза этой соли следующий:
|
NO2– |
+ HOH |
↔ HNO2 + OH– |
|
осн.2 |
к-та 1 |
к-та 2 осн. 1 |
KNO2 + H2O ↔ HNO2 + KOH
Анион NO2– «захватывает» протон из молекулы воды, ведет себя как протолитическое основание, а молекула воды внешней сферы является протолитической кислотой. Реакция среды щелочная. Пишем формулу Кгидр. Для соли, образованной сильным основанием и слабой кислотой, и рассчитываем ее:
|
Кгидр.KNO |
= |
Kw |
= |
Кw |
= |
1 10−14 |
= 1,96 10−11 |
||
|
2 |
Kион.слаб.к−ты |
Kион.HNO2 |
5,1 10−4 |
||||||
51

9.4. При смешивании растворов хлорида железа (Ш) и карбоната натрия выделяется диоксид углерода и гидроксид железа (Ш). Напишите уравнение реакции гидролиза.
Р е ш е н и е: При смешивании растворов FeCl3 и Na2CO3 происходит взаимное усиление гидролиза, т.к. ионы Н+ и ОН–, образующиеся в результате гидролиза указанных солей, уходят из сферы реакции в виде молекул воды, что смещает равновесие процесса гидролиза вправо и активизирует последующие ступени гидролиза. Это приводит к образованию молекул слабой кислоты и слабого основания.
2FeCl3 + 3Na2CO3 + 6H2O → 2Fe(OH)3↓ + 3H2CO3 + 6NaCl
3H2O 3CO2↑
в ионном виде:
2Fe3+ + 3CO32- + 6HOH → 2Fe(OH)3 + 3H2CO3.
9.5. Подвергается ли гидролизу соль CuSO4? Дайте пояснения. Какими способами можно усилить гидролиз?
Р е ш е н и е: Соль CuSO4 образована слабым основанием и сильной кислотой, гидролизу подвергается по катиону. Заряд катиона +2, следовательно, гидролиз будет протекать по двум ступеням, обра-
зуется аквагидроксосоль. Реакция среды кислая (рН < 7). Cu2+ + HOH ↔ CuOH+ + H
2CuSO4 + 2H2O ↔ (CuOH)2SO4 + H2SO4
или через образование аквакомплекса: CuSO4 → Cu2+ + SO42-
Cu2+ + 4H2O → [Cu(H2O)4]2+ H+
[Cu(H2O)4]2+ + HOH ↔ [Cu(H2O)3OH]+ + H3O+
к-та 1 осн. 2 осн. 1 к-та 2 Гидролиз можно усилить:
а) разбавляя раствор; б) нагревая раствор, т.к. реакция гидролиза – процесс эндотер-
мический; в) добавляя какую-либо щелочь, т.к. при этом связываются
ионы гидроксония в молекулу воды, и равновесие реакции гидролиза смещается вправо: Н3О+ + ОН– → 2Н2О.
52

10. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА РАСТВОРОВ
Осмотическое давление растворов. Закон Вант-Гоффа
Осмотическое давление разбавленных растворов неэлектролитов может быть вычислено по уравнению Вант-Гоффа:
π = C·R·T,
где π – осмотическое давление; С – молярная концентрация, моль/л; R – газовая постоянная;
Т– температура, К.
Единицей измерения давления в СИ является Паскаль (Па) – н/м2 – Ньютон/м2.
Универсальная газовая постоянная в СИ равна 8,31 Дж/моль·К. Иногда давление приводят в атмосферах (атм.) и мм рт.ст. Приборы, измеряющие давление, калиброваны также в этих единицах, поэтому в решении задач будем использовать единицу измерения – атм.
Осмотическое давление раствора электролита вычисляется по уравнению: π = i·C·R·T,
где i – изотонический коэффициент, показывающий, во сколько раз осмотическое давление раствора электролита больше осмотического давления раствора неэлектролита той же молярной концентрации:
i = πэл. .
πнеэл.
Изотонический коэффициент рассчитывается по уравнению: i = 1 + α(n – 1),
где α – степень ионизации электролита;
n – число частиц, которые образуются при ионизации электролита в растворе.
Для очень разбавленных растворов сильных электролитов α = 1 и i = n
Осмотическое давление в растворах ВМС не подчиняется закону Вант-Гоффа. Оно значительно увеличивается с ростом концентрации и может быть рассчитано по уравнению Галлера:
π = МС RT + KC 2 RT
В этом уравнении:
С – массовая концентрация ВМС, г/см3;
М– молекулярная масса ВМС;
К– константа Галлера;
R– универсальная газовая постоянная;
Т– температура, К.
53
Растворы с одинаковым осмотическим давлением называются изотоническими. В медицинской и фармацевтической практике под изотоническими растворами понимают растворы, по величине осмотического давления равные осмотическому давлению плазмы крови (7,4 атм).
Задачи и упражнения
10.1. Взяты 0,1 моль/л растворы NaCl, K2SO4, C6H12O6. В каком из растворов осмотическое давление будет максимальным?
Р е ш е н и е: прежде всего осмотическое давление растворов электролитов (NaCl и K2SO4) будет выше, чем осмотическое давление раствора неэлектролита – глюкозы (С6Н12О6).
πглюк. = C·R·T; πэл. = i·C·R·T,
где С – молярная концентрация всех растворов одинаковая – моль/л;
Т– температура раствора одна и та же.
Следовательно, из двух растворов электролитов максимальное осмотическое давление будет в растворе с наибольшим изотоническим коэффициентом – 1. Для сильных электролитов степень ионизации α можно принять равной 1, отсюда: NaCl → Na+ + Cl– диссоциирует с образованием двух ионов, и i = 1 + 1(2 – 1) = 2. K2SO4 диссоциирует с образованием трех ионов, и i = 1 + 1(3 – 1) = 3;
πK2SO4 = 3CRT; πNaCl = 2CRT; πглюк. = CRT.
Ответ: Максимальным осмотическим давлением в данном ряду растворов обладает раствор сульфата калия (K2SO4).
10.2. Будут ли изотоничны 1 моль/л раствор NaCl и 1 моль/л раствор глюкозы?
Ответ: Растворы называются изотоническими, если имеют равные осмотические давления. При одинаковой молярной концентрации раствор NaCl будет иметь осмотическое давление в два раза больше, чем рас-
твор глюкозы. πглюк. = CRT; πNaCl = iCRT = 2CRT; i NaCl = 2 (см.
вопрос 1).
Понижение давления пара растворителя над раствором. Закон Рауля
При заданной температуре давление насыщенного пара над жидкостью величина постоянная. При растворении в жидкости какого-либо нелетучего вещества давление насыщенного пара этой жидкости понижается. Разность между давлением насыщенного пара над чистым растворителем (Ро) и давлением насыщенного пара растворителя над раствором (Р) называется понижением давления над раствором: Р = Ро – Р.
Закон Рауля связывает относительное понижение давления насыщенного пара растворителя над разбавленными растворами нелетучих неэлектролитов с концентрацией.
54
|
Величина |
Ро −Р |
называется относительным понижением давления |
|||
|
Ро |
|||||
|
пара: |
Ро −Р |
= хi; |
xi = |
νi |
– мольная доля растворенного вещества. |
|
Ро |
∑νi |
Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества. Понижение давления пара растворителя над растворами электролитов:
Рэл. = i Pнеэл.
где: i – изотонический коэффициент.
Первое следствие из закона Рауля: температура кипения раствора выше, чем чистого растворителя. Повышение температуры кипения раствора прямо пропорционально моляльной концентрации раствора.
|
Для неэлектролитов: |
tкип. = Кэб·b, |
|
для электролитов: |
tкип. = i Kэб.·b, |
где: b – моляльная концентрация растворенного вещества, моль/кг; i – изотонический коэффициент,
Kэб. – эбулиоскопическая константа, К·кг·моль-1 (см. табл. 14).
При b = 1 моль/кг, Кэб. = tкип., т.е. Кэб. можно назвать молярным повышением температуры кипения.
Эбулиоскопическая константа характеризует только природу растворителя. Для любого водного раствора Кэб. = 0,52о (приложение, табл. 5). Второе следствие из закона Рауля: температура замерзания раствора ниже, чем чистого растворителя. Понижение температуры замерзания раствора прямо пропорционально моляльной концентрации раствора.
|
Для неэлектролитов: |
tзам. = Ккр. ·b, |
|
для электролитов: |
tзам. = i·Kкр. ·b, |
где: tзам. – понижение температуры замерзания (иногда называют депрессией);
i – изотонический коэффициент;
Ккр. – криоскопическая константа, К·кг·моль-1 (см. табл. 14).
При b = 1 моль/кг tзам. = Ккр.; Ккр. называют моляльной депрессией. Криоскопическая константа характеризует только природу растворите-
ля и не зависит от природы растворенного вещества. Для водного раствора Ккр = 1,86о (приложение, табл. 5).
10.3. Найдите понижение давления пара растворителя над раствором, если 18 г глюкозы растворено в 360 мл Н2О. Давление пара
воды при данной температуре Ро = 10 кПа, Мглюк. = 180 г/моль.
Р е ш е н и е: Решаем по закону Рауля: Р = Ро – Р = Ро·xi. Определим мольную долю растворенного вещества, xi:
55

|
mглюк. |
||||||||||||||||||
|
xi = |
νi |
= |
Mглюк. |
|||||||||||||||
|
∑ ν |
i |
m |
глюк. |
+ |
mН |
О |
||||||||||||
|
2 |
||||||||||||||||||
|
Мглюк. |
МН2О |
|||||||||||||||||
|
18 |
0,1 |
|||||||||||||||||
|
хглюк . = |
180 |
= |
= 0,005 , |
|||||||||||||||
|
18 |
20 ,1 |
|||||||||||||||||
|
+ |
360 |
|||||||||||||||||
|
180 |
18 |
Р = 10 кПа·0,005 = 0,05 кПа.
Ответ: Понижение давления пара над раствором составляет 0,05 кПа, что в мм рт. ст. составляет 0,37 (760 мм рт. ст. – 101,3 кПа).
10.4. Взяты растворы глюкозы, NaCI и СаCI2 с концентрацией 1 моль/кг. Какой из растворов имеет наиболее низкую температуру замерзания?
Т.к. концентрация растворов 1 моль/кг, то понижение температуры замерзания раствора глюкозы (неэлектролит) равно Ккр = tзам..
|
Для электролитов |
tзам. = i·Ккр. |
|
tзам.NaCI = 2·Ккр. |
tзам.CaCI2 = 3 Ккр. |
Следовательно, понижение температуры замерзания для раствора CaCI2 наибольшее, и этот раствор будет иметь наиболее низкую температуру замерзания:
|
tзам. = 0 – tзам. = – |
tзам. |
|
Т.к. все растворы водные, tозам..глюкозы = -1,86о; |
|
|
tозам.NaCI = -2·1,86о = -3,72о; |
tозам.CaCI2 = -3·1,86о = -5,58о. |
10.5. Определите относительную молекулярную массу глюкозы, если раствор, содержащий 116 г глюкозы в 1000 г воды, замерзает при температуре -1,2о.
Р е ш е н и е: Задача на определение относительной молекулярной массы криометрическим методом, т.е. методом, в котором измеряется понижение температуры замерзания раствора в зависимости
|
от концентрации растворенного вещества. |
||
|
Для решения задачи воспользуемся следствием из закона Рауля: |
||
|
где: tзам. |
tзам. = Ккр. ·b, |
(1) |
|
– понижение температуры замерзания; |
||
|
Ккр = 1,86о |
– криоскопическая константа воды. |
Подставим в уравнение (1) выражение моляльной концентрации b: b = mгл 1000
Mr mр−ля
56

|
получим: tзам. = Ккр. |
mгл. 1000 |
(2) |
|
|
Mr mр−ля |
|||
Найдем из уравнения (2) относительную молекулярную массу вещества:
|
Mr = |
Ккр mгл. 1000 |
|
(3) |
|
|
tзам. mр−ля |
Подставим в уравнение (3) численные значения всех величин tзам. = 0 – tзам. = 0 – (-1,2о) = 1,2
1,86 116 1000 =
Mr = 180 . 1,2 1000
Ответ: Полученное значение (180) соответствует относительной молекулярной массе глюкозы.
10.6. 200 мг белка цитохрома растворено в 10 см3 воды. Относительная молекулярная масса цитохрома 12400. Каково понижение температуры замерзания раствора?
Р е ш е н и е: Т.к. плотность воды ρ = 1 г/см3, можно считать известной массу Н2О: mH2O = ρ·V = 1 г/см3·10 см3 = 10 г
Задача на связь молекулярной массы вещества с понижением температуры замерзания раствора, т.е. аналогично задаче 1. Поэтому запишем уравнение (2)
m 1000
tзам. = Ккр. Mr mр−ля
1,86о 0,21000 = о tзам. = 0,003
12400 10
Ответ: Способ определения молекулярной массы по измерению температуры замерзания раствора имеет свои пределы. Для соединений с большой молекулярной массой оказывается трудным ввести в раствор достаточное количество вещества, чтобы удалось точно измерить изменение температуры замерзания. 0,003о – величина слишком малая для точного определения молекулярной массы. В этом случае лучше воспользоваться другим методом.
10.7. Осмотическое давление, обусловленное растворением 200 мг цитохрома в 10 см3 воды при 25о, составляет 0,039 атм. Вычислите молярную массу цитохрома.
Р е ш е н и е: Осмотическое давление 0,039 атм намного легче измерить, чем уменьшение температуры на 0,003 К. Поэтому осмоти-
57

ческое давление является наиболее удобным коллигативным свойст-
|
вом, используемым для измерения больших молекулярных масс. |
|||||||
|
Запишем уравнение Вант-Гоффа для осмотического давления: |
|||||||
|
π = CRT |
(4) |
||||||
|
Подставим в уравнение (4) выражение молярной концентрации |
|||||||
|
С = |
m |
, моль/л, получим: |
π = |
m RT |
(5) |
||
|
M V |
M V |
||||||
Из уравнения (5) найдем молярную массу:
M= m RT .
πV
Подставим в уравнение численные значения всех величин:
|
M = |
0,2 0,082 298 |
= 12400 г/моль |
|
|
0,039 0,01 |
|||
Ответ: Молярная масса цитохрома, определенная по измерению осмотического давления, соответствует относительной молекулярной массе.
10.8. Рассчитайте осмотическое давление раствора неэлектролита при 0оС, если раствор замерзает при -1,86о.
Ре ш е н и е: Задача на связь осмотического давления раствора
спонижением температуры замерзания. Запишем уравнение ВантГоффа для неэлектролитов:
Для разбавленных растворов можно принять, что молярная концентрация (С) совпадает с моляльной концентрацией (b).
Моляльную концентрацию раствора найдем из выражения для понижения температуры замерзания:
|
tзам. – Ккр. ·b, |
b = |
tзам. |
|
Ккр. |
Подставим значение b в уравнение (4), получим:
Подставим значения величин, входящих в уравнение:
π = 1,86 0,082 273 = 22,4 атм 1,86
Ответ: Понижение температуры замерзания соответствовало моляльной депрессии, поэтому полученное значение осмотического давления отвечает допущениям газовых законов при выводе уравнения ВантГоффа.
58

10.9. Определите кажущуюся степень ионизации нитрата кальция в растворе, полученном растворением 16,4 г этой соли в 1 л воды, если такой раствор замерзает при -0,46о.
Р е ш е н и е: Раствор нитрата кальция – раствор электролита, поэтому:
Подставим в уравнение (7) значение моляльной концентрации и решим полученное уравнение относительно i:
|
tзам. = i Ккр |
m 1000 |
; |
i = |
tзам. mр−ля Mr |
(8) |
|||
|
Mr mр−ля |
Ккр. m 1000 |
|||||||
|
т.к. i = 1 + α(n – 1), |
i − 1 |
|||||||
|
отсюда |
α = |
(9) |
||||||
|
n − 1 |
||||||||
|
nCa(NO3 )2 |
= 3 |
|||||||
Подставим в уравнение (8) значения величин: i = 0,46 164 1000 = 2,5
1,86 16,4 1000
Зная величину i, определим α из выражения (9): α = 23,5−−11 = 0,75 , что соответствует 75%
Ответ: 75% – кажущаяся степень диссоциации, т.к. Ca(NO3)2 – раствор сильного электролита с достаточно высокой концентрацией.
10.10. Рассчитайте осмотическое давление раствора хлорида
натрия при температуре 25оС, если раствор замерзает при температуре – 0,56о.
Р е ш е н и е: Задача на расчет осмотического давления по методу криометрии. Запишем уравнение Вант-Гоффа для расчета осмоти-
|
ческого давления раствора электролита: |
π = iCRT |
||
|
αNaCI = 1 |
NaCI → Na+ + CI–; |
n = 2, |
i = 2. |
|
π = 2·CRT |
Раствор разбавленный, поэтому С → b – моляльную концентрацию раствора определим по понижению температуры замерзания:
|
tзам. = 2·Ккр. ·b; |
b = |
tзам. |
|||
|
2 Ккр. |
|||||
|
Подставим выражение b в уравнение: |
|||||
|
π = 2 |
tзам. |
R T |
(10) |
||
|
2 |
Ккр. |
59

Подставим в уравнение (10) значения входящих величин:
π = 2 0,56 0,082 298 = 7,35 атм 1,86 2
Ответ: Данный раствор NaCl является гипотоническим раствором, т.к. его осмотическое давление ниже осмотического давления крови (7,63 атм).
10.11. Определите относительную молекулярную массу неэлектролита, если при растворении 3 г этого вещества в 100 г воды температура кипения раствора повысилась на 0,087о.
Р е ш е н и е: Задача на нахождение относительной молекулярной массы по методу эбулиоскопии. Воспользуемся следствием из закона Рауля:
tкип = Кэб·b
Подставим значение моляльной концентрации (b) и решим полученное уравнение относительно молекулярной массы вещества:
|
tкип = |
Кэб m 1000 |
; |
Mr = |
Кэб m 1000 |
|
tкип mр−ля |
||||
|
Mr mр−ля |
Подставим численные значения:
|
M r = |
0,52 3 1000 |
= 180 |
|
|
0,087 100 |
|||
Ответ: Действительно, в воде была растворена глюкоза, относительная молекулярная масса которой 180.
10.12. Будут ли изотоничны растворы (неэлектролиты), если осмотическое давление одного 5 атм, а понижение температуры замерзания другого раствора составило 0,34о. Температура 25оС.
Р е ш е н и е: Задача на нахождение осмотического давления по методу криометрии. Запишем уравнение Вант-Гоффа для раствора неэлектролита:
π = CRT
Подставим выражение моляльной концентрации из выражения:
|
tзам. = b·Kкр , |
|
|
получим: π = |
tзам RT |
|
Kкр |
Рассчитаем величину π2 : π2 = 0,34 0,082 298 =5 атм
1,86
Ответ: Два раствора изотоничны, т.к. их осмотические давления равны.
60
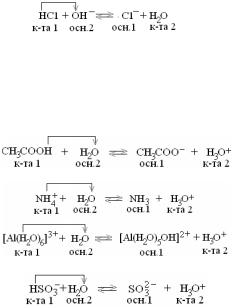
11. ПРОТОЛИТИЧЕСКАЯ ТЕОРИЯ КИСЛОТ И ОСНОВАНИЙ
В1923 г. И.Бренстед и Т.Лоури предложили протолитическую теорию кислот и оснований. Согласно этой теории:
кислота – это молекула или ион, который является донором протонов Н+, протогеном; основание – это молекула или ион, который является акцептором протонов, протофилом;
амфотерным соединением или амфолитом являются молекулы или ионы, способные как отдавать, так и присоединять протон, а, следовательно, вступать в реакции, характерные как для кислот, так и для оснований.
Врезультате взаимодействия протолитической кислоты и протолитического основания образуются новые сопряженные кислота и основание:
Кпротолитическим реакциям относят реакции нейтрализации, ионизации, гидролиза, аутопротолиза.
Классификация кислот и оснований в водных растворах
Протолитическими кислотами могут быть нейтральные молекулы, катионы и анионы. Вода может выполнять роль кислоты и основания.
а) нейтральные молекулы
б) катионы
в) анионы
Протолитическими основаниями могут быть также нейтральные молекулы, катионы и анионы:
а) нейтральные молекулы
61
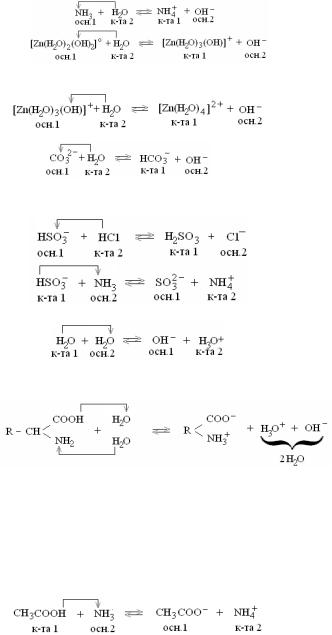
б) катионы
в) анионы
Амфотерным соединением или амфолитом может быть любая частица в зависимости от характера партнера:
К амфолитам также относят Н2О, аминокислоты
Аутопротолиз – это реакция, в которой роль кислоты и основания выполняет одна и та же молекула
Таким образом, согласно протолитической теории кислотно-основные свойства соединения проявляются только в присутствии партнера с противоположными свойствами. Роль такого партнера может выполнять и молекула растворителя.
Классификация растворителей
Протогенные растворители – доноры протонов, обладающие только кислотными свойствами. В их присутствии растворенное вещество обладает свойством основания: HF, HC1, H2SO4, CH3COOH.
62
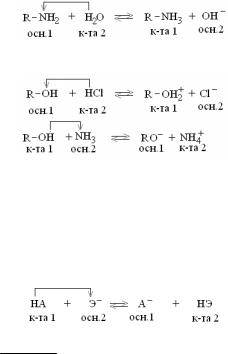
Протофильные растворители – акцепторы Н+, обладающие только основными свойствами: NH3 ж, R-NH2 , C5H5N, NH2-NH2. В их присутствии растворенное вещество становится кислотой:
Амфипротонные растворители проявляют и кислотные и основные свойства: Н2О, аминокислоты, низкомолекулярные спирты
Апротонные растворители не обладают способностью ни отдавать, ни присоединять Н+: С6Н6, С6Н5СН3.
Количественная характеристика кислотно-основных свойств
Протолиз – это равновесный процесс взаимодействия протолитической кислоты и протолитического основания, поэтому он может быть описан константой равновесия, которая называется константой про-
толиза.
= [A−][НЭ]
Кпротолиза [HA][Э−]
Рассмотрим каждую сопряженную реакцию:
|
HA ↔ H+ +A− |
KHA = |
[H+ ][A−] |
||
|
[HA] |
||||
|
HЭ ↔ Н+ +Э− |
КНЭ = |
[H+ ][Э−] |
||
|
[H ] Э |
||||
Константы КНА и КНЭ называются константами кислотности; разделим эти константы друг на друга.
|
KHA |
= |
[H+ ][A−][HЭ] |
= Kпротолиза |
|
[HA][H+ ][Э−] |
|||
|
KНЭ |
Таким образом, константа протолиза выражается отношением констант ионизации протолитических кислот и показывает силу одной кислоты относительно другой (см. табл. 9).
63
12. БУФЕРНЫЕ СИСТЕМЫ
Буферными называются системы, которые обладают определенным значением рН и поддерживают это значение при разбавлении раствора
идобавлении небольших количеств сильных кислот или щелочей. Буферные системы 1 типа состоят из слабых кислот и солей этих ки-
слот и сильных оснований. При этом, с точки зрения протолитической теории, кислота, как донор протонов, служит для связывания ОН– ионов
посторонней щелочи. Роль протолитического основания выполняет анион соли, который связывает ионы Н+ посторонней сильной кислоты
иобразует молекулы слабой кислоты, входящей в состав буфера. Таков механизм буферного действия систем данного типа.
Примером буферных систем 1 типа могут служить ацетатный, фосфат-
ный и гидрокарбонатный буферы: CH3COOH – CH3COONa ; NaH2PO4 – Na2HPO4; H2CO3 – NaHCO3.
При добавлении сильной кислоты или щелочи имеют место следующие процессы, поддерживающие постоянство рН:
|
СН3СОО– + Н+ ↔ СН3СООН |
СН3СООН + ОН– ↔ СН3СОО– + Н2О |
||
|
основание |
кислота |
кислота |
основание |
|
НРО42- + Н+ ↔ Н2РО4– |
Н2РО4– + ОН– ↔ НРО42- + Н2О |
||
|
НСО3– + Н+ ↔ Н2СО3 |
Н2СО3 + ОН– ↔ НСО3– + Н2О |
Нетрудно заметить, что в процессе буферного действия один компонент буфера превращается в эквивалентное количество другого компонента.
Буферные системы 2 типа составлены из слабого основания и соли этого основания и сильной кислоты. Катионы соли служат протолитической кислотой. Примерами буферных систем 2 типа являются следующие:
аммиачная: NH3·H2O (NH4OH) – NH4Cl гидроксиламиновая: NH2OH – NH2OH·HCl (HONH3Cl) анилиновая: C6H5NH2·H2O – C6H5NH3Cl.
Процесс буферного действия аммиачной системы может быть выражен
уравнениями:
NH3·H2O + H+ ↔ NH4+ + H2O
основание
NH4+ + OH– ↔ NH3·H2O
кислота Для расчета рН буферных систем используются следующие формулы:
|
1 тип: рН = рКк + lg |
νсоли |
|
|
νкислоты |
||
64

2 тип: рН = 14 – (рКосн + lg ννсоли )
основ.
рК = -lgK, где К – константа ионизации слабой кислоты или слабого основания буферной системы.
ν = C·V или νэ = Сэ·V, т.е. число моль или моль эквивалентов. Для оценки способности буферной системы поддерживать постоянство рН при добавлении посторонних кислот или щелочей используется величина буферной емкости:
В = νэ , моль экв/л, V pH
где: νэ – число моль эквивалентов посторонней кислоты или щелочи, добавленное к 1 л буферного раствора;
V – объем буферного раствора, л; рН – изменение рН буфера.
Если в системе νэ основания > νэ кислоты, то в системе емкость по кислоте будет выше емкости по основанию Вк > Восн.
Если же νэ кислоты > νэ основания, то Восн > Вк. В буфере будет соблюдаться равенство Вк = Восн, если νэ кислоты = νэ основания, т.е. рН = рКк для буфера 1 типа и рН = 14 – рК для буфера 2 типа.
В процессе обмена веществ в организме человека образуется большое количество кислых продуктов. Сохранение постоянства реакции среды организмов обеспечивается наличием в них буферных систем: белковой, бикарбонатной, фосфатной, гемоглобиновой, оксигемоглобиновой, аммиачной.
Белковый буфер представляет систему из протеина и его соли, образованной сильным основанием. Компоненты этого буфера могут быть выражены как Pt-COOH – слабодиссоциированная белок-кислота и ее соль Pt-COONa.
Pt-COOH ↔ Pt-COO– + H+
Pt-COONa → Pt-COO– + Na+
При увеличении концентрации Н+ соль белка реагирует с кислотами, образуя слабодиссоциированную белок-кислоту и нейтральную соль:
Pt/NHCOO2 − + Na+ +H+ +C1− → Pt/NHCOOH2 + Na+ +Cl−
При взаимодействии со щелочами в реакцию вступает белок-кислота, и вместо сильного основания образуется слабоосновная соль:
|
Pt / COOH → Pt / COO− |
ионизированнаяформа белка. |
|
|
NH2 |
+ |
|
|
NH3 |
Белок в ионизированной форме проявляет буферное действие:
65

|
Pt / COO+ |
− +H+ +Cl− → Pt / COOH+ +Cl− |
|
NH3 |
NH3 |
При добавлении сильной кислоты образуется слабокислая соль белка (солянокислый протеин). При добавлении щелочи образуется слабоосновная соль белка (протеинат натрия) по уравнению:
|
Pt / COO+ |
− + Na+ +OH− → Pt /NHCOOOH− |
+ Na+ |
|
NH3 |
3 |
|
Благодаря белкам все клетки и ткани организма обладают определенным буферным действием.
Бикарбонатный буфер присутствует в крови в большой концентрации.
Все кислоты попадают в кровь, связываются бикарбонатным буфером. Na+ + HCO3– + H+ + Cl– → Na+ + Cl– + H2O + CO2.
Углекислый газ легкими выбрасывается в атмосферу. Таким образом, организм освобождается от избытка кислоты; накапливающиеся соль и вода удаляются с мочой и потом, а убыль бикарбоната пополняется в процессе тканевого дыхания.
Фосфатный буфер имеет наибольшее значение в таких биологических жидкостях, как моча и соки пищеварительных желез.
Наиболее мощными буферными системами крови являются гемоглобиновый и оксигемоглобиновый буферы, которые составляют 75 % буферной емкости крови. Буферные свойства этих систем идентичны белковой буферной системе.
Задачи и упражнения
12.1. Рассчитайте количество мл 0,1 М СН3СООН и 0,1 М CH3COONa, необходимое для приготовления 100 мл буферного рас-
твора с рН = 4,0, рКСН3СООН = 4,76.
Р е ш е н и е: Для систем 1 типа: рН = рКкисл + lg Cc Vc
Ск Vк
|
отсюда: lg |
Cc Vc |
= рН – рКкисл |
|||||||||||
|
C |
к |
V |
|||||||||||
|
к |
|||||||||||||
|
Подставим известные величины: |
|||||||||||||
|
lg |
0,1 |
Vc |
= 4 − 4,76 = −0,76 , |
Vc + Vк = 100 мл |
|||||||||
|
0,1 |
Vк |
||||||||||||
|
lg |
Vc |
= −0,76 ; |
Vc |
= 0,174 ; V |
= |
17,4 |
= 14,84 мл |
||||||
|
(100 − Vc ) |
|||||||||||||
|
100 − Vc |
c |
1,174 |
|||||||||||
Vк = 100 – 14,84 = 85,16 мл
66
Таким образом, чтобы приготовить 100 мл 0,1 М ацетатного буфера необходимо слить 14,84 мл 0,1 М CH3COONa и 85,16 мл 0,1 М
СН3СООН.
12.2. Рассчитайте рН фосфатного буфера, состоящего из 100 мл 0,01 М NaH2PO4 и 20 мл 0,1 М Na2HPO4. Как изменится рН при добавлении к этой смеси 30 мл раствора NaOH с молярной концентрацией эквивалента Сэ = 0,02 моль экв/л? КН2РО−4 = 1,6·10-7
|
Р е ш е н и е: Рассчитаем рН: |
рН = рК |
− + lg |
Cc Vc |
||||
|
Н2 |
Ск Vк |
||||||
|
РО4 |
|||||||
|
− = -lg 1,6·10-7 = 6,8 |
|||||||
|
рК |
Н2 |
||||||
|
РО4 |
|||||||
|
рН = 6,8 + lg |
0,1 20 |
= 6,8 + lg 2 = 7,1 |
|||||
|
0,01 100 |
|||||||
Роль соли (основания) в буфере выполняет Na2HPO4, а роль кислоты –
NaH2PO4.
Н2РО4– + ОН– ↔ НРО42- + Н2О кислота НРО42- + Н+ ↔ Н2РО4– основание
При добавлении NaOH в буфере уменьшится количество кислоты NaH2PO4 и увеличится количество соли Na2HPO4. Расчет ведем в миллимолях (ммоль). νNaOH = X = 30 мл·0,02 = 0,6 ммоль
|
рН = 6,8 + lg |
2 |
+ X |
= 6,8 + lg |
2 |
+ 0,6 |
= 6,8 + lg |
2 |
,6 |
|
|
1 |
− X |
1 |
− 0,6 |
0 |
,4 |
||||
рН = 6,8 + 0,815 = 7,615 ≈ 7,62
Произошел значительный сдвиг рН в щелочную область ( рН = 0,52), что можно объяснить небольшим содержанием кислоты NaH2PO4 (1ммоль) в буфере, т.е. низкой емкостью по основанию
12.3. Аммиачный буфер содержит 20 мл 0,1 М NH3·H2O и 50 мл 0,2 М (NH4)2SO4. рКNH3 H2O = 4,74. Будет ли изменяться рН буфера
при разбавлении раствора в 2 раза? Ответ подтвердите расчетом.
|
Р е ш е н и е: Для буфера 2 типа: рОН = рКосн. + lg |
Сс Vc |
|||||||
|
C |
ос |
V |
||||||
|
Рассчитаем исходное значение рНо: |
ос |
|||||||
|
рНо =14 − 4,74 −lg |
0,2 50 |
= 9,26 −lg |
10 |
= 8,94 |
||||
|
0,1 20 |
2 |
|||||||
После разбавления раствора в 2 раза соответственно уменьшится вдвое число моль основания и соли;
67
|
pH = 9,26 − lg |
10 0,5 |
= 8,94 |
|
|
2 0,5 |
|||
Таким образом, как показал расчет, при разбавлении раствора рН буфера не изменилось.
12.4. Рассчитайте буферную емкость по кислоте, если при добавлении к 100 мл гидрокарбонатного буфера 25 мл раствора НСI Сэ = 0,05 моль экв/л рН изменилось от 3,5 до 4,0.
|
В |
= |
ν HCIэ |
25мл 10 −3 0,05 1000 |
−2 |
моль экв/л |
||||
|
к |
V рН = |
(4,0 − 3,5) 100 |
= 2,5 |
10 |
|||||
|
12.5. |
Приготовлен буферный |
раствор, содержащий |
0,02 |
моль/л анилина, 0,04 моль/л солянокислого анилина. К 1 л буферного раствора добавили 10 мл раствора NaOH Сэ = 0,1 моль экв/л. Рассчитайте емкость буфера по основанию. Изменится ли величина емкости, если предварительно буфер разбавить в 4 раза? Ответ подтвердите расчетом. КС6 Н5 NH2 = 4,1·10-10.
Р е ш е н и е: рКС6Н5NH2 = -lg 4,1·10-10 = 9,4
|
рН |
о |
= 14 − рК |
С6 Н5 NH 2 |
− lg |
νc |
= 14 − 9,4 − lg |
0,04 |
= 14 − 9,4 − 0,3 = 4,3 |
|||||||||||
|
νосн |
0,02 |
||||||||||||||||||
|
После добавления 0,001 моль щелочи к исходному раствору: |
|||||||||||||||||||
|
рН =14 −9,4 −lg |
0,04 −0,001 |
= 4,33 |
|||||||||||||||||
|
1 |
0,02 +0,001 |
||||||||||||||||||
|
B |
= |
νоснэ |
= |
0,001 |
= 0,033 моль экв/л |
||||||||||||||
|
V рН |
0,03 |
||||||||||||||||||
|
1осн |
|||||||||||||||||||
|
После добавления 0,001 моль щелочи к разбавленному раствору: |
|||||||||||||||||||
|
рН 2 |
= 14 − 9,4 − lg |
0,01 − 0,001 |
= 14 − 9,4 − lg |
0,009 |
= 4,42 |
||||||||||||||
|
0,005 + 0,001 |
|||||||||||||||||||
|
0,006 |
|||||||||||||||||||
|
B 2осн = |
0,001 |
= |
0,001 |
= 0,0083 |
моль экв/л |
||||||||||||||
|
4,42 − 4,3 |
0,12 |
||||||||||||||||||
Таким образом, при разбавлении буферного раствора его емкость уменьшается.
Сравните емкость данных растворов по кислоте и основанию.
|
рКNH3 Н2О = 4,74. |
|
|
Ответ: 1) Вк = 0,042; |
Восн = 0,062 |
|
2) Вк = 0,070; |
Восн = 0,046. |
68

13. ЭЛЕКТРОХИМИЯ И ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ И ДИАГНОСТИКИ
ВМЕДИЦИНЕ И САНИТАРИИ
Вмедицинской практике широко применяют методы электродиагностики и электролечения, основанные на использовании электрической проводимости тканей организма и ответных реакций на электрическое воздействие.
Электрохимические методы, применяемые в медицине, делят на две группы. К первой относят методы, требующие внешнего источника тока; они изучают явления и процессы, протекающие в тканях и жидкостях организма при прохождении через них электрического тока. Ко второй группе относят методы без использования внешнего источника тока; они основаны на измерении электродвижущей силы гальванических элементов – составляющих электрохимических систем. К первой группе относится кондуктометрия, ко второй – потенциометрия.
Кондуктометрия
Кондуктометрией называют электрохимический метод анализа, основанный на изучении электрической проводимости проводников ионного типа.
Биологические жидкости организма, внутри- и межклеточная жидкость содержат большое количество сильных и слабых электролитов. проницаемость биологических мембран во многом определяется концентрацией электролитов.
Определение содержания электролитов в тканях и жидкостях организма позволяет проводить диагностику некоторых патологических состояний.
Электрическая проводимость растворов электролитов
Существуют проводники двух типов: 1 и 2 рода. В проводниках 1 рода носителями электричества являются электроны. К ним относят металлы. Растворы и расплавы электролитов относят к проводникам 2 рода. Перенос электричества в них осуществляется положительными и отрицательными ионами. Величина, характеризующая способность вещества проводить электрический ток, называется электрической проводи-
мостью – L.
Если сопротивление проводника R, электрическая проводимость этого проводника L = R1 . Единица измерения L Стилл обратный Ом–. Сопро-
тивление однородного проводника прямопропорционально его длине и обратнопропорционально площади его поперечного сечения:
69

R = ρSl ,
где R – сопротивление проводника, Ом; ℓ – длина проводника, м;
S – площадь поперечного сечения, м2;
ρ – удельное сопротивление материала проводника, Ом·м.
Удельной электрической проводимостью называют величину, изме-
ряемую обратным значением его удельного сопротивления: æ = ρ1 ,
где ρ – удельное сопротивление, Ом·м или См/м; æ – удельная электрическая проводимость, Ом–·м–.
Удельная электрическая проводимость – характеристика материала проводника, численно равная проводимости вещества, заключенного в объеме между двумя электродами, отстоящими друг от друга на рас-
|
2 |
1 |
l |
||
|
стоянии ℓ = 1 м и с площадью S = 1 м : |
æ = |
. |
||
|
R |
S |
Электрическая проводимость раствора одного и того же вещества зависит от концентрации вещества в растворе, поэтому для сравнения способности различных электролитов проводить электрический ток применяют молярную электропроводимость λV.
Молярной электрической проводимостью называют величину, изме-
ряемую электрической проводимостью объема раствора, содержащего один моль эквивалента вещества и заключенного между электродами, отстоящими друг от друга на расстоянии один метр.
λV = æ/1000С,
где æ – удельная электропроводимость, Ом–·м–; С – молярная концентрация раствора, моль/л;
λV – молярная электропроводимость, Ом–·м2·моль–.
Удельная и молярная электропроводимости зависят от природы электролитов, температуры, концентрации.
Закон Кольрауша
Электрический ток в растворах электролитов переносится катионами и анионами, движущимися в противоположных направлениях. При большом разведении раствора катионы и анионы перемещаются независимо, и предельную удельную электрическую проводимость можно определить æ∞ = æА + æК, а предельную молярную электропроводимость рассчитывают по формуле:
λ∞ = æ∞/1000С = æА/1000С + æК/1000С
70
Предельная молярная электрическая проводимость иона прямопропорциональна его электрической подвижности (U)
λ = F·U,
где F – постоянная Фарадея, 96500 Кл/моль;
Если обозначить æА/1000С = UA; æK/1000С = UK,
то λ∞ = UA + UK.
UA и UK – предельные молярные подвижности анионов и катионов. Закон Кольрауша гласит: предельная молярная электропроводимость λ∞ раствора электролита равна сумме молярных подвижностей анионов и катионов, входящих в состав этого электролита.
Молярные подвижности различных ионов вычислены и сведены в таблицы (см. табл. 15). С помощью табличных данных можно рассчитывать предельные молярные электрические проводимости растворов электролитов.
Электрическая проводимость клеток и тканей организма
Живой организм с точки зрения электрохимии можно рассматривать как систему, состоящую из клеток и межклеточного пространства, заполненного раствором электролитов. Удельная электрическая проводимость клеток составляет 10-3-10-9 Ом–·м–, а межклеточной жидкости – 10-3 Ом–·м–. По электрической проводимости биологические ткани и жидкости можно расположить в следующей последовательности: кровь, лимфа, желчь, мышечная ткань, серое вещество мозга, ткань легких, ткань печени, жировая ткань, костная ткань. Изменение электрической проводимости тканей и клеток используют для диагностики заболеваний.
Кондуктометрический метод исследования делят на прямую кондуктометрию и кондуктометрическое титрование. Прямую кондуктометрию используют для определения общего содержания и состояния электролитов в биологических средах: плазме, сыворотке крови, желудочном соке, моче, тканевых жидкостях. Кондуктометрическое титрование применяют для количественного определения кислот, оснований, солей в различных жидкостях, в том числе и биологических.
Сущность прямой кондуктометрии сводится к измерению сопротивления проводника с помощью прибора – кондуктометра. Кондуктометрическая ячейка представляет стеклянный сосуд с вмонтированными в него платиновыми электродами. При прямых кондуктометрических измерениях строится график зависимости электропроводимости от концентрации L = f(C), по которому определяют концентрацию электролита в исследуемом растворе.
Кондуктометрическое титрование – это метод анализа, в котором точка эквивалентности определяется по изменению электрической проводи-
71

мости раствора в ходе титрования. Экспериментально определяется зависимость между электрической проводимостью титруемого раствора и добавляемым объемом титранта, и строится график зависимости L
= f(Vтитранта).
Например, раствор сильной кислоты НС1 неизвестной концентрации титруем раствором NaOH. Идет реакция нейтрализации:
HCl + NaOH → NaCl + H2O
H+ + Cl– + Na+ + OH– → Na+ + Cl– + H2O
Протоны, обладающие большей подвижностью, замещаются менее подвижными ионами Na+, Электрическая проводимость вследствие этого уменьшается и в точке эквивалентности становится минимальной. В точке эквивалентности соблюдается закон эквивалентов:
Vиссл.р-ра ·Сэ иссл.р-ра = Vтитранта ·Сэ титранта, по которому рассчитывают кон-
центрацию исследуемого раствора.
Задачи и упражнения
13.1. При 18оС электропроводность 5 % раствора Mg(NO3)2 равна 4,38 Ом-1·м-1, плотность его 1,038 г/мл. Вычислите кажущуюся степень ионизации Mg(NO3)2 в указанном растворе.
Р е ш е н и е: Молярная концентрация 5 % раствора Mg(NO3)2
равна:
|
С = |
ω ρ1000 |
= |
5 0,38 1000 |
= 0,35моль/ л |
||
|
100 МMg(NO3 )2 |
||||||
|
100 148 |
||||||
|
Молярная электропроводность равна: |
||||||
|
λс = |
4,38 10−3 |
=1,25 10−2 Ом-1·м2·моль-1 |
||||
|
0,35 |
||||||
|
Значения λ∞ вычисляем, исходя из подвижности ионов: |
||||||
|
λMg2+ = 89,2·10-4, |
λNO3− = 62,6·10-4 (табл. 15, приложение) |
λ∞ = (89,2 + 2·62,6) ·10-4 = 214,4·10-4 = 2,144·10-2 Ом-1·м2·моль-1
=1,25 10 −2 =
λ∞ 2,144 10 −2 0,583 , α = 58,3 %
13.2.При 18оС электропроводность насыщенного раствора иодида серебра равна 4,144·10-6 Ом-1·м-1; электропроводность воды, определенная в этих же условиях, 4·10-6 Ом-1·м-1. Вычислите концентрацию
AgI (моль/л) в насыщенном растворе (растворимость). Подвижности ионов Ag+ и I– соответственно равны 53,5·10-4 и 66,5·10-4 Ом-1·м2·моль-1 (табл. 15, приложение).
Р е ш е н и е: Насыщенный раствор труднорастворимого вещества можно считать бесконечно разбавленным. По электропровод-
72
Соседние файлы в предмете Химия
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #












