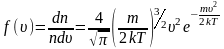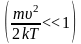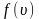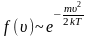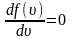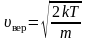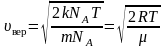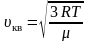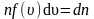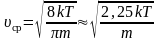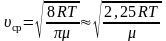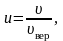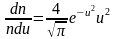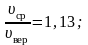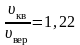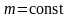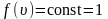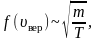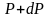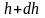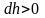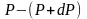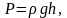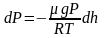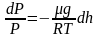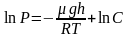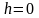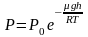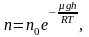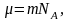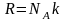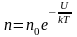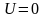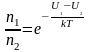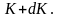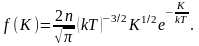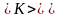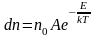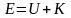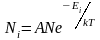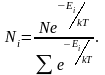Средняя скорость молекул
В физике выделяют 2 скорости, характеризующие движение молекул: средняя скорость движения молекул и средняя квадратичная скорость.
Средняя скорость движения молекул
Средняя скорость движения молекул называется также скоростью теплового движения молекул.
Формула средней относительной скорости молекул в физике представлена следующим выражением:
υotn=28kTπm0=2υ.
Средняя квадратичная скорость
Средняя квадратичная скорость движения молекул газа это следующая величина:
υkυ=1N∑i=1Nυi2
Формулу средней квадратичной скорости можно переписать так:
υkυ2=∫0∞υ2Fυdυ.
Проводя интегрирование, аналогичное интегрированию при получении связи средней скорости с температурой газа, получаем:
υkυ=3kTm0=3RTμ
Именно средняя квадратичная скорость поступательного движения молекул газа входит в состав основного уравнения молекулярно-кинетической теории:
p=13nm0υkυ,
где n=NV – это концентрация частиц вещества, N – это количество частиц вещества, V – это объем.
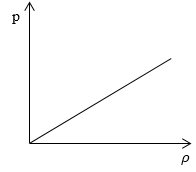
Необходимо определить, как изменяется средняя скорость движения молекул идеального газа с увеличением давления в процессе, изображенном на графике (рисунок 1).
Рисунок 1
Решение
Запишем выражение для средней скорости движения молекул газа следующим образом:
υ=8kTπm0
Из графика видно, что p~ρ или p=Cρ, где C – это некоторая константа.
m0=ρn, p=nkT=Cρ→kT=Cρn
Подставив m0=ρn, p=nkT=Cρ→kT=Cρn в υ=8kTπm0, получаем:
υ=8kTπm0=8Cρπnnρ=8Cπ
Ответ: В процессе, представленном на графике, с увеличением давления средняя скорость движения молекул не меняется.
Можно ли найти среднюю квадратичную скорость молекулы идеального газа, если известно: давление газа (p), молярная масса газа (μ), а также концентрация молекул газа (n)?
Решение
Применим выражение для υkυ:
υkυ=3RTμ
Помимо этого, из уравнения Менделеева-Клайперона и зная, что mμ=NNA:
pV=mμRT=NNART.
Поделим правую и левую части pV=mμRT=NNART на V, и зная NV=n, получаем:
p=nNART→RT=pNAn
Подставляем p=nNART→RT=pNAn в выражение для среднеквадратичной скорости υkυ=3RTμ, получаем:
υkυ=3pNAμn
Ответ: По заданным в условии задачи параметрам среднеквадратичная скорость движения молекул газа вычисляется при помощи формулы υkυ=3pNAμn.
Средняя квадратичная скорость молекул — среднее квадратическое значение модулей скоростей всех молекул рассматриваемого количества газа
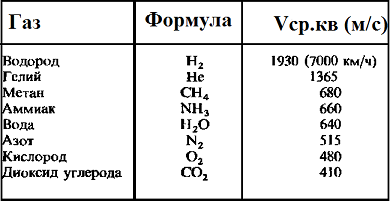
Таблица значений средней квадратичной скорости молекул некоторых газов
Для того чтоб понять, откуда же у нас получается эта формула, мы выведем среднюю квадратичную скорость молекул. Вывод формулы начинается с основного уравнения молекулярно кинетический теории (МКТ):
Где у нас количество вещества, для более легкого доказательства, возьмем на рассмотрение 1 моль вещества, тогда у нас получается:
Если посмотреть, то PV это две третьих средней кинетической энергии всех молекул (а у нас взят 1 моль молекул):
Тогда, если приравнять правые части, у нас получается, что для 1 моля газа средняя кинетическая энергия будет равняться:
Но средняя кинетическая энергия, так же находится, как :
А вот теперь, если мы приравняем правые части и выразим из них скорость и возьмем квадрат,Число Авогадро на массу молекулы , получается Молярная масса то у нас и получится формула для средней квадратичной скорости молекулы газа:
А если расписать универсальную газовую постоянную, как , и за одно молярную массу
, то у нас получится?
В Формуле мы использовали :
— Средняя квадратичная скорость молекул
— Постоянная Больцмана
— Температура
— Масса одной молекулы
— Универсальная газовая постоянная
— Молярная масса
— Количество вещества
— Средняя кинетическая энергия молекул
— Число Авогадро
Наиболее вероятная, среднеквадратичная и средняя арифметическая скорости молекул газа
Рассмотрим, как изменяется с абсолютной
величиной скорости число частиц,
приходящихся на единичный интервал
скоростей, при единичной концентрации
частиц.
График функции распределения Максвелла
,
приведен
на рисунке 2.6.

Рис.
2.6
Из
графика видно, что при «малых» υ,
т.е. при
,
имеем
;
затем
достигает максимума А
и далее экспоненциально спадает
.
Величину
скорости, на которую приходится максимум
зависимости
,
называют
наиболее вероятной скоростью.
Найдем
эту скорость из условия равенства
производной
.
, (2.3.6)
– наиболее
вероятная скорость одной молекулы.
Для
одного моля газа:
. (2.3.7)
Среднюю
квадратичную скорость
найдем, используя соотношение
:
– для одной молекулы. (2.3.8)
– для одного моля газа. (2.3.9)
Средняя
арифметическая скорость:
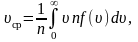
где
– число молекул со скоростью от υ
до
.
Если подставить сюда f(υ)
и вычислить, то получим:
–
для одной молекулы. (2.3.10)
–
для одного моля газа. (2.3.11)
Все
три скорости незначительно отличаются
друг от друга множителем порядка единицы,
причем
Формула Максвелла для относительных скоростей
Для
решения многих задач удобно использовать
формулу Максвелла, где скорость выражена
в относительных единицах.
Относительную
скорость обозначим через u:
(2.3.13)
где
.
Тогда из (2.3.3), получим
. (2.3.14)
Это
уравнение универсальное. В
таком виде функция
распределения
не зависит ни от рода газа, ни от
температуры.
На
рисунке 2.7 показано максвелловское
распределение частиц f(υ),
имеющих скорости от υ до
За единицу скорости здесь взята наиболее
вероятная скорость.
Полезно
знать, что
.
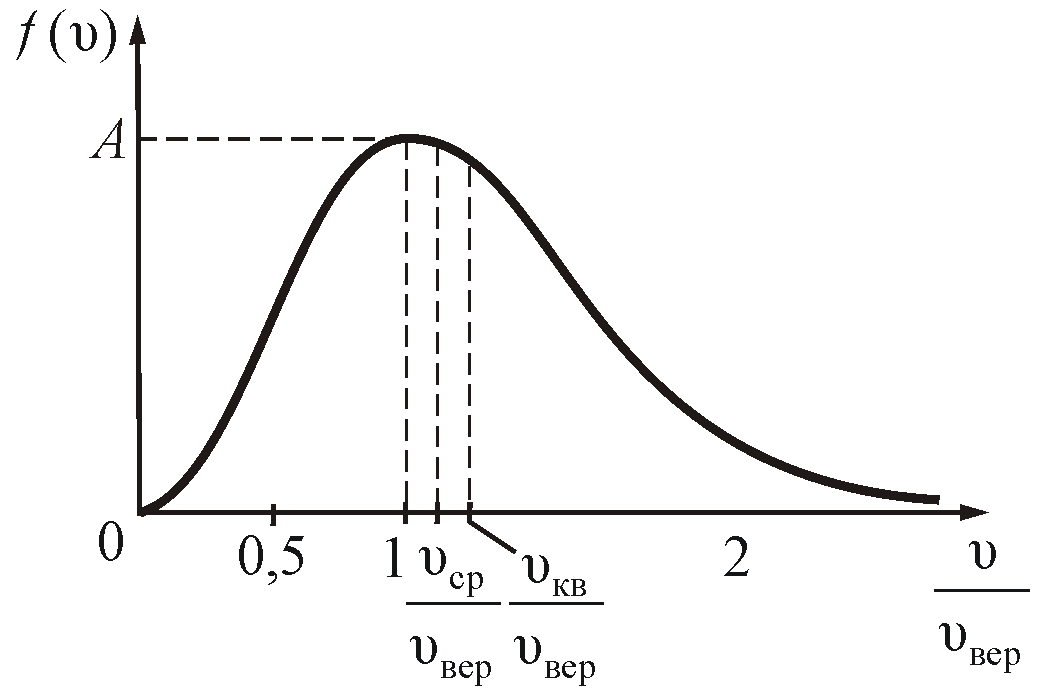
Рис.
2.7
Зависимость функции распределения Максвелла от массы молекул и температуры газа
На
рисунке 2.8 показана зависимость
при различных температурах и массах
молекул газа.
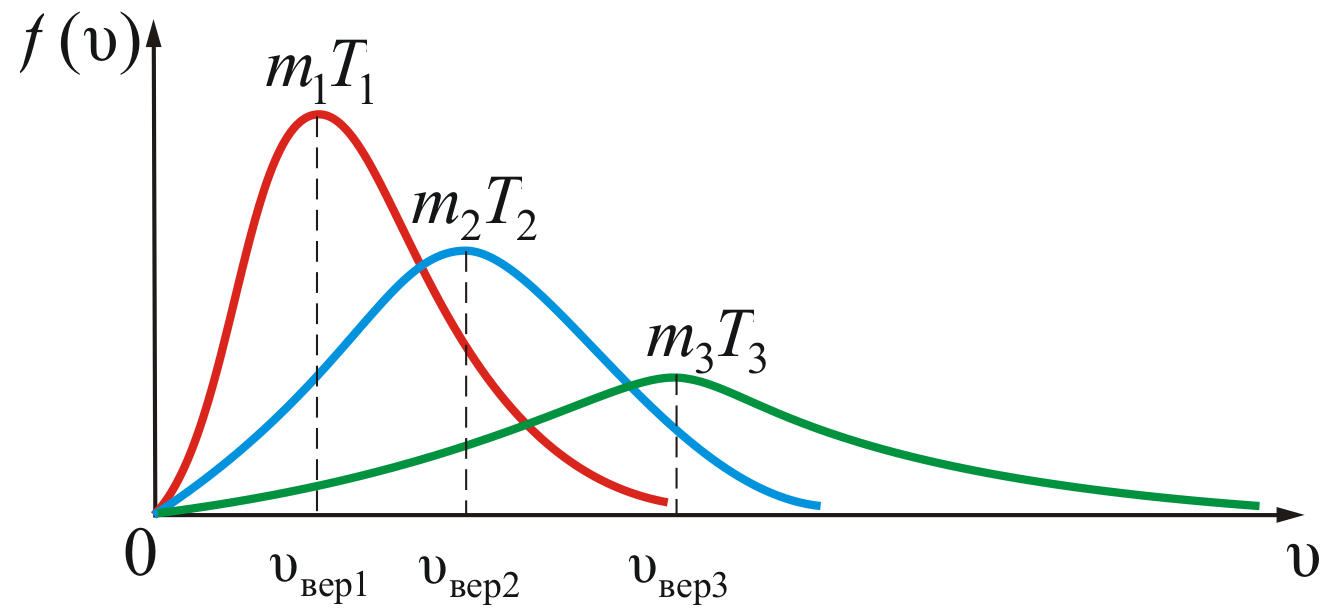
Рис.
2.8
Из
рисунка 2.8 можно проследить за изменением
при изменении m
и T.
В данном случае
(при
)
или
(при
).
Площадь
под кривой величина постоянная,
равная единице (
),
поэтому важно знать как будет изменяться
положение максимума кривой:
кроме
того
Максвелловский
закон распределения по скоростям и все
вытекающие следствия справедливы только
для газа в равновесной системе. Закон
статистический, и выполняется тем лучше,
чем больше число молекул.
Барометрическая формула
Рассмотрим
ещё один очень важный закон.
Атмосферное
давление на какой-либо высоте h
обусловлено весом слоёв газа, лежащих
выше. Пусть P
– давление на высоте h,
а
–
на высоте
(рис. 2.9).
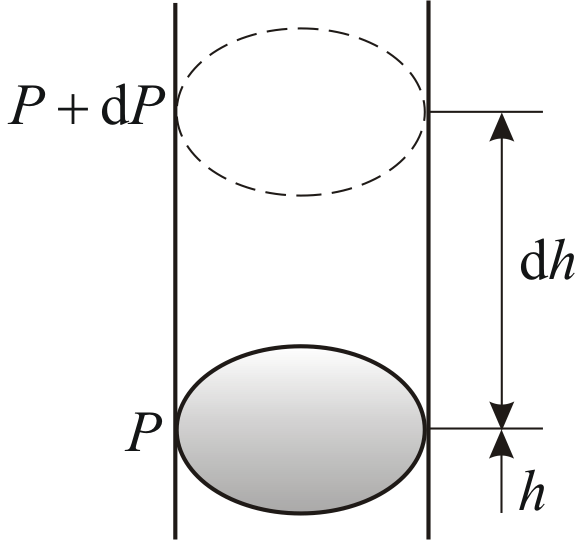
Рис.
2.9
Причём
,
а dР
< 0, так как на большей высоте давление
меньше. Разность давления
равна весу газа, заключённого в объёме
цилиндра с площадью основания равного
единице и высотой dh.
Т.к.
где
плотность газа на высоте h,
медленно убывающая с высотой, то можно
записать:
.
или
.
Проинтегрировав
это выражение, получим:
,
где
С
– произвольная постоянная.
В
силу произвольности, примем, что С
= Р0
– давление на высоте
.
Отсюда, после потенцирования, получаем
барометрическую формулу:
(2.4.1)
Из
формулы (2.4.1) следует, что P
убывает с высотой тем быстрее, чем
тяжелее газ (чем больше μ) и чем ниже
температура (например, на больших высотах
концентрация легких газов Не и Н2
гораздо больше, чем у поверхности Земли).
На
рисунке 2.10 изображены две кривые, которые
можно трактовать, либо как соответствующие
разным μ (при одинаковой Т),
либо как отвечающие разным Т,
при одинаковых μ.
Таким
образом, чем тяжелее
газ (больше μ) и чем ниже
температура, тем быстрее
убывает давление.
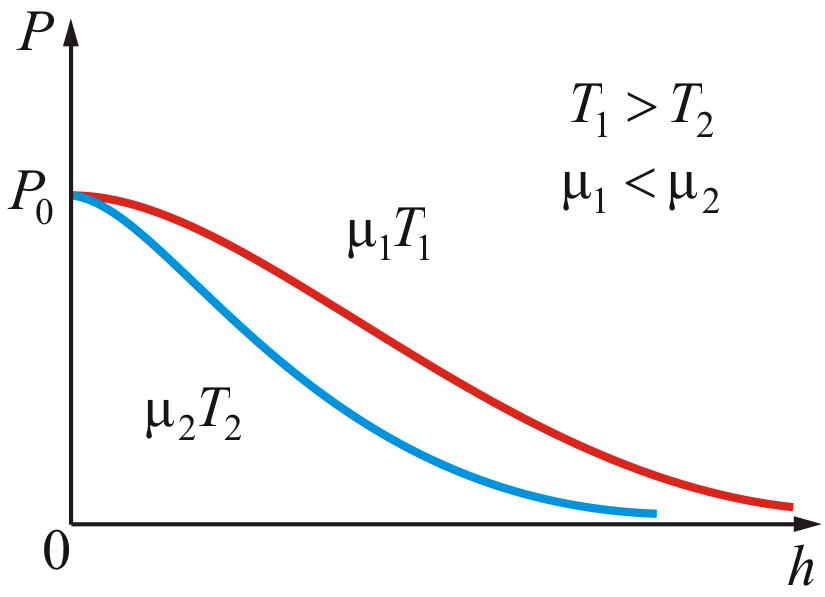
Рис.
2.10
Пусть идеальный газ находится в поле
консервативных сил в условиях теплового
равновесия. При этом концентрация газа
будет различной в точках с различной
потенциальной энергией, что необходимо
для соблюдения условий механического
равновесия. Так, число молекул в единичном
объеме n убывает с
удалением от поверхности Земли, и
давление, в силу соотношения
,
падает.
Если известно число молекул в единичном
объеме, то известно и давление, и наоборот.
Давление и плотность пропорциональны
друг другу, поскольку температура в
нашем случае постоянна. Давление с
уменьшением высоты должно возрастать,
потому что нижнему слою приходится
выдерживать вес всех расположенных
сверху атомов.
Исходя
из основного уравнения молекулярно-кинетической
теории:
,
заменим P
и P0
в барометрической формуле (2.4.1) на n
и n0
и получим распределение
Больцмана
для молярной массы газа:
(2.5.1)
где
n0
и n
число молекул в единичном объёме на
высоте h
= 0 и h.
Так
как
а
,
то (2.5.1) можно представить в виде
(2.5.2)
С
уменьшением температуры число молекул
на высотах, отличных от нуля, убывает.
При
тепловое движение прекращается, все
молекулы расположились бы на земной
поверхности. При высоких температурах,
наоборот, молекулы оказываются
распределёнными по высоте почти
равномерно, а плотность молекул медленно
убывает с высотой. Так как
– это потенциальная энергия U,
то на разных высотах
– различна. Следовательно, (2.5.2)
характеризует распределение частиц по
значениям потенциальной энергии:
, (2.5.3)
– это
закон распределения частиц по потенциальным
энергиям – распределение Больцмана.
Здесь n0
– число молекул в единице объёма там,
где
.
На
рисунке 2.11 показана зависимость
концентрации различных газов от высоты.
Видно, что число более тяжелых молекул
с высотой убывает быстрее, чем легких.
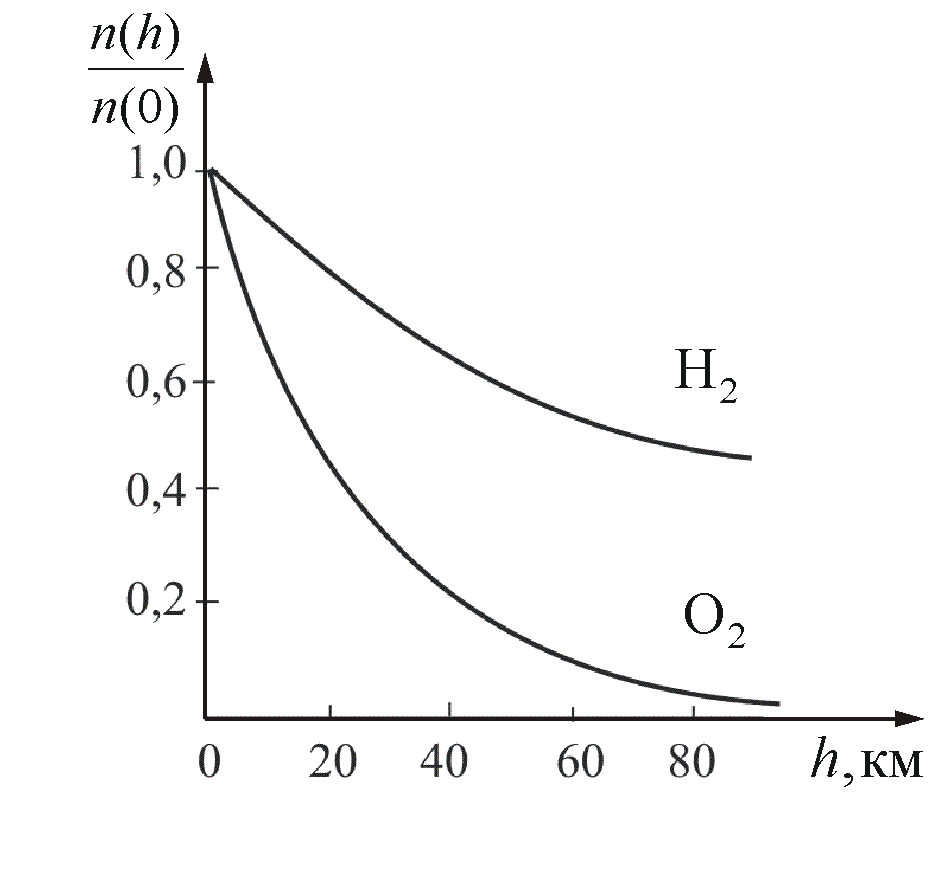
Рис.
2.11
Из
(2.5.3) можно получить, что отношение
концентраций молекул в точках с U1
и U2
равно:
. (2.5.4)
Больцман
доказал, что соотношение (2.5.3) справедливо
не только в потенциальном поле сил
гравитации, но и в любом потенциальном
поле, для совокупности любых одинаковых
частиц, находящихся в состоянии
хаотического теплового движения.
В
п. 2.3 мы получили выражение для распределения
молекул по скоростям (распределение
Максвелла):
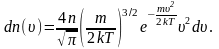
Из
этого выражения легко найти
распределение молекул газа по значениям
кинетической энергии
K.
Для этого перейдём от переменной υ
к переменной
:
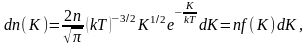
где
dn(K)
– число молекул, имеющих кинетическую
энергию поступательного движения,
заключённую в интервале от K
до
Отсюда получим функцию
распределения молекул по энергиям
теплового движения:
(2.6.1)
Средняя
кинетическая энергия
молекулы идеального газа:
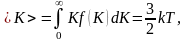
то
есть получаем результат, совпадающий
с прежним результатом, полученным в п.
1.3.
Итак,
закон Максвелла даёт распределение
частиц по значениям кинетической
энергии, а закон Больцмана – распределение
частиц по значениям потенциальной
энергии. Оба распределения можно
объединить в единый закон
Максвелла – Больцмана:
. (2.6.2)
Здесь
n0
– число молекул в единице объёма в той
точке, где
,
– полная энергия.
В
последнем выражении, потенциальная и
кинетическая энергии, а следовательно
и полная энергия Е,
могут принимать непрерывный ряд значений.
Если же энергия частицы может принимать
лишь дискретный ряд значений Е1,
Е2…,
(как это имеет место, например, для
внутренней энергии атома), то в этом
случае распределение Больцмана имеет
вид:
, (2.6.3)
где
Ni
– число частиц, находящихся в состоянии
с энергией Еi,
а А
– коэффициент пропорциональности,
который должен удовлетворять условию
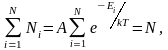
где
N
– полное число частиц в рассматриваемой
системе.
Тогда
окончательное выражение распределения
Максвелла – Больцмана для случая
дискретных значений энергий
будет иметь вид:
(2.6.4)
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Средняя квадратичная скорость — среднее квадратическое значение скоростей всех молекул данного количества газа. Измеряется в (м^2/с^2.)
Что оказывает влияние на скорость молекул
На быстроту движения молекул в газе оказывают влияние следующие параметры:
- Давление (возникает в результате ударов частиц о стенки сосуда).
- Концентрация частиц (количество частиц в единице объема).
- Температура (с увеличением температуры, частицы начинают двигаться быстрее, с уменьшением — замедляются).
- Масса молекул.
Эта взаимозависимость выражается главным уравнением молекулярно-кинетической теории идеального газа:
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
(P=frac13times m_0times ntimes V^2)
Где P — давление газа в Паскалях, (m_0) — масса молекулы в килограммах, n — концентрация частиц в (м^3), V — скорость движения молекул в м/с.
Расчет по формуле
Для определения средней квадратичной скорости (обозначение — v) всех молекул в газе, нужно вычислить квадратный корень из средней арифметической величины квадратов скоростей каждой частицы.
В виде формулы это выглядит так:
(v=sqrt{frac{v_1^2+v_2^2+…v_n^2}N})
Где (v_1) — (v_n) — это скорости молекул, N — их число в газе.
Расчет значения по такой формуле очень громоздок и сложен, поэтому для определения значения средней квадратичной скорости используют следующее уравнение:
(v=sqrt{frac{3times Rtimes T}M})
Где R — универсальная газовая постоянная, равная примерно 8,31 Дж/Кхмоль, T — температура в Кельвинах, M — молярная масса в кг/моль.
Получается такое уравнение путем преобразования основного уравнения кинетической теории газов.
Для характеристики движения молекул в физике используют две скорости: среднюю и среднюю квадратичную скорость молекул.
Важно. Следует обязательно понимать, что в реальных условиях мы не можем точно знать ни конкретное число молекул в системе, ни тем более скорость каждой из них в конкретный момент времени. Это обусловлено неимоверно гигантским числом частиц в реальных и даже сколько-нибудь приближенных к ним системах. Например, в 1 см3 при давлении 200 мм. рт. ст. содержится 4,18*1018 молекул водорода. Говоря более понятными категориями, это более чем 4 миллиарда миллиардов. Заметим, что указанное давление меньше атмосферного почти в 4 раза. Последнее в среднем равняется 760 мм. рт. ст. Разрежённый водород по своим свойствам наиболее близок к идеальному газу. В данном случае физика вынуждена иметь дело с распределениями скоростей и энергий частиц.
Что такое средняя скорость движения молекул
Среднюю скорость движения молекул часто именуют скоростью их теплового движения.
Определение 1
Вид формулы средней относительной скорости молекул в физике можно представить выражением:
[text { Vотн }=sqrt{2} sqrt{frac{8 R T}{pi m_{0}}}]
Выражение под корнем – средняя скорость молекул идеального газа.
Как определить среднюю квадратичную скорость движения молекул
Определение 2
Средней квадратичной скоростью молекул идеального газа называют величину равную квадратному корню из среднего арифметического величины квадратов скоростей каждой из молекул.
Средняя скорость молекул равна:
[leftlanglemathrm{V}_{mathrm{KB}}rightrangle=sqrt{frac{1}{N} sum_{i=1}^{N} v_{i}^{2}}]
Если обе её части возвести в квадрат и проинтегрировать, то получим выражение:
[langlemathrm{VKB}rangle^{2}=int_{0}^{infty} v^{2} F(v) d v]
Ещё одно выражение для среднеквадратичной скорости:
[leftlangle V_{K B}rightrangle=sqrt{frac{3 k T}{m_{0}}}=sqrt{frac{3 R T}{mu}}]
Именно она присутствует в уравнении, именуемом основным уравнением молекулярно-кинетической теории
P = (1/3)nm*<Vкв>
Где n – концентрация молекул, которая вычисляется делением их общего числа на объём.
Пример. 1.
Рассмотрим простейший случай, чтобы использование интегрирования не затруднило понимание сути явления и помогло лучше понять материал. Вычислим как меняется средняя скорость движения молекул в идеальном газе при линейном увеличении его давления. График следующий:
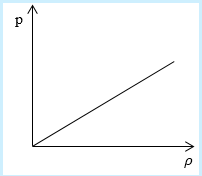
Напомним, что средняя скорость частиц:
[mathrm{Vcp}=sqrt{frac{8 R T}{pi m_{0}}}]
Если присмотреться к представленному графику, то можно заметить, что P приблизительно равно ρ. Эти две величины можно связать соотношением
P=C*ρ
Где С – некоторая постоянная величина, константа.
Далее считаем m0= ρ/n, p = n*k*T = C* ρ. Отсюда следует, что k*T = (C*ρ)/n.
Нужно лишь подставить эти значения в формулу для средней скорости:
[V c p=sqrt{8 mathrm{kT} / pi mathrm{m}}=sqrt{(8 mathrm{C} rho / pi mathrm{n})(mathrm{n} / rho)}=sqrt{8 mathrm{C} / pi}]
В полученном выражении нет ни одной переменной величины, т. е. при увеличении давления, вопреки ожиданиям, скорость оказалась неизменной.
Ответ: В процессе, который был дан нам на графике, при увеличении давления средняя скорость молекул никак не меняется.
Нет времени решать самому?
Наши эксперты помогут!
Пример. 2.
Определим среднюю квадратичную скорость молекул газа при условии, что нам известны его давление (P), молярная масса (M) и концентрация частиц (n).
Воспользуемся формулой:
[leftlanglemathrm{V}_{kappa в}rightrangle=sqrt{frac{3 k T}{m_{0}}}=sqrt{frac{3 R T}{mu}}]
Также нам потребуется уравнение Менделеева-Клайперона
Здесь мы воспользовались тем, что:
m/μ = N/Na
PV = (m/μ)*RT = (N/Na)*RT
Если обе части этого уравнения поделить на V и принять во внимание, что
(N/V) = n, то можно получить
P = (n/Na)*RT. Отсюда находим, что RT = (p*N)/n
Если мы это подставим в выражение для среднеквадратичной скорости [leftlangle V_{K B}rightrangle=sqrt{3 mathrm{kT} / mathrm{m}_{0}}=sqrt{3 mathrm{RT} / mu}], получим, что средняя квадратичная скорость движения молекул газа: [leftlangle V_{K B}rightrangle=sqrt{left(3 rho N_{a}right) /(mu mathrm{n})}]
Ответ: Формула средней квадратичной скорости молекул исходя из данный нам условий следующая:
[leftlangle V_{K B}rightrangle=sqrt{left(3 rho N_{a}right) /(mu mathrm{n})}]