Команда “Газы!” была объявлена еще две недели назад. И что?! Легкие задачи порешали и расслабились?! Или вы думаете, что задачи на газы касаются только 28-х заданий ЕГЭ?! Как бы не так! Если газов пока еще не было в 34-х заданиях, это ничего не значит! Задач на электролиз тоже не было в ЕГЭ до 2018 года. А потом как врезали, мама не горюй! Обязательно прочитайте мою статью “Тайны задач по химии? Тяжело в учении – легко в бою!”. В этой статье очень подробно рассказывается о новых фишках на электролиз. Статья вызвала шквал самых разных эмоций у преподавателей химии. До сих пор мне и пишут, и звонят, и благодарят, и бьются в конвульсиях. Просто цирк с конями, в котором я – зритель в первом ряду.
Однако, вернемся к нашим баранам, вернее, Газам. Я прошла через огонь и воду вступительных экзаменов и знаю точно – хочешь завалить абитуриента, дай ему задачу на Газы. Почитайте на досуге сборник задач И.Ю. Белавина. Я процитирую одну такую “мозгобойню”, чтобы вам жизнь медом не казалась. Попробуйте решить.
И.Ю. Белавин, 2005, задача 229
“Два из трех газов (сероводород, водород и кислород) смешали и получили газовую смесь, плотность которой оказалась равной плотности оставшегося газа. Полученную газовую смесь вместе с равным ей объемом третьего газа под давлением поместили в замкнутый сосуд емкостью 4 л, содержавший азот при н.у. и нагревали при 600 С до окончания химических реакций, затем постепенно охладили. Определите массы веществ, содержавшихся в сосуде после охлаждения, если плотность газовой смеси в сосуде перед нагреванием равнялась 9,25г/л. (Ответ: m(S) = 7,5 г, m(SO2) = 15 г, m(Н2О) = 9 г)”
Ну как, решили? Нет?! А ваши репетиторы?! Извините, это был риторический вопрос. Кстати, мои ученики, абитуриенты 2003-2008 гг. такие задачи щелкали, как семечки, на экзаменах во 2-й медицинский (теперь РНИМУ им. Н.И. Пирогова). Надеюсь, вам понятно, что 34-м задачам ЕГЭ еще есть куда усложняться, perfectio interminatus est (нет предела совершенству), с газами нужно работать, работать и работать. Поэтому команду “Газы!” отменять рано. Итак, поехали!
Сегодня мы поговорим о газовых смесях, затронем понятие плотности газа (абсолютной и относительной), средней молярной массы, решим задачи: определение средней молярной массы и плотности газа по компонентам смеси и наоборот.
• Газовая смесь – смесь отдельных газов НЕ вступающих между собой в химические реакции. К смесям газов относятся: воздух (состоит из азота, кислорода, углекислого газа, водяного пара и др.), природный газ (смесь предельных и непредельных углеводородов, оксида углерода, водорода, сероводорода, азота, кислорода, углекислого газа и др.), дымовые газы (содержат азот, углекислый газ, пары воды, сернистый газ и др.) и др.
• Объемная доля – отношение объема данного газа к общему объему смеси, показывает, какую часть общего объема смеси занимает данный газ, измеряется в долях единицы или в процентах.
• Мольная доля – отношение количества вещества данного газа к общему количеству вещества смеси газов, измеряется в долях единицы или в процентах.
• Плотность газа (абсолютная) – определяется как отношение массы газа к его объему, единица измерения (г/л). Физический смысл абсолютной плотности газа – масса 1 л, поэтому молярный объем газа (22,4 л при н.у. t° = 0°C, P = 1 атм) имеет массу, численно равную молярной массе.
• Относительная плотность газа (плотность одного газа по другому) – это отношение молярной массы данного газа к молярной массе того газа, по которому она находится
• Средняя молярная масса газа – рассчитывается на основе молярных масс составляющих эту смесь газов и их объемных долей
Настоятельно рекомендую запомнить среднюю молярную массу воздуха Мср(в) = 29 г/моль, в заданиях ЕГЭ часто встречается.
Обязательно посетите страницу моего сайта “Изучаем Х-ОбХ-04. Закон Авогадро. Следствия из закона Авогадро. Нормальные условия. Молярный объем газа. Абсолютная и относительная плотность газа. Закон объемных отношений” и сделайте конспекты по теории. Затем возьмите бумагу и ручку и решайте задачи вместе со мной.
ВАНГУЮ: чует мое сердце, что ЕГЭ по химии 2019 года устроит нам газовую атаку, а противогазы не выдаст!
Задача 1
Определить плотность по азоту газовой смеси, состоящей из 30% кислорода, 20% азота и 50% углекислого газа.
Задача 2
Вычислите плотность по водороду газовой смеси, содержащей 0,4 моль СО2, 0,2 моль азота и 1,4 моль кислорода.
Задача 3
5 л смеси азота и водорода имеют относительную плотность по водороду 12. Определить объем каждого газа в смеси.
Несколько задач со страницы моего сайта
Задача 4
Плотность по водороду пропан-бутановой смеси равна 23,5. Определите объемные доли пропана и бутана
Задача 5
Газообразный алкан объемом 8 л (н.у.) имеет массу 14,28 г. Чему равна его плотность по воздуху
Задача 6
Плотность паров альдегида по метану равна 2,75. Определите альдегид
Ну как? Пошло дело? Если туго, вернитесь к задачам и решайте их самостоятельно до тех пор, пока не щелкнет! А для стимуляции – десерт в виде еще одной задачи И.Ю. Белавина на газы. Наслаждайтесь ее решением самостоятельно!
И.Ю. Белавин, 2005, задача 202
“Сосуд емкостью 5,6 л при н.у. заполнили метаном, затем нагрели до высокой температуры, в результате чего произошло частичное разложение метана. Определите массу образовавшейся сажи, если известно, что после приведения к нормальным условиям объем полученной газовой смеси оказался в 1,6 раза больше объема исходного метана, эта газовая смесь обесцвечивает бромную воду и имеет плотность по воздуху 0,2931. (Ответ: m(C) = 0,6 г)”
Задачи И.Ю. Белавина – это крутой драйв! Попробуйте порешать, и вы откажетесь от просмотра любых ужастиков, поскольку запасетесь адреналином надолго! Но нам нужно спуститься на землю к ЕГЭ, простому и надежному, как первый советский трактор. Кстати, у меня в коллекции припасено немало сюрпризов с газовыми фишками, собранными за все годы работы и бережно хранимыми. Думаю, пришло время сказать им: “И снова здравствуйте!”, поскольку ЕГЭ с каждым годом становится “все чудесатее и чудесатее”. Но это уже совсем другая история. Читайте мои статьи – и вы подстелите соломку под свою ЕГЭшную попу.
Вы готовитесь к ЕГЭ и хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии http://repetitor-him.ru. Здесь вы найдете огромное количество задач, заданий и теоретического материала, познакомитесь с моими учениками, многие из которых уже давно работают врачами. Позвоните мне +7(903)186-74-55, приходите ко мне на курс, на бесплатные Мастер-классы “Решение задач по химии”. Я с удовольствием вам помогу.
Репетитор по химии и биологии кбн В.Богунова
Под плотностью
или объемной массой тела понимают
отношение массы тела в состоянии
покоя к его объему.
Плотность газа в
нормальных физических условиях может
быть определена по его молекулярной
массе
![]()
,
кг/м3 (1)
Если плотность
газа задана при нормальном давлении,
то пересчет ее на другое давление р
(при той же температуре) для идеального
газа проводится по формуле
![]()
(Ш.2)
.
Часто для
характеристики газа применяют
относительную плотность его по воздуху
при нормальных условиях 0=0:1,293.
|
Коммерческие
расчеты в газовой промышленности
производятся при стандартных
физических условиях: давлении 0,1013 МПа
и температуре 20 °С.
Состав газовой смеси
Газовые смеси (как
и смеси жидкостей и паров) характеризуются
массовыми или молярными концентрациями
компонентов. Объемный состав газовой
смеси примерно совпадает с молярным,
так как объем 1 кмоля идеального газа
при одинаковых физических условиях, по
закону Авогадро, имеет одно и то же
численное значение, в частности при О
°С и 760 мм рт. ст. равен 22,41 м3.
Для характеристики
газовой смеси надо знать ее среднюю
молекулярную массу, среднюю плотность
в кг/м3
или относительную плотность по
воздуху.
Если известен
молярный состав смеси в процентах, то
средняя молекулярная масса
![]()
.
(3)
где у1,
у2,…,
уn
— молярные (объемные) доли компонентов,
%;
M1,
М2,
…, Мn
— молекулярные массы компонентов.
Если задан массовый
состав смеси в процентах, то ее средняя
молекулярная масса вычисляется по
формуле
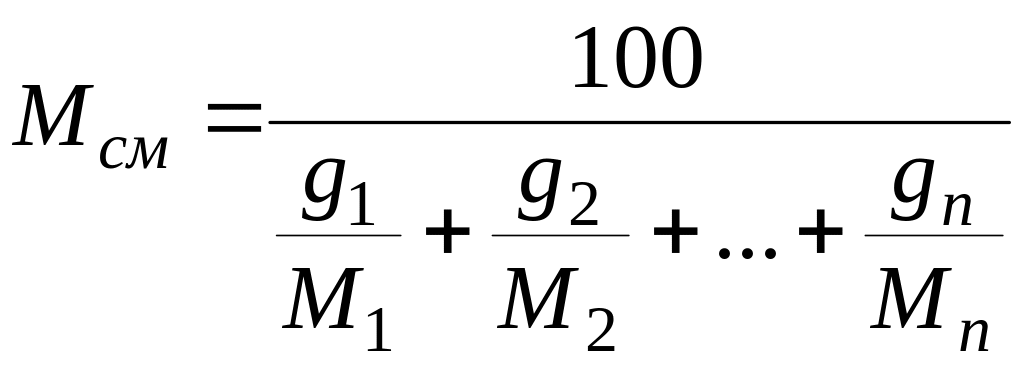
(4)
где g1,
g2,
…, gn
— массовые доли компонентов, %.
Плотность смеси
см
определяют по вычисленному значению
средней молекулярной массы Мсм по
формуле, аналогичной (1):
![]()
.
(5)
Относительную
плотность определяют по формуле
![]()
(6)
где рcм
и рв
— плотность смеси и воздуха при
температуре О °С и нормальном давлении.
Содержание тяжелых углеводородов в газе
Для полной
характеристики природного газа необходимо
также знать содержание в нем тяжелых
углеводородов. Принято считать, что
в газе три фракции: пропановая, бутановая
и газовый бензин, причем последний, для
подсчета ресурсов, принимается
состоящим из 1/3 бутана и 2/3 пентана (по
массе).
Если дан массовый
или молярный состав газа, то содержание
тяжелых углеводородов определяется по
формуле
Gi
= 10giсм
= 10уii,
(7)
где gi
— массовая доля данного тяжелого
углеводорода в газе, %; cм
— средняя плотность природного газа,
кг/м3;
yi
— молярная доля данного тяжелого
углеводорода в газе, %; i–плотность
данного тяжелого углеводорода, кг/м3.
После определения
содержания в газе каждого отдельного
углеводорода (пропана, бутана, пентана
и высших) делают пересчет на содержание
пропана, бутана, газового бензина. Для
этого прибавляют к пентану требуемое
количество бутана, чтобы получить
газовый бензин
Пример. По данному
массовому составу газа требуется
определить содержание в нем пропана,
бутана и газового бензина (в г/м3).
Массовый состав газа (в %): метан—19,50;
этан—11,80; пропан — 37,95; изобутан — 3,25;
н-бутан—12,05; пентан и высшие — 8,15; азот
—7,30.
Решение. Для
определения средней плотности газа
найдем среднюю молекулярную массу газа
по формуле (4)
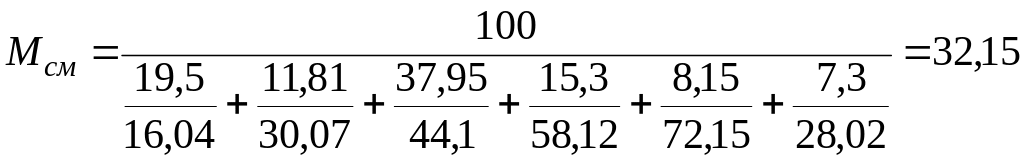
Средняя плотность
газа по формуле (5)
![]()
кг/м3
Состав газа
определим по формуле (7)
пропана 1037,951,43
= 542 г/м3
изобутана
103,251,43
= 46,5 г/м3
н-бутана
1012,051,43=172
г/м3
пентана и высших
108,151,43
= 117 г/м3
Итого:
877,5 г/м3
Газового бензина
(пентана две части и н-бутана одна часть)
будет 117 +117/2 = 175,5 г/м3
н-бутана 172 —58,5=
113,5 г/м3
изобутана
46,5 г/м3
пропана 542,0 г/м3
Всего тяжелых
углеводородов 877,5 г/м3
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
1.Находим
количество вещества газовой смеси: υ(смеси)=![]() =14/22,4=0,625(моль)
=14/22,4=0,625(моль)
2.Вычисляем среднюю молярную массу смеси: М(смеси) = ![]() = 25,5:0,625= 40,8(г/моль)
= 25,5:0,625= 40,8(г/моль)
3.
Находим объемную долю азота в смеси: Пусть x—объемная доля
азота в смеси, φ(N2)=x, тогда
(1-x)—объемная
доля оксида углерода(IV) в
смеси, φ (CO2)= 1-x
по формуле М(смеси)= φ(N2) × М(N2) + φ (CO2) × М(CO2)
40,8= x×28 +
(1-x) ×
44 откуда x=0,2
или x=20%
φ(N2)=20%
φ (CO2)=1-0,2=0,8
или 80%
4.
Определяем мольную долю азота в смеси. По закону Авогадро объемная доля газа
в смеси равна его мольной доле, поэтому φ(N2)= χ(N2)=0,2
или 20%
5.
Вычисляем массовую долю азота в смеси, на основе формулы χ(N2)= υ(N2)/ υ(смеси)
находим
количество вещества азота
υ(N2) = χ(N2) × υ(смеси)=0,2×0,625=0,125
(моль), тогда m(N2)= υ(N2) × M(N2)=
0,125×28=3,5(г)
ω(N2)=![]() = 3,5/25,5=0,137 или 13,7%
= 3,5/25,5=0,137 или 13,7%
Все эти
действия можно объединить одной формулой ω(N2)= ![]() = 0,2 × 0,625 × 28/25,5=0,137
= 0,2 × 0,625 × 28/25,5=0,137
или
ω(N2)=![]() = 0,2 × 28/40,8 = 0,137 или 13,7%
= 0,2 × 28/40,8 = 0,137 или 13,7%
Ответ:
φ(N2)=20%
; χ(N2)=20%
ω(N2)=13,7%
Надо было указать, при каких условиях необходимо найти плотность смеси газов. Будем считать, что тебе даны нормальные условия.
Рассмотрим пример.
Пусть тебе дана смесь двух газов – кислорода и водорода. Количество вещества смеси газов примем равным 1 моль.
n(смеси) = 1,0 моль
Объемные доли водорода и кислорода в смеси газов φ(О2) и φ(Н2).
На основании закона Авогадро объемные доли в смеси газов равны их мольным долям.
Х(О2) = φ(О2)
Х(Н2) = φ(Н2)
Для простоты расчетов мольные доли переводишь из процентов в доли единицы.
Х(О2) + Х(Н2) = 1
Молярная масса смеси газов
M(смеси) = [X(О2)*M(O2) + X(Н2)*M(H2)]/[X(O2) + X(Н2)] = X(О2)*M(O2) + X(Н2)*M(H2)
На основании закона Авогадро один моль газа занимает при нормальных условиях объем 22,4 литра.
Плотность смеси газов находишь, разделив молярную массу смеси газов на молярный объем.
ρ(смеси) = M(смеси)/Vm
Vm = 22,4 л/моль
Если тебе даны массовые доли газов в смеси, то принимаешь массу смеси равной 1000 г.
m(смеси) = 1000 г
Массовые доли газов для удобства переводишь из процентов в доли единицы. Находишь массу каждого газа, а затем количество вещества каждого газа в смеси.
m(O2) = ω(О2)*m(смеси)
n(O2) = m(O2)/M(O2)
m(H2) = ω(H2)*m(смеси)
n(H2) = m(H2)/M(Н2)
n(смеси) = n(O2) + n(H2)
По закону Авогадро находишь объем, занимаемый смесью при нормальных условиях.
V(смеси) = n(смеси)*Vm
Плотность смеси газов находишь, разделив массу смеси газов на объем смеси.
ρ(смеси) = m(смеси)/V(смеси)
Если условия отличаются от нормальных, то молярный объем находишь по
уравнению Менделеева – Клайперона.
P*Vm = n(смеси)*R*T
n(смеси) = 1 моль
Масса склянки возросла из-за реакции пропина и брома:
HC≡C-CH3 + 2Br2 = CHBr2-CBr2-CH3
n(HC≡C-CH3) = m/M = 0.8 г. / 40 г/моль = 0.02 моль
Масса трубки с P2O5 возросла из-за реакции с водой:
P2O5 + 3H2O = 2H3PO4
n(H2O) = m/M = 7.92 г. / 18 г/моль = 0.44 моль
Теперь о водороде:
n(H) = 2n(H2O) = 0.88 моль
Количество моль водорода в пропине:
n(H)пропин = 4n(HC≡C-CH3) = 0.08 моль
Тогда остальное “принадлежит” бутану.
n(H)бутан = 0.88 – 0.08 = 0.8 моль
n(C4H10) = n(H)бутан/10 = 0.08 моль
V(C4H10) = n*VM = 1.792 л.
V(HC≡C-CH3) = n*VM = 0.448 л.
φ(C4H10) = 1.792 / (1.792 + 0.448) = 0.8 или 80%
