Основы деления солей на отдельные группы были заложены в трудах французского химика и аптекаря Г. Руэля ((1703)–(1770)). Именно он в (1754) г. предложил разделить известные к тому времени соли на кислые, основные и средние (нейтральные). В настоящее время выделяют и другие группы этого чрезвычайно важного класса соединений.
Средними называют соли, в состав которых входят металлический химический элемент и кислотный остаток.
В состав солей аммония вместо металлического химического элемента входит одновалентная группа аммония
NH4I
.
Примеры средних солей:
— хлорид натрия;
Al2IIISO4II3
— сульфат алюминия;
NHI4NO3I
— нитрат аммония.
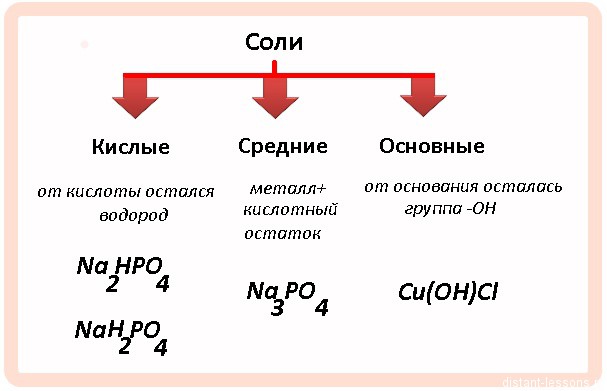
Кислыми называют соли, в состав которых, кроме металлического химического элемента и кислотного остатка, входят атомы водорода.
Кислые соли можно считать продуктом неполной нейтрализации многоосновной кислоты.
Обрати внимание!
Составляя формулы кислых солей, следует иметь в виду, что валентность остатка от кислоты численно равна количеству атомов водорода, входивших в состав молекулы кислоты и замещённых металлом.
При составлении названия такого соединения к названию соли добавляется приставка «гидро», если в остатке от кислоты имеется один атом водорода, и «дигидро», если в остатке от кислоты содержатся два атома водорода.
— гидрокарбонат кальция;
Na2IHPO4⏞II
— гидрофосфат натрия;
NaIH2PO4⏞I
— дигидрофосфат натрия.
Простейшим примером кислых солей может служить пищевая сода, т. е. гидрокарбонат натрия (NaHCO_3).
Основными называют соли, в состав которых, кроме металлического химического элемента и кислотного остатка, входят гидроксогруппы.
Основные соли можно рассматривать как продукт неполной нейтрализации многокислотного основания.
Обрати внимание!
Составляя формулы таких веществ, следует иметь в виду, что валентность остатка от основания численно равна количеству гидроксогрупп, «ушедших» из состава основания.
При составлении названия основной соли к названию соли добавляется приставка «гидроксо», если в остатке от основания имеется одна гидроксогруппа, и «дигидроксо», если в остатке от основания содержатся две гидроксогруппы.
— гидроксохлорид магния;
FeOH⏞IINO32I
— гидроксонитрат железа((III));
FeOH2⏞INO3I
— дигидроксонитрат железа((III)).
Известным примером основных солей может служить налёт зелёного цвета гидроксокарбоната меди((II)) ((CuOH)_2CO_3), образующийся с течением времени на медных предметах и предметах, изготовленных из сплавов меди, если они контактируют с влажным воздухом. Такой же состав имеет и минерал малахит.
Комплексные соединения — разнообразный класс веществ. Заслуга в создании теории, объясняющей их состав и строение, принадлежит лауреату Нобелевской премии по химии (1913) г. швейцарскому учёному А. Вернеру ((1866)–(1919)). Правда, термин «комплексные соединения» в (1889) г. был введён другим выдающимся химиком, лауреатом Нобелевской премии (1909) г. В. Оствальдом ((1853)–(1932)).
В составе катиона или аниона комплексных солей имеется элемент-комплексообразователь, связанный с так называемыми лигандами. Число лигандов, которое присоединяет комплексообразователь, называется координационным числом. Например, координационное число двухвалентной меди, а также бериллия, цинка, равно (4). Координационное число алюминия, железа, трёхвалентного хрома равно (6).
В названии комплексного соединения число лигандов, соединённое с комплексообразователем, отображается греческими числительными: (2) — «ди», (3) — «три», (4) — «тетра», (5) — «пента», (6) — «гекса». В качестве лигандов могут выступать как электрически нейтральные молекулы, так и ионы.
Название комплексного аниона начинается с указания состава внутренней сферы.
Если в качестве лигандов выступают анионы, к их названию добавляется окончание «–о»:
(–Cl) — хлоро-, (–OH) — гидроксо-, (–CN) — циано-.
Если лигандами являются электрически нейтральные молекулы воды, используется название «аква», а если аммиака — название «аммин».
Затем называют комплексообразователь, используя его латинское название и окончание «–ат», после чего без пробела римскими цифрами в скобках указывают степень окисления (если комплексообразователь может иметь несколько степеней окисления).
После обозначения состава внутренней сферы указывают название катиона внешней сферы — той, что в химической формуле вещества находится вне квадратных скобок.
Пример:
— тетрагидроксоцинкат калия,
K3AlOH6
— гексагидроксоалюминат калия,
K4FeCN6
— гексацианоферрат((II)) калия.
В школьных учебниках формулы комплексных солей более сложного состава, как правило, упрощаются. Например, формулу тетрагидроксодиакваалюмината калия
KAlH2O2OH4
принято записывать как формулу тетрагидроксоалюмината.
Если комплексообразователь входит в состав катиона, то название внутренней сферы составляют так же, как в случае комплексного аниона, но используют русское название комплексообразователя и в скобках указывают степень его окисления.
Пример:
— хлорид диамминсеребра,
CuH2O4SO4
— сульфат тетрааквамеди((II)).
Гидратами называют продукты присоединения воды к частичкам вещества (термин образован от греческого hydor — «вода»).
Многие соли выпадают в осадок из растворов в виде кристаллогидратов — кристаллов, содержащих молекулы воды. В кристаллогидратах молекулы воды прочно связаны с катионами или анионами, образующими кристаллическую решётку. Многие соли такого вида по сути являются комплексными соединениями. Хотя многие из кристаллогидратов известны с незапамятных времён, начало систематическому изучению их состава положил голландский химик Б. Розебом ((1857)–(1907)).
В химических формулах кристаллогидратов принято указывать соотношение количества вещества соли и количество вещества воды.
Обрати внимание!
Точка, которая делит химическую формулу кристаллогидрата на две части, в отличие от математических выражений не обозначает действие умножения и читается как предлог «с».
Например, химическая формула
Na2SO4⋅10H2O
читается так:
«натрий-два-эс-о-четыре-с-десятью-аш-два-о».
В названии при помощи греческого числительного (а для числа (9) — латинского) указывается количество вещества воды в моле кристаллогидрата, затем слитно следует слово «гидрат», а за ним (раздельно) — систематическое, т. е. международное, название соли.
Пример:
— дигидрат сульфата кальция;
CuSO4⋅5H2O
— пентагидрат сульфата меди((II)).
Для названия целого ряда кристаллогидратов, кроме систематического, используют и исторические (тривиальные) названия. Например, гемигидрат сульфата кальция
CaSO4⋅0.5H2O
называют жжёным гипсом, пентагидрат сульфата меди((II))
CuSO4⋅5H2O
называют медным купоросом, а декагидрат карбоната натрия
Na2CO3⋅10H2O
— кристаллической содой.
Соли встречаются в химии очень часто. Состоят они из металла и кислотного остатка, образуются чаще всего в реакции нейтрализации, то есть реакции между основанием и кислотой, хотя получить соли можно и другими способами. Изучение химии в школе предполагает знакомство со средними солями, но иногда в школьной химии встречаются кислые и основные соли. О них и пойдёт речь.
Классификация солей
Средние соли
Итак, средние соли образуются, когда в кислоте все атомы водорода замещены металлом. Примеры средних солей: КCl, Li2SO4, Na3PO4.
Из примеров как раз видно, что в кислотах, использованных для получения солей, все атомы водорода заместились на металл. Посмотрите, например, на фосфат натрия Na3PO4. Эта соль фосфорной кислоты H3PO4. Видно, что все три атома водорода заместились на атомы натрия.
Средние соли. Номенклатура
Здесь нет никакой сложности:
в названии используется название кислотного остатка и металл.
Примеры:
Ca(NO3)2 – нитрат кальция (нитрат – соль азотной кислоты),
MgSO4 – сульфат магния (сульфат – соль серной кислоты),
К3PO4 – фосфат калия (фосфат – соль фосфорной кислоты).
Кислые соли
Кислые соли – продукт неполного замещения атомов водорода в кислоте атомами металла. Примеры кислых солей: NaHCO3, KHSO3.
При составлении формул кислых солей важно понимать, как они образуются, иначе будет путаница с индексами. Давайте разберём это на примере гидрокарбоната натрия NaHCO3. Для начала вспомним о карбонате натрия Na2CO3. Это соль угольной кислоты Н2СО3. При образовании карбоната натрия заместились оба атома водорода на два атома натрия, то есть вместо двух атомов водорода в кислоте H2CO3 встали два атома натрия, образовав карбонат натрия Na2CO3:
в H2CO3 заместились 2 атома водорода на 2 атома натрия с образованием Na2CO3
А вот если атомов натрия не хватило, то атом натрия заместит лишь один атом водорода, второй при этом останется, то есть:
в H2CO3 заместился 1 атом водорода на 1 атом натрия с образованием NaHCO3
Обратите внимание, что все валентности учтены! Это важно! Вы знаете, что валентность кислотного остатка угольной кислоты СО3 равна II (потому что угольная кислота двухосновная, в ней два атома водорода). Валентность атома натрия I, валентность атома водорода I, поэтому и формула гидрокарбоната выглядят так: NaHCO3.
Кислые соли. Номенклатура
Чтобы назвать кислую соль правильно,
нужно к кислотному остатку добавить часть «гидро» (если в соли два атома водорода, то нужно добавить «дигидро»).
Примеры:
NaHSO3 – гидросульфит натрия (сульфит – соль сернистой кислоты H2SO3, но у нас соль кислая, поэтому добавляем «гидро»),
Na2HPO4 – гидрофосфат натрия (фосфат – соль фосфорной кислоты H3PO4, но у нас соль кислая, поэтому добавляем «гидро»),
NaH2PO4 – дигидрофосфат натрия (фосфат – соль фосфорной кислоты H3PO4, но у нас соль кислая, причём в ней два атома водорода, поэтому добавляем «дигидро»).
Запомните, что одноосновные кислоты не образуют кислых солей. Это довольно очевидно, ведь в одноосновных кислотах всего один атом водорода, и если он не заместится, то кислота так и останется кислотой, не превратившись в соль. Например, в соляной кислоте (одноосновной) HCl атом водорода в любом случае должен заместиться на атом металла, иначе соли не получится.
Основные соли
Основные соли получаются, когда не все гидроксильные группы в основании заместились кислотным остатком. Примеры основных солей: Zn(OH)Cl, Al(OH)SO4, Fe(OH)(NO3)2.
Здесь ситуация обратна той, что имеется при образовании кислых солей. Но если в кислых солях частично замещаются атомы водорода, то в основных – частично замещаются гидроксогруппы. Давайте рассмотрим это на примере гидроксохлорида цинка Zn(OH)Cl.
В гидроксиде цинка Zn(OH)2 заместились две группы ОН на два кислотных остатка соляной кислоты Cl с получением хлорида цинка ZnCl2 (средней соли).
Но бывает, что в гидроксиде цинка Zn(OH)2 заместилась одна группа ОН на один кислотный остаток соляной кислоты Cl с получением гидроксохлорида цинка Zn(ОН)Cl (средней соли).
Составление формул основных солей тоже требует внимательности. Здесь нужно учитывать число гидроксильных групп ОН и валентность кислотного остатка. Например, в Zn(OH)Cl валентность цинка II, валентность гидроксогруппы I, валентность кислотного остатка Cl – I.
Основные соли. Номенклатура
Чтобы правильно назвать основную соль,
нужно к кислотному остатку прибавить «гидроксо» (если в соли две гидроксильные группы, то добавляют «дигидроксо»).
Al(OH)SO4 – гидроксосульфат алюминия (сульфат – соль серной кислоты H2SO4, но у нас соль основная, поэтому добавляем «гидроксо»),
Fe(OH)2(NO3) – дигидроксонитрат железа (III) (нитрат – соль азотной кислоты HNO3, но у нас соль основная, причём в ней две гидроксильные группы ОН, поэтому добавляем «дигидроксо»),
Mg(ОН)Cl – гидроксохлорид магния (хлорид – соль соляной кислоты HCl, но у нас основная соль, поэтому добавляем «гидроксо»).
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Средние соли как определить?
cool-ibragim3
17 ноября 2018 · 2,4 K
Вообще соль – это химическое соединение, в котором атом металла связан с кислотным остатком. Средние соли – это соли, в которых происходит полное замещение атомов водорода ионами металла. Например: кухонная соль и гипс. Средние соли охватывают большое количество соединений, часто встречающихся в природе:цинковая обманка – ZnS, пиррит – FeS2 и т.д. Этот вид солей самый распространенный. Средние соли получают реакцией нейтрализации, когда кислота и основание взяты в эквимолярных соотношениях, например:
H2SO3 + 2 NaOH = Na2SO3 + 2 H2O
Получается средняя соль сульфат натрия. Если взять 1 моль гидроксида натрия, то реакция пойдет следующим образом:
H2SO3 + NaOH = NaHSO3 + H2O
Получается кислая соль гидросульфит натрия.
Если в кратце, то как то так)))
2,0 K
Комментировать ответ…Комментировать…
Кислые и средние соли
09-Дек-2014 | комментария 4 | Лолита Окольнова
Задания на соли встречаются в ЕГЭ не только в части А, но и в части С.
Давайте разберем основные примеры задач на
кислые и средние соли
1. Определите, какое вещество, и в каком количестве образуется, если прореагировали (н.у.):
а) 0,2 моль Н2S и 0,2 моль КОН;
б) 2,24 л SO2 и 4 г NaOH;
в) 4,48 л СО2 и 7,4 г Са(ОН)2;
г) 4,48 л аммиака и 19,6 г серной кислоты;
д) 0,3 моль гидроксида натрия и 0,3 моль фосфорной кислоты;
е) 4,48 л аммиака и 100 г 9,8 %-ного раствора фосфорной кислоты;
ж) 14,2 г Р2О5 и 0,4 моль КОН;
з) 5,6 г оксида кальция и 0,2 моль серной кислоты.
Итак, как образуются кислые и средние соли?
Обычно это взаимодействие основного оксида или основания с кислотой или кислотным оксидом.
Какая соль образуется — зависит от соотношения реагентов
LiOH + H2SO3 = LiHSO3 + H2O (образовалась кислая соль)
(1 моль щелочи : 1 моль кислоты)
2LiOH + H2SO4 = Li2SO4 + 2H2O (образовалась средняя соль)
(2 моль щелочи : 1 моль кислоты)
Вывод:
- если в избытке основание, то образуется средняя соль;
- при эквимолярном соотношении — кислая соль
Обратите внимание — сравнивать нужно именно количества веществ — моли!
В нашем задании:
а) соотношение сероводорода и гидроксида калия 1:1, значит, получится кислая соль KHS;
б) 0,1 моль SO2 и 0,1 моль NaOH (формулы: n=mMr и т=VV м). Соль — NaHSO3
в) 0,2 моль CO2 и 0,1 моль Ca(OH)2:
CO2 + Ca(OH)2 = CaCO3 + H2O
Т.к. реагируют двухвалентный кальций и кислотный остаток имеет заряд -2, то образуется карбонат кальция — средняя соль
г) 0,2 моль NH3 и 0.2 моль H2SO4. Соотношение 1:1, значит, получится соль — NH4HSO4 — гидросульфат аммония;
д) NaOH и H3PO4. Соотношение 1:1. Получится NaH2PO4 — дигидрофосфат натрия — кислая соль;
e) 0.2 моль NH3 и 0.1 моль (см. формулу массовой доли ω). Аммиак в избытке, значит, получится средняя соль — (NH4)2SO4
ж) 0.1 моль P2O5 и 0,4 моль КОН
3KOH + H3PO4 = K3PO4 + 3H2O
Гидроксид калия дан в значительном избытке, значит, получится фософат калия — средняя соль
з) 0.1 моль CaO и 0.2 моль H2SO4
CaO + 2H2SO4 = Ca(НSO4)2 + H2O
2. Определить количества растворенных веществ в растворе, полученном пропусканием через 200 г 4 %-ного раствора гидроксида натрия при н.у.:
а) 1,12 л углекислого газа;
б) 2,24 л сернистого газа;
в) 3,36 л сероводорода;
г) 4,48 л углекислого газа;
д) 20 г SO3.
n(NaOH)=m(раствора)*ω Mr = 200 г*0.04 40 гмоль = 0.2 моль
Выпишем все уравнения:
CO2 + 2NaOH = Na2CO3 + H2O
0,05 0.2 —> 0,05 моль
SO2 + 2NaOH = Na2SO3 + H2O
0.1 0.2 —> 0.1 моль
H2S + NaOH = NHS + H2O
0,15 0.2 моль —> 0,15 моль
CO2 + NaOH = NaHCO3
0.2 0.2 —> 0.2 моль
SO3 + NaOH = NaHSO4
0.25 0.2 —> 0.2 моль
Количества вещества продукта реакции находим традиционно по недостатку.
Обсуждение: “Кислые и средние соли”
(Правила комментирования)
Средние соли
Средними солями
называются соли, которые являются
продуктом полного замещения атомов
водорода соответствующей кислоты на
атомы металла или ион NH4+.
Например:
H2CO3
(NH4)2CO3;
H3PO4
Na3PO4
Название средней соли
образуется из названия аниона, за которым
следует название катиона. Для солей
бескислородных кислот наименование
соли составляется из латинского названия
неметалла с добавлением суффикса –ид,
например, NaCl – хлорид натрия. Если
неметалл проявляет переменную степень
окисления, то после его названия в
скобках римскими цифрами указывается
степень окисления металла: FeS – сульфид
железа (II), Fe2S3
– сульфид железа (III).
Для солей кислородсодержащих
кислот к латинскому корню названия
элемента добавляется окончание –ат
для высших степеней окисления, -ит
для более низких.
Например,
K2SiO3
– силикат калия, KNO2
– нитрит калия,
KNO3
– нитрат калия, K3PO4
– фосфат калия,
Fe2(SO4)3
– сульфат железа (III),
Na2SO3
– сульфит натрия.
Для солей некоторых
кислот используется приставка –гипо
для более низких степеней окисления и
–пер
для высоких степеней окисления. Например,
KClO
– гипохлорит калия, KClO2
– хлорит калия,
KClO3
– хлорат калия, KClO4
– перхлорат калия.
Способы получения
средних солей:
– взаимодействием
металлов с неметаллами, кислотами и
солями:
2Na
+ Cl2
= 2NaCl
Zn + 2HCl = ZnCl2
+ H2
Fe
+ CuSO4
= FeSO4
+ Cu
– взаимодействием
оксидов:
основных с кислотами
BaO + 2HNO3
= Ba(NO3)2
+ H2O
кислотных со щелочами
2NaOH + SiO2
= Na2SiO3
+ H2O
основных оксидов с
кислотными Na2O
+ CO2
= Na2CO3
– взаимодействием
кислот с основаниями и с амфотерными
гидроксидами:
KOH
+ HCl = KCl + H2O
Cr(OH)3
+ 3HNO3
= Cr(NO3)3
+ 3H2O
–
взаимодействием солей с кислотами, со
щелочами и солями:
Na2CO3
+ 2HCl = 2NaCl + CO2
+ H2O
FeCl3
+ 3KOH = 3KCl + Fe(OH)3
Na2SO4
+ BaCl2
= BaSO4
+ 2NaCl
Химические свойства
средних солей:
– взаимодействие с
металлами
Zn
+ Hg(NO3)2
= Zn(NO3)2
+ Hg
– взаимодействие с
кислотами
AgNO3
+ HCl
= AgCl
+ HNO3
– взаимодействие со
щелочами
CuSO4
+ 2NaOH
= Cu(OH)2
+ Na2SO4
– взаимодействие с
солями
CaCl2
+ Na2CO3
= CaCO3
+ 2NaCl
– разложение солей
NH4Cl
= NH3
+ HCl
CaCO3
= CaO
+ CO2
(NH4)2Cr2O7
= N2
+ Cr2O3
+ 4H2O
Кислые соли
Кислые соли – это
продукты неполного замещения атомов
водорода в молекулах многоосновных
кислот на атомы металла.
Например: H2CO3
NaHCO3
H3PO4
NaH2PO4
Na2HPO4
При наименовании кислой
соли к названию соответствующей средней
соли добавляется приставка гидро-,
которая указывает на наличие атомов
водорода в кислотном остатке.
Например, NaHS –
гидросульфид натрия, Na2HPO4
– гидрофосфат натрия, NaH2PO4
– дигидрофосфат натрия.
Кислые соли могут быть
получены:
– действием избытка
многоосновных кислот на основные оксиды,
щелочи и средние соли:
K2O
+ 2H2S
= 2KHS + H2O
NaOH + H2SO4
= NaHSO4
+ H2O
K2SO4
+ H2SO4
= 2KHSO4
– действием избытка
кислотных оксидов на щелочи
NaOH
+ CO2
= NaHCO3
Химические свойства
кислых солей:
– взаимодействие с
избытком щелочи
Ca(HCO3)2
+ Ca(OH)2
= 2CaCO3
+ 2H2O
– взаимодействие с
кислотами
Ca(HCO3)2
+ 2HCl
= CaCl2
+ 2H2O
+ 2CO2
– разложение
Ca(HCO3)2
= CaCO3
+ CO2
+ H2O
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #