Электролитическая диссоциация.
Степень диссоциации
Ключевые слова конспекта: электролитическая диссоциация, теория, электролиты, неэлектролиты, определения основаниям, кислотам и солям как электролитам, степень диссоциации, степень электролитической диссоциации.
ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
Электрический ток – это направленное движение заряженных частиц. В металлах такое направленное движение осуществляется за счёт относительно свободных электронов. Но проводить электрический ток могут не только металлы.
Вещества, растворы или расплавы которых проводят электрический ток, называются электролитами. Вещества, растворы или расплавы которых не проводят электрический ток, называются неэлектролитами.
Почему же электролиты проводят электрический ток?
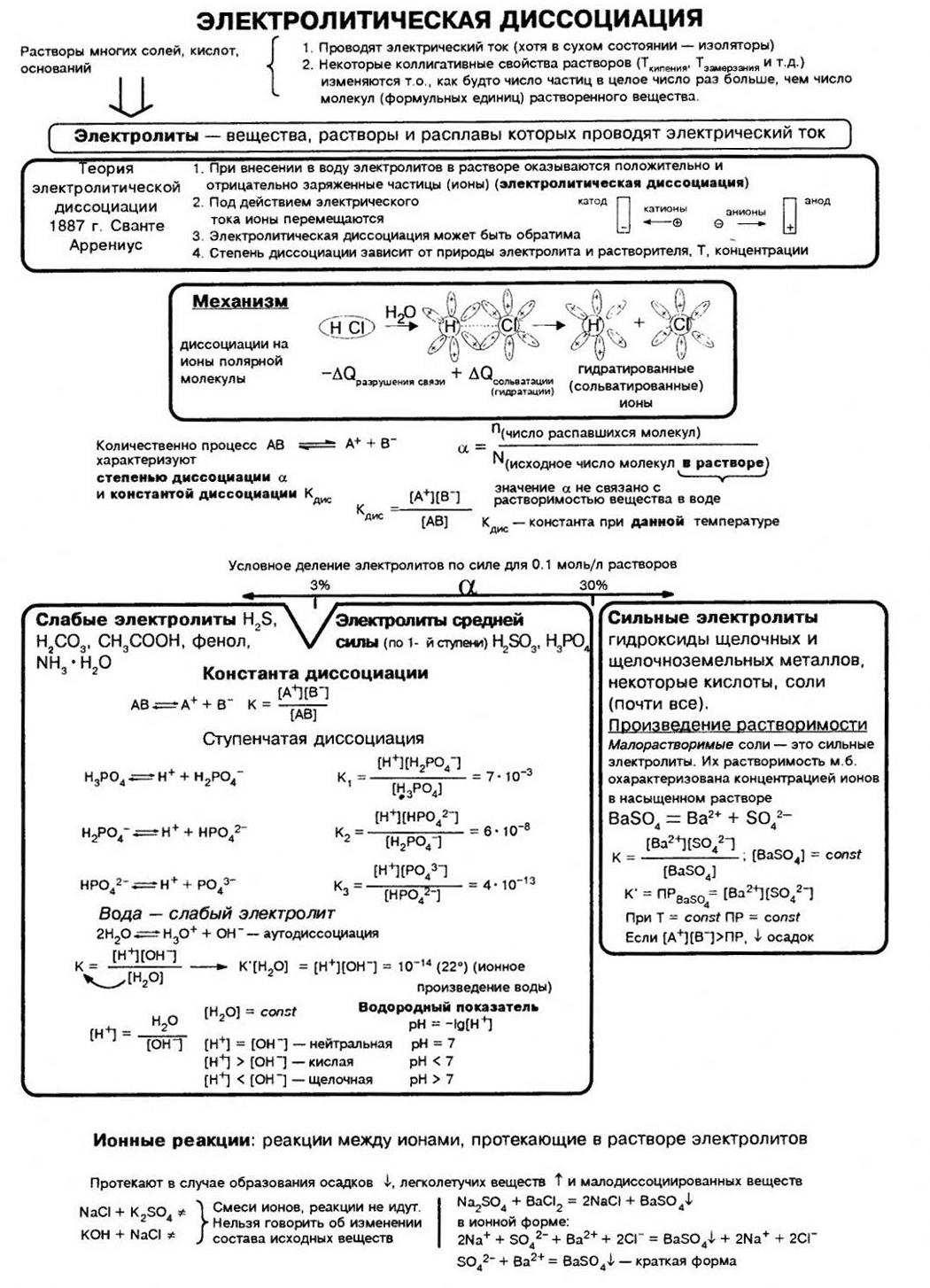
В 1887 г. шведский учёный Сванте Аррениус сформулировал положения теории электролитической диссоциации. Основная идея этой теории заключается в том, что электролиты под действием растворителя самопроизвольно распадаются на ионы. Электропроводность электролитов обусловлена именно наличием в растворе свободных ионов, которые и являются носителями зарядов.
В дальнейшем теория электролитической диссоциации совершенствовалась. Современная теория водных растворов электролитов, кроме теории С. Аррениуса, включает в себя представления о гидратации ионов (И. А. Каблуков, В. А. Кистяковский) и теорию сильных электролитов (П. Й. Дебай, Э. А. Хюккель, 1923 г.).
Основными положениями теории электролитической диссоциации являются следующие:
- Электролиты в растворах под действием растворителя самопроизвольно распадаются на ионы. Такой процесс называется электролитической диссоциацией. Диссоциация также может происходить при плавлении твёрдых электролитов (термическая диссоциация электролитов).
- Ионы отличаются от атомов по составу и по свойствам. В водных растворах ионы находятся в гидратированном состоянии. Ионы в гидратированном состоянии отличаются по свойствам от ионов в газообразном состоянии вещества.
- В растворах или расплавах электролитов ионы движутся хаотично, но при пропускании через раствор или расплав электролита электрического тока ионы движутся направленно: катионы – к катоду, анионы – к аноду.
ОПРЕДЕЛЕНИЯ ОСНОВАНИЙ, КИСЛОТ И СОЛЕЙ
В свете теории электролитической диссоциации можно дать определения основаниям, кислотам и солям как электролитам.
Основания – это электролиты, в результате диссоциации которых в водных растворах образуется только один вид анионов – гидроксид-анионы OH–:
КОН = К+ + OH–
Са(ОН)2 = Са2+ + 2 OH–
Кислоты – это электролиты, в результате диссоциации которых в водных растворах образуется только один вид катионов – катионы водорода Н+ (точнее – катионы гидроксония H3O+).
Катион гидроксония образуется при взаимодействии Н+ с молекулой H2O. В результате образуется ещё одна ковалентная связь кислорода с водородом по донорно-акцепторному механизму:
Н+ + H2O = H3O+
Примеры диссоциации кислот:
НCl = Н+ + Cl– или НCl + H2O = H3O+ + Cl–
НСlO4 = Н+ + СlO4– или НСlO4 + H2O = H3O+ + СlO4–
Многоосновные кислоты диссоциируют ступенчато:
Суммарное уравнение: H2SO4 + 2Н2О = 2H3O+ + SO4
Соли – это электролиты, диссоциирующие в водном растворе на катионы металлов и анионы кислотного остатка.
Средние соли диссоциируют с образованием только катионов металла и анионов кислотного остатка. Например:
Соли аммония вместо катиона металла содержат катион аммония. Например:
NH4Cl = NH4+ + Cl–
Основные соли диссоциируют с образованием катионов металла, анионов ОН– и анионов кислотного остатка:

Суммарное уравнение: AlOНCl2 = Al3+ + ОН– + 2Cl–
Кислые соли диссоциируют с образованием катионов металла, катионов водорода (гидроксония) и анионов кислотного остатка. Например:

Суммарное уравнение: Са(НСO3)2 + 2H2O = Са2+ + 2H3O+ + 2СО32–
Двойные соли – соли, в результате диссоциации которых образуются катионы нескольких металлов (или аммония и какого–либо металла) и анионы одного кислотного остатка. Например, сульфат калия–хрома (хромокалиевые квасцы):
KCr(SO4)2 = К+ + Cr3+ + 2SO42–
Смешанные соли – соли, в результате диссоциации которых образуются катионы какого-либо металла и анионы нескольких кислотных остатков. Например, хлорид-гипохлорит кальция (хлорная известь):
СаСlOCl = Са2+ + Cl– + СlO–
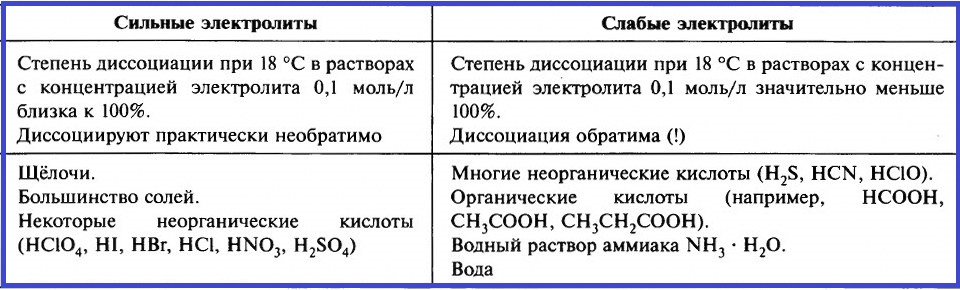
При растворении одних электролитов диссоциация происходит практически полностью. Такие электролиты называют сильными. При растворении других электролитов диссоциация происходит в незначительной мере, их называют слабыми.
СТЕПЕНЬ ДИССОЦИАЦИИ
Для количественной оценки силы электролита введено понятие степени электролитической диссоциации.
Степень электролитической диссоциации (α) – отношение количества вещества электролита, распавшегося на ионы (nрасп.), к количеству вещества электролита, поступившего в раствор (nобщ.):
Степень диссоциации также выражают в процентах, тогда 0% < α < 100%.
Степень электролитической диссоциации зависит от природы электролита, его концентрации в растворе и температуры. С разбавлением и с повышением температуры степень электролитической диссоциации возрастает.
Оценить силу различных электролитов можно, сравнивая степень их электролитической диссоциации при одинаковых условиях:
Всё об электрической диссоциации кратко в одной таблице.
Всё об электрической диссоциации кратко в одной таблице.
Конспект урока «Электролитическая диссоциация. Степень диссоциации».
Следующая тема: «Реакции ионного обмена. Ионное уравнение».
Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Степень диссоциации
Классификация электролитов
Диссоциация электролитов
Константа диссоциации
Примеры решения задач
Задачи для самостоятельного решения
Степень диссоциации
Вещества, которые в растворах или расплавах полностью или частично распадаются на ионы, называются электролитами.
Степень диссоциации α — это отношение числа молекул, распавшихся на ионы N′ к общему числу растворенных молекул N:
α = N′/N
Степень диссоциации выражают в процентах или в долях единицы. Если α =0, то диссоциация отсутствует и вещество не является электролитом. В случае если α =1, то электролит полностью распадается на ионы.
Классификация электролитов
Согласно современным представлениям теории растворов все электролиты делятся на два класса: ассоциированные (слабые) и неассоциированные (сильные). Неассоциированные электролиты в разбавленных растворах практически полностью диссоциированы на ионы. Для этого класса электролитов a близко к единице (к 100 %). Неассоциированными электролитами являются, например, HCl, NaOH, K2SO4 в разбавленных водных растворах.
Ассоциированные электролиты подразделяются на три типа:
-
-
- Слабые электролиты существуют в растворах как в виде ионов, так и в виде недиссоциированных молекул. Примерами ассоциированных электролитов этой группы являются, в частности, Н2S, Н2SO3, СН3СOОН в водных растворах.
- Ионные ассоциатыобразуются в растворах путем ассоциации простых ионов за счет электростатического взаимодействия. Ионные ассоциаты возникают в концентрированных растворах хорошо растворимых электролитов. В результате в растворе находятся как простые ионы, так и ионные ассоциаты. Например, в концентрированном водном растворе КCl образуются простые ионы К+, Cl— , а также возможно образование ионных пар (К+Cl— ), ионных тройников (K2Cl+, KCl2— ) и ионных квадруполей (K2Cl2, KCl32- , K3Cl2+).
- Комплексные соединения(как ионные, так и молекулярные), внутренняя сфера которых ступенчато диссоциирует на ионные и (или) молекулярные частицы.
Примеры комплексных ионов: [Cu(NH3)4]2+, [Fe(CN)6]3+, [Cr(H2O)3Cl2]+.
-
При таком подходе один и тот же электролит может относиться к различным типам в зависимости от концентрации раствора, вида растворителя и температуры. Подтверждением этому являются данные, приведенные в таблице.
Таблица. Характеристика растворов KI в различных растворителях
| Концентрация электролита, С, моль/л | Температура
t,оС |
Растворитель | Тип электролита |
| 0,01 | 25 | Н2О | Неассоциированный (сильный) |
| 5 | 25 | Н2О | Ионный ассоциат |
| 0,001 | 25 | С6Н6 | Ассоциированный (слабый) |
Приближенно, для качественных рассуждений можно пользоваться устаревшим делением электролитов на сильные и слабые. Выделение группы электролитов “средней силы” не имеет смысла. Эти электролиты являются ассоциированными. К слабым электролитам обычно относят электролиты, степень диссоцииации которых мала α<<1.
Таким образом, к сильным электролитам относятся разбавленные водные растворы почти всех хорошо растворимых в воде солей, многие разбавленные водные растворы минеральных кислот (НСl, HBr, НNО3, НСlO4 и др.), разбавленные водные растворы гидроксидов щелочных металлов. К слабым электролитам принадлежат все органические кислоты в водных растворах, некоторые водные растворы неорганических кислот, например, H2S, HCN, H2CO3, HNO2, HСlO и др. К слабым электролитам относится и вода.
Диссоциация электролитов
Уравнение реакции диссоциации сильного электролита можно представить следующим образом. Между правой и левой частями уравнения реакции диссоциации сильного электролита ставится стрелка или знак равенства:
HCl → H+ + Cl—
Na2SO3 = 2Na+ + SO32-
Допускается также ставить знак обратимости, однако в этом случае указывается направление, в котором смещается равновесие диссоциации, или указывается, что α≈1. Например:
NaOH → Na+ + OH—
Диссоциация кислых и основных солей в разбавленных водных растворах протекает следующим образом:
NaHSO3 → Na+ + HSO3—
Анион кислой соли будет диссоциировать в незначительной степени, поскольку является ассоциированным электролитом:
HSO3— → H+ + SO32-
Аналогичным образом происходит диссоциация основных солей:
Mg(OH)Cl → MgOH+ + Cl—
Катион основной соли подвергается дальнейшей диссоциации как слабый электролит:
MgOH+ → Mg2+ + OH—
Двойные соли в разбавленных водных растворах рассматриваются как неассоциированные электролиты:
KAl(SO4)2 → K+ + Al3+ + 2SO42-
Комплексные соединения в разбавленных водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы:
K3[Fe(CN)6] → 3K+ + [Fe(CN)6]3-
В свою очередь, комплексный ион в незначительной степени подвергается дальнейшей диссоциации:
[Fe(CN)6]3- → Fe3+ + 6CN—
Константа диссоциации
При растворении слабого электролита КА в растворе установится равновесие:
КА ↔ К+ + А—
которое количественно описывается величиной константы равновесия Кд, называемой константой диссоциации:
Kд = [К+] · [А—] /[КА] (2)
Константа диссоциации характеризует способность электролита диссоциировать на ионы. Чем больше константа диссоциации, тем больше ионов в растворе слабого электролита. Например, в растворе азотистой кислоты HNO2 ионов Н+ больше, чем в растворе синильной кислоты HCN, поскольку К(HNO2) = 4,6·10— 4, а К(HCN) = 4,9·10— 10.
Для слабых I-I электролитов (HCN, HNO2, CH3COOH) величина константы диссоциации Кд связана со степенью диссоциации α и концентрацией электролита c уравнением Оствальда:
Кд = (α2·с)/(1-α) (3)
Для практических расчетов при условии, что α<<1 используется приближенное уравнение:
Кд = α2·с (4)
Поскольку процесс диссоциации слабого электролита обратим, то к нему применим принцип Ле Шателье. В частности, добавление CH3COONa к водному раствору CH3COOH вызовет подавление собственной диссоциации уксусной кислоты и уменьшение концентрации протонов. Таким образом, добавление в раствор ассоциированного электролита веществ, содержащих одноименные ионы, уменьшает его степень диссоциации.
Следует отметить, что константа диссоциации слабого электролита связана с изменением энергии Гиббса в процессе диссоциации этого электролита соотношением:
ΔGT0 = — RTlnKд (5)
Уравнение (5) используется для расчета констант диссоциации слабых электролитов по термодинамическим данным.
Примеры решения задач
Задача 1. Определите концентрацию ионов калия и фосфат-ионов в 0,025 М растворе K3PO4.
Решение. K3PO4 – сильный электролит и в водном растворе диссоциирует полностью:
K3PO4 → 3К+ + РО43-
Следовательно, концентрации ионов К+ и РО43- равны соответственно 0,075М и 0,025М.
Задача 2. Определите степень диссоциации αд и концентрацию ионов ОН— (моль/л) в 0,03 М растворе NH3·H2О при 298 К, если при указанной температуре Кд(NH3·H2О) = 1,76× 10— 5.
Решение. Уравнение диссоциации электролита:
NH3·H2О → NH4+ + OH—
Концентрации ионов: [NH4+] = αС ; [OH—] = αС , где С – исходная концентрация NH3·H2О моль/л. Следовательно:
Kд = αС · αС /(1 — αС)
Поскольку α << 1, то:
Кд ≈ α 2С
Константа диссоциации зависит от температуры и от природы растворителя, но не зависит от концентрации растворов NH3·H2О. Закон разбавления Оствальда выражает зависимость α слабого электролита от концентрации.
α = √(Кд / С) = √(1,76× 10— 5 / 0,03) = 0,024 или 2,4 %
[OH—] = αС, откуда [OH— ] = 2,4·10— 2·0,03 = 7,2·10-4 моль/л.
Задача 3. Определите константу диссоциации уксусной кислоты, если степень диссоциации CH3CОOH в 0,002 М растворе равна 9,4 %.
Решение. Уравнение диссоциации кислоты:
CH3CОOH → СН3СОО— + Н+.
α = [Н+] / Сисх(CH3CОOH)
откуда [Н+] = 9,4·10—2·0,002 = 1,88·10-4 М.
Так как [CH3CОO—] = [Н+] и [CH3CОOH] ≈ Сисх(CH3CОOH), то:
Kд = [Н+]2 / Сисх(CH3CОOH)
Константу диссоциации можно также найти по формуле: Кд ≈ α 2С.
Задача 4. Константа диссоциации HNO2 при 298К равна 4,6× 10— 4. Найдите концентрацию азотистой кислоты, при которой степень диссоциации HNO2 равна 5 %.
Решение.
Кд =α 2С , откуда получаем Сисх(HNO2) = 4,6·10— 4/(5·10— 2)2 = 0,184 М.
Задача 5. На основе справочных данных рассчитайте константу диссоциации муравьиной кислоты при 298 К.
Решение. Уравнение диссоциации муравьиной кислоты
НСООН →Н+ + СООН—
В “Кратком справочнике физико–химических величин” под редакцией А.А. Равделя и А.М. Пономаревой приведены значения энергий Гиббса образований ионов в растворе, а также гипотетически недиссоциированных молекул. Значения энергий Гиббса для муравьиной кислоты и ионов Н+ и СООН— в водном растворе приведены ниже:
| Вещество, ион | НСООН | Н+ | СООН— |
| ΔGT0, кДж/моль | — 373,0 | 0 | — 351,5 |
Изменение энергии Гиббса процесса диссоциации равно:
ΔGT0 = — 351,5- (- 373,0) = 21,5 кДж/моль.
Для расчета константы диссоциации используем уравнение (5). Из этого уравнения получаем:
lnKд = — Δ GT0/RT= — 21500/(8,31 298) = — 8,68
Откуда находим: Kд = 1,7× 10— 4.
Задачи для самостоятельного решения
1. К сильным электролитам в разбавленных водных растворах относятся:
- СН3СOOH
- Na3PO4
- NaCN
- NH3
- C2H5OH
- HNO2
- HNO3
13.2. К слабым электролитам в водных растворах относятся:
- KAl(SO4)2
- NaNO3
- HCN
- NH4Cl
- C2H5OH
- H2SO3
- H2SO4
3. Определите концентрацию ионов NH4+ в 0,03 М растворе (NH4)2Fe(SO4)2;
4. Определите концентрацию ионов водорода в 6 мас.% растворе H2SO4, плотность которого составляет 1,038 г/мл. Принять степень диссоциации кислоты по первой и второй ступеням равной 100 %.
5. Определите концентрацию гидроксид-ионов в 0,15 М растворе Ba(OH)2.
6. Степень диссоциации муравьиной кислоты в 0,1 М растворе равна 4 %. Рассчитайте Концентрацию ионов водорода в этом растворе и константу диссоциации НСООН.
7. Степень диссоциации муравьиной кислоты в водном растворе увеличится при:
а) уменьшении концентрации HCOOH;
б) увеличении концентрации HCOOH;
в) добавлении в раствор муравьиной кислоты HCOONa;
г) добавлении в раствор муравьиной кислоты НCl.
8. Константа диссоциации хлорноватистой кислоты равна 5× 10— 8. Определите концентрацию HClO, при которой степень диссоциации HClO равна 0,5 %, и концентрацию ионов Н+ в этом растворе.
9. Вычислите объем воды, который необходимо добавить к 50 мл 0,02 М раствора NH3·H2О, чтобы степень диссоциации NH3·H2О увеличилась в 10 раз, если Кд(NH4OH) = 1,76·10— 5.
10. Определите степень диссоциации азотистой кислоты в 0,25 М растворе при 298 К, если при указанной температуре Кд(HNO2) = 4,6× 10— 4.
В растворах электролитов наряду с ионами присутствуют и молекулы. Поэтому растворы электролитов характеризуются степенью диссоциации, которую обозначают греческой буквой
α
(«альфа»).
Степень диссоциации — это отношение количества вещества электролита, распавшегося на ионы, к общему количеству растворённого вещества:
Степень диссоциации электролита определяют опытным путём и выражают в долях единицы или в процентах.
Электролиты имеют различную степень диссоциации, т. е. степень диссоциации зависит от природы электролита.
Она также зависит и от концентрации: с разбавлением раствора степень диссоциации увеличивается.
По степени электролитической диссоциации электролиты разделяют на сильные и слабые.
Сильные электролиты при растворении в воде практически полностью диссоциируют на ионы. У таких электролитов значение степени диссоциации стремится к единице в разбавленных растворах.
Пример:
к сильным электролитам относят:
1) практически все соли;
2) сильные кислоты, например: серную, соляную, азотную;
3) все щёлочи.
Слабые электролиты при растворении в воде почти не диссоциируют на ионы.
У таких электролитов значение степени диссоциации стремится к нулю.
Пример:
к слабым электролитам относят:
1) слабые кислоты, например: сероводородную, угольную, азотистую, сернистую;
2) водный раствор аммиака.
Урок №
9 дата
класс 9 предмет химия
Тема
урока: Степень диссоциации. Сильные и слабые электролиты
Цели
урока: сформировать знания о
степени диссоциации и силе электролитов.
Задачи:
Обучающие: углубить понятия об электролитах и ЭДС;
показать влияние разбавления, температуры на степень диссоциации; определить
понятие «степень электролитической диссоциации», сильные и слабые электролиты
Развивающие: развивать
умение записывать реакции диссоциации; формировать понятие
диссоциированных и недиссоциированных молекул; научиться определять силу
электролита в зависимости от степени диссоциации; развивать умение учащихся на
основе теоретических знаний сравнивать, анализировать, обобщать, логически
рассуждать, делать выводы, развивать устную речь.
Воспитательные: воспитывать
интерес к знаниям, взаимопомощь, чувство товарищества,
коммуникабельность, критичность по отношению к себе и другим, развивать
самооценку.
Оборудование
: Таблица растворимости, учебник, тетради, тесты, карточки, прибор для
электролиза
Тип
урока: комбинированный
Ход урока:
I. Оргмомент
2.
Актуализация опорных знаний
–
проверка домашнего задания
Химический
диктант
Закончить
предложение:
1).
Электролитическая диссоциация – это….
2).
Электролиты – это….
3).
Неэлектролиты – это…
4).
Что показывают уравнения: а) NaCl – Na++Cl– и
б) Na++Cl– – NaCl ? Как осуществить
эти процессы в домашних условиях?
Карточки:
1).Составить
уравнения диссоциации веществ: NaNO3, HCl, KOH
2).
При диссоциации каких веществ в воде образуются ионы: Na+, Cl–, H+, Br–, Li+,OH–
3).
Составьте уравнения диссоциации веществ: серной кислоты, карбоната натрия,
гидроксида кальция
3.Мотивация
До сих
пор мы рассматривали электролиты, которые в водных растворах диссоциируют
полностью. Возникает вопрос: все ли электролиты в одинаковой степени
распадаются на ионы? Какова цель нашего урока?
4.
Целеполагание
5.
Изучение нового материала
1)Если
опустить в концентрированный раствор хлорида натрия электроды прибора для
определения электрической проводимости, то лампочка в нем засветится ярко, а в
концентрированном растворе уксусной кислоты – неярко. При добавлении воды к
раствору уксусной кислоты лампочка начинает светиться все ярче. Разбавление же
раствора хлорида натрия почти не влияет на яркость свечения лампочки. Так как
электрическая проводимость зависит от числа ионов в растворе, то,
следовательно, хлорид натрия даже в концентрированных растворах диссоциирует на
ионы полностью, молекулы же уксусной кислоты в концентрированных растворах
почти не диссоциируют. При разбавлении раствора уксусной кислоты число
диссоциированных молекул увеличивается.
2).
Дайте определение кислотам с точки зрения ТЭД. Приведите примеры.
-Дайте
определение щелочам с точки зрения ТЭД. Приведите примеры.
-Дайте
определение солям с точки зрения ТЭД. Приведите примеры.
Выводы:
– Некоторые
электролиты независимо от концентрации в водных растворах диссоциируют на ионы
полностью. Это вещества с ионной кристаллической решеткой.
– Существуют
электролиты, которые диссоциируют частично. Разбавление таких растворов
приводит к смещению равновесия вправо, а увеличение концентрации – влево.
ФИЗМИНУТКА!
3)Степень
электролитической диссоциации.
Отношение
числа диссоциированных молекул к общему числу молекул, находящихся в растворе,
называют степенью диссоциации.
Степень
диссоциации (α – греческая
буква альфа) – это отношение числа молекул, распавшихся на ионы
(n), к общему числу растворенных молекул (N):

Степень
диссоциации электролита определяется опытным путем и выражается в долях единицы
или в процентах. Если α = 0, то диссоциация отсутствует, а если α = 1 или 100%,
то электролит полностью распадается на ионы. Если же α = 20%, то это означает,
что из 100 молекул данного электролита 20 распалось на ионы.
4)Степень
диссоциации зависит от природы электролита и растворителя, от концентрации
электролита, температуры.
1. Зависимость
степени диссоциации от добавления одноименных ионов: при
добавлении одноименных ионов в раствор, степень диссоциации уменьшается.
2. Зависимость степени диссоциации от концентрации электролита: с
уменьшением концентрации электролита, т.е. при разбавлении его водой, степень
диссоциации всегда увеличивается.
3. Зависимость степени диссоциации от
температуры: степень диссоциации
возрастает при повышении температуры.
Сильные и слабые электролиты
В
зависимости от степени диссоциации различают электролиты сильные и слабые.
Электролиты со степенью диссоциации больше 30% обычно называют сильными, со
степенью диссоциации от 3 до 30% — средними, менее 3% — слабыми электролитами.
Классификация
электролитов в зависимости от степени электролитической диссоциации (памятка)
2.
Сильные кислоты (НСl, HBr, HI, НNО3, НClO4, Н2SO4(разб.));
3.
Сильные основания – щёлочи.
H3PO4
H2SO3
1.
Почти все органические кислоты (CH3COOH, C2H5COOH
и др.);
2.
Некоторые неорганические кислоты (H2CO3, H2S и
др.);
3.
Почти все малорастворимые в воде соли, основания и гидроксид аммония (Ca3(PO4)2;
Cu(OH)2; Al(OH)3; NH4OH);
6.
Закрепление
1.Чему
равна степень диссоциации электролита, если при растворении его в воде из
каждых 100 молекул на ионы распалось: а) 5 молекул, б) 80 молекул?
2.В
перечне веществ подчеркните слабые электролиты.
H2SO4; H2S; CaCl2;
Ca(OH)2; Fe(OH)2; Al2(SO4)3; Mg3(PO4)2;
H2SO3; КОН, KNO3; HCl; BaSO4;
Zn(OH)2; CuS; Na2CO3.
3. При
полной диссоциации 1 моль нитрата меди (II) в растворе образуется:
А) 3
моль катионов меди и 1 моль нитрат-ионов;
Б) 2
моль катионов меди и 3 моль нитрат-ионов;
В) 1
моль катионов меди и 2 моль нитрат-ионов;
Г) 1
моль катионов меди и 3 моль нитрат-ионов.
7.
Рефлексия
8. Домашнее задание: п. упр. 1, 4 стр.
письменно, учить правила, подготовиться к тестам
9.
Подведение итога урока
Химический
диктант
Закончить
предложение:
1).
Электролитическая диссоциация – это….
2).
Электролиты – это….
3).
Неэлектролиты – это…
4).
Что показывают уравнения: а) NaCl – Na++Cl– и
б) Na++Cl– – NaCl
Как
осуществить эти процессы в домашних условиях?
Химический
диктант
Закончить
предложение:
1).
Электролитическая диссоциация – это….
2).
Электролиты – это….
3).
Неэлектролиты – это…
4).
Что показывают уравнения: а) NaCl – Na++Cl– и
б) Na++Cl– – NaCl
Как
осуществить эти процессы в домашних условиях?
Химический
диктант
Закончить
предложение:
1).
Электролитическая диссоциация – это….
2).
Электролиты – это….
3).
Неэлектролиты – это…
4).
Что показывают уравнения: а) NaCl – Na++Cl– и
б) Na++Cl– – NaCl
Как
осуществить эти процессы в домашних условиях?
Химический
диктант
Закончить
предложение:
1).
Электролитическая диссоциация – это….
2).
Электролиты – это….
3).
Неэлектролиты – это…
4).
Что показывают уравнения: а) NaCl – Na++Cl– и
б) Na++Cl– – NaCl
Как
осуществить эти процессы в домашних условиях?
Химический
диктант
Закончить
предложение:
1).
Электролитическая диссоциация – это….
2).
Электролиты – это….
3).
Неэлектролиты – это…
4).
Что показывают уравнения: а) NaCl – Na++Cl– и
б) Na++Cl– – NaCl
Как
осуществить эти процессы в домашних условиях?
Химический
диктант
Закончить
предложение:
1).
Электролитическая диссоциация – это….
2).
Электролиты – это….
3).
Неэлектролиты – это…
4).
Что показывают уравнения: а) NaCl – Na++Cl– и
б) Na++Cl– – NaCl
Как
осуществить эти процессы в домашних условиях?
Карточка№
2
1).Составьте
уравнения диссоциации веществ: NaNO3, HCl, KOH
2).
При диссоциации каких веществ в воде образуются ионы: Na+, Cl–, H+, Br–, Li+,OH–
3).
Составьте уравнения диссоциации веществ: серной кислоты, карбоната натрия,
гидроксида кальция
Карточка№
2
1).Составьте
уравнения диссоциации веществ: NaNO3, HCl, KOH
2).
При диссоциации каких веществ в воде образуются ионы: Na+, Cl–, H+, Br–, Li+,OH–
3).
Составьте уравнения диссоциации веществ: серной кислоты, карбоната натрия,
гидроксида кальция
Карточка№
2
1).Составьте
уравнения диссоциации веществ: NaNO3, HCl, KOH
2).
При диссоциации каких веществ в воде образуются ионы: Na+, Cl–, H+, Br–, Li+,OH–
3).
Составьте уравнения диссоциации веществ: серной кислоты, карбоната натрия,
гидроксида кальция
Карточка№
2
1).Составьте
уравнения диссоциации веществ: NaNO3, HCl, KOH
2).
При диссоциации каких веществ в воде образуются ионы: Na+, Cl–, H+, Br–, Li+,OH–
3).
Составьте уравнения диссоциации веществ: серной кислоты, карбоната натрия,
гидроксида кальция
Карточка№
2
1).Составьте
уравнения диссоциации веществ: NaNO3, HCl, KOH
2).
При диссоциации каких веществ в воде образуются ионы: Na+, Cl–, H+, Br–, Li+,OH–
3).
Составьте уравнения диссоциации веществ: серной кислоты, карбоната натрия,
гидроксида кальция
Карточка№
2
1).Составьте
уравнения диссоциации веществ: NaNO3, HCl, KOH
2).
При диссоциации каких веществ в воде образуются ионы: Na+, Cl–, H+, Br–, Li+,OH–
3).
Составьте уравнения диссоциации веществ: серной кислоты, карбоната натрия,
гидроксида кальция
Учебно-методическое пособие
9 класс
Продолжение. См. 21, 22/2003
1. Электролитическая диссоциация
1.5. Вычисления по теме
«Электролитическая диссоциация»
Степень электролитической диссоциации ![]() :
:
![]() = N1/N,
= N1/N,
где N1 – число диссоциированных
молекул, N – общее число молекул в растворе.
Значения a выражают в долях единицы или в
процентах.
Количество вещества n:
![]() = m/M.
= m/M.
масса m:
m = ![]() •M.
•M.
Объем V:
V = VM•![]() .
.
Единицы измерения: ![]() – моль, m – г (кг), V – л (м3).
– моль, m – г (кг), V – л (м3).
Число частиц N:
N = NA•![]()
Постоянные величины:
молярный объем VM = 22,4 л/моль – такой
объем занимает 1 моль любого газа при нормальных
условиях (н. у.) (t = 0 °С, р = 105 Па);число Авогадро NA = 6,02•1023 –
столько частиц (атомов, молекул, ионов) содержит 1
моль любого вещества.
Способы выражения концентрации растворов
Массовая доля растворенного вещества ![]() (p. в.):
(p. в.):
![]() (p. в.)
(p. в.)
= m (p. в.)/m (p-ра),
выражается в долях единицы или в процентах.
Молярная концентрация СМ:
СМ = ![]() /V,
/V,
где ![]() –
–
количество вещества (моль), V – объем (л).
Раствор с молярной концентрацией, равной x
моль/л, называется x-молярным (xМ,
например 1М KOH, 0,4М HCl).
Кристаллогидраты – кристаллические вещества,
содержащие молекулы воды:
СuSO4•5Н2О – пятиводный
кристаллогидрат сульфата меди(II), медный купорос;
Nа2SO4•10Н2О – десятиводный
кристаллогидрат сульфата натрия, глауберова
соль.
Вычисление молекулярной массы
кристаллогидрата:
Mr(CuSO4•5H2O) = Mr(CuSO4)
+ 5Mr(H2O) = 160 + 90 = 250.
Вычисления по теме «Степень диссоциации».
(Алгоритм 9.)
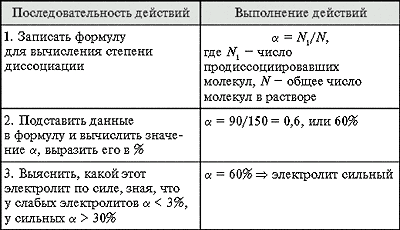
Задача 1. Определите, чему равна
степень диссоциации электролита, если при 20 °С
из каждых 150 молекул распалось на ионы 90. Сильный
или слабый это электролит?
Задача 2. Определите, сколько молекул
электролита продиссоциировало в растворе, если
степень диссоциации электролита равна 0,1, а в
раствор было введено 3,01•1020 молекул.

Задания для
самоконтроля
1. Рассчитайте степень диссоциации борной
кислоты Н3ВО3, если известно, что в
растворе из каждых 500 молекул распались на ионы
только 40. Сильный, средний или слабый по силе этот
электролит?Ответ. 8%, слабый.
2. Рассчитайте, сколько молекул электролита
продиссоциирует из каждых 120 молекул в растворе,
если степень диссоциации составляет 95%.Ответ. 114.
3. Укажите, сколько молекул сернистой кислоты
находятся в недиссоциированном состоянии в 4%-м
растворе сернистой кислоты массой 100 г, если
степень ее диссоциации составляет 0,02.Ответ. 2,9•1022.
Массовая доля растворенного вещества.
(Алгоритм 10.)
Задача 1. Как приготовить 300 г раствора
с массовой долей соли 15%?
Приготовление растворов
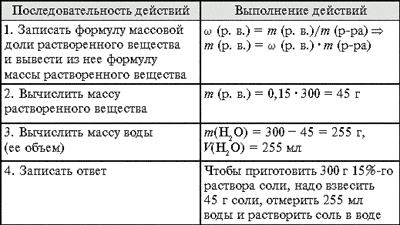
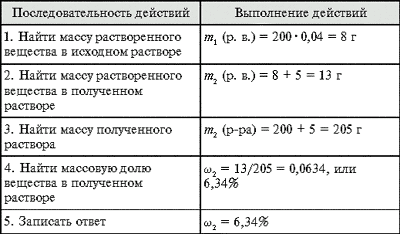
Задача 2. К 120 г 15%-го раствора соли
добавили 80 г воды. Вычислите массовую долю соли
во вновь полученном растворе.
Разбавление растворов

Задача 3. К 200 г 4%-го раствора сахара
добавили 5 г сахара. Рассчитайте массовую долю
вещества в полученном растворе.
Концентрирование растворов
Задача 4. К 120 г 20%-го раствора серной
кислоты добавили 40 г 50%-го раствора серной
кислоты. Какова массовая доля вещества во вновь
полученном растворе?
Смешивание двух растворов

Задачи для
самоконтроля
1. Навеску технической поваренной соли,
содержащей нерастворимые примеси, массой 25 г
растворили в 60 г воды и получили раствор с
массовой долей хлорида натрия 25%. Какова массовая
доля нерастворимых примесей в образце соли?Ответ. 20%.
2. К 80 г раствора с неизвестной массовой долей
вещества прибавили 40 г воды. Вычислить массовую
долю соли в исходном растворе, если после
разбавления она стала равна 18%.Ответ. 27%.
3. Определите массу соли, которую надо добавить
к 80 г 10%-го раствора, чтобы получить 25%-й раствор
этой соли.Ответ. 16 г.
4. Определите массу воды, в которой надо
растворить 2 г натриевой селитры, чтобы получить
10%-й раствор для полива комнатных растений.Ответ. 18 г.
5. Сколько граммов 8%-го и 75%-го растворов
некоторого вещества нужно взять для получения 400
г 42%-го раствора?
Ответ. 197 г 8%-го раствора
и 203 г 75%-го раствора.
Молярная концентрация. (Алгоритм 11.)
Задача. Вычислите молярную
концентрацию 20%-го раствора хлорида калия (![]() = 1,13 г/мл).
= 1,13 г/мл).

Задания для
самоконтроля
1. Вычислите массовую долю нитрата натрия в 1M
растворе этого вещества ((р-ра) = 1,05 г/мл).
Ответ. 8,1%.
2. Смешали 325 мл 8%-го раствора серной кислоты (
= 1,05 г/мл) и 375 мл 1,5M
раствора этого же вещества (= 1,1 г/мл). Определите массовую
долю вещества в полученном растворе и его
молярную концентрацию (изменением объема
раствора после смешивания пренебречь).
Ответ.
= 10,9%,
C = 1,21 моль/л.
Вычисления по уравнениям реакций,
если одно из веществ дано в избытке. (Алгоритм 12.)
Задача. Железо массой 5,6 г сожгли в 5,6 г
хлора (н. у.). Вычислите массу образовавшегося
хлорида железа(III).
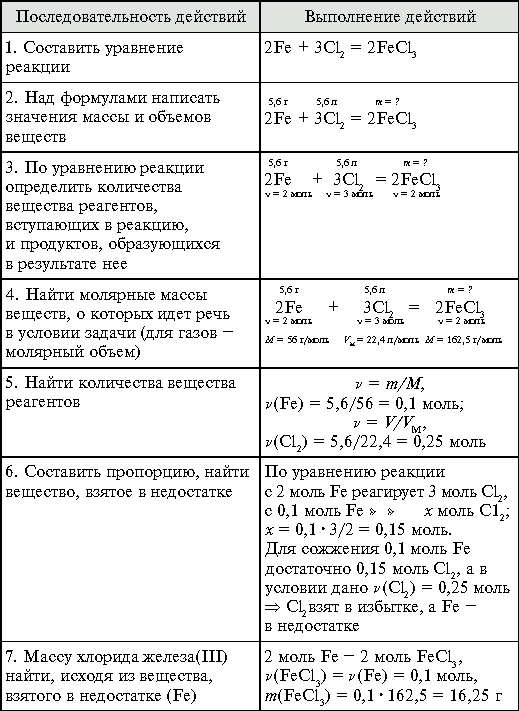
Задания для
самоконтроля
1. Рассчитайте массу осадка, который образуется
при сливании 15 г 5%-го раствора хлорида бария и 10 г
8%-го раствора сульфата натрия.
Ответ. 0,84 г.
2. Какой объем газа выделится (н. у.) при сливании
150 г 30%-й соляной кислоты с раствором карбоната
натрия, содержащим 0,5 моль этой соли?
Ответ. 11,2 л.
3. К раствору, содержащему 1 моль хлорида меди(II),
добавили раствор, в котором растворен гидроксид
натрия количеством вещества 3 моль. Какова
реакция полученного раствора на индикатор?
Какова масса полученной соли?
Ответ. Щелочная, 117 г.
4. Какой объем оксида углерода(IV) выделится при
взаимодействии 0,5 моль карбоната натрия с
раствором соляной кислоты объемом 400 мл и
концентрацией 2,5 моль/л?
Ответ. 11,2 л.
5. Какая масса соли образуется при
взаимодействии 400 мл раствора серной кислоты с
концентрацией 0,5 моль/л и 10,4%-го раствора хлорида
бария объемом 200 мл и
плотностью 1,22 г/см3?
Ответ. 28,4 г.
Кристаллогидраты. (Алгоритм 13.)
Задача 1. При полном обезвоживании 48,3 г
кристаллогидрата получено 21,3 г сульфата натрия.
Определите формулу кристаллогидрата.
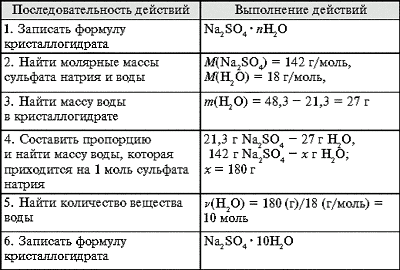
Задача 2. Сколько воды и английской
соли (семиводный кристаллогидрат сульфата
магния) необходимо взять для приготовления 440 г
раствора сульфата магния с массовой долей 8%?

Задания для
самоконтроля
1. Кристаллогидрат хлорида бария содержит 14,8%
кристаллизационной воды. Определите формулу
кристаллогидрата.Ответ. BaCl2•2H2O.
2. Определите формулу кристаллогидрата, если
известно, что при прокаливании кристаллогидрата
карбоната натрия массой 14,3 г его масса
уменьшилась на 9 г.Ответ. Na2СО3•10H2O.
3. Какая масса кристаллической соды Nа2СО3•10Н2О
потребуется для получения 10%-го раствора
безводного карбоната натрия массой 200 г?Ответ. 54 г.
4. Какова массовая доля сульфата цинка в
растворе, полученном при растворениии 114,8 г ZnSO4•7Н2О
в воде объемом 85,2 мл?Ответ. 32,2%.
2. Закономерности течения
химических реакций
Знать: энергетику химических
превращений; закон Гесса; зависимость скорости
химической реакции от температуры, концентрации,
площади соприкосновения реагирующих веществ,
природы реагирующих веществ, участия
катализаторов и ингибиторов; правило Вант-Гоффа;
принцип Ле Шателье; условия смещения химического
равновесия.
Уметь: на конкретных примерам
разъяснять зависимость скорости химических
реакций от различных факторов и смещение
химического равновесия в зависимости от условий
течения реакций; использовать понятия скорости
химической реакции, теплот образования и
сгорания при решении расчетных задач.
Основные понятия: тепловой эффект,
термохимическое уравнение, экзотермические и
эндотермические реакции, энтальпия, энергия
активации, теплоты образования и сгорания
веществ, энтропия, химическое равновесие,
реакции обратимые и необратимые, реакции прямые
и обратные, равновесные концентрации, константа
химического равновесия, скорость химической
реакции, катализатор, ингибитор, каталитическая
реакция.
Контрольные вопросы
1. От каких факторов зависит скорость реакции?
2. Что называют скоростью химической реакции?
3. По каким формулам можно рассчитать величину
скорости реакции?
4. Как формулируют закон действия масс?
5. Как читается правило Вант-Гоффа?
6. Почему при повышении температуры скорость
реакции возрастает?
7. Какие вещества называют катализаторами, а
какие ингибиторами?
8. Что называют кинетическим уравнением реакции?
9. Что называют энергией активации?
10. Какие реакции называют обратимыми и какие
необратимыми?
11. Что называют химическим равновесием?
12. Что называют константой равновесия?
13. Что называют смещением химического
равновесия?
14. Как читается принцип Ле Шателье?
15. Почему любая химическая реакция
сопровождается тепловым эффектом?
16. Какие реакции называют экзотермическими, а
какие эндотермическими?
17. Сформулируйте закон Гесса и следствия из него.
2.1. Скорость химической реакции
Скорость химической реакции ![]() – физическая величина.
– физическая величина.
![]()
где С1 – начальная концентрация
одного из реагирующих веществ в момент времени ![]() 1, С2 –
1, С2 –
концентрация в момент времени ![]() 2,
2, ![]() 1 – начальное время,
1 – начальное время, ![]() 2 – время окончания
2 – время окончания
реакции.
Поскольку значение скорости реакции не может
быть отрицательным, то в случае получения
отрицательного значения берем его
математический модуль.
Единицы измерения величин: С – моль/л, ![]() – с (секунда),
– с (секунда), ![]() – моль/(л•с).
– моль/(л•с).
Скорость химической реакции зависит:
а) от природы реагирующих веществ;
б) от концентрации реагентов;
в) от температуры;
г) от поверхности соприкосновения реагирующих
веществ (для гетерогенных систем);
д) от участия катализатора или ингибитора.
Для реакции А + В = С
![]() = k[A]•[B],
= k[A]•[B],
где k – константа скорости, [A] –
концентрация вещества А, [В] – концентрация
вещества В.
Если в реакции в отдельном столкновении
участвуют а молекул А и b молекул В,
т. е. аА + bВ = С, то выражение ![]() = k•[A]а•[B]b
= k•[A]а•[B]b
называют законом действующих масс. (Отметим, что
показатели степени а и b часто не равны
стехиометрическим коэффициентам вследствие
сложного механизма реакции.)
При повышении температуры на каждые 10°
скорость реакции возрастает в 2–4 раза (правило
Вант-Гоффа):
![]()
где ![]() 2 –
2 –
скорость реакции при температуре ![]() 2,
2, ![]() 1 – скорость реакции при
1 – скорость реакции при
температуре ![]() 1,
1,
![]() – температурный
– температурный
коэффициент, он принимает значения от 2 до 4.
Скорость реакции обратно пропорциональна
времени:
![]()
