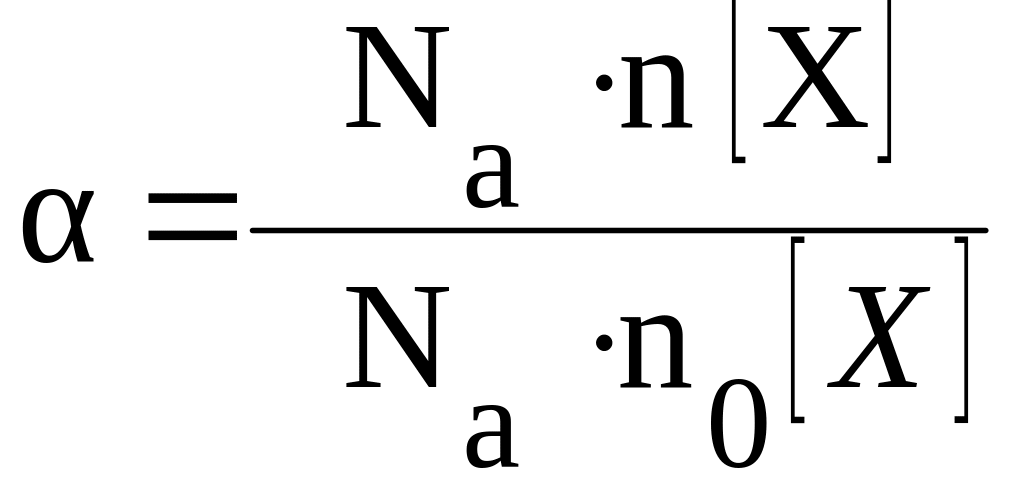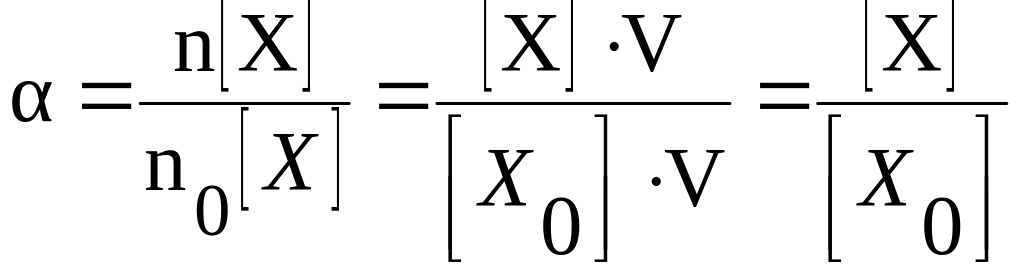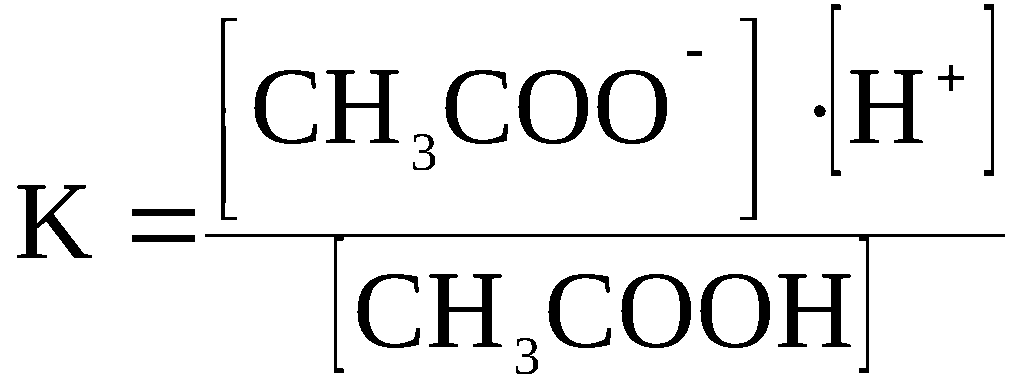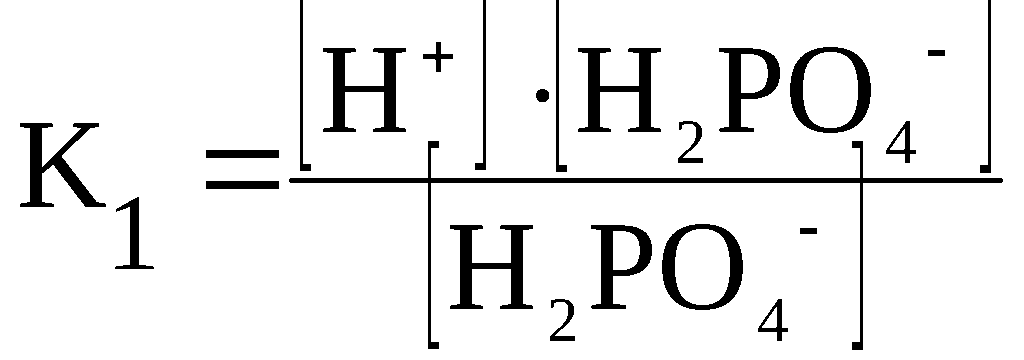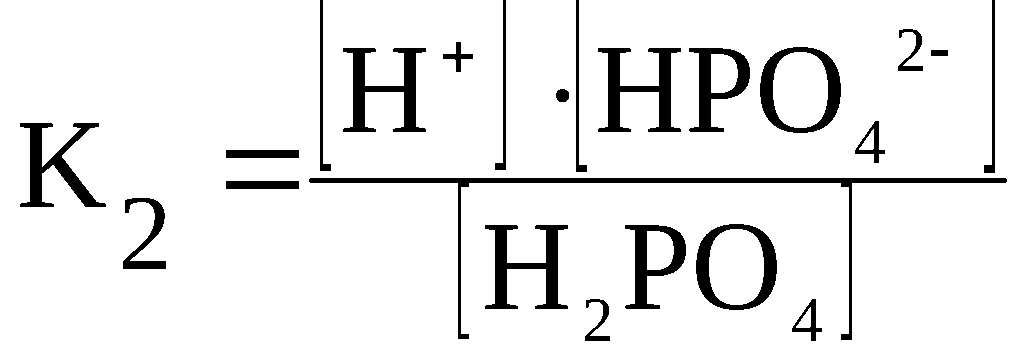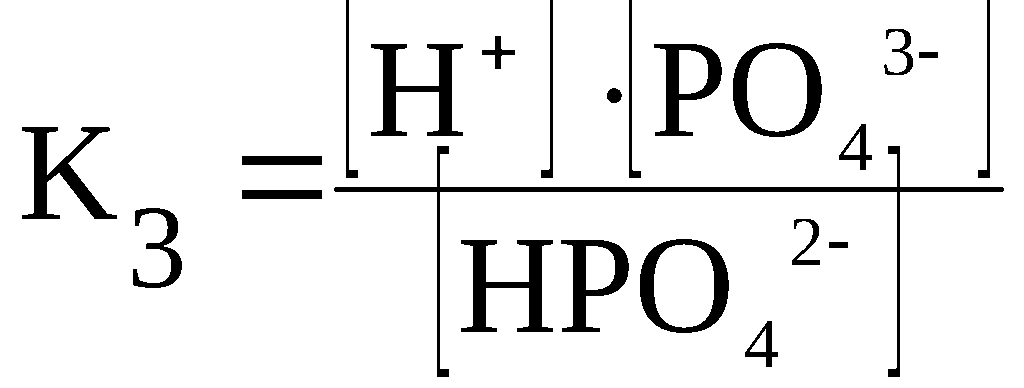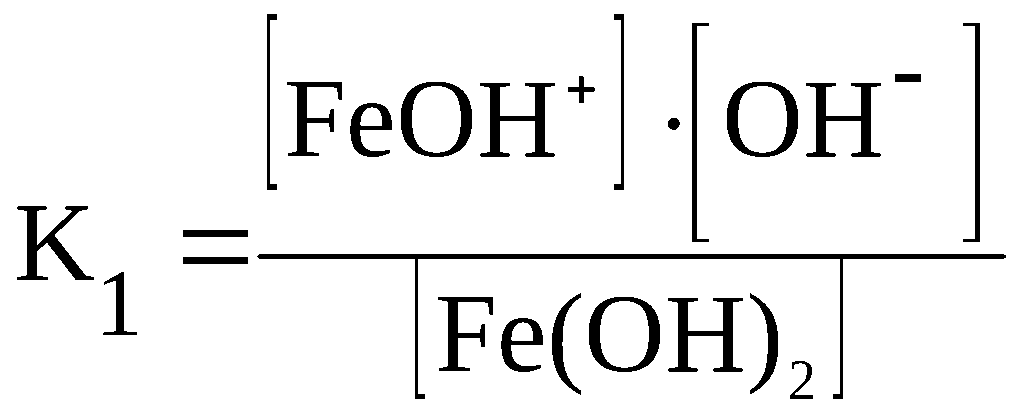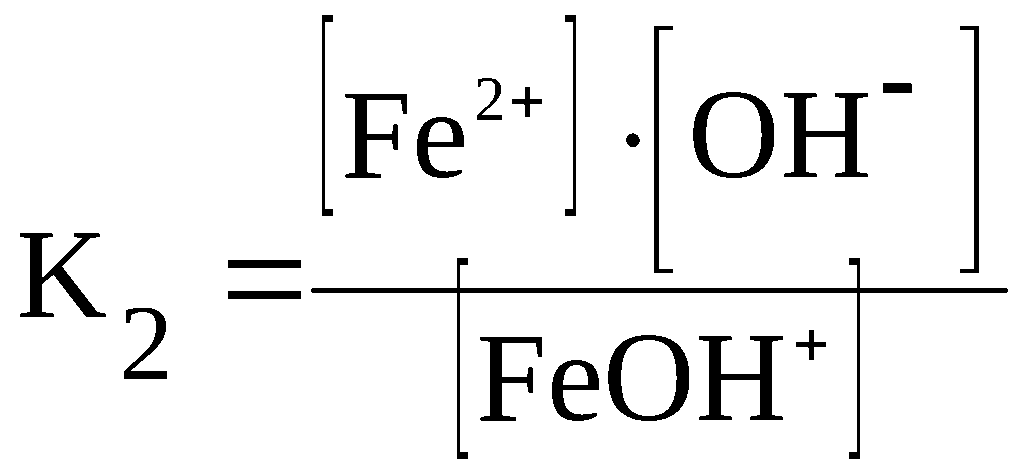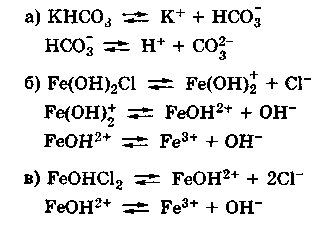Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
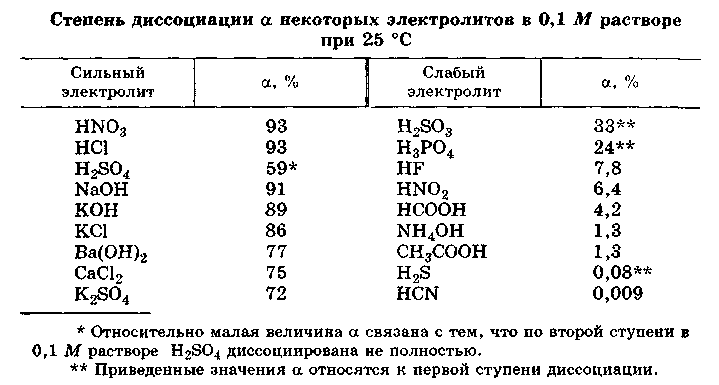
Степень диссоциации
Классификация электролитов
Диссоциация электролитов
Константа диссоциации
Примеры решения задач
Задачи для самостоятельного решения
Степень диссоциации
Вещества, которые в растворах или расплавах полностью или частично распадаются на ионы, называются электролитами.
Степень диссоциации α — это отношение числа молекул, распавшихся на ионы N′ к общему числу растворенных молекул N:
α = N′/N
Степень диссоциации выражают в процентах или в долях единицы. Если α =0, то диссоциация отсутствует и вещество не является электролитом. В случае если α =1, то электролит полностью распадается на ионы.
Классификация электролитов
Согласно современным представлениям теории растворов все электролиты делятся на два класса: ассоциированные (слабые) и неассоциированные (сильные). Неассоциированные электролиты в разбавленных растворах практически полностью диссоциированы на ионы. Для этого класса электролитов a близко к единице (к 100 %). Неассоциированными электролитами являются, например, HCl, NaOH, K2SO4 в разбавленных водных растворах.
Ассоциированные электролиты подразделяются на три типа:
-
-
- Слабые электролиты существуют в растворах как в виде ионов, так и в виде недиссоциированных молекул. Примерами ассоциированных электролитов этой группы являются, в частности, Н2S, Н2SO3, СН3СOОН в водных растворах.
- Ионные ассоциатыобразуются в растворах путем ассоциации простых ионов за счет электростатического взаимодействия. Ионные ассоциаты возникают в концентрированных растворах хорошо растворимых электролитов. В результате в растворе находятся как простые ионы, так и ионные ассоциаты. Например, в концентрированном водном растворе КCl образуются простые ионы К+, Cl— , а также возможно образование ионных пар (К+Cl— ), ионных тройников (K2Cl+, KCl2— ) и ионных квадруполей (K2Cl2, KCl32- , K3Cl2+).
- Комплексные соединения(как ионные, так и молекулярные), внутренняя сфера которых ступенчато диссоциирует на ионные и (или) молекулярные частицы.
Примеры комплексных ионов: [Cu(NH3)4]2+, [Fe(CN)6]3+, [Cr(H2O)3Cl2]+.
-
При таком подходе один и тот же электролит может относиться к различным типам в зависимости от концентрации раствора, вида растворителя и температуры. Подтверждением этому являются данные, приведенные в таблице.
Таблица. Характеристика растворов KI в различных растворителях
| Концентрация электролита, С, моль/л | Температура
t,оС |
Растворитель | Тип электролита |
| 0,01 | 25 | Н2О | Неассоциированный (сильный) |
| 5 | 25 | Н2О | Ионный ассоциат |
| 0,001 | 25 | С6Н6 | Ассоциированный (слабый) |
Приближенно, для качественных рассуждений можно пользоваться устаревшим делением электролитов на сильные и слабые. Выделение группы электролитов “средней силы” не имеет смысла. Эти электролиты являются ассоциированными. К слабым электролитам обычно относят электролиты, степень диссоцииации которых мала α<<1.
Таким образом, к сильным электролитам относятся разбавленные водные растворы почти всех хорошо растворимых в воде солей, многие разбавленные водные растворы минеральных кислот (НСl, HBr, НNО3, НСlO4 и др.), разбавленные водные растворы гидроксидов щелочных металлов. К слабым электролитам принадлежат все органические кислоты в водных растворах, некоторые водные растворы неорганических кислот, например, H2S, HCN, H2CO3, HNO2, HСlO и др. К слабым электролитам относится и вода.
Диссоциация электролитов
Уравнение реакции диссоциации сильного электролита можно представить следующим образом. Между правой и левой частями уравнения реакции диссоциации сильного электролита ставится стрелка или знак равенства:
HCl → H+ + Cl—
Na2SO3 = 2Na+ + SO32-
Допускается также ставить знак обратимости, однако в этом случае указывается направление, в котором смещается равновесие диссоциации, или указывается, что α≈1. Например:
NaOH → Na+ + OH—
Диссоциация кислых и основных солей в разбавленных водных растворах протекает следующим образом:
NaHSO3 → Na+ + HSO3—
Анион кислой соли будет диссоциировать в незначительной степени, поскольку является ассоциированным электролитом:
HSO3— → H+ + SO32-
Аналогичным образом происходит диссоциация основных солей:
Mg(OH)Cl → MgOH+ + Cl—
Катион основной соли подвергается дальнейшей диссоциации как слабый электролит:
MgOH+ → Mg2+ + OH—
Двойные соли в разбавленных водных растворах рассматриваются как неассоциированные электролиты:
KAl(SO4)2 → K+ + Al3+ + 2SO42-
Комплексные соединения в разбавленных водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы:
K3[Fe(CN)6] → 3K+ + [Fe(CN)6]3-
В свою очередь, комплексный ион в незначительной степени подвергается дальнейшей диссоциации:
[Fe(CN)6]3- → Fe3+ + 6CN—
Константа диссоциации
При растворении слабого электролита КА в растворе установится равновесие:
КА ↔ К+ + А—
которое количественно описывается величиной константы равновесия Кд, называемой константой диссоциации:
Kд = [К+] · [А—] /[КА] (2)
Константа диссоциации характеризует способность электролита диссоциировать на ионы. Чем больше константа диссоциации, тем больше ионов в растворе слабого электролита. Например, в растворе азотистой кислоты HNO2 ионов Н+ больше, чем в растворе синильной кислоты HCN, поскольку К(HNO2) = 4,6·10— 4, а К(HCN) = 4,9·10— 10.
Для слабых I-I электролитов (HCN, HNO2, CH3COOH) величина константы диссоциации Кд связана со степенью диссоциации α и концентрацией электролита c уравнением Оствальда:
Кд = (α2·с)/(1-α) (3)
Для практических расчетов при условии, что α<<1 используется приближенное уравнение:
Кд = α2·с (4)
Поскольку процесс диссоциации слабого электролита обратим, то к нему применим принцип Ле Шателье. В частности, добавление CH3COONa к водному раствору CH3COOH вызовет подавление собственной диссоциации уксусной кислоты и уменьшение концентрации протонов. Таким образом, добавление в раствор ассоциированного электролита веществ, содержащих одноименные ионы, уменьшает его степень диссоциации.
Следует отметить, что константа диссоциации слабого электролита связана с изменением энергии Гиббса в процессе диссоциации этого электролита соотношением:
ΔGT0 = — RTlnKд (5)
Уравнение (5) используется для расчета констант диссоциации слабых электролитов по термодинамическим данным.
Примеры решения задач
Задача 1. Определите концентрацию ионов калия и фосфат-ионов в 0,025 М растворе K3PO4.
Решение. K3PO4 – сильный электролит и в водном растворе диссоциирует полностью:
K3PO4 → 3К+ + РО43-
Следовательно, концентрации ионов К+ и РО43- равны соответственно 0,075М и 0,025М.
Задача 2. Определите степень диссоциации αд и концентрацию ионов ОН— (моль/л) в 0,03 М растворе NH3·H2О при 298 К, если при указанной температуре Кд(NH3·H2О) = 1,76× 10— 5.
Решение. Уравнение диссоциации электролита:
NH3·H2О → NH4+ + OH—
Концентрации ионов: [NH4+] = αС ; [OH—] = αС , где С – исходная концентрация NH3·H2О моль/л. Следовательно:
Kд = αС · αС /(1 — αС)
Поскольку α << 1, то:
Кд ≈ α 2С
Константа диссоциации зависит от температуры и от природы растворителя, но не зависит от концентрации растворов NH3·H2О. Закон разбавления Оствальда выражает зависимость α слабого электролита от концентрации.
α = √(Кд / С) = √(1,76× 10— 5 / 0,03) = 0,024 или 2,4 %
[OH—] = αС, откуда [OH— ] = 2,4·10— 2·0,03 = 7,2·10-4 моль/л.
Задача 3. Определите константу диссоциации уксусной кислоты, если степень диссоциации CH3CОOH в 0,002 М растворе равна 9,4 %.
Решение. Уравнение диссоциации кислоты:
CH3CОOH → СН3СОО— + Н+.
α = [Н+] / Сисх(CH3CОOH)
откуда [Н+] = 9,4·10—2·0,002 = 1,88·10-4 М.
Так как [CH3CОO—] = [Н+] и [CH3CОOH] ≈ Сисх(CH3CОOH), то:
Kд = [Н+]2 / Сисх(CH3CОOH)
Константу диссоциации можно также найти по формуле: Кд ≈ α 2С.
Задача 4. Константа диссоциации HNO2 при 298К равна 4,6× 10— 4. Найдите концентрацию азотистой кислоты, при которой степень диссоциации HNO2 равна 5 %.
Решение.
Кд =α 2С , откуда получаем Сисх(HNO2) = 4,6·10— 4/(5·10— 2)2 = 0,184 М.
Задача 5. На основе справочных данных рассчитайте константу диссоциации муравьиной кислоты при 298 К.
Решение. Уравнение диссоциации муравьиной кислоты
НСООН →Н+ + СООН—
В “Кратком справочнике физико–химических величин” под редакцией А.А. Равделя и А.М. Пономаревой приведены значения энергий Гиббса образований ионов в растворе, а также гипотетически недиссоциированных молекул. Значения энергий Гиббса для муравьиной кислоты и ионов Н+ и СООН— в водном растворе приведены ниже:
| Вещество, ион | НСООН | Н+ | СООН— |
| ΔGT0, кДж/моль | — 373,0 | 0 | — 351,5 |
Изменение энергии Гиббса процесса диссоциации равно:
ΔGT0 = — 351,5- (- 373,0) = 21,5 кДж/моль.
Для расчета константы диссоциации используем уравнение (5). Из этого уравнения получаем:
lnKд = — Δ GT0/RT= — 21500/(8,31 298) = — 8,68
Откуда находим: Kд = 1,7× 10— 4.
Задачи для самостоятельного решения
1. К сильным электролитам в разбавленных водных растворах относятся:
- СН3СOOH
- Na3PO4
- NaCN
- NH3
- C2H5OH
- HNO2
- HNO3
13.2. К слабым электролитам в водных растворах относятся:
- KAl(SO4)2
- NaNO3
- HCN
- NH4Cl
- C2H5OH
- H2SO3
- H2SO4
3. Определите концентрацию ионов NH4+ в 0,03 М растворе (NH4)2Fe(SO4)2;
4. Определите концентрацию ионов водорода в 6 мас.% растворе H2SO4, плотность которого составляет 1,038 г/мл. Принять степень диссоциации кислоты по первой и второй ступеням равной 100 %.
5. Определите концентрацию гидроксид-ионов в 0,15 М растворе Ba(OH)2.
6. Степень диссоциации муравьиной кислоты в 0,1 М растворе равна 4 %. Рассчитайте Концентрацию ионов водорода в этом растворе и константу диссоциации НСООН.
7. Степень диссоциации муравьиной кислоты в водном растворе увеличится при:
а) уменьшении концентрации HCOOH;
б) увеличении концентрации HCOOH;
в) добавлении в раствор муравьиной кислоты HCOONa;
г) добавлении в раствор муравьиной кислоты НCl.
8. Константа диссоциации хлорноватистой кислоты равна 5× 10— 8. Определите концентрацию HClO, при которой степень диссоциации HClO равна 0,5 %, и концентрацию ионов Н+ в этом растворе.
9. Вычислите объем воды, который необходимо добавить к 50 мл 0,02 М раствора NH3·H2О, чтобы степень диссоциации NH3·H2О увеличилась в 10 раз, если Кд(NH4OH) = 1,76·10— 5.
10. Определите степень диссоциации азотистой кислоты в 0,25 М растворе при 298 К, если при указанной температуре Кд(HNO2) = 4,6× 10— 4.
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 28 декабря 2018 года; проверки требуют 24 правки.
Степень диссоциации — величина, характеризующая состояние равновесия в реакции диссоциации в (однородных)[1] системах.
Определение[править | править код]
Степень диссоциации равна отношению продиссоциированных молекул вещества 

Степень диссоциации зависит как от природы растворённого электролита, так и от концентрации раствора.
Пример. Для уксусной кислоты CH3COOH величина 
М растворе). Это значит, что в водном растворе кислоты лишь 4 из каждых 100 молекул диссоциированы, то есть находятся в виде ионов Н+ и СН3СОО−, остальные же 96 молекул не диссоциированы. Как видно в таком примере, количества частиц, о которых идёт речь в определении степени диссоциации (они же концентрации при условии единичного объёма) – это равновесные количества (концентрации соответственно).
Экспериментальные методы[править | править код]
Степень диссоциации определяется:
- по электропроводности раствора
- по понижению температуры замерзания
Мнимая степень электрической диссоциации[править | править код]
Поскольку сильные электролиты диссоциируют практически полностью, можно было бы ожидать для них изотонический коэффициент, равный количеству ионов (или поляризованных атомов) в формульной единице (молекуле). Однако в действительности этот коэффициент всегда меньше определённого по формуле (например, изотонический коэффициент для 0,05-молярного раствора NaCl равен i = 1,9 вместо 2,0, а (для раствора сульфата магния той же концентрации вовсе i = 1,3). Это объясняет теория сильных электролитов, разработанная в 1923 году П. Дебаем и Э. Хюккелем: передвижение ионов в растворе затруднено образовавшейся оболочкой сольватации. К тому же, ионы взаимодействуют и между собой: разноимённо заряженные притягиваются, а одноимённо заряженные — отталкиваются; силы взаимного притяжения приводят к образованию групп ионов, перемещающихся по раствору совместно. Такие группы называют ионными ассоциатами или ионными па́рами. Соответственно, раствор ведёт себя так, будто содержит меньше частиц, чем на самом деле, ведь свобода их перемещения ограничена. Наиболее очевиден пример, касающийся электропроводности растворов 

,
где 

Связь с константой диссоциации[править | править код]
Из закона разбавления Оствальда следует:

Зависимость степени диссоциации 

при малых значениях 


|

|

|
|---|---|---|
| 100% | 0.61803398875 | 61.803398875% |
| 50% | 0.2807 | 39.04% |
| 40% | 0.2198 | 32.79% |
| 30% | 0.1612 | 25.84% |
| 20% | 0.1050 | 18.10% |
| 15% | 0.0778 | 13.92% |
| 10% | 0.0512 | 9.51% |
| 5% | 0.0225 | 4.88% |
| x | 0.5*x + 0.1184*x^2 | 
|
для диссоциации вида AnBm = nA + mB
![{displaystyle alpha ={sqrt[{n+m}]{Kcdot (1-alpha ) over n^{n}m^{m}C^{n+m-1}}} {overset {underset {mathrm {alpha <<1} }{}}{approx }} {sqrt[{n+m}]{K over n^{n}m^{m}C^{n+m-1}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9e2661fda430566fea8f53b201b3921272c8a483)
Поскольку диссоциация описывается постадийно, данная формула не применяется.
См. также[править | править код]
- Закон разбавления Оствальда
- Константа диссоциации
Примечания[править | править код]
- ↑ Stray Kids // Википедия. — 2023-02-28.
Литература[править | править код]
- Глинка Н. Л. Общая химия — 24-е издание, исправленное. М. 1985. с. 228.
Изучая
свойства растворов электролитов, С.
Аррениус ввёл понятие «степень
диссоциации», предположив, что некоторые
электролиты не могут полностью
диссоциировать на ионы.
Степенью
диссоциации называется отношение
числа молекул, распавшихся в растворе
на ионы, к общему числу молекул электролита
в растворе.
|
|
(1) |
где:
N(X)
– число продиссоциировавших молекул
электролита X;
N0(X)
– общее число молекул электролита X
в растворе.
Степень
диссоциации ()
зависит от следующих факторов:
– от
природы электролита и растворителя;
– концентрации
электролита;
– температуры.
Степень
диссоциации можно также выразить через
количество вещества по формуле:
|
|
(2) |
где
n(X)
– количество молей продиссоциировавшего
вещества X;
n0б(X)
– общее количество молей вещества X
в растворе;
Na
–
число Авогадро.
Количество вещества
можно выразить через молярную концентрацию
раствора и объём раствора, поэтому
степень диссоциации можно также
определить как отношение молярной
концентрации продиссоциировавшего
вещества к молярной концентрации всего
вещества, находящегося в растворе.
|
|
( |
где
[Х] – молярная концентрация
продиссоциировавшего вещества X;
[Х0]
– общая молярная концентрация вещества
X
в растворе.
Электролиты
можно разделить на 2 большие группы:
электролиты сильные и слабые.
Сильные
электролиты
диссоциируют в растворах полностью и
процесс диссоциации необратим:
HNO3
H+
+ NO3–
. Из этого следует, что степень
диссоциации сильного электролита равна
1.
Сильными
электролитами являются:
–все
растворимые соли;
– гидроксиды
щелочных и щелочно-земельных металлов
(NaOH,
KOH,
Ba(OH)2;
– некоторые
кислоты (H2SO4,
HNO3,
HCl,
HBr,
HI.
Для
слабых электролитов степень диссоциации
α < 1,
поскольку слабые электролиты диссоциируют
лишь частично, и
процесс диссоциации обратим, т.е.
в растворе устанавливается динамическое
равновесие между ионами и
непродиссоциировавшими молекулами.
Основные
слабые электролиты:
– вода
H2O;
– гидроксиды
Al(OH)3;
Обратимый
характер диссоциации слабых электролитов
отражается при записи уравнений.
CH3COOH
⇆
CH3COO–
+ H+
H3PO4
⇆
H+
+ H2PO4–
H2PO4–
⇆
H+
+ HPO42–
HPO42–
⇆
H+
+ PO43–
4 Константа диссоциации
К
равновесию, которое устанавливается в
растворе слабого электролита между
молекулами и ионами, можно применить
законы химического равновесия и записать
выражение константы равновесия.
Ниже
приводится выражение константы равновесия
для процесса диссоциации уксусной
кислоты CH3COOH
⇆
CH3COO–
+ H+.
К
онстанта
равновесия, соответствующая процессу
диссоциации слабого электролита,
называется
константой
диссоциации.
Величина
константы диссоциации зависит от природы
электролита и растворителя, температуры,
но не зависит от концентрации электролита
в растворе.
Она
характеризует способность данной
кислоты или данного основания распадаться
на ионы: чем легче электролит диссоциирует
на ионы, тем больше константа диссоциации.
Константа
диссоциации является справочной
величиной.
Ступенчатая
диссоциация электролитов. Многоосновные
кислоты и многокислотные основания
диссоциируют ступенчато.
Каждая
стадия ступенчатой диссоциации
многоосновной кислоты характеризуется
своей константой диссоциации.
H3PO4
⇆
H+
+ H2PO4–
H2PO4–
⇆
H+
+ HPO42–
HPO42–
⇆
H+
+ PO43–
Аналогичные
соотношения характеризуют и ступенчатую
диссоциацию оснований многовалентных
металлов.
Fe(OH)2
⇆
FeOH+
+ OH–
F
eOH+
⇆
Fe2+
+ OH–
При
ступенчатой диссоциации веществ распад
по первой ступени всегда происходит в
гораздо большей степени, чем по второй;
по второй стадии – больше, чем по третьей
и т.д. Иначе говоря, соблюдается
неравенство:
K1
>> K2
> K3
> … .
Это
объясняется тем, что энергия, необходимая
для отрыва иона от нейтральной молекулы,
меньше, чем от заряженной частицы.
Например, отрыв иона H+
будет происходить более легко от
нейтральной частицы – молекулы H3PO4,
чем от отрицательно заряженного иона
H2PO4–.
В свою очередь, отрыв иона H+
от однозарядного иона H2PO4–
требует меньшей энергии, чем от
двухзарядного иона HPO4–.
Кислые
и основные соли также диссоциируют
ступенчато, например:
Нетрудно заметить,
что диссоциация гидроаниона или
гидроксокатиона идентична второй или
третьей ступени диссоциации соответствующих
кислоты или основания и потому подчиняется
тем же закономерностям, которые были
сформулированы для ступенчатой
диссоциации кислот и оснований. В
частности, если основная соль
соответствует слабому основанию, а
кислая соль – слабой кислоте, то диссоциация
гидроаниона или гидроксокатиона (т. е.
вторая или третья ступень диссоциации
соли) протекает в незначительной степени.
Во всякой
кислородсодержащей кислоте и во всяком
основании (имеются в виду кислоты и
основания в традиционном понимании)
имеются гидроксогруппы. Разница между
кислотой и основанием заключается в
том, что в первом случае диссоциация
происходит по связи ЭО—Н, а во втором
— по связи Э—ОН.
Амфотерные
гидроксиды диссоциируют и как основания,
и как кислоты (и те и другие очень слабые).
Так, ионизацию гидроксида цинка можно
представить следующей схемой (без учета
гидратации образующихся ионов):
Прибавление кислоты
смещает эти равновесия влево, а
прибавление щелочи – вправо. Поэтому
в кислой среде преобладает диссоциация
по типу основания, а в щелочной — по
типу кислоты. В обоих случаях связывание
в молекулы воды ионов, образующихся
при диссоциации малорастворимого
амфотерного электролита, вызывает
переход в раствор новых порций таких
ионов, их связывание, переход в раствор
новых ионов и т. д. Следовательно,
растворение такого электролита происходит
как в растворе кислоты, так и в растворе
щелочи.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Статьи
Основное общее образование
Линия УМК В. В. Лунина. Химия (8-9)
Химия
Теория электролитической диссоциации
Что такое электролитная диссоциация? В следствие чего она образуется и какие факторы влияют на ее степень? Как научиться составлять уравнения диссоциации?
Кто открыл способность некоторых растворов проводить электрический ток и почему великий русский химик Д.И.Менделеев не получил Нобелевской премии?
Ответы на все эти вопросы вы узнаете из этой статьи.
26 апреля 2019
История вопроса
Изучение растворов с давних времен занимало умы исследователей. В начале XIX века М. Фарадей открыл способность некоторых растворов проводить электрический ток. Геймгольц, немецкий физик, предположил, что электролиты в растворе полностью распадаются на ионы, то есть существует электролитическая диссоциация. Однако увеличение электропроводности с уменьшением концентрации раствора объяснить не смог.
Ученые заметили, что растворы замерзают при более низкой температуре, чем чистые растворители. Именно этим свойством растворов и в наше время пользуются дворники, щедро посыпая солью обледеневшие тротуары. Однако, температура замерзания электролитов не соответствовала расчетным данным.
Научным несостыковкам требовалось найти объяснение. И молодой, 29-летний шведский ученый С. Аррениус, в 1887 г. исследуя проведение электрического тока в растворах различных веществ, выдвинул теорию, которая могла объяснить эти факты.
Основные положения теории электролитической диссоциации
- Химические субстанции делятся на электролиты — вещества, которые проводят электрический ток, и неэлектролиты. К электролитам относится большинство сложных неорганических веществ: кислоты, основания, соли.
К неэлектролитам — большинство органических веществ. - В воде электролиты распадаются на ионы: положительно заряженные катионы и отрицательно заряженные анионы. Ионы бывают простые и сложные. В растворе ионы находятся в хаотическом движении.
- Под действием электрического тока движение ионов упорядочивается, и катионы движутся к отрицательному полюсу — катоду, анионы к положительному аноду.
- На степень электролитической диссоциации влияют различные факторы: природа растворенного вещества и его количество, свойства растворителя, температура раствора.

Химия. 8 класс. Учебник
Учебник написан преподавателями химического факультета МГУ имени М.В. Ломоносова. Отличительными особенностями книги являются простота и наглядность изложения материала, высокий научный уровень, большое количество иллюстраций, экспериментов и занимательных опытов, что позволяет использовать ее в классах и школах с углубленным изучением естественно-научных предметов.
Купить
Степень диссоциации
В ходе научных исследований ученые определили, что в растворе диссоциирует некоторая часть молекул растворителя. Для количественной характеристики силы электролита был введен показатель степени диссоциации, который обозначается α и рассчитывается по формуле
α = ν / ν0.
Где ν — количество вещества, распавшееся на ионы,
ν0 — общее количество вещества.
Степень диссоциации также можно выразить в процентах. Как это сделать, можно узнать в § 11 учебника
«Химия. 9 класс» под редакцией В.В. Еремина.
В зависимости от степени диссоциации вещества делят на сильные и слабые электролиты.
Сильные электролиты представляют собой вещества, которые в разбавленных растворах практически полностью распадаются на ионы. Степень диссоциации более 0.5, или 50%.
Для слабых электролитов значение степени диссоциации α меньше 0.1, или 10%.
Вещества с промежуточными значениями от 10 до 50% иногда называют средними электролитами.
Уравнение диссоциации
Уравнение электролитической диссоциации используют для записи процессов, происходящих в растворе.
Диссоциация сильного электролита протекает практически необратимо, что показывает стрелка →.
NaCl → Na+ + Cl–
CaCl2 → Ca2+ + 2Cl–
Диссоциация слабого электролита — обратимый процесс, протекает не полностью и не до конца, что обозначает стрелка ⇄
СH3COOH ⇄ СH3COO– + H+
Умение составлять уравнения диссоциации будет отличным подспорьем при разборе темы «§ 13. Реакции ионного обмена и условия их протекания» в учебнике
«Химия. 9 класс» под редакцией В.В. Еремина и для решения ионных уравнений.
Противостояние титанов
Теория электролитической диссоциации Аррениуса вызвала жаркие споры среди ученых.
Химический мир разделился на два лагеря. Сторонники «физической» теории Аррениуса считали, что распад на ионы происходит без какого-либо воздействия сил внешней среды и раствор представляет собой механическую взвесь ионов и молекул воды.
Но эта теория не могла объяснить тепловые эффекты при растворении. Например, нагревание колбы при разведении в воде серной кислоты или покрытие сосуда инеем при растворении в воде аммиачной селитры или азотнокислого аммония.
Сторонники «химической», или гидратной, теории, автором которой был Д.И. Менделеев, считали, что в растворе происходит взаимодействие растворенного вещества и растворителя.
Много копий было сломано в этой борьбе. Проявились худшие человеческие качества. Так, Аррениус, пользуясь служебным положением (в 1905 году он был назначен директором физико-химического Нобелевского института в Стокгольме), приложил массу усилий, чтобы, несмотря на трехкратную номинацию на получение Нобелевской премии в 1905, 1906 и 1907 годах, Д.И. Менделеев так ее и не получил.
Но истина, как всегда, оказалась посередине: в ходе дальнейших экспериментов ученые выяснили, что растворитель и растворенное вещество, взаимодействуя между собой, дают необходимую энергию для разрушения кристаллической решетки электролитов. В споре великих умов родилась новая протолитическая, или протонная, теория кислот и оснований.
#ADVERTISING_INSERT#
Известно, что существуют две основные причины прохождения электрического тока через проводники: либо за счёт движения электронов в электрическом поле, либо за счет движения ионов. Электрическая проводимость присуща, прежде всего, металлам. Ионная проводимость присуща многим химическим соединения, обладающим ионным строением, например, солям в твёрдом или расплавленном состояниях, а также многим водным и неводным растворам. В связи с этим все вещества принято условно делить на две категории:
а) вещества, растворы которых обладают ионной проводимостью, называются электролитами;
б) вещества, растворы которых не обладают ионной проводимостью, называются неэлектролитами.
К электролитам относится большинство неорганических кислот, оснований и солей. К неэлектролитам относятся многие органические соединения, например, спирты, углеводы.
Оказалось, что, кроме хорошей электропроводности, растворы электролитов обладают более низкими значениями давлениями пара растворителя и температуры плавления и более высокими температурами кипения по сравнению с соответствующими значениями для чистого растворителя или для раствора неэлектролита в этом же растворителе. Для объяснения этих свойств, шведский ученый С. Аррениус в 1887 г. предложил теорию электролитической диссоциации.
Под электролитической диссоциацией понимается распад молекул электролита в растворе с образованием положительно и отрицательно заряженных ионов – катионов и анионов под действием растворителя. Например, молекула уксусной кислоты может диссоциировать в водном растворе следующим образом:
$$ {mathrm{CH}}_{3}mathrm{COOH}rightleftarrows {mathrm{H}}^{+}+{mathrm{CH}}_{3}{mathrm{COO}}^{–}$$.
Сущность теории электролитической диссоциации С. Аррениуса
1. Электролиты при растворении в воде распадаются (диссоциируют) на ионы: положительные (катионы) и отрицательные (анионы).
2. Под действием электрического тока положительно заряженные ионы движутся к отрицательному полюсу источника тока – катоду, и поэтому называются катионами, а отрицательно заряженные ионы движутся к положительному полюсу источника тока – аноду, и поэтому называются анионами.
3. Электролитическая диссоциация – процесс обратимый для слабых электролитов, т. е. вместе с распадом молекул на ионы (диссоциация) идет процесс соединения ионов в молекулы (ассоциация).
Электролиты подразделяются в зависимости от степени диссоциации на сильные и слабые.
вещества, которые диссоциируют полностью и необратимо, т. е. в растворе присутствуют только гидратиро-ванные ионы. Относятся все соли, сильные кислоты `”HI”`, `”HCl”`, `”HBr”`, `”HNO”_3`, `”H”_2″SO”_4`, `”HMnO”_4`, `”HClO”_4`, `”HClO”_3`, щелочи `”NaOH”`, `”LiOH”`, `”KOH”`, `”RbOH”`, `”CsOH”`, `”Ca”(“OH”)_2`, `”Ba”(“OH”)_2`, `”Sr”(“OH”)_2`.
С точки зрения теории электролитической диссоциации, кислотой называется соединение, образующее при диссоциации в водном растворе только ионы `”H”^+`:
`”HNO”_3 → “H”^+ + “NO”_3^-`
Если кислота является двухосновной, то диссоциация кислоты происходит ступенчато. Количество стадий определяется основностью кислоты:
$$ {mathrm{H}}_{2}{mathrm{SO}}_{4}to {mathrm{H}}^{+}+{mathrm{HSO}}_{4}^{-}$$
$$ {mathrm{HSO}}_{4}^{-}rightleftarrows {mathrm{H}}^{+}+{mathrm{SO}}_{4}^{2-}$$.
Сила бескислородных кислот возрастает в ряду однотипных соединений при переходе вниз по подгруппе кислотообразующего элемента: `”HCl”-“HBr”-“HI”`. Бромоводородная кислота `”HBr”` и йодоводородная `”HI”` кислоты сильнее хлороводородной, что объясняется увеличением межъядерных расстояний в их молекулах.
Фтороводородная (плавиковая) кислота `”HF”` растворяет стекло, но это вовсе не говорит о её силе. В ряду бескислородных галогенсодержащих кислот она относится к кислотам средней силы ввиду низкой концентрации в растворе ионов водорода из-за способности молекул `”HF”` к объединению (ассоциации), благодаря сильным водородным связям, возникающим при взаимодействии ионов `”F”^-` с молекулами `”HF”` (водородные связи) с образованием ионов `”HF”_2^-`, `”H”_2″F”_3^-` и других боле сложных частиц. В результате концентрация ионов водорода в водном растворе фтороводородной кислоты оказывается сильно пониженной.
Сила однотипных кислородных кислот изменяется в противоположном направлении, например, йодная кислота `”HIO”_4` слабее хлорной кислоты `”HClO”_4`. Если элемент образует несколько кислородных кислот, то наибольшей силой обладает кислота, в которой кислотообразующий элемент имеет самую высокую валентность.
Так, в ряду кислот `”HClO”-“HClO”_2-“HClO”_3-“HClO”_4` хлорная кислота наиболее сильная.
Схематически процесс распада (диссоциации) соляной кислоты на ионы можно представить следующим образом. Чтобы вещество в воде было электролитом, его молекула должна быть полярной.
Полярная молекула вещества окружена полярными молекулами воды, которые разрывают молекулу на две противоположно заряженные частицы – ионы.
с точки зрения теории электролитической диссоциации, представляет собой вещество, способное отдавать в растворе гидроксильную группу `”OH”^-`:
$$ mathrm{NaOH} to {mathrm{Na}}^{+} + {mathrm{OH}}^{–}$$.
Диссоциация многокислотного гидроксида происходит ступенчато, например:
$$ mathrm{Ba}(mathrm{OH}{)}_{2} to {mathrm{BaOH}}^{+} + {mathrm{OH}}^{-}$$,
$$ {mathrm{BaOH}}^{+}rightleftarrows {mathrm{Ba}}^{2+}+ {mathrm{OH}}^{-}$$.
В свете теории электролитической диссоциации соли представляют собой соединения, образующие в водном растворе положительно заряженные ионы металла и отрицательно заряженные ионы кислотного остатка (для средних солей), а также кроме них ионы водорода (для кислых солей) и гидроксид-ионы (для основных солей):
Средняя соль:
$$ {mathrm{Na}}_{2}{mathrm{SO}}_{4} to 2{mathrm{Na}}^{+} + {mathrm{SO}}_{4}^{2-}$$.
Кислая соль:
$$ {mathrm{NaHSO}}_{4} to {mathrm{Na}}^{+}+{mathrm{HSO}}_{4}^{-}$$;
$$ {mathrm{HSO}}_{4}^{-}rightleftarrows {mathrm{H}}^{+}+{mathrm{SO}}_{4}^{2-}$$.
Основная соль:
$$ mathrm{MgOHCl} to {mathrm{MgOH}}^{+}+{mathrm{Cl}}^{-}$$;
$$ {mathrm{MgOH}}^{+} rightleftarrows {mathrm{Mg}}^{2+} +{mathrm{OH}}^{-}$$.
вещества, которые диссоциируют частично и обратимо.
$$ {mathrm{HNO}}_{2} rightleftarrows {mathrm{H}}^{+}+{mathrm{NO}}_{2}^{-}$$
$$ {mathrm{CH}}_{3}mathrm{COOH} rightleftarrows {mathrm{CH}}_{3}{mathrm{COO}}^{–}+{mathrm{H}}^{+}$$.
В растворе слабого электролита присутствуют гидратированные ионы и некоторая часть недиссоциированных молекул.
К слабым электролитам относятся:
1) вода;
2) соли `”Zn”`, `”Cd”`, `”Hg”`;
3) оставшиеся кислоты, не относящиеся к сильным, например, `”HF”`, `”H”_2″S”`, `”HNO”_2`, `”H”_3″PO”_4` и другие, а также незамещённые органические кислоты. При растворении углекислого газа в воде образуется его гидрат `”CO”_2*”H”_2″O”` и в незначительном количестве угольная кислота `”H”_2″CO”_3`. Тем не менее, для диссоциации воспользуемся формулой угольной кислоты:
$$ {mathrm{H}}_{2}{mathrm{CO}}_{3} rightleftarrows {mathrm{H}}^{+}+{mathrm{HCO}}_{3}^{-}$$
$$ {mathrm{HCO}}_{3}^{-}rightleftarrows {mathrm{H}}^{+}+{mathrm{CO}}_{3}^{2-}$$.
Практически диссоциация осуществляется лишь по первой ступени. Образующийся гидрокарбонат-ион `”HCO”_3^-` ведёт себя как слабый электролит.
Причиной диссоциации электролита в водных растворах является его гидратация, т. е. взаимодействие электролита с молекулами воды и разрыв химической связи в нем. В результате такого взаимодействия образуются гидратированные, т. е. связанные с молекулами воды, ионы.
Диссоциации проходит благодаря тому, что при гидратации ионов выделяется больше энергии, чем требуется на разрыв связи в молекуле. Примерно также происходит растворение ионного кристалла в воде и образование ионов. У кристаллов энергия гидратации ионов выше энергии кристаллической решётки.
Следует учитывать, что в растворах электролитов хаотически движущиеся гидратированные ионы могут столкнуться и вновь объединиться между собой. Этот обратный процесс называется ассоциацией. При некоторой постоянной температуре в данной системе устанавливается химическое равновесие, при котором скорость диссоциации станет равной скорости ассоциации.
Также необходимо учитывать, что свойства гидратированных ионов отличаются от свойств негидратированных ионов. Например, негидратированный ион меди `”Cu”^(2+)` – белый в безводных кристаллах сульфата меди (II) `”СuSO”_4` и имеет голубой цвет, когда гидратирован, т. е. связан с молекулами воды `”Cu”^(2+)*”H”_2″O”`. Гидратированные ионы имеют как постоянное, так и переменное количество молекул воды.
Основные свойства гидроксидов одного и того же элемента усиливаются с уменьшением его валентности. Так, основные свойства у гидроксида железа (II) выражены сильнее, чем у гидроксида железа (III) и наоборот.
Слабым электролитом является гидроксид аммония `”NH”_4″OH”`. При растворении аммиака `”NH”_3` в воде образуется раствор, который слабо проводит электрический ток и имеет горько-мыльный вкус. Среда раствора основная. В растворе образуются гидрат аммиака `”NH”_3*”H”_2″O”` и в незначительном количестве гидроксид аммония `”NH”_4″OH”`, который диссоциирует как слабый электролит с образованием ионов аммония `”NH”_4^+` и гидроксид-иона `”OH”^-`.
$$ {mathrm{NH}}_{4}mathrm{OH} rightleftarrows {mathrm{NH}}_{4}^{+}+{mathrm{OH}}^{-}$$.
К слабым электролитам относят некоторые соли, например хлорид цинка `”ZnCl”_2`, тиоцианат железа `”Fe”(“NCS”)_3`, цианид ртути `”Hg”(“CN”)_2`, которые также диссоциируют по ступеням.
Разделение электролитов на сильные, средние и слабые зависит от доли продиссоциированных молекул или степени диссоциации `alpha`, которая показывает отношение числа молекул, распавшихся на ионы `(N_”д”)`, к общему числу введённых в раствор молекул `(N_”р”)`:
`alpha=(N_”д”)/(N_”р”)*100%`
Электролиты со степенью диссоциации `30%` и более называют сильными, со степенью диссоциации `3`-`30%` называют средними (средней силы), со степенью диссоциации менее `3%` – слабыми.
Степень диссоциации не является строгим показателем силы электролита, т. к. она зависит от концентрации раствора, природы растворителя, присутствия в растворе другие электролитов.
При понижении концентрации степень диссоциации может повышаться, и в очень разбавленных растворах слабый электролит может находиться в состоянии почти полной диссоциации, в то же время в концентрированном растворе сильный электролит может вести себя как слабый и даже как неэлектролит.
Степень диссоциации как сильных, так и слабых электролитов зависит от концентрации раствора (степень диссоциации тем выше, чем более разбавлен раствор). Более точной характеристикой диссоциации электролита является константа диссоциации, которая от концентрации раствора не зависит.
Выражение для константы диссоциации можно получить, если записать уравнение реакции диссоциации электролита АК в общем виде:
$$ AK rightleftarrows {A}^{-}+{K}^{+}$$.
Поскольку диссоциация слабого электролита является обратимым равновесным процессом, то к данной реакции применим закон действующих масс, и можно определить константу равновесия как
`K_”дис”=([A^-][K^+])/([AK])`,
где `K_”дис”` – константа диссоциации, которая зависит от температуры и природы электролита и растворителя, но не зависит от концентрации электролита;
`[AK]` – концентрация недиссоцированных молекул;
`[A^-]`, `[K^+]` – молярные концентрации анионов и катионов.
Рассчитайте количество ионов водорода в `1` л раствора серной кислоты с концентрацией `0,1` моль/л.
`”H”_2″SO”_4 → “H”^+ + “HSO”_4^-`
`0,1` моль `0,1` моль
Количество ионов водорода равно `0,1` моль.
Запишем уравнение диссоциации по второй ступени и по справочным данным определим степень диссоциации (`0,3`):
| $$ {mathrm{HSO}}_{4}^{-}rightleftarrows $$ | `”H”^+ +”SO”_4^(2-)`. |
| `0,1` моль | `0,03` моль |
Используем формулу для нахождения степени диссоциации (при решении задачи степень диссоциации удобно выразить в долях от единицы):
`alpha(“H”_2″SO”_4)=(n(“диссоцH”_2″SO”_4))/(n(“общH”_2″SO”_4))`
`n(“диссоцH”_2″SO”_4)=0,1` моль/л `*0,3=0,03` моль.
`n(“H”^+)=n(“диссоцH”_2″SO”_4)=0,03` моль.
Таким образом, в растворе появилось ионов `”H”^+`:
`0,1` моль `+ 0,03` моль `= 0,13` моль.
Следовательно, концентрация ионов водорода в растворе серной кислоты равна `0,13` моль/л.
Степень диссоциации гидроксида бария по первой ступени `- 92%`, по второй ступени `- 56%`. Рассчитайте число катионов бария и число гидроксид-ионов в `0,5` л `1,5 M` растворе.
Дано:
`alpha_1(“Ba(OH”)_2)=92%`
`alpha_2(“Ba(OH”)_2)=56%`
`V_”р-ра”(“Ba(OH”)_2)=0,5` л
`c(“Ba(OH”)_2)=1,5M=1,5 “моль”//”л”`
`N(“Ba”^(2+))` – ?
`N(“OH”^-)` – ?
1) Запишем уравнение электролитической диссоциации гидроксида бария:
1 ступень: `”Ba(OH”)_2-> “BaOH”^+ + “OH”^-`,
2 ступень: $$ {mathrm{BaOH}}^{+}rightleftarrows {mathrm{Ba}}^{2+}+{mathrm{OH}}^{-}$$.
2) Найдём количество вещества гидроксида бария, содержащегося в данном образце раствора:
`nu(“Ba(OH”)_2)=c(“Ba(OH”)_2)*V_”р-ра”(“Ba(OH”)_2)=`
`=1,5″моль”//”л” * 0,5″л”=0,75″моль”`
3) Зная степень диссоциации вычислим число молекул `”Ba(OH”)_2` распавшихся на ионы по первой ступени диссоциации:
`nu_”дис”(“Ba”(“OH”)_2)=(alpha_1(“Ba”(“OH”)_2)*nu(“Ba”(“OH”)_2))/(100%)=`
`=(0,75 “моль”*92%)/(100%)=0,69 “моль”`.
Согласно диссоциации по `”I”` ступени, это количество вещества равно количеству вещества гидроксид-ионов, образовавшихся по первой ступени диссоциации, и количество ионов `”Ba(OH”)^+`:
`nu(“Ba(OH”)^+ )=nu_1(“OH”^-)=nu_”дис”(“Ba(OH”)_2)=0,69` моль.
4) Исходя из количества вещества гидроксокатионов бария, образовавшихся на первой стадии диссоциации, и степени диссоциации по второй ступени, вычислим количество ионов `”Ba”(“OH”)^+`, диссоциирующих по второй ступени:
`nu(“Ba”(“OH”)^+)=(alpha_2(“Ba”(“OH”)_2)*nu(“Ba”(“OH”)^+))/(100%)=`
`=(56%*0,69 “моль”)/(100%)=0,386 “моль”`.
В соответствии с диссоциацией по `”II”` ступени, это количество вещества равно количеству вещества катионов `”Ba”^(2+)` и количеству ионов `”OH”^-`, образовавшихся по `”II”` ступени диссоциации:
`nu(“Ba”^(2+))=nu_2(“OH”^-)=nu_”дис”(“Ba(OH”)^+)=0,386` моль.
5) Найдём число катионов `”Ba”^(2+)`, образующихся при диссоциации:
`N(“Ba”^(2+))=nu(“Ba”^(2+))*N_A=0,386 “моль”*6,02*10^(23) “моль”^(-1)=`
`=2,324*10^(23)`.
6) Вычислим количество вещества гидроксид-ионов, образовавшихся на обеих стадиях диссоциации, и их число:
`nu(“OH”^-)=nu_1(“OH”^-)+nu_2(“OH”^-)=0,69 “моль”+0,386 “моль”=`
`=1,076″моль”`.
`N(“OH”^-)=nu(“OH”^-)*N_A=1,076 “моль”*6,02*10^(23) “моль”^(-1)=`
`=6,478*10^(23)`.
`N(“Ba”^(2+))=2,324*10^(23)”моль”^(-1)`.
`N(“OH”^-)=6,478*10^(23)`.