Как правильно рассчитать константу диссоциации слабого электролита
Задача 94.
Концентрация ионов Н+ в 0,1 М растворе СН3СООН равна 1,3 · 10–3 моль/дм3. Вычислите константу и степень диссоциации кислоты.
Решение:
СМ(СН3СООН) = 0,1 моль/дм3;
[H+] = 1,3 · 10–3 моль/дм3;
KD(CH3COOH) = ?
α = ?
1. Вычисление степень диссоциации уксусной кислоты
Для расчета будем использовать формулу: [H+] = СМ · α
Тогда
α = [H+]/CM(CH3COOH) = (1,3 · 10–3)/0,1 = 1,3 · 10–2 или 1,3%.
2. Вычисление константы диссоциации уксусной кислоты
В случае слабых электролитов константа диссоциации определяется по формуле:
KD = (αCM · αCM)/CM(1 – α) = α2CM/(1 – α).
Тогда
KD(СН3СООН) = [(α)2 · СМ(СН3СООН)]/(1 – α) = [(1,3 · 10–2)2 · 0,1]/(1 – 1,3 · 10–2) =
= 0,0000169/0,987 = 0,0000171 = 1,71 · 10–5.
Ответ: KD(СН3СООН) = 1,71 · 10–5; альфа = 1,3%.
Задача 95.
Вычислите константу диссоциации НСООН, если в растворе w% = 0,46% и она диссоциирована на 4,2%.
Решение:
М(НСООН) = 46 г/моль;
w% = 0,46%;
α = 4,2% или 0,042
KD(НСООН) = ?
1. Вычисление концентрацию муравьиной кислоты
Концентрацию кислоты находим из вычисления:
СМ(НСООН) = [(w% · 1000г)/100%]/M(НСООН); СМ(НСООН) = [(0,46% · 1000г)/100%]/46 г/моль = 0,1 моль/дм3.
2. Вычисление константы диссоциации НСООН
В случае слабых электролитов константа диссоциации определяется по формуле:
KD = (αCM · αCM)/CM(1 – α) = α2CM/(1 – α).
Тогда
KD(НСООН) = [(0,042)2 · 0,1]/(1 – 0,042) = 0,0001764/0,958 = 0,000184 или 1,84 · 10–4.
Ответ: KD(НСООН) = 1,84 · 10–4.
Задача 96.
Вычислите константу диссоциации диметиламина, если в 0,2 М растворе он диссоциирован на 7,42%.
Решение:
M[(CH3)2NH] = 45,08 г/моль;
CM[(CH3)2NH] = 0,2 М;
α = 7,42% или 0,0742.
1. Вычисление константы диссоциации (CH3)2NH
В случае слабых электролитов константа диссоциации определяется по формуле:
KD = (αCM · αCM)/CM(1 – α) = α2CM/(1 – α).
Тогда
KD[(CH3)2NH] = [(0,0742)2 · 0,2]/(1 – 0,0742) = 0,0011/0,9258 = 0,0012 или 1,20 · 10–3.
Ответ: KD[(CH3)2NH] = 1,20 · 10–3.
Задача 97.
Концентрация ионов Н+ в 0,2 М растворе C2H5COOH равна 1,2 · 10–2 моль/дм3. Вычислите константу и степень диссоциации кислоты.
Решение:
СМ(C2H5COOH) = 0,2 моль/дм3;
[H+] = 1,2 · 10–2 моль/дм3;
KD(C2H5COOH) = ?
α = ?
1. Вычисление степень диссоциации этановой кислоты
Для расчета будем использовать формулу: [H+] = СМ · α
Тогда
α = [H+]/CM(C2H5COOH) = (1,2 · 10–2)/0,2 = 6,0 · 10–2 или 6%.
2. Вычисление константы диссоциации этановой кислоты
В случае слабых электролитов константа диссоциации определяется по формуле:
KD = (αCM · αCM)/CM(1 – α) = α2CM/(1 – α).
Тогда
KD(C2H5COOH) = [(α)2 · СМ(СН3СООН)]/(1 – α) = [(6,0 · 10–2)2 · 0,2]/(1 – 6,0 · 10–2) = 0,00072/0,94 = 0,0000171 = 7,7 · 10-4.
Ответ: KD(C2H5COOH) = 7,7 · 10-4; α = 0,06%.
Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Степень диссоциации
Классификация электролитов
Диссоциация электролитов
Константа диссоциации
Примеры решения задач
Задачи для самостоятельного решения
Степень диссоциации
Вещества, которые в растворах или расплавах полностью или частично распадаются на ионы, называются электролитами.
Степень диссоциации α — это отношение числа молекул, распавшихся на ионы N′ к общему числу растворенных молекул N:
α = N′/N
Степень диссоциации выражают в процентах или в долях единицы. Если α =0, то диссоциация отсутствует и вещество не является электролитом. В случае если α =1, то электролит полностью распадается на ионы.
Классификация электролитов
Согласно современным представлениям теории растворов все электролиты делятся на два класса: ассоциированные (слабые) и неассоциированные (сильные). Неассоциированные электролиты в разбавленных растворах практически полностью диссоциированы на ионы. Для этого класса электролитов a близко к единице (к 100 %). Неассоциированными электролитами являются, например, HCl, NaOH, K2SO4 в разбавленных водных растворах.
Ассоциированные электролиты подразделяются на три типа:
-
-
- Слабые электролиты существуют в растворах как в виде ионов, так и в виде недиссоциированных молекул. Примерами ассоциированных электролитов этой группы являются, в частности, Н2S, Н2SO3, СН3СOОН в водных растворах.
- Ионные ассоциатыобразуются в растворах путем ассоциации простых ионов за счет электростатического взаимодействия. Ионные ассоциаты возникают в концентрированных растворах хорошо растворимых электролитов. В результате в растворе находятся как простые ионы, так и ионные ассоциаты. Например, в концентрированном водном растворе КCl образуются простые ионы К+, Cl— , а также возможно образование ионных пар (К+Cl— ), ионных тройников (K2Cl+, KCl2— ) и ионных квадруполей (K2Cl2, KCl32- , K3Cl2+).
- Комплексные соединения(как ионные, так и молекулярные), внутренняя сфера которых ступенчато диссоциирует на ионные и (или) молекулярные частицы.
Примеры комплексных ионов: [Cu(NH3)4]2+, [Fe(CN)6]3+, [Cr(H2O)3Cl2]+.
-
При таком подходе один и тот же электролит может относиться к различным типам в зависимости от концентрации раствора, вида растворителя и температуры. Подтверждением этому являются данные, приведенные в таблице.
Таблица. Характеристика растворов KI в различных растворителях
| Концентрация электролита, С, моль/л | Температура
t,оС |
Растворитель | Тип электролита |
| 0,01 | 25 | Н2О | Неассоциированный (сильный) |
| 5 | 25 | Н2О | Ионный ассоциат |
| 0,001 | 25 | С6Н6 | Ассоциированный (слабый) |
Приближенно, для качественных рассуждений можно пользоваться устаревшим делением электролитов на сильные и слабые. Выделение группы электролитов “средней силы” не имеет смысла. Эти электролиты являются ассоциированными. К слабым электролитам обычно относят электролиты, степень диссоцииации которых мала α<<1.
Таким образом, к сильным электролитам относятся разбавленные водные растворы почти всех хорошо растворимых в воде солей, многие разбавленные водные растворы минеральных кислот (НСl, HBr, НNО3, НСlO4 и др.), разбавленные водные растворы гидроксидов щелочных металлов. К слабым электролитам принадлежат все органические кислоты в водных растворах, некоторые водные растворы неорганических кислот, например, H2S, HCN, H2CO3, HNO2, HСlO и др. К слабым электролитам относится и вода.
Диссоциация электролитов
Уравнение реакции диссоциации сильного электролита можно представить следующим образом. Между правой и левой частями уравнения реакции диссоциации сильного электролита ставится стрелка или знак равенства:
HCl → H+ + Cl—
Na2SO3 = 2Na+ + SO32-
Допускается также ставить знак обратимости, однако в этом случае указывается направление, в котором смещается равновесие диссоциации, или указывается, что α≈1. Например:
NaOH → Na+ + OH—
Диссоциация кислых и основных солей в разбавленных водных растворах протекает следующим образом:
NaHSO3 → Na+ + HSO3—
Анион кислой соли будет диссоциировать в незначительной степени, поскольку является ассоциированным электролитом:
HSO3— → H+ + SO32-
Аналогичным образом происходит диссоциация основных солей:
Mg(OH)Cl → MgOH+ + Cl—
Катион основной соли подвергается дальнейшей диссоциации как слабый электролит:
MgOH+ → Mg2+ + OH—
Двойные соли в разбавленных водных растворах рассматриваются как неассоциированные электролиты:
KAl(SO4)2 → K+ + Al3+ + 2SO42-
Комплексные соединения в разбавленных водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы:
K3[Fe(CN)6] → 3K+ + [Fe(CN)6]3-
В свою очередь, комплексный ион в незначительной степени подвергается дальнейшей диссоциации:
[Fe(CN)6]3- → Fe3+ + 6CN—
Константа диссоциации
При растворении слабого электролита КА в растворе установится равновесие:
КА ↔ К+ + А—
которое количественно описывается величиной константы равновесия Кд, называемой константой диссоциации:
Kд = [К+] · [А—] /[КА] (2)
Константа диссоциации характеризует способность электролита диссоциировать на ионы. Чем больше константа диссоциации, тем больше ионов в растворе слабого электролита. Например, в растворе азотистой кислоты HNO2 ионов Н+ больше, чем в растворе синильной кислоты HCN, поскольку К(HNO2) = 4,6·10— 4, а К(HCN) = 4,9·10— 10.
Для слабых I-I электролитов (HCN, HNO2, CH3COOH) величина константы диссоциации Кд связана со степенью диссоциации α и концентрацией электролита c уравнением Оствальда:
Кд = (α2·с)/(1-α) (3)
Для практических расчетов при условии, что α<<1 используется приближенное уравнение:
Кд = α2·с (4)
Поскольку процесс диссоциации слабого электролита обратим, то к нему применим принцип Ле Шателье. В частности, добавление CH3COONa к водному раствору CH3COOH вызовет подавление собственной диссоциации уксусной кислоты и уменьшение концентрации протонов. Таким образом, добавление в раствор ассоциированного электролита веществ, содержащих одноименные ионы, уменьшает его степень диссоциации.
Следует отметить, что константа диссоциации слабого электролита связана с изменением энергии Гиббса в процессе диссоциации этого электролита соотношением:
ΔGT0 = — RTlnKд (5)
Уравнение (5) используется для расчета констант диссоциации слабых электролитов по термодинамическим данным.
Примеры решения задач
Задача 1. Определите концентрацию ионов калия и фосфат-ионов в 0,025 М растворе K3PO4.
Решение. K3PO4 – сильный электролит и в водном растворе диссоциирует полностью:
K3PO4 → 3К+ + РО43-
Следовательно, концентрации ионов К+ и РО43- равны соответственно 0,075М и 0,025М.
Задача 2. Определите степень диссоциации αд и концентрацию ионов ОН— (моль/л) в 0,03 М растворе NH3·H2О при 298 К, если при указанной температуре Кд(NH3·H2О) = 1,76× 10— 5.
Решение. Уравнение диссоциации электролита:
NH3·H2О → NH4+ + OH—
Концентрации ионов: [NH4+] = αС ; [OH—] = αС , где С – исходная концентрация NH3·H2О моль/л. Следовательно:
Kд = αС · αС /(1 — αС)
Поскольку α << 1, то:
Кд ≈ α 2С
Константа диссоциации зависит от температуры и от природы растворителя, но не зависит от концентрации растворов NH3·H2О. Закон разбавления Оствальда выражает зависимость α слабого электролита от концентрации.
α = √(Кд / С) = √(1,76× 10— 5 / 0,03) = 0,024 или 2,4 %
[OH—] = αС, откуда [OH— ] = 2,4·10— 2·0,03 = 7,2·10-4 моль/л.
Задача 3. Определите константу диссоциации уксусной кислоты, если степень диссоциации CH3CОOH в 0,002 М растворе равна 9,4 %.
Решение. Уравнение диссоциации кислоты:
CH3CОOH → СН3СОО— + Н+.
α = [Н+] / Сисх(CH3CОOH)
откуда [Н+] = 9,4·10—2·0,002 = 1,88·10-4 М.
Так как [CH3CОO—] = [Н+] и [CH3CОOH] ≈ Сисх(CH3CОOH), то:
Kд = [Н+]2 / Сисх(CH3CОOH)
Константу диссоциации можно также найти по формуле: Кд ≈ α 2С.
Задача 4. Константа диссоциации HNO2 при 298К равна 4,6× 10— 4. Найдите концентрацию азотистой кислоты, при которой степень диссоциации HNO2 равна 5 %.
Решение.
Кд =α 2С , откуда получаем Сисх(HNO2) = 4,6·10— 4/(5·10— 2)2 = 0,184 М.
Задача 5. На основе справочных данных рассчитайте константу диссоциации муравьиной кислоты при 298 К.
Решение. Уравнение диссоциации муравьиной кислоты
НСООН →Н+ + СООН—
В “Кратком справочнике физико–химических величин” под редакцией А.А. Равделя и А.М. Пономаревой приведены значения энергий Гиббса образований ионов в растворе, а также гипотетически недиссоциированных молекул. Значения энергий Гиббса для муравьиной кислоты и ионов Н+ и СООН— в водном растворе приведены ниже:
| Вещество, ион | НСООН | Н+ | СООН— |
| ΔGT0, кДж/моль | — 373,0 | 0 | — 351,5 |
Изменение энергии Гиббса процесса диссоциации равно:
ΔGT0 = — 351,5- (- 373,0) = 21,5 кДж/моль.
Для расчета константы диссоциации используем уравнение (5). Из этого уравнения получаем:
lnKд = — Δ GT0/RT= — 21500/(8,31 298) = — 8,68
Откуда находим: Kд = 1,7× 10— 4.
Задачи для самостоятельного решения
1. К сильным электролитам в разбавленных водных растворах относятся:
- СН3СOOH
- Na3PO4
- NaCN
- NH3
- C2H5OH
- HNO2
- HNO3
13.2. К слабым электролитам в водных растворах относятся:
- KAl(SO4)2
- NaNO3
- HCN
- NH4Cl
- C2H5OH
- H2SO3
- H2SO4
3. Определите концентрацию ионов NH4+ в 0,03 М растворе (NH4)2Fe(SO4)2;
4. Определите концентрацию ионов водорода в 6 мас.% растворе H2SO4, плотность которого составляет 1,038 г/мл. Принять степень диссоциации кислоты по первой и второй ступеням равной 100 %.
5. Определите концентрацию гидроксид-ионов в 0,15 М растворе Ba(OH)2.
6. Степень диссоциации муравьиной кислоты в 0,1 М растворе равна 4 %. Рассчитайте Концентрацию ионов водорода в этом растворе и константу диссоциации НСООН.
7. Степень диссоциации муравьиной кислоты в водном растворе увеличится при:
а) уменьшении концентрации HCOOH;
б) увеличении концентрации HCOOH;
в) добавлении в раствор муравьиной кислоты HCOONa;
г) добавлении в раствор муравьиной кислоты НCl.
8. Константа диссоциации хлорноватистой кислоты равна 5× 10— 8. Определите концентрацию HClO, при которой степень диссоциации HClO равна 0,5 %, и концентрацию ионов Н+ в этом растворе.
9. Вычислите объем воды, который необходимо добавить к 50 мл 0,02 М раствора NH3·H2О, чтобы степень диссоциации NH3·H2О увеличилась в 10 раз, если Кд(NH4OH) = 1,76·10— 5.
10. Определите степень диссоциации азотистой кислоты в 0,25 М растворе при 298 К, если при указанной температуре Кд(HNO2) = 4,6× 10— 4.
Характер ионов,
образующихся при диссоциации разных
электролитов, должен быть различен. В
молекулах солей диссоциация всегда
идет с образованием положительных ионов
металла и отрицательно заряженных ионов
кислотного остатка.
Соли
могут быть определены как соединения,
дающие в водном растворе ионы металла
и кислотного остатка
KNO3
↔
K+
+
NO3–;
Na2SO4
↔
2Na+
+
SO42–;
MgCl2
↔
Mg2+
+
2Cl–;
MgSO4
↔
Mg2+
+
SO42–
При растворении
кислых солей
в растворе образуются катионы металла
и сложные анионы кислотного остатка, а
также ионы, являющиеся продуктами
диссоциации этого сложного кислотного
остатка, в том числе H+.
Например:
NaHCO3
↔ Na+
+ HCO3–;
HCO3–
↔ H+
+ CO32–
При диссоциации
основных
солей
образуются анионы кислотного остатка
и сложные катионы, состоящие из металла
и гидроксогрупп. Эти сложные катионы
также способны к диссоциации. Поэтому
в растворе основной соли присутствуют
OH–:
MgOHCl
↔ MgOH+
+ Cl–;
MgOH+
↔ Mg2+
+ OH–
Основания
можно определить как соединения, дающие
в водном растворе анионы гидроксила и
катионы металла:
NaOH ↔
Na+
+
OH–;
Ba(OH)2
↔
Ba2+
+
2 OH–
Кислотами
называются соединения, дающие в водных
растворах ионы водорода (точнее ионы
гидроксония) и анионы кислотного остатка
HNO3
↔
H+
+
NO3–;
H2SO4
↔
2H+
+
SO4–
Характер
электролитической диссоциации той или
иной молекулы в значительной степени
определяется полярностями ее валентных
связей. Полярность связи водорода с
кислородом в соединениях типа ROH
существенно меняется в зависимости от
химической природы радикала R.
Если радикал характеризуется сильно
выраженными металлическими свойствами,
связь между ним и О резко полярна, связь
же О−Н в этом случае малополярна.
Наоборот, если R
обладает резко выраженными неметаллическими
свойствами, связи между ним и О малополярна,
связь же О−Н резко полярна.
Таким образом,
диссоциация соединений типа ROH
может происходить по двум направлениям:
R





O
H
Некоторые соединения,
способные при одних и тех же условиях
отщеплять и ионы водорода и ионы
гидроксила, называются амфотерными.
К амфотерным электролитам относятся
Zn(OH)2,
Al(OH)3,
Cr(OH)3
и др.
Простейшим
амфотерным соединением является вода,
дающая при диссоциации ионы H+
и OH–.
Однако диссоциация воды настолько мала,
что концентрация H+
и ОН–
в чистой воде равна 10-7
г-ион/л. Опыт показывает, что содержание
ионов в воде с течением времени не
изменяется. Следовательно, наряду с
процессом распада (диссоциации) имеет
место и обратный – образование из ионов
недиссоциированных молекул (моляризация).
Таким образом, электролитическая
диссоциация есть процесс
обратимый.
4. Степень диссоциации электролита. Закон разбавления Оствальда
Количественную
характеристику равновесного состояния
электролита дает его степень
диссоциации
(a),
т.е. отношение числа молекул, распавшихся
на ионы, к общему числу растворенных
молекул.
a
= n
/ N
a
измеряется в % (долях). N
– общее число молекул в растворе, n
– число диссоциированных молекул.
Степень диссоциации
электролита зависит от ряда факторов,
среди которых:
-
природа
электролита; -
природа
растворителя; -
температура;
-
концентрация
раствора; -
присутствие
одноименных ионов.
Природа электролита
– главный фактор, определяющий степень
диссоциации. Чем более полярной является
химическая связь между атомами или
группами атомов в молекуле, тем сильнее
растворитель с высоким значением
диэлектрической проницаемости
препятствует электростатическому
взаимодействию ионов противоположного
знака в растворе, тем больше степень
диссоциации.
Природа растворителя
также оказывает существенное влияние
на степень диссоциации растворённого
вещества. Степень диссоциации в
значительной мере зависит от диэлектрической
проницаемости растворителя. Диэлектрическая
проницаемость (ξ) показывает, во сколько
раз сила взаимодействия между двумя
зарядами в данной среде меньше, чем в
вакууме. Чем больше диэлектрическая
проницаемость среды, тем больше степень
электролитической диссоциации. Самое
высокое значение ξ=81 имеет вода. Замена
воды на растворитель с меньшей
диэлектрической проницаемостью,
например, на этиловый спирт (ξ=25), сильно
понижает степень диcсоциации. Сильные
электролиты в спирте становятся
электролитами средней силы, а слабые –
практически не диссоциируют.
В общем случае
степень электролитической диссоциации
сложным образом зависит от температуры.
Для многих электролитов существует
достаточно широкий температурный
интервал, в котором наблюдается простая
зависимость между тепловым эффектом,
степенью диссоциации и температурой.
Если процесс диссоциации экзотермичен,
то с повышением температуры степень
диссоциации падает. При эндотермическом
процессе – повышение температуры ведёт
к увеличению степени диссоциации. Так,
степень диссоциации воды растёт с
увеличением температуры. При 18 °С степень
диссоциации воды равна 1,5∙10–9,
а при 100 °С – 1,5∙10–8.
Для каждого электролита существуют
температурные условия, в которых он
диcсоциирует в большей степени. Так,
степень диссоциации уксусной кислоты
максимальна при 25 °С (Кд
= 1,75∙10–5).
Выше и ниже этой температуры степень
диссоциации уксусной кислоты меньше (
при 0 °С Кд
= 1,65∙10–5,
а при 50 °С Кд
= 1,62∙10–5).
Отсутствие чёткой зависимости степени
диссоциации от температуры объясняется
неравномерным изменением энтальпии
гидратации, состава ионов, свойств
растворителя и других с изменением
температуры.
Изменение
концентрации
раствора будет различно отражаться на
процессах диссоциации и моляризации.
Степень диссоциации электролита при
разбавлении раствора увеличивается.
Все электролиты
в зависимости от степени диссоциации
делятся на сильные, средней силы и
слабые. Электролиты, диссоциированные
при указанных условиях на 30 % и больше,
называют сильными; диссоциированные
на 5÷30%, – электролитами средней силы,
еще менее диссоциированные – слабыми
электролитами.
Все соли являются
сильными электролитами. К сильным
электролитам принадлежат следующие
кислоты: HNO3,
HClO4,
HClO3,
H2SO4,
HCl,
HBr,
HI,
HMnO4.
К слабым кислотам относятся все
органические кислоты, а также H2CO3,
H2S,
HCN,
H2SiO3
и некоторые другие. К сильным основаниям
относятся KOH,
NaOH,
Ca(OH)2,
Ba(OH)2.
К слабым основаниям принадлежат NH4OH,
Al(OH)3,
Zn(OH)2,
Mg(OH)2,
Cu(OH)2
и др.
В растворах слабых
электролитов процесс диссоциации
молекул на ионы обратим. Поэтому к ним,
как к равновесным системам, приложим
закон действия масс. Например, для
диссоциации уксусной кислоты в водном
растворе CH3COOH![]() H++CH3COO–.
H++CH3COO–.
Константа равновесия
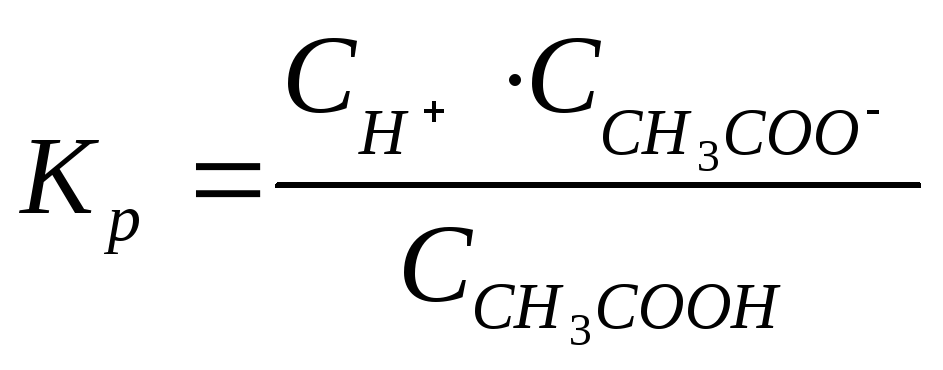 называется
называется
константой диссоциации (Кд).
Чем меньше Кд,
тем слабее электролит проявляет
способность к диссоциации. Если молекула
слабого электролита может диссоциировать
на два и на большее число ионов, то
диссоциация проходит по стадиям
(ступенчатая диссоциация). При этом
каждая стадия характеризуется своей
константой диссоциации. Например, H3PO4
диссоциирует по уравнениям
H3PO4
↔ H+
+ H2PO4– K1
H2PO4–
↔ H+
+ HPO42–
K2
HPO42–
↔ H+
+ PO43–
K3
Значение констант
изменяется в ряду К1
> К2
> К3.
Это положение имеет общее значение,
т.к. отщепление второго и третьего ионов
водорода требует большей энергии
(приложение, табл. 1).
Константа
полной диссоциации слабого электролита
равна произведению констант его
диссоциации по ступеням.
Например, для
H2CO3
Kд
= K1K2
= 4,7∙10–11∙
4,5∙10-7
= 2,1∙10-17
Константа диссоциации
слабого электролита связана со степенью
диссоциации. Обозначим: С – исходная
концентрация электролита, α – степень
диссоциации. Тогда концентрация ионов
в состоянии равновесия для бинарного
электролита Сα.
Концентрация недиссоциированных молекул
будет
(С – С∙α) = С (1–α).
Константу диссоциации
для уксусной кислоты можно представить
следующим образом:
![]() закон разведения
закон разведения
Оствальда.
В слабых электролитах
величина α << 1. Поэтому значением α
можно пренебречь и величину (1-α) принять
равной 1. Тогда K=Cα2,
![]()
т.е. степень диссоциации слабых
электролитов обратно пропорциональна
квадратному корню из концентрации.
Таким образом,
закон
разбавления Оствальда
формулируется следующим образом: степень
диссоциации электролита при разбавлении
раствора увеличивается.
При прибавлении
в раствор слабой кислоты или основания
соли, содержащей одноимённый
анион или катион
для кислоты или основания соответственно,
то согласно принципу Ле-Шателье, следует
ожидать смещения равновесия диссоциации
влево, т.е. в сторону уменьшения степени
диссоциации. Так, если к раствору уксусной
кислоты добавить немного ацетата натрия,
то добавленные ацетат-ионы смещают
равновесие диссоциации кислоты
СН3СООН
↔ CH3COO
– + H+
влево и степень
диссоциации уксусной кислоты уменьшается.
Об этом свидетельствуют приведенные
ниже данные:
[СН3СООNa],
моль/л 0,0 0,001 0,002 0,005 0,010 0,020
α
СН3СООН,
% 4,1 1,5 0,84 0,35 0,18 0,09
Подавление
диссоциации под влиянием одноимённого
иона называется “репрессией ионизации”.
С репрессией ионизации связаны многие
процессы, имеющие практическое значение.
Так, её используют для уменьшения
растворимости тех или иных соединений.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Определите pH кислоты (0,17 нормальной уксусной кислоты (CH3COOH)), константа диссоциации которой равна 1,75 ⋅ 10-5.
Решение задачи
Константа и степень диссоциации слабого электролита связаны между собой соотношением:
![]()
где:
α – степень диссоциации;
K – константа диссоциации;
C– общая концентрация электролита.
Определить pH кислоты
Получаем:
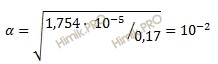
Определяем концентрацию ионов водорода [H+]:
[H+] = 0,17 ⋅ 1 ⋅ 10-2 = 0,17 ⋅ 10-2 (моль/л).
Определим pH кислоты (CH3COOH) по формуле:
![]()
Водородный показатель (pH) раствора численно равен отрицательному десятичному логарифму концентрации ионов водорода в этом растворе.
Получаем:
pH (CH3COOH) = -lg 0,17 ⋅ 10-2 = 2,77.
Ответ:
водородный показатель раствора 2,77.
