Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 28 декабря 2018 года; проверки требуют 24 правки.
Степень диссоциации — величина, характеризующая состояние равновесия в реакции диссоциации в (однородных)[1] системах.
Определение[править | править код]
Степень диссоциации равна отношению продиссоциированных молекул вещества 

Степень диссоциации зависит как от природы растворённого электролита, так и от концентрации раствора.
Пример. Для уксусной кислоты CH3COOH величина 
М растворе). Это значит, что в водном растворе кислоты лишь 4 из каждых 100 молекул диссоциированы, то есть находятся в виде ионов Н+ и СН3СОО−, остальные же 96 молекул не диссоциированы. Как видно в таком примере, количества частиц, о которых идёт речь в определении степени диссоциации (они же концентрации при условии единичного объёма) – это равновесные количества (концентрации соответственно).
Экспериментальные методы[править | править код]
Степень диссоциации определяется:
- по электропроводности раствора
- по понижению температуры замерзания
Мнимая степень электрической диссоциации[править | править код]
Поскольку сильные электролиты диссоциируют практически полностью, можно было бы ожидать для них изотонический коэффициент, равный количеству ионов (или поляризованных атомов) в формульной единице (молекуле). Однако в действительности этот коэффициент всегда меньше определённого по формуле (например, изотонический коэффициент для 0,05-молярного раствора NaCl равен i = 1,9 вместо 2,0, а (для раствора сульфата магния той же концентрации вовсе i = 1,3). Это объясняет теория сильных электролитов, разработанная в 1923 году П. Дебаем и Э. Хюккелем: передвижение ионов в растворе затруднено образовавшейся оболочкой сольватации. К тому же, ионы взаимодействуют и между собой: разноимённо заряженные притягиваются, а одноимённо заряженные — отталкиваются; силы взаимного притяжения приводят к образованию групп ионов, перемещающихся по раствору совместно. Такие группы называют ионными ассоциатами или ионными па́рами. Соответственно, раствор ведёт себя так, будто содержит меньше частиц, чем на самом деле, ведь свобода их перемещения ограничена. Наиболее очевиден пример, касающийся электропроводности растворов 

,
где 

Связь с константой диссоциации[править | править код]
Из закона разбавления Оствальда следует:


Зависимость степени диссоциации 

при малых значениях 


|

|

|
|---|---|---|
| 100% | 0.61803398875 | 61.803398875% |
| 50% | 0.2807 | 39.04% |
| 40% | 0.2198 | 32.79% |
| 30% | 0.1612 | 25.84% |
| 20% | 0.1050 | 18.10% |
| 15% | 0.0778 | 13.92% |
| 10% | 0.0512 | 9.51% |
| 5% | 0.0225 | 4.88% |
| x | 0.5*x + 0.1184*x^2 | 
|
для диссоциации вида AnBm = nA + mB
![{displaystyle alpha ={sqrt[{n+m}]{Kcdot (1-alpha ) over n^{n}m^{m}C^{n+m-1}}} {overset {underset {mathrm {alpha <<1} }{}}{approx }} {sqrt[{n+m}]{K over n^{n}m^{m}C^{n+m-1}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9e2661fda430566fea8f53b201b3921272c8a483)
Поскольку диссоциация описывается постадийно, данная формула не применяется.
См. также[править | править код]
- Закон разбавления Оствальда
- Константа диссоциации
Примечания[править | править код]
- ↑ Stray Kids // Википедия. — 2023-02-28.
Литература[править | править код]
- Глинка Н. Л. Общая химия — 24-е издание, исправленное. М. 1985. с. 228.
Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Степень диссоциации
Классификация электролитов
Диссоциация электролитов
Константа диссоциации
Примеры решения задач
Задачи для самостоятельного решения
Степень диссоциации
Вещества, которые в растворах или расплавах полностью или частично распадаются на ионы, называются электролитами.
Степень диссоциации α — это отношение числа молекул, распавшихся на ионы N′ к общему числу растворенных молекул N:
α = N′/N
Степень диссоциации выражают в процентах или в долях единицы. Если α =0, то диссоциация отсутствует и вещество не является электролитом. В случае если α =1, то электролит полностью распадается на ионы.
Классификация электролитов
Согласно современным представлениям теории растворов все электролиты делятся на два класса: ассоциированные (слабые) и неассоциированные (сильные). Неассоциированные электролиты в разбавленных растворах практически полностью диссоциированы на ионы. Для этого класса электролитов a близко к единице (к 100 %). Неассоциированными электролитами являются, например, HCl, NaOH, K2SO4 в разбавленных водных растворах.
Ассоциированные электролиты подразделяются на три типа:
-
-
- Слабые электролиты существуют в растворах как в виде ионов, так и в виде недиссоциированных молекул. Примерами ассоциированных электролитов этой группы являются, в частности, Н2S, Н2SO3, СН3СOОН в водных растворах.
- Ионные ассоциатыобразуются в растворах путем ассоциации простых ионов за счет электростатического взаимодействия. Ионные ассоциаты возникают в концентрированных растворах хорошо растворимых электролитов. В результате в растворе находятся как простые ионы, так и ионные ассоциаты. Например, в концентрированном водном растворе КCl образуются простые ионы К+, Cl— , а также возможно образование ионных пар (К+Cl— ), ионных тройников (K2Cl+, KCl2— ) и ионных квадруполей (K2Cl2, KCl32- , K3Cl2+).
- Комплексные соединения(как ионные, так и молекулярные), внутренняя сфера которых ступенчато диссоциирует на ионные и (или) молекулярные частицы.
Примеры комплексных ионов: [Cu(NH3)4]2+, [Fe(CN)6]3+, [Cr(H2O)3Cl2]+.
-
При таком подходе один и тот же электролит может относиться к различным типам в зависимости от концентрации раствора, вида растворителя и температуры. Подтверждением этому являются данные, приведенные в таблице.
Таблица. Характеристика растворов KI в различных растворителях
| Концентрация электролита, С, моль/л | Температура
t,оС |
Растворитель | Тип электролита |
| 0,01 | 25 | Н2О | Неассоциированный (сильный) |
| 5 | 25 | Н2О | Ионный ассоциат |
| 0,001 | 25 | С6Н6 | Ассоциированный (слабый) |
Приближенно, для качественных рассуждений можно пользоваться устаревшим делением электролитов на сильные и слабые. Выделение группы электролитов “средней силы” не имеет смысла. Эти электролиты являются ассоциированными. К слабым электролитам обычно относят электролиты, степень диссоцииации которых мала α<<1.
Таким образом, к сильным электролитам относятся разбавленные водные растворы почти всех хорошо растворимых в воде солей, многие разбавленные водные растворы минеральных кислот (НСl, HBr, НNО3, НСlO4 и др.), разбавленные водные растворы гидроксидов щелочных металлов. К слабым электролитам принадлежат все органические кислоты в водных растворах, некоторые водные растворы неорганических кислот, например, H2S, HCN, H2CO3, HNO2, HСlO и др. К слабым электролитам относится и вода.
Диссоциация электролитов
Уравнение реакции диссоциации сильного электролита можно представить следующим образом. Между правой и левой частями уравнения реакции диссоциации сильного электролита ставится стрелка или знак равенства:
HCl → H+ + Cl—
Na2SO3 = 2Na+ + SO32-
Допускается также ставить знак обратимости, однако в этом случае указывается направление, в котором смещается равновесие диссоциации, или указывается, что α≈1. Например:
NaOH → Na+ + OH—
Диссоциация кислых и основных солей в разбавленных водных растворах протекает следующим образом:
NaHSO3 → Na+ + HSO3—
Анион кислой соли будет диссоциировать в незначительной степени, поскольку является ассоциированным электролитом:
HSO3— → H+ + SO32-
Аналогичным образом происходит диссоциация основных солей:
Mg(OH)Cl → MgOH+ + Cl—
Катион основной соли подвергается дальнейшей диссоциации как слабый электролит:
MgOH+ → Mg2+ + OH—
Двойные соли в разбавленных водных растворах рассматриваются как неассоциированные электролиты:
KAl(SO4)2 → K+ + Al3+ + 2SO42-
Комплексные соединения в разбавленных водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы:
K3[Fe(CN)6] → 3K+ + [Fe(CN)6]3-
В свою очередь, комплексный ион в незначительной степени подвергается дальнейшей диссоциации:
[Fe(CN)6]3- → Fe3+ + 6CN—
Константа диссоциации
При растворении слабого электролита КА в растворе установится равновесие:
КА ↔ К+ + А—
которое количественно описывается величиной константы равновесия Кд, называемой константой диссоциации:
Kд = [К+] · [А—] /[КА] (2)
Константа диссоциации характеризует способность электролита диссоциировать на ионы. Чем больше константа диссоциации, тем больше ионов в растворе слабого электролита. Например, в растворе азотистой кислоты HNO2 ионов Н+ больше, чем в растворе синильной кислоты HCN, поскольку К(HNO2) = 4,6·10— 4, а К(HCN) = 4,9·10— 10.
Для слабых I-I электролитов (HCN, HNO2, CH3COOH) величина константы диссоциации Кд связана со степенью диссоциации α и концентрацией электролита c уравнением Оствальда:
Кд = (α2·с)/(1-α) (3)
Для практических расчетов при условии, что α<<1 используется приближенное уравнение:
Кд = α2·с (4)
Поскольку процесс диссоциации слабого электролита обратим, то к нему применим принцип Ле Шателье. В частности, добавление CH3COONa к водному раствору CH3COOH вызовет подавление собственной диссоциации уксусной кислоты и уменьшение концентрации протонов. Таким образом, добавление в раствор ассоциированного электролита веществ, содержащих одноименные ионы, уменьшает его степень диссоциации.
Следует отметить, что константа диссоциации слабого электролита связана с изменением энергии Гиббса в процессе диссоциации этого электролита соотношением:
ΔGT0 = — RTlnKд (5)
Уравнение (5) используется для расчета констант диссоциации слабых электролитов по термодинамическим данным.
Примеры решения задач
Задача 1. Определите концентрацию ионов калия и фосфат-ионов в 0,025 М растворе K3PO4.
Решение. K3PO4 – сильный электролит и в водном растворе диссоциирует полностью:
K3PO4 → 3К+ + РО43-
Следовательно, концентрации ионов К+ и РО43- равны соответственно 0,075М и 0,025М.
Задача 2. Определите степень диссоциации αд и концентрацию ионов ОН— (моль/л) в 0,03 М растворе NH3·H2О при 298 К, если при указанной температуре Кд(NH3·H2О) = 1,76× 10— 5.
Решение. Уравнение диссоциации электролита:
NH3·H2О → NH4+ + OH—
Концентрации ионов: [NH4+] = αС ; [OH—] = αС , где С – исходная концентрация NH3·H2О моль/л. Следовательно:
Kд = αС · αС /(1 — αС)
Поскольку α << 1, то:
Кд ≈ α 2С
Константа диссоциации зависит от температуры и от природы растворителя, но не зависит от концентрации растворов NH3·H2О. Закон разбавления Оствальда выражает зависимость α слабого электролита от концентрации.
α = √(Кд / С) = √(1,76× 10— 5 / 0,03) = 0,024 или 2,4 %
[OH—] = αС, откуда [OH— ] = 2,4·10— 2·0,03 = 7,2·10-4 моль/л.
Задача 3. Определите константу диссоциации уксусной кислоты, если степень диссоциации CH3CОOH в 0,002 М растворе равна 9,4 %.
Решение. Уравнение диссоциации кислоты:
CH3CОOH → СН3СОО— + Н+.
α = [Н+] / Сисх(CH3CОOH)
откуда [Н+] = 9,4·10—2·0,002 = 1,88·10-4 М.
Так как [CH3CОO—] = [Н+] и [CH3CОOH] ≈ Сисх(CH3CОOH), то:
Kд = [Н+]2 / Сисх(CH3CОOH)
Константу диссоциации можно также найти по формуле: Кд ≈ α 2С.
Задача 4. Константа диссоциации HNO2 при 298К равна 4,6× 10— 4. Найдите концентрацию азотистой кислоты, при которой степень диссоциации HNO2 равна 5 %.
Решение.
Кд =α 2С , откуда получаем Сисх(HNO2) = 4,6·10— 4/(5·10— 2)2 = 0,184 М.
Задача 5. На основе справочных данных рассчитайте константу диссоциации муравьиной кислоты при 298 К.
Решение. Уравнение диссоциации муравьиной кислоты
НСООН →Н+ + СООН—
В “Кратком справочнике физико–химических величин” под редакцией А.А. Равделя и А.М. Пономаревой приведены значения энергий Гиббса образований ионов в растворе, а также гипотетически недиссоциированных молекул. Значения энергий Гиббса для муравьиной кислоты и ионов Н+ и СООН— в водном растворе приведены ниже:
| Вещество, ион | НСООН | Н+ | СООН— |
| ΔGT0, кДж/моль | — 373,0 | 0 | — 351,5 |
Изменение энергии Гиббса процесса диссоциации равно:
ΔGT0 = — 351,5- (- 373,0) = 21,5 кДж/моль.
Для расчета константы диссоциации используем уравнение (5). Из этого уравнения получаем:
lnKд = — Δ GT0/RT= — 21500/(8,31 298) = — 8,68
Откуда находим: Kд = 1,7× 10— 4.
Задачи для самостоятельного решения
1. К сильным электролитам в разбавленных водных растворах относятся:
- СН3СOOH
- Na3PO4
- NaCN
- NH3
- C2H5OH
- HNO2
- HNO3
13.2. К слабым электролитам в водных растворах относятся:
- KAl(SO4)2
- NaNO3
- HCN
- NH4Cl
- C2H5OH
- H2SO3
- H2SO4
3. Определите концентрацию ионов NH4+ в 0,03 М растворе (NH4)2Fe(SO4)2;
4. Определите концентрацию ионов водорода в 6 мас.% растворе H2SO4, плотность которого составляет 1,038 г/мл. Принять степень диссоциации кислоты по первой и второй ступеням равной 100 %.
5. Определите концентрацию гидроксид-ионов в 0,15 М растворе Ba(OH)2.
6. Степень диссоциации муравьиной кислоты в 0,1 М растворе равна 4 %. Рассчитайте Концентрацию ионов водорода в этом растворе и константу диссоциации НСООН.
7. Степень диссоциации муравьиной кислоты в водном растворе увеличится при:
а) уменьшении концентрации HCOOH;
б) увеличении концентрации HCOOH;
в) добавлении в раствор муравьиной кислоты HCOONa;
г) добавлении в раствор муравьиной кислоты НCl.
8. Константа диссоциации хлорноватистой кислоты равна 5× 10— 8. Определите концентрацию HClO, при которой степень диссоциации HClO равна 0,5 %, и концентрацию ионов Н+ в этом растворе.
9. Вычислите объем воды, который необходимо добавить к 50 мл 0,02 М раствора NH3·H2О, чтобы степень диссоциации NH3·H2О увеличилась в 10 раз, если Кд(NH4OH) = 1,76·10— 5.
10. Определите степень диссоциации азотистой кислоты в 0,25 М растворе при 298 К, если при указанной температуре Кд(HNO2) = 4,6× 10— 4.
В растворах электролитов наряду с ионами присутствуют и молекулы. Поэтому растворы электролитов характеризуются степенью диссоциации, которую обозначают греческой буквой
α
(«альфа»).
Степень диссоциации — это отношение количества вещества электролита, распавшегося на ионы, к общему количеству растворённого вещества:
Степень диссоциации электролита определяют опытным путём и выражают в долях единицы или в процентах.
Электролиты имеют различную степень диссоциации, т. е. степень диссоциации зависит от природы электролита.
Она также зависит и от концентрации: с разбавлением раствора степень диссоциации увеличивается.
По степени электролитической диссоциации электролиты разделяют на сильные и слабые.
Сильные электролиты при растворении в воде практически полностью диссоциируют на ионы. У таких электролитов значение степени диссоциации стремится к единице в разбавленных растворах.
Пример:
к сильным электролитам относят:
1) практически все соли;
2) сильные кислоты, например: серную, соляную, азотную;
3) все щёлочи.
Слабые электролиты при растворении в воде почти не диссоциируют на ионы.
У таких электролитов значение степени диссоциации стремится к нулю.
Пример:
к слабым электролитам относят:
1) слабые кислоты, например: сероводородную, угольную, азотистую, сернистую;
2) водный раствор аммиака.
Слабые и сильные электролиты. Степень диссоциации
Электролитическая диссоциация в той или иной степени – процесс обратимый. Но при растворении некоторых соединений равновесие диссоциации в значительной степени смещено в сторону диссоциируемой формы. В растворах таких электролитов диссоциация протекает практически необратимо. Поэтому при написании уравнений диссоциации таких веществ пишется или знак равенства или прямая стрелка, обозначающая, что реакция происходит практически необратимо.
I. Степень электролитической диссоциации
Посмотрите видео-презентацию: “Степень электролитической диссоциации”
Поскольку электролитическая диссоциация – процесс обратимый, то в растворах электролитов наряду с их ионами присутствуют и молекулы. Другими словами, различные электролиты, согласно теории С. Аррениуса, диссоциируют на ионы в различной степени. Полнота распада (сила электролита) характеризуется количественной величиной – степенью диссоциации.
Степень диссоциации (α – греческая буква альфа) – это отношение числа молекул, распавшихся на ионы (n), к общему числу растворенных молекул (N):

Степень диссоциации электролита определяется опытным путем и выражается в долях единицы или в процентах. Если α = 0, то диссоциация отсутствует, а если α = 1 или 100%, то электролит полностью распадается на ионы. Если же α = 20%, то это означает, что из 100 молекул данного электролита 20 распалось на ионы.
Степень диссоциации зависит от природы электролита и растворителя, от концентрации электролита, температуры.
1. Зависимость степени диссоциации от природы: чем полярнее химическая связь в молекуле электролита и растворителя, тем сильнее выражен процесс диссоциации электролита на ионы и тем выше значение степени диссоциации.
2. Зависимость степени диссоциации от концентрации электролита: с уменьшением концентрации электролита, т.е. при разбавлении его водой, степень диссоциации всегда увеличивается.
3. Зависимость степени диссоциации от температуры: степень диссоциации возрастает при повышении температуры (повышение температуры приводит к увеличению кинетической энергии растворённых частиц, что способствует распаду молекул на ионы).
II. Сильные и слабые электролиты
В зависимости от степени диссоциации различают электролиты сильные и слабые. Электролиты со степенью диссоциации больше 30% обычно называют сильными, со степенью диссоциации от 3 до 30% — средними, менее 3% — слабыми электролитами.
Классификация электролитов в зависимости от степени электролитической диссоциации (памятка)
|
Классификация электролитов |
Сильные электролиты |
Средние электролиты |
Слабые электролиты |
|
Значение степени диссоциации (α) |
α>30% |
3%≤α≤30% |
α<3% |
|
Примеры |
1. Растворимые соли 2. Сильные кислоты: НСl, HBr, HI, НNО3, НClO4, Н2SO4(разб.) 3. Сильные основания – щёлочи |
H3PO4 H2SO3 |
1. Почти все органические кислоты CH3COOH, C2H5COOH и др. 2. Некоторые неорганические кислоты H2CO3, H2S и др. 3. Почти все малорастворимые в воде соли, основания и гидроксид аммония (Ca3(PO4)2; Cu(OH)2; Al(OH)3; NH4OH) 4. Вода |
Определение сильных и слабых электролитов
III. Тренажёр
“Сильные и слабые электролиты”
ЦОРы
Видео-презентация: “Степень электролитической диссоциации”
Видео:Зависимость степени диссоциации от концентрации электролита
Видео: Зависимость степени диссоциации от температуры
Определение сильных и слабых электролитов
-
Степень диссоциации. Сильные и слабые электролиты
Кроме
константы диссоциации силу электролита
можно определить по значению другого
параметра, зависящего от концентрации
раствора. Таким параметром является
кажущаяся
степень диссоциации
которая
показывает долю молекул распавшихся
на ионы.
Степень
диссоциации (
) – это отношение числа распавшихся на
ионы молекул (Nдис.)
к общему числу молекул растворенного
вещества (Nобщ.):
![]() (7.6.4.)
(7.6.4.)
Степень
диссоциации выражают в долях единицы
или в процентах. Поскольку общее число
молекул вещества в растворе пропорционально
количеству его вещества и его молярной
концентрации, то можно записать:
![]() (7.6.5.)
(7.6.5.)
где
nдис.
и cдис.
– соответственно, количество и молярная
концентрация растворенного вещества,
подвергшегося электролитической
диссоциации.
К
сильным электролитам условно относят
вещества, кажущаяся степень диссоциации
которых в растворе превышает 30% (
> 0,3). При
< 3% (
< 0,03) электролиты считают слабыми, в
других случаях о них говорят как об
электролитах средней силы.
Степень
диссоциации обычно определяют по данным
измерения электропроводности растворов,
которая прямо пропорциональна концентрации
свободно движущихся ионов. При этом
получают не истинные значения ,
а кажущиеся значения. Они всегда меньше
истинных значений ,
т.к. ионы при движении к электродам
сталкиваются и частично уменьшают свою
подвижность, особенно при высокой их
концентрации в растворе, когда возникает
электростатическое притяжение между
ионами. Например, истинное значение
степени электролитической диссоциации
HCl в разбавленном растворе равно 1, в 1 М
растворе
= 0,78 (78%) при 180
С, однако, в этом растворе не содержится
22% недиссоциированных молекул HCl,
практически все молекулы диссоциированы.
Электролиты,
которые в разбавленном водном растворе
диссоциируют практически полностью,
называют сильными электролитами.
К
сильным электролитам в водных растворах
принадлежат почти все соли, многие
неорганические кислоты (H2SO4,
HNO3,
HClO4,
галогеноводородные, кроме HF и др.),
гидроксиды s-элементов (исключение –
Be(OH)2
и Mg(OH)2).
Кажущиеся значения a этих электролитов
находятся в пределах от 70 до 100%. Диссоциация
сильных электролитов – это практически
необратимый процесс:
HCl
H+
+ Cl–
или HCl = H+
+ Cl–
С
точки зрения теории электролитической
диссоциации кислоты
– это вещества, диссоциирующие в водном
растворе с образованием катионов
водорода и анионов кислотного остатка,
основания – это вещества, диссоциирующие
в водном растворе с образованием
гидроксид-ионов OH–
и катионов металла.
Слабые
многоосновные кислоты диссоциируют
ступенчато. Каждую ступень характеризуют
своим значением константы диссоциации,
например:
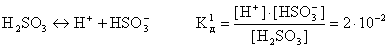

В
связи со ступенчатой диссоциацией
многоосновные
кислоты способны образовывать кислые
соли,
NaHSO4,
NaHCO3,
K2HPO4
и т.д.
Слабые
многокислотные основания диссоциируют
ступенчато:


![]()
Этим
объясняют способность
многокислотных оснований образовывать
основные соли:
CuOHCl, (ZnOH)2SO4
и др.
Электролиты,
которые в разбавленном водном растворе
диссоциируют частично, называют слабыми.
Диссоциация слабых электролитов –
обратимый процесс
например:
|
|
|
|
HCN |
7·10-5 |
|
|
0,013 |
Степень
электролитической диссоциации
зависит от:
-
природы
электролита и растворителя; -
концентрации
раствора; -
температуры
и
возрастает
при увеличении разбавления раствора:
|
C(CH3COOH) |
0,2 |
0,1 |
0,05 |
0,01 |
0,005 |
0,001 |
|
|
0,05 |
1,4 |
1,9 |
4,2 |
6,0 |
12,4 |
|
слабый |
электролит |
Степень
диссоциации возрастает при увеличении
температуры раствора. Увеличение
кинетической энергии растворенных
частиц способствует распаду молекул
на ионы, что приводит к возрастанию
степени диссоциации при нагревании
растворов.
Если
в растворе слабой кислоты или слабого
основания увеличить концентрацию
одноименного иона введением соответствующей
соли, то наблюдается резкое изменение
степени диссоциации слабого электролита.
Рассмотрим, например, как изменится
уксусной кислоты (CH3COOH) при введении в
раствор ацетата натрия (введение
одноименных ионов CH3COO-).
Согласно
принципу Ле Шателье равновесие процесса
диссоциации
![]()
сместится
влево в результате увеличения концентрации
ацетат-ионов CH3COO–,
образующихся при диссоциации ацетата
натрия:
CH3COONa
CH3COO–
+ Na+.
Такое
смещение равновесия в сторону образования
CH3COOH
означает уменьшение степени ее диссоциации
и приводит к уменьшению концентрации
ионов водорода, например:
|
C(CH3COOH), |
0,01 |
0,01 |
|
C(CH3COONa), |
0,01 |
|
|
[H+], |
4,32·0-4 |
1,86·10-5 |
Таким
образом, в результате введения в 1 л 0,01
М раствора CH3COOH
0,01 моль CH3COONa
концентрация ионов водорода уменьшилась
в
![]() .
.
С
точки зрения теории электролитической
диссоциации амфотерные
гидроксиды (амфолиты) – это вещества,
диссоциирующие в водном растворе как
по типу кислот, так и по типу оснований.
К ним относят Be(OH)2,
Zn(OH)2,
Pb(OH)2,
Sn(OH)2,
Al(OH)3,
Cr(OH)3,
и др. Например, уравнения электролитической
диссоциации Be(OH)2:
1)
диссоциация по типу основания:
Be(OH)2
+ 3H2O
OH–
+ [BeOH(H2O)3]
[BeOH(H2O)3]
+ H2O
OH–
+ [Be(H2O)4]
2)
диссоциация
по
типу
кислоты:
Be(OH)2
+ 2H2O
H+
+ [Be(OH)3H2O]
[Be(OH)2H2O]
H+
+ [Be(OH)3]
-
Закон
разведения Оствальда
Вильгельм
Фридрих Оствальд
(2.09.1853,—4.04.1932)—
балтийский
немец,
физико-химик и философ-идеалист,
лауреат Нобелевской
премии по химии
1909
года.
Член-корреспондент
Петербургской
АН
(1895).
Между константой и степенью
диссоциации существует определенная
закономерность, которую в 1888г.обнаружил В.Оствальд
и сумел ее объяснить. Эта закономерность
впоследствии была названа законом
разведения Оствальда.
Экспериментальное установление
правильности закона разбавления
Оствальда имело большое значение для
обоснования теории электролитической
диссоциации.
Kдсвязана спростой зависимостью. Если общую молярную
концентрацию электролита в растворе
обозначить СКА, то для бинарных
электролитов концентрации ионов Ky+и Ax-будут равны·CKA. Очевидно, что
[Ky+]
= [Ax-]
= ·CKA
,
[KA]
= CKA
– ·CKA
= CKA·(1-
), тогда
![]() (7.6.6.)
(7.6.6.)
Для
слабых электролитов
0 и (1 –
)
1. Следовательно,
 (7.6.7.)
(7.6.7.)
Полученная
зависимость является математическим
выражением закона
разбавления Оствальда:
степень
диссоциации слабого электролита
увеличивается при разбавлении раствора
обратно пропорционально корню квадратному
из его молярной концентрации.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #

