Электролиз расплавов
05-Апр-2013 | комментариев 14 | Лолита Окольнова
Мы уже рассматривали электролиз растворов солей, теперь давайте разберем электролиз расплавов веществ.
В этой лекции мы рассмотрим электролиз расплавов трех видов веществ:
- электролиз расплавов оксидов;
- электролиз расплавов оснований;
- электролиз расплавов солей.
Для запоминания катодных и анодных процессов в электрохимии существует следующее мнемоническое правило:
- У анода анионыокисляются.
- На катоде катионы восстанавливаются.
В первой строке все слова начинаются с гласной буквы, во второй — с согласной.
Или проще:
-
КАТод — КАТионы (ионы у катода)
-
АНод — АНионы (ионы у анода)
Электролиз расплавов оксидов
На катоде идет восстановление: Me n+ + ne— = Me0, т.е. на катоде выделяется металл.
На аноде окисляется кислород: O-2 -2e— = O2
Возьмем для примера электролиз расплава оксида калия: 2K2O -> 4K + O2
Электролиз расплавов оснований
На катоде традиционно восстанавливается металл:
Me n+ +ne— = Me0
На аноде будет окисляться кислород в составе гидроксид-группы:
4OH− −4e =2H2O + O2
Электролиз расплавов солей
1. Электролиз расплава бескислородной соли:
На катоде всегда восстанавливается металл: Me n+ +ne— = Me0
На аноде окисляется бескислородный анион: A n- — ne— = A0
Электролиз расплава NaCl: 2NaCl = 2Na + Cl2
2. Электролиз расплава кислородсодержащей соли (элемент аниона не в высшей степени окисления):
На катоде всегда восстанавливается металл: Me n+ +ne— = Me0
На аноде будет окисляться элемент аниона: SO3 2- — 2e— = SO3
Например, электролиз расплава сульфита натрия:
Na2SO3 = 2Na + SO3
S в сульфите имеет степень окисления +4, при электролизе она окисляется до +6 — SO3
3. Электролиз расплава кислородсодержащей соли (элемент аниона в высшей степени окисления):
На катоде все без изменений 🙂
На аноде — т.к. элемент уже в высшей степени окисления, то окисляться будет кислород:
2CO3-2 — 4e—= 2CO2 + O2
Например, электролиз расплава карбоната натрия:
2Na2CO3 = 4Na + 2CO2+ O2
Важно понимать, что эти реакции не идут сами по себе. Их протекание возможно только при действии электрического тока.
Обсуждение: “Электролиз расплавов”
(Правила комментирования)
План урока:
Гидролиз
Электролиз
Виды электродов
Значение электролиза
Гидролиз
Гидролиз – процесс распада молекул под действием молекул воды. Гидролизу подвергаются соли. Во время этого процесса образуются исходные вещества – кислота и основание. Если исходные компоненты растворимы в воде, процесс гидролиза обратим и продукты зафиксировать сложно, поэтому, гидролиз возможен только для тех солей, один из исходных компонентов которой – слабое соединение. В этом случае образуется продукт – осадок, газ или вода, выпадающий из общей реакции.

Процесс диссоциации хлорида натрия
Кроме гидролиза существует процесс диссоциации. По сути, это первая стадия гидролиза – разрушение молекулы водой. Если после этого происходит образование новых химических соединений, происходит гидролиз. Эти процессы могут идти одновременно и конкурировать между собой или будет преобладать только один из вариантов.
Константа гидролиза солей
Хоть гидролиз и является общим свойством селей, многие соли подвергаются ему в разной степени. Это зависит не только от наличия сильного и слабого иона, но и от растворимости самой соли.
Степень гидролиза определенной соли называют константой гидролиза солей и обозначают Kr. Это табличные данные, но в эксперименте их можно посчитать по формуле: К = [К+][А–]/[КА]. То есть, чтобы определить этот параметр, нужно концентрацию катионов и анионов разделить на концентрацию недиссоциированных молекул. Максимальное значение константы = 1. Чем ближе к этой цифре, тем выше степень гидролиза молекулы.
Константа зависит от ряда параметров:
- Температура раствора;
- Природа соли (ее растворимость);
- Длительность процесса.
Но, не зависит от концентрации соли и объема реакционной среды.
Одно и то же вещество может иметь разные значения константы гидролиза. Это характерно для таких молекул, у которых несколько атомов катиона или аниона. Например, Na3PO4 распадается постепенно, отщепляя по одному атому Na:
- Na3PO4↔ Na+ + Na2PO4–
- Na2PO42- ↔ Na+ + NaPO42-
- NaPO42-↔ Na+ + PO43-
- Суммарно: Na3PO4↔3Na+ + PO43-
Активнее всего процесс будет идти по первой ступени, ниже по второй. Третий этап, практически, не осуществим.
Обратимый гидролиз
Если в растворе идет как распад исходной молекулы с образованием новых продуктов, так и образование молекул этого же вещества, это обратимый гидролиз. В качестве примера рассмотрим этот процесс для фосфата натрия Na3PO4 по первой ступени: в растворе образуются ионы, соединяющиеся в продукты NaOH и Na2HPO4. Оба вещества растворимы в воде, а значит, тоже могут распадаться на ионы. В результате устанавливается равновесие между двумя процессами – прямой и обратный гидролиз:
Na3PO4 + H2O ↔ Na2HPO4 + NaOH
3Na+ + PO43- + HOH ↔2Na+ + HPO42- + Na ++ OH–
Для того чтобы реакция шла только в одном направлении можно удалять нужный продукт или формировать подходящую кислотность.
Гидролиз растворов может протекать по аниону или катиону. Анион – ион, заряженный отрицательно, а катион – положительно. Условием этого процесса является наличие одного или дух слабых ионов. При их распаде образуется необратимый продукт, позволяющий зафиксировать процесс.
К слабым кислотам (анион) относятся:
- все органические кислоты;
- бескислородные кислоты, кроме HBr, HCl, HI;
- кислоты, проявляющие переменную степень окисления (H2SO3, HNO2);
- кислоты, которые быстро распадаются (H2CO3, H2SiO3, H3PO4).
Слабость основания (катиона) можно определить по таблице растворимости. К слабым основаниям относятся все малорастворимые и нерастворимые вещества. Например, Al(OH)3 и Zn(OH)2 – слабые основания.

Возможно 4 варианта гидролиза в зависимости от состава соли.
Щелочь + слабая кислота (гидролиз по аниону)
Гидролиз по аниону проходит, если соль имеет кислотный остаток слабой кислоты. В финальном растворе останутся гидроксид-ионы, за счет чего сформируется щелочная среда (pH>7).
Пример: Na3PO4 + H2O ↔ Na2HPO4 + NaOH
Реакцию можно рассмотреть с точки зрения последовательного образования анионов и катионов.
- Na3PO4 ↔ 3 Na3+ + PO43-
- 3 Na3+ + PO43- + H2O ↔ 3 Na+ + HPO42- + OH–
Растворимое слабое основание + сильная кислота (гидролиз по катиону)
Если в соли слабо основание, будет происходить его распад. В этом случае в растворе останется больше катионов водорода и среда сформируется кислая (pH<7).
Пример: AlCl3 + H2O ↔ AlOHCl + HCl
Гидролиз веществ проходит в две стадии.
- AlCl3 ↔ Al3+ + 3 Cl–
- Al3+ +3 Cl–+ H2O ↔ AlOH2+Cl + H+ + Cl–
Слабое основание + слабая кислота (гидролиз по катиону и аниону)
Если обе части соли слабые, гидролиз будет идти по обеим частям. Так как образуются и катионы водорода, и гидроксид-ионы в равном количестве, среда будет нейтральная(рН = 7).
Пример: (NH4)2S + 2 H2O → 2 NH4OH + H2S
- (NH4)2S → 2 NH4+ + S–
- NH4+ + H2O ↔ NH4OH + H+
S– + H2O ↔ HS– + OH–
Щелочь + сильная кислота
Сильные молекулы называются так из-за очень высокой реакционной способности ионов, в таком случае, даже если происходит их распад на катионы и анионы, они сразу соединяются обратно. Молекулы воды не успевают оттащить их достаточно далеко, чтобы образовались новые продукты реакции.
Электролиз
Электролиз – разложение веществ под действием электрического тока. Он представляет собой окислительно-восстановительную реакцию.

Под действием электрического тока ионы начинают двигаться направленно – положительно заряженные катионы к отрицательному катоду, а отрицательно заряженные анионы к положительному аноду. На катоде катионы принимают электроны и восстанавливаются, а на аноде анионы отбирают электроны и окисляются. Электролиз протекает в расплаве или в растворе.
Виды электродов
Электрод – один из основных компонентов электролиза. Именно на нем происходит процесс объединение ионов и формирования продуктов реакции. Существует несколько видов электродов, на каждом из которых есть особенности процессов.
В химических лабораториях используют несколько видов электродов:
- платиновый,
- инертный,
- угольный,
- стандартный водородный.

Электроды отличаются стандартным электродным потенциалом. Это значит, на разных электродах скорость ОВР будет различна. Для каждого электрода приведены стандартные значения его потенциала, что может быть использовано в решении задач для определения степени электролиза.
Электролиз расплавов
При электролизе расплавов солей вода не участвует в процессе реакции. Этот способ применяется в том случае, если продукты электролиза вступают в реакцию с водой, например, при получении щелочных и щелочно-земельных металлов. В этом случае вместо металла образуется щелочь.
2NaCl(расплав) электролиз 2Na + Cl2↑
Катод( ): Na+ + ē =Na
Анод(+): 2Cl–– 2ē = 2Cl = Cl2↑

Электролиз растворов
Электролиз растворов протекает в присутствии воды.
Продукты реакции на катоде и аноду зависят от характеристик соответствующих катионов и анионов.
Процесс на катоде
На катоде происходит восстановление металлов и водорода, в зависимости от активности металла. Можно выделить три варианта продуктов реакции на катоде, в зависимости от положения металла в электрохимическом ряду напряжений.

- Активный металл (металлы в ряду напряжений стоят до алюминия включительно)
В процессе реакции восстанавливается водород, т.к.активные металлы не могут долго существовать в чистом виде и быстро образуют новые соединения в растворе.
2 Н2О + 2 ē → Н2 + 2 ОН–
- Металл со средней активностью (металл находится между алюминием и водородом)
В процессе электролиза одновременно восстанавливаются вода и металл.
Меn+ + n ē → Me0
2 H2O + 2 ē → Н2 + 2 ОН–
- Неактивный металл (металлы в ряду располагаются после водорода)
В процессе электролиза восстанавливается только металл, так как его реакционная активность низкая.
Меn+ + n ē → Me0
Процессы на аноде
К положительно заряженному аноду подходят анионы. Анионы играют роль окислителя, а кислотные остатки или вода – восстановителей. Здесь, так же, возможно образования различных продуктов в зависимости от аниона.
- Бескислородный кислотный остаток (I–, Br–, Cl–) восстанавливается до соответствующего неметалла:
неМеn-– n ē → неМе0
- Кислородсодержащий кислотный остаток сильной кислоты (SO42-, NO3–) и фторид-ион (F–) не окисляются. Вместо них происходит окисление воды с образованием кислорода:
2 Н2О-2 – 4 ē → О20 + 4 Н+
- Гидроксид-ион (OH–) окисляется с образованием кислорода:
4 ОН– – 4 ē → О2 + 2 Н2О
Суммарные процессы электролиза
В суммарном уравнении электролиза записывают те продукты, которые образовались н электродах. Например, процесс электролиза раствора сульфата меди выглядит следующим образом:
2 Cu2+SO4 + 2 H2O → 2 Cu0 + 2 H2SO4 + O2
К (-): Сu2+ + 2 ē → Сu0
А (+): 2 H2O – 4 ē → О20 + 4 Н+
Электролиз раствора хлорида натрия выглядит следующим образом:
2 NaCl– + 2 H2O → H2 + 2 NaOH + Cl20
K (-):2 H2O + 2 ē → Н2 + 2 ОН–
А (+): 2 Cl– – 2 ē → Cl20
Значение электролиза
Электролиз – важный химический процесс. Основная область его применения – получение неустойчивых элементов, которые нельзя синтезировать в процессе стандартной реакции. Например, так получают щелочные металлы.

Другой вариант – покрытие металлических изделий антикоррозионными элементами. В этом случае, нахождение металлического объекта (например, корабля) в соленой воде приравнивается к процессу электролиза, что приводит к коррозии. Чтобы предотвратить этот процесс, к конструкции прикрепляется элемент с большим потенциалом. Тогда он будет вступать в этот процесс вместо основной конструкции.
В городах электролиз применяют для очистки сточных вод.
Результаты ЕГЭ показывают, что задания по теме “Электролиз”
для выпускников остаются сложными. В школьной программе на изучение этой темы
отводится недостаточное количество часов. Поэтому при подготовке школьников к
ЕГЭ необходимо изучить этот вопрос очень подробно. Знание основ электрохимии
поможет выпускнику успешно сдать экзамен и продолжить обучение в высшем учебном
заведении.
Для изучения темы “Электролиз” на достаточном уровне
необходимо провести подготовительную работу с выпускниками, сдающими ЕГЭ:
– рассмотреть определения основных понятий в теме
“Электролиз”;
– анализа процесса электролиза расплавов и растворов
электролитов;
– закрепить правила восстановления катионов на катоде и
окисления анионов на аноде (роль молекул воды во время электролиза растворов);
– формирование умений составлять уравнения процесса
электролиза (катодный и анодный процессы);
– научить учащихся выполнять типовые задания базового уровня
(задачи), повышенного и высокого уровня сложности.
Электролиз – окислительно-восстановительный процесс,
протекающий в растворах и расплавах электролитов при прохождении постоянного
электрического тока. В растворе или расплаве электролита происходит его
диссоциация на ионы. При включении электрического тока ионы приобретают
направленное движение и на поверхности электродов могут происходить
окислительно-восстановительные процессы.
Анод – положительный электрод, на нём идут процессы
окисления.
Катод – отрицательный электрод, на нём идут процессы восстановления.
Электролиз расплавов применяется для получения активных металлов,
расположенных в ряду напряжений до алюминия (включительно).
Электролиз расплава хлорида натрия
К(-) Na+ + 1e —> Na0
A(+) 2Cl– – 2e —> Cl20
2NaCl(эл.ток) —> 2Na + Cl2 (только при электролизе расплава).
Алюминий получают электролизом раствора оксида алюминия в расплавленном
криолите (Na3AlF6).
2Al2O3(эл.ток) —>4Al +3O2
K(-)Al3++3e‾ —>Al
A(+)2O2‾-2e‾ —>O2
Электролиз расплава гидроксида калия .
KOH—>K+ +OH‾
К(-) K+ + 1e —> K0
A(+) 4OH– – 4e —> O20 +2Н2О
4KOH(эл.ток) —> 4K0 + O20 +2Н2О
Электролиз водных растворов протекает сложнее, так как на электродах в этом
случае могут восстанавливаться или окисляться молекулы воды.
Электролиз водных растворов солей более сложен из-за возможного
участия в электродных процессах молекул воды на катоде и на аноде.
Правила электролиза в водных растворах.
На катоде:
1. Катионы, расположенные в ряду напряжений металлов от лития до алюминия
(включительно), а также катионы NН4+ не
восстанавливаются, вместо них восстанавливаются молекулы воды:
2Н2О + 2е —> Н2 + 2ОН–
2. Катионы, расположенные в ряду напряжений после алюминия до водорода, могут
восстанавливаться вместе с молекулами воды:
2Н2О + 2е —> Н2 + 2ОН–
Zn2+ + 2e —> Zn0
3. Катионы, расположенные в ряду напряжений после водорода, полностью
восстанавливаются: Аg+ + 1е —> Аg 0
4. В растворах кислот восстанавливаются ионы водорода: 2Н+ + 2е
—> Н2
На аноде:
1. Кислородосодержащие анионы и F– – не окисляются, вместо
них окисляются молекулы воды:
2Н2О – 4е —> О2 + 4Н+
2.Анионы серы, иода, брома, хлора (в этой последовательности) окисляются
до простых веществ:
2Сl– – 2е —> Сl20 S2-
– 2е —> S 0
3. В растворах щелочей окисляются гидроксид-ионы:
4ОН– – 4е —> О2 + 2Н2О
4. В растворах солей карбоновых кислот окисляются анионы:
2 R – СОО– – 2е —> R – R + 2СО2
5. При использовании растворимых анодов электроны во внешнюю цепь посылает сам
анод за счёт окисления атомов металла, из которого сделан анод:
Сu0 – 2е —> Сu2+
Примеры процессам электролиза в водных растворах электролитов
Пример 1. K2 SO4—> 2K+ + SO42-
K(-)2H2O + 2e‾ —> H2 + 2OH–
A(+)2H2O – 4e‾ —> O2 + 4H+
Общее уравнение электролиза: 2H2O(эл.ток) —>2 H2 + O2
Пример 2. NaCl —>Na+ +Cl‾
K(-)2H2O + 2e‾ —> H2 + 2OH–
A(+) 2Cl– – 2e —> Cl20
2NaCl +2H2O(эл.ток ) —> H2 + 2NaOH + Cl2
Пример 3. Cu SO4 —> Cu2+ + SO42-
K(-) Cu2+ + 2e‾ —> Cu
A(+)2H2O – 4e‾ —> O2 + 4H+
Общее уравнение электролиза: 2 Cu SO4+ 2H2O(эл. ток )
—>2Cu + O2 + 2H2 SO4
Пример 4. CH3COONa—>CH3COO‾ +Na+
K(-)2H2O + 2e‾ —> H2 + 2OH–
A(+)2CH3COO‾– 2e‾ —>C2H6 +2CO2
Общее уравнение электролиза:
CH3COONa+2H2O(эл.ток) —> H2 + 2NaHCO3+C2H6
Задания базового уровня сложности
Тест по теме “Электролиз расплавов и растворов солей. Ряд
напряжений металлов”.
1. Щёлочь – один из продуктов электролиза в водном растворе:
1) KCI 2) CuSO4 3) FeCI2 4) AgNO3
2. При электролизе водного раствора нитрата калия на аноде выделяется:
1) О2 2) NO2 3) N2 4) Н2
3. Водород образуется при электролизе водного раствора:
1) CaCI2 2) CuSO4 3)Hg(NO3)2
4) AgNO3
4. Реакция возможна между:
1) Ag и K2SO4 (р-р) 2) Zn и KCI(р-р) 3) Mg и SnCI2(р-р)
4) Ag и CuSO4(р-р)
5. При электролизе раствора иодида натрия у катода окраска лакмуса в растворе:
1) красная 2) синяя 3) фиолетовая 4) жёлтая
6. При электролизе водного раствора фторида калия на катоде выделяется:
1) водород 2) фтороводород 3) фтор 4) кислород
Задачи по теме “Электролиз”
1. Электролиз 400 г 20 %-ого раствора поваренной соли был остановлен, когда
на катоде выделилось 11,2 л (н.у.) газа. Степень разложения исходной соли (в %)
составляет:
1) 73 2) 54,8 3) 36,8 4) 18
Решение задачи.
Составляем уравнение реакции электролиза:
2NaCl + 2H2O→H2↑ +Cl2↑
+2NaOH
m(NaCl)=400∙0,2=80 г соли было в растворе.
ν(H2)=11,2/22,4=0,5 моль ν(NaCl)=0,5∙2=1 моль
m(NaCl)= 1∙58,5=58,5 г соли было разложено во время
электролиза.
Степень разложения соли 58,5/80=0,73 или 73%.
Ответ: 73% соли разложилось.
2. Провели электролиз 200 г 10 %-ого раствора сульфата хрома (III) до полного
расходования соли (на катоде выделяется металл). Масса (в граммах)
израсходованной воды составляет:
1) 0,92 2) 1,38 3) 2,76 4) 5,52
Решение задачи.
Составляем уравнение реакции электролиза:
2Cr2(SO4)3 +6H2O→4Cr
+3O2↑ +6H2SO4
m(Cr2(SO4)3)=200∙0,1=20г
ν(Cr2(SO4)3)=20/392=0,051моль
ν(H2O)=0,051∙3=0,153 моль
m(H2O)= 0,153∙18=2,76 г
Задания повышенного уровня сложности В3
1. Установите соответствие между формулой соли и уравнением процесса,
протекающего на аноде при электролизе её водного раствора.
| ФОРМУЛА СОЛИ
А) KCl Б) AlBr3 В) CuSO4 Г) AgNO3 |
УРАВНЕНИЕ АНОДНОГО ПРОЦЕССА 1) 2H2O – 4e → O2 + 4H+ 2) 2H2O + 2e → H2 + 2OH– 3) 2Cl– -2e → Cl20 4) 2Br– – 2e → Br20 5) 2SO42- -2e → S2O82- 6) 2NO3– -2e → 2NO2 + O2 |
2. Установите соответствие между формулой соли и продуктом, образующимся на
инертном аноде при электролизе её водного раствора.
| ФОРМУЛА СОЛИ
А) RbSO4 Б) CH3COOK В) BaBr2 Г) CuSO4 |
ПРОДУКТ, ОБРАЗУЮЩИЙСЯ НА АНОДЕ
1) метан 2) сернистый газ 3) кислород 4) водород 5) бром 6) этан и углекислый газ |
3. Установите соответствие между формулой соли и уравнением процесса,
протекающего на катоде при электролизе её водного раствора.
| ФОРМУЛА СОЛИ
А) Al(NO3)3 Б) CuCl2 В) Г) Cu(NO3)2 |
УРАВНЕНИЕ КАТОДНОГО ПРОЦЕССА
1) 2 ) 2H2O + 2e → H2 + 2OH– 3) Cu2+ + 2e → Cu0 4) Cu2+ + 1e → Cu+ 5) Sb3+ +3e→ Sb0 |
4. Установите соответствие между названием вещества и способом его
получения.
| НАЗВАНИЕ ВЕЩЕСТВА А) литий Б) фтор В) серебро Г) магний |
ПОЛУЧЕНИЕ ЭЛЕКТРОЛИЗОМ
1) 2) расплава LiF 3) раствора MgCl2 4) раствора AgNO3 5) расплава Ag2O 6) расплава MgCl2 |
5. Установите соответствие между названием вещества и продуктами
электролиза его водного раствора.
| НАЗВАНИЕ ВЕЩЕСТВА
А) бромид Б) сульфат меди (II) В) бромид меди (II) |
ПРОДУКТЫ ЭЛЕКТРОЛИЗА
1) водород, бром, гидроксид калия 2) натрий, углекислый газ 3) медь, оксид серы (IV) 4) медь, кислород, серная кислота 5) медь, бром |
Ответы: 1 – 3411, 2 – 3653, 3 – 2353, 4 – 2246,
5 – 145 .
Таким образом, изучая тему электролиза, выпускники хорошо
усваивают этот раздел и показывают хорошие результаты на экзамене. Изучение
материала сопровождается презентацией по данной теме.
Электролиз (греч. elektron – янтарь + lysis — разложение) – химическая реакция, происходящая при прохождении постоянного тока через
электролит. Это разложение веществ на их составные части под действием электрического тока.
Процесс электролиза заключается в перемещении катионов (положительно заряженных ионов) к катоду (заряжен отрицательно), и отрицательно
заряженных ионов (анионов) к аноду (заряжен положительно).

Итак, анионы и катионы устремляются соответственно к аноду и катоду. Здесь и происходит химическая реакция. Чтобы успешно решать задания
по этой теме и писать реакции, необходимо разделять процессы на катоде и аноде. Именно так и будет построена эта статья.
Катод
К катоду притягиваются катионы – положительно заряженные ионы: Na+, K+, Cu2+, Fe3+,
Ag+ и т.д.
Чтобы установить, какая реакция идет на катоде, прежде всего, нужно определиться с активностью металла: его положением в электрохимическом
ряду напряжений металлов.

Если на катоде появился активный металл (Li, Na, K) то вместо него восстанавливаются молекулы воды, из которых выделяется водород. Если металл средней
активности (Cr, Fe, Cd) – на катоде выделяется и водород, и сам металл. Малоактивные металлы выделяются на катоде в чистом виде (Cu, Ag).
Замечу, что границей между металлами активными и средней активности в ряду напряжений считается алюминий. При электролизе на катоде металлы
до алюминия (включительно!) не восстанавливаются, вместо них восстанавливаются молекулы воды – выделяется водород.
В случае, если на катод поступают ионы водорода – H+ (например при электролизе кислот HCl, H2SO4) восстанавливается
водород из молекул кислоты: 2H+ – 2e = H2
Анод
К аноду притягиваются анионы – отрицательно заряженные ионы: SO42-, PO43-, Cl–, Br–,
I–, F–, S2-, CH3COO–.

При электролизе кислородсодержащих анионов: SO42-, PO43- – на аноде окисляются не анионы, а молекулы
воды, из которых выделяется кислород.
Бескислородные анионы окисляются и выделяют соответствующие галогены. Сульфид-ион при оксилении окислении серу. Исключением является фтор – если он
попадает анод, то разряжается молекула воды и выделяется кислород. Фтор – самый электроотрицательный элемент, поэтому и является исключением.
Анионы органических кислот окисляются особым образом: радикал, примыкающий к карбоксильной группе, удваивается, а сама карбоксильная группа (COO)
превращается в углекислый газ – CO2.
Примеры решения
В процессе тренировки вам могут попадаться металлы, которые пропущены в ряду активности. На этапе обучения вы можете пользоваться расширенным рядом
активности металлов.

Теперь вы точно будете знать, что выделяется на катоде 😉
Итак, потренируемся. Выясним, что образуется на катоде и аноде при электролизе растворов AgCl, Cu(NO3)2, AlBr3,
NaF, FeI2, CH3COOLi.

Иногда в заданиях требуется записать реакцию электролиза. Сообщаю: если вы понимаете, что образуется на катоде, а что на аноде,
то написать реакцию не составляет никакого труда. Возьмем, например, электролиз NaCl и запишем реакцию:
NaCl + H2O → H2 + Cl2 + NaOH (обычно в продуктах оставляют именно запись “NaOH”, не подвергая его дальнейшему электролизу)
Натрий – активный металл, поэтому на катоде выделяется водород. Анион не содержит кислорода, выделяется галоген – хлор. Мы пишем уравнение, так
что не можем заставить натрий испариться бесследно 🙂 Натрий вступает в реакцию с водой, образуется NaOH.
Запишем реакцию электролиза для CuSO4:
CuSO4 + H2O → Cu + O2 + H2SO4
Медь относится к малоактивным металлам, поэтому сама в чистом виде выделяется на катоде. Анион кислородсодержащий, поэтому в реакции выделяется
кислород. Сульфат-ион никуда не исчезает, он соединяется с водородом воды и превращается в серую кислоту.
Электролиз расплавов
Все, что мы обсуждали до этого момента, касалось электролиза растворов, где растворителем является вода.
Перед промышленной химией стоит важная задача – получить металлы (вещества) в чистом виде. Малоактивные металлы (Ag, Cu) можно легко получать
методом электролиза растворов.
Но как быть с активными металлами: Na, K, Li? Ведь при электролизе их растворов они не выделяются на катоде в чистом виде, вместо них восстанавливаются
молекулы воды и выделяется водород. Тут нам как раз пригодятся расплавы, которые не содержат воды.

В безводных расплавах реакции записываются еще проще: вещества распадаются на составные части:
AlCl3 → Al + Cl2
LiBr → Li + Br2
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Электролиз

Электролизом называют химические реакции, которые протекают под действием электрического тока на электродах в растворах и расплавах электролитов.
Катодом называют отрицательно заряженный электрод. На его поверхности ионы, молекулы или атомы присоединяют электроны, т. е. протекает реакция электрохимического восстановления катионов.
Анодом называют положительно заряженный электрод. На его поверхности происходит отдача электронов, т. е. реакция окисления.
Для установления продуктов электролиза водных растворов солей используют так называемый электрохимический ряд напряжений металлов, а также ряд восстановительной активности анионов.
Электрохимический ряд напряжений металлов:
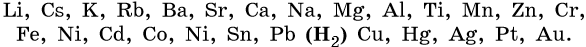
Ряд восстановительной активности анионов:
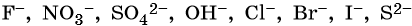
Рассмотрим несколько примеров реакций электролиза, протекающих на инертных, т.е. не вступающих в какие-либо химические реакции, электродах.
Прогнозировать происходящие при электролизе водных растворов процессы можно с помощью ряда напряжений металлов и некоторых экспериментально обоснованных закономерностей.
Для катодных процессов существуют следующие закономерности:
1. Катионы металлов, стандартные электродные потенциалы которых выше, чем у водорода, т.е. расположенные в этом ряду правее его (Cu, Hg, Ag, Pt, Au), при электролизе полностью восстанавливаются на катоде в виде металла: Men+ + nе– → Me0.
2. Катионы металлов с малой величиной стандартного электродного потенциала (Li+, Na+, K+, Rb+, …, до Al3+ включительно) при электролизе на катоде не восстанавливаются, а вместо них восстанавливаются молекулы воды: 2H2O + 2e– → Н2 + 2ОН–.
3. Катионы металлов со стандартными электродными потенциалами меньше, чем у водорода, но больше, чем у алюминия (Mn2+, Zn2+, Cr3+, Fe2+, …, до H), при электролизе восстанавливаются на катоде одновременно с молекулами воды, т.е. одновременно идут два процесса:
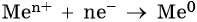
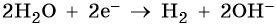
При электролизе водных растворов кислот и щелочей на катоде всегда выделяется водород.
Для анодных процессов:
1. При электролизе водных растворов щелочей, кислородсодержащих кислот и их солей, в которых атомы неметаллов или металлов находятся в высшей степени окисления (NO3–, SO42–, PO43–, ClO4–, MnO4– и т.п.), а также фторид-ионов F– на аноде будут окисляться не анионы, а гидроксид-ионы и молекулы воды и выделяться кислород:
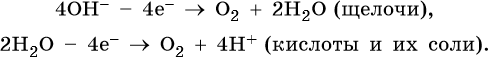
2. При электролизе хлоридов, бромидов, йодидов у анода будут разряжаться анионы и выделяться соответствующие галогены:
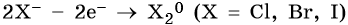
3. При электролизе анионов, содержащих неметалл в промежуточной степени окисления (SO32–, NO2– и др.), они сами окисляются на аноде:
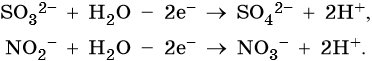
Усвоение учебного материала по данной теме на ЕГЭ проводят с помощью заданий повышенного уровня сложности.
Пример 1. Установите соответствие между формулой вещества и продуктами, которые могут образовываться на катоде в результате электролиза его водного раствора.

Нитрат меди (II). Медь в электрохимическом ряду напряжений металлов стоит после водорода. Следовательно, при электролизе она выделится на катоде в виде металла: Cu2+ + 2е– → Cu0. На аноде при этом будет происходить окисление молекул воды и выделяться кислород: 2H2O – 4e– → О2 + 4Н+. Уравниваем процессы окисления и восстановления:
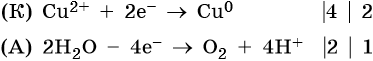
Окончательно получаем:
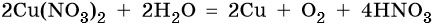
Нитрат серебра. Серебро в электрохимическом ряду напряжений металлов стоит после водорода. Следовательно, при электролизе оно выделится на катоде в виде металла: Ag+ + 1е– → Ag0. На аноде при этом будет происходить окисление молекул воды и выделяться кислород: 2H2O – 4e– → О2 + 4Н+. Уравниваем процессы окисления и восстановления:
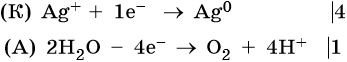
Окончательно получаем:
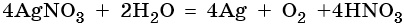
Хлорид железа (II), FeCl2. Железо в ряду напряжений стоит после алюминия и до водорода. При электролизе на катоде восстанавливаются и металл, и молекулы воды, т. е. одновременно идут два процесса: Fe2+ + 2е– → Fe0; 2H2O + 2e– → Н2 + 2ОН–. На аноде будет выделяться хлор: 2Cl– – 2e– → Cl20.
Уравниваем процессы окисления и восстановления:
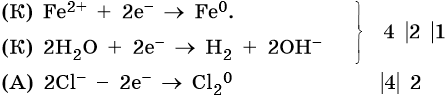
Окончательно получаем:
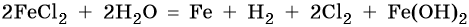
Сульфат калия. Катион калия в ряду напряжений металлов стоит до алюминия. Поэтому катион калия при электролизе на катоде не восстанавливается, а вместо него восстанавливаются молекулы воды: 2H2O + 2e– → Н2 + 2ОН–. На аноде будут окисляться молекулы воды: 2H2O – 4e– → О2 + 4Н+.
Уравниваем процессы окисления и восстановления:
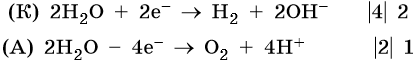
После сокращения получаем:
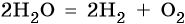
Ответ: А – 1; Б – 5; В – 6; Г – 2.
