…
В общем случае, гидролиз солей – это процесс обменного разложения воды и растворенной в ней соли – электролита, приводящий к образованию малодиссоциирующего вещества.
Гидролиз является частным случаем сольволиза – обменного разложения растворенного вещества и растворителя.
Характеризовать гидролиз количественно позволяют такие величины, как Степень гидролиза и константа гидролиза.
Степень гидролиза
Степень гидролиза — это соотношение количества подвергающейся гидролизу соли nгидр и общего количества растворенной соли nобщ.
Обычно, ее обозначают через hгидр (или α ):
hгидр = (nгидр/nобщ)·100 %
Величина hгидр увеличивается с уменьшением силы образующих соль кислоты или основания.
Константа гидролиза
Представим в общем виде процесс гидролиза соли, в котором в роли соли выступает – МА, а НА и МОН — соответственно, кислота и основание, которые образуют данную соль:
MA + H2O ↔ HA + MOH
Применив закон действующих масс, запишем константу, соответствующую этому равновесию:
K = [HA]·[MOH]/[MA]·[H2O]
Известно, что концентрация воды в разбавленных растворах, имеет практически постоянное значение, поэтому ее можно включить в константу
K·[H2O]= Kг,
тогда соотношение для константы гидролиза соли Kгбудет иметь такой вид:
Kг = [HA]·[MOH]/[MA]
По величине константы гидролиза можно судить о полноте гидролиза:
чем больше значение константы гидролиза Kг, тем в большей мере протекает гидролиз.
Константа и степень гидролиза связаны соотношением:
Kг = С·h2/(1- h), моль/л
Где С – концентрация соли в растворе,
h- степень гидролиза.
Это выражение можно упростить, т.к. обычно h˂˂1, тогда
Kг = С·h2
Зная, константу гидролиза, можно определить pH среды:
Kг = [HA]·[MOH]/[MA]
Концентрация образовавшейся кислоты равна концентрации гидроксид ионов, тогда
Kг = [OH—]2/[MA]
Используя это выражение можно вычислить pH раствора
[OH—] = (Kг·[MA])1/2 моль/л
[H+] = 10-14/[OH—] моль/л
pH = -lg[H+]
Гидролиз солей можно представить, как поляризационное взаимодействие ионов и их гидратной оболочки.
Гидролиз протекает тем полнее, сильнее поляризующее действие ионов.
Возможны 4 случая протекания гидролиза:
1. Соли, образованные сильным основанием и сильной кислотой (гидролиз не протекает)
Соли, образованные сильным основанием и сильной кислотой не подвергаются гидролизу.
В этом случае, гидролиз практически не происходит, т.к. катионы и анионы, образующиеся в растворе при диссоциации соли, слабо поляризуют гидратную оболочку. pH среды не изменяется (рН ≈ 7):
NaCl ↔ Na+ + Cl—
Na+ + HOH ↔ реакция практически не протекает
Cl— + HOH ↔ реакция практически не протекает
2. Соли, образованные слабым основанием и сильной кислотой (гидролиз по катиону)
Такое соединение, при ионизации, образует катионы, способные к поляризации гидратной оболочки и анионы, которые их поляризуют слабо. Тогда гидролиз проходит по катиону, при этом среда носит кислый характер, т.е. рН ˂ 7:
NH4Cl ↔ NH4+ + Cl—
NH4+ + HOH ↔ NH4OH + H+
Cl—+ HOH ↔ реакция практически не идет
NH4Cl+ HOH ↔ NH4OH + HCl
Для солей, образованных слабым основанием и сильной кислотой, константа гидролиза и константа диссоциации основания связаны соотношением:
Kг = KH2O/Kосн
Понятно, что чем меньше сила основания, тем в большей степени протекает гидролиз.
Если соль образованна слабым основанием многовалентного металла и сильной кислотой, то ее гидролиз будет протекать ступенчато:
FeCl2 ↔ Fe2+ + 2Cl—
| I ступень | Fe2++ HOH ↔ (FeOH)+ + H+ FeCl2 + HOH ↔ (FeOH)Cl + HCl |
| II ступень | (FeOH)+ + HOH ↔ Fe(OH)2 + H+ (FeOH)Cl + HOH↔ Fe(OH)2 + HCl |
Константа гидролиза по первой ступени связана с константой диссоциации основания по второй ступени, а константа гидролиза по второй ступени — с константой диссоциации основания по первой ступени:
Kг1 = KH2O/Kосн2
Kг2 = KH2O/Kосн1
Поскольку первая константа диссоциации кислоты всегда больше второй, то первая константа гидролиза всегда больше, чем константа вторая гидролиза, так как первая константа диссоциации основания всегда больше второй
Kг1 > Kг2
Отсюда следует, что по первой ступени, гидролиз всегда будет протекать в большей степени, чем по второй. Этому также способствуют ионы, которые образуются при гидролизе по первой ступени, они приводят подавлению гидролиза по второй ступени, смещая равновесие влево.
Сравнивая величины Kг и Kосн можно качественно определить pH среды.
Так, если Kгнамного больше Kосн, то среда сильнокислая, при Kгнамного меньшей Kосн — среда слабокислая, а если Kги Kосн сопоставимы, то — среднекислая.
3. Соль, образованная сильным основанием и слабой кислотой (гидролиз по аниону)
Такое соединение в растворе образует слабополяризующие катионы и среднеполяризующие анионы. Гидролиз протекает по аниону, и в его результате создается щелочная среда, pH > 7:
NaCN ↔ Na+ + CN—
CN— + HOH ↔ HCN + OH—
Na+ + HOH ↔ реакция практически не идет
NaCN + HOH ↔ HCN + NaOH
Константа гидролиза и константа диссоциации кислоты связаны зависимостью:
Kг = KH2O/Kк-ты
Т.е. гидролиз соли протекает тем полнее, чем слабее образующая эту соль, кислота.
Возможен гидролиз соли, образованной слабой многоосновной кислотой и сильным основанием. В этом случае гидролиз протекает по ступеням:
Na2SO3 ↔ 2Na+ + SO32-
| I ступень | SO32- + HOH ↔ HSO3— + OH— Na2SO3 + HOH ↔ NaHSO3 + NaOH |
| II ступень | HSO3— + HOH ↔ H2SO3 + OH— NaHSO3 + HOH ↔ H2SO3 + NaOH |
В этом случае, константа гидролиза по первой и второй ступеням определяется соотношениями:
Kг1 = KH2O/Kк-ты2
Kг2 = KH2O/Kк-ты1
Следует помнить, что гидролиз по второй ступени протекает в ничтожно малой степени.
Сравнивая величины Kг и Kк-ты, можно качественно определить pH среды. Так, если Kгнамного больше Kк-ты, то среда сильнощелочная, при Kгнамного меньшей Kк-ты — среда слабощелочная, а если Kги Kосн сопоставимы, то — среднещелочная.
4. Соли, образованные слабым основанием и слабой кислотой (гидролиз и по катиону и по аниону)
Такие соли, при ионизации образуют среднеполяризующие катионы и анионы, поэтому гидролиз возможен как по катиону, так и по аниону.
При этом относительная сила образовавшихся кислоты и основания, будут влиять на характер среды (слабокислая или слабощелочная, pH ≈ 7). Такого типа гидролиз протекает особо полно, обычно с образованием малорастворимого вещества:
Al2S3 + 6HOH ↔ 2Al(OH)3↓+ 3H2S↑
Константу гидролиза можно рассчитать, зная константы диссоциации кислоты и основания с помощью следующего соотношения:
Kг = KH2O/(Kк-ты·Kосн)
Совместный гидролиз солей
Совместный гидролиз протекает при взаимодействии растворов двух солей, одна из которых образована слабым основанием и сильной кислотой, а вторая напротив сильным основанием и слабой кислотой. Т.е. одна соль гидролизуется по катиону, а другая – по аниону.
В таких случаях гидролиз взаимно усиливается.
Например, рассмотрим совместный гидролиз растворов солей хлорида алюминия и сульфида натрия:
При гидролизе хлорида алюминия соль гидролизуется по катиону:
AlCl3 ↔ Al3+ + 3Cl—
Al3+ + 3HOH ↔ Al(OH)3 + 3H+
При гидролизе сульфида натрия соль гидролизуется по аниону:
Na2S ↔ 2Na+ + S2-
S2- + 2HOH ↔ H2S + 2OH—
Суммарная реакция гидролиза:
2AlCl3 + 3Na2S + 6H2O = 2Al(OH)3↓ + 3H2S↑ + 6NaCl
Влияние различных факторов на протекание гидролиза
- Природа соли. Это видно из выражения для константы гидролиза.
- Концентрация соли и продуктов реакции. В соответствии с принципом Ле-Шателье, равновесие должно смещаться вправо, при этом увеличивается концентрация ионов водорода (или гидроксид-ионов), что приводит к уменьшению степени гидролиза.
- Температура. Известно, что гидролиз притекает с поглощением теплоты (эндотермическая реакция), поэтому согласно принципу Ле Шателье, при увеличении температуры равновесие сдвигается вправо, что ведет к росту степени гидролиза.
В разделе Задачи к разделу Гидролиз солей приведены задачи на определение степени и константы гидролиза, составление уравнений гидролиза, определение рН среды и др.
Уравнения для расчета константы, степени гидролиза и рН растворов и гидролизующихся солей:
|
Типы |
Кг |
h |
рН |
|
Соль |
|
|
7- |
|
Соль |
|
|
7+ |
|
Соль |
|
|
7- |
Гидролиз
солей – это взаимодействие ионов соли
с водой, приводящее к образованию слабого
электролита.
Различают
3 типа гидролиза солей:
а) гидролиз по
аниону. Соль образована сильным основанием
и слабой кислотой. Например, CH3COONa.
Диссоциация соли
(сильный электролит):
CH3COONa
CH3COO–
+ Na+. (1)
Диссоциация воды
(слабый электролит):
Н2О
Н+ +
ОН–. (2)
Ацетат-ионы
связывают ионы Н+
с образованием молекулы слабого
электролита – уксусной кислоты:
CH3COO–
+ Н+
CH3COOH. (3)
Суммируя уравнения
(2), (3), получаем уравнение гидролиза соли
в ионном виде:
CH3COO–
+ Н2О
CH3COOH
+ ОН–. (4)
Уравнение (4)
показывает, что идет накопление
гидроксид-ионов, а потому раствор
приобретает щелочную реакцию.
В молекулярном
виде гидролиз CH3COONa
записывается так:
CH3COONa
+ Н2О
CH3COOH
+ NaOH.
Количественно
реакция гидролиза характеризуется:
1) степенью гидролиза
(h) – отношением числа гидролизовавшихся
молекул соли к исходному числу молекул
соли;
2) константой
гидролиза (Кг).
В соответствии с
законом действующих масс константа
равновесия для реакции (4):
или
Поскольку
[Н2О]const,
то К[Н2О]const=Кг;
где Кг
– константа гидролиза.
Учитывая, что
,
получаем:
Константа диссоциации
СН3СООН
(Кк):
CH3COOНCH3COO–+Н+
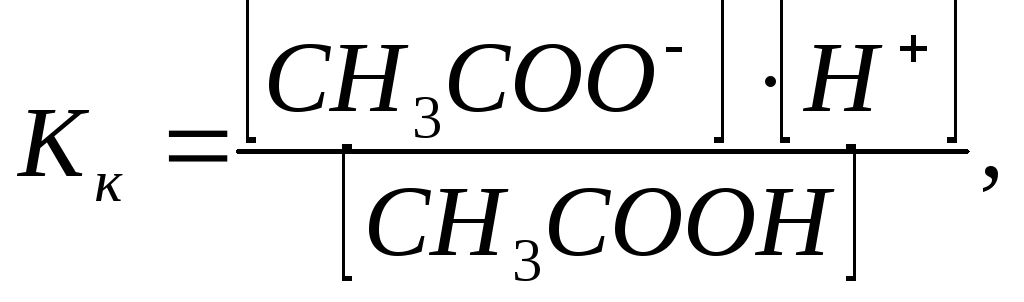
тогда.
Чем больше Кг,
тем сильнее соль гидролизуется.
Обозначим
концентрацию соли CH3COONa
через С. Тогда [CH3COONa]=[CH3COO–]=C.
Степень гидролиза, согласно определению,
можно записать для уравнения (4) следующим
образом: h =
.
Поскольку [СН3СООН]=
[ОН–],
то
.
Для уравнения (4)
концентрация негидролизовавшихся ионов
[CH3COO–]
= C – Ch.
Таким образом,
.
Так как для многих солей величина h –
величина очень малая, то 1-h
1 и Ch2
Кв/Кк.
Откуда ;
б) гидролиз по
катиону. Соль образована сильной кислотой
и слабым основанием. Например, NH4Cl:
NH4Cl
NH4+
+ Cl–
Н2О
Н+ +
ОН–
NH4+
+ ОН–
NH4OH
т. е. NH4+
+ Н2О
NH4OH
+ Н+
В молекулярном
виде:
NH4Cl
+ Н2О
NH4OH
+ HCl.
В этом случае
реакция раствора кислая, т. к. происходит
накопление ионов Н+.
По аналогии с вышерассмотренным примером
можно получить константу и степень
гидролиза для такого типа гидролиза.
Для двух типов
гидролиза степень гидролиза тем больше:
1) чем больше Кв,
т. е. чем больше температура (т. к. Кв
возрастает с температурой);
2) чем меньше Кк
и Косн,
т. е. чем слабее кислота или основание,
которые образуются в результате гидролиза
соли;
3) чем меньше
концентрация, т. е. чем больше разбавлен
раствор.
Таким
образом, чтобы усилить гидролиз солей,
образованных слабым основанием и сильной
кислотой или сильным основанием и слабой
кислотой, необходимо разбавить раствор
соли и нагреть его;
в) гидролиз по
катиону и аниону. Соль образована слабой
кислотой и слабым основанием. Например,
CH3COONH4:
CH3COONH4
CH3COO–
+ NH4+
Н2О
Н+ +
ОН–
CH3COO–
+ Н+
CH3COOH
NH4+
+ OН–
NH4OH
т. е. CH3COONH4
+ Н2О
CH3COOН
+ NH4ОН.
Степень гидролиза
солей, образованных слабой кислотой и
слабым основанием, от разбавления не
зависит. В этом случае рН водных растворов
солей может быть больше, равен или меньше
7: реакция раствора кислая, если Кк
Косн;
щелочная – Кк
Косн
; нейтральная – Кк
Косн.
Гидролиз солей
многоосновных кислот и многокислотных
оснований протекает ступенчато в
соответствии со ступенчатой диссоциацией.
Например, для Na2CO3:
CO3-2
+ H2O
HCO3–
+ OH–
HCO3–
+ H2O
H2CO3
+ OH–
Пример
1. Составьте
ионно-молекулярные и молекулярные
уравнения гидролиза солей: a) NaCN; б) К2СО3;
в) ZnSO4.
Определите реакцию среды растворов
этих солей.
Решение. а) цианид натрия NaCN – соль
слабой одноосновной кислоты HCN и сильного
основания NaOH. При растворении в воде
молекулы NaCN полностью диссоциируют на
катионы Na+и анионы CN–. Катионы
натрия Na+не могут связывать анионы
воды ОН–, так как NaOH – сильный
электролит. А анионы CN–связывают
катионы воды Н+, образуя молекулы
слабого электролита. Соль гидролизуется
по аниону.Ионно-молекулярное уравнение
гидролиза имеет вид:
CN– + Н2ООН– + HCN или в молекулярной форме:CN
+ Н2ОКОН +
HCN. В результате гидролиза появляется
избыток гидроксид-ионов ОН–,
поэтому раствор имеет щелочную реакцию
среды
(рН > 7);
б) карбонат калия
–
соль слабой многоосновной кислоты и
сильного основания. В этом случае анионы
соли СО32-,
связывая водородные ионы воды Н+,
образуют анионы кислой соли НСО3
–,
а не молекулы Н2СО3,
так как ионы НСО3–
диссоциируют гораздо труднее, чем
молекулы Н2СО3.
В обычных условиях гидролиз идет по
первой ступени. Соль гидролизуется по
аниону. Ионно-молекулярное уравнение
имеет вид:
СO3– + H2OОН–+ НСO3–
или в молекулярной форме:К2СО3+ Н2ОКОН +
NaHCО3.В растворе появляется избыток
ионов ОН–, поэтому раствор К2СO3имеет щелочную реакцию (рН > 7);
в) сульфат цинка ZnSО4– соль слабого
многокислотного основания Zn(OH)2и сильной кислоты H2SO4. В этом
случае катионы Zn2+связывают
гидроксильные ионы воды ОН–,
образуя катионы основной соли ZnOH+.
Образование молекул Zn(OH)2не
происходит, так как ионы ZnОН+диссоциируют гораздо труднее, чем
молекулы Zn(OH)2. В обычных условиях
гидролиз идет по первой ступени. Соль
гидролизуется по катиону.
Ионно-молекулярное уравнение гидролиза
имеет вид:
Zn2++ Н2ОН++ ZnОН+или в молекулярной
форме:
2ZnSО4+ 2Н2О(ZnOH)2SО4
+H2SO4.
В растворе появляется избыток ионов
водорода Н+, поэтому раствор ZnSО4имеет кислую реакцию (рН < 7).
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Теоретическое введение
Примеры обратимого гидролиза
Случаи необратимого гидролиза
Константа и степень гидролиза
Примеры решения задач
Задачи для самостоятельного решения
Теоретическое введение
Гидролиз – обменная реакция взаимодействия растворенного вещества (например, соли) с водой. Гидролиз происходит в тех случаях, когда ионы соли способны образовывать с Н+ и ОН— ионами воды малодиссоциированные электролиты.
Примеры обратимого гидролиза
Соли, образованные сильным основанием и слабой кислотой, например, CH3COONa, Na2CO3, Na2S, KCN гидролизуются по аниону:
СН3СООNa + НОН ↔ СН3СООН + NaОН (рН > 7)
Гидролиз солей многоосновных кислот протекает ступенчато. 1 ступень:
CO32– + HOH ↔ HCO3– + OH–,
или в молекулярной форме:
Na2CO3 + HOH ↔ NaHCO3 + NaOH.
2 ступень:
НCO3– + HOH ↔ Н2CO3 + OH—,
или в молекулярной форме:
NaНCO3 + HOH ↔ H2CO3 + NaOH.
Продукты гидролиза по первой ступени подавляют вторую ступень гидролиза, в результате вторая ступень гидролиза протекает незначительно.
Соли, образованные слабым основанием и сильной кислотой, например, NH4Cl, FeCl3, Al2(SO4)3, гидролизуются по катиону:
NH4+ + HOH ↔ NH3·H2О + H+
или в молекулярной форме:
NH4Cl + HOH ↔ NH3·H2О + HCl (рН < 7).
Соли, образованные многокислотными основаниями, гидролизуются ступенчато, образуя катионы основных солей. 1 ступень:
Fe3+ + HOH ↔ FeOH2+ + H+;
FeCl3 + HOH ↔ FeOHCl2 + HCl
2 ступень:
FeOH2+ + HOH ↔ Fe(OH)2+ + H+;
FeOHCl2 + HOH ↔ Fe(OH)2Cl+ HCl.
3 ступень:
Fe(OH)2+ + HOH ↔ Fe(OH)3 + H+;
Fe(OH)2Cl + HOH ↔ Fe(OH)3+ HCl.
Гидролиз по второй и, в особенности, по третьей ступени практически не протекает при комнатной температуре.
Соли, образованные слабым основанием и слабой кислотой, например, CH3COONH4, (NH4)2CO3, HCOONH4, гидролизуются и по катиону, и по аниону:
СH3COO– + NH4+ + HOH ↔ СH3COOH + NH3·H2О.
СH3COONH4 + HOH ↔ СH3COOH + NH3·H2О.
В этом случае реакция раствора зависит от соотношения констант диссоциации образующихся кислот и оснований. Поскольку в рассматриваемом примере константы диссоциации СH3COOH и NH3·H2О при 25оС примерно равны (Кд(СH3COOH) = 1,75·10–5, Кд(NH3·H2О) = 1,76·10–5), то раствор соли будет нейтральным.
При гидролизе HCOONH4 реакция раствора будет слабокислой, поскольку константа диссоциации муравьиной кислоты (Кд(HCOOН) = 1,77·10–4) больше константы диссоциации уксусной кислоты.
Соли, образованные сильным основанием и сильной кислотой (например, NaNO3, KCl, Na2SO4), при растворении в воде гидролизу не подвергаются.
Случаи необратимого гидролиза
Гидролиз некоторых солей, образованных слабыми основаниями и слабыми кислотами, протекает необратимо. Необратимо гидролизуется, например, сульфид алюминия:
Al2S3 + 6H2O → 2Al(OH)3↓ + 3H2S↑
Следует отметить, что при смешении растворов солей гидролизующихся по аниону и катиону:
Mg2+ + HOH ↔ MgOH+ + H+,
CO32– + HOH ↔ HCO3– + OH–
Продукты гидролиза первой соли усиливают гидролиз второй соли и наоборот. В результате при смешении водных растворов сульфата магния и карбоната натрия образуется основной карбонат магния:
2MgSO4 + 2Na2CO3 + H2O → Mg2(OH)2CO3↓ + CO2↑ + 2Na2SO4
Основные карбонаты выпадают в осадок также при смешивании растворов карбонатов щелочных металлов и солей Be2+, Co2+, Ni2+, Zn2+, Pb2+, Cu2+ и др.
При сливании растворов соды и солей Fe2+, Ca2+, Sr2+, Ba2+ реакции протекают следующим образом:
МеCl2 + Na2CO3 = МеCO3↓ + 2NaCl
(Ме – Fe, Ca, Sr, Ba)
При взаимодействии солей Аl3+, Сr3+ и Fe3+ в растворе с сульфидами, карбонатами и сульфитами в результате гидролиза в осадок выпадают не сульфиды, карбонаты и сульфиты этих катионов, а их гидроксиды:
2AlCl3 + 3Na2S + 6H2O = 2Al(OH)3↓ + 3H2S↑ + 6NaCl,
2CrCl3 + 3K2CO3 + 3H2O = 2Сr(ОН)3↓ + 3СO2↑ + 6KCl,
2Fe(NO3)3 + 3Na2SO3 + 3H2O = 2Fe(ОН)3↓ + 3SO2↑ + 6NaNO3.
Следует отметить, что катион Fe3+ производит окисляющее действие на анион S2-. В результате протекает реакция:
2Fe3+ + S2- = 2Fe2+ + Sо.
Например, хлорид железа (III) реагирует с сульфидом калия:
2FeCl3 + 3K2S = 2FeS + S + 6KCl
Некоторые соли в результате гидролиза в воде образуют малорастворимые оксосоединения:
Bi(NO3)3 + H2O → BiONO3↓ + 2 HNO3,
SbCl3 + H2O → SbOCl↓ + 2HCl.
Необратимо гидролизуются в водных растворах галогенангидриды:
SO2Cl2 + 2 H2O = H2SO4 + 2 HCl,
SOCl2 + 2 H2O = H2SO3 + 2 HCl,
PCl5 + 4 H2O = H3PO4 + 5 HCl,
CrO2Cl2 + 2H2O = H2CrO4 + 2HCl.
Константа и степень гидролиза
Константа Кг и α г степень гидролиза для растворов электролитов связаны между собой уравнением, по форме совпадающим с уравнением Оствальда:

Константа гидролиза Кг может быть рассчитана на основе значений ионного произведения воды Кw и константы диссоциации Кд образующихся в результате гидролиза слабой кислоты или слабого основания:

Примеры решения задач
Задача 1. Вычислите Кг, α г и рН 0,01 М раствора NH4Cl при температуре 298 К, если при указанной температуре Кд(NH3·H2O) = 1,76× 10-5.
Решение.
NH4+ + H2O ↔ NH3·H2O + H+

Кг ≈ Cисх(NH4Cl)·αг2.
αг2 = √(Kг / Cисх(NH4Cl))
или 2,4× 10-2 %.
[Н+] = 2,4·10–4× 0,01 = 2,4× 10–6М.
рН = — lg 2,4× 10–6 = 5,6.
Задача 2. Определите константу гидролиза, степень гидролиза и рН 0,02 М раствора НСООNa при 298 К, если при указанной температуре Кд(НСООН) = 1,77× 10–4.
Решение. Формиат натрия гидролизуется в соответствии с уравнением:
НСОО— + Н2О ↔ НСООН + ОН—.
Поскольку [НСООН] = [ОН–] и [НСОО–]·Сисх(НСООNa), то константу гидролиза можно записать следующим образом:

или 5,3·10-3%.
[Н+] = 10–14÷1,06× 10–6 = 9,4·10–9 М
рН = — lg 9,4× 10–9 = 8
Задача 3. Определите рН 0,006М раствора NaNO2, если α г = 7·10–3%.
Решение.
NO2– + H2O ↔ HNO2 + OH–.
[ОН–] = 0,006× 7× 10–5 = 4,2× 10–7 М.
[Н+] = 10–14:4,2× 10–7 = 2,4× 10–8 М.
рН = — lg 2,4× 10–8 = 7,6.
Задача 5. Определите рН 0,1 М раствора Na3PO4 при 298 К, если константы диссоциации ортофосфорной кислоты при указанной температуре соответственно равны: Кд.1 = 7,11× 10— 3, Kд.2 = 6,34× 10— 8, Kд.3 = 4,40× 10— 13.
Решение. Na3PO4 диссоциирует в растворе и подвергается ступенчатому гидролизу:
Na3PO4 → 3Na+ + PO43-
PO43- + H2O ↔ HPO42- + OH—
.
Следует обратить внимание на выбор “нужной” величины Кд.
HPO42- + H2O ↔ H2PO4- + OH—
H2PO4— + H2O H3PO4 + OH—
.
H2PO4— HPO42- + H+
Kдисс.2 = 6,34·10— 8
Поскольку Кг,3 < < Kд,2, то гидролиз по третьей ступени практически не идет и в растворе NaH2PO4 преобладает процесс диссоциации ионов H2PO4— .
Так как Кг,1 > > Кг,2, то можно считать, что соль подвергается гидролизу только по первой ступени.
Значит:

поскольку [HPO42- ] = [OH—].
Можно принять, что Сисх(Na3PO4) ≈ [PO43- ], тогда
рОН = –lg 4,76× 10— 2 = 1,32 и рН = 14 – 1,32 = 12,68.
Задачи для самостоятельного решения
1. Гидролиз соли Na2SO3 усилится при добавлении в раствор веществ:
| а) Н2O | б) Na2CO3 | в) NaOH |
| г) H2SO4 | д) Na2S | е) Na2SO4 |
2. Напишите уравнение реакции NiCl2 + Na2CO3 + H2O → .
3. Напишите уравнение реакции Fe2(SO4)3 + Na2CO3 + H2O→
4. Напишите уравнение реакции KCr(SO4)2 + K2S + 6H2O → .
5. Напишите уравнение реакции гидролизa BiCl3.
6. Напишите уравнение реакции гидролизa Al2(SO4)3.
7. Напишите уравнение реакции гидролизa SO2Cl2.
8. Определите рН 0,01 М раствора Na2 НPO4 при 298 К, если константы диссоциации ортофосфорной кислоты при указанной температуре соответственно равны:
К1 = 7,11× 10— 3, K2 = 6,34× 10— 8, K3 = 4,4× 10— 13.
9. При 298 К рН 0,049 М раствора KCN равен 11. Определите константу диссоциации синильной кислоты при указанной температуре.
10. Рассчитать константу гидролиза, степень гидролиза NH4NO3 в 0,18 М растворе, если рН 0,18 М раствора нитрата аммония равен 5.
Термин, используемый для описания электрохимического процесса, протекающего в расстворах, а также для обозначения подобного биологического процесса.
Обычно гидролиз представляет собой химический процесс, при котором молекула воды присоединяется к определенному веществу. Иногда это присоединение заставляет молекулу вещества и воды диссоциировать на части. В таких реакциях один фрагмент молекулы-мишени (или родительской молекулы) получает ион водорода. Он разрушает химическую связь в соединении.
Гидролиз солей
Растворимые в воде соли практически полностью диссоциируют на ионы. В некоторых солях катионы более реакционноспособны по сравнению с анионами, и они реагируют с водой с образованием ионов H+. Таким образом, раствор приобретает кислую среду:
M++H2O→MOH+H+M^+ + H_2O → MOH + H^+
В других солях анионы могут быть более реакционноспособными по сравнению с катионами, и они реагируют с водой с образованием ионов ОН–. Таким образом, раствор становится щелочным:
A−+H2O→HA+OH−A^-+ H_2O → HA + OH^-
Процесс гидролиза соли фактически является обратной нейтрализацией:
соль + вода → кислота + основание
Поскольку природа катиона или аниона соли определяет, будет ли ее раствор кислым или щелочным, целесообразно рассмотреть все четыре возможные комбинации.
Соли сильных кислот и слабых оснований
Раствор такой соли является кислым. Катион соли, пришедший из слабого основания, является реакционноспособным. Он реагирует с водой с образованием слабого основания и ионов H+.
B++H2O→BOH+H+B^+ + H_2O → BOH + H^+
Пример 1
Рассмотрим, например, NH4ClNH_4Cl. Он полностью ионизован в воде на ионы NH4+NH_4^+ и Cl−Cl^-. Ионы реагируют с водой с образованием слабого основания (NH4OH)(NH_4OH) и ионов H+H^+.
NH4++H2O→NH4OH+H+NH^+_4 + H_2O → NH_4OH + H^+
Таким образом, концентрация ионов водорода возрастает, и раствор становится кислым.
Соли слабых кислот и сильных оснований
Раствор такой соли является щелочным. Анион соли реагирует с водой с образованием слабых ионов кислоты и OH–ионов.
A−+H2O→HA+OH−A^- + H_2O → HA + OH^-
Пример 2
Рассмотрим, например, соль CH3COONaCH_3COONa. Он полностью ионизирует в воде, чтобы дать ионы CH3COO−CH_3COO^- и Na+Na^+. CH3COO−CH_3COO^- ионы реагируют с водой с образованием слабых кислот, ионов CH3COOHCH_3COOH и OH−OH^- ионов.
CH3COO−+H2O→CH3COOH+OH−CH_3COO^- + H_2O → CH_3COOH + OH^-
Таким образом, концентрация ионов OH–ионов возрастает, раствор становится щелочным.
Соли слабых кислот и слабых оснований
В случае соли такого типа гидролиз происходит максимально, так как катион и анион являются реакционноспособными и реагируют с водой с образованием ионов H+ и OH–. Образованный раствор, как правило, остается нейтральным, но он может быть либо слабо кислым, либо слабощелочным, если обе реакции происходят с разными скоростями.
Пример 3
Рассмотрим, например, соль CH3COONH4CH_3COONH_4. Она диссоциирует на ионы ионы CH3COO−CH_3COO^- и ионы NH4+NH_4^+, которые реагируют с водой:
CH3COO−+H2O→CH3COOH+OH−CH_3COO^- + H_2O → CH_3COOH + OH^-
NH4++H2O→NH4OH+H+NH^+_4 + H_2O → NH_4OH + H^+
Среда раствора соли, образованной слабой кислотой и слабым основанием будет определяться из соотношения pK ее катиона и аниона.
Когда pKa = pKb, pH = 7, то есть раствор соли будет нейтральным.
Когда pKa > pKb. Раствор будет щелочным, так как кислота будет немного слабее, чем основание, а значение pH будет больше 7.
В случае pKa < pKb раствор будет кислым, так как кислота относительно сильнее основания, а pH будет меньше 7.
Соли сильных кислоты и сильных оснований
Такая соль, например NaClNaCl, не подвергается гидролизу, так как ионы не реагируют. Таким образом, раствор будет нейтральным.
Константа и степень гидролиза
Количественно гидролиз оценивают по степени и константе гидролиза.
Количественный показатель характеризующий процесс гидролиза, выражается как степень гидролиза и определяется как доля одного моля соли, которая гидролизуется когда достигнуто равновесие. Он обычно выражается как h или x:
h = (количество гидролизованой соли) / (общее количество соли)
Степень гидролиза зависит от природы соли, ее концентрации и температуры раствора. С разбавлением и повышением температуры раствора степень гидролиза соли растет.
Полнее характеризует гидролиз константа гидролиза (Кг). которая является константой равновесия относительно реакции гидролиза.
Пример 4
Например, для CH3COONaCH_3COONa, гидролиз которого происходит по уравнению:
CH3COO−+H2O→CH3COOH+OH−,CH_3COO^- + H_2O → CH_3COOH + OH^-,
согласно закону действующих масс. Можно записать константу гидролиза Кг в таком виде:
Кг=OH−[CH3COOH][CH3COO−]Кг=frac{OH^-[CH_3COOH]}{[CH_3COO^-]}
Помножим числитель и знаменатель уравнения на [Н+], тогда с учетом того, что [Н+] [ОН–] = Kw, уравнение будет иметь вид
Кг=H+OH−[CH3COOH]H+[CH3COO−]=КwКд(CH3COOH)Кг=frac{H^+OH^-[CH_3COOH]}{H^+[CH_3COO^-]}=frac{Кw}{Кд(CH_3COOH)}
Тест по теме «Гидролиз солей. Константа и степень гидролиза»
Гидролиз
Гидролиз (греч. hydor – вода и lysis – разрушение) – процесс расщепления молекул сложных химических веществ за счет реакции с молекулами воды.
В химии, как и в жизни, разрушается чаще всего нестойкое и слабое (стойкое и сильное выдерживает удар). Запомните, что гидролиз (вода) разрушает “слабое” – это правило вам очень пригодится.
Любая соль состоит из остатка основания и кислоты. Абсолютно любая:
- NaCl – производное основания NaOH и кислоты HCl
- KNO3 – производное основания KOH и кислоты HNO3
- CuSO4 – производное основания Cu(OH)2 и кислоты H2SO4
- Al3PO4 – производное основания Al(OH)3 и кислоты H3PO4
- Ca(NO2)2 – производное основания Ca(OH)2 и кислоты HNO2
Чтобы успешно решать задания по теме гидролиза и писать реакции, вам следует запомнить, какие основания и кислоты являются слабыми, а какие – сильными.
При изучении гидролиза я рекомендую ученикам сохранить на гаджет схему, которую вы видите ниже. Для того, чтобы приобрести нужный опыт – она незаменима. Пользуйтесь ей как можно чаще, подглядывайте в нее и она незаметно окажется в вашем интеллектуальном составляющем 😉
По катиону, по аниону или нет гидролиза?
Итак, если в состав соли входит остаток сильного основания и остаток сильной кислоты – гидролиза не происходит. Примеры: NaCl, KBr, CaSO4. Также гидролиза не происходит, если соль нерастворима (вне зависимости от того, чем она образована): AlPO4, FeSO3, CaSO3.
Если в состав соли входит остаток слабого основания и остаток сильной кислоты, то гидролиз идет по катиону. Помните, что гидролиз разрушает слабое, в данном случае – катион. Примеры: AlCl3, MgBr2, Cr2SO4, NH4NO3.
Катион NH4 + и его основание NH4OH , несмотря на растворимость, является слабым, поэтому гидролиз будет идти по катиону в соли NH4Cl. Замечу также, что Ca(OH)2 считается растворимым основанием, поэтому гидролиза соли CaCl2 не происходит.
Если в состав соли входит остаток сильного основания и остаток слабой кислоты, то гидролиз идет по аниону. Примеры: K3PO4, NaNO2, Ca(OCl)2, Ba(CH3COO)2, Li2SiO3.
Если соль образована остатком слабого основания и слабой кислоты, то гидролиз идет и по катиону, и по аниону. Примеры: Mg(NO2)2, Al2S3, Cr2(SO3)3, CH3COONH4.
Среда раствора
Среда раствора может быть нейтральной, кислой или щелочной. Определяется типом гидролиза. Некоторые задания могут быть построены так, что, увидев соль, вы должны будете определить ее тип раствора.
Обрадую вас: если вы усвоили тему гидролиза, сделать это проще простого. В случае, когда гидролиз не идет или идет и по катиону, и по аниону среда раствора – нейтральная.
Если гидролиз идет по катиону (разрушается остаток основания) среда – кислая, если гидролиз идет по аниону (разрушается остаток кислоты), то среда раствора будет щелочная. Изучите примеры.
Однако замечу, что в дигидрофосфатах, гидросульфитах и гидросульфатах среда всегда кислая из-за особенностей диссоциации. Примеры: NH4H2PO4, LiHSO4. В гидрофосфатах среда щелочная из-за того, что константа диссоциации по третьей ступени меньше, чем константа гидролиза. Примеры: K2HPO4, Na2HPO4.
Попробуйте определить среду раствора для соединений из самостоятельного задания, которое вы только что решили. Ниже будет располагаться решение.
С целью запутать в заданиях часто бывают даны синонимы. Так “среду раствора” могут заменить водородным показателем pH.
Запомните, что кислая среда характеризуется pH 7.
Например, в соли CaCl2 среда раствора будет нейтральной (pH=7), а в растворе AlCl3 – кислой (pH
Гидролиз солей
В общем случае, гидролиз солей – это процесс обменного разложения воды и растворенной в ней соли – электролита, приводящий к образованию малодиссоциирующего вещества.
Гидролиз является частным случаем сольволиза – обменного разложения растворенного вещества и растворителя.
Характеризовать гидролиз количественно позволяют такие величины, как Степень гидролиза и константа гидролиза.
Степень гидролиза
Степень гидролиза — это соотношение количества подвергающейся гидролизу соли nгидр и общего количества растворенной соли nобщ.
Обычно, ее обозначают через hгидр (или α ):
Величина hгидр увеличивается с уменьшением силы образующих соль кислоты или основания.
Константа гидролиза
Представим в общем виде процесс гидролиза соли, в котором в роли соли выступает – МА, а НА и МОН — соответственно, кислота и основание, которые образуют данную соль:
MA + H2O ↔ HA + MOH
Применив закон действующих масс, запишем константу, соответствующую этому равновесию:
Известно, что концентрация воды в разбавленных растворах, имеет практически постоянное значение, поэтому ее можно включить в константу
тогда соотношение для константы гидролиза соли Kг будет иметь такой вид:
По величине константы гидролиза можно судить о полноте гидролиза:
чем больше значение константы гидролиза Kг, тем в большей мере протекает гидролиз.
Константа и степень гидролиза связаны соотношением:
Где С – концентрация соли в растворе,
h- степень гидролиза.
Это выражение можно упростить, т.к. обычно h˂˂1, тогда
Зная, константу гидролиза, можно определить pH среды:
Концентрация образовавшейся кислоты равна концентрации гидроксид ионов, тогда
Kг = [OH — ] 2 /[MA]
Используя это выражение можно вычислить pH раствора
[OH — ] = (Kг·[MA]) 1/2 моль/л
[H + ] = 10 -14 /[OH — ] моль/л
pH = -lg[H + ]
Гидролиз солей можно представить, как поляризационное взаимодействие ионов и их гидратной оболочки.
Гидролиз протекает тем полнее, сильнее поляризующее действие ионов.
Возможны 4 случая протекания гидролиза:
1. Соли, образованные сильным основанием и сильной кислотой (гидролиз не протекает)
Соли, образованные сильным основанием и сильной кислотой не подвергаются гидролизу.
В этом случае, гидролиз практически не происходит, т.к. катионы и анионы, образующиеся в растворе при диссоциации соли, слабо поляризуют гидратную оболочку. pH среды не изменяется (рН ≈ 7):
NaCl ↔ Na + + Cl —
Na + + HOH ↔ реакция практически не протекает
Cl — + HOH ↔ реакция практически не протекает
2. Соли, образованные слабым основанием и сильной кислотой (гидролиз по катиону)
Такое соединение, при ионизации, образует катионы, способные к поляризации гидратной оболочки и анионы, которые их поляризуют слабо. Тогда гидролиз проходит по катиону, при этом среда носит кислый характер, т.е. рН ˂ 7:
NH4Cl ↔ NH4 + + Cl —
NH4 + + HOH ↔ NH4OH + H +
Cl — + HOH ↔ реакция практически не идет
NH4Cl+ HOH ↔ NH4OH + HCl
Для солей, образованных слабым основанием и сильной кислотой, константа гидролиза и константа диссоциации основания связаны соотношением:
Понятно, что чем меньше сила основания, тем в большей степени протекает гидролиз.
Если соль образованна слабым основанием многовалентного металла и сильной кислотой, то ее гидролиз будет протекать ступенчато:
FeCl2 ↔ Fe 2+ + 2Cl —
| I ступень | Fe 2+ + HOH ↔ (FeOH) + + H + FeCl2 + HOH ↔ (FeOH)Cl + HCl |
| II ступень | (FeOH) + + HOH ↔ Fe(OH)2 + H + (FeOH)Cl + HOH↔ Fe(OH)2 + HCl |
Константа гидролиза по первой ступени связана с константой диссоциации основания по второй ступени, а константа гидролиза по второй ступени — с константой диссоциации основания по первой ступени:
Поскольку первая константа диссоциации кислоты всегда больше второй, то первая константа гидролиза всегда больше, чем константа вторая гидролиза, так как первая константа диссоциации основания всегда больше второй
Отсюда следует, что по первой ступени, гидролиз всегда будет протекать в большей степени, чем по второй. Этому также способствуют ионы, которые образуются при гидролизе по первой ступени, они приводят подавлению гидролиза по второй ступени, смещая равновесие влево.
Сравнивая величины Kг и Kосн можно качественно определить pH среды.
Так, если Kг намного больше Kосн, то среда сильнокислая, при Kг намного меньшей Kосн — среда слабокислая, а если Kг и Kосн сопоставимы, то — среднекислая.
3. Соль, образованная сильным основанием и слабой кислотой (гидролиз по аниону)
Такое соединение в растворе образует слабополяризующие катионы и среднеполяризующие анионы. Гидролиз протекает по аниону, и в его результате создается щелочная среда, pH > 7:
NaCN ↔ Na + + CN —
CN — + HOH ↔ HCN + OH —
Na + + HOH ↔ реакция практически не идет
NaCN + HOH ↔ HCN + NaOH
Константа гидролиза и константа диссоциации кислоты связаны зависимостью:
Т.е. гидролиз соли протекает тем полнее, чем слабее образующая эту соль, кислота.
Возможен гидролиз соли, образованной слабой многоосновной кислотой и сильным основанием. В этом случае гидролиз протекает по ступеням:
| I ступень | SO3 2- + HOH ↔ HSO3 — + OH — Na2SO3 + HOH ↔ NaHSO3 + NaOH |
| II ступень | HSO3 — + HOH ↔ H2SO3 + OH — NaHSO3 + HOH ↔ H2SO3 + NaOH |
В этом случае, константа гидролиза по первой и второй ступеням определяется соотношениями:
Следует помнить, что гидролиз по второй ступени протекает в ничтожно малой степени.
Сравнивая величины Kг и Kк-ты, можно качественно определить pH среды. Так, если Kг намного больше Kк-ты, то среда сильнощелочная, при Kг намного меньшей Kк-ты — среда слабощелочная, а если Kг и Kосн сопоставимы, то — среднещелочная.
4. Соли, образованные слабым основанием и слабой кислотой (гидролиз и по катиону и по аниону)
Такие соли, при ионизации образуют среднеполяризующие катионы и анионы, поэтому гидролиз возможен как по катиону, так и по аниону.
При этом относительная сила образовавшихся кислоты и основания, будут влиять на характер среды (слабокислая или слабощелочная, pH ≈ 7). Такого типа гидролиз протекает особо полно, обычно с образованием малорастворимого вещества:
Константу гидролиза можно рассчитать, зная константы диссоциации кислоты и основания с помощью следующего соотношения:
Совместный гидролиз солей
Совместный гидролиз протекает при взаимодействии растворов двух солей, одна из которых образована слабым основанием и сильной кислотой, а вторая напротив сильным основанием и слабой кислотой. Т.е. одна соль гидролизуется по катиону, а другая – по аниону.
В таких случаях гидролиз взаимно усиливается.
Например, рассмотрим совместный гидролиз растворов солей хлорида алюминия и сульфида натрия:
При гидролизе хлорида алюминия соль гидролизуется по катиону:
AlCl3 ↔ Al 3+ + 3Cl —
Al 3+ + 3HOH ↔ Al(OH)3 + 3H +
При гидролизе сульфида натрия соль гидролизуется по аниону:
Na2S ↔ 2Na + + S 2-
S 2- + 2HOH ↔ H2S + 2OH —
Суммарная реакция гидролиза:
Влияние различных факторов на протекание гидролиза
- Природа соли. Это видно из выражения для константы гидролиза.
- Концентрация соли и продуктов реакции. В соответствии с принципом Ле-Шателье, равновесие должно смещаться вправо, при этом увеличивается концентрация ионов водорода (или гидроксид-ионов), что приводит к уменьшению степени гидролиза.
- Температура. Известно, что гидролиз притекает с поглощением теплоты (эндотермическая реакция), поэтому согласно принципу Ле Шателье, при увеличении температуры равновесие сдвигается вправо, что ведет к росту степени гидролиза.
В разделе Задачи к разделу Гидролиз солей приведены задачи на определение степени и константы гидролиза, составление уравнений гидролиза, определение рН среды и др.
Гидролиз
О чем эта статья:
11 класс, ЕГЭ/ОГЭ
Определение гидролиза
Гидролиз — это процесс взаимодействия сложного химического вещества с водой, итогом которого становится разложение молекул этого вещества. Сам термин происходит от двух греческих слов: hydor, что значит «вода», и lysis, то есть «распад».
Гидролизации подвержены как органические, так и неорганические вещества: углеводы, белки, оксиды, карбиды, соли и т. д. Например, гидролиз органических соединений напрямую связан с пищеварением — с его помощью происходит распад и усвоение клетками организма жиров, белков, углеводов. Но сейчас мы займемся неорганической химией и рассмотрим гидролизацию на примере солей.
Гидролиз солей — это реакция взаимодействия ионов соли с Н + и ОН − ионами воды, которая ведет к распаду исходного соединения. В результате такого ионного обмена образуется слабый электролит — кислотный, щелочной или нейтральный.
Условия гидролиза
Далеко не все соединения распадаются, вступая в реакцию с молекулами воды. Сейчас мы на примере солей рассмотрим, какие вещества подвергаются гидролизу, а какие нет, и от чего это зависит.
Начнем с того, что любая соль включает основание — амфотерный гидроксид, и кислотный остаток.
сульфат меди CuSO4состоит из основания Cu(ОН)2и кислоты H2SO4;
хлорид натрия NaCl состоит из основания NaOH и кислоты HCl;
хлорид цинка ZnCl2состоит из основания Zn(ОН)2 и кислоты HCI;
карбонат натрия Na2CO3состоит из основания NaOH и кислоты H2CO3.
В жизни первым разрушается самое слабое, и гидролиз в химии действует по тому же принципу. В ходе этой реакции распадаются более слабые соединения (основания или кислотные остатки). Слабый катион или слабый анион вступают во взаимодействие с ионами воды и связывают один из них или оба. В растворе образуется избыток ионов H + или гидроксильная группа OH − .
В зависимости от того, какие соли подвергаются гидролизу — со слабым основанием или слабой кислотой, в итоге может получиться кислая, щелочная или нейтральная среда водного раствора.
А что происходит, если соль состоит из сильного основания и сильного кислотного остатка? Ничего. 🙂 В этом случае ее сильные катионы и анионы не взаимодействуют с ионами воды. Такая соль не распадается, то есть не подвержена гидролизу.
Схема химической реакции гидролиза выглядит так:
XY + HOH ↔ XH + HOY
В данном случае:
XY — формула соли;
XH — кислотный остаток;
Индикаторы среды раствора
Для определения среды раствора за считанные секунды используются специальные индикаторы. Самый распространенный из них — лакмусовая бумага, но также популярны фенолфталеин и метиловый оранжевый. В нейтральной среде они не меняют свой цвет, а в кислотной или щелочной — приобретают другую окраску.
Изменение цвета индикатора однозначно говорит о том, что произошла гидролизация. Однако если цвет остался тем же — это не всегда означает отсутствие гидролиза. Среда будет почти нейтральной и в том случае, когда гидролизу подвергается соль со слабым основанием и слабой кислотой. Но об этом поговорим дальше, а пока посмотрите таблицу.
Виды гидролиза
Мы выяснили, что в составе соли может быть слабый ион, который и отвечает за гидролизацию. Он находится в основании, в кислотном остатке или в обоих компонентах, и от этого зависит тип гидролиза.
Соль с сильным основанием и сильной кислотой
Гидролиз отсутствует. Как вы уже знаете, при наличии сильного основания и сильного кислотного остатка соль не распадается при взаимодействии с водой. Так, например, невозможен гидролиз хлорида натрия (NaCl), поскольку в составе этого вещества нет слабых ионов. К таким же не подверженным гидролизации солям относят KClO4, Ba(NO3)2 и т. д.
Среда водного раствора — нейтральная, т. е. pH = 7.
Реакция индикаторов: не меняют свой цвет (лакмус остается фиолетовым, а фенолфталеин — бесцветным).
Соль со слабым основанием и сильной кислотой
Гидролиз по катиону. Как мы помним, гидролизация происходит только при наличии слабого иона, в данном случае — иона основания. Его катион вступает в реакцию и связывает гидроксид-ионы воды OH − . В итоге образуется раствор с избытком ионов водорода H + .
Среда водного раствора — кислая, pH меньше 7.
Реакция индикаторов: фенолфталеин остается бесцветным, лакмус и метиловый оранжевый — краснеют.
Нитрат аммония NH4NO3 состоит из слабого основания NH4OH и сильного кислотного остатка HNO3, поэтому он гидролизуется по катиону, то есть его катион NH4 + связывает ионы воды OH − .
Соль с сильным основанием и слабой кислотой
Гидролиз по аниону. Если слабым оказывается ион кислотного остатка, его отрицательно заряженная частица (анион) взаимодействует с катионом водорода H + в молекуле воды. В итоге получается раствор с повышенным содержанием OH − .
Среда водного раствора — щелочная, pH больше 7.
Реакция индикаторов: фенолфталеин становится малиновым, лакмус — синим, а метиловый оранжевый желтеет.
Нитрат калия KNO2 отличается сильным основанием KOH и слабым кислотным остатком HNO2, поэтому он гидролизуется по аниону. Другими словами, анион кислоты NO2 − связывает ионы воды H + .
Молекулярное уравнение: KNO2 + H2O ↔ HNO2 + KOH
Ионное уравнение: K + + NO2 − + HOH ↔ HNO2 + K + + OH −
Гидролиз по катиону и аниону. Если у соли оба компонента — слабые, при взаимодействии с водой в реакцию вступает и анион, и катион. При этом катион основания связывает ионы воды OH − а анион кислоты связывает ионы H +
Среда водного раствора: нейтральная, слабокислая или слабощелочная.
Реакция индикаторов: могут не изменить свой цвет.
Цианид аммония NH4CN включает слабое основание NH4OH и слабую кислоту HCN.
Молекулярное уравнение: NH4CN + H2O ↔ NH4OH + HCN
Ионное уравнение: NH4 + + CN − + HOH ↔ NH4OH + HCN
Среда в данном случае будет слабощелочной.
Обобщим все эти сведения в таблице гидролиза солей.
Ступенчатый гидролиз
Любой из видов гидролиза может проходить ступенчато. Так бывает в тех случаях, когда с водой взаимодействует соль с многозарядными катионами и анионами. Сколько ступеней будет включать процесс — зависит от числового заряда иона, отвечающего за гидролиз.
Как определить количество ступеней:
если соль содержит слабую многоосновную кислоту — число ступеней равняется основности этой кислоты;
если соль содержит слабое многокислотное основание — число ступеней определяют по кислотности основания.
Для примера рассмотрим гидролиз карбоната калия K2CO3. У нас есть двухосновная слабая кислота H2CO3, а значит, гидролизация пройдет по аниону в две ступени.
I ступень: K2CO3+HOH ↔ KOH+KHCO3, итогом которой стало получение гидроксида калия (KOH) и кислой соли (KHCO3).
II ступень: K2HCO3+HOH ↔ KOH+H2CO3, в итоге получился тот же гидроксид калия (KOH) и слабая угольная кислота (H2CO3).
Для приблизительных расчетов обычно принимают в учет только результаты первой ступени.
Обратимый и необратимый гидролиз
Химические вещества могут гидролизоваться обратимо или необратимо. В первом случае распадается лишь некоторое количество частиц, а во втором — практически все. Если соль полностью разлагается водой, это необратимый процесс, и его называют полным гидролизом.
Необратимо гидролизуются соли, в составе которых есть слабые нерастворимые основания и слабые и/или летучие кислоты. Такие соединения могут существовать лишь в сухом виде, их не получить путем смешивания водных растворов других солей.
Например, полному гидролизу подвергается сульфид алюминия:
Как видите, в результате гидролизации образуется гидроксид алюминия и сероводород.
Необратимые реакции при взаимодействии с водой имеют место и в органической химии. В качестве примера рассмотрим полный гидролиз органического вещества — карбида кальция, в результате которого образуется ацетилен:
Степень гидролиза
Взаимодействие соли или другого химического соединения с водой может усиливаться или ослабляться в зависимости от нескольких факторов. Если нужно получить количественное выражение гидролиза, говорят о его степени, которая указывается в процентах.
h — степень гидролиза,
nгидр. — количество гидролизованного вещества,
nобщ. — общее количество растворенного в воде вещества.
На степень гидролизации может повлиять:
температура, при которой происходит процесс;
концентрация водного раствора;
состав участвующих в гидролизе веществ.
Можно усилить гидролиз с помощью воды (просто разбавить полученный раствор) или стимулировать процесс повышением температуры. Более сложным способом будет добавление в раствор такого вещества, которое могло бы связать один из продуктов гидролиза. К соли со слабой кислотой и сильным основанием нужно добавить соль со слабым основанием и сильной кислотой.
Для ослабления гидролиза раствор охлаждают и/или делают более концентрированным. Также можно изменить его состав: если гидролизация идет по катиону — добавляют кислоту, а если по аниону — щелочь.
Итак, мы разобрались, что такое гидролиз солей и каким он бывает. Пора проверить свои знания и ответить на вопросы по материалу.
Вопросы для самопроверки:
Назовите необходимое условие для гидролиза.
Какие типы гидролиза вы знаете?
В каком случае в результате гидролиза может образоваться слабощелочная или слабокислая среда?
По какому типу гидролизуется соль с сильным основанием и слабым кислотным остатком?
При гидролизе соли с сильным основанием и слабой кислотой для ослабления процесса нужно добавить в раствор кислоту или щелочь?
Как воздействует на гидролиз разбавление раствора водой?
Как определяется количество ступеней гидролиза?
Какая среда раствора образуется при гидролизации солей NaF, KCl, FeBr2, Na2PO4? Ответов может быть несколько.
Какие из солей гидролизуются по катиону: Csl, FeSO4, RbNO3, CuSO4, Mn(NO3)2? Ответов может быть несколько.
Какая из солей не подвергается гидролизу: K2HPO4, KNO3, KCN, Ni(NO3)2?
[spoiler title=”источники:”]
http://zadachi-po-khimii.ru/obshaya-himiya/gidroliz-solej.html
http://skysmart.ru/articles/chemistry/gidroliz
[/spoiler]














