Теория электролитической ионизации (диссоциации).
Электролитическая
ионизация в растворе – это распад
вещества на сольватиованные
(гидратированные) ионы под действием
молекул растворителя.
Данная
теория была разработана шведским ученым
Сванте Аррениусом в 1887 г. Основные ее
положения:
-
Вещества
распадаются на положительные и
отрицательно заряженные ионы под
действием растворителя. -
Под
дейсвием электрического тока положительно
заряженные ионы двигаются к катоду (-)
и называются катионами, а отрицательно
заряженные двигаются к аноду (+) и
называются анионами. -
Диссоциация
– процесс обратимый, наряду с распадом
молекул протекает процесс соединения
ионов в молекулу (молязация).

В
своих работах Аррениус доказал, что
распад молекул на ионы происходит уже
в самом процессе растворения независимо
от того, пропускают электрический ток
через раствор или нет. Благодаря ионизации
увеличивается число частиц в расторе,
что ведет к повышению осмотического
давления, однако он не учитывал
взаимодействие растворенного вещества
с растворителем (сольватационные
процессы), данный процесс рассматривал
как физический.
Основоположником
современной теории электролитической
ионизации как процесса, вызываемого
сольватацией молекул, являются И.А.
Каблуков и В.А. Кистяковский. Они расширили
теорию Аррениуса с позиции химической
теории растворов Д.И. Менделеева.
Основная
причина электролитической ионизации
– гидратация (сольватация) ионов,
затрудняющая обратное соединение ионов
(ассоциацию).
Дипольные
молекулы воды взаимодействуют с ионами
или полярными молекулами в растворе
как за счет неподеленных электронных
пар атома кислорода, так и за счет
образования водородных связей:

Таким
образом, катионы связаны с молекулами
воды по типу донорно-акцепторного
взаимодействия. Доморами являются атомы
кислорода молекулы воды, имеющие
свободные электронные пары, акцепторами
– катионы, имеющие свободные орбитали.
Анионы
связаны с водой водородной связью. Число
координированных молекул воды называется
координационным числом. Оно может
бытьравно 4,6 и т.д. В общем виде растворение
электролита в воде описывает уравнение:
КА
+ (x
+ у) Н2О
↔ [К(Н2О)х]+
+ [А(Н2О)у]–
На
практике пользуются упрощенным
уравнением: КА ↔ К+
+ А–
Таков
механизм ионизации вещества ионного
характера, кристаллическая решетка
которых состоит из ионов.
При
растворении в воде или других полярных
растворителях соединений с ковалентной
полярной связью происходит ионизация
по типу:

Аналогично
идет растворение галогенидов кобальта,
алюминия, хрома, марганца,железа, меди
и др.: СоCl2
+ 6H2O
= [Co(H2O)6]2+
+ 2Cl–
Элементарных
ионов кобальта в растворе нет. Часто
аквакомплексы оказываются настолько
прочными, что выделяются из растворов
в составе кристаллогидратов, например:
CuSO4·5H2O,
AlCl3·6H2O,
BeCl2·4H2O.
Количественной
характеристикой электролитической
ионизации является
 – степень ионизации. Это отношение числа
– степень ионизации. Это отношение числа
ионизированных молекул к общему числу:
 (65)
(65)
По
степени ионизации условно электролиты
делятся на сильные (α>30%), средние (30%
>α > 3%) и слабые (α<3%).
Степень
ионизации можно вычислить, если найти
опытным путем изотонический коэффициент
Вант-Гоффа:
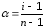 (66)
(66)
n-
общее количество ионов на которые
распадается электролит
Из
сказанного выше следует, что растворы
будут изотоничны, если при одинаковой
температуре содержат одинаковое число
частиц в еденице объема. У растворов с
одинаковой молярной концентрацией
осмотической давление выше в растворе
электролита, с более высоким значением
α. У растворов электролитов с одинаковыми
СМ
и α осмотическое давление выше у раствора
электролита, диссоциирующего на болшее
число частиц.
Факторы,
влияющие на степень ионизации:
-
Природа
растворителя -
Природа
растворенного вещества -
Температура
(ионизация – это эндотермический
процесс, поэтому с повышением температуры
ионизация увеличивается). -
Концентрация
(с увеличением концентрации уменьшается
степень ионизации и наоборот). -
Наличие
одноименных ионов уменьшает степень
ионизации.
К
равновесиям в растворе слабого электролита
применимы законы химического равновесия:


Киониз.
– константа
ионизации
зависит от природы электролита и
растворителя, от температуры и не зависти
от концентрации. Это постоянная величина
(прилож. 7) характеризует способность
электролита распадаться на ионы. Чем
больше Киониз.,
тем лучше вещество распадается на ионы.
Для сильных электролитов Киониз
>1
рКиониз
= -lgКиониз (67)
Взаимосвязь
константы ионизации и степенью ионизации
выражает закон разбавления Оствальда:
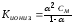
(68)
Для
слабых электролитов, в очень разбавленных
растворах:
 (69)
(69)
Степень
ионизации слабого электролита возрастает
с разведением раствора.
Ионизации
подвергаются не только молекулы, но и
сложные ионы. При ступенчатой ионизации
кислот и оснований каждая ступень
характеризуется собственной константой:
Н3РО4
↔Н+
+ Н2РО4–
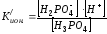
Н2РО4–
↔ Н+
+ НРО42-

НРО42-
↔ Н+
+ РО43-

Общая
Киониз
= К/ион.
· К//ион·
К///ион.
Поскольку К/ион.
> К//ион
> К///ион,
в наибольшей степени идет ионизация по
первой ступени.
Электролиты
– вещества, расплавы и растворы которых
содержат подвижные ионы и проводят
электрический ток. К сильным электролитам,
если растворителем является вода
относятся: все соли, сильные кислоты
(соляная, бромоводородная, йодоводородная,
хлорная, серная, азотная), основания
(гидроксиды лития, натрия, калия, рубидия,
цезия, кальция, бария).
Данные
вещества в растворах полностью
диссоциируют на ионы. Однако экспериментально
было доказано, что не все ионы,
образовавшиеся в результате полной
диссоциации электролита, являются
свободными (электрическая проводимость
растворов электролитов, которая связана
с движением ионов, в концентрированных
растворах оказалась незначительной).
Это говорит о том, что в них ионы движутся
медленнее, чем в разбавленных. Это
обусловлено электростатическим
взаимодействием между ионами и зависит
от концентрации раствора, природы
электролита и среды. Наличие этих сил
приводит к тому, что каждый ион окружен
«ионной атмосферой», состоящей из ионов
с противоположным знаком (сложные
агрегаты – ассоциаты).
Движение
положительных ионов в сторону
отрицательного электрода тормозится
силами притяжения отрицательно заряженной
«ионной атмосферы» к положительному
электроду (рис. 30). При разбавлении это
взаимодействие ослабевает, подвижность
ионов возрастает (максимальна при
бесконечном разбавлении раствора).
Активную
(эффективную) концентрацию электролита
(количество свободных ионов) называют
активностью (Льюис, 1901 г).
Активность
– это условная концентрация соответственно
которой электролит действует в химических
реакциях. Активность раствора связана
с молярной концентрацией:
Рис.
30. Торможение ионов в электрическом
поле.
 (70)
(70)
Для
сильно разбавленных растворов она равна
концентрации.
F
– коэффициент активности, характеризует
межионные взаимодействия. Чем они
сильнее, тем меньше коэффициент, тем
больше отличаются активность и
концентрация. Это безмерная величина,
характеризует степень отклонения
свойств данного раствора от свойств
идеального (если раствор разбавлять,
то
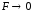 и С=а)
и С=а)
Сила
взаимодействия между ионами – F-
зависят от: концентрации ионов и заряда.
Эти
факторы учитываются величиной – ионной
силой раствора (I)
– полусумма
произведений концентраций всех ионов
в растворах на квадрат их заряда:
 (71)
(71)
Для
сильно разбавленных растворов коэффициент
активности (в приложении 7.) зависит
только от ионной силы. Согласно теории
сильных электролитов Дебая-Гюккеля
(1923 г), коэффициент активности электролита
связан с ионной силой раствора следующим
соотношением:
 (72)
(72)
А
– коэффициент, зависит от заряда иона,
диэлектрической проницаемости среды
и температуры.
Согласно
теории электролитической диссоциации
Аррениуса кислота
– это соединение, распадающееся в водном
растворе с образованием ионов Н+,
а основание
– вещество, при диссоциации которого
образуются ионы ОН–.
Эти определения являются весьма
упрощенными, поскольку относятся только
к водным растворам (кислотно-основные
свойства проявляются в разных растворителях
и даже при их отсутствии). Многие вещества
не содержат в своем составе гидроксильных
групп, и тем
не менее
являются основаниями. В данном процессе
диссоциации не учитываются молекулы
растворителя.
В
развитии представлений о кислотах и
основаниях появляется протеолитическая
теория Бренстеда –Лоури (1923г). Согласно
этой теории кислота
– вещество, которое может отщеплять
протоны, а основание
– вещество, присоединяющее протоны.


ацетет
ион – основание хлорид ион –
основание, более слабое. Следовательно,
хлороводород – сильный электролит.
В
каждом примере есть кислота и основание,
которые называются сопряженными.
 В
В
процессе нейтрализации два основания
конкурируют за обладание протонами.
Протолитическое,
или кислотно-основное, равновесие
устанавливается в результате конкуренции
за протон между основаниями взаимодействующих
сопряженных кислотно-основных пар ( НА,
А–
и ВН+,
В).
Протолитическое
равновесие всегда смещается в сторону
образования более слабой кислоты:
НА
+ В ↔ А–
+ ВН+
pKa(
HA)
+ pKb(А–)=
14
pKa(ВH+)
+ pKb(B)
= 14
Согласно
протеолитической теории сила кислот и
оснований зависят от природы растворителя.
Так, если в качестве растворителя
хлороводорода вместо воды взять безводную
уксусную кислоту (более слабое основание,
чем вода), то равновесие не будет полностью
смещено вправо, т.е. хлороводород –
слабая кислота.

Наоборот,
если уксусную кислоту растворить не в
воде, а в жидком аммиаке (более сильное
основание чем вода) диссоциация уксусной
кислоты существенно увеличится.

Почти
одновременно с протеолитической теорией
Дж. Льюис предложит электронную теорию
кислот и оснований. Согласно этой теории
основания –
соединения, имеющие неподеленные
электронные пары и способные их
обобществлять с другими молекулами или
ионами. Кислоты
– вещества, способные акцептировать
электронные пары. (В теории Бренседа-Лоури
нейтрализация – процесс передачи
протона от кислоты к основанию, то здесь
– происходит перенос электронной пары
– донорно-акцепторное взаимодействие).
По
Льюису кислотами являются: Н+,
Аl3+,
BF3,
основаниями – Н2О,
NH3,
Cl–
(рис. 31).
Рис.
31. Кислоты и основания Льюиса.
-
Контрольные
вопросы и задания
-
Учение
о растворах. Раствор, растворитель,
растворенное вещество, растворимость. -
Гидратная
теория растворов Д.И. Менделеева. -
Сущность
явления осмоса. Осмотическое давление.
Закон Вант-Гоффа. -
Изо-,
гипо-, гипертонические растворы.
Плазмолиз, тургор, гемолиз. -
Роль
осмотического давления в биологических
системах. -
Основные
положения теории электролитической
диссоциации С. Аррениуса и ее развитие
И.А. Каблуковым. -
Состояние
ионов в водных растворах. Гидратация
ионов, образование аквакатионов,
сольватация. -
Степень
ионизации. Факторы, влияющие на степень
ионизации. -
Изотонический
коэффициент. Константа ионизации. -
Взаимосвязь
степени и константы ионизации.Закон
разбавления Оствальда. -
Понятие
об активности. Кислоты и основания по
Бренстеду-Лоури и Льюису.
-
Примеры
решения задач
Пример
1. Вычислите
осмотическое давление раствора,
содержащего 16 г сахарозы С12Н22О11
в 350 г воды при 293 К. Плотность раствора
считать равной 1.
Решение.
Находим массу раствора: 16 + 350 = 366 г
Поскольку плотность равна 1 г/см3,
то объем раствора равен 366 см3
= 0,366 дм3.
Находимо
осмотическое давление раствора:

Пример
2. В 250 см3
раствора содержится 2,3 г растворенного
вещества. Осмотическое давление при 27
0С
равно 249 кПа. Вычислите молярную массу
вещества.
Решение.
V
= 0,25 дм3;
Т = 27+273 = 300 К
 .
.
Откуда

Пример
3. При 0 0С
осмотическое давление 0,1 н раствора
карбоната калия равно 272,6 кПа. Определите
кажущуюся степень ионизации соли.
Решение.
Находим молярную концентрацию 0,1 н
раствора К2СО3
(fЭ
= ½): 0,1 · ½ = 0,05 моль/л.
Находим
изотонический коэффициент для раствора
соли (сильный электролит):
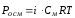 .
.
Откуда
 .
.
К2СО3
↔ 2К+
+ СО32-,
следовательно n
= 3
Кажущуюся
степень ионизации находим из соотношения:

Пример
4. При 20 0С
осмотическое давление раствора, в 100 мл
которого содержится 6,33 г красящего
вещества крови – гематина, равно 243,4
кПа. Определите молекулярную формулу,
если известен элементарный состав (в
%) гематина: С – 64,6; Н – 5,2; N
– 8,8; О – 12,6; Fe
– 8,8.
Решение.
Находим молярность раствора:
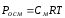 ;
;
Т = 20 + 273 = 293 К; .
.
Определяем
молекулярную массу гематина: в 1 л
раствора содержится 63,3 г гематина, это
0,1 моль. Таким образом, молярная масса
гематина равна 63,3/0,1 = 633 г/моль.
Находим
простейшую формулу гематина: С:Н:N:О:Fe
=
 =
=
34:33:4:5:1.
Простейшая
формула гематина: С34Н33N4O5Fe.
Этой формуле соответствует молекулярная
масса 633 г/моль, что совпадает с найденным
выше значением. Таким образом, искомая
молекулярная формула гематина
С34Н33N4O5Fe.
Пример
5. Вычислите
[H+],
[HS–],
[S2-]
в 0,1 М растворе H2S.
Решение.
Поскольку диссоциация сероводорода
протекает преимущественно по первой
ступени, то концентрацией [H+],
образующихся при диссоциации по второй
ступени, можно пренебречь и считать,
что [H+]
= [HS–]
=
 =
= моль/л
моль/л
(К1
– константа диссоциации по первой
ступени – табл. величина).
К2
– константа диссоциации по второй
ступени – табл. величина).
 .
.
Тогда [S2-]
= 1·10-14
моль/л.
Пример
6. Вычислите
концентрацию ионов водорода в 0,1 М
растворе хлорноватистой кислоты (Ка
= 5 · 10-8).
Решение.
Находим степень диссоциации хлорноватистой
кислоты:
 .
.
Отсюда [Н+]
= α · См
= 7 · 10-4
· 0,1 = 7 · 10-5
моль/л.
Пример
7. Степень
диссоциации уксусной кислоты в 0,1 М
растворе равна 1,32 · 10-2.
найдите константу диссоциации кислоты
и значение рКа.
Решение.
Подставляем данные задачи в уравнение
закона разбавления Оствальда:
 .
.
Находим рКа
= -lg
Ka=
– lg(1,77
· 10-5)
= 5 – lg
1,77 = 5 – 0,25 = 4,75.
Пример
8. Вычислите
ионную силу и активность ионов в растворе,
содержащем 0,01 моль/л MgSO4
и 0,01 моль/л MgCl2.
Решение.
Определяем ионную силу раствора:

Находим
коэффициенты активности ионов по
формуле:

 ;
;
f
= 0.3
 ;
;
f
= 0,74.
Находим
активность каждого иона по формуле, а
= f
· См:
a(Mg2+)
= 0,02 · 0,3 = 0,006 моль/л;
a(SO42-)
= 0,01 · 0,3 = 0,003 моль/л;
a(Cl–)
= 0,02 · 0,74 = 0,0148 моль/л.
-
Индивидуальные
задания
Задание.
Решите задачи своего варианта (табл.
48).
Таблица
48
From Wikipedia, the free encyclopedia

A plasma lamp, illustrating a low degree of ionization (i.e. a partially ionized gas)
The degree of ionization (also known as ionization yield in the literature) refers to the proportion of neutral particles, such as those in a gas or aqueous solution, that are ionized. For electrolytes, it could be understood as a capacity of acid/base to ionize itself. A low degree of ionization is sometimes called partially ionized (also weakly ionized), and a high degree of ionization as fully ionized. However, fully ionized can also mean that an ion has no electrons left.[1]
Ionization refers to the process whereby an atom or molecule loses one or several electrons from its atomic orbital, or conversely gains an additional one, from an incoming free electron (electron attachment). In both cases, the atom or molecule ceases to be a neutral particle and becomes a charge carrier. If the species has lost one or several electrons, it becomes positively charged and is called a positive ion, or cation. On the contrary, if the species has gained one or several additional electrons, it becomes negatively charged and is called a negative ion, or anion. Individual free electrons and ions in a plasma have very short lives typically inferior to the microsecond, as ionization and recombination, excitation and relaxation are collective continuous processes.[2]
Chemistry usage[edit]
The degree of dissociation α (also known as degree of ionization), is a way of representing the strength of an acid. It is defined as the ratio of the number of ionized molecules and the number of molecules dissolved in water. It can be represented as a decimal number or as a percentage. One can classify strong acids as those having ionization degrees above 30%, weak acids as those with α below 30%, and the rest as moderate acids, at a specified molar concentration.
Physics usage[edit]
In plasma, the degree of ionization 
where 

When referred to an atom, “fully ionized” means that there are no bound electrons left, resulting in a bare nucleus.
A particular case of fully ionized gases are very hot thermonuclear plasmas, such as plasmas artificially produced in nuclear explosions or naturally formed in the Sun and all stars in the universe. Regular stars largely contain hydrogen and helium that are fully ionized into protons (H+) and alpha-particles (He2+).
History[edit]
Ionized matter was first identified in a discharge tube (or Crookes tube), and so described by Sir William Crookes in 1879 (he called it “radiant matter”).[3] The nature of the Crookes tube “cathode ray” matter was subsequently identified by English physicist Sir J.J. Thomson in 1897,[4] and dubbed “plasma” by Irving Langmuir in 1928,[5] perhaps because it reminded him of a blood plasma.[6]
See also[edit]
- List of plasma physics articles
Footnotes[edit]
- ^ Mochizuki, Y.; Takahashi, K.; Janka, H.-Th.; Hillebrandt, W.; Diehl, R. (2008). “Titanium-44: Its effective decay rate in young supernova remnants, and its abundance in Cas A”. Astronomy and Astrophysics. 346 (3): 831–842. arXiv:astro-ph/9904378.
- ^ Chapman, Brian (25 September 1980). Glow Discharge Processes: Sputtering and Plasma Etching. New York: John Wiley & Sons. ISBN 978-0471078289. Archived from the original on 1 October 2020. Retrieved 7 April 2018.
- ^ Crookes presented a lecture to the British Association for the Advancement of Science, in Sheffield, on Friday, 22 August 1879 [1] Archived 9 July 2006 at the Wayback Machine [2]
- ^ Announced in his evening lecture to the Royal Institution on Friday, 30 April 1897, and published in Philosophical Magazine, 44, 293 [3]
- ^ I. Langmuir, “Oscillations in ionized gases,” Proc. Natl. Acad. Sci. U.S., vol. 14, p. 628, 1928
- ^ G. L. Rogoff, Ed., IEEE Transactions on Plasma Science, vol. 19, p. 989, Dec. 1991. See extract at “Coalition for Plasma Science – What is a plasma?”. Archived from the original on 20 April 2006. Retrieved 24 May 2006.
Для каждого электролита степень электролитической диссоциации определяют опытным путем, измеряя электропроводность его водного раствора. Степень диссоциации (a) выражается в процентах или в долях единицы.
Степень электролитической диссоциации равна отношению числа молекул, которые распались на ионы, к общему числу растворенных молекул электролита.
a = n .100% или a = n , где n – число молекул, распавшихся и на ионы;
N – общее число растворенных молекул.
Пример: aCH3OOH в 0,1 M растворе равна 1,36 %, что означает: из 10000 молекул CH3OOH 136 распадаются на ионы по уравнению реакции:
 CH3COOH CH3COO — + H +
CH3COOH CH3COO — + H +

Степень диссоциации зависит от природы растворителя и природы растворенного вещества.
Одно и то же вещество в одних растворителях может вести себя как электролит, в других – как неэлектролит (молекулы серной кислоты хорошо диссоциируют в воде, слабее в этаноле и совсем не диссоциируют в бензоле).
Объяснение в том, что вода является одним из наиболее полярных растворителей, этанол – слабополярный, а бензол – неполярный растворитель.
Вода является основным растворителем, следовательно, рассматриваем классификацию электролитов по степени диссоциации в водных растворах.
На степень ионизации влияет тип химической связи в молекулах электролита, так как в этом случае диссоциация проходит в разной степени. Для электролитов с ионными или сильно полярными ковалентными связями диссоциация в воде протекает практически нацело. Это сильные электролиты и степень диссоциации равна 1 (100%). К ним относятся:
— практически все соли;
— кислоты: HClO4 (хлорная), HClO3 (хлорноватая), HCl (хлороводородная), HBr (бромоводородная), HJ (йодоводородная), HNO3 (азотная), H2SO4 (серная), H2Cr2O7 (двухромовая), H2CrO4 (хромовая). Это сильные кислоты.
— щелочи LiOH, NaOH, KOH, CsOH, RвOH, Ca(OH)2, Sr(OH)2, Ba(OH)2 — это сильные основания.
Электролиты со слабо полярными связями диссоциируют в воде частично. Электролиты, диссоциирующие не полностью являются слабыми и степень диссоциации их меньше 1(100%).
К ним относятся:
— слабые кислоты: HClO2 (хлористая), HClO(хлорноватистая), HNO2(азотистая), H2CO3 (угольная), H2SiO3 (кремниевая), H3PO4 (ортофосфорная), HF (фтороводородная), H3BO3 (борная), CH3 COOH (уксусная), H2S (сероводородная), HCN (цианидводородная).
— слабые малорастворимые в воде основания и амфотерные гидроксиды: Fe(OH)2 , Fe (OH)3 , Cu(OH)2 , Pb(OH)2 , Al (OH)3 , Cr(OH)3
На степень диссоциации слабых электролитов влияет несколько факторов.
Степень ионизации электролита зависит от его концентрации в растворе. Разбавление раствора ведет к повышению степени диссоциации электролита, так как с уменьшением его концентрации уменьшается вероятность встречи ионов в растворе.
Повышение концентрации электролита в растворе понижает степень его ионизации.
Изменение температуры раствора электролита так же влияет на степень ионизации. При повышении температуры степень диссоциации электролита увеличивается, так как с повышением температуры энергия молекул увеличивается, химическая связь в них ослабляется, что облегчает процесс диссоциации электролитов; понижение температуры дает противоположный эффект.
На степень диссоциации влияет действие одноименного иона. Например, при диссоциации уксусной кислоты устанавливается равновесие:
 CH3COOH CH3COO — + H +
CH3COOH CH3COO — + H +
Согласно принципу Ле-Шателье, изменяя концентрацию одного из образующихся веществ, происходит смещение равновесия. В данном случае при добавлении в раствор ацетата натрия (CH3COONa), который является сильным, электролитом, увеличивается количество ацетат-ионов (CH3COO — ) и равновесие смещается влево, то есть в сторону образования недиссоциированных молекул и степень диссоциации уксусной кислоты уменьшается. Следовательно, уменьшится концентрация ионов водорода и кислотность среды понизится.
Подобным образом можно понизить степень диссоциации раствора аммиака. При добавлении аммонийной соли (например, хлорид аммония NH4Cl) резко повысится концентрация ионов аммония и равновесия сместится влево.
 NH4OH NH4 + + OH —
NH4OH NH4 + + OH —

Заметно понизится концентрация гидроксид-ионов (OH — ), т.е. уменьшится щелочность раствора.
Таким образом, чтобы понизить степень диссоциации слабого электролита, необходимо добавить в раствор другой сильный электролит с одноименным ионом.
д) Константа диссоциации (ионизации)
Слабые электролиты в водных растворах диссоциируют только частично, поэтому в растворе устанавливается динамическое равновесие между молекулами и ионами.
Ионное равновесие раствора уксусной кислоты выражается уравнением:
 CH3COOH CH3COO — + H +
CH3COOH CH3COO — + H +
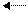
Применив закон действующих масс, можно написать выражения для константы равновесия:
Kравн. = [CH3COO — ] . [H + ]
Константа равновесия диссоциации для слабых электролитов называется константой диссоциации.
В применении к диссоциации любого слабого электролита.

 АnBm nA + + mB —
АnBm nA + + mB —
К дисс. определяется выражением:
К дисс. = [A] n . [B] m , где
[A + ] – концентрация катиона; [B — ] – концентрация аниона; [An Bm] — концентрация недиссоциированных молекул.
K дисс. для слабых электролитов не зависит от концентрации раствора и при постоянной температуре является постоянной величиной для данного электролита. Чем выше К дисс,. тем больше степень диссоциации для данного электролита, тем сильнее этот электролит.
Многоосновные кислоты и основания многовалентных металлов диссоциируют ступенчатого, и каждая стадия диссоциации характеризуется собственной константой диссоциации.
Диссоциация фосфорной кислоты:
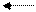
 H3PO4 H + + H2PO4 – K дисс.1 = 7,6 . 10 -3
H3PO4 H + + H2PO4 – K дисс.1 = 7,6 . 10 -3
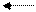
 H2PO4 — H + + HPO4 2– K дисс.2 = 6,2 . 10 -6
H2PO4 — H + + HPO4 2– K дисс.2 = 6,2 . 10 -6
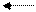
 HPO4 2- H + + PO4 3– K дисс.3 = 4,4 . 10 -13
HPO4 2- H + + PO4 3– K дисс.3 = 4,4 . 10 -13
Значение K дисс. для каждой последующей ступени уменьшается.
При диссоциации оснований многовалентных металлов наблюдается подобное явление.
Рассчитайте степень ионизации (α) этакриновой кислоты, хинидина, аспирина и уравнение Гендерсона-Хассельбаха) в соке тощей кишки (6,5 ). О чём говорит величина (α) в каждом из приведённых примеров?
Этакриновая кислота 3.5
Ацетилсалициловая кислота 3,0
рКа соответствует значению рН, при котором концентрации ионизированной и неионизированной форм находятся в равновесии.
Расчет степени ионизации производится на основе определения постоянной равновесия процесса ионизации, а так же термодинамический коэффициент реакции.
Постоянная равновесия рассчитывается путем отношений парциальных давлений (концентрации) продуктов реакции к парциальным давлениям (концентрациям) исходных веществ в период равновесного протекания реакции.
А  =А
=А  + е Р=1
+ е Р=1



Под парциальным давлением понимают часть общего давления газов приходящего на конкретный газ. Парциальное давление пропорционально концентрации газов в смеси.

где С  — концентрация, определяемая отношением числа конкретных частиц к общему числу частиц в смеси;
— концентрация, определяемая отношением числа конкретных частиц к общему числу частиц в смеси;
Р — общее давление.
Пусть в условном объеме находится n атомов. Происходит ионизация атомов, которая достигла равновесия. Считаем, что ионизация происходит одноступенчатая.
 , Х — степень ионизации
, Х — степень ионизации 





Определим парциальные давления каждого вида частиц:



Определим постоянную равновесия:

Из этой формулы по известной  можно определить степень ионизации.
можно определить степень ионизации.



По заданному Р и заданной температуре можно определить степень ионизации.
М.Саг постоянную равновесия определил через термодинамический потенциал реакции и получил формулу для определения степени ионизации атомов газа.

где p – давление газа при равновесии;
Т – температура газа при равновесии;
eui – работа ионизации;
х – степень ионизации.
Формула предназначена для определения степени ионизации газа.
Результаты расчета степени ионизации различных газов приведены на графике

Из графика следует, что в дуге достигается большая степень ионизации щелочноземельных металлов и меньшая степень ионизации нейтральных газов и других.
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Для студентов недели бывают четные, нечетные и зачетные. 9855 —  | 7659 —
| 7659 —  или читать все.
или читать все.
В 30.09.2022 в 18:26, yatcheh сказал:
Борная кислота – кошмар аналитика. У неё действующая константа диссоциации – ни фига не константа, от концентрации зависит.
Там просто крохотная разница между К1,2,3, поэтому она не оттитровывается количественно по ступеням.
А так, задача умеренной бредовости. Не хуже и не лучше других таких же, начисто лишенных практического смысла –
В 30.09.2022 в 15:12, Виктория18 сказал:
В качестве наружного антисептического средства
– оно конечно, нужно для антисептических свойств считать степень ионизации.
Содержание:
- Электролитическая ионизация. Степень ионизации. Константа ионизации
- Понятие теории сильных электролитов. Деятельность
- Кислотно-основная ионизация
- Вывод:
| Предмет: | Химия |
| Тип работы: | Курсовая работа |
| Язык: | Русский |
| Дата добавления: | 16.04.2019 |
- Данный тип работы не является научным трудом, не является готовой выпускной квалификационной работой!
- Данный тип работы представляет собой готовый результат обработки, структурирования и форматирования собранной информации, предназначенной для использования в качестве источника материала для самостоятельной подготовки учебной работы.
Если вам тяжело разобраться в данной теме напишите мне в whatsapp разберём вашу тему, согласуем сроки и я вам помогу!
По этой ссылке вы сможете найти много готовых курсовых работ по химии:
Посмотрите похожие темы возможно они вам могут быть полезны:
Введение:
Исследование разбавленных растворов показало, что все их общие свойства (снижение давления пара, изменение температуры замерзания и кипения, величина осмотического давления) изменяются пропорционально количеству частиц растворенного вещества. Эта формулировка является обобщенным законом разбавленных растворов Рауля-Вант-Хоффа. Эта общая закономерность оказалась верной для растворов органических веществ в воде и растворов в органических растворителях. При исследовании водных растворов солей, кислот, оснований было установлено, что изменение соответствующего свойства в зависимости от состава раствора значительно превышает ожидаемое значение. Например, снижение температуры замерзания молярного раствора NaCl почти вдвое превышает криоскопическую постоянную для воды (3,36 ° вместо 1,86 °). Это указывает на то, что количество частиц в водных растворах кислот, оснований и солей не соответствует молярной концентрации раствора.
Кроме того, растворы, для которых характерны отклонения от законов разбавленных растворов, обладают значительной электропроводностью, в отличие от водных растворов некоторых органических веществ. Это можно объяснить наличием заряженных частиц в растворе. Растворы, которые проводят электрический ток, назывались электролитами.
Электролитическая ионизация. Степень ионизации. Константа ионизации
Свойства электролитов были рассмотрены и обобщены основоположником теории электролитической ионизации Аррениусом (1887) и развиты в работах В.А. Кистяковский И.А. Каблукова на основе химической (гидратационной) теории растворения Д.И. Менделеев.
Основные положения теории электролитической диссоциации:
- когда соли, кислоты и основания растворяются в воде, эти вещества диссоциируют с образованием электрически заряженных частиц – катионов и анионов;
- электропроводность таких растворов прямо пропорциональна суммарной концентрации ионов в растворе.
В работах И.А.Каблукова и В.А.Кистяковского было отмечено, что электролитическая ионизация обусловлена взаимодействием молекул полярного растворителя с частицами растворенного вещества (молекулами газа, атом-ионами при растворении кристаллов). Это взаимодействие приводит к поляризации даже преимущественно ковалентных связей, как, например, в хлористом водороде. Когда этот газ растворяется в воде, образуются ионы водорода и хлора вследствие ослабления связи Н – С1 в среде с большой диэлектрической проницаемостью. Переход ионов в раствор сопровождается их гидратацией: НС1 + НН2О Н + (Н2О) х + С1- (Н2О) н-х.
Тот же процесс наблюдается при растворении ионно-ковалентных кристаллов (например, NaCl) в воде. Хотя в кристаллической решетке NaCl нет ионов Na + и Cl-, взаимодействие с молекулами дипольного растворителя способствует поляризации связей в кристалле, их ослаблению и обеспечивает возможность перехода частиц в раствор с образованием гидратированных ионов: НС1 + nН2О Na + (Н2О) x + С1- (Н2О) n-x.
Таким образом, в сильно полярных растворителях ионизируются не только вещества с преимущественно гетерополярной связью (соли), но и молекулы, характеризующиеся низкой ионностью. С этой точки зрения известное правило «подобное растворяется в подобном» не является универсальным.
Процесс гидратации является высоко экзотермическим и происходит самопроизвольно с уменьшением энтальпии. Теплота гидратации значительно превышает энергию разрыва связи (теплота диссоциации). Обычно степень гидратации, то есть число молекул растворителя, окружающих каждый ион, очень велика (n и x – целые числа, n >> 1, x >> 1); только при кислотной ионизации х = 1: НA + nН2О H3O + + A- (Н2О) n-1.
Это связано с небольшим размером иона водорода (протона), который составляет ~ 10-4 от размера атома. Во время гидратации протон внедряется в сферу молекулы H2O с образованием иона оксония H3O +. Новая ковалентная связь образуется посредством донорно-акцепторного механизма благодаря свободной электронной паре кислорода и насыщается. Одной из количественных характеристик электролитической ионизации является степень ионизации, которая определяется как отношение диссоциированных молекул к общему количеству растворенных молекул. Обычно степень ионизации выражается в долях единицы или в процентах: b = (n / n0) 100, где n0 – количество растворенных частиц; n – количество частиц, подвергшихся электролитической ионизации.
По степени ионизации электролиты условно подразделяют на сильные (b> 30%) и слабые (b <3%). Степень ионизации зависит от природы растворителя. Чем более полярна молекула растворителя, тем выше, при прочих равных условиях, степень ионизации растворенного вещества. Поскольку электролитическая ионизация сопровождается тепловым эффектом, степень ионизации зависит от температуры, и влияние температуры можно оценить по принципу Ле-Шателье: если электролитическая ионизация является эндотермическим процессом, то степень ионизации увеличивается с ростом температуры в противном случае оно уменьшается.
Концентрация раствора сильно влияет на степень электролитической ионизации. Если рассматривать электролитическую ионизацию как равновесный обратимый химический процесс KA + nН2О K + (Н2О) x + A- (Н2О) n-x, затем, в соответствии с принципом смещения равновесия, разбавление водой увеличивает количество диссоциированных молекул, то есть степень ионизации увеличивается с разбавлением. В связи с этим разделение электролитов по прочности в соответствии с величиной степени ионизации является условным и приведенная выше классификация действительна только для 0,1 н. Растворов.
Процесс электролитической ионизации удобнее охарактеризовать по константе ионизации, применяя к ней законы химического равновесия. Итак, для реакции КА К + + А-, константа ионизации, Ki = [K +] [A -] / [KA].
Здесь и далее символ [] обозначает молярную концентрацию компонентов. В отличие от степени ионизации, константа электролитической ионизации зависит только от природы электролита и температуры. Чем больше значение Ki, тем сильнее электролит.
Существует количественная зависимость между константой и степенью электролитической ионизации. Действительно, пусть в рассматриваемом процессе общее количество растворенного вещества СА равно C, а степень ионизации равна b. Тогда [K +] = [A-] = bC и, соответственно, концентрация недиссоциированных частиц [CA] = (1 – b) C.
Полученный коэффициент известен как закон разбавления Оствальда.
Для слабых электролитов, когда b << 1, Ki b2C.
Из формулы следует, что если, например, раствор разбавить в 100 раз, степень ионизации увеличится в 10 раз.
Принимая во внимание степень электролитической ионизации, можно применять законы разбавленных растворов к растворам электролитов, вводя поправочный коэффициент i, называемый изотоническим коэффициентом Вант-Хоффа. Тогда отношение соответствующего свойства (уменьшение давления паров, изменение температур плавления и кипения, осмотического давления) для электролита к аналогичному свойству неэлектролитного раствора той же концентрации равно коэффициенту Вант-Хоффа, т.е. П ‘/? P =? Т’3 /? Т3 =? Т’к /? Tk = P’osm / Rosm = я.
Очевидно, что для растворов электролитов всегда i> 1, а для неэлектролитных растворов i = 1.
Законы разбавленных растворов легко трансформируются по отношению к растворам электролитов:
- P’osm. = iCRT, Цам. = iKСm,
- Tboil = iECm, P ‘= iP0AxA.
Коэффициент изотоничности может быть связан со степенью ионизации раствора электролита. Пусть степень ионизации определенного электролита с общим числом молекул в растворе C будет равна b. Предположим, что при диссоциации каждая молекула электролита разлагается на n ионов. Тогда число молекул электролита, которые распались на ионы, равно 6C, количество ионов в растворе равно nbC, а количество молекул, которые не распались на ионы, составляет (1 – b) C. Общее количество частиц в растворе является (1 – b) C + nbC.
Отношение общего количества частиц в растворе к количеству растворенных молекул является изотоническим коэффициентом:
- , i = 1 – b (1 – n).
- b = (i – 1) / (n – 1).
Это соотношение позволяет определить степень ионизации электролита по отклонению его свойств от законов разбавленных растворов. В качестве примера приведем степень ионизации 0,1 н. K2SO4, которая замерзает при -0,225 ° C (TZ ‘= 0,225 °). Для водных растворов неэлектролитов криоскопическая константа K = 1,86 °. Если бы K2SO4 не распался на ионы в водном растворе, то соответствующее уменьшение 0,1 н. Раствора было бы равно 0,093 °. Тогда изотонический коэффициент
Понятие теории сильных электролитов. Деятельность
Для сильных электролитов, когда степень ионизации велика, константа ионизации зависит от концентрации, так как, когда в растворе накапливается большое количество ионов, отражается их взаимное влияние.
Потенциально свойствами сильных электролитов обладают вещества с кристаллической структурой координационного типа со значительной ионной связью. Многие соли являются типичными примерами таких веществ. Невозможно выделить одну молекулу в их кристаллической решетке. Поэтому, когда такие вещества растворяются в полярных растворителях (воде), отдельные сольватированные ионы переходят в раствор, и, таким образом, процесс электролитической ионизации проходит полностью, то есть в растворе отсутствуют недиссоциированные частицы. Отсюда следует, что понятия постоянной и степени ионизации неприменимы для растворов сильных электролитов, поскольку обе эти концепции учитывают наличие определенной доли недиссоциированных частиц в растворе.
При определенных условиях, например, когда растворитель имеет низкую диэлектрическую проницаемость, создаются условия для электростатического взаимодействия сольватированных ионов противоположного знака. В этом случае последние сближаются друг с другом и образуют так называемую ионную пару – сложный агрегат, состоящий из двух противоположно заряженных ионов, окруженных молекулами растворителя, в которых электрические заряды взаимно компенсируются. Этот процесс называется ассоциацией. По своей природе и механизму образования ионные пары не идентичны недиссоциированным молекулам слабых электролитов.
Концепция образования ионных пар в растворах сильных электролитов была введена Бьёррумом и Семенченко. В соответствии с этой концепцией для каждого растворителя существует определенный параметр q (параметр Бьёррума), который представляет собой расстояние, на котором ионы приходят друг к другу во время образования ионной пары. Э
Из соотношения следует, что с увеличением заряда ионов расстояние, на котором они начинают взаимодействовать, увеличивается. Напротив, с увеличением диэлектрической проницаемости растворителя сила электростатического взаимодействия между ионами уменьшается в D раз. Поэтому полярные растворители, характеризующиеся высокой диэлектрической проницаемостью, способствуют образованию растворов, которые являются сильными электролитами с низкая склонность к образованию ионных пар. Даже на относительно небольших расстояниях взаимодействием ионов можно пренебречь (величина q мала), из-за чего ионы можно считать практически изолированными. С ростом температуры параметр Бьёррума q уменьшается, а взаимодействие между ионами ослабляется на меньших расстояниях, что объясняется увеличением энергии теплового движения ионов. Параметр Бьёррума имеет четко определенное значение для каждого растворителя при данной температуре и заряде ионов. Например, для однозарядных ионов в воде (z + = z – = 1) при температуре 25 °.
Если расстояние между ионами меньше этого значения, то молекулу можно считать недиссоциированной. Если q> 3,57 E, ионы считаются изолированными.
В разбавленных растворах сильных электролитов ионы расположены на расстояниях, значительно превышающих параметр Бьёррума, не взаимодействуют друг с другом, и электролит полностью ионизируется. По мере увеличения концентрации раствора расстояния между ионами уменьшаются, что усиливает межионное взаимодействие. В результате экспериментально определенные свойства растворов сильных электролитов (P, Tboil, Tz и т. д.), Которые зависят от общего числа частиц в растворе, меньше, чем рассчитанные в предположении полной ионизации. Таким образом, во время ионизации K2SO4 теоретическое значение изотонического коэффициента должно быть равно 3 (поскольку каждая формульная единица K2SO4 разлагается на 3 иона в растворе). Экспериментальное значение изотонического коэффициента, определяемого по уменьшению температуры замерзания раствора, составляет 2,42. Как следствие, кажущаяся степень ионизации составляет 6 = 71%. Создается впечатление, что ионизация не прошла полностью и в растворе есть определенное количество недиссоциированных частиц. Фактически этот эффект обусловлен ассоциацией сольватированных ионов с образованием ионных пар. Поэтому степень ионизации в растворах сильных электролитов, определенная экспериментально, очевидна. Таким образом, для растворов сильных электролитов законы идеальных растворов оказываются неприменимыми. Количественное описание поведения таких растворов осложняется многими факторами, определяющими общее количество частиц в растворе.
Чтобы иметь возможность использовать простые соотношения идеальных решений для описания поведения реальных решений, Льюис в 1907 году ввел формальную концепцию эффективной концентрации – активности. Активность связана с истинной концентрацией растворенного вещества соотношением.
Активность измеряется в тех же единицах, что и концентрация, поскольку коэффициент активности является безразмерной величиной. Характеризует степень отклонения свойств данного решения от свойств идеального решения. Для бесконечно разбавленных растворов электролитов, где взаимодействие ионов практически отсутствует, активность становится равной концентрации, а коэффициент активности равен единице: b / C = 1.
Если вместо концентрации экспериментально определенные значения активности подставляются в уравнения, отражающие законы Рауля, Генри, Вант-Гоффа и т. д., то эти уравнения остаются в силе для реальных растворов, в частности для растворов сильных электролитов.
Введение понятия активности позволяет без уточнения сложной картины взаимодействия частиц в реальном решении оценить суммарный эффект этого взаимодействия, который проявляется в отклонении свойств системы от идеального, и применять законы идеальных решений для анализа реальных систем.
Кислотно-основная ионизация
Характер электролитической ионизации гидроксидов общей формулы EON зависит от относительной прочности и полярности связей E – O и O – H и может протекать в двух типах:
- EON E + + OH- (I)
- EOH EO- + H + (II).
Известно, что полярность связей определяется разницей в электроотрицательности компонентов, размере и эффективном заряде атомов. Щелочные и щелочноземельные металлы, а также переходные элементы в более низких степенях окисления образуют ионы относительно большого размера и с низким эффективным зарядом. Поэтому удельный заряд таких ионов низкий, а их поляризующие свойства слабо выражены. В этом случае связь E – O имеет относительно низкую прочность, и диссоциация EON происходит главным образом за счет удаления гидроксила, то есть в соответствии с основным типом.
С увеличением степени окисления удельный заряд E увеличивается, и диссоциация кислотного типа с элиминированием иона водорода преобладает, поскольку связь E – O усиливается и вследствие перераспределения электронной плотности в кислороде, связь O – H ослабевает. Таким образом, диссоциация по кислотному типу происходит, если eo-n << EE-O, а по базовому типу – если EO-N >> EE-O. При сравнимой силе связей O-H и E-O диссоциация гидроксида может одновременно происходить в обоих типах I и II с удалением как гидроксила, так и иона водорода. Электролиты, которые ионизируются в растворе одновременно с кислотным и основным, называются амфотерными. Амфотерность в той или иной степени является общим свойством гидроксидов.
Количественно ионизация того или иного типа характеризуется константой ионизации:
- H + + RO- roh R + + he-
- Каин = [R +] [OH -] / [ROH]
- K кислота = [RО -] [Н +] / [ROH].
Из этих уравнений следует, что отношение постоянной ионизации основного типа кбазы к постоянной ионизации кислотного типа Ккисл составляет Кб / К кислота = [R +] [OH -] / [RO -] [H +].
Если отношение Кб / К кислота >> 1, то ионизация в растворе происходит в основном по основному типу, то есть концентрация ионов ОН- во много раз превышает концентрацию гидратированных протонов Н +. Если Кб / К кислота << 1, диссоциация происходит в соответствии с типом кислоты. При Кб / К кислота 1 диссоциация протекает одновременно и одинаково у обоих типов. Например, для гидроксида галлия Ga (OH) 3 константы ионизации, соответствующие уравнениям, составляют приблизительно 10-12 (то есть Kb = K acid).
Следовательно, гидроксид галлия является примером идеального амфолита (амфотерного электролита).
Применение принципа Ле-Шателье к кислотно-щелочному равновесию показывает, что с увеличением концентрации гидроксила вероятность ионизации по кислотному типу увеличивается, а увеличение концентрации иона водорода приводит к преимущественной диссоциации основным тип. Таким образом, в кислой среде амфолит является основным, а в щелочной среде – кислым. Например, гидроксид цинка при взаимодействии с кислотами ведет себя как основание: Zn (OH) 2 + 2HC1> ZnCl2 + 2H2O а при взаимодействии со щелочами – в виде кислоты (H2ZnO2 или Zn (OH) 2): H2ZnO2 + 2NaOH> Na2ZnO2 + 2Н2О.
Рассмотрим основные закономерности изменения характера ионизации гидроксида в растворе в зависимости от положения элемента в периодической таблице. В ряду элементов периода III, от натрия до хлора, степень окисления увеличивается, а эффективные ионные радиусы заметно уменьшаются.
Ниже приведено изменение ионных радиусов элементов периода III в наибольшей степени окисления:
- Элемент …….. Na Mg Al Si P S Cl
- Состояние окисления … +1 +2 +3 +4 +5 +6 +7
- Ионный радиус, E … 0,98 0,78 0,57 0,39 0,34 0,29 0,26.
В этой серии объемная плотность заряда резко возрастает. Следовательно, поляризующий эффект ионов элементов, приводящий к перераспределению электронной плотности между связями E – O и O – H, увеличивается в том же направлении. Гидроксиды наиболее удаленных членов рассматриваемой серии обладают чрезвычайно выраженными основными (NaOH) и кислотными (HClO4) свойствами. Гидроксид натрия относится к классу сильнорастворимых оснований и является одним из самых сильных щелочей. Хлорная кислота сильнее, чем кислоты, такие как HCl, H2SO4, HNO3 и т. д.
При переходе от натрия к магнию наблюдается некоторое ослабление основных свойств, однако Mg (OH) 2 остается довольно сильным основанием. Гидроксид алюминия A1 (OH) 3 уже является амфолитом с некоторым преобладанием основных свойств, а гидроксид кремния Si (OH) 4 является амфолитом с резко преобладающими кислотными свойствами и образует в растворе кислородсодержащие анионы. Последующие представители ряда имеют ярко выраженную тенденцию к образованию сложных анионов в растворе, а соответствующие гидроксиды относятся к кислотам, и их прочность в ряду высших кислот Н2РO4 – H2SO4 – НС1O4 увеличивается.
Для переходных металлов, которые образуют гидроксиды с переменной степенью окисления, характерны те же закономерности изменения свойств. С увеличением степени окисления и уменьшением эффективного радиуса ионов основные ослабевают, а кислотные свойства возрастают. В качестве примера рассмотрим ряд гидроксидов марганца Mn (OH) 2, Mn (OH) 3, Mn (OH) 4, H2MnO4, HMnO4, в которых степень окисления марганца изменяется в последовательности +2, +3, + 4, +6, + 7. Первые два гидроксида представляют собой основания, последние два представляют собой кислоты, а гидроксид Mn (OH) 4 представляет собой амфолит с некоторым преобладанием кислотных свойств.
Вывод:
Таким образом, если элемент образует гидроксиды в нескольких степенях окисления, то его гидроксиды в более низких степенях окисления имеют более основной (или менее кислый) характер, а гидроксиды в более высоких степенях окисления имеют более кислый (или менее основной) характер.

