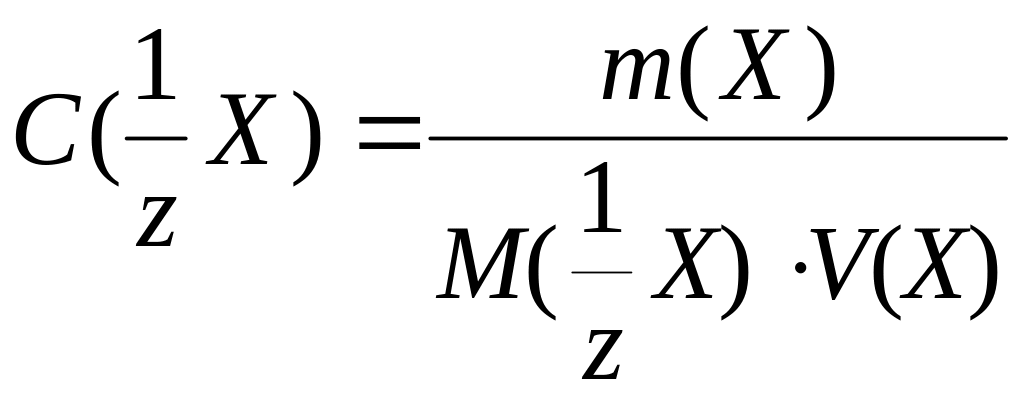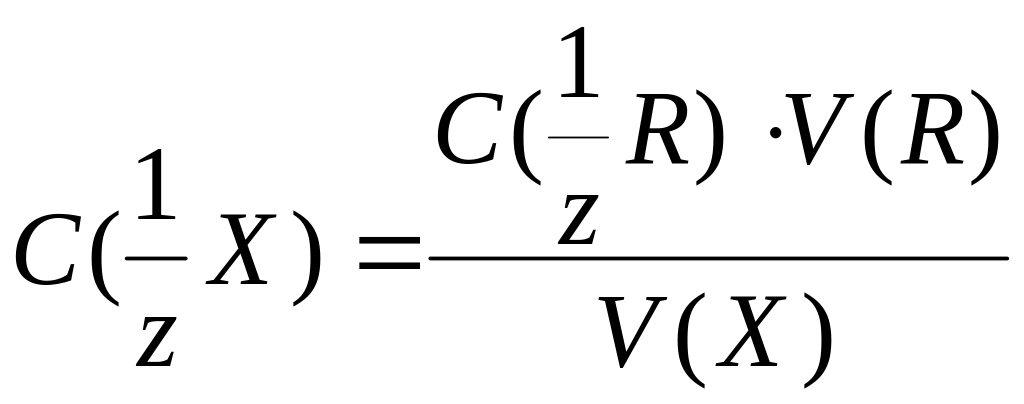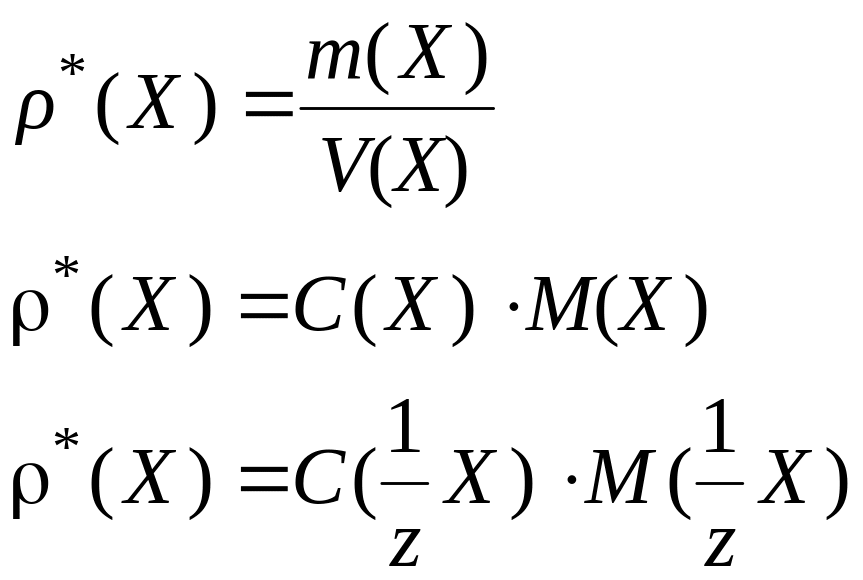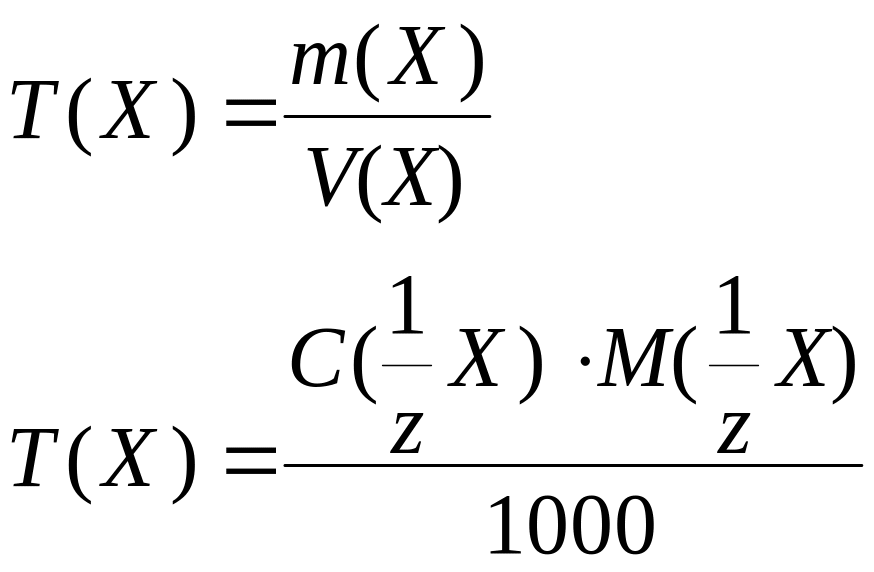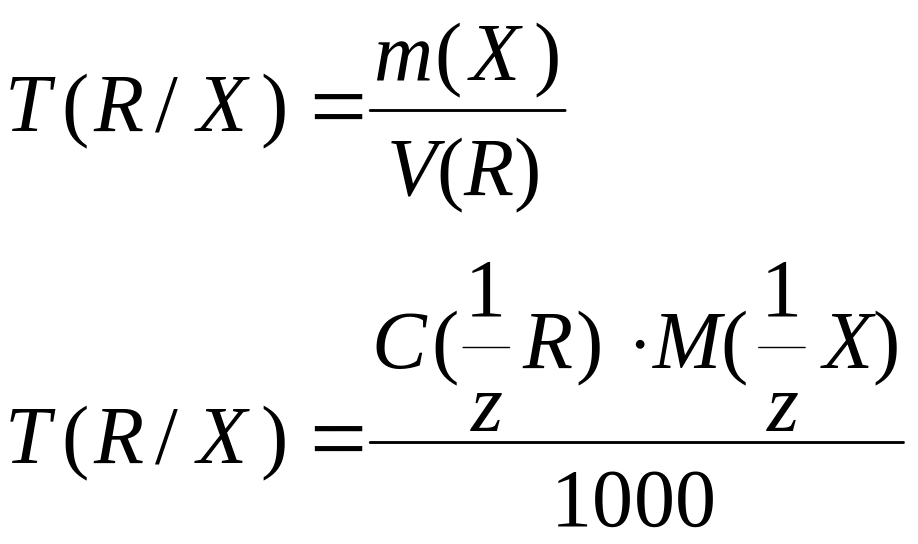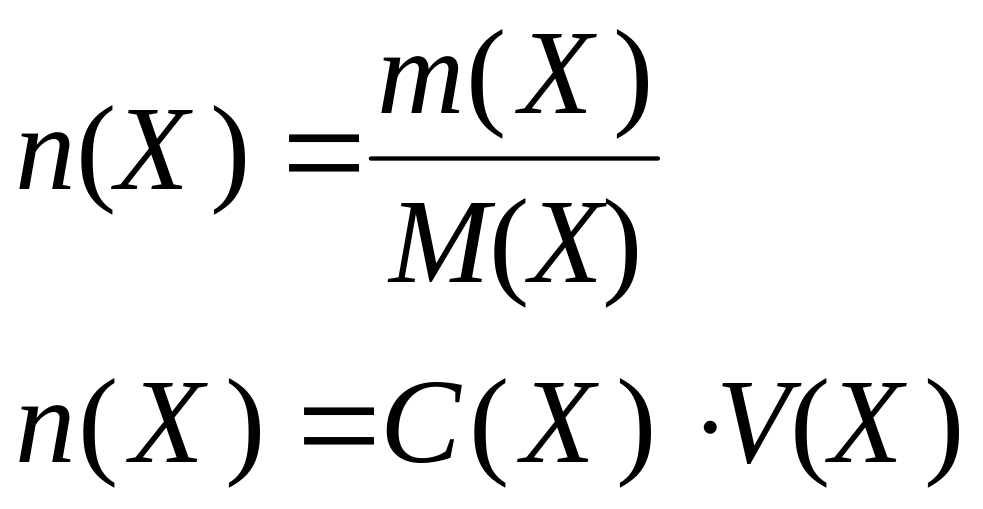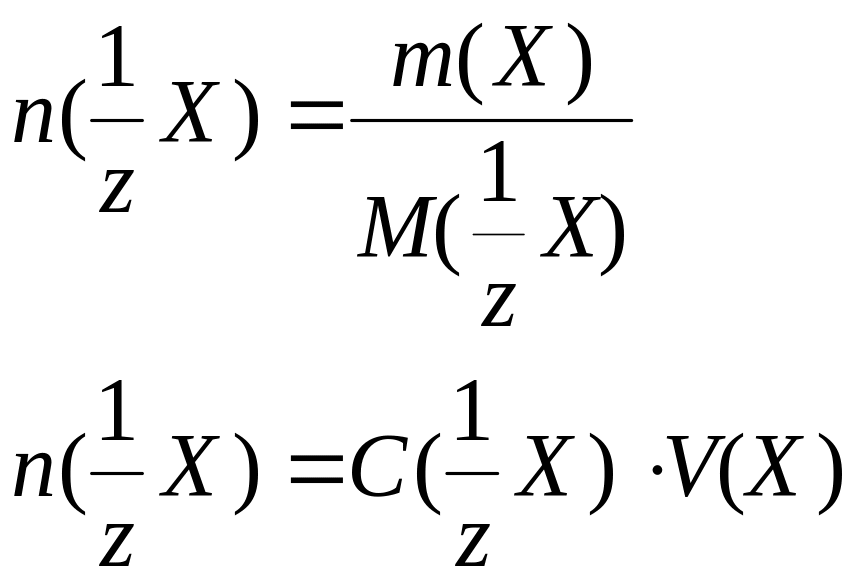Цель
работы –
определить константу распределения и
степень экстракции иода из водной фазы
в органическую фазу.
Сущность
работы.
Экстракция – процесс распределения
вещества между двумя несмешивающимися
жидкими фазами, чаще всего между
органическим растворителем и водой.
Экстракцию можно использовать для
извлечения веществ, разделения или
концентрирования.
При
экстракции вещества частично или
практически полностью переходят из
одной фазы в другую. Экстрагироваться
могут как молекулы веществ, так и ионы
(по ионообменному механизму). Если к
водному раствору неэлектролита I2
прилить не смешивающийся с водой
органический растворитель (например
гептан) и встряхивать полученную систему,
то I2
распределяется между органической и
водной фазами:
I2
(водн) ↔ I2
(орг).
Встряхивание
необходимо для увеличения поверхности
контакта фаз с целью быстрого достижения
равновесия. Данное равновесие распределения
вещества между фазами описывается
константой распределения P:
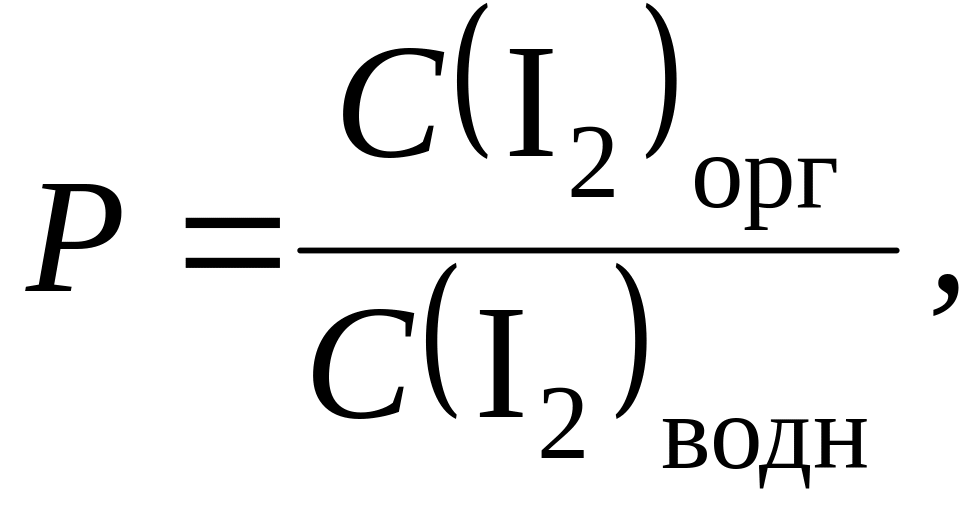
(12.1)
где
C(I2)орг
и C(I2)водн
– равновесные концентрации иода в
органической и водной фазах соответственно.
Если
объемы фаз не равны, то константу
распределения выражают как отношение
количества моль вещества в фазах:

, (12.2)
где
Vорг
и Vводн
– объемы органической и водной фаз
соответственно.
Константа
распределения зависит от природы
распределяемого вещества, природы фаз
и температуры и не зависит от равновесных
концентраций вещества и объемов фаз.
Отношение
количества экстрагированного вещества
n
к его общему (суммарному) количеству N
(т. е. к исходному) представляет собой
степень экстракции R
(или степень извлечения):
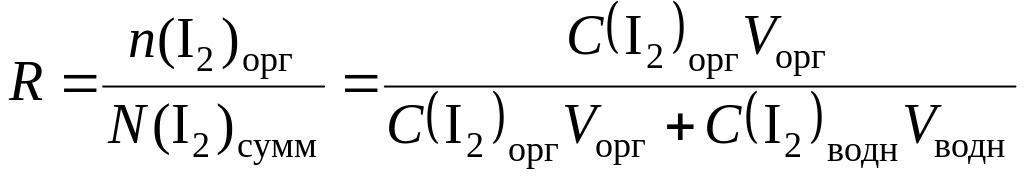
(12.3)
Степень
экстракции неэлектролита зависит от
константы распределения и отношения
объемов водной и органической фаз. При
прочих равных условиях степень экстракции
тем выше, чем больше константа
распределения.
Если
распределяемое вещество обладает
интенсивной собственной окраской хотя
бы в одной из фаз, то для определения
его концентрации можно применить
фотометрический метод.
Оборудование,
посуда, реактивы:
спектрофотометр или фотоколориметр
КФК-3; кюветы стеклянные длиной 3 мм;
пробирка с пришлифованной пробкой,
пипетки градуированные для отмеривания
объемов 5,0 или 10,0 мл, стеклянная
воронка, фильтр бумажный, пробирки
конические; стандартный 1 · 10–3 M
водный раствор I2,
гептан (или другой растворитель).
Выполнение
работы
1.
Получение
спектра поглощения и выбор рабочей
длины волны.
Включают спектрофотометр или фотоколориметр
согласно инструкции к прибору. Одну
кювету заполняют стандартным 1 · 10–3 M
водным раствором I2,
другую – дистиллированной водой (раствор
сравнения). Помещают их в ячейки кюветного
отделения спектрофотометра. Проводят
измерения оптической плотности раствора
I2
в диапазоне длин волн 370–550 нм с
интервалом 5 нм.
По
полученным данным строят график в
координатах A – λ,
нм. Выбирают длину волны, при которой
наблюдается максимальное светопоглощение,
и рассчитывают значение молярного
коэффициента поглощения (ε) иода при
данной длине волны.
2.
Проведение экстракции.
В чистую пробирку с пришлифованной
пробкой вносят 10,0 мл стандартного
1 · 10–3 M
водного раствора I2
и 2,0 мл гептана или другого растворителя
по указанию преподавателя. Плотно
закрывают пробирку пробкой и встряхивают
экстракционную систему в течение
5 минут. При этом встряхивание не
должно быть чрезмерно интенсивным во
избежание образования эмульсии или
пены. Оставляют пробирку в штативе до
практически полного расслоения фаз.
Для
отбора нижней водной фазы зажимают
верхнее отверстие пипетки вместимостью
10,0 мл, быстро опускают ее на дно
пробирки и открывают верхнее отверстие.
Отбирают ~ ¾ объема водной фазы и
профильтровывают через бумажный фильтр
в коническую пробирку. Органическую
фазу переливают в емкость для отходов.
3.
Определение
равновесной концентрации иода в водной
фазе после проведения экстракции.
Заполняют кювету водной фазой и измеряют
оптическую плотность относительно того
же раствора сравнения. Рассчитывают
равновесную концентрацию иода в водной
фазе по закону Бугера – Ламберта – Бера,
используя измеренное значение А,
известное значение l
и рассчитанное
значение ε.
4.
Расчет
количественных характеристик процесса
экстракции.
Рассчитывают константу распределения
P*
и степень извлечения R
иода по приведенным выше формулам. Для
расчета равновесной концентрации иода
в органической фазе используют формулу
![]()
=
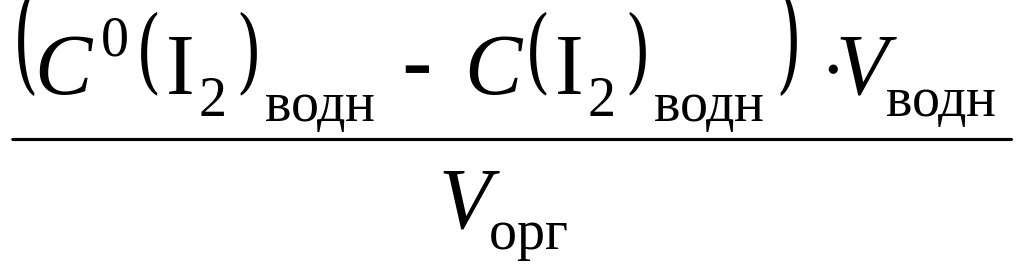
,
где
![]()
– исходная концентрация иода в водной
фазе.
На
основании полученных данных делают
вывод об эффективности экстракционного
извлечения иода данным растворителем
и о возможности применения данной
экстракционной системы для концентрирования
иода.
Программа
курса
«ФИЗИКО-ХИМИЧЕСКИЕ
МЕТОДЫ АНАЛИЗА»
Общие вопросы
Различия
между химическими, физическими и
физико-химическими методами анализа.
Особенности и преимущества инструментальных
методов анализа. Классификация
инструментальных методов анализа.
Значение инструментальных методов
анализа в современной науке и химической
технологии.
Аналитический
сигнал, его получение и измерение.
Составляющие аналитического сигнала
(значимые, мешающие и шумовые сигналы).
Аналитический сигнал фона, холостая
проба. Зависимость между аналитическим
сигналом и концентрацией определяемого
компонента (уравнение связи). Приемы
определения неизвестной концентрации
компонента в инструментальных методах
анализа: методы градуировочного графика,
стандартов, добавок и инструментальное
титрование. Сущность и условия применимости
каждого приема.
Метрологические
характеристики инструментальных методов
анализа.
Электрохимические
методы анализа
Классификация
электрохимических методов анализа.
Кондуктометрические
методы анализа.
Сущность
и классификация кондуктометрических
методов анализа: прямая кондуктометрия
и кондуктометрическое титрование.
Аналитические возможности и метрологические
характеристики методов.
Удельная
электрическая проводимость как
аналитический сигнал, факторы, влияющие
на величину сигнала. Зависимость удельной
электрической проводимости от
концентрации, причины отклонения от
линейной зависимости в области больших
концентраций. Эквивалентная электрическая
проводимость, факторы, влияющие на ее
величину. Подвижность ионов, уравнение
Кольрауша.
Измерение
аналитического сигнала. Кондуктометрическая
ячейка и измерительные приборы.
Современные кондуктометры и
кондуктометрические датчики.
Прямая
кондуктометрия: сущность метода, приемы
нахождения неизвестной концентрации,
применение для целей анализа.
Кондуктометрическое
титрование: сущность метода, кривые
титрования индивидуальных веществ и
смесей для реакций кислотно-основного
взаимодействия, осаждения,
комплексообразования. Факторы, влияющие
на четкость излома кривых титрования
в каждом случае.
Потенциометрические
методы анализа.
Сущность
и классификация потенциометрических
методов анализа: прямая потенциометрия
(ионометрия) и потенциометрическое
титрование.
Аналитические возможности и метрологические
характеристики методов.
Измерение
аналитического сигнала. Индикаторные
электроды и электроды сравнения,
требования к ним. Измерительные приборы.
Классификация
электродов в зависимости от принципа
работы: электронообменные (металлические)
и ионообменные (мембранные, ионоселективные)
электроды, уравнения Нернста для них.
Ионометрия.
Ионоселективные электроды, зависимость
их потенциала от активности определяемых
ионов в отсутствие и в присутствии
мешающих ионов, уравнение Никольского.
Основные характеристики ионоселективных
электродов, потенциометрический
коэффициент селективности. Методы
определения концентрации ионов с
использованием ионоселективных
электродов.
Потенциометрическое
титрование: сущность метода, кривые
титрования индивидуальных веществ и
смесей. Графические
способы определения конечной точки
титрования.
Выбор системы
электродов для проведения потенциометрического
титрования с использованием
кислотно-основных
и окислительно-восстановительных
реакций, реакций осаждения и
комплексообразования. Неводное
потенциометрическое титрование.
Вольтамперометрические
методы анализа.
Сущность и классификация вольтамперометрических
методов анализа. Аналитические возможности
и метрологические характеристики
методов.
Электролитическая
ячейка и измерительные приборы.
Поляризация электродов, требования к
электродам. Жидкие и твердые рабочие
электроды, понятие о современных видах
рабочих электродов (вращающиеся дисковые,
модифицированные, ртутно-графитовые
электроды in situ и др.). Современные приборы
для вольтамперометрического анализа
– полярографы, вольтамперометрические
анализаторы.
Вольтамперная
зависимость (полярограмма, полярографическая
волна). Остаточный, диффузионный и
предельный диффузионный токи. Зависимость
предельного диффузионного тока от
концентрации. Уравнение Ильковича.
Основные характеристики волны –
потенциал полуволны и высота волны, их
использование для целей качественного
и количественного анализа. Уравнение
Гейровского, его применение в анализе.
Условия получения волны. Миграционный
и конвекционный токи, их подавление.
Приемы
нахождения неизвестной концентрации
в вольтамперометрии. Амперометрическое
титрование.
Инверсионная
вольтамперометрия. Сущность и особенности
метода, его аналитические возможности
и метрологические характеристики.
Основные этапы инверсионно-вольтамперометрического
определения. Вольтамперная зависимость,
ее основные характеристики – потенциал
пика и высота (глубина) пика, их
использование для целей качественного
и количественного анализа.
Спектроскопические
и другие оптические методы анализа
Классификация
спектроскопических и других оптических
методов анализа в зависимости от
спектрального диапазона, в котором
измеряют величину аналитического
сигнала, и от явлений, которые происходят
при взаимодействии света с веществом.
Атомная
спектроскопия.
Теоретические
основы метода. Законы испускания и
поглощения электромагнитного излучения
атомами. Способы атомизации пробы и
возбуждения атомов.
Эмиссионная
фотометрия пламени.
Сущность метода, его аналитические
возможности и метрологические
характеристики. Эмиссионные спектры,
их происхождение,
получение и регистрация. Основные
характеристики линий эмиссионного
спектра, их использование для качественного
и количественного анализа. Резонансные
спектральные линии, их значение в
анализе. Процессы, протекающие в пламени
при распылении в нем исследуемого
раствора. Возбуждение частиц в пламени,
распределение Больцмана. Зависимость
интенсивности излучения от концентрации
элемента в растворе, причины отклонения
от линейности. Влияние различных факторов
на результаты пламенно-фотометрических
определений. Мешающее влияние катионов
и анионов. Приемы определения неизвестной
концентрации. Основные узлы и общий
принцип работы приборов эмиссионной
фотометрии пламени. Пламя как источник
возбуждения и атомизатор, его характеристики
(температура, состав).
Абсорбционная
спектроскопия.
Происхождение спектров поглощения.
Вращательные спектры. Колебательные
спектры и их использование в аналитической
практике.
Электронные
спектры поглощения, их получение и
регистрация. Основные характеристики
полос поглощения, их использование для
качественного и количественного анализа.
Основные величины, характеризующие
светопоглощение. Закон Бугера – Ламберта – Бера,
условия его применимости, причины
отклонений от него. Закон аддитивности
светопоглощения.
Фотоколориметрия
и спектрофотометрия: сущность,
аналитические возможности и метрологические
характеристики методов. Основные этапы
фотометрического определения.
Фотометрические реакции и фотометрические
реагенты. Выбор условий фотометрического
определения (длина волны, толщина
поглощающего слоя). Оптимальный интервал
значений светопоглощения.
Прямые
и косвенные приемы определения неизвестной
концентрации. Фотометрическое титрование,
виды кривых титрования. Определение
светопоглощающих веществ в смеси.
Основные
узлы и общий принцип работы приборов
абсорбционной спектроскопии. Источники
света различных областей спектра,
монохроматизаторы (призмы, дифракционные
решетки, светофильтры), кюветы, приемники
света.
Нефелометрия
и турбидиметрия.
Сущность методов, их аналитические
возможности и метрологические
характеристики.
Взаимодействие
света со взвешенными частицами. Закон
Релея. Зависимость аналитического
сигнала от концентрации вещества в
нефелометрии и турбидиметрии. Условия
проведения нефелометрических и
турбидиметрических измерений. Приемы
определения неизвестной концентрации.
Приборы
для нефелометрических
и турбидиметрических измерений –
нефелометры, мутномеры, турбидиметры,
фотоколориметры,
спектрофотометры, абсорбциометры.
Основные узлы и общий принцип работы.
Рефрактометрия.
Сущность
метода, его аналитические возможности
и метрологические характеристики.
Показатель
преломления как аналитический сигнал,
факторы, влияющие на величину сигнала.
Условия проведения рефрактометрических
измерений. Удельная и молярная рефракция.
Формула Лоренц-Лоренца и правило
аддитивности рефракции, их использование
для анализа бинарных смесей.
Рефрактометры.
Основные
узлы и общий принцип работы. Предельный
угол преломления и его значение при
измерении АС. Специализированные
рефрактометры, шкала Брикса. Современные
рефрактометры для проведения
экспресс-анализа, их элементная база.
Хроматографические
методы анализа
Хроматографические
методы анализа, их сущность, особенности
и аналитические возможности. Основы
процесса хроматографического разделения.
Классификация хроматографических
методов. Подвижные и неподвижные фазы
в хроматографии. Хроматограмма,
хроматографические параметры и их
использование для целей качественного
и количественного анализа.
Газовая
хроматография. Сущность
метода, его разновидности. Теоретические
основы и аналитические возможности
газожидкостной и газоадсорбционной
хроматографии. Параметры удерживания.
Параметры разделения. Основные узлы и
принцип действия газовых хроматографов.
Условия проведения эксперимента, выбор
оптимальных условий хроматографирования.
Методы идентификации и определения
компонентов пробы в газовой хроматографии.
Жидкостная
хроматография. Сущность и аналитические
возможности метода. Основные
узлы и принцип действия жидкостных
хроматографов. Высокоэффективная
жидкостная хроматография в адсорбционном
и ионообменном вариантах.
Методы разделения
и концентрирования, основанные на
однократном распределении вещества
между двумя фазами
Сущность, задачи
и основные количественные характеристики
методов разделения и концентрирования.
Константа и коэффициент распределения,
степень извлечения. Классификация
методов разделения и концентрирования.
Экстракция.
Сущность экстракции и ее применение в
анализе. Экстракционное равновесие.
Скорость экстракции. Условия проведения
экстракции.
Ионный обмен.
Сущность ионного обмена и его применение
в анализе. Иониты, их классификация.
Строение ионитов. Ионообменное равновесие.
Закономерности ионного обмена. Обменная
емкость ионитов, ее виды. Факторы,
влияющие на обменную емкость.
ПРИЛОЖЕНИЕ
Основные
расчетные формулы
|
Величина: |
Расчетная формула |
|
|
название |
обозначение |
|
|
Масса |
m(Х), |
m(Х) = C(1/zR) × V(R) × M(1/zХ)
m(Х) = C(1/zХ) × V(Х) × M(1/zХ) |
|
Массовая |
w(Х), |
|
|
Молярная концентрация |
С(Х), |
|
|
Молярная концентрация эквивалента |
С(1/zХ), |
|
|
Массовая концентрация |
r*(Х), и другие единицы |
|
|
Титр |
Т(Х), |
|
|
Титр |
Т(R/X), |
|
|
Количество вещества |
n(X), |
|
|
Количество вещества эквивалента |
n(1/zX), |
n(1/z X) = n(1/z R) |
Обозначения:
Х
– определяемое вещество; 1/z
– фактор эквивалентности вещества в
данной реакции; R
– титрант.
ОГЛАВЛЕНИЕ
|
Введение |
|
|
ОРГАНИЗАЦИЯ |
|
|
Выполнение |
|
|
Ведение |
|
|
Контроль |
|
|
1. Кондуктометрическое |
|
|
Лабораторная и NiSO4 |
|
|
Лабораторная и H3BO3 |
|
|
Лабораторная |
|
|
2. |
|
|
Лабораторная компонентов |
|
|
Лабораторная |
|
|
Лабораторная рН-метрического |
|
|
Лабораторная и Zn2+ |
|
|
3. |
|
|
Лабораторная
Вариант 1.
Вариант 2. |
|
|
4. |
|
|
Лабораторная микроколичеств
Вариант 1.
Вариант 2.
Вариант 3. |
|
|
5. |
|
|
Лабораторная |
|
|
Лабораторная |
|
|
6. |
|
|
Лабораторная тиоцианатного комплекса . |
|
|
Лабораторная двухкомпонентных |
|
|
Лабораторная с использованием фотометрического титрования . . . . . . |
|
|
7. СПЕКТРОФОТОМЕТРИЯ |
|
|
Лабораторная и при совместном присутствии в растворе |
|
|
Лабораторная в УФ области с предварительным |
|
|
8. ТУРБИДИМЕТРИЯ |
|
|
Лабораторная
Вариант 1.
Вариант 2.
Вариант 2.
Лабораторная |
|
|
9. ЭМИССИОННАЯ |
|
|
Лабораторная и калия в смеси
Вариант 1.
Вариант 2.
Вариант 3.
Вариант 4.
Лабораторная в почвенных вытяжках |
|
|
10. РЕФРАКТОМЕТРИЯ |
|
|
Лабораторная |
|
|
Лабораторная |
|
11. ИОННЫЙ ОБМЕН |
|
|
Лабораторная |
|
|
12. ЭКСТРАКЦИЯ |
|
|
Лабораторная характеристик и степени извлечения |
|
|
Программа |
|
|
ПРИЛОЖЕНИЕ. |
Учебное
издание
Радион
Елена
Вадимовна
Соколовский
Александр Евгеньевич
Коваленко
Наталья
Александровна
Супиченко
Галина Николаевна
Кийко
Татьяна Николаевна
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Степень – извлечение – вещество
Cтраница 1
Степень извлечения вещества с помощью экстракции зависит от свойств выбранного растворителя и от состояния вещества в водной фазе. Некоторые вещества можно практически полностью извлечь при однократной экстракции. Для других требуется двух -, трех – или многократная экстракция. Если об этом не говорится в прописи, следует предварительно установить степень извлечения опытным путем. Эффективность экстрагирования в сильной степени зависит от условий, в частности от рН раствора, поэтому необходимо точно придерживаться указаний, приведенных в прописи.
[1]
От каких факторов зависит степень извлечения вещества.
[2]
Как видно из этого уравнения, степень извлечения вещества прямо пропорциональна его начальной концентрации в степени Ь и расходу воздуха на единицу обрабатываемой воды Q в степени а. Однако увеличение интенсивности барботажа воздуха приводит к возрастанию степени извлечения ПАВ лишь-в определенных пределах. Например, при барботаже воздуха через пористые пластины нижнее критическое значение скорости продувания воздуха через жидкость отвечает требованию равенства давления газа гидростатическому сопротивлению-столба барботируемого раствора. При меньшем напоре газа пузырьки не образуются и пена, естественно, не образуется.
[3]
Очевидно, что с возрастанием числа экстракций степень извлечения вещества I возрастает, а чистота его ( чистота экстракта) падает. Выход вещества II, напротив, с увеличением п уменьшается, нечистота его ( чистота рафината) возрастает.
[4]
Стало быть, и в этом случае повышается степень извлечения вещества или увеличивается число ступеней изменения концентрации. Это подтверждается результатами экспериментов ( фиг. Однако ввиду незначительного количества экспериментального материала сделанные выводы о влиянии скорости вращения ротора и величины расхода дисперсной фазы на степень извлечения вещества следует считать предварительными.
[5]
Выражение (7.89) является модификацией формулы Гедеса [33] г которая связывает степень извлечения вещества со средними значениями параметров процесса. Очевидно, что формула (7.89) также корректна и для средних значений параметров процесса.
[6]
Из этого уравнения следует, что при прочих равных условиях степень извлечения вещества тем больше, чем больше константа распределения и чем меньше отношение объемов УВод / Уорг.
[7]
Исходя из закона распределения и допуская, что один растворитель совершенно не смешивается с другим, можно вывести общие формулы, определяющие степень извлечения вещества из раствора.
[8]
Исходя из закона распределения и допуская, что один растворитель совершенно не смешивается с другим, можно вывести: общие формулы, определяющие степень извлечения вещества из раствора.
[9]
Эти помехи исключаются в способе, использующем воздух для извлечения ОВ. Степень извлечения вещества при воздушной экстракции значительно меньше, что часто обусловлено весьма устойчивой сорбцией ОВ материалом обмундирования. Поэтому для извлечения малолетучих ОВ, таких, как серный иприт, зоман или V-газы, требуется просасывать воздух в течение продолжительного времени.
[10]
При таком однократном взаимодействии при длительном времени контактирования могут быть получены близкие к равновесным составы экстракта и рафината. Степень извлечения вещества при однократной экстракции является низкой.
[12]
Как видно из этого уравнения, степень извлечения вещества прямо пропорциональна его начальной концентрации в степени 6 и расходу воздуха на единицу обрабатываемой воды Q в степени а или интенсивности барботажа воздуха.
[13]
Как правило, первые две стадии промывки полидисперсных осадков незначительно зависят от скорости потока промывной жидкости, а определяются в основном ее объемом. На третьей стадии промывки наблюдается увеличение степени извлечения вещества с уменьшением скорости движения промывной жидкости.
[14]
Увеличение межфазной поверхности играет существенную роль в ускорении процесса массопередачи, однако уменьшение размеров капель вызывает меньшее возрастание скорости массопередачи, чем при повышении скорости циркуляции жидкости в каплях. Гидродинамический режим в аппарате необходимо выбирать таким образом, чтобы не допустить образования устойчивых эмульсий и потерь дисперсной фазы со сплошной фазой, что может привести к снижению степени извлечения вещества.
[15]
Страницы:
1
2
В настояшей главе рассматривается расчет колонного аппарата при прямо- и противотоке с учетом продольного перемешивания в приближении однопараметрической диффузионной модели. Задача расчета сводится либо к нахождению высоты колонны, соответствующей заданной степени извлечения, либо к определению степени извлечения при заданной высоте колонны. Как будет показано ниже, первая задача значительно проше при численных расчетах, чем вторая. [c.299]
Определенный вклад в степень извлечения при экстракции вносит концевой эффект, т. е. массопередача в период образования капель. Здесь также существенным является отдельное рассмотрение процесса массопередачи в объеме лимитирующей фазы. Особенности массо-и теплообмена в период образования капель и оценка величины эффекта при лимитирующем сопротивлении дисперсной или сплошной фаз рассмотрены в разделе 4.5. [c.168]
Анализируя связь между достигаемым фактором разделения СО2/СН4 и параметрами процесса очистки на примере одноступенчатой схемы (вариант о), можно сделать вывод, что фактор разделения значительно влияет на степень извлечения только до некоторого определенного (в данном случае а= 10) значения. Это подтверждается и на примере других процессов мембранного разделения газов. Сравнение различных методов очистки биогаза, в том числе и мембранного, приведено в литературе [51]. [c.303]
Основным методом отделения и концентрирования следовых количеств веществ является экстракция (см. гл. 38). Многие элементы можно перевести в соединения, малорастворимые в воде, но хорощо растворимые в органических растворителях. Применяя различные лиганды для комплексообразования, меняя рн водного раствора, степень окисления экстрагируемых катионов и применяя различные растворители для экстракции, можно варьировать степень извлечения и концентрирования. В идеальном случае извлекаемый элемент при встряхивании (для увеличения поверхности раздела фаз с целью ускорения достижения равновесного состояния) полностью переходит в органическую фазу, в то время как мещающие определению элементы остаются в водной фазе. Таким образом удается отделить следовые количества элементов от больших количеств других элементов (матрицы) и сконцентрировать их. [c.426]
В ряде работ, например [321-324], для концевого эффекта, определенного методом экстраполяции на нулевую высоту колонны, были получены.значения степени извлечения от нескольких единиц до нескольких десятков процентов даже при весьма малых временах образования капель. Столь большие значения концевого эффекта при малых временах контакта противоречат общепринятым представлениям о механизме массопередачи. Некоторыми исследователями высказывались различные предположения о механизме интенсификации массопередачи в процессе образования капли. Так, авторы работы [325] считают, что процесс [c.209]
Промышленные массо- и теплообменные процессы в дисперсных системах реализуются, как правило, в противоточных колонных аппаратах. Эффективность колонны характеризуется интенсивностью массо- и теплопереноса в ней. Конечная цель расчета эффективности — определение высоты колонны, соответствующей заданной степени извлечения или нагрева. [c.217]
На новых газобензиновых заводах для определения степени извлечения отдельных углеводородных компонентов широко начали применять хроматографию [33]. Установка таких приборов помогает ускоренному пуску и выведению установки на заданный режим, контролю работы отдельных аппаратов и т. д. [c.28]
Определение затрат на обратноосмотическое опреснение солоноватых вод представляет определенные трудности вследствие большого их разнообразия по составу. Кроме того, на стоимость оказывают влияние такие локальные факторы, как стоимость электроэнергии, труда, расстояния между установкой и источником солоноватой воды и т. п. Другими факторами, влияющими на стоимость опреснения, являются размеры установки и степень извлечения чистой воды. Затраты (N в долларах— долл. и центах — ц), иллюстрируемые рис. У1-14, включают [c.301]
Для практических расчетов, например при проектировании новых фильтровальных установок, целесообразно использовать экспериментальные данные о необходимом количестве промывной жидкости, полученные при исследовании определенного осадка в заданных условиях. Для получения таких данных может быть использован метод непосредственного определения количества промывной жидкости, обеспечивающего достижение желательной степени извлечения жидкой фазы осадка. Могут быть применены так- [c.245]
На рис. 103 показана зависимость потребляемой мощности и степени извлечения пропана от температуры на установке масляной абсорбции с применением холода. Эти данные относительны и связаны с определенной скоростью циркуляции абсорбента и газом определенного состава. Однако из рисунка можно понять, почему в настоящее время строится так много холодильных установок в сочетании с масляной абсорбцией. [c.179]
Комплексообразование карбамида с углеводородами протекает с разной скоростью. Изучению скорости комплексообразования посвящено много работ. Изучалась скорость вступления в комплекс углеводородов в зависимости от длины цепи и природы исходного сырья [за] исследовалась скорость реакции комплексообразования с точки зрения диффузионных явлений внутри кристалла карбамида, т-е. проникновения н-алканов в зоны неотработанного кристалла карбамида [34]. В работе [35] были продолжены исследования по определению скорости реакции комплексообразования. Были изучены непрерывные кинетические кривые, полученные при образовании комплекса карбамида с н-алканами от до и с другими комплексообразующими углеводородами, находящимися в дизельных фракциях некоторых нефтей. Изучали последовательность вступления в комплекс и скорость реакции комплексообразования исследуемых продуктов, степень извлечения их от потенциала в зависимости от температуры и длительности реакции. Физико-хи ,ические свойства исследуемых дизельных фракций сун-женской, усть-балыкской и грозненской нефтей приведены в табл. 2.2. [c.41]
Как и в процессе ректификации (см. стр. 658), орошение колонны флегмой позволяет существенно увеличить степень извлечения экстрагируемого компонента. Однако, в отличие от ректификации, при использовании флегмы в процессе экстракции требуется соблюдение определенных условий экстрагент должен быть лишь частично растворим в обоих компонентах исходного раствора, а различие плотностей обеих фаз должно быть достаточно для их движения противотоком в колонне. [c.649]
Для переноса максимального количества серы из регенератора в реактор требуется соблюдать определенные условия. В частности, необходимо содержание кокса на катализаторе поддерживать на низком уровне, регенерировать катализатор в избытке воздуха и располагать большим числом активных центров на каталитической поверхности. Предполагается, что этот вариант может в экономическом отношении конкурировать с традиционными методами очистки [236]. Если серы в сырье более 2,0% (масс.), в коксе содержание ее такое, что степень извлечения оксидов серы из газов регенерации составляет менее 50%. Поэтому в настоящее время проводят исследования с целью создания катализаторов, позволяющих улавливать до 80-90% оксидов серы. [c.134]
Себестоимостью называется денежное выражение затрат данного предприятия на изготовление и сбыт продукции. Для составления калькуляции себестоимости, т. е. расчета затрат на единицу продукции, определяют статьи расхода, в том числе расходные коэффициенты по сырью, материалам, топливу и энергии, и с учетом цены на них рассчитывают калькуляцию. На практике обычно чем меньше расходные коэффициенты, тем экономичнее процесс и соответственно тем меньше себестоимость продукции. Однако снижение расходных коэффициентов ниже определенного минимума связано с необходимостью повышения чистоты исходных материалов, степеней извлечения, выхода продукта, что требует значительных расходов и может повести к увеличению себестоимости продукта. [c.7]
Расчетные формулы для определения выхода продукта в гетерогенных процессах осложнены наличием нескольких фаз. Пользуясь законом сохранения массы, расчет степени превращения обычно ведут только по одной фазе, чаще всего передающей. Например, степень превращения (степень извлечения) при адсорбции или абсорбции рассчитывают по формуле [c.156]
Однако обычно заданы только начальные составы газа и жидкости (Уь Х2) и степень извлечения е. Заданным условиям соответствует определенное значение Уг, которое можно найти по формуле (17-4) и таким образом построить точку В (рис. 17-1). В зависимости от у- ельного расхода поглотителя рабочая [c.592]
Заключительным этапом моделирования процессов является их о п т и -мизация — выбор наилучших, или оптимальных, условий проведения процесса. Определение этих условий связано с выбором критерия оптимизации, который может зависеть от оптимальных значений ряда параметров (например, температуры, давления, степени извлечения и др.). Между указанными параметрами обычно существует сложная взаимосвязь, что сильно затрудняет выбор единого критерия, всесторонне характеризующего эффективность процесса. Задача сводится к поиску экстремального значения (минимума или максимума) целевой функции, выражающей зависимость величины выбранного критерия оптимизации от влияющих на него факторов. [c.19]
Другие схемы переработки газа не дают возможности регулировать, поддерживать на одном уровне глубину извлечения целевых компонентов при изменении состава газа. Действительно, любая схема, основанная на процессе конденсации, рассчитана на определенные параметры. Если газ, поступающий на переработку стал беднее, то при тех же параметрах (при тех же температуре и давлении процесса) степень извлечения целевых компонентов уменьшается. Наоборот, если перерабатываемый газ стал более жирным, то степень извлечения целевых компонентов возрастает. [c.194]
На рис. 59,а показано положение рабочей линии при противотоке без рециркуляции АВ ) и с рециркуляцией (ЛВ). Из уравнения (И 1-90) можно установить, что кратность циркуляции равна отношению отрезка (а+й) к отрезку а. Максимально возможная кратность циркуляции при заданной степени извлечения (т. е. при определенном значении у ) соответствует положению точки В на линии равновесия (рабочая линия АВ”). При у Уу возможны любые кратности циркуляции, так как рабочая линия может принять вертикальное положение. [c.216]
Описанный метод расчета применим для определения количеств и составов фаз при известном числе единиц переноса Мц. Значение Л о надо определить предварительно по заданной степени извлечения ключевого компонента. Это можно сделать приближенным способом (стр. 299), так как мало зависит от изменения и / по высоте аппарата. При абсорбции нескольких компонентов возможно появление экстремумов на кривых изменения составов отдельных компонентов. Нетрудно показать, что экстремуму на кривой Х (и У ) соответствует условие dXj= X df , при этом ниже точки экстремума будет происходить десорбция компонента /. На кривой возможен экстремум без перехода к десорбции вследствие возрастания количества жидкости в результате абсорбции более растворимых компонентов. [c.295]
На рис. 222,а показан объект с одним регулируемым параметром—абсорбер, в котором необходимо получить жидкость определенной концентрации (степень извлечения компонента из газа не регулируется) схема воздействия ясна из рисунка. [c.708]
Если формулы (2-3), (2-4) выражают степень извлечения частиц с размером, меньшим или большим определенной величины, а формула (2-12) характеризует степень чистоты получаемых продуктов, то формула (2-15) характеризует процесс сепарации как с точки зрения эффект[ вности извлечения, так и в отношении чистоты разделения. При этом величина к. п. д. не зави- [c.43]
Выделение желаемого индикаторного радионуклида можно облегчить с помощью добавления в качестве носителя известного количества (0,1-10 мг) того же элемента в неактивной, но такой же химической форме. Таким образом, становится возможным выделять сравнительно большое и постоянное количество определяемого элемента, предполагая, что количество элемента в пробе пренебрежимо мало по сравнению с количеством добавленного носителя. После установления химического равновесия определяемый элемент отделяют от смеси радионуклидов. Выделение не обязательно должно быть количественным, если выход определяют каким-либо общепринятым химическим методом, таким, как гравиметрия, титриметрия или спектрофотометрия. Активационный анализ в сочетании с индивидуальным выделением и определением степени извлечения носителя способен давать правильные результаты даже при очень низких содержаниях элементов — на уровне миллиардных долей и ниже. [c.116]
Сорбция в потоке — впрыск в поток исходной смеси стабильного конденсата или других углеводородных жидкостей на некотором расстоянии от сепаратора, т. е. утяжеление исходной смеси. Как было показано, до определенного предела утяжеление состава тощей исходной смеси позволяет повысить степень извлечения конденсатобразующих компонентов. Но это ме-роирнятне пе дает эффекта для жирных смесей. [c.155]
Сорбция ионов сильных электролитов на угле обусловлена наличием на его поверхности химически активных адсорбированных газов. Ионообменные свойства углей имеют важное значение для правильного установления технологического режима очистки сточных вод от ПАВ, поскольку катионоактнвные и анионоактивные ПАВ в определенных условиях ведут себя как электролиты. Степень извлечения ПАВ, проявляющих свойства электролитов, тем больше, чем меньше их степень диссоциации. Последнюю можно регулировать изменениелг pH среды или солесодержанием, а также добавлением неорганических электролитов. [c.216]
В настоящей главе рассматриваются закономерности массообменных процессов, осложненных химическими реакциями первого и второго порядка, протекающими в объеме сплошной или дисперсной фазы. Основные результаты получены на базе решения уравнений, описьтаю-щих процесс хемосорбции при конвективном массообмене в области малых и средних значений критерия Ке. Проводится анализ процесса как для конечных значений константы скорости реакции, так и в случае быстропротекающих реакций. Приведены расчетные формулы, таблицы и графики для определения степени извлечения и фактора, характеризующего ускоряющее действие химической реакции на процесс массообмена. Эти данные используются в гл. 7 и 8 для расчета колонных аппаратов. [c.259]
Расчетные формулы для определения К или йэкв получают обычно сравнением выражений для степени извлечения в соответствии с моделью противотока и моделью, учитывающей продольное перемешивание. Так как аналитические выражения для степени [c.238]
Отметим, что процессы массообмена, описываемые линейным уравнением равновесия, на практике встречаются редко, поэтому приведенные решения характеризуют частный случай. При произвольной линии равновесия часто пользуются графическим решением. Проиллюстрируем его для определения минимального расхода абсорбата, когда заданы составы поступающих в абсорбер газа Со (0) = Сво и жидкости С (Ь) = С о а также необходимая степень извлечения компонента а = (С о—Со)1Соо. Обратим внимание на то, что система (П.18) может быть проинтегрирована относительно ОС, так как й Сг С ,) = —й ОсСа)- Если массовые потоки С велики и их можно считать постоянными, то, зачитывая условие для а, имеем [c.83]
Выбор того или иного процесса для осуществления перечисленных стадий осуществ яется для каждого ГПЗ индивидуально в зависимости от характеристик сырья и существующих потребностей в определенных продуктах. Например, очистка газа от кислых компонентов может происходить в два этапа очистка от НгЗ и СО2 растворами аминов практически без извлечения меркаптанов и очистка от меркаптанов растворами щелочи или адсорбцией на цеолитах. Той же цели можно достигать и в одну стадию при использовании физикохимических абсорбентов, таких как Укарсол или Экосорб , способных одновременно извлекать Н25, СО2 и сераорганические соединения, хотя в этом случае степень извлечения меркаптанов ниже, чем при защелачивании. [c.177]
Задачей технологического расчета абсорбции является определение необходимого числа тарелок или расхода абсорбента, а исходными данными для расчета служат состав разделяемого газа, требуемая степень извлечения ключевого компонента, параметры процесса. За ключевой компонент принимается тот, для извлечения которого необходим наибольший расход абсорбента или наибольшее число теоретических тарелок. Последовательность расчета для случая, когда заданк степени извлечения ключевого компонента и число теоретических тарелок, приводится ниже. [c.112]
Коэффициент полезного действия реальной тарелки может иметь различное значение для различных компонентов в этом случае при определении степени извлечения каждого компопента по графику Кремсера (рис. 8. 7) или по ураинению (8. 26) принимают число теоретических тарелок т, опроделяемоо из соотношения [c.238]
Дополнительная сложность расчета процессов абсорбции по кинетическому методу — необходимость определения коэффициентов массопередачи. Именно поэтому они не получили пока распространения в расчетной практике. Только в последние годы с внедрением быстродействующих ЭВМ работы в этом направлении рас-щирились с тем, чтобы исключить необходимость перехода от теоретических тарелок к реальным и сразу получать число необходимых реальных тарелок. Цель расчета процесса абсорбции — определение удельного расхода абсорбента, степени извлечения компонентов и числа действительных тарелок. Для более точного расчета размеров аппарата желательно знать величину жидкостных и паровых потоков по высоте абсорбера. [c.307]
ЕО определение числа единиц переноса при десорбции не встречает затруднений. Поскольку на абсорбцию возвращается с десорбции жидкость состава х , то парциальное давление компонента в газе после абсорбции должно быть выше Рдес. (см. рис. 92). Это ограничивает возможную степень извлечения компонента из газа при десорбции путем снижения давления жидкости. Поэтому данный способ десорбции часто комбинируют с другими способами. Например, выходящую из десорбера жидкость направляют на десорбцию инертным газом в этом случае содержание компонента в десорбированной жидкости может быть значительно снижено и на абсорбцию подают жидкость с меньшим содержанием компонента. [c.313]
А бсорбционная установка, в зависимости от своего назначе-ния, должна обеспечивать получение продукта определенной концентрации или степень извлечения компонента не ниже заданной, либо и то и другое. При тех или иных встречающихся в производственных условиях возмущениях происходит отклонение указанных параметров от заданных величин. Так, при изменении количества или концентрации поступающего газа изменяется концентрация вытекающей жидкости, и для поддержания ее на заданном уровне надо изменить подачу поглотителя. [c.687]
Чаще всего применяют агитационное В. Его проводят в реакторах с мех. (с помощью мешалок), пневматич. (путем подачи воздуха, острого пара или др. газов) или комбиниров. перемешиванием. Важное значение имеет размер частиц твердого в-ва и его концентрация в системе. Увеличение степени измельчения до определенного предела повышает скорость процесса и конечную степень извлечения благодаря росту пов-сти контакта фаз и большей доступности заблокированных пустой породой включений растворяемого минерала. Однако слишком тонкий помол приводит к повышению вязкости смеси, резко усложняет послед, разделение фаз и требует большого расхода энергии. Средний размер частиц при В. редко бывает менее 50-75 мкм. При понижении концентрации твердой фазы облегчается перемешивание, однако при этом повышается расход выщелачивающего реагента и затрудняется послед, фильтрация. При малом кол-ве жидкости система становится слишком вязкой и плотной. Обычно соотношение по массе жидкой и твердой фаз при В. составляет от 0,7 до. 6 (чаще всего 1-2) и зависит от состава выщелачиваемого материала, р-римости извлекаемого соед. и др. факторов. [c.446]
Кон юрмных растворов теория 4/367 Концевые фуппы, определение 3/218 Концентраты 3/629-638 5/210 безбалластные 2/869, 870 белково-витаминные 1/483 2/232, 233 3/157, 212,281, 862, 864, 884 гранулирование 1/1188 деасфальтизатов 2/6 древесно-сульфитные 3/894 компоненты, степень извлечения 2/916 мастак 2/1318 металлов, обработка 3/93 пигаентов 2/1001, 1002 3/1013 пирометаллургия 3/1068 полимерорастворимых красителей 2/994 [c.630]