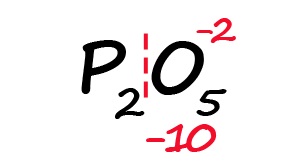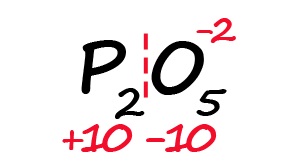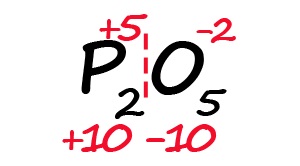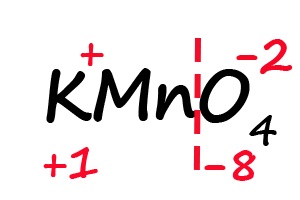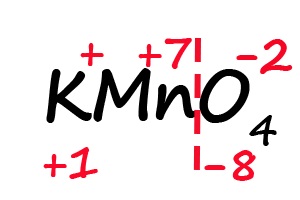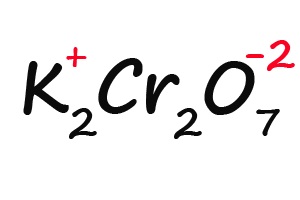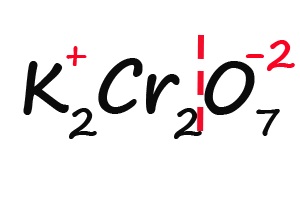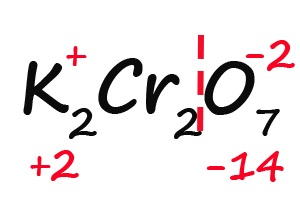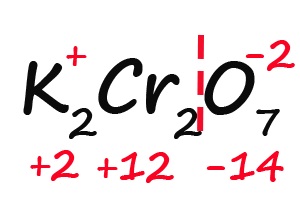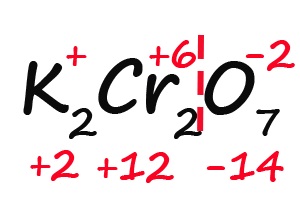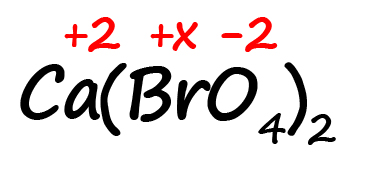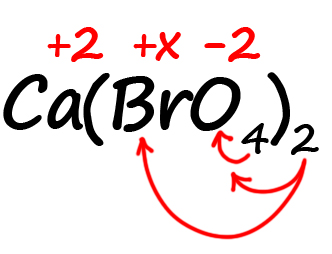| Символ | Br– |
| Номер | 35 |
| Атомный вес | 79.9010000 |
| Латинское название | Bromum |
| Русское название | Бром |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
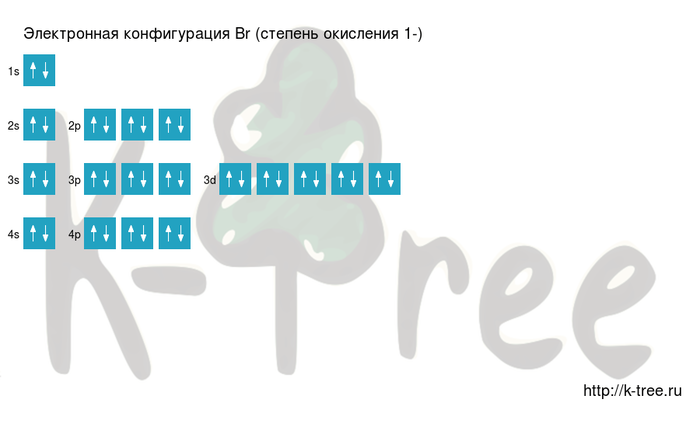
Электронная схема брома
Br: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5 →
Br–:1s22s22p63s23p64s23d104p6
Одинаковую электронную конфигурацию имеют
ион брома -1 и
As-3, Se-2, Kr, Rb+1, Sr+2, Y+3, Zr+4, Tc+7
Порядок заполнения оболочек атома брома (Br–) электронами:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d →
5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ – до 6, на
‘d’ – до 10 и на ‘f’ до 14
Бром имеет 35 электронов,
заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
10 электронов на 3d-подуровне
6 электронов на 4p-подуровне
Степень окисления брома
Атомы брома в соединениях имеют степени окисления 7, 5, 4, 3, 1, 0, -1.
Степень окисления – это условный заряд атома в соединении: связь в молекуле
между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается
заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается,
то степень окисления положительная.
Степень окисления иона Br– = -1
Ионы брома
Валентность Br–
Атомы брома в соединениях проявляют валентность VII, V, IV, III, I.
Валентность брома характеризует способность атома Br к образованию хмических связей.
Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании
химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Br 1-
Квантовые числа определяются последним электроном в конфигурации,
для иона Br эти числа имеют значение N = 4, L = 1, Ml = 1, Ms = -½
Видео заполнения электронной конфигурации (gif):
Результат:
Перейти к другим элементам таблицы менделеева
Где Br в таблице менделеева?
Таблица Менделеева
Скачать таблицу менделеева в хорошем качестве
Степень окисления брома.
Степень окисления брома:
Степень окисления (окислительное число) – это вспомогательная условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций. Она указывает на состояние окисления отдельного атома молекулы и представляет собой лишь удобный метод учёта переноса электронов. Однако она не является истинным зарядом атома в молекуле.
Степень окисления соответствует числу электронов, которое следует присоединить к положительному иону (катиону), чтобы восстановить его до нейтрального атома, или отнять от отрицательного иона (аниона), чтобы окислить его до нейтрального атома.
Степень окисления (в отличие от валентности) может иметь нулевое, отрицательное и положительное значения.
Значения степени окисления записывают арабскими цифрами сверху над символом элемента. При указании степени окисления первым ставится знак, а потом численное значение, а не наоборот.
Степень окисления (в отличие от валентности) может иметь нулевое, отрицательное и положительное значения: -5, -4, -3, -2, -1, 0, +1, +2 , +3 , +4, +5, +6 , +7.
Следует помнить, что степень окисления является сугубо условной величиной, не имеющей физического смысла, но характеризующей образование химической связи межатомного взаимодействия в молекуле.
Степень окисления в ряде случаев не совпадает с валентностью. Например, в молекуле азотной кислоты степень окисления центрального атома азота равна +5, тогда как валентность равна IV.
Степень окисления зачастую не совпадает с фактическим числом электронов, которые участвуют в образовании связей.
Степень окисления брома равна -1, 0, +1, +3, +4, +5, +7.
| Степень окисления брома в соединениях | |
| -1 | HBr, NaBr, KBr, MgBr2, CaBr2, AlBr3, FeBr3, SiBr4 |
| 0 | Br2 |
| +1 | BrF, Br2O, Br3N |
| +3 | BrF3 |
| +4 | |
| +5 | BrOF3, BrO2F, BrF5 |
| +7 | Br2O7, KBrO4, BrO3F, NaBrO3F2, BrO2F3 |
Все свойства атома брома
Источник: https://ru.wikipedia.org
Примечание: © Фото https://www.pexels.com, https://pixabay.com
Коэффициент востребованности
206
| Бром | |||
|---|---|---|---|
| ← Селен | Криптон → | |||
|
|||
| Внешний вид простого вещества | |||

Образец брома |
|||
| Свойства атома | |||
| Название, символ, номер | Бром / Bromum (Br), 35 | ||
| Группа, период, блок |
17 (устар. 7), 4, p-элемент |
||
| Атомная масса (молярная масса) |
[79,901; 79,907][комм 1][1]. а. е. м. (г/моль) | ||
| Электронная конфигурация |
[Ar] 3d104s24p5 1s22s22p63s23p63d104s24p5 |
||
| Радиус атома | 119 пм | ||
| Химические свойства | |||
| Ковалентный радиус | 114 пм | ||
| Радиус иона | (+5e)47 (-1e)196 пм | ||
| Электроотрицательность | 2,96 (шкала Полинга) | ||
| Электродный потенциал | 0 | ||
| Степени окисления | −1, 0, +1, +3, +5, +7 | ||
| Энергия ионизации (первый электрон) |
1142,0 (11,84) кДж/моль (эВ) | ||
| Термодинамические свойства простого вещества | |||
| Плотность (при н. у.) | 3,102 (25 °C) г/см³ | ||
| Температура плавления | 265,90 К (−7,25 °C)[2] | ||
| Температура кипения | 332,4 К (59,2 °C)[2] | ||
| Критическая точка | 588 К, 10,0 МПа | ||
| Уд. теплота плавления | (Br—Br) 10,58[2] кДж/моль | ||
| Уд. теплота испарения | (Br—Br) 30,86[2] кДж/моль | ||
| Молярная теплоёмкость | 75,69[2] Дж/(K·моль) | ||
| Молярный объём | 23,5 см³/моль | ||
| Кристаллическая решётка простого вещества | |||
| Структура решётки | Орторомбическая | ||
| Параметры решётки | a = 4,48, b = 6,67, c = 8,72 Å[2] | ||
| Прочие характеристики | |||
| Удельное сопротивление | 7,69·1010[2] Ом·м | ||
| Теплопроводность | (300 K) 4,5[2] Вт/(м·К) | ||
| Тепловое расширение | 1,10·10−3 К−1[2] | ||
| Номер CAS | 7726-95-6 |
Бром (химический символ — Br, от др.-греч. βρῶμος — «зловонный»[3], также от лат. Bromum) — химический элемент 17-й группы (по устаревшей классификации — главной подгруппы седьмой группы, VIIA) четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 35.
Простое вещество бром (при нормальных условиях) — это химически активный неметалл (химическая формула — Br2) — тяжёлая едкая жидкость красно-бурого цвета с сильным неприятным «тяжёлым» запахом, отдалённо напоминающим запах одновременно иода и хлора. Летуч и ядовит.
История[править | править код]
Бром был независимо открыт[4] двумя химиками: Карлом Якобом Лёвихом (нем. Carl Jacob Löwig) в 1825 году[5], и Антуаном Жеромом Баларом в 1826 году[6]. Балар заметил бурое окрашивание при прибавлении хлорной воды к маточному раствору бассейнов, в которых из рассолов кристаллизовалась поваренная соль («садочные бассейны»)[7]. Долгое время наполняя такие бассейны свежей морской водой, собирая поваренную соль и не сливая остатков, в них накапливают бромиды, которые содержатся в морской воде в незначительных количествах и не кристаллизуются с солью, потому что не достигают насыщения[8]. Балар дал открытому элементу название «мурид», но по предложению проверявшей его открытие комиссии Парижской Академии Наук (Воклен, Тенар, Гей-Люссак) изменил его на закрепившееся «бром» от греческого бромос — вонь. В России бром под именем «вромий» (в древнегреческом β читается как [б], а в новогреческом как [в]) стал известен в 1827 году после доклада профессора А. Иовского на публичном заседании в Московском Университете. В том же году в журнале «Указатель открытий по физике, химии, естественной истории и технологии» оповестил об открытии брома (именно через б) профессор Н. П. Щеглов[7].
Нахождение в природе[править | править код]
Кларк брома — 1,6 г/т. Бром широко распространён в природе и в рассеянном состоянии встречается почти повсеместно, как примесь содержится в сотнях минералов. Почти все соединения брома хорошо растворяются в воде и поэтому легко выщелачиваются из горных пород. В море сосредоточена бо́льшая часть брома, он находится в значительных количествах также в водах солёных озёр и в подземных водоносных пластах, сопутствующих месторождениям горючих ископаемых, а также калийных солей и каменной соли. Есть бром и в атмосфере, причем содержание этого элемента в воздухе приморских районов всегда больше, чем в районах с резко континентальным климатом.
Имеется лишь небольшое количество нерастворимых в воде соединений брома, это соли серебра и меди. Самый известный из этих минералов — бромаргирит AgBr. Другие минералы — йодобромит Ag(Br, Cl, I), эмболит Ag(Cl, Br)[9]. Собственных минералов брома мало ещё и потому, что его ионный радиус велик, ион брома не может надёжно закрепиться в кристаллической решетке других элементов вместе с катионами средних размеров. В накоплении брома основную роль играют процессы испарения океанической воды, в результате чего он накапливается как в жидкой, так и в твёрдой фазах. Наибольшие концентрации отмечаются в конечных маточных рассолах. В горных породах бром присутствует главным образом в виде ионов, которые мигрируют вместе с грунтовыми водами. Часть земного брома связана в организмах растений в сложные и большей частью нерастворимые органические соединения. Некоторые растения, в первую очередь бобовые — горох, фасоль, чечевица, а также морские водоросли, активно накапливают бром.
Физические свойства[править | править код]
При нормальных условиях бром — тяжёлая летучая жидкость, тёмно-красная на просвет, в отражённом свете тёмно-фиолетового, почти чёрного цвета. Обладает резким неприятным запахом, ядовит, при соприкосновении с кожей образуются долго не заживающие ожоги. Бром — одно из двух простых веществ (и единственное из неметаллов), наряду со ртутью, которое при комнатной температуре является жидким. Плотность при 0 °C — 3,19 г/см³. Температура плавления брома равна −7,25 °C, энтальпия плавления 10,58 кДж/моль. Температура кипения составляет +59,2 °C, при кипении бром превращается из жидкости в жёлто-бурые пары, при вдыхании раздражающие дыхательные пути; энтальпия испарения 30,86 кДж/моль. Давление насыщенных паров при 0 °C составляет 8,7 кПа, при 20 °C 22,8 кПа[2].
Теплопроводность жидкого брома при 25 °C составляет 4,5 Вт/(м·К), газообразного (при 59 °C) 0,21 Вт/(м·К). Молярная энтропия жидкого брома S0
298 = 152,0 Дж/(моль·К), газообразного 245,37 Дж/(моль·К). Молярная теплоёмкость C0
p = 75,69 Дж/(моль·К)[2].
| T, K | So,
Дж/(моль×К) |
cp,
Дж/(моль×К) |
T, K | So,
Дж/(моль×К) |
cp,
Дж/(моль×К) |
|
|---|---|---|---|---|---|---|
| 15 | 0,650 | 1,725 | 160 | 18,130 | 11,981 | |
| 20 | 1,325 | 03,04 | 170 | 18,864 | 12,2 | |
| 25 | 2,144 | 4,309 | 180 | 19,570 | 12,416 | |
| 30 | 3,027 | 5,364 | 190 | 20,245 | 12,632 | |
| 35 | 3,921 | 6,226 | 200 | 20,898 | 12,851 | |
| 40 | 4,799 | 6,929 | 210 | 21,530 | 13,077 | |
| 45 | 5,650 | 7,5 | 220 | 22,144 | 13,315 | |
| 50 | 6,465 | 7,968 | 230 | 22,742 | 13,57 | |
| 55 | 7,244 | 8,355 | 240 | 23,324 | 13,848 | |
| 60 | 7,985 | 8,683 | 250 | 23,896 | 14,157 | |
| 65 | 8,692 | 8,969 | 260 | 24,458 | 14,504 | |
| 70 | 9,366 | 9,228 | 265,9 | 24,786 | 14,732 | |
| 80 | 10,628 | 9,682 | Плавление | |||
| 90 | 11,791 | 10,074 | 265,9 | 34,290 | 18,579 | |
| 100 | 12,870 | 10,419 | 270 | 34,573 | 18,487 | |
| 110 | 13,879 | 10,728 | 280 | 35,241 | 18,3 | |
| 120 | 14,824 | 11,011 | 290 | 35,881 | 18,164 | |
| 130 | 15,718 | 11,273 | 298,15 | 36,384 | 18,089 | |
| 140 | 16,563 | 11,52 | 300 | 36,496 | 18,077 | |
| 150 | 17,365 | 11,755 |
Твёрдый бром образует молекулярные (состоящие из молекул Br2)[11] кристаллы ромбической сингонии, пространственная группа Ccma, параметры ячейки a = 0,448 нм, b = 0,667 нм, c = 0,872 нм, Z = 4. Они игольчатые, красно-коричневые со слабым металлическим блеском, при снижении температуры до 21 К становятся бесцветными; плотность при температуре плавления составляет 4,073 г/см³[2].
Температурный коэффициент объёмного расширения жидкого брома при нормальных условиях равен 1,10·10−3 К−1. Критические параметры: температура 315 °C (588 К), давление 10,0 МПа, плотность 1,26 г/см³. Динамическая вязкость при 0 °C составляет 1,241 мПа·с, температурный коэффициент изменения вязкости равен (1 + 0,01225t + 2,721·10−6t²), где t — температура в градусах Цельсия. Поверхностное натяжение 1,5 мПа (20 °C)[2].
Стандартный электродный потенциал Br2/Br− в водном растворе равен +1,065 В. Удельное электрическое сопротивление жидкого брома 7,69·10¹² Ом·см. Диэлектрическая проницаемость 3,148[2].
Молекулярный бром диамагнитен[2]. Магнитная восприимчивость χ = −56,4·10−6 см³/моль.
Коэффициент преломления составляет 1,659 (в жёлтой D-линии натрия 589 нм при 15 °C). Молекулярный бром проявляет широкую полосу поглощения в видимой и ультрафиолетовой области с максимумом на длине волны 420 нм; сильным поглощением видимого света в области коротких длин волн объясняется красный цвет брома[2].
Атомный радиус брома 119 пм, ионные радиусы в кристаллах: Br− 182 пм (координационное число 6), Br3+ 73 пм (4), Br5+ 45 пм (3), Br7+ 53 пм (6) и 39 пм (4). Электроотрицательность по Полингу 2,8[2].
Энергии ионизации[2]:
- Br0 → Br+ + e−: 11,81381 эВ[12];
- Br+ → Br2+ + e−: 21,80 эВ;
- Br2+ → Br3+ + e−: 35,90 эВ;
- Br3+ → Br4+ + e−: 47,3 эВ;
- Br4+ → Br5+ + e−: 59,7 эВ;
- Br5+ → Br6+ + e−: 88,6 эВ;
- Br6+ → Br7+ + e−: 109,0 эВ (по другим данным 103,0 эВ[12]);
- Br7+ → Br8+ + e−: 192,8 эВ.
Двухатомная молекула брома имеет длину связи 228 пм, энергия диссоциации молекулы 1,969 эВ (190,0 кДж/моль), диаметр молекулы 323 пм. Заметная диссоциация молекул на атомы наблюдается при температуре 800 °C и быстро возрастает при дальнейшем росте температуры; степень диссоциации 0,16 % при 800 °C и 18,3 % при 1284 °C[2].
Изотопы[править | править код]
Природный бром состоит из двух стабильных изотопов 79Br (50,54 %) и 81Br (49,46 %)[13]. Искусственно получены многочисленные радиоактивные изотопы брома.
Химические свойства[править | править код]
В свободном виде существует в виде двухатомных молекул Br2. В пара́х обнаружена примесь молекул Br4[2].
Бром — сильный окислитель, он окисляет сульфит-ион до сульфата, нитрит-ион — до нитрата и т. д.
Стандартный электродный потенциал при 25 °C +1,066 В[13]:
![{displaystyle {ce {2Br- <=>[{-2e}] Br2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/65f2d08030767f0013c9d7dd80f0e3db8f8b82f7)
По химической активности бром занимает промежуточное положение между хлором и иодом[13]. При реакции брома с растворами иодидов выделяется свободный иод:
Напротив, при действии хлора на бромиды, находящиеся в водных растворах, выделяется свободный бром. Реакция протекает при кипении:

Характерные степени окисления брома: −1 (бромиды Br−), +1 (гипобромиты BrO−), +3 (бромиты BrO−
2), +5 (броматы BrO−
3), +7 (перброматы BrO−
4).
Вода
Бром немного, но лучше других галогенов растворим в воде (3,55 г на 100 г воды при 20 °C[13]), раствор называют бромной водой. В бромной воде протекает реакция с образованием бромоводородной и неустойчивой бромноватистой кислот:
Бром на свету или при кипении[источник не указан 281 день] реагирует с водой из-за разложения бромноватистой кислоты[13]:
![{displaystyle {ce {2 H_2O +2Br_2 ->[hnu] 4 HBr + O2 ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0b843e11251dca7e3fca4c0ea5d7bdb03074b2fc)
При температуре ниже 6,2 °C образует декагидрат 
При взаимодействии брома с растворами щелочей и с растворами карбонатов натрия или калия образуются соответствующие бромиды и броматы, например:
Неметаллы
При реакции брома с серой образуется S2Br2, при реакции брома с фосфором (воспламеняется[13]) — PBr3 и PBr5. Бром реагирует также с неметаллами селеном и теллуром.
Реакция брома с водородом протекает при нагревании и приводит к образованию бромоводорода HBr. Раствор HBr в воде — это бромоводородная кислота, по силе близкая к соляной кислоте HCl. Соли бромоводородной кислоты — бромиды (NaBr, MgBr2, AlBr3 и др.). Качественная реакция на присутствие бромид-ионов в растворе — образование с ионами Ag+ светло-желтого осадка бромида серебра AgBr, практически нерастворимого в воде.
С кислородом и азотом бром непосредственно не реагирует. Бром образует большое число различных соединений с остальными галогенами. Например, со фтором бром образует неустойчивые BrF, BrF3 и BrF5, с хлором — BrCl, с иодом — IBr и IBr3, получен также бромид астата AtBr.
Металлы
При взаимодействии со многими металлами бром образует бромиды в высших степенях окисления, например, AlBr3, CuBr2, MgBr2 и др.
Реакция со многими металлами в мелкодисперсном состоянии (калий кусочками, порошки мышьяка, сурьмы, висмута, цинка и алюминия) сопровождается воспламенением[13].
Жидкий бром взаимодействует и с золотом, образуя трибромид золота AuBr3[13][14]:
Устойчивы к действию брома тантал и платина[13], в меньшей степени — серебро, титан и свинец.
Органические соединения
С большинством органических растворителей (спирт, эфир, хлороформ, тетрахлор, сероуглерод) бром смешивается во всех отношениях, при этом часто вступает с ними в реакцию[13].
При взаимодействии с органическими соединениями, содержащими двойную связь, бром присоединяется, давая соответствующие дибромпроизводные:
Присоединяется бром и к органическим молекулам, в составе которых есть тройная связь. Обесцвечивание бромной воды при пропускании через неё газа или добавлении к ней жидкости свидетельствует о том, что в газе или в жидкости присутствует непредельное соединение.
При нагревании в присутствии катализатора бром реагирует с бензолом с образованием бромбензола C6H5Br (реакция замещения).
Реагирует с родановодородом:
Получение[править | править код]
В качестве исходного сырья для производства брома служат:
- морская вода (65 мг/л[15]),
- рассолы соляных озёр,
- щёлок калийных производств,
- подземные воды нефтяных и газовых месторождений.
Бром получают химическим путём из природных рассолов и других растворов, содержащих ион Br−, окисляя его газообразным хлором:
Затем молекулярный бром выделяют из раствора потоком водяного пара или воздуха и конденсируют[11].
Бромсодержащие кислоты[править | править код]
Помимо бескислородной бромоводородной кислоты HBr, бром образует ряд кислородных кислот: бромную HBrO4, бромноватую HBrO3, бромистую HBrO2, бромноватистую HBrO.
Применение[править | править код]
В химии[править | править код]
- Вещества на основе брома широко применяются в органическом синтезе.
- «Бромная вода» (водный раствор брома) применяется как реагент для качественного определения непредельных органических соединений.
Промышленное применение[править | править код]
Значительная часть элементарного брома до начала 1980-х использовалась для производства 1,2-дибромэтана, входившего в состав этиловой жидкости — антидетонирующей добавки в бензины, содержащей тетраэтилсвинец; дибромэтан в этом случае служил источником брома для образования относительно летучего дибромида свинца для предотвращения осаждения твёрдых оксидов свинца на деталях двигателя.
Бром также используется в синтезе антипиренов — добавок, придающих пожароустойчивость пластикам, древесине, текстильным материалам.
- Бромид серебра AgBr применяется в фотографии как светочувствительное вещество.
- Пентафторид брома иногда используется как очень мощный окислитель ракетного топлива.
- Растворы бромидов используются в нефтедобыче.
- Растворы бромидов тяжёлых металлов используются как «тяжёлые жидкости» при обогащении полезных ископаемых методом флотации.
- Многие броморганические соединения применяются как инсектициды и пестициды.
В медицине[править | править код]
- В медицине бромид натрия и бромид калия применяют как успокаивающие средства.
В производстве оружия[править | править код]
Со времен Первой мировой войны бром используется для производства боевых отравляющих веществ.
Физиологическое действие[править | править код]
Бром и его пары сильно токсичны. Уже при содержании брома в воздухе в концентрации около 0,001 % (по объёму) наблюдается раздражение слизистых оболочек, головокружение, носовые кровотечения, а при более высоких концентрациях — спазмы дыхательных путей, удушье. ПДК паров брома — 0,5 мг/м³ в соответствии с ГОСТ 12.1.005-88. ЛД50 при пероральном введении для крыс составляет 2600 мг/кг, для морских свинок 5500 мг/кг[16]. Для человека смертельная доза перорально составляет 14 мг/кг[17]. При вдыхании паров брома половинная летальная концентрация для мышей составляет 750 ppm (9 минут) и 240 ppm (2 часа)[16]. При отравлении парами брома пострадавшего нужно немедленно вывести на свежий воздух (в как можно более ранней стадии показаны ингаляции кислорода); для восстановления дыхания можно на небольшое время пользоваться тампоном, смоченным нашатырным спиртом, на короткое время периодически поднося его к носу пострадавшего. Дальнейшее лечение должно проводиться под наблюдением врача. Рекомендуются ингаляции тиосульфата натрия в виде 2 % водного раствора, обильное питьё теплого молока с минеральной водой или содой, кофе. Особенно опасно отравление парами брома людей, страдающих астмой и заболеваниями лёгких, так как при вдыхании паров брома очень высока вероятность отёка лёгких. Жидкий бром при попадании на кожу вызывает болезненные и долго не заживающие ожоги.
Биологическое значение[править | править код]
В 2014 году исследование показало, что бром (в форме бромид-иона) является необходимым кофактором в ходе биосинтеза коллагена IV, делая элемент существенным в архитектуре базальной мембраны и развитии тканей у животных[18]. Тем не менее, не было отмечено никаких чётких симптомов или синдромов дефицита при полном удалении брома из пищи[19]. В других биологических функциях бром может не быть необходимым, но всё же приносить пользу, особенно когда он заменяет хлор. Например, в присутствии перекиси водорода H2O2 синтезируемая эозинофилами с ионами хлорида или бромида эозинофильная пероксидаза обеспечивает мощный механизм, с помощью которого эозинофилы убивают многоклеточных паразитов (таких, как, например, нематодные черви, участвующие в филяриозе) и некоторые бактерии, такие как бактерии туберкулёза). Эозинофильная пероксидаза — это галопероксидаза, которая более эффективно использует бром, а не хлор для этой цели, производя гипобромит (бромоводородную кислоту), хотя использование хлорид-иона также возможно[20]. Хотя α-галоэфиры, как правило, считаются высокореактивными и, следовательно, токсичными промежуточными продуктами в биоорганическом синтезе, млекопитающие, включая людей, кошек и крыс, по-видимому, биосинтезируют следы α-бромэфира, 2-октил-4-бром-3-оксобутаноата, которые присутствуют в их спинномозговой жидкости и, вероятно, играют пока неясную роль в возникновении быстрого сна[21].
Морские организмы являются основным источником броморганических соединений, и именно в этих организмах роль брома могла бы быть намного более высокой. Более 1600 таких броморганических соединений были идентифицированы к 1999 году. Наиболее распространённым является метилбромид (CH3Br), около 56 000 тонн которого синтезируется за год морскими водорослями[22]. Эфирное масло гавайской водоросли Asparagopsis taxiformis состоит из 80 % бромоформа[23]. Большинство таких броморганических соединений в море синтезируется водорослями под действием уникального фермента, ванадийбромпероксидазы[24].
Особенности работы[править | править код]
При работе с бромом следует пользоваться защитной спецодеждой, противогазом, специальными перчатками. Из-за высокой химической активности и токсичности как паров брома, так и жидкого брома его следует хранить в стеклянной, плотно закупоренной толстостенной посуде. Сосуды с бромом располагают в ёмкостях с песком, который предохраняет сосуды от разрушения при встряхивании. Из-за высокой плотности брома сосуды с ним ни в коем случае нельзя брать только за горло (горло может оторваться, и тогда бром окажется на полу).
Проливы брома целесообразно посыпать карбонатом натрия:
либо влажной пищевой содой:
Однако реакция элементарного брома с содой носит сильно экзотермический характер, что ведёт к увеличению испарения брома, к тому же выделяющаяся углекислота также способствует испарению, поэтому пользоваться вышеописанными методами не всегда правильно. Безопаснее всего для дегазации брома подходит водный раствор тиосульфата натрия Na2S2O3. Для локализации больших проливов брома можно использовать раствор тиосульфата натрия с добавками пенообразующих веществ и аэросила. Этот же раствор (3—5-процентный тиосульфат натрия) используется для смачивания ватно-марлевых повязок, которые помогают защитить органы дыхания от паров брома.
Мифы, легенды, заблуждения и их опровержения[править | править код]
Существует широко распространённая городская легенда, будто бы в армии, местах лишения свободы и психиатрических больницах добавляют соединения брома в еду для снижения полового влечения. Происхождение этого мифа доподлинно неизвестно.
Препараты брома имеют солёный вкус и оказывают седативный (успокаивающий) и снотворный эффект[25].
Ни в коем случае не следует путать «аптечный бром» (водные растворы бромида калия или натрия), который применяют при расстройствах нервной системы, и элементарный бром, который является весьма токсичным веществом с раздражающим действием. Принимать элементарный бром внутрь ни в коем случае нельзя — это сильный яд[26].
См. также[править | править код]
- Утечка брома в Челябинске
Комментарии[править | править код]
- ↑ Указан диапазон значений атомной массы в связи с неоднородностью распространения изотопов в природе
Примечания[править | править код]
- ↑ Meija J. et al. Atomic weights of the elements 2013 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2016. — Vol. 88, no. 3. — P. 265—291. — doi:10.1515/pac-2015-0305.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 ХЭ, 1988.
- ↑ Большой древнегреческий словарь (αω) Архивная копия от 31 января 2013 на Wayback Machine.
- ↑ Weeks, Mary Elvira (англ.) (рус.. The discovery of the elements: XVII. The halogen family (англ.) // Journal of Chemical Education (англ.) (рус. : journal. — 1932. — Vol. 9, no. 11. — P. 1915. — doi:10.1021/ed009p1915. — Bibcode: 1932JChEd…9.1915W.
- ↑ Löwig, Carl Jacob. Das Brom und seine chemischen Verhältnisse (нем.) : magazin. — Heidelberg: Carl Winter, 1829.
- ↑ Vauquelin, L. N.; Thenard, L. J.; Gay-Lussac, J. L. Rapport sur la Mémoire de M. Balard relatif à une nouvelle Substance (фр.) // Annales de Chimie et de Physique (англ.) (рус. (2nd series) : magazine. — 1826. — Vol. 32. — P. 382—384.
- ↑ 1 2 3 Меншуткин Б. Н. Курс общей химии (неорганической). — 4-е. — Л.: Госхимтехиздат, 1933. — С. 559—560, 581—582. — 738 с.
- ↑ Менделеев Д. И. Основы химии. — 11-е. — М.—Л.: Госхимтехиздат, 1932. — Т. 1. — С. 229. — 488 с.
- ↑ Эмболит // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- ↑ D. L. Hildenbrand, W. R. Kramer, R. A. McDonald, D. R. Stull. Bromine: The Heat Capacity and Thermodynamic Properties from 15 to 300°K. (англ.) // Journal of the American Chemical Society. — 1958-08. — Vol. 80, iss. 16. — P. 4129–4132. — ISSN 1520-5126 0002-7863, 1520-5126. — doi:10.1021/ja01549a004. Архивировано 1 июня 2022 года.
- ↑ 1 2 Greenwood N. N., Earnshaw A. Chemistry of the Elements. — 2nd Ed. — Elsevier, 2012. — 1600 с. — ISBN 9780080501093.
- ↑ 1 2 David R. Lide (ed.), CRC Handbook of Chemistry and Physics, 84th Edition. CRC Press. Boca Raton, Florida, 2003; Section 10, Atomic, Molecular, and Optical Physics; Ionization Potentials of Atoms and Atomic Ions.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 Brockhaus ABC Chemie in zwei Baenden. — Leipzig: VEB F. A. Brockhaus Verlag, 1966. — Bd. 1 A-K. — S. 203. — 768 S.
- ↑ Лидин Р. А. и др. Химические свойства неорганических веществ. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- ↑ J. P. Riley, Skirrow G. Chemical Oceanography, V. 1, 1965.
- ↑ 1 2 Bromine. Immediately Dangerous to Life or Health Concentrations (IDLH). Архивная копия от 1 августа 2020 на Wayback Machine The National Institute for Occupational Safety and Health (NIOSH). May 1994.
- ↑ Каталог химических реактивов фирмы MERCK (Германия), 2008—2010 г.
- ↑ McCall A. S. et al. Bromine Is an Essential Trace Element for Assembly of Collagen IV Scaffolds in Tissue Development and Architecture (англ.) // Cell : journal. — Cell Press, 2014. — Vol. 157, no. 6. — P. 1380—1392. — doi:10.1016/j.cell.2014.05.009. — PMID 24906154. — PMC 4144415.
- ↑ Nielsen F. H. Possibly Essential Trace Elements // Clinical Nutrition of the Essential Trace Elements and Minerals: The Guide for Health Professionals. — 2000. — С. 11—36. — ISBN 978-1-61737-090-8. — doi:10.1007/978-1-59259-040-7_2.
- ↑ Mayeno A. N., Curran A. J., Roberts R. L., Foote C. S. Eosinophils preferentially use bromide to generate halogenating agents (англ.) // J. Biol. Chem. : journal. — 1989. — Vol. 264, no. 10. — P. 5660—5668. — PMID 2538427.
- ↑ Gribble, Gordon W. The diversity of naturally occurring organobromine compounds (англ.) // Chemical Society Reviews (англ.) (рус. : journal. — 1999. — 1 January (vol. 28, no. 5). — P. 335. — ISSN 1460-4744. — doi:10.1039/A900201D. Архивировано 7 сентября 2018 года.
- ↑ Gribble G. W. The diversity of naturally occurring organobromine compounds (англ.) // Chemical Society Reviews (англ.) (рус. : journal. — 1999. — Vol. 28, no. 5. — P. 335—346. — doi:10.1039/a900201d.
- ↑ Burreson B. J., Moore R. E., Roller P. P. Volatile halogen compounds in the alga Asparagopsis taxiformis (Rhodophyta) (англ.) // Journal of Agricultural and Food Chemistry (англ.) (рус. : journal. — 1976. — Vol. 24, no. 4. — P. 856—861. — doi:10.1021/jf60206a040.
- ↑ Butler A., Carter-Franklin J. N. The role of vanadium bromoperoxidase in the biosynthesis of halogenated marine natural products (англ.) // Natural Product Reports (англ.) (рус. : journal. — 2004. — Vol. 21, no. 1. — P. 180—188. — doi:10.1039/b302337k. — PMID 15039842.
- ↑ Машковский М. Д. Лекарственные средства. — 15-е изд. — М.: Новая Волна, 2005. — С. 89-90. — 1200 с. — ISBN 5-7864-0203-7.
- ↑ Сергей Уфимцев. Утечка брома сорвала праздник знаний в школах Челябинска. Комсомольская правда. Дата обращения: 24 февраля 2013. Архивировано 25 февраля 2013 года.
Литература[править | править код]
- Львов М. Д. Бром, химический элемент // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Ксензенко В. И., Стасиневич Д. С. Бром // Химическая энциклопедия : в 5 т. / Гл. ред. И. Л. Кнунянц. — М.: Советская энциклопедия, 1988. — Т. 1: А — Дарзана. — С. 318—319. — 623 с. — 100 000 экз. — ISBN 5-85270-008-8.
- Справочник для химиков, инженеров, врачей. Вредные вещества в промышленности. Том 3. — Л.: Химия, 1977. — С. 22—24.
Ссылки[править | править код]
- Бром на WebElements.com
- Бром в Популярной библиотеке химических элементов
- График теплопроводности брома (англ.)
- Вязкость брома при определённых условиях (англ.)
Как определить степень окисления
Материал по химии
Что такое степень окисления?
Степень окисления – это условная величина, отражающая количество принятых или отданных электронов при образовании заряженной частицы из электронейтрального атома при условии, что электроны переходят от одного атома к другому полностью.
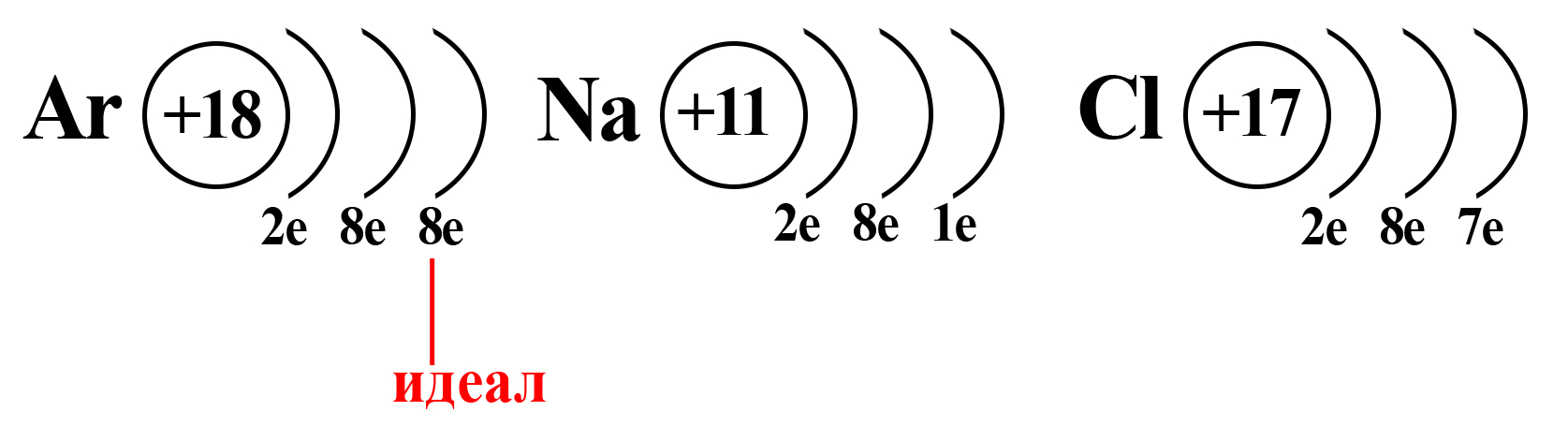
Вспомним, что идеальное количество электронов на внешнем электронном уровне атома равно восьми. Такую конфигурацию внешнего слоя имеют атомы большинства благородных газов (кроме гелия). И к такой электронной конфигурации стремятся атомы других элементов.
Как определить степень окисления
Конфигурация благородного газа
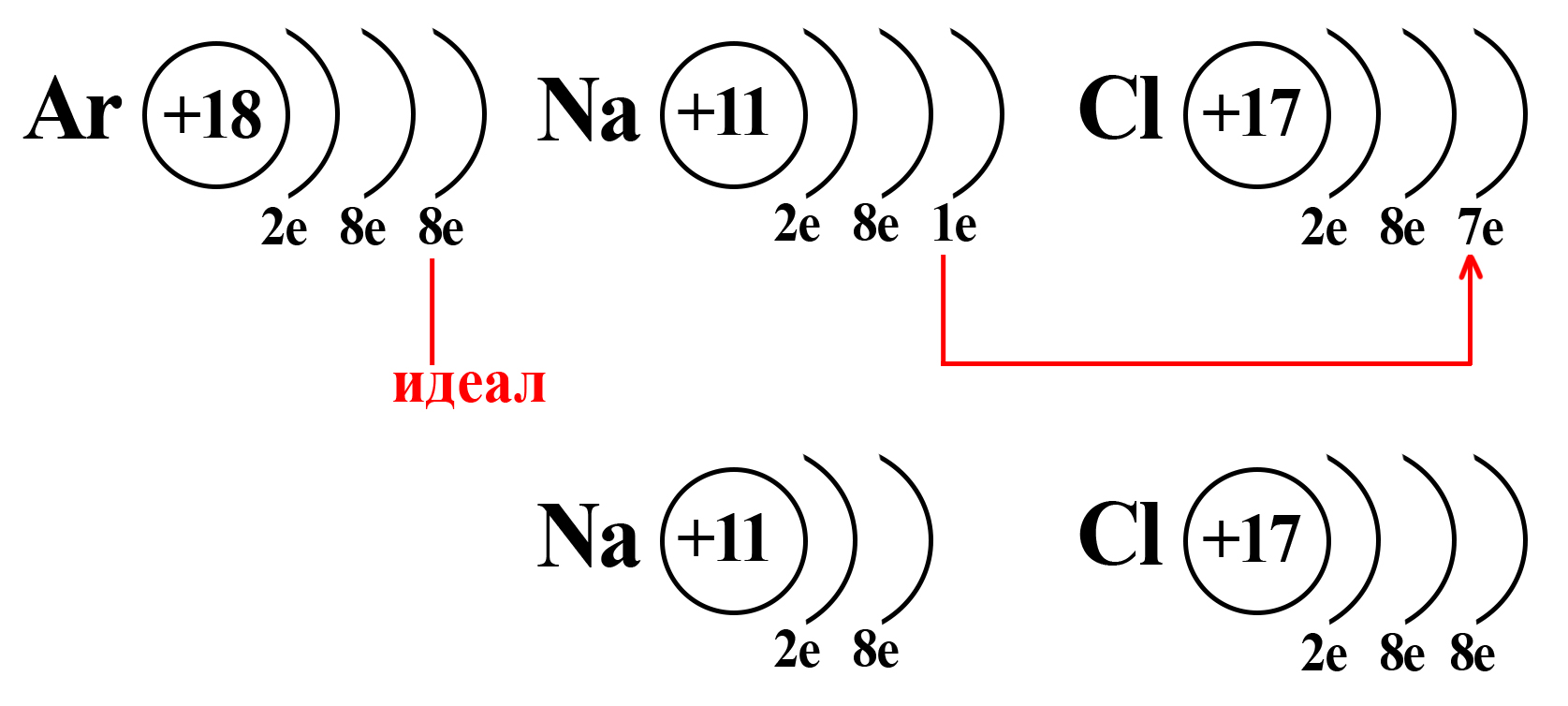
Натрий и хлор не так далеки от «идеала», как может показаться. Если атомы этих элементов столкнуться, внешний электрон натрия притянется на внешний электронный уровень хлора (из-за большей электроотрицательности хлора):
Таким образом, натрий и хлор как будто вступают в симбиоз: натрию, для приобретения «благородной» конфигурации необходимо избавиться от внешнего электрона (при потере внешнего электрона теряется и внешний уровень, а предвнешний уровень, имеющий идеальное количество электронов, становится внешним), тогда как хлору необходимо получить один электрон, чтобы завершить внешний энергетический уровень.
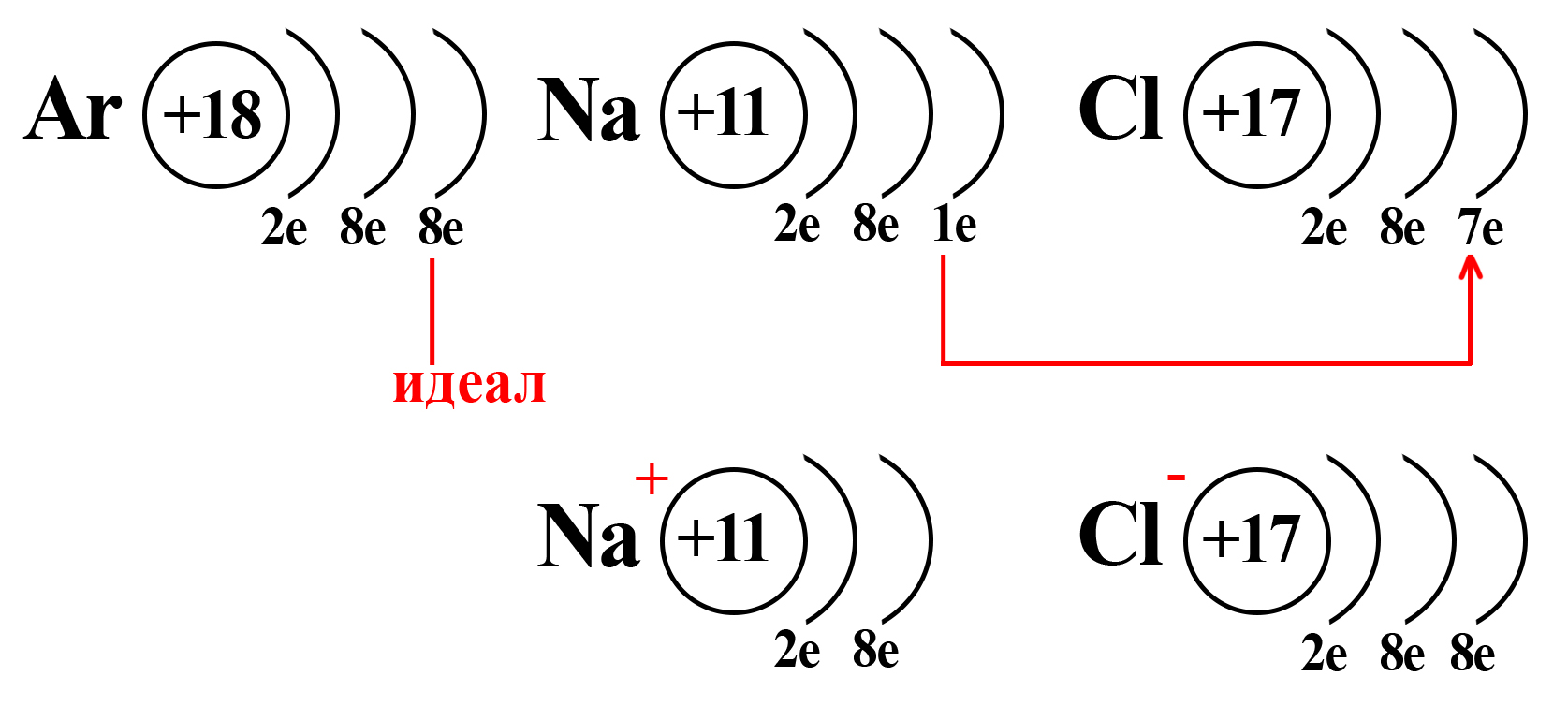
Потеряв один электрон, натрий приобретает положительный заряд, становится катионом (положительно заряженной частицей). Это объясняется тем, что ядро натрия по-прежнему имеет 11 протонов, а вот электронная оболочка, после взаимодействия с хлором, содержит 10 электронов. Таким образом, натрий будет иметь 11 положительно заряженных частиц и 10 отрицательно заряженных частиц. По простейшему уравнению: +11 – 10 = +1, становится ясно, откуда взялся положительный заряд.
Аналогичный расчет можно привести и для хлора. После взаимодействия с натрием ядро атома хлора не изменяется, оно содержит 17 положительно заряженных частиц (протонов), а оболочка – 18 отрицательно заряженных частиц (электронов). +17 – 18 = ‒1.
Полученные заряды и являются степенями окисления.
Также степень окисления можно выразить количеством электронов, которые иону нужно получить или отдать для того, чтобы стать электронейтральным атомом. Так, катион натрия, имеющий заряд «+1», должен получить 1 электрон, чтобы превратиться в атом натрия: Na+ +1ē = Na0. А анион хлора (хлорид-ион), имеющий заряд «‒1» должен отдать один электрон: Cl– -1ē = Cl0.
Для упрощения понятие «степень окисления» применяется не только для веществ с ионным строением (металл + неметалл), но и для веществ с ковалентными полярными связями. Несмотря на то, что в таком типе связи полного перехода электронов от одного атома к другому не происходит, полученные частичные заряды превращаются в целые.
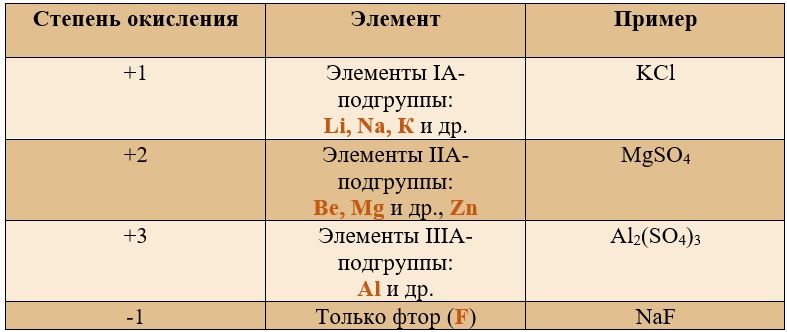
Постоянные степени окисления.
Знания этой простой, базовой темы помогут Вам решать не только тестовые задания. Одно из самых сложных заданий ЕГЭ – расстановка коэффициентов с помощью электронного баланса – не решается без знания степеней окисления.
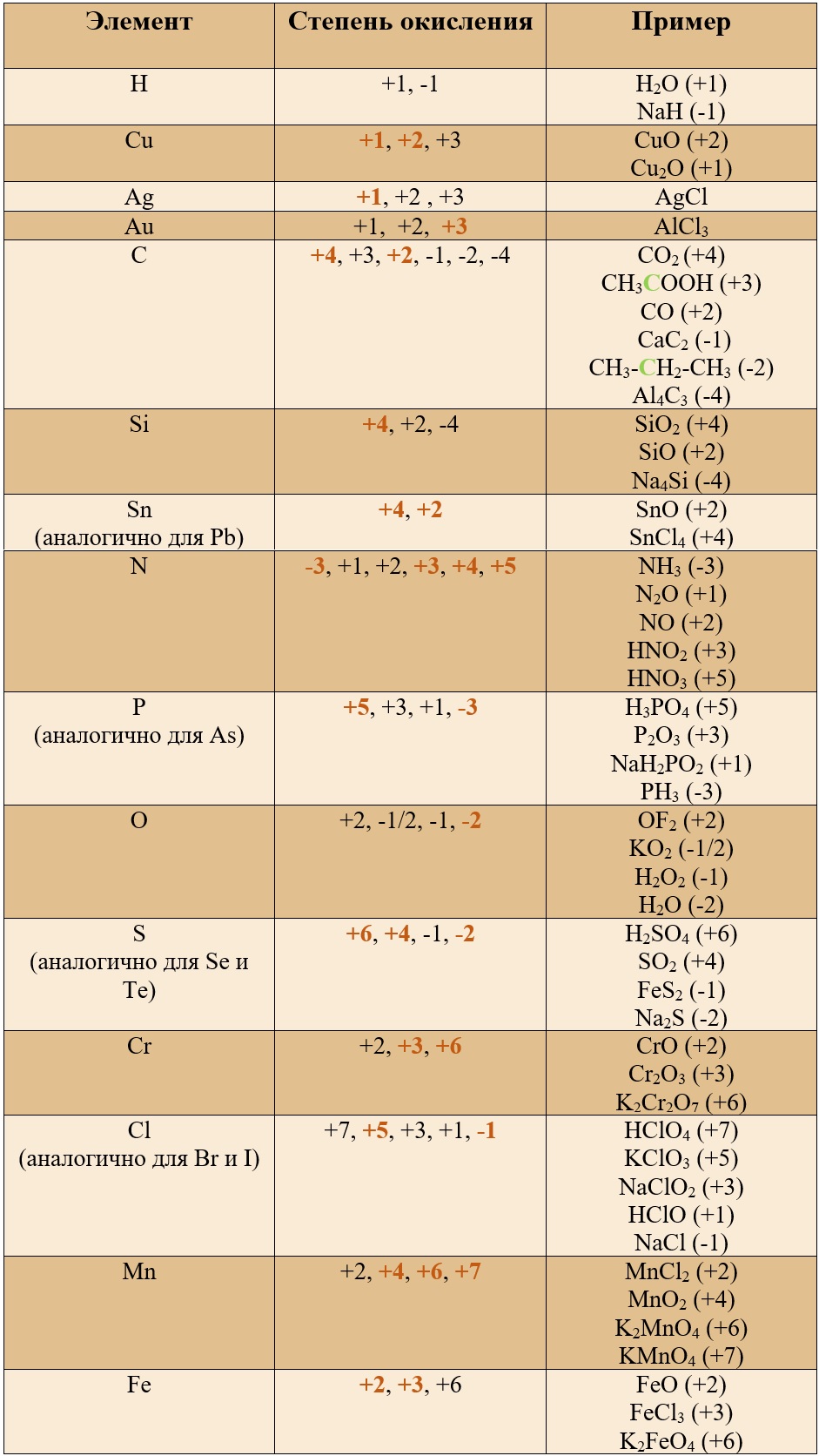
Таблица «Элементы, имеющие постоянную степень окисления»
Таблица «Наиболее популярные степени окисления у остальных элементов» (Выделены бурым)*
*В таблице указаны не все возможные степени окисления.
Таким образом, медь, серебро, золото и железо не проявляют высшей степени окисления, равной номеру группы, у остальных же элементов высшая степень окисления равна номеру группы.
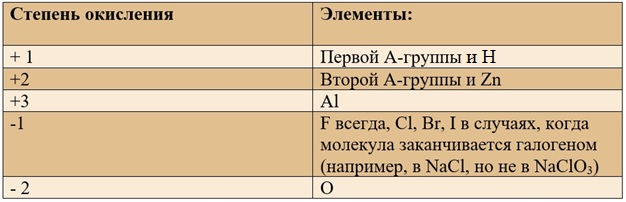
Для определения степени окисления не нужно учить всю таблицу, и тем более все степени окисления. Они приведены для справки, наиболее важными являются:
Определение степеней окисления в бинарных соединениях
Для примера возьмём оксид фосфора (P2O5)
- Определим степень окисления известного элемента (в нашем случае это кислород).
- Условно разделим молекулу на две части: чаще всего первая часть молекулы положительная, а вторая – отрицательная (искл: NH3 и PH3).
- Индекс после кислорода указывает на, что в молекуле содержится пять атомов кислорода, каждый из них имеет степень окисления «-2», поэтому общее количество отрицательных зарядов будет равно «-10».
- Молекула должна быть электронейтральной, то есть количество положительных и отрицательных зарядов должны быть равными. Из этого следует, что все атомы фосфора в данной молекуле в сумме должны иметь десять положительных зарядов.
- Индекс «2» после фосфора означает, что в молекуле содержится два атома фосфора, между которыми поровну нужно разделить общий положительный заряд (+10:2=+5)
Аналогичным образом происходит определение степени окисления в более сложных веществах, для примера возьмём перманганат калия (KMnO4):
- Подпишем степени окисления для элементов, имеющих постоянные их значения:
- Разделим молекулу на положительный и отрицательный «полюс» (в соединениях, состоящих из атомов трех элементов, чаще всего первые два являются положительными, а третий – отрицательным).
- Посчитаем общее количество положительных и отрицательных зарядов с учетом индексов:
- Ответим на вопрос: какого количества плюсов не хватает, что бы положительные и отрицательные заряды имели одинаковое значение? До +8 не хватает семи положительных зарядов, откуда следует, что степень окисления марганца равна «+7».
Ну и напоследок разберем степени окисления элементов в дихромате калия (K2Cr2O7):
- Подписываем известные степени окисления:
- Делим молекулу на положительную и отрицательную части:
- Считаем общее количество «плюсов» и «минусов»:
- Подсчитываем, сколько положительных зарядов не достает для того, чтобы молекула стала электронейтральной (т. е. такой молекулой, в которой количество положительных и отрицательных зарядов было одинаковым):
- Так как молекула содержит два атома хрома, двенадцать положительных зарядов должны распределиться между ними поровну, то есть, каждый хром имеет заряд +6:
Как быть, если в формуле встретились скобки? Например, как посчитать степень окисления брома в пербромате кальция?
- Для начала определим все известные степени окисления, как делали в предыдущих примерах:
- Посчитаем сумму положительных и отрицательных зарядов. Важно учесть все индексы. Помните, что индекс. Расположенный за атомом действует только на этот атом, а индекс, расположенный за скобкой, действует на всё содержимое скобок:
Таким образом, в пербромате кальция содержится: один атом кальция, два атома брома и 8 атомов кислорода (индексы, относящиеся к одному и тому же атому перемножаются).
Следовательно, мы имеем два положительных заряда от кальция и шестнадцать отрицательных от кислорода. Так как индекс «2» за скобками действует и на бром, его заряд можно выразить как 2х.
Получаем уравнение:
2 + 2х ‒ 16 = 0
2х = 14
х = 7
Степень окисления брома в пербромате кальция равна «+7».
Таблица окисления химических элементов

4.7
Средняя оценка: 4.7
Всего получено оценок: 552.
4.7
Средняя оценка: 4.7
Всего получено оценок: 552.
Чтобы определить условный заряд атомов в окислительно-восстановительных реакциях, используют таблицу окисления химических элементов. В зависимости от свойств атома элемент может проявлять положительную или отрицательную степень окисления.
Что такое степень окисления
Условный заряд атомов элементов в сложных веществах называется степенью окисления. Значение заряда атомов записывается в окислительно-восстановительных реакциях, чтобы понять, какой элемент является восстановителем, а какой – окислителем.
Степень окисления взаимосвязана с электроотрицательностью, которая показывает возможность атомов принимать или отдавать электроны. Чем выше значение электроотрицательности, тем больше способность атома отнимать электроны в реакциях.
Степень окисления может иметь три значения:
- нулевое – атом находится в состоянии покоя (все простые вещества имеют степень окисления 0);
- положительное – атом отдаёт электроны и является восстановителем (все металлы, некоторые неметаллы);
- отрицательное – атом принимает электроны и является окислителем (большинство неметаллов).
Например, степени окисления в реакции натрия с хлором выглядят следующим образом:
2Na0 + Cl20 → 2Na+1Cl-1
В реакции металлов с неметаллами металл всегда является восстановителем, а неметалл – окислителем.
Как определить
Существует таблица, в которой указаны все возможные степени окисления элементов.
|
Название |
Символ |
Степень окисления |
|
Водород |
H |
+1, -1 |
|
Гелий |
He |
0 |
|
Литий |
Li |
+1 |
|
Бериллий |
Be |
+2 |
|
Бор |
B |
-1, 0, +1, +2, +3 |
|
Углерод |
C |
-4, -3, -2, -1, 0, +2, +4 |
|
Азот |
N |
-3, -2, -1, 0, +1, +2, +3, +4, +5 |
|
Кислород |
O |
-2, -1, 0, +1, +2 |
|
Фтор |
F |
-1 |
|
Неон |
Ne |
0 |
|
Натрий |
Na |
+1 |
|
Магний |
Mg |
+2 |
|
Алюминий |
Al |
+3 |
|
Кремний |
Si |
-4, 0, +2, +4 |
|
Фосфор |
P |
3, 0, +3, +5 |
|
Сера |
S |
2, 0, +4, +6 |
|
Хлор |
Cl |
1, 0, +1, +3, +5, +7, редко +2 и +4 |
|
Аргон |
Ar |
0 |
|
Калий |
K |
+1 |
|
Кальций |
Ca |
+2 |
|
Скандий |
Sc |
+3 |
|
Титан |
Ti |
+2, +3, +4 |
|
Ванадий |
V |
+2, +3, +4, +5 |
|
Хром |
Cr |
+2, +3, +6 |
|
Марганец |
Mn |
+2, +3, +4, +6, +7 |
|
Железо |
Fe |
+2, +3, редко +4 и +6 |
|
Кобальт |
Co |
+2, +3, редко +4 |
|
Никель |
Ni |
+2, редко +1, +3, +4 |
|
Медь |
Cu |
+1, +2, редко +3 |
|
Цинк |
Zn |
+2 |
|
Галлий |
Ga |
+3, редко +2 |
|
Германий |
Ge |
-4, +2, +4 |
|
Мышьяк |
As |
-3, +3, +5, редко +2 |
|
Селен |
Se |
-2, +4, +6, редко +2 |
|
Бром |
Br |
-1, +1, +5, редко +3, +4 |
|
Криптон |
Kr |
0 |
|
Рубидий |
Rb |
+1 |
|
Стронций |
Sr |
+2 |
|
Иттрий |
Y |
+3 |
|
Цирконий |
Zr |
+4, редко +2, +3 |
|
Ниобий |
Nb |
+3, +5, редко +2, +4 |
|
Молибден |
Mo |
+3, +6, редко +2, +3, +5 |
|
Технеций |
Tc |
+6 |
|
Рутений |
Ru |
+3, +4, +8, редко +2, +6, +7 |
|
Родий |
Rh |
+4, редко +2, +3, +6 |
|
Палладий |
Pd |
+2, +4, редко +6 |
|
Серебро |
Ag |
+1, редко +2, +3 |
|
Кадмий |
Cd |
+2, редко +1 |
|
Индий |
In |
+3, редко +1, +2 |
|
Олово |
Sn |
+2, +4 |
|
Сурьма |
Sb |
-3, +3, +5, редко +4 |
|
Теллур |
Te |
-2, +4, +6, редко |
|
Иод |
I |
-1, +1, +5, +7, редко +3, +4 |
|
Ксенон |
Xe |
0 |
|
Цезий |
Cs |
+1 |
|
Барий |
Bа |
+2 |
|
Лантан |
La |
+3 |
|
Церий |
Ce |
+3, +4 |
|
Празеодим |
Pr |
+3 |
|
Неодим |
Nd |
+3, +4 |
|
Прометий |
Pm |
+3 |
|
Самарий |
Sm |
+3, редко +2 |
|
Европий |
Eu |
+3, редко +2 |
|
Гадолиний |
Gd |
+3 |
|
Тербий |
Tb |
+3, +4 |
|
Диспрозий |
Dy |
+3 |
|
Гольмий |
Ho |
+3 |
|
Эрбий |
Er |
+3 |
|
Тулий |
Tm |
+3, редко +2 |
|
Иттербий |
Ib |
+3, редко +2 |
|
Лютеций |
Lu |
+3 |
|
Гафний |
Hf |
+4 |
|
Тантал |
Ta |
+5, редко +3, +4 |
|
Вольфрам |
W |
+6, редко +2, +3, +4, +5 |
|
Рений |
Re |
+2, +4, +6, +7, редко -1, +1, +3, +5 |
|
Осмий |
Os |
+3, +4, +6, +8, редко +2 |
|
Иридий |
Ir |
+3, +4, +6, редко +1, +2 |
|
Платина |
Pt |
+2, +4, +6, редко +1, +3 |
|
Золото |
Au |
+1, +3, редко +2 |
|
Ртуть |
Hg |
+1, +2 |
|
Талий |
Tl |
+1, +3, редко +2 |
|
Свинец |
Pb |
+2, +4 |
|
Висмут |
Bi |
+3, редко +3, +2, +4, +5 |
|
Полоний |
Po |
+2, +4, редко -2, +6 |
|
Астат |
At |
– |
|
Радон |
Ra |
0 |
|
Франций |
Fr |
– |
|
Радий |
Ra |
+2 |
|
Актиний |
Ac |
+3 |
Или использовать на уроках этот вариант таблицы.
Кроме того, степени окисления химических элементов можно определить по периодической таблице Менделеева:
- высшая степень (максимально положительная) совпадает с номером группы;
- для определения минимального значения степени окисления из номера группы вычитается восемь.
Большинство неметаллов имеют положительную и отрицательную степени окисления. Например, кремний находится в IV группе, значит, его максимальная степень окисления +4, а минимальная -4. В соединениях неметаллов (SO3, CO2, SiC) окислителем является неметалл с отрицательной степенью окисления или с большим значением электроотрицательности. Например, в соединении PCl3 фосфор имеет степень окисления +3, хлор -1. Электроотрицательность фосфора – 2,19, хлора – 3,16.
Второе правило не работает для щелочных и щелочноземельных металлов, которые всегда имеют одну положительную степень окисления, равную номеру группы. Исключения составляют магний и бериллий (+1, +2). Также постоянную степень окисления имеют:
- алюминий (+3);
- цинк (+2);
- кадмий (+2).
Остальные металлы имеют непостоянную степень окисления. В большинстве реакций выступают в качестве восстановителя. В редких случаях могут быть окислителями с отрицательной степенью окисления.
Фтор – самый мощный окислитель. Его степень окисления всегда -1.
Что мы узнали?
Из урока 8 класса узнали о степени окисления. Это условная величина, показывающая, сколько электронов может отдать или принять атом в ходе химической реакции. Значение связано с электроотрицательностью. Окислители принимают электроны и имеют отрицательную степень окисления, восстановители отдают электроны и проявляют положительную степень окисления. Большинство металлов – восстановители с постоянной или переменной степенью окисления. Неметаллы могут проявлять свойства окислителя и восстановителя в зависимости от вещества, с которым реагируют.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-
Александр Котков
5/5
-
Александр Котков
5/5
-
Паша Кривов
4/5
-
Александр Котков
5/5
-
Лидия Маслова
5/5
Оценка доклада
4.7
Средняя оценка: 4.7
Всего получено оценок: 552.
А какая ваша оценка?