Степень окисления – это численное значение, которое показывает, сколько электронов потерял или приобрел атом в химической реакции. Вещества, в которых атомы имеют разное количество электронов, имеют разные степени окисления. Степень окисления цинка может быть положительной, отрицательной или нулевой, в зависимости от того, сколько электронов потерял или приобрел атом цинка.
Степень окисления элемента отражает количество присоединенных к нему атомов кислорода, которое может варьироваться от -2 до +4 в зависимости от соединения. Стандартная степень окисления (или состояние) цинка составляет +2, однако, в определенных соединениях, его степень окисления может варьироваться от 0 (сам металлический цинк) до +4.
В сочетании с хлором Zn может образовывать несколько соединений, степень окисления которых варьируется от +1 (ZnCl) до +3 (ZnCl2). В сочетании с азотом его степень окисления может варьироваться от +2 (Zn(NO3)2) до +4 (Zn(NO2)4). Аналогичным образом, при соединении с серой цинк образует два соединения со степенью окисления +2 (ZnS) и +4 (ZnSO4).
Самая высокая степень окисления цинка наблюдается, когда он образует оксид цинка (ZnO). В этом соединении степень окисления цинка составляет +4. Аналогично, в сочетании с серой (ZnS) степень окисления цинка также составляет +4. При взаимодействии с ионами гидроксида (OH-), например, в случае Zn(OH) 2, цинк также достигает степени окисления +4.
Некоторые комплексы могут содержать смешанные валентные состояния, которые содержат как более низкие, так и более высокие степени окисления элемента, чем обычно; они обычно обозначаются как гибридизации. Комплексы, содержащие как Zn (II), так и Zn (IV), известны как цинковые амальгамы и встречаются в нескольких химических применениях, включая лекарства и промышленные катализаторы.
Цинк также может окисляться непосредственно под воздействием воздуха или других кислородсодержащих сред, таких как вода. Полученный оксид обычно имеет степень окисления либо 0 (металлический цинк), либо 2 + (оксид цинка), в зависимости от условий. При воздействии влаги с течением времени цинк образует на своей поверхности тонкий слой гидратированного оксида, который содержит различное количество ионов 0 и 2 +.
Некоторые цинксодержащие соли содержат соединения с более высокой степенью окисления, такие как Zn (H2O) 63 + или даже Zn (H2O) 64 +. Это относительно редкие случаи, хотя и не считаются частью стандартных “степеней окисления”, которые обычно обсуждаются, когда речь идет о цинке.
В соединениях, где цинк соединен с более электроотрицательными элементами, такими как кислород, сера или хлор, степень окисления цинка может быть положительной. В оксиде цинка (ZnO) степень окисления цинка равна +2, а в хлориде цинка (ZnCl2) степень окисления равна +2 для каждого атома цинка.
В других соединениях, где цинк соединен с менее электроотрицательными элементами, такими как водород или кислород в воде, степень окисления цинка может быть нулевой. В гидроксиде (Zn(OH)2) степень окисления цинка равна 0.
В соединениях, где цинк соединен с более электроотрицательными элементами, но обладает отрицательным зарядом, степень окисления цинка может быть отрицательной. В сульфиде цинка (ZnS) степень окисления цинка равна -2.
Степень окисления цинка может меняться в зависимости от условий, в которых происходит реакция, и может варьировать от -2 до +2.
Хотя стандартная степень окисления цинка составляет +2, он демонстрирует различные степени окисления, когда присутствует в различных соединениях с другими элементами (Cl, N и S). Такая универсальность делает цинк идеальным материалом для использования во многих областях, где изменение его степени окисления может оказаться выгодным.
Соединения цинка с положительной степенью окисления
Цинк может иметь положительную степень окисления в различных соединениях, таких как оксид цинка, карбонат цинка, нитрат цинка и других. Эти соединения имеют различные химические свойства, включая свойства окислителя, противоположные свойствам соединений цинка с отрицательной степенью окисления.
Соединения цинка с положительной степенью окисления образуются, когда цинк теряет электроны в химической реакции и становится положительно заряженным. Наиболее распространенными степенями окисления цинка являются +1 и +2.
Соединения цинка с +1 степенью окисления включают хлорид цинка(І) – ZnCl, и гидроксид цинка(І) – Zn(OH)₂. Хлорид цинка(І) может быть получен в результате реакции металлического цинка с хлоридом водорода:
Zn + 2 HCl → ZnCl + H₂
Гидроксид цинка(І) может быть получен путем обработки раствора хлорида цинка(І) гидроксидом натрия:
ZnCl + 2 NaOH → Zn (OH)₂ + 2 NaCl
Соединения цинка с +2 степенью окисления включают оксид цинка, ZnO, сульфат цинка, ZnSO₄, и нитрат цинка, Zn(NO₃)₂. Оксид цинка может быть получен путем нагревания цинка в присутствии кислорода:
2 Zn + O₂ → 2 ZnO
Сульфат цинка может быть получен реакцией цинка с серной кислотой:
Zn + H₂SO₄ → ZnSO₄ + H₂
Нитрат цинка может быть получен реакцией цинка с азотной кислотой:
Zn + 2 HNO₃ → Zn(NO₃)₂ + H₂
Соединения цинка с положительной степенью окисления имеют широкое применение в промышленности и быту. Оксид цинка используется в производстве каучука, лакокрасочных материалов, косметики, и как добавка в пищевых продуктах. Сульфат цинка используется в качестве удобрения, а также в производстве батарей и красителей. Нитрат цинка используется в производстве древесных защитных средств и пиротехники.
Соединения цинка с “-” степенью
Это соединения, в которых цинк присутствует в виде иона или атома, имеющих больше электронов, чем в нейтральном состоянии. Обычно это соединения, в которых цинк соединяется с более электроотрицательными элементами, такими как хлор, сера и кислород.
Одним из наиболее распространенных соединений цинка с отрицательной степенью окисления является хлорид цинка (ZnCl2). Это белый кристаллический порошок, который хорошо растворяется в воде и обладает хорошей электропроводностью. Хлорид цинка является сильным электролитом и используется в различных процессах – гальваническое цинкование, производство смол и красок, а также в качестве катализатора в химических реакциях.
Сульфид цинка (ZnS) – соединение цинка с отрицательной степенью окисления. Это желтый кристаллический порошок, который слабо растворяется в воде. Сульфид цинка используется в производстве лаков, пигментов, стекла и других продуктов.
Гидроксид цинка (Zn(OH)2) – это белый порошок, который хорошо растворяется в кислотах и слабых щелочах. Гидроксид цинка используется в производстве каучука, лаков, красок и других продуктов.
Соединения цинка с отрицательной степенью окисления относятся к группе ZnX2, где X – анион. Такие соединения имеют формулу ZnX2, где X может быть хлоридом (Cl), бромидом (Br), иодидом (I), сульфатом (SO4) и т.д.
Рассмотрим несколько реакций с участием соединений цинка с отрицательной степенью окисления:
- Реакция с хлоридом натрия (NaCl): ZnCl2 + 2NaCl → ZnCl4Na2
- Реакция с гидроксидом натрия (NaOH): ZnCl2 + 2NaOH → Zn(OH)2 + 2NaCl
- Реакция с серной кислотой (H2SO4): ZnCl2 + H2SO4 → ZnSO4 + 2HCl
- Реакция с аммиаком (NH3): ZnCl2 + 2NH3 → Zn(NH3)2Cl2
Свойства соединений цинка с отрицательной степенью окисления значительно отличаются от химических характеристик соединений с положительной степенью окисления. Они обычно являются более реактивными, чем соединения с положительной степенью окисления, и могут обладать свойствами восстановителя. Кроме того, они могут использоваться в качестве катализаторов в химических реакциях.
Соединения цинка с отрицательной степенью окисления используются в различных областях промышленности и быта. Хлорид цинка (ZnCl2) используется в качестве катализатора в производстве этилена, а также как дезодорирующее средство для обработки сточных вод. Сульфат цинка (ZnSO4) используется в качестве добавки к кормам животных, а также в медицине для лечения различных заболеваний.
Степени окисления цинка в биологии
Цинк играет важную роль в биологических системах и является необходимым микроэлементом для жизнедеятельности многих организмов. Он участвует во многих биохимических процессах, таких как синтез белков, гормонов, ферментов и нуклеиновых кислот. Кроме того, цинк влияет на функционирование иммунной системы и роста клеток.
Степени окисления цинка в биологических системах обычно равны +2. Эта степень окисления обеспечивает цинку возможность связываться с различными биологическими молекулами, включая белки, ферменты и ДНК. Степени окисления цинка могут изменяться в зависимости от конкретного биологического процесса или функции. В некоторых белках цинк может иметь степень окисления +1. Это позволяет ему связываться с карбоксилатными группами в белковой структуре и играть важную роль в каталитических реакциях. Цинк может иметь степени окисления +3 и +4 в некоторых комплексах с другими металлами, такими как железо и медь.
Степени окисления цинка влияют на его биологическую активность и связывание с другими молекулами. В белковых структурах цинк с +2 степенью окисления может связываться с аминокислотами, содержащими кислород и нитроген, а также с гидроксильными группами, образуя ковалентные связи. Это позволяет цинку выполнять различные функции в биологических процессах, таких как каталитические реакции и стабилизация белковой структуры.
Изменяющейся степени окисления цинк играет важную роль во многих химических процессах и применениях, таких как медицина и промышленность. Возможные степени окисления варьируются от + 1 до + 4, при этом наиболее распространенным состоянием является + 2; однако более высокие степени могут быть достигнуты в зависимости от того, с какими другими элементами он связывается, образуя сложную молекулу или соединение.
Степень окисления цинка является важным показателем его химической активности и может варьироваться в зависимости от соединения, в котором он находится. Понимание степени окисления цинка позволяет лучше понять его реакционную способность и использовать его в различных химических процессах.
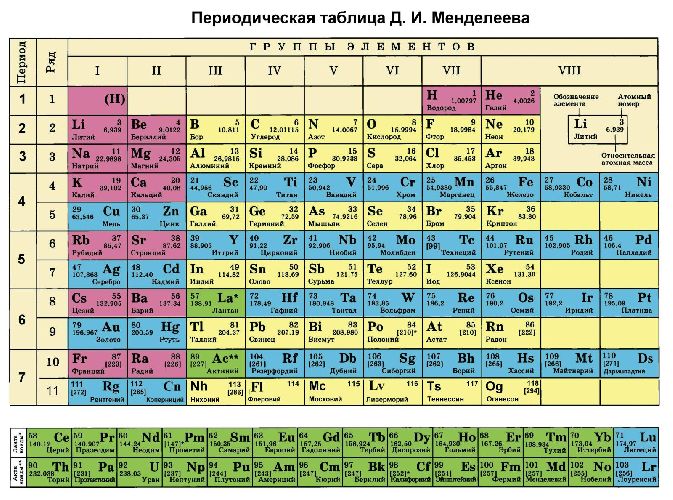
Цинк в таблице менделеева занимает 30 место, в 4 периоде.
| Символ | Zn |
| Номер | 30 |
| Атомный вес | 65.3800000 |
| Латинское название | Zincum |
| Русское название | Цинк |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема цинка
Zn: 1s2 2s2 2p6 3s2 3p6 4s2 3d10
Короткая запись:
Zn: [Ar]4s2 3d10
Одинаковую электронную конфигурацию имеют
атом цинка и
Ga+1, Ge+2, As+3, Se+4, Br+5
Порядок заполнения оболочек атома цинка (Zn) электронами:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d →
5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ – до 6, на
‘d’ – до 10 и на ‘f’ до 14
Цинк имеет 30 электронов,
заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
10 электронов на 3d-подуровне
Степень окисления цинка
Атомы цинка в соединениях имеют степени окисления 2, 1, 0.
Степень окисления – это условный заряд атома в соединении: связь в молекуле
между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается
заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается,
то степень окисления положительная.
Ионы цинка
Валентность Zn
Атомы цинка в соединениях проявляют валентность II, I.
Валентность цинка характеризует способность атома Zn к образованию хмических связей.
Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании
химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Zn
Квантовые числа определяются последним электроном в конфигурации,
для атома Zn эти числа имеют значение N = 3, L = 2, Ml = 2, Ms = -½
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Чем ближе электрон к центру атома – тем больше энергии необходимо, что бы его оторвать.
Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo.
Если не указано иное, то энергия ионизации – это энергия отрыва первого электрона, также существуют энергии
ионизации для каждого последующего электрона.
Энергия ионизации Zn:
Eo = 906 кДж/моль
— Что такое ион читайте в статье.
Перейти к другим элементам таблицы менделеева
Где Zn в таблице менделеева?
Таблица Менделеева
Скачать таблицу менделеева в хорошем качестве
Степень окисления цинка.
Степень окисления цинка:
Степень окисления (окислительное число) – это вспомогательная условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций. Она указывает на состояние окисления отдельного атома молекулы и представляет собой лишь удобный метод учёта переноса электронов. Однако она не является истинным зарядом атома в молекуле.
Степень окисления соответствует числу электронов, которое следует присоединить к положительному иону (катиону), чтобы восстановить его до нейтрального атома, или отнять от отрицательного иона (аниона), чтобы окислить его до нейтрального атома.
Степень окисления (в отличие от валентности) может иметь нулевое, отрицательное и положительное значения.
Значения степени окисления записывают арабскими цифрами сверху над символом элемента. При указании степени окисления первым ставится знак, а потом численное значение, а не наоборот.
Степень окисления (в отличие от валентности) может иметь нулевое, отрицательное и положительное значения: -5, -4, -3, -2, -1, 0, +1, +2 , +3 , +4, +5, +6 , +7.
Следует помнить, что степень окисления является сугубо условной величиной, не имеющей физического смысла, но характеризующей образование химической связи межатомного взаимодействия в молекуле.
Степень окисления в ряде случаев не совпадает с валентностью. Например, в молекуле азотной кислоты степень окисления центрального атома азота равна +5, тогда как валентность равна IV.
Степень окисления зачастую не совпадает с фактическим числом электронов, которые участвуют в образовании связей.
Степень окисления цинка равна -2, 0, +1, +2.
| Степень окисления цинка в соединениях | |
| -2 | |
| 0 | Zn |
| +1 | C20H30Zn2 – декаметилдизинкоцен |
| +2 | ZnO, ZnCl2, ZnH2, Zn(OH)2, ZnSO4 |
Все свойства атома цинка
Источник: https://ru.wikipedia.org
Примечание: © Фото https://www.pexels.com, https://pixabay.com
Коэффициент востребованности
235
Таблица окисления химических элементов

4.7
Средняя оценка: 4.7
Всего получено оценок: 556.
4.7
Средняя оценка: 4.7
Всего получено оценок: 556.
Чтобы определить условный заряд атомов в окислительно-восстановительных реакциях, используют таблицу окисления химических элементов. В зависимости от свойств атома элемент может проявлять положительную или отрицательную степень окисления.
Что такое степень окисления
Условный заряд атомов элементов в сложных веществах называется степенью окисления. Значение заряда атомов записывается в окислительно-восстановительных реакциях, чтобы понять, какой элемент является восстановителем, а какой – окислителем.
Степень окисления взаимосвязана с электроотрицательностью, которая показывает возможность атомов принимать или отдавать электроны. Чем выше значение электроотрицательности, тем больше способность атома отнимать электроны в реакциях.
Степень окисления может иметь три значения:
- нулевое – атом находится в состоянии покоя (все простые вещества имеют степень окисления 0);
- положительное – атом отдаёт электроны и является восстановителем (все металлы, некоторые неметаллы);
- отрицательное – атом принимает электроны и является окислителем (большинство неметаллов).
Например, степени окисления в реакции натрия с хлором выглядят следующим образом:
2Na0 + Cl20 → 2Na+1Cl-1
В реакции металлов с неметаллами металл всегда является восстановителем, а неметалл – окислителем.
Как определить
Существует таблица, в которой указаны все возможные степени окисления элементов.
|
Название |
Символ |
Степень окисления |
|
Водород |
H |
+1, -1 |
|
Гелий |
He |
0 |
|
Литий |
Li |
+1 |
|
Бериллий |
Be |
+2 |
|
Бор |
B |
-1, 0, +1, +2, +3 |
|
Углерод |
C |
-4, -3, -2, -1, 0, +2, +4 |
|
Азот |
N |
-3, -2, -1, 0, +1, +2, +3, +4, +5 |
|
Кислород |
O |
-2, -1, 0, +1, +2 |
|
Фтор |
F |
-1 |
|
Неон |
Ne |
0 |
|
Натрий |
Na |
+1 |
|
Магний |
Mg |
+2 |
|
Алюминий |
Al |
+3 |
|
Кремний |
Si |
-4, 0, +2, +4 |
|
Фосфор |
P |
3, 0, +3, +5 |
|
Сера |
S |
2, 0, +4, +6 |
|
Хлор |
Cl |
1, 0, +1, +3, +5, +7, редко +2 и +4 |
|
Аргон |
Ar |
0 |
|
Калий |
K |
+1 |
|
Кальций |
Ca |
+2 |
|
Скандий |
Sc |
+3 |
|
Титан |
Ti |
+2, +3, +4 |
|
Ванадий |
V |
+2, +3, +4, +5 |
|
Хром |
Cr |
+2, +3, +6 |
|
Марганец |
Mn |
+2, +3, +4, +6, +7 |
|
Железо |
Fe |
+2, +3, редко +4 и +6 |
|
Кобальт |
Co |
+2, +3, редко +4 |
|
Никель |
Ni |
+2, редко +1, +3, +4 |
|
Медь |
Cu |
+1, +2, редко +3 |
|
Цинк |
Zn |
+2 |
|
Галлий |
Ga |
+3, редко +2 |
|
Германий |
Ge |
-4, +2, +4 |
|
Мышьяк |
As |
-3, +3, +5, редко +2 |
|
Селен |
Se |
-2, +4, +6, редко +2 |
|
Бром |
Br |
-1, +1, +5, редко +3, +4 |
|
Криптон |
Kr |
0 |
|
Рубидий |
Rb |
+1 |
|
Стронций |
Sr |
+2 |
|
Иттрий |
Y |
+3 |
|
Цирконий |
Zr |
+4, редко +2, +3 |
|
Ниобий |
Nb |
+3, +5, редко +2, +4 |
|
Молибден |
Mo |
+3, +6, редко +2, +3, +5 |
|
Технеций |
Tc |
+6 |
|
Рутений |
Ru |
+3, +4, +8, редко +2, +6, +7 |
|
Родий |
Rh |
+4, редко +2, +3, +6 |
|
Палладий |
Pd |
+2, +4, редко +6 |
|
Серебро |
Ag |
+1, редко +2, +3 |
|
Кадмий |
Cd |
+2, редко +1 |
|
Индий |
In |
+3, редко +1, +2 |
|
Олово |
Sn |
+2, +4 |
|
Сурьма |
Sb |
-3, +3, +5, редко +4 |
|
Теллур |
Te |
-2, +4, +6, редко |
|
Иод |
I |
-1, +1, +5, +7, редко +3, +4 |
|
Ксенон |
Xe |
0 |
|
Цезий |
Cs |
+1 |
|
Барий |
Bа |
+2 |
|
Лантан |
La |
+3 |
|
Церий |
Ce |
+3, +4 |
|
Празеодим |
Pr |
+3 |
|
Неодим |
Nd |
+3, +4 |
|
Прометий |
Pm |
+3 |
|
Самарий |
Sm |
+3, редко +2 |
|
Европий |
Eu |
+3, редко +2 |
|
Гадолиний |
Gd |
+3 |
|
Тербий |
Tb |
+3, +4 |
|
Диспрозий |
Dy |
+3 |
|
Гольмий |
Ho |
+3 |
|
Эрбий |
Er |
+3 |
|
Тулий |
Tm |
+3, редко +2 |
|
Иттербий |
Ib |
+3, редко +2 |
|
Лютеций |
Lu |
+3 |
|
Гафний |
Hf |
+4 |
|
Тантал |
Ta |
+5, редко +3, +4 |
|
Вольфрам |
W |
+6, редко +2, +3, +4, +5 |
|
Рений |
Re |
+2, +4, +6, +7, редко -1, +1, +3, +5 |
|
Осмий |
Os |
+3, +4, +6, +8, редко +2 |
|
Иридий |
Ir |
+3, +4, +6, редко +1, +2 |
|
Платина |
Pt |
+2, +4, +6, редко +1, +3 |
|
Золото |
Au |
+1, +3, редко +2 |
|
Ртуть |
Hg |
+1, +2 |
|
Талий |
Tl |
+1, +3, редко +2 |
|
Свинец |
Pb |
+2, +4 |
|
Висмут |
Bi |
+3, редко +3, +2, +4, +5 |
|
Полоний |
Po |
+2, +4, редко -2, +6 |
|
Астат |
At |
– |
|
Радон |
Ra |
0 |
|
Франций |
Fr |
– |
|
Радий |
Ra |
+2 |
|
Актиний |
Ac |
+3 |
Или использовать на уроках этот вариант таблицы.
Кроме того, степени окисления химических элементов можно определить по периодической таблице Менделеева:
- высшая степень (максимально положительная) совпадает с номером группы;
- для определения минимального значения степени окисления из номера группы вычитается восемь.
Большинство неметаллов имеют положительную и отрицательную степени окисления. Например, кремний находится в IV группе, значит, его максимальная степень окисления +4, а минимальная -4. В соединениях неметаллов (SO3, CO2, SiC) окислителем является неметалл с отрицательной степенью окисления или с большим значением электроотрицательности. Например, в соединении PCl3 фосфор имеет степень окисления +3, хлор -1. Электроотрицательность фосфора – 2,19, хлора – 3,16.
Второе правило не работает для щелочных и щелочноземельных металлов, которые всегда имеют одну положительную степень окисления, равную номеру группы. Исключения составляют магний и бериллий (+1, +2). Также постоянную степень окисления имеют:
- алюминий (+3);
- цинк (+2);
- кадмий (+2).
Остальные металлы имеют непостоянную степень окисления. В большинстве реакций выступают в качестве восстановителя. В редких случаях могут быть окислителями с отрицательной степенью окисления.
Фтор – самый мощный окислитель. Его степень окисления всегда -1.
Что мы узнали?
Из урока 8 класса узнали о степени окисления. Это условная величина, показывающая, сколько электронов может отдать или принять атом в ходе химической реакции. Значение связано с электроотрицательностью. Окислители принимают электроны и имеют отрицательную степень окисления, восстановители отдают электроны и проявляют положительную степень окисления. Большинство металлов – восстановители с постоянной или переменной степенью окисления. Неметаллы могут проявлять свойства окислителя и восстановителя в зависимости от вещества, с которым реагируют.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-
Александр Котков
5/5
-
Александр Котков
5/5
-
Паша Кривов
4/5
-
Александр Котков
5/5
-
Лидия Маслова
5/5
Оценка доклада
4.7
Средняя оценка: 4.7
Всего получено оценок: 556.
А какая ваша оценка?