Степень окисления и валентность – понятия в чём-то близкие и взаимозаменяемые в ряде ситуаций. Но если валентность всегда положительна (поскольку по определение – способность атомов образовывать то или иное число химических связей. А число связей, очевидно, отрицательным быть не может), то степень окисления может иметь как положительные, так и отрицательные значения. А всё потому, что степень окисления – показывает, каким бы был заряд атома, если бы все электроны, образующие химическую связь сместились к нему (или полностью от него оторвались, сместившись к другому атому).
В бинарных соединениях степень окисления найти просто. Нужно помнить два момента:
1. Молекула всегда нейтральна, у неё нет заряда (или же он равен 0), поэтому число отрицательных зарядов равно числу зарядов положительных.
2. Произведения степени окисления атома и индекса, стоящего у атома в молекуле, у обоих составляющих молекулу атомов равны по модулю.
Также стоит запомнить, что
у многих элементов степени окисления почти всегда постоянны. Так, кислород имеет степень окисления -2, водород (очень часто, но не всегда!) и щелочные металлы +1, металлы второй группы +2 и т.д.
Но есть и элементы, которые могут иметь разную степень кисления, например, у серы она может быть -2, +4 или +6.
Для примера определим степени окисления меди в двух оксидах: Cu2O и CuO.
Известно, что у кислорода степень окисления -2. Напомню, что степень окисления указывается справа вверху от элемента. Таким образом, запишем для первого оксида:
Для кислорода произведение степени окисления и индекса -2*1=-2 или по модулю 2. Для меди произведение степени окисления и индекса тоже должно равняться 2. С учётом того, что у меди стоит индекс 2 получаем степень окисления 1. Очевидно, что это +1: поскольку в молекуле уже есть отрицательно заряженная составляющая, другая составляющая должна быть заряжена положительно. Таким образом, в оксиде меди Cu2O степень окисления меди +1.
С оксидом CuО дело обстоит ещё проще. Когда в молекуле атомы соединены 1 к 1, то степени окисления у них равны по модулю. Поскольку у кислорода степень окисления -2, то у меди здесь степень окисления +2.
Теперь разберём примеры посложнее и рассмотрим молекулы, состоящие из атомов трёх видов.
Пример 1.
Определите степень окисления серы в серной кислоте.
Серная кислота имеет формулу H2SO4. Чтобы понять, какая степень окисления у серы в этом соединении, нужно помнить, что заряд молекулы всегда равен 0, то есть число отрицательных зарядов всегда равно числу положительных. Теперь посмотрим на формулу и вспомним, что кислород имеет степень окисления -2, водород +1, то есть:
Что отсюда видно? Что пока у нас имеется два положительных заряда, это вклад водорода (+2 мы получаем, умножив степень окисления водорода на индекс: +1*2=+2) и восемь отрицательных, это вклад кислорода (-8 мы получаем, умножив степень окисления кислорода на индекс: -2*4=-8). Но нам нужно, чтобы число положительных зарядов было равно числу отрицательных, только при этом условии заряд молекулы будет 0. Следовательно, недостаёт 6 положительных зарядов. Это и есть степень окисления серы в серной кислоте: +6. То есть можно записать так:
Пример 2.
Найдём степень окисления азота в азотистой кислоте HNO2.
Рассуждать будет аналогично, исходя из известных степеней окисления (-2 у кислорода и +1 и водорода):
Перемножив степени окисления с индексами, получим, что у нас 1 положительный заряд (от водорода: +1*1=+1) и четыре отрицательных (от кислорода: -2*2=-4). Для общего нулевого заряда молекулы недостаёт трёх положительных зарядов, которые и даст азот. То есть в азотистой кислоте степень окисления азота +3:
Для тренировки попробуйте самостоятельно определить степень окисления хрома в бихромате калия K2CrO4.
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Алгоритм «Определение степени окисления элементов по химической формуле»
Задание: Определите степени окисления элементов в серной кислоте (H2SO4)
1.Написать формулу серной кислоты
H2SO4
2.По периодической таблице определить степень окисления элемента, стоящего слева. Определение производить согласно правила: элемент, стоящий слева отдает электроны, его степень окисления положительна и численно равна номеру группы элемента. Так слева в формуле расположен водород это элемент первой группы периодической системы, следовательно его степень окисления равна +1
(H2+1SO4)[1][2]
3.По периодической таблице определить степень окисления элемента, стоящего справа. Определение производить согласно правила: элемент, стоящий справа принимает электроны, его степень окисления отрицательна и численно равна номеру группы, в которой находится элемент минус восемь ( №периода – 8).[2][3] Так справа в формуле расположен кислород, это элемент шестого периода, следовательно его степень окисления равна (6-8=-2).
H2+1SO4-2
.4.Определить степень окисления третьего элемента согласно правила: сумма степеней окисления всех атомов, образующих частицу равна заряду частицы – для нейтральной молекулы – это 0. С этой целью составим математическое уравнение, включив в него степени окисления всех атомов молекулы и приняв за х степень окисления серы.
2(+1) + х + 4(-2) = 0
5.Решить уравнение, определив степень окисления серы.
Х=+6
6.Проставить степени окисления элементов в химической формуле
H2+1S+6O4-2
Степень окисления не всегда совпадает с валентностью.
Кислоты бывают:
-
бескислородные: хлороводородная (соляная) HCl, сероводородная H2S
-
кислородосодержащие: азотная HNO3, серная H2SO4 и т.д.
• По числу атомов водорода: одноосновные (HNO3), двухосновные (H2SO4) трехосновные (H3PO4).
• По растворимости: растворимые, нерстворимые (см. таблицу растворимости)
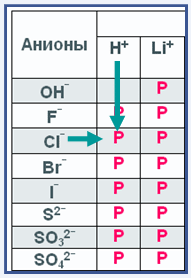
На рисунке слева представлена небольшая часть уже знакомой тебе таблицы растворимости. Под общим названием анионы расположены различные отрицательно заряженные ионы, кроме гидроксид иона ОН– все остальные – это ионы кислотных остатков.
При пересечении, например столбца иона водорода Н+ с ионом хлора Cl– мы видим ячейку в которой находится буква Р (растворяется). Это значит, что соляная кислота HCl растворяется в воде. Так определяют растворимость кислот.
![]() Запомни: Оксид, которому соответствует кислота называется кислотный оксид: S > SO3 > H2SO4 . Кслотный оксид SO3, ему соотвествует серная кислота.
Запомни: Оксид, которому соответствует кислота называется кислотный оксид: S > SO3 > H2SO4 . Кслотный оксид SO3, ему соотвествует серная кислота.
![]()
Вопрос: Как составить формулу оксида соответствующего данной кислоте?
Пример: Для серной кислоты составим соответствующий оксид. Для этого:
1. Определим степень окисления элементов в кислоте.
H2SO4 – формула серной кислоты
Степени окисления водорода и кислорода нам известны: водорода +1, кислорода -2. Неизвестна только степень окисления у серы. Обозначим её х. Подставим все степени окисления в формулу серной кислоты.
H2+1SхO4-2 т.к. для химического соединения в сумме все степени окисления равны 0, можно составить уравнение:
+1 • 2 + х + (-2) • 4 = 0
решим его:
2 + х – 8 = 0
Х = +6
все степени окисления известны: H2+1S+6O4-2
2. Степень окисления серы в серной кислоте +6. Составим оксид соответствующий серной кислоте: S+6O3-2 или SO3.
Таблица кислот и оксидов
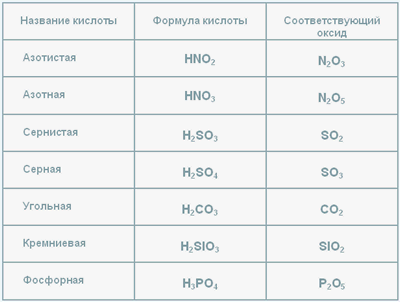
Табл.1
В таблице представленны формулы кислот, их названия и оксиды, соответствующие данной кислоте.
* * *
.
Темы кодификатора ЕГЭ: Электроотрицательность. Степень окисления и валентность химических элементов.
Когда атомы взаимодействуют и образуют химическую связь, электроны между ними в большинстве случаев распределяются неравномерно, поскольку свойства атомов различаются. Более электроотрицательный атом сильнее притягивает к себе электронную плотность. Атом, который притянул к себе электронную плотность, приобретает частичный отрицательный заряд δ—, его «партнер» — частичный положительный заряд δ+. Если разность электроотрицательностей атомов, образующих связь, не превышает 1,7, мы называем связь ковалентной полярной. Если разность электроотрицательностей, образующих химическую связь, превышает 1,7, то такую связь мы называем ионной.
Степень окисления – это вспомогательный условный заряд атома элемента в соединении, вычисленный из предположения, что все соединения состоят из ионов (все полярные связи – ионные).
Что значит «условный заряд»? Мы просто-напросто договариваемся, что немного упростим ситуацию: будем считать любые полярные связи полностью ионными, и будем считать, что электрон полностью уходит или приходит от одного атома к другому, даже если на самом деле это не так. А уходит условно электрон от менее электроотрицательного атома к более электроотрицательному.
Например, в связи H-Cl мы считаем, что водород условно «отдал» электрон, и его заряд стал +1, а хлор «принял» электрон, и его заряд стал -1. На самом деле таких полных зарядов на этих атомах нет.
Наверняка, у вас возник вопрос — зачем же придумывать то, чего нет? Это не коварный замысел химиков, все просто: такая модель очень удобна. Представления о степени окисления элементов полезны при составлении классификации химических веществ, описании их свойств, составлении формул соединений и номенклатуры. Особенно часто степени окисления используются при работе с окислительно-восстановительными реакциями.
Степени окисления бывают высшие, низшие и промежуточные.
Высшая степень окисления равна номеру группы со знаком «плюс».
Низшая определяется, как номер группы минус 8.
И промежуточная степень окисления — это почти любое целое число в интервале от низшей степени окисления до высшей.

Например, для азота характерны: высшая степень окисления +5, низшая 5 — 8 = -3, а промежуточные степени окисления от -3 до +5. Например, в гидразине N2H4 степень окисления азота промежуточная, -2.
Чаще всего степень окисления атомов в сложных веществах обозначается сначала знаком, потом цифрой, например +1, +2, -2 и т.д. Когда речь идет о заряде иона (предположим, что ион реально существует в соединении), то сначала указывают цифру, потом знак. Например: Ca2+, CO3 2-.
Для нахождения степеней окисления используют следующие правила:
- Степень окисления атомов в простых веществах равна нулю;
- В нейтральных молекулах алгебраическая сумма степеней окисления равна нулю, для ионов эта сумма равна заряду иона;
- Степень окисления щелочных металлов (элементы I группы главной подгруппы) в соединениях равна +1, степень окисления щелочноземельных металлов (элементы II группы главной подгруппы) в соединениях равна +2; степень окисления алюминия в соединениях равна +3;
- Степень окисления водорода в соединениях с металлами (солеобразные гидриды — NaH, CaH2 и др.) равна -1; в соединениях с неметаллами (летучие водородные соединения) +1;
- Степень окисления кислорода равна -2. Исключение составляют пероксиды – соединения, содержащие группу –О-О-, где степень окисления кислорода равна -1, и некоторые другие соединения (супероксиды, озониды, фториды кислорода OF2 и др.);
- Степень окисления фтора во всех сложных веществах равна -1.
Выше перечислены ситуации, когда степень окисления мы считаем постоянной. У всех остальных химических элементов степень окисления — переменная, и зависит от порядка и типа атомов в соединении.
Примеры:
Задание: определите степени окисления элементов в молекуле дихромата калия: K2Cr2O7.
Решение: степень окисления калия равна +1, степень окисления хрома обозначим, как х, степень окисления кислорода -2. Сумма всех степеней окисления всех атомов в молекуле равна 0. Получаем уравнение: +1*2+2*х-2*7=0. Решаем его, получаем степень окисления хрома +6.
В бинарных соединениях более электроотрицательный элемент характеризуется отрицательной степенью окисления, менее электроотрицательный – положительной.
Обратите внимание, что понятие степени окисления – очень условно! Степень окисления не показывает реальный заряд атома и не имеет реального физического смысла. Это упрощенная модель, которая эффективно работает, когда нам необходимо, например, уравнять коэффициенты в уравнении химической реакции, или для алгоритмизации классификации веществ.
Степень окисления – это не валентность! Степень окисления и валентность во многих случаях не совпадают. Например, валентность водорода в простом веществе Н2 равна I, а степень окисления, согласно правилу 1, равна 0.
Это базовые правила, которые помогут Вам определить степень окисления атомов в соединениях в большинстве случаев.
В некоторых ситуациях вы можете столкнуться с трудностями при определении степени окисления атома. Рассмотрим некоторые из этих ситуаций, и разберем способы их разрешения:
- В двойных (солеобразных) оксидах степень у атома, как правило, две степени окисления. Например, в железной окалине Fe3O4 у железа две степени окисления: +2 и +3. Какую из них указывать? Обе. Для упрощения можно представить это соединение, как соль: Fe(FeO2)2. При этом кислотный остаток образует атом со степенью окисления +3. Либо двойной оксид можно представить так: FeO*Fe2O3.
- В пероксосоединениях степень окисления атомов кислорода, соединенных ковалентными неполярными связями, как правило, изменяется. Например, в пероксиде водорода Н2О2, и пероксидах щелочных металлов степень окисления кислорода -1, т.к. одна из связей – ковалентная неполярная (Н-О-О-Н). Другой пример – пероксомоносерная кислота (кислота Каро) H2SO5 (см. рис.) содержит в составе два атома кислорода со степенью окисления -1, остальные атомы со степенью окисления -2, поэтому более понятной будет такая запись: H2SO3(O2). Известны также пероксосоединения хрома – например, пероксид хрома (VI) CrO(O2)2 или CrO5, и многие другие.
- Еще один пример соединений с неоднозначной степенью окисления – супероксиды (NaO2) и солеобразные озониды KO3. В этом случае уместнее говорить о молекулярном ионе O2 с зарядом -1 и и O3 с зарядом -1. Строение таких частиц описывается некоторыми моделями, которые в российской учебной программе проходят на первых курсах химических ВУЗов: МО ЛКАО, метод наложения валентных схем и др.
- В органических соединениях понятие степени окисления не очень удобно использовать, т.к. между атомами углерода существует большое число ковалентных неполярных связей. Тем не менее, если нарисовать структурную формулу молекулы, то степень окисления каждого атома также можно определить по типу и количеству атомов, с которыми данный атом непосредственно связан. Например, у первичных атомов углерода в углеводородах степень окисления равна -3, у вторичных -2, у третичных атомов -1, у четвертичных — 0.
Потренируемся определять степень окисления атомов в органических соединениях. Для этого необходимо нарисовать полную структурную формулу атома, и выделить атом углерода с его ближайшим окружением — атомами, с которыми он непосредственно соединен.
Полезные советы:
- Для упрощения расчетов можно использовать таблицу растворимости – там указаны заряды наиболее распространенных ионов. На большинстве российских экзаменов по химии (ЕГЭ, ГИА, ДВИ) использование таблицы растворимости разрешено. Это готовая шпаргалка, которая во многих случаях позволяет значительно сэкономить время.
- При расчете степени окисления элементов в сложных веществах сначала указываем степени окисления элементов, которые мы точно знаем (элементы с постоянной степенью окисления), а степень окисления элементов с переменной степенью окисления обозначаем, как х. Сумма всех зарядов всех частиц равна нулю в молекуле или равна заряду иона в ионе. Из этих данных легко составить и решить уравнение.
Тренировочный тест по теме «Степени окисления и валентность» 10 вопросов, при каждом прохождении новые.
194
Создан на
07 января, 2022 От Admin

Тренировочный тест “Степени окисления”
1 / 10
1) S 2) Na 3) Se 4) Te 5) Ca
Из числа указанных в ряду элементов выберите два элемента, каждый из которых образует с водородом соединения с общей формулой ЭНх, в которых водород проявляет степень окисления, равную -1.
Запишите в поле ответа номера выбранных элементов.
2 / 10
1) Al 2) S 3) Ca 4) N 5) Na
Из указанных в ряду химических элементов выберите два элемента, которые в составе образованных ими оксидов с общей формулой ЭО2 могут иметь одинаковую степень окисления.
Запишите в поле ответа номера выбранных элементов.
3 / 10
1) Na 2) Cl 3) Si 4) Mn 5) Cr
Из числа указанных в ряду элементов выберите два элемента, которые в соединениях могут проявлять валентность 1.
4 / 10
1) Sr 2) Br 3) Rb 4) As 5) Se
Из указанных в ряду элементов выберите два элемента, которые в соединениях проявляют постоянную степень окисления.
5 / 10
1) K 2) Na 3) Se 4) Mg 5) S
Из указанных в ряду элементов выберите два элемента, которые в соединении с водородом проявляют отрицательную степень окисления.
6 / 10
1) Na 2) Cl 3) As 4) Ca 5) Ge
Из указанных в ряду элементов выберите два элемента, которые в соединениях могут проявлять степень окисления +5.
7 / 10
1) K 2) Br 3) Se 4) Si 5) S
Из указанных в ряду элементов выберите два элемента, которые в соединениях могут проявлять степень окисления -2.
8 / 10
1) Cl 2) Sr 3) Se 4) P 5) K
Из числа указанных в ряду элементов выберите два элемента, которые в составе образованных ими кислородсодержащих анионов могут иметь одинаковую степень окисления.
9 / 10
1) B 2) Mg 3) Cl 4) S 5) V
Из числа указанных в ряду элементов выберите два элемента, которые имеют одинаковую разность между значениями степеней окисления в высшем оксиде и летучем водородном соединении.
10 / 10
1) Cr 2) P 3) Al 4) Mn 5) S
Из числа указанных в ряду элементов выберите два элемента, которые имеют одинаковую разность между значениями их высшей и низшей степеней окисления.
Ваша оценка
The average score is 56%
