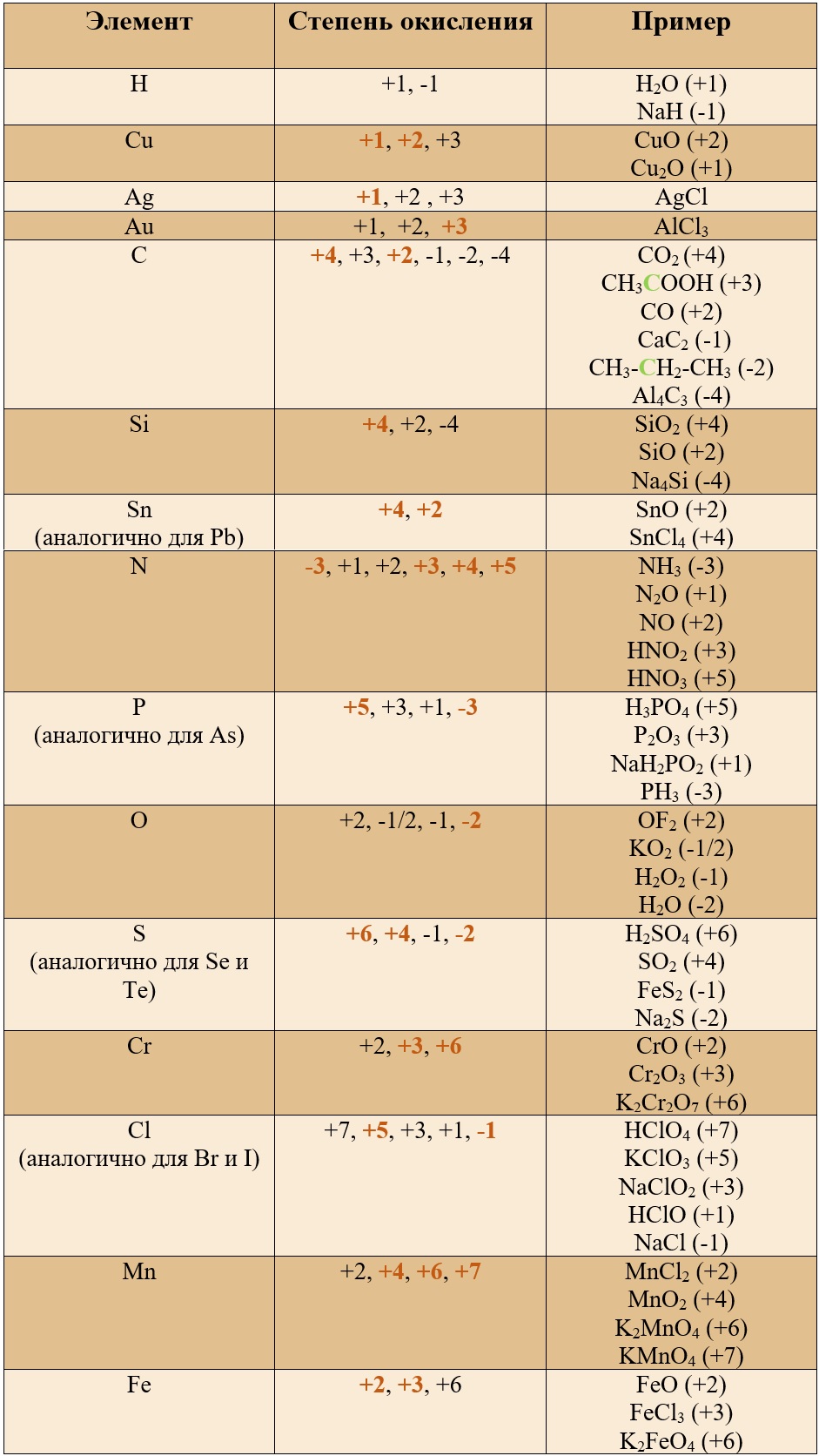
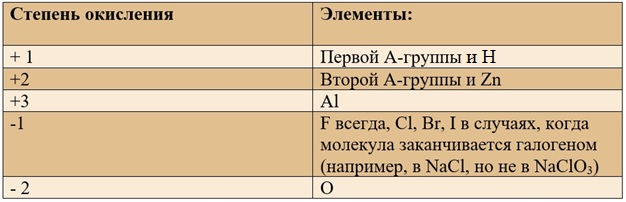
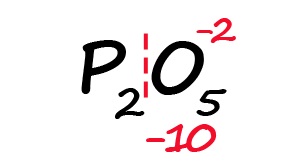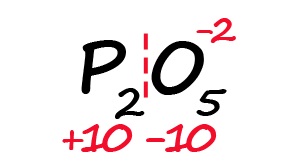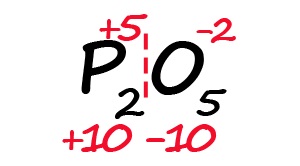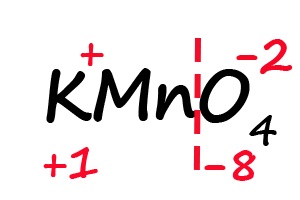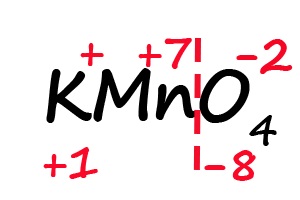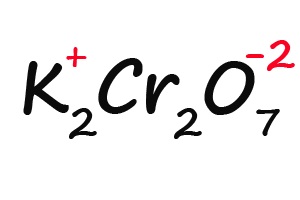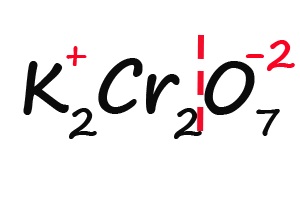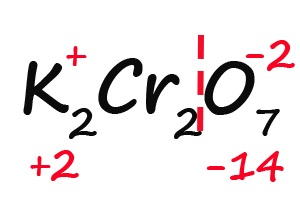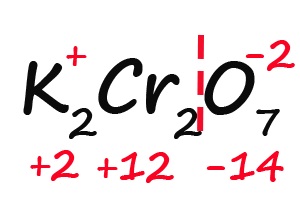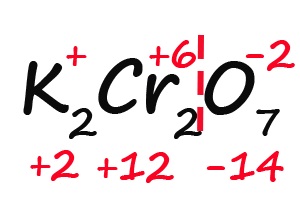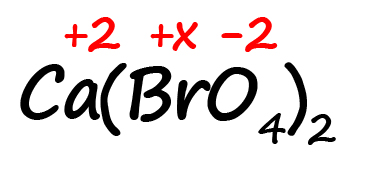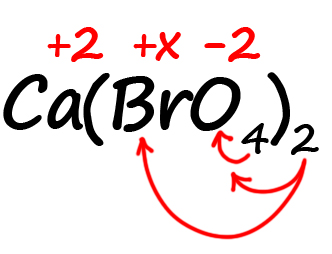Степень окисления и валентность – понятия в чём-то близкие и взаимозаменяемые в ряде ситуаций. Но если валентность всегда положительна (поскольку по определение – способность атомов образовывать то или иное число химических связей. А число связей, очевидно, отрицательным быть не может), то степень окисления может иметь как положительные, так и отрицательные значения. А всё потому, что степень окисления – показывает, каким бы был заряд атома, если бы все электроны, образующие химическую связь сместились к нему (или полностью от него оторвались, сместившись к другому атому).
В бинарных соединениях степень окисления найти просто. Нужно помнить два момента:
1. Молекула всегда нейтральна, у неё нет заряда (или же он равен 0), поэтому число отрицательных зарядов равно числу зарядов положительных.
2. Произведения степени окисления атома и индекса, стоящего у атома в молекуле, у обоих составляющих молекулу атомов равны по модулю.
Также стоит запомнить, что
у многих элементов степени окисления почти всегда постоянны. Так, кислород имеет степень окисления -2, водород (очень часто, но не всегда!) и щелочные металлы +1, металлы второй группы +2 и т.д.
Но есть и элементы, которые могут иметь разную степень кисления, например, у серы она может быть -2, +4 или +6.
Для примера определим степени окисления меди в двух оксидах: Cu2O и CuO.
Известно, что у кислорода степень окисления -2. Напомню, что степень окисления указывается справа вверху от элемента. Таким образом, запишем для первого оксида:
Для кислорода произведение степени окисления и индекса -2*1=-2 или по модулю 2. Для меди произведение степени окисления и индекса тоже должно равняться 2. С учётом того, что у меди стоит индекс 2 получаем степень окисления 1. Очевидно, что это +1: поскольку в молекуле уже есть отрицательно заряженная составляющая, другая составляющая должна быть заряжена положительно. Таким образом, в оксиде меди Cu2O степень окисления меди +1.
С оксидом CuО дело обстоит ещё проще. Когда в молекуле атомы соединены 1 к 1, то степени окисления у них равны по модулю. Поскольку у кислорода степень окисления -2, то у меди здесь степень окисления +2.
Теперь разберём примеры посложнее и рассмотрим молекулы, состоящие из атомов трёх видов.
Пример 1.
Определите степень окисления серы в серной кислоте.
Серная кислота имеет формулу H2SO4. Чтобы понять, какая степень окисления у серы в этом соединении, нужно помнить, что заряд молекулы всегда равен 0, то есть число отрицательных зарядов всегда равно числу положительных. Теперь посмотрим на формулу и вспомним, что кислород имеет степень окисления -2, водород +1, то есть:
Что отсюда видно? Что пока у нас имеется два положительных заряда, это вклад водорода (+2 мы получаем, умножив степень окисления водорода на индекс: +1*2=+2) и восемь отрицательных, это вклад кислорода (-8 мы получаем, умножив степень окисления кислорода на индекс: -2*4=-8). Но нам нужно, чтобы число положительных зарядов было равно числу отрицательных, только при этом условии заряд молекулы будет 0. Следовательно, недостаёт 6 положительных зарядов. Это и есть степень окисления серы в серной кислоте: +6. То есть можно записать так:
Пример 2.
Найдём степень окисления азота в азотистой кислоте HNO2.
Рассуждать будет аналогично, исходя из известных степеней окисления (-2 у кислорода и +1 и водорода):
Перемножив степени окисления с индексами, получим, что у нас 1 положительный заряд (от водорода: +1*1=+1) и четыре отрицательных (от кислорода: -2*2=-4). Для общего нулевого заряда молекулы недостаёт трёх положительных зарядов, которые и даст азот. То есть в азотистой кислоте степень окисления азота +3:
Для тренировки попробуйте самостоятельно определить степень окисления хрома в бихромате калия K2CrO4.
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Загрузить PDF
Загрузить PDF
В химии термины «окисление» и «восстановление» означает реакции, при которых атом или группа атомов теряют или, соответственно, приобретают электроны. Степень окисления — это приписываемая одному либо нескольким атомам численная величина, характеризующая количество перераспределяемых электронов и показывающая, каким образом эти электроны распределяются между атомами при реакции. Определение этой величины может быть как простой, так и довольно сложной процедурой, в зависимости от атомов и состоящих из них молекул. Более того, атомы некоторых элементов могут обладать несколькими степенями окисления. К счастью, для определения степени окисления существуют несложные однозначные правила, для уверенного пользования которыми достаточно знания основ химии и алгебры.
-
1
Определите, является ли рассматриваемое вещество элементарным. Степень окисления атомов вне химического соединения равна нулю. Это правило справедливо как для веществ, образованных из отдельных свободных атомов, так и для таких, которые состоят из двух, либо многоатомных молекул одного элемента.
- Например, Al(s) и Cl2 имеют степень окисления 0, поскольку оба находятся в химически несвязанном элементарном состоянии.
- Обратите внимание, что аллотропная форма серы S8, или октасера, несмотря на свое нетипичное строение, также характеризуется нулевой степенью окисления.
-
2
Определите, состоит ли рассматриваемое вещество из ионов. Степень окисления ионов равняется их заряду. Это справедливо как для свободных ионов, так и для тех, которые входят в состав химических соединений.
- Например, степень окисления иона Cl– равняется -1.
- Степень окисления иона Cl в составе химического соединения NaCl также равна -1. Поскольку ион Na, по определению, имеет заряд +1, мы заключаем, что заряд иона Cl -1, и таким образом степень его окисления равна -1.
-
3
Учтите, что ионы металлов могут иметь несколько степеней окисления. Атомы многих металлических элементов могут ионизироваться на разные величины. Например, заряд ионов такого металла как железо (Fe) равняется +2, либо +3.[1]
Заряд ионов металла (и их степень окисления) можно определить по зарядам ионов других элементов, с которыми данный металл входит в состав химического соединения; в тексте этот заряд обозначается римскими цифрами: так, железо (III) имеет степень окисления +3.- В качестве примера рассмотрим соединение, содержащее ион алюминия. Общий заряд соединения AlCl3 равен нулю. Поскольку нам известно, что ионы Cl– имеют заряд -1, и в соединении содержится 3 таких иона, для общей нейтральности рассматриваемого вещества ион Al должен иметь заряд +3. Таким образом, в данном случае степень окисления алюминия равна +3.
-
4
Степень окисления кислорода равна -2 (за некоторыми исключениями). Почти во всех случаях атомы кислорода имеют степень окисления -2. Есть несколько исключений из этого правила:
- Если кислород находится в элементарном состоянии (O2), его степень окисления равна 0, как и в случае других элементарных веществ.
- Если кислород входит в состав перекиси, его степень окисления равна -1. Перекиси — это группа соединений, содержащих простую кислород-кислородную связь (то есть анион перекиси O2-2). К примеру, в составе молекулы H2O2 (перекись водорода) кислород имеет заряд и степень окисления -1.
- В соединении с фтором кислород обладает степенью окисления +2, читайте правило для фтора ниже.
-
5
Водород характеризуется степенью окисления +1, за некоторыми исключениями. Как и для кислорода, здесь также существуют исключения. Как правило, степень окисления водорода равна +1 (если он не находится в элементарном состоянии H2). Однако в соединениях, называемых гидридами, степень окисления водорода составляет -1.
- Например, в H2O степень окисления водорода равна +1, поскольку атом кислорода имеет заряд -2, и для общей нейтральности необходимы два заряда +1. Тем не менее, в составе гидрида натрия степень окисления водорода уже -1, так как ион Na несет заряд +1, и для общей электронейтральности заряд атома водорода (а тем самым и его степень окисления) должен равняться -1.
-
6
Фтор всегда имеет степень окисления -1. Как уже было отмечено, степень окисления некоторых элементов (ионы металлов, атомы кислорода в перекисях и так далее) может меняться в зависимости от ряда факторов. Степень окисления фтора, однако, неизменно составляет -1. Это объясняется тем, что данный элемент имеет наибольшую электроотрицательность — иначе говоря, атомы фтора наименее охотно расстаются с собственными электронами и наиболее активно притягивают чужие электроны. Таким образом, их заряд остается неизменным.
-
7
Сумма степеней окисления в соединении равна его заряду. Степени окисления всех атомов, входящих в химическое соединение, в сумме должны давать заряд этого соединения. Например, если соединение нейтрально, сумма степеней окисления всех его атомов должна равняться нулю; если соединение является многоатомным ионом с зарядом -1, сумма степеней окисления равна -1, и так далее.
- Это хороший метод проверки — если сумма степеней окисления не равна общему заряду соединения, значит вы где-то ошиблись.
Реклама
-
1
Найдите атомы, не имеющие строгих правил относительно степени окисления. По отношению к некоторым элементам нет твердо установленных правил нахождения степени окисления. Если атом не подпадает ни под одно правило из перечисленных выше, и вы не знаете его заряда (например, атом входит в состав комплекса, и его заряд не указан), вы можете установить степень окисления такого атома методом исключения. Вначале определите заряд всех остальных атомов соединения, а затем из известного общего заряда соединения вычислите степень окисления данного атома.
- Например, в соединении Na2SO4 неизвестен заряд атома серы (S) — мы лишь знаем, что он не нулевой, поскольку сера находится не в элементарном состоянии. Это соединение служит хорошим примером для иллюстрации алгебраического метода определения степени окисления.
-
2
Найдите степени окисления остальных элементов, входящих в соединение. С помощью описанных выше правил определите степени окисления остальных атомов соединения. Не забывайте об исключениях из правил в случае атомов O, H и так далее.
- Для Na2SO4, пользуясь нашими правилами, мы находим, что заряд (а значит и степень окисления) иона Na равен +1, а для каждого из атомов кислорода он составляет -2.
-
3
Умножьте количество атомов на их степень окисления. Теперь, когда нам известны степени окисления всех атомов за исключением одного, необходимо учесть, что атомов некоторых элементов может быть несколько. Умножьте число атомов каждого элемента (оно указано в химической формуле соединения в виде подстрочного числа, следующего за символом элемента) на его степень окисления.
- В Na2SO4 мы имеем 2 атома Na и 4 атома O. Таким образом, умножая 2 × +1, получаем степень окисления всех атомов Na (2), а умножая 4 × -2 — степень окисления атомов O (-8).
-
4
Сложите предыдущие результаты. Суммируя результаты умножения, получаем степень окисления соединения без учета вклада искомого атома.
- В нашем примере для Na2SO4 мы складываем 2 и -8 и получаем -6.
-
5
Найдите неизвестную степень окисления из заряда соединения. Теперь у вас есть все данные для простого расчета искомой степени окисления. Запишите уравнение, в левой части которого будет сумма числа, полученного на предыдущем шаге вычислений, и неизвестной степени окисления, а в правой — общий заряд соединения. Иными словами, (Сумма известных степеней окисления) + (искомая степень окисления) = (заряд соединения).
- В нашем случае Na2SO4 решение выглядит следующим образом:
- (Сумма известных степеней окисления) + (искомая степень окисления) = (заряд соединения)
- -6 + S = 0
- S = 0 + 6
- S = 6. В Na2SO4 сера имеет степень окисления 6.
Реклама
- В нашем случае Na2SO4 решение выглядит следующим образом:
Советы
- В соединениях сумма всех степеней окисления должна равняться заряду. Например, если соединение представляет собой двухатомный ион, сумма степеней окисления атомов должна быть равна общему ионному заряду.
- Очень полезно уметь пользоваться периодической таблицей Менделеева и знать, где в ней располагаются металлические и неметаллические элементы.
- Степень окисления атомов в элементарном виде всегда равна нулю. Степень окисления единичного иона равна его заряду. Элементы группы 1A таблицы Менделеева, такие как водород, литий, натрий, в элементарном виде имеют степень окисления +1; степень окисления металлов группы 2A, таких как магний и кальций, в элементарном виде равна +2. Кислород и водород, в зависимости от вида химической связи, могут иметь 2 различных значения степени окисления.
Реклама
Что вам понадобится
- Периодическая таблица элементов
- Доступ в интернет или справочники по химии
- Лист бумаги, ручка или карандаш
- Калькулятор
Об этой статье
Эту страницу просматривали 644 821 раз.
Была ли эта статья полезной?
Как определить степень окисления
Задача по определению степени окисления может оказаться как простой формальностью, так и сложной головоломкой. В первую очередь, это будет зависеть от формулы химического соединения, а также наличия элементарных знаний по химии и математике.
Зная основные правила и алгоритм последовательно-логичных действий, о которых пойдет речь в данной статье, при решении задач подобного типа, каждый с легкостью сможет справиться с этим заданием.
А потренировавшись и научившись определять степени окисления разноплановых химических соединений, можно смело браться за уравнивание сложных окислительно-восстановительных реакций методом составления электронного баланса.
1
Понятие степени окисления
Чтобы научиться определять степень окисления, для начала необходимо разобраться, что это понятие означает?
- Степень окисления применяют при записи в окислительно-восстановительных реакциях, когда происходит передача электронов от атома к атому.
- Степень окисления фиксирует количество перенесенных электронов, обозначая условный заряд атома.
- Степень окисления и валентность зачастую тождественны.
Данное обозначение пишется сверху химического элемента, в его правом углу, и представляет собой целое число со знаком «+» или «-». Нулевое значение степени окисления знака не несет.
2
Правила определения степени окисления
Рассмотрим основные каноны определения степени окисления:
- Простые элементарные вещества, то есть те, которые состоят из одного вида атомов, всегда будут иметь нулевую степень окисления. Например, Na0, H02, P04
- Существует ряд атомов, имеющих всегда одну, постоянную, степень окисления. Приведенные в таблице значения лучше запомнить.
| Элемент | Характерная степень окисления | Исключения |
| H | +1 | Гидриды металлов: LіH-1 |
| O | -2 | O+2F2, пероксиды (H2O2-1), надпероксиды (КО2-1), озониды (КО3-1) |
| F | -1 | |
| Al | +3 | |
| Be, Mg, Ca, Sr, Ba, Ra | +2 | |
| Li, Na, K, Rb, Cs, Fr | +1 |
- Как видно, исключение бывает лишь у водорода в соединении с металлами, где он приобретает не свойственную ему степень окисления «-1».
- Кислород также принимает степень окисления «+2» в химическом соединении с фтором и «-1» в составах перекисей, надперекисей или озонидов, где атомы кислорода соединены друг с другом.
- Ионы металлов имеют несколько значений степени окисления (причем только положительные), поэтому ее определяют по соседним элементам в соединении. Например, в FeCl3, хлор имеет степень окисления «-1», у него 3 атома, значит умножаем -1 на 3, получаем «-3». Чтобы в сумме степеней окисления соединения получась «0», железо должно иметь степень окисления «+3». В формуле FeCl2, железо, соответственно, изменит свою степень на «+2».
- Математически суммируя степени окисления всех атомов в формуле (с учетом знаков), всегда должно получаться нулевое значение. Например, в соляной кислоте H+1Cl-1 (+1 и -1 = 0), а в сернистой кислоте H2+1S+4O3-2(+1 * 2 = +2 у водорода,+4 у серы и -2 * 3 = – 6 у кислорода; в сумме +6 и -6 дают 0).
- Степень окисления одноатомного иона будет равна его заряду. Например: Na+, Ca+2.
- Наивысшая степень окисления, как правило, соотносится с номером группы в периодической системе Д.И.Менделеева.
3
Алгоритм действий определения степени окисления
Порядок нахождения степени окисления не сложен, но требует внимания и выполнения определенных действий.
Задача: расставить степени окисления в соединении KMnO4
- Первый элемент – калий, имеет постоянную степень окисления «+1».Для проверки можно посмотреть в периодическую систему, где калий находится в 1 группе элементов.
- Из оставшихся двух элементов, кислород, как правило, принимает степень окисления «-2».
- Получаем следующую формулу: К+1MnхO4-2. Остается определить степень окисления марганца.Итак, х – неизвестная нам степень окисления марганца. Теперь важно обратить внимание на количество атомов в соединении.Количество атомов калия – 1, марганца – 1, кислорода – 4.С учетом электронейтральности молекулы, когда общий (суммарный) заряд равен нулю,
1*(+1) + 1*(х) + 4(-2) = 0,+1+1х+(-8) = 0,-7+1х = 0,(при переносе меняем знак)
1х = +7, х = +7
Таким образом, степень окисления марганца в соединении равна «+7».
Задача: расставить степени окисления в соединении Fe2O3.
- Кислород, как известно, имеет степень окисления «-2» и выступает окислителем. С учетом количества атомов (3), в сумме у кислорода получается значение «-6» (-2*3= -6), т.е. умножаем степень окисления на количество атомов.
- Чтобы уравновесить формулу и привести к нулю, 2 атома железа будут иметь степень окисления «+3» (2*+3=+6).
- В сумме получаем ноль (-6 и +6 = 0).
Задача: расставить степени окисления в соединении Al(NO3)3.
- Атом алюминия – один и имеет постоянную степень окисления «+3».
- Атомов кислорода в молекуле – 9 (3*3), степень окисления кислорода, как известно «-2», значит, умножая эти значения, получаем «-18».
- Осталось уровнять отрицательные и положительные значения, определив таким образом степень окисления азота. -18 и +3, не хватает + 15. А учитывая, что имеется 3 атома азота, легко определить его степень окисления: 15 делим на 3 и получаем 5.
- Степень окисления азота «+5», а формула будет иметь вид: Al+3(N+5O-23)3
- Если сложно таким способом определять искомое значение, можно составлять и решать уравнения:
1*(+3) + 3х + 9*(-2) = 0.+3+3х-18=03х=15
х=5
Итак, степень окисления – достаточно важное понятие в химии, символизирующее состояние атомов в молекуле.
Без знания определенных положений или основ, позволяющих правильно определять степень окисления, невозможно справиться с выполнением этой задачи.
Следовательно, вывод один: досконально ознакомиться и изучить правила нахождения степени окисления, четко и лаконично представленные в статье, и смело двигаться дальше по нелегкой стезе химических премудростей.
Как определить степень окисления элементов: чему она равна и что это такое
В химических процессах главную роль играют атомы и молекулы, свойства которых определяют исход химических реакций. Одной из важных характеристик атома является окислительное число, которое упрощает метод учета переноса электронов в частице. Как определить степень окисления или формальный заряд частицы и какие правила необходимо знать для этого?
Определение
Любая химическая реакция обусловлена взаимодействием атомов различных веществ. От характеристик мельчайших частиц зависит процесс реакции и ее результат.
Термин окисление (оксидация) в химии означает реакцию, в ходе которой группа атомов или один из них теряют электроны или приобретают, в случае приобретения реакцию называют «восстановлением».
Степень окисления – это величина, которая измеряется количественно и характеризует перераспределяемые электроны в ходе реакции. Т.е.
в процессе оксидации электроны в атоме уменьшаются или увеличиваются, перераспределяясь между другими взаимодействующими частицами, и уровень оксидации показывает, как именно они реорганизуются.
Данное понятие тесно связано с электроотрицательностью частиц – их умением притягивать и отталкивать от себя свободные ионы.
! Что такое алканы: строение и химические свойства
Определение уровня оксидации зависит от характеристик и свойств конкретного вещества, поэтому нельзя однозначно назвать процедуру вычисления легкой или сложной, но ее результаты помогают условно записать процессы окислительно-восстановительных реакций. Следует понимать, что полученный результат вычислений является результатом учета переноса электронов и не имеет физического смысла, а также не является истинным зарядом ядра.
Важно знать! Неорганическая химия часто использует термин валентности вместо степени окисления элементов, это не является ошибкой, но следует учитывать, что второе понятие более универсальное.
Понятия и правила вычислений движения электронов являются основой для классификации химических веществ (номенклатура), описания их свойств и составления формул связи. Но наиболее часто данное понятие используется для описания и работы с окислительно-восстановительными реакциями.
Правила определения степени окисления
Как узнать степень окисления? При работе с окислительно-восстановительными реакциями важно знать, что формальный заряд частицы всегда будет равен величине электрона, выраженного в числовом значении.
Эта особенность связана с тем предположением, что электронные пары, образующие связь, всегда полностью смещаются в сторону более отрицательных частиц.
Следует понимать, что речь идет об ионных связях, а в случае реакции при ковалентной связи электроны будут делиться поровну между одинаковыми частицами.
Окислительное число может иметь как положительные, так и отрицательные значения.
Все дело в том, что в процессе реакции атом должен стать нейтральным, а для этого нужно либо присоединить к иону некое количество электронов, если он положительный, либо отнять их, если он отрицательный.
Для обозначения данного понятия при записи формулы обычно прописывают над обозначением элемента арабскую цифру с соответствующим знаком. Например, или и т.д.
Следует знать, что формальный заряд металлов всегда будет положительным, а в большинстве случаев, чтобы определить его, можно воспользоваться таблицей Менделеева. Существует ряд особенностей, которые необходимо учитывать, чтобы определять показатели правильно.
Как определить степень окисления
Степень оксидации:
- У простых элементов всегда равна нулю: или .
- У фтора всегда будет равна -1.
- Как и у металлов, у элементов из групп IA, IIA и IIIA групп всегда одинаковая – это номер группы, в которой они расположены.
- У кислорода в любой связи равна -2, кроме связей с пероксидами (Н2О2), когда значение равно -1 и оксидом фтора (O+2F2-1, O2+1F2-1), когда она равна +2.
- У водорода всегда +1, кроме его взаимодействия с гидридами (Na+H- и связями по типу C+4H4-1).
- У простого вещества без связей с другими элементами всегда равна нулю.
- У простого иона с одним атомом равна числу его электрона (Na+, Ca+2).
- Если рассматривается связь двух веществ различной природы (металл и неметалл), то отрицательное окислительное число будет наблюдаться у вещества, которое обладает большей электроотрицательностью (H+F-, Cu+Br-), а положительное, соответственно, у элемента с электроотрицательностью больше нуля.
- У щелочных металлов, таких как литий, натрий, калий и прочих, всегда +1.
- У металлов из главной подгруппы II (магний, барий, кальций и стронций) равна +2.
- У алюминия всегда одинаковое значение — +3.
Запомнив эти особенности, достаточно просто будет определять окислительное число у элементов, независимо от сложности и количества уровней атомов.
Как определить степень окисления
Периодическая таблица Менделеева содержит почти всю необходимую информацию для работы с химическими элементами. Например, школьники используют только ее для описания химических реакций. Так, чтобы определить максимальные положительные и отрицательные значения окислительного числа необходимо свериться с обозначением химического элемента в таблице:
- Максимально положительное – это номер группы, в которой находится элемент.
- Максимально отрицательная степень окисления – это разница между максимально положительной границей и числом 8.
Таким образом, достаточно просто узнать крайние границы формального заряда того или иного элемента. Такое действие можно совершить с помощью вычислений на основе таблицы Менделеева.
Важно знать! У одного элемента могут быть одновременно несколько различных показателей оксидации.
Различают два основных способа определения уровня оксидации, примеры которых представлены ниже. Первый из них – это способ, который требует знаний и умений применять законы химии. Как расставлять степени окисления с помощью этого способа?
Правило определения степеней окисления
Для этого необходимо:
- Определить, является ли данное вещество элементарным и находится ли оно вне связи. Если да, то его окислительное число будет равно 0, независимо от состава вещества (отдельные атомы или многоуровневые атомные соединения).
- Определить, состоит ли рассматриваемое вещество из ионов. Если да, то степень оксидации будет равна их заряду.
- Если рассматриваемое вещество металл, то посмотреть на показатели других веществ в формуле и вычислить показания металла путем арифметических действий.
- Если все соединение имеет один заряд (по сути это сумма всех частиц представленных элементов), то достаточно определить показатели простых веществ, затем вычесть их от общей суммы и получить данные металла.
- Если связь нейтральная, то общая сумма должна быть равна нулю.
! Уроки химии: что это такое галогены
Для примера можно рассмотреть объединение с ионом алюминия, чей общий заряд равен нулю. Правила химии подтверждают тот факт, что ион Cl имеет окислительное число -1, а в данном случае их три в соединении. Значит ион Al должен быть равен +3, чтобы все соединение было нейтральным.
Этот способ весьма хорош, поскольку правильность решения всегда можно проверить, если сложить все уровни оксидации вместе.
Второй метод можно применять без знания химических законов:
- Найти данные частиц, по отношению к которым нет строгих правил и точное количество их электронов неизвестно (можно путем исключения).
- Выяснить показатели всех прочих частиц и после из общей суммы путем вычитания найти нужную частицу.
Рассмотрим второй метод на примере вещества Na2SO4, в котором не определен атом серы S, известно лишь, что он отличен от нуля.
! Уроки химии: катионы и анионы – что это такое
Чтобы найти, чему равны все степени окисления необходимо:
- Найти известные элементы, помня о традиционных правилах и исключениях.
- Ион Na = +1, а каждый кислород = -2.
- Умножить количество частиц каждого вещества на их электроны и получить степени оксидации всех атомов, кроме одного.
- В Na2SO4 состоят 2 натрия и 4 кислорода, при умножении получается: 2 X +1 = 2 – это окислительное число всех частиц натрия и 4 X -2 = -8 – кислородов.
- Сложить полученные результаты 2+(-8) =-6 – это общий заряд соединения без частицы серы.
- Представить химическую запись в виде уравнения: сумма известных данных + неизвестное число = общий заряд.
- Na2SO4 представлено следующим образом: -6 + S = 0, S = 0 + 6, S = 6.
Таким образом, чтобы использовать второй метод, достаточно знать простые законы арифметики.
Таблица оксидации
Для простоты работы и вычисления показателей оксидации для каждого химического вещества используют специальные таблицы, где прописаны все данные.
Она выглядит следующим образом:
Вывод
Нахождение степени окисления для химического вещества – это простое действие, которое требует лишь внимательности и знания основных правил и исключений. Зная исключения и пользуясь специальными таблицами, это действие не будет занимать много времени.
Степень окисления
Темы кодификатора ЕГЭ: Электроотрицательность. Степень окисления и валентность химических элементов.
Когда атомы взаимодействуют и образуют химическую связь, электроны между ними в большинстве случаев распределяются неравномерно, поскольку свойства атомов различаются. Более электроотрицательный атом сильнее притягивает к себе электронную плотность.
Атом, который притянул к себе электронную плотность, приобретает частичный отрицательный заряд δ—, его «партнер» — частичный положительный заряд δ+. Если разность электроотрицательностей атомов, образующих связь, не превышает 1,7, мы называем связь ковалентной полярной.
Если разность электроотрицательностей, образующих химическую связь, превышает 1,7, то такую связь мы называем ионной.
Степень окисления – это вспомогательный условный заряд атома элемента в соединении, вычисленный из предположения, что все соединения состоят из ионов (все полярные связи – ионные).
Что значит «условный заряд»? Мы просто-напросто договариваемся, что немного упростим ситуацию: будем считать любые полярные связи полностью ионными, и будем считать, что электрон полностью уходит или приходит от одного атома к другому, даже если на самом деле это не так. А уходит условно электрон от менее электроотрицательного атома к более электроотрицательному.
Например, в связи H-Cl мы считаем, что водород условно «отдал» электрон, и его заряд стал +1, а хлор «принял» электрон, и его заряд стал -1. На самом деле таких полных зарядов на этих атомах нет.
Наверняка, у вас возник вопрос — зачем же придумывать то, чего нет? Это не коварный замысел химиков, все просто: такая модель очень удобна.
Представления о степени окисления элементов полезны при составлении классификации химических веществ, описании их свойств, составлении формул соединений и номенклатуры.
Особенно часто степени окисления используются при работе с окислительно-восстановительными реакциями.
Степени окисления бывают высшие, низшие и промежуточные.
Высшая степень окисления равна номеру группы со знаком «плюс».
Низшая определяется, как номер группы минус 8.
И промежуточная степень окисления — это почти любое целое число в интервале от низшей степени окисления до высшей.
Например, для азота характерны: высшая степень окисления +5, низшая 5 — 8 = -3, а промежуточные степени окисления от -3 до +5. Например, в гидразине N2H4 степень окисления азота промежуточная, -2.
Чаще всего степень окисления атомов в сложных веществах обозначается сначала знаком, потом цифрой, например +1, +2, -2 и т.д. Когда речь идет о заряде иона (предположим, что ион реально существует в соединении), то сначала указывают цифру, потом знак. Например: Ca2+, CO3 2-.
Для нахождения степеней окисления используют следующие правила:
- Степень окисления атомов в простых веществах равна нулю;
- В нейтральных молекулах алгебраическая сумма степеней окисления равна нулю, для ионов эта сумма равна заряду иона;
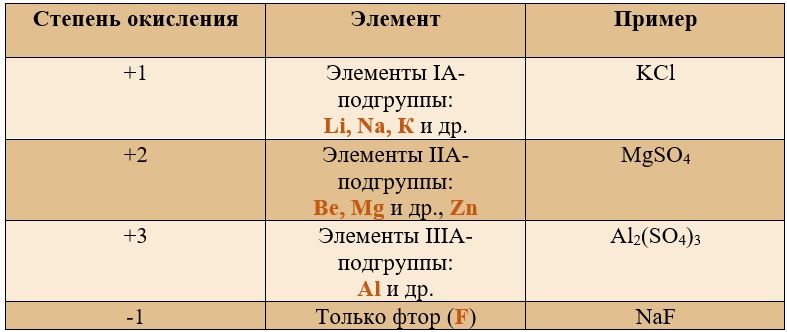
- Степень окисления щелочных металлов (элементы I группы главной подгруппы) в соединениях равна +1, степень окисления щелочноземельных металлов (элементы II группы главной подгруппы) в соединениях равна +2; степень окисления алюминия в соединениях равна +3;
- Степень окисления водорода в соединениях с металлами (солеобразные гидриды — NaH, CaH2 и др.) равна -1; в соединениях с неметаллами (летучие водородные соединения) +1;
- Степень окисления кислорода равна -2. Исключение составляют пероксиды – соединения, содержащие группу –О-О-, где степень окисления кислорода равна -1, и некоторые другие соединения (супероксиды, озониды, фториды кислорода OF2 и др.);
- Степень окисления фтора во всех сложных веществах равна -1.
Выше перечислены ситуации, когда степень окисления мы считаем постоянной. У всех остальных химических элементов степень окисления — переменная, и зависит от порядка и типа атомов в соединении.
Примеры:
Задание: определите степени окисления элементов в молекуле дихромата калия: K2Cr2O7.
Решение: степень окисления калия равна +1, степень окисления хрома обозначим, как х, степень окисления кислорода -2. Сумма всех степеней окисления всех атомов в молекуле равна 0. Получаем уравнение: +1*2+2*х-2*7=0. Решаем его, получаем степень окисления хрома +6.
В бинарных соединениях более электроотрицательный элемент характеризуется отрицательной степенью окисления, менее электроотрицательный – положительной.
Обратите внимание, что понятие степени окисления – очень условно!Степень окисления не показывает реальный заряд атома и не имеет реального физического смысла. Это упрощенная модель, которая эффективно работает, когда нам необходимо, например, уравнять коэффициенты в уравнении химической реакции, или для алгоритмизации классификации веществ.
Степень окисления – это не валентность! Степень окисления и валентность во многих случаях не совпадают. Например, валентность водорода в простом веществе Н2 равна I, а степень окисления, согласно правилу 1, равна 0.
Это базовые правила, которые помогут Вам определить степень окисления атомов в соединениях в большинстве случаев.
В некоторых ситуациях вы можете столкнуться с трудностями при определении степени окисления атома. Рассмотрим некоторые из этих ситуаций, и разберем способы их разрешения:
- В двойных (солеобразных) оксидах степень у атома, как правило, две степени окисления. Например, в железной окалине Fe3O4 у железа две степени окисления: +2 и +3. Какую из них указывать? Обе. Для упрощения можно представить это соединение, как соль: Fe(FeO2)2. При этом кислотный остаток образует атом со степенью окисления +3. Либо двойной оксид можно представить так: FeO*Fe2O3.
- В пероксосоединениях степень окисления атомов кислорода, соединенных ковалентными неполярными связями, как правило, изменяется. Например, в пероксиде водорода Н2О2, и пероксидах щелочных металлов степень окисления кислорода -1, т.к. одна из связей – ковалентная неполярная (Н-О-О-Н). Другой пример – пероксомоносерная кислота (кислота Каро) H2SO5 (см. рис.) содержит в составе два атома кислорода со степенью окисления -1, остальные атомы со степенью окисления -2, поэтому более понятной будет такая запись: H2SO3(O2). Известны также пероксосоединения хрома – например, пероксид хрома (VI) CrO(O2)2 или CrO5, и многие другие.
- Еще один пример соединений с неоднозначной степенью окисления – супероксиды (NaO2) и солеобразные озониды KO3. В этом случае уместнее говорить о молекулярном ионе O2 с зарядом -1 и и O3 с зарядом -1. Строение таких частиц описывается некоторыми моделями, которые в российской учебной программе проходят на первых курсах химических ВУЗов: МО ЛКАО, метод наложения валентных схем и др.
- В органических соединениях понятие степени окисления не очень удобно использовать, т.к. между атомами углерода существует большое число ковалентных неполярных связей. Тем не менее, если нарисовать структурную формулу молекулы, то степень окисления каждого атома также можно определить по типу и количеству атомов, с которыми данный атом непосредственно связан. Например, у первичных атомов углерода в углеводородах степень окисления равна -3, у вторичных -2, у третичных атомов -1, у четвертичных — 0.
Потренируемся определять степень окисления атомов в органических соединениях. Для этого необходимо нарисовать полную структурную формулу атома, и выделить атом углерода с его ближайшим окружением — атомами, с которыми он непосредственно соединен.
Полезные советы:
- Для упрощения расчетов можно использовать таблицу растворимости – там указаны заряды наиболее распространенных ионов. На большинстве российских экзаменов по химии (ЕГЭ, ГИА, ДВИ) использование таблицы растворимости разрешено. Это готовая шпаргалка, которая во многих случаях позволяет значительно сэкономить время.
- При расчете степени окисления элементов в сложных веществах сначала указываем степени окисления элементов, которые мы точно знаем (элементы с постоянной степенью окисления), а степень окисления элементов с переменной степенью окисления обозначаем, как х. Сумма всех зарядов всех частиц равна нулю в молекуле или равна заряду иона в ионе. Из этих данных легко составить и решить уравнение.
Валентность химических элементов. Степень окисления химических элементов – HIMI4KA
ОГЭ 2018 по химии › Подготовка к ОГЭ 2018
Валентность является сложным понятием. Этот термин претерпел значительную трансформацию одновременно с развитием теории химической связи. Первоначально валентностью называли способность атома присоединять или замещать определённое число других атомов или атомных групп с образованием химической связи.
Количественной мерой валентности атома элемента считали число атомов водорода или кислорода (данные элементы считали соответственно одно- и двухвалентными), которые элемент присоединяет, образуя гидрид формулы ЭHx или оксид формулы ЭnOm.
Так, валентность атома азота в молекуле аммиака NH3 равна трём, а атома серы в молекуле H2S равна двум, поскольку валентность атома водорода равна одному.
В соединениях Na2O, BaO, Al2O3, SiO2 валентности натрия, бария и кремния соответственно равны 1, 2, 3 и 4.
Понятие о валентности было введено в химию до того, как стало известно строение атома, а именно в 1853 году английским химиком Франклендом. В настоящее время установлено, что валентность элемента тесно связана с числом внешних электронов атомов, поскольку электроны внутренних оболочек атомов не участвуют в образовании химических связей.
В электронной теории ковалентной связи считают, что валентность атома определяется числом его неспаренных электронов в основном или возбуждённом состоянии, участвующих в образовании общих электронных пар с электронами других атомов.
Для некоторых элементов валентность является величиной постоянной. Так, натрий или калий во всех соединениях одновалентны, кальций, магний и цинк — двухвалентны, алюминий — трёхвалентен и т. д.
Но большинство химических элементов проявляют переменную валентность, которая зависит от природы элемента — партнёра и условий протекания процесса.
Так, железо может образовывать с хлором два соединения — FeCl2 и FeCl3, в которых валентность железа равна соответственно 2 и 3.
Степень окисления — понятие, характеризующее состояние элемента в химическом соединении и его поведение в окислительно-восстановительных реакциях; численно степень окисления равна формальному заряду, который можно приписать элементу, исходя из предположения, что все электроны каждой его связи перешли к более электроотрицательному атому.
Электроотрицательность — мера способности атома к приобретению отрицательного заряда при образовании химической связи или способность атома в молекуле притягивать к себе валентные электроны, участвующие в образовании химической связи. Электроотрицательность не является абсолютной величиной и рассчитывается различными методами. Поэтому приводимые в разных учебниках и справочниках значения электроотрицательности могут отличаться.
В таблице 2 приведена электроотрицательность некоторых химических элементов по шкале Сандерсона, а в таблице 3 — электроотрицательность элементов по шкале Полинга.
Значение электроотрицательности приведено под символом соответствующего элемента. Чем больше численное значение электроотрицательности атома, тем более электроотрицательным является элемент. Наиболее электроотрицательным является атом фтора, наименее электроотрицательным — атом рубидия.
В молекуле, образованной атомами двух разных химических элементов, формальный отрицательный заряд будет у атома, численное значение электроотрицательности у которого будет выше. Так, в молекуле диоксида серы SO2 электроотрицательность атома серы равна 2,5, а значение электроотрицательности атома кислорода больше — 3,5.
Следовательно, отрицательный заряд будет на атоме кислорода, а положительный — на атоме серы.
В молекуле аммиака NH3 значение электроотрицательности атома азота равно 3,0, а водорода — 2,1. Поэтому отрицательный заряд будет у атома азота, а положительный — у атома водорода.
Следует чётко знать общие тенденции изменения электроотрицательности.
Поскольку атом любого химического элемента стремится приобрести устойчивую конфигурацию внешнего электронного слоя — октетную оболочку инертного газа, то электроотрицательность элементов в периоде увеличивается, а в группе электроотрицательность в общем случае уменьшается с увеличением атомного номера элемента. Поэтому, например, сера более электроотрицательна по сравнению с фосфором и кремнием, а углерод более электроотрицателен по сравнению с кремнием.
При составлении формул соединений, состоящих из двух неметаллов, более электроотрицательный из них всегда ставят правее: PCl3, NO2. Из этого правила есть некоторые исторически сложившиеся исключения, например NH3, PH3 и т.д.
Степень окисления обычно обозначают арабской цифрой (со знаком перед цифрой), расположенной над символом элемента, например:
Для определения степени окисления атомов в химических соединениях руководствуются следующими правилами:
- Степень окисления элементов в простых веществах равна нулю.
- Алгебраическая сумма степеней окисления атомов в молекуле равна нулю.
- Кислород в соединениях проявляет главным образом степень окисления, равную –2 (во фториде кислорода OF2 + 2, в пероксидах металлов типа M2O2 –1).
- Водород в соединениях проявляет степень окисления + 1, за исключением гидридов активных металлов, например, щелочных или щёлочноземельных, в которых степень окисления водорода равна – 1.
- У одноатомных ионов степень окисления равна заряду иона, например: K+ — +1, Ba2+ — +2, Br– — –1, S2– — –2 и т. д.
- В соединениях с ковалентной полярной связью степень окисления более электроотрицательного атома имеет знак минус, а менее электроотрицательного — знак плюс.
- В органических соединениях степень окисления водорода равна +1.
Проиллюстрируем вышеприведённые правила несколькими примерами.
Пример 1. Определить степень окисления элементов в оксидах калия K2O, селена SeO3 и железа Fe3O4.
Оксид калия K2O. Алгебраическая сумма степеней окисления атомов в молекуле равна нулю. Степень окисления кислорода в оксидах равна –2. Обозначим степень окисления калия в его оксиде за n, тогда 2n + (–2) = 0 или 2n = 2, отсюда n = +1, т. е. степень окисления калия равна +1.
Оксид селена SeO3. Молекула SeO3 электронейтральна. Суммарный отрицательный заряд трёх атомов кислорода составляет –2 × 3 = –6. Следовательно, чтобы уравнять этот отрицательный заряд до ноля, степень окисления селена должна быть равна +6.
Молекула Fe3O4 электронейтральна. Суммарный отрицательный заряд четырёх атомов кислорода составляет –2 × 4 = –8. Чтобы уравнять этот отрицательный заряд, суммарный положительный заряд на трёх атомах железа должен быть равен +8. Следовательно, на одном атоме железа должен быть заряд 8/3 = +8/3.
Следует подчеркнуть, что степень окисления элемента в соединении может быть дробным числом. Такие дробные степени окисления не имеют смысла при объяснении связи в химическом соединении, но могут быть использованы для составления уравнений окислительно-восстановительных реакций.
Пример 2. Определить степень окисления элементов в соединениях NaClO3, K2Cr2O7.
Молекула NaClO3 электронейтральна. Степень окисления натрия равна +1, степень окисления кислорода равна –2. Обозначим степень окисления хлора за n, тогда +1 + n + 3 × (–2) = 0, или +1 + n – 6 = 0, или n – 5 = 0, отсюда n = +5. Таким образом, степень окисления хлора равна +5.
Молекула K2Cr2O7 электронейтральна. Степень окисления калия равна +1, степень окисления кислорода равна –2. Обозначим степень окисления хрома за n, тогда 2 × 1 + 2n + 7 × (–2) = 0, или +2 + 2n – 14 = 0, или 2n – 12 = 0, 2n = 12, отсюда n = +6. Таким образом, степень окисления хрома равна +6.
Пример 3. Определим степени окисления серы в сульфат-ионе SO42–. Ион SO42– имеет заряд –2. Степень окисления кислорода равна –2. Обозначим степень окисления серы за n, тогда n + 4 × (–2) = –2, или n – 8 = –2, или n = –2 – (–8), отсюда n = +6. Таким образом, степень окисления серы равна +6.
Следует помнить, что степень окисления иногда не равна валентности данного элемента.
Например, степени окисления атома азота в молекуле аммиака NH3 или в молекуле гидразина N2H4 равны –3 и –2 соответственно, тогда как валентность азота в этих соединениях равна трём.
Максимальная положительная степень окисления для элементов главных подгрупп, как правило, равна номеру группы (исключения: кислород, фтор и некоторые другие элементы).
Максимальная отрицательная степень окисления равна 8 — номер группы.
Тренировочные задания
1. В каком соединении степень окисления фосфора равна +5?
1) HPO3
2) H3PO3
3) Li3P
4) AlP
2. В каком соединении степень окисления фосфора равна –3?
1) HPO3
2) H3PO3
3) Li3PO4
4) AlP
3. В каком соединении степень окисления азота равна +4?
1) HNO2
2) N2O4
3) N2O
4) HNO3
4. В каком соединении степень окисления азота равна –2?
1) NH3
2) N2H4
3) N2O5
4) HNO2
5. В каком соединении степень окисления серы равна +2?
1) Na2SO3
2) SO2
3) SCl2
4) H2SO4
6. В каком соединении степень окисления серы равна +6?
1) Na2SO3
2) SO3
3) SCl2
4) H2SO3
7. В веществах, формулы которых CrBr2, K2Cr2O7, Na2CrO4, степень окисления хрома соответственно равна
1) +2, +3, +6 2) +3, +6, +6 3) +2, +6, +5
4) +2, +6, +6
8. Минимальная отрицательная степень окисления химического элемента, как правило, равна
1) номеру периода 2) порядковому номеру химического элемента 3) числу электронов, недостающих до завершения внешнего электронного слоя
4) общему числу электронов в элементе
9. Максимальная положительная степень окисления химических элементов, расположенных в главных подгруппах, как правило, равна
1) номеру периода 2) порядковому номеру химического элемента 3) номеру группы
4) общему числу электронов в элементе
10. Фосфор проявляет максимальную положительную степень окисления в соединении
1) HPO3
2) H3PO3
3) Na3P
4) Ca3P2
11. Фосфор проявляет минимальную степень окисления в соединении
1) HPO3
2) H3PO3
3) Na3PO4
4) Ca3P2
12. Атомы азота в нитрите аммония, находящиеся в составе катиона и аниона, проявляют степени окисления соответственно
1) –3, +3 2) –3, +5 3) +3, –3
4) +3, +5
13. Валентность и степень окисления кислорода в перекиси водорода соответственно равны
1) II, –2 2) II, –1 3) I, +4
4) III, –2
14. Валентность и степень окисления серы в пирите FeS2 соответственно равны
1) IV, +5 2) II, –1 3) II, +6
4) III, +4
15. Валентность и степень окисления атома азота в бромиде аммония соответственно равны
1) IV, –3 2) III, +3 3) IV, –2
4) III, +4
16. Атом углерода проявляет отрицательную степень окисления в соединении с
1) кислородом 2) натрием 3) фтором
4) хлором
17. Постоянную степень окисления в своих соединениях проявляет
1) стронций 2) железо 3) сера
4) хлор
18. Степень окисления +3 в своих соединениях могут проявлять
1) хлор и фтор 2) фосфор и хлор 3) углерод и сера
4) кислород и водород
19. Степень окисления +4 в своих соединениях могут проявлять
1) углерод и водород 2) углерод и фосфор 3) углерод и кальций
4) азот и сера
20. Степень окисления, равную номеру группы, в своих соединениях проявляет
1) хлор 2) железо 3) кислород
4) фтор
Ответы
Степени окисления элементов. Как найти степени окисления?
Чтобы правильно расставлять степени окисления, необходимо держать в голове четыре правила.
1) В простом веществе степень окисления любого элемента равна 0. Примеры: Na0, H02, P04.
2) Следует запомнить элементы, для которых характерны постоянные степени окисления. Все они перечислены в таблице.
| Элемент | Характерная степень окисления | Исключения |
| H | +1 | Гидриды металлов: LIH-1 |
| F | -1 | F2 |
| O | -2 | F2O+2; пероксиды, надпероксиды, озониды |
| Li, Na, K, Rb, Cs, Fr | +1 | |
| Be, Mg, Ca, Sr, Ba, Ra | +2 | |
| Al | +3 |
3) Высшая степень окисления элемента, как правило, совпадает с номером группы, в которой находится данный элемент (например, фосфор находится в V группе, высшая с. о. фосфора равна +5). Важные исключения: F, O.
4) Поиск степеней окисления остальных элементов основан на простом правиле:
В нейтральной молекуле сумма степеней окисления всех элементов равна нулю, а в ионе — заряду иона.
Пример 1. Необходимо найти степени окисления элементов в аммиаке (NH3).
Решение. Мы уже знаем (см. 2), что ст. ок. водорода равна +1. Осталось найти эту характеристику для азота. Пусть х — искомая степень окисления. Составляем простейшее уравнение: х + 3 • (+1) = 0. Решение очевидно: х = -3. Ответ: N-3H3+1.
Пример 2. Укажите степени окисления всех атомов в молекуле H2SO4.
Решение. Степени окисления водорода и кислорода уже известны: H(+1) и O(-2). Составляем уравнение для определения степени окисления серы: 2 • (+1) + х + 4 • (-2) = 0. Решая данное уравнение, находим: х = +6. Ответ: H+12S+6O-24.
Пример 3. Рассчитайте степени окисления всех элементов в молекуле Al(NO3)3.
Решение. Алгоритм остается неизменным. В состав «молекулы» нитрата алюминия входит один атом Al(+3), 9 атомов кислорода (-2) и 3 атома азота, степень окисления которого нам и предстоит вычислить. Соответствующее уравнение: 1 • (+3) + 3х + 9 • (-2) = 0. Ответ: Al+3(N+5O-23)3.
Пример 4. Определите степени окисления всех атомов в ионе (AsO4)3-.
Решение. В данном случае сумма степеней окисления будет равна уже не нулю, а заряду иона, т. е., -3. Уравнение: х + 4 • (-2) = -3. Ответ: As(+5), O(-2).
Что делать, если неизвестны степени окисления двух элементов
А можно ли определить степени окисления сразу нескольких элементов, пользуясь похожим уравнением? Если рассматривать данную задачу с точки зрения математики, ответ будет отрицательным. Линейное уравнение с двумя переменными не может иметь однозначного решения. Но ведь мы решаем не просто уравнение!
Пример 5. Определите степени окисления всех элементов в (NH4)2SO4.
Решение. Степени окисления водорода и кислорода известны, серы и азота — нет. Классический пример задачи с двумя неизвестными! Будем рассматривать сульфат аммония не как единую «молекулу», а как объединение двух ионов: NH4+ и SO42-.
Заряды ионов нам известны, в каждом из них содержится лишь один атом с неизвестной степенью окисления. Пользуясь опытом, приобретенным при решении предыдущих задач, легко находим степени окисления азота и серы. Ответ: (N-3H4+1)2S+6O4-2.
Вывод: если в молекуле содержится несколько атомов с неизвестными степенями окисления, попробуйте «разделить» молекулу на несколько частей.
Как расставлять степени окисления в органических соединениях
Пример 6. Укажите степени окисления всех элементов в CH3CH2OH.
Решение. Нахождение степеней окисления в органических соединениях имеет свою специфику. В частности, необходимо отдельно находить степени окисления для каждого атома углерода. Рассуждать можно следующим образом. Рассмотрим, например, атом углерода в составе метильной группы.
Данный атом С соединен с 3 атомами водорода и соседним атомом углерода. По связи С-Н происходит смещение электронной плотности в сторону атома углерода (т. к. электроотрицательность С превосходит ЭО водорода). Если бы это смещение было полным, атом углерода приобрел бы заряд -3.
Атом С в составе группы -СН2ОН связан с двумя атомами водорода (смещение электронной плотности в сторону С), одним атомом кислорода (смещение электронной плотности в сторону О) и одним атомом углерода (можно считать, что смещения эл. плотности в этом случае не происходит). Степень окисления углерода равна -2 +1 +0 = -1.
Ответ: С-3H+13C-1H+12O-2H+1.
Не смешивайте понятия «валентность» и «степень окисления»!
Степень окисления часто путают с валентностью. Не совершайте подобной ошибки. Перечислю основные отличия:
- степень окисления имеет знак (+ или -), валентность — нет;
- степень окисления может быть равна нулю даже в сложном веществе, равенство валентности нулю означает, как правило, что атом данного элемента не соединен с другими атомами (всякого рода соединения включения и прочую «экзотику» здесь обсуждать не будем);
- степень окисления — формальное понятие, которое приобретает реальный смысл лишь в соединениях с ионными связями, понятие «валентность», наоборот, наиболее удобно применять по отношению к ковалентным соединениям.
Степень окисления (точнее, ее модуль) часто численно равен валентности, но еще чаще эти величины НЕ совпадают. Например, степень окисления углерода в CO2 равна +4; валентность С также равна IV. А вот в метаноле (CH3OH) валентность углерода остается той же, а степень окисления С равна -1.
Небольшой тест на тему «Степень окисления»
Потратьте несколько минут, проверьте, как вы усвоили эту тему. Вам необходимо ответить на пять несложных вопросов. Успехов!
Для желающих еще немного потренироваться рекомендую соответствующий тематический тест.
Темы кодификатора ЕГЭ: Электроотрицательность. Степень окисления и валентность химических элементов.
Когда атомы взаимодействуют и образуют химическую связь, электроны между ними в большинстве случаев распределяются неравномерно, поскольку свойства атомов различаются. Более электроотрицательный атом сильнее притягивает к себе электронную плотность. Атом, который притянул к себе электронную плотность, приобретает частичный отрицательный заряд δ—, его «партнер» — частичный положительный заряд δ+. Если разность электроотрицательностей атомов, образующих связь, не превышает 1,7, мы называем связь ковалентной полярной. Если разность электроотрицательностей, образующих химическую связь, превышает 1,7, то такую связь мы называем ионной.
Степень окисления – это вспомогательный условный заряд атома элемента в соединении, вычисленный из предположения, что все соединения состоят из ионов (все полярные связи – ионные).
Что значит «условный заряд»? Мы просто-напросто договариваемся, что немного упростим ситуацию: будем считать любые полярные связи полностью ионными, и будем считать, что электрон полностью уходит или приходит от одного атома к другому, даже если на самом деле это не так. А уходит условно электрон от менее электроотрицательного атома к более электроотрицательному.
Например, в связи H-Cl мы считаем, что водород условно «отдал» электрон, и его заряд стал +1, а хлор «принял» электрон, и его заряд стал -1. На самом деле таких полных зарядов на этих атомах нет.
Наверняка, у вас возник вопрос — зачем же придумывать то, чего нет? Это не коварный замысел химиков, все просто: такая модель очень удобна. Представления о степени окисления элементов полезны при составлении классификации химических веществ, описании их свойств, составлении формул соединений и номенклатуры. Особенно часто степени окисления используются при работе с окислительно-восстановительными реакциями.
Степени окисления бывают высшие, низшие и промежуточные.
Высшая степень окисления равна номеру группы со знаком «плюс».
Низшая определяется, как номер группы минус 8.
И промежуточная степень окисления — это почти любое целое число в интервале от низшей степени окисления до высшей.
Например, для азота характерны: высшая степень окисления +5, низшая 5 — 8 = -3, а промежуточные степени окисления от -3 до +5. Например, в гидразине N2H4 степень окисления азота промежуточная, -2.
Чаще всего степень окисления атомов в сложных веществах обозначается сначала знаком, потом цифрой, например +1, +2, -2 и т.д. Когда речь идет о заряде иона (предположим, что ион реально существует в соединении), то сначала указывают цифру, потом знак. Например: Ca2+, CO3 2-.
Для нахождения степеней окисления используют следующие правила:
- Степень окисления атомов в простых веществах равна нулю;
- В нейтральных молекулах алгебраическая сумма степеней окисления равна нулю, для ионов эта сумма равна заряду иона;
- Степень окисления щелочных металлов (элементы I группы главной подгруппы) в соединениях равна +1, степень окисления щелочноземельных металлов (элементы II группы главной подгруппы) в соединениях равна +2; степень окисления алюминия в соединениях равна +3;
- Степень окисления водорода в соединениях с металлами (солеобразные гидриды — NaH, CaH2 и др.) равна -1; в соединениях с неметаллами (летучие водородные соединения) +1;
- Степень окисления кислорода равна -2. Исключение составляют пероксиды – соединения, содержащие группу –О-О-, где степень окисления кислорода равна -1, и некоторые другие соединения (супероксиды, озониды, фториды кислорода OF2 и др.);
- Степень окисления фтора во всех сложных веществах равна -1.
Выше перечислены ситуации, когда степень окисления мы считаем постоянной. У всех остальных химических элементов степень окисления — переменная, и зависит от порядка и типа атомов в соединении.
Примеры:
Задание: определите степени окисления элементов в молекуле дихромата калия: K2Cr2O7.
Решение: степень окисления калия равна +1, степень окисления хрома обозначим, как х, степень окисления кислорода -2. Сумма всех степеней окисления всех атомов в молекуле равна 0. Получаем уравнение: +1*2+2*х-2*7=0. Решаем его, получаем степень окисления хрома +6.
В бинарных соединениях более электроотрицательный элемент характеризуется отрицательной степенью окисления, менее электроотрицательный – положительной.
Обратите внимание, что понятие степени окисления – очень условно! Степень окисления не показывает реальный заряд атома и не имеет реального физического смысла. Это упрощенная модель, которая эффективно работает, когда нам необходимо, например, уравнять коэффициенты в уравнении химической реакции, или для алгоритмизации классификации веществ.
Степень окисления – это не валентность! Степень окисления и валентность во многих случаях не совпадают. Например, валентность водорода в простом веществе Н2 равна I, а степень окисления, согласно правилу 1, равна 0.
Это базовые правила, которые помогут Вам определить степень окисления атомов в соединениях в большинстве случаев.
В некоторых ситуациях вы можете столкнуться с трудностями при определении степени окисления атома. Рассмотрим некоторые из этих ситуаций, и разберем способы их разрешения:
- В двойных (солеобразных) оксидах степень у атома, как правило, две степени окисления. Например, в железной окалине Fe3O4 у железа две степени окисления: +2 и +3. Какую из них указывать? Обе. Для упрощения можно представить это соединение, как соль: Fe(FeO2)2. При этом кислотный остаток образует атом со степенью окисления +3. Либо двойной оксид можно представить так: FeO*Fe2O3.
- В пероксосоединениях степень окисления атомов кислорода, соединенных ковалентными неполярными связями, как правило, изменяется. Например, в пероксиде водорода Н2О2, и пероксидах щелочных металлов степень окисления кислорода -1, т.к. одна из связей – ковалентная неполярная (Н-О-О-Н). Другой пример – пероксомоносерная кислота (кислота Каро) H2SO5 (см. рис.) содержит в составе два атома кислорода со степенью окисления -1, остальные атомы со степенью окисления -2, поэтому более понятной будет такая запись: H2SO3(O2). Известны также пероксосоединения хрома – например, пероксид хрома (VI) CrO(O2)2 или CrO5, и многие другие.
- Еще один пример соединений с неоднозначной степенью окисления – супероксиды (NaO2) и солеобразные озониды KO3. В этом случае уместнее говорить о молекулярном ионе O2 с зарядом -1 и и O3 с зарядом -1. Строение таких частиц описывается некоторыми моделями, которые в российской учебной программе проходят на первых курсах химических ВУЗов: МО ЛКАО, метод наложения валентных схем и др.
- В органических соединениях понятие степени окисления не очень удобно использовать, т.к. между атомами углерода существует большое число ковалентных неполярных связей. Тем не менее, если нарисовать структурную формулу молекулы, то степень окисления каждого атома также можно определить по типу и количеству атомов, с которыми данный атом непосредственно связан. Например, у первичных атомов углерода в углеводородах степень окисления равна -3, у вторичных -2, у третичных атомов -1, у четвертичных — 0.
Потренируемся определять степень окисления атомов в органических соединениях. Для этого необходимо нарисовать полную структурную формулу атома, и выделить атом углерода с его ближайшим окружением — атомами, с которыми он непосредственно соединен.
Полезные советы:
- Для упрощения расчетов можно использовать таблицу растворимости – там указаны заряды наиболее распространенных ионов. На большинстве российских экзаменов по химии (ЕГЭ, ГИА, ДВИ) использование таблицы растворимости разрешено. Это готовая шпаргалка, которая во многих случаях позволяет значительно сэкономить время.
- При расчете степени окисления элементов в сложных веществах сначала указываем степени окисления элементов, которые мы точно знаем (элементы с постоянной степенью окисления), а степень окисления элементов с переменной степенью окисления обозначаем, как х. Сумма всех зарядов всех частиц равна нулю в молекуле или равна заряду иона в ионе. Из этих данных легко составить и решить уравнение.
Тренировочный тест по теме «Степени окисления и валентность» 10 вопросов, при каждом прохождении новые.
201
Создан на
07 января, 2022 От Admin
Тренировочный тест “Степени окисления”
1 / 10
1) Al 2) Sr 3) In 4) Tl 5) C
Из числа указанных в ряду элементов выберите два элемента, каждый из которых может образовать оксид с общей формулой ЭО.
Запишите в поле ответа номера выбранных элементов.
2 / 10
1) Al 2) Si 3) Mg 4) C 5) N
Из числа указанных в ряду элементов выберите два элемента, которые в соединениях проявляют постоянную степень окисления.
3 / 10
1) С 2) N 3) F 4) Be 5) Ne
Из числа указанных в ряду элементов выберите два элемента, которые не проявляют положительной степени окисления.
4 / 10
1) N 2) He 3) C 4) F 5) Be
Из числа указанных в ряду элементов выберите два элемента, которые не проявляют отрицательной степени окисления.
5 / 10
1) Ca 2) Cl 3) Si 4) S 5) Mn
Из числа указанных в ряду элементов выберите два элемента, степень окисления которых в высших гидроксидах равна +7.
6 / 10
1) S 2) Si 3) Ne 4) Al 5) Mg
Из числа указанных в ряду элементов выберите два элемента, которые в соединениях могут проявлять отрицательную степень окисления.
7 / 10
1) N 2) С 3) B 4) Na 5) Al
Из числа указанных в ряду элементов выберите два элемента, степень окисления которых в оксидах может принимать значение +1.
8 / 10
1) Cl 2) Sr 3) Se 4) P 5) K
Из числа указанных в ряду элементов выберите два элемента, которые в составе образованных ими кислородсодержащих анионов могут иметь одинаковую степень окисления.
9 / 10
1) S 2) Ca 3) Mn 4) Al 5) Cl
Из числа указанных в ряду элементов выберите два элемента, которые в высших оксидах проявляют одинаковую степень окисления.
10 / 10
1) Na 2) S 3) F 4) V 5) Si
Из числа указанных в ряду элементов выберите два элемента, которые в образованных ими анионах с общей формулой ЭOx2− могут иметь одинаковую степень окисления.
Ваша оценка
The average score is 57%
Как определить степень окисления
Материал по химии
Что такое степень окисления?
Степень окисления – это условная величина, отражающая количество принятых или отданных электронов при образовании заряженной частицы из электронейтрального атома при условии, что электроны переходят от одного атома к другому полностью.
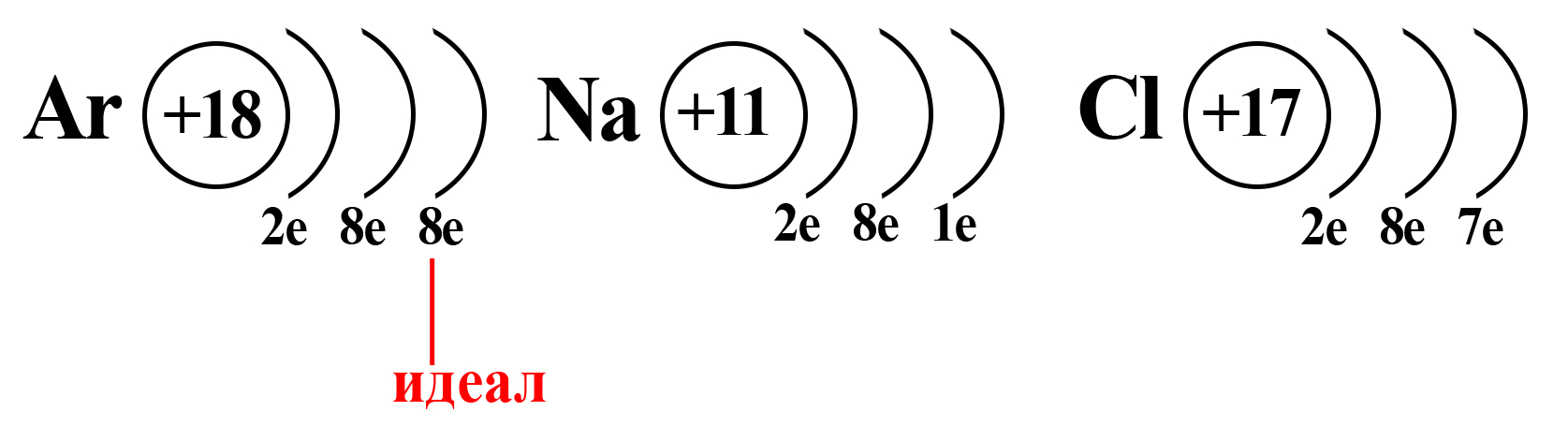
Вспомним, что идеальное количество электронов на внешнем электронном уровне атома равно восьми. Такую конфигурацию внешнего слоя имеют атомы большинства благородных газов (кроме гелия). И к такой электронной конфигурации стремятся атомы других элементов.
Как определить степень окисления
Конфигурация благородного газа
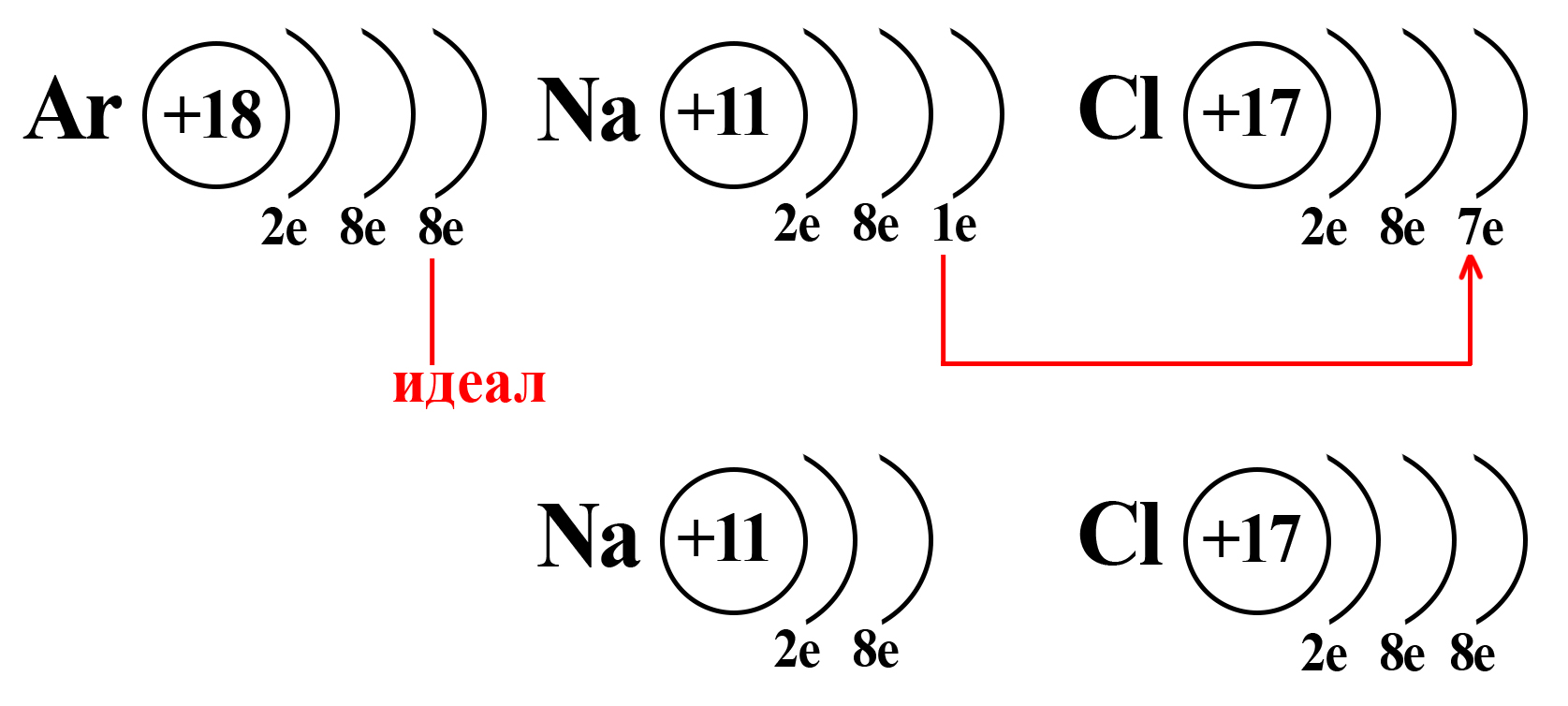
Натрий и хлор не так далеки от «идеала», как может показаться. Если атомы этих элементов столкнуться, внешний электрон натрия притянется на внешний электронный уровень хлора (из-за большей электроотрицательности хлора):
Таким образом, натрий и хлор как будто вступают в симбиоз: натрию, для приобретения «благородной» конфигурации необходимо избавиться от внешнего электрона (при потере внешнего электрона теряется и внешний уровень, а предвнешний уровень, имеющий идеальное количество электронов, становится внешним), тогда как хлору необходимо получить один электрон, чтобы завершить внешний энергетический уровень.
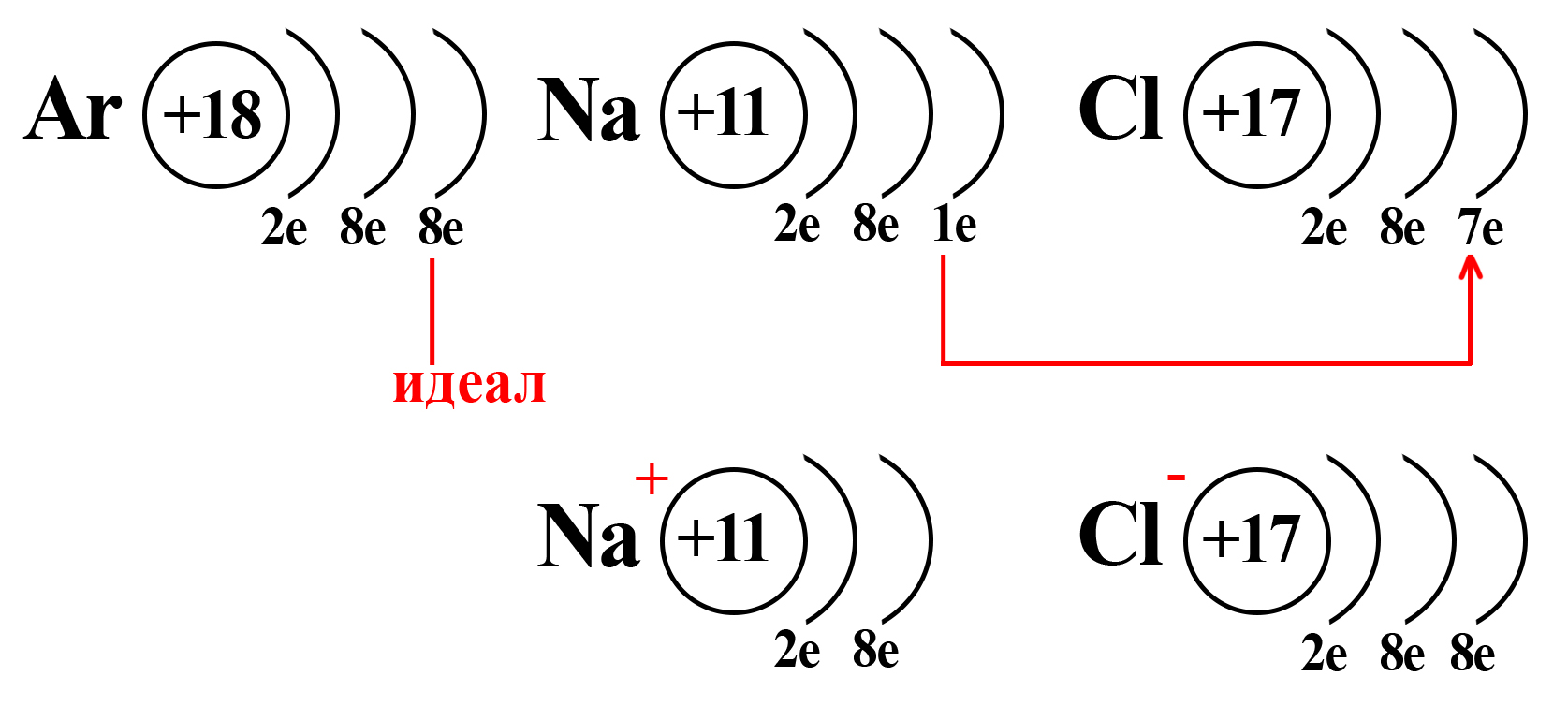
Потеряв один электрон, натрий приобретает положительный заряд, становится катионом (положительно заряженной частицей). Это объясняется тем, что ядро натрия по-прежнему имеет 11 протонов, а вот электронная оболочка, после взаимодействия с хлором, содержит 10 электронов. Таким образом, натрий будет иметь 11 положительно заряженных частиц и 10 отрицательно заряженных частиц. По простейшему уравнению: +11 – 10 = +1, становится ясно, откуда взялся положительный заряд.
Аналогичный расчет можно привести и для хлора. После взаимодействия с натрием ядро атома хлора не изменяется, оно содержит 17 положительно заряженных частиц (протонов), а оболочка – 18 отрицательно заряженных частиц (электронов). +17 – 18 = ‒1.
Полученные заряды и являются степенями окисления.
Также степень окисления можно выразить количеством электронов, которые иону нужно получить или отдать для того, чтобы стать электронейтральным атомом. Так, катион натрия, имеющий заряд «+1», должен получить 1 электрон, чтобы превратиться в атом натрия: Na+ +1ē = Na0. А анион хлора (хлорид-ион), имеющий заряд «‒1» должен отдать один электрон: Cl– -1ē = Cl0.
Для упрощения понятие «степень окисления» применяется не только для веществ с ионным строением (металл + неметалл), но и для веществ с ковалентными полярными связями. Несмотря на то, что в таком типе связи полного перехода электронов от одного атома к другому не происходит, полученные частичные заряды превращаются в целые.
Постоянные степени окисления.
Знания этой простой, базовой темы помогут Вам решать не только тестовые задания. Одно из самых сложных заданий ЕГЭ – расстановка коэффициентов с помощью электронного баланса – не решается без знания степеней окисления.
Таблица «Элементы, имеющие постоянную степень окисления»
Таблица «Наиболее популярные степени окисления у остальных элементов» (Выделены бурым)*
*В таблице указаны не все возможные степени окисления.
Таким образом, медь, серебро, золото и железо не проявляют высшей степени окисления, равной номеру группы, у остальных же элементов высшая степень окисления равна номеру группы.
Для определения степени окисления не нужно учить всю таблицу, и тем более все степени окисления. Они приведены для справки, наиболее важными являются:
Определение степеней окисления в бинарных соединениях
Для примера возьмём оксид фосфора (P2O5)
- Определим степень окисления известного элемента (в нашем случае это кислород).
- Условно разделим молекулу на две части: чаще всего первая часть молекулы положительная, а вторая – отрицательная (искл: NH3 и PH3).
- Индекс после кислорода указывает на, что в молекуле содержится пять атомов кислорода, каждый из них имеет степень окисления «-2», поэтому общее количество отрицательных зарядов будет равно «-10».
- Молекула должна быть электронейтральной, то есть количество положительных и отрицательных зарядов должны быть равными. Из этого следует, что все атомы фосфора в данной молекуле в сумме должны иметь десять положительных зарядов.
- Индекс «2» после фосфора означает, что в молекуле содержится два атома фосфора, между которыми поровну нужно разделить общий положительный заряд (+10:2=+5)
Аналогичным образом происходит определение степени окисления в более сложных веществах, для примера возьмём перманганат калия (KMnO4):
- Подпишем степени окисления для элементов, имеющих постоянные их значения:
- Разделим молекулу на положительный и отрицательный «полюс» (в соединениях, состоящих из атомов трех элементов, чаще всего первые два являются положительными, а третий – отрицательным).
- Посчитаем общее количество положительных и отрицательных зарядов с учетом индексов:
- Ответим на вопрос: какого количества плюсов не хватает, что бы положительные и отрицательные заряды имели одинаковое значение? До +8 не хватает семи положительных зарядов, откуда следует, что степень окисления марганца равна «+7».
Ну и напоследок разберем степени окисления элементов в дихромате калия (K2Cr2O7):
- Подписываем известные степени окисления:
- Делим молекулу на положительную и отрицательную части:
- Считаем общее количество «плюсов» и «минусов»:
- Подсчитываем, сколько положительных зарядов не достает для того, чтобы молекула стала электронейтральной (т. е. такой молекулой, в которой количество положительных и отрицательных зарядов было одинаковым):
- Так как молекула содержит два атома хрома, двенадцать положительных зарядов должны распределиться между ними поровну, то есть, каждый хром имеет заряд +6:
Как быть, если в формуле встретились скобки? Например, как посчитать степень окисления брома в пербромате кальция?
- Для начала определим все известные степени окисления, как делали в предыдущих примерах:
- Посчитаем сумму положительных и отрицательных зарядов. Важно учесть все индексы. Помните, что индекс. Расположенный за атомом действует только на этот атом, а индекс, расположенный за скобкой, действует на всё содержимое скобок:
Таким образом, в пербромате кальция содержится: один атом кальция, два атома брома и 8 атомов кислорода (индексы, относящиеся к одному и тому же атому перемножаются).
Следовательно, мы имеем два положительных заряда от кальция и шестнадцать отрицательных от кислорода. Так как индекс «2» за скобками действует и на бром, его заряд можно выразить как 2х.
Получаем уравнение:
2 + 2х ‒ 16 = 0
2х = 14
х = 7
Степень окисления брома в пербромате кальция равна «+7».