Комплексные соединения
Общая химия. Учебное пособие — Таирова А.Р., Кузнецов А.И. — 2005
- 9.1. Определение комплексных соединений
- 9.2. Комплексообразователи
- 9.3.Лиганды
- 9.4. Номенклатура комплексных соединений
- 9.5. Диссоциация комплексных соединений
- 9.6. Константы устойчивости комплексов
- 9.7.Роль комплексных соединений
- 9.8. Комплексонометрия. Жесткость воды
9.1. Определение комплексных соединений. Такие соединения, как оксиды, кислоты, основания, соли образованы из атомов в результате возникновения между ними химической связи. Это соединения обычные, или соединения первого порядка.
Однако имеются вещества, которые образованы в результате соединения друг с другом нейтральных молекул без возникновения новых связующих электронных пар. Например:
K2S04 + A12 (S04)3 = K2S04·AI2 (SО4)3 = 2KA1 (SO4)2
CuSO4 + 5H2O = CuSO4 · 5H2O
CuS04 + 4NH3 = CuSО4·4NH3 = [Cu (NH3)4] SO4
Fe (CN)3 + 3KCN = Fe (CN)3·3KCN = K3 [Fe (CN)6]
HgI2 + 2KI = HgI2·2KI = K2[HgI4]
Это молекулярные соединения, или соединения высшего порядка. Одни из них диссоциируют в водном растворе на простые ноны, например:
КА1 (SО4)2 ↔ K+ + А13+ + 2 SО42 —
другие — на сложные (комплексные) ионы, состоящие, в свою очередь, из более простых ионов, как, например:
К3 [Fe (CN)6] ↔ЗК + + [Fe (CN)6]3-
Молекулярные соединения, образующие комплексные ионы, способные к существованию как в растворе, так и в кристалле, называют комплексными. Но такое определение применимо лишь в известных пределах. Оно не охватывает соединений типа неэлектролитов, например карбонилов металлов —Ni(CO)4 и др., а потому не является и полным.
Чтобы объяснить, почему происходит присоединение одних простых молекул к другим, швейцарский химик А. Вернер ввел понятие о главной и побочной валентности. Тогда образование, скажем, K2[HgI4] можho представить так: ион ртути за счет своей главной валентности (обозначается сплошной линией), равной двум, присоединяет два иодид-иона, а за счет побочной — (обозначается пунктиром) — дополнительно еще два иодид-иона. По Вернеру, это может быть изображено формулой
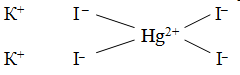
В настоящее время главную валентность надо объяснить ионной или ковалентной связью, а побочную – ковалентной связью, возникшей по донорно-акцепторному механизму (см. раздел 4.8.2.). Исходя из механизма образования комплексных соединений, им можно дать более точное, не имеющее исключений определение: комплексные соединения – это соединения, характеризующиеся наличием хотя бы одной ковалентной связи, возникшей по донорно-акцепторному механизму.
Комплексообразование происходит во всех случаях, когда из менее сложных систем образуются системы более сложные. Согласно координационной теории А. Вернера в структуре комплексного соединения различают координационную (внутреннюю) сферу, состоящую из центральной частицы – комплексообразователя (ион или атом) – и окружающих ее лигандов (ионы противоположного знака или молекулы). Ионы, находящиеся за пределами координационной сферы, образуют внешнюю сферу комплексного соединения. Число лигандов вокруг комплексообразователя называется его координационным числом. Внутренняя сфера (комплекс) может быть анионом, катионом и не иметь заряда. Например, в комплексном соединении K3[Fe(CN)6] внешняя сфера – 3К+, внутренняя сфера [Fe(CN)6]3-, где Fe3+ — комплексообразователь, a 6CN – лиганды, причем, 6 – координационное число. Таким образом, комплексное соединение (как правило) в узлах кристаллической решетки содержит комплекс, способный к самостоятельному существованию и в растворе.
9.2. Комплексообразователи. Комплексообразователями служат атомы или ионы, имеющие вакантные орбитали. Способность к комплексообразованию возрастает с увеличением заряда иона и уменьшением его размера. К наиболее распространенным комплексообразователям относятся ионы d-элементов VII, VIII, I и II групп периодической таблицы элементов.
9.3.Лиганды. К числу лигандов относятся простые анионы, такие как F— , СI—, Вr—, I—, S2-, сложные анионы, например CN– , NCS – , NO2—) , молекулы, например Н2О, NH3, C. Ионы или отдельные атомы ионов и молекул лигандов имеют неподеленные пары электронов. В зависимости от того, какое число вакантных орбиталей у комплексообразователя занимают лиганды, они подразделяются на монодентантные (одна орбиталь), например NН3, СI—, бидентантные, например N2H4или En, полидентантные, например этилендиаминтетрауксусная кислота (ЕДТА), являющаяся шестидентантным лигандом
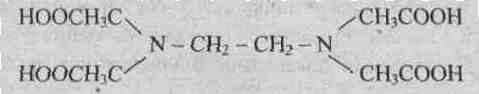
Динатриевая соль ЕДТА и сама кислота относятся к классу соединений, называемых комплексонами. Би- и полидентантные лиганды при взаимодействии с комлексообразователями образуют замкнутые циклы, называемые хелатными, поэтому и комплексы с би- и полидентантными лигандами называют хелатными (или клешневидными), например
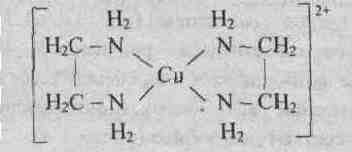
Пример 1. Определите заряд комплексного иона, координационное число (к.ч.) и степень окисления комплексообразователя в соединениях: a) K4[Fe(CN)6]; б) Na[Ag(NO2)2]; в) K2[MoF8]; г) [Сr(Н2O)2(NН3)3С1]С12.
Решение. Заряд комплексного иона равен заряду внешней сферы, но противоположен ему по знаку. Координационное число комплексообразователя равно числу лигандов, координированных вокруг него. Степень окисления комплексообразователя определяется так же, как степень окисления атома в любом соединении, исходя из того, что сумма степеней окисления всех атомов в молекуле равна нулю. Заряды нейтральных молекул (H2O, NН3) равны нулю. Заряды кислотных остатков определяют из формул соответствующих кислот. Отсюда:
| Заряд иона | К.ч. | Степень окисления | |
| а) | -4 | 6 | +2 |
| б) | -1 | 2 | +1 |
| в) | -2 | 8 | +6 |
| г) | +2 | 6 | +3 |
9.4. Номенклатура комплексных соединений. Название комплексного катиона записывается одним словом, начинающимся с названия отрицательного лиганда с прибавлением буквы «о», затем приводятся нейтральные молекулы и центральный атом с указанием римской цифрой его степени окисления для металлов переменной валентности. Для молекул Н2О (аква), NН3 (аммин), СО (карбонил), NO (нитрозил) даются особые названия, указанные в скобках.
Число лигандов обозначают греческими приставками (ди-, три-, тетра- и т.д.) или бис-, трис-, тетракис-, пентакис- и гексакис- для 2, 3, 4, 5 и 6 соответственно у сложных лигандов. Например, соединение [Zn(NH3)2Cl]CI называется хлорид хлородиамин цинка (II), а [Ni(En)2]Cl2 – хлорид бис(этилендиамин) никеля (II).
Комплексный анион записывается аналогично названию катиона, но с добавлением суффикса -«am» к названию комплексообразователя, например K2[Zn(CN)4] — тетрацианоцинкат (II) калия. Нейтральный комплекс записывается подобно катиону, например комплекс [Ni(CО)4] называется тетракарбонил никеля (II). Соответственно по типу лигандов комплексы называют аквакомплексы (лиганд Н2О), аминокомплексы (лиганд NH3), ацидокомплексы (лиганды анионы кислот), комплексонатные комплексы (лиганды-комплексоны) и т.д.
9.5. Диссоциация комплексных соединений. Комплексные соединения — неэлектролиты в водных растворах диссоциации не подвергаются. У них отсутствует внешняя сфера комплекса, например: [Zn(NH3)2Cl2], [Co(NH3)3(NO3)3], [Pt (NH3)2C12]. В водной среде такие молекулы гидратируются как единое образование.
Комплексные соединения — электролиты при диссоциации в водных растворах образуют комплексные ионы, например:
[Ag (NH3)2] CI ↔[Ag (NH3)2]+ +С1– ; К [Ag (CN)2 ↔K+ + [Ag (CN)2]—
Такая диссоциация протекает полностью, ионы гидратируются. Комплексные ионы в свою очередь подвергаются вторичной диссоциации:
[Ag(NH3)2]+ ↔Ag++2NH3 (a)
[Ag (CN)2] — ↔ Ag+ +2CN— (б)
Однако эта диссоциация обычно протекает в незначительной степени. Применяя закон действующих масс к обратимым процессам (а) и (б), получаем выражения констант нестойкости комплексных ионов:
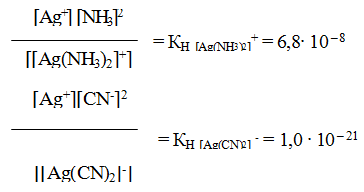
Константа нестойкости комплексного иона характеризует прочность (устойчивость) внутренней сферы комплексного соединения. В приведенных примерах комплекс [Ag(CN)2]— более прочен, чем
комплекс [Ag(NH3)2]+, так как имеет меньшее значение КН.
Соединения с малоустойчивой внутренней сферой называют двойными солями. Обозначают их иначе, чем комплексные соединения, а именно — как соединения молекул, например K2SO4∙A12(SO4)3. Принципиальной же разницы между двойными солями и комплексными соединениями нет. В растворе двойной соли имеется некоторое количество комплексных ионов (например, [Al (SO4)2]—). Двойная соль отличается от комплексной соли лишь диссоциацией комплексного иона: у первой она практически полная, а у второй — незначительная.
Двойные соли — довольно распространенные соединения. К ним относятся соль Мора (NH4)2SO4∙FeSO4∙6H2O, двойной хлорид калия и меди 2КС1 ∙ СuС12 ∙ 2Н2О и многие другие. Если, например, растворить в воде двойной хлорид, то происходит диссоциация
2КС1∙СuС12∙2Н2О↔2К++Сu2+ + 4С1—+2Н2О
и все образовавшиеся в растворе ионы можно обнаружить с помощью соответствующих реакций. Но если это соединение рассматривать как комплексное, то его формулу надо изобразить как K2[CuС14]∙2H2О. Диссоциация K2[CuС14]∙2H2О протекает по уравнению:
К2 [CuCl4] ∙ 2H2O↔ 2К + + [CuC14]2 — + 2Н2О
и
[CuCl4]2-↔Cu2+ + 4Cl—
Образующийся комплексный ион устойчив только в концентрированных растворах, и его константа нестойкости при комнатной температуре
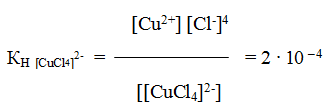
Сравним значение КН [CuCl4]2- со значением константы нестойкости одного из комплексных ионов меди, например КН[Cu(NH3)4]2+ = 4,6 ∙ 10 – 14. Тогда мы увидим, что КН [CuCl4]2- > КН[Cu(NH3)4]2+ на несколько порядков, а чем меньше константа нестойкости комплекса, тем больше его устойчивость.
Пример 1. Напишите выражение для константы нестойкости комплекса [Fе(СМ)6]4-.
Решение. Если комплексная соль гексацианоферрат (II) калия, являясь сильным электролитом, в водном растворе необратимо диссоциирует на ионы внешней и внутренней сфер
K4[Fe(CN)6] = 4K+ + [Fe(CN)6]4–
то комплексный ион диссоциирует обратимо и в незначительной степени на составляющие его частицы:
[Fe(CN)6]4– ↔ Fe2+ + 6CN–
Обратимый процесс характеризуется своей константой равновесия, которая в данном случае называется константой нестойкости (Кн) комплекса:
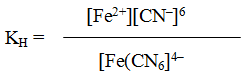
Чем меньше KH, тем более прочен данный комплекс.
9.6. Константы устойчивости комплексов. Для характеристики устойчивости (прочности) комплексного иона применяют также величину, обратную константе нестойкости. Ее называют константой устойчивости (КУСТ) или константой образования комплекса. Величины КН и КУСТ взаимосвязаны:
Очевидно, чем выше КУСТ, тем прочнее комплексный ион и тем больше его концентрация при равновесии.
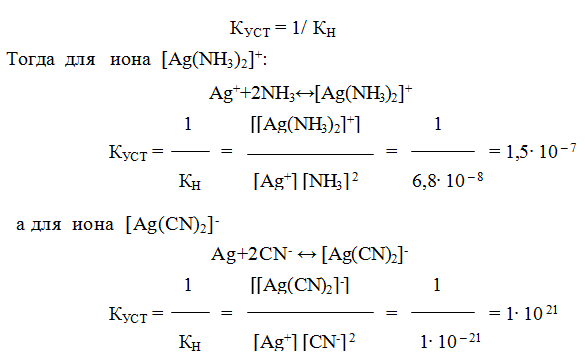
Следует подчеркнуть, что как диссоциация комплексного иона, так и его образование являются процессами обратимыми и протекают ступенчато, как у слабых электролитов. Каждой ступени соответствует определенная величина константы устойчивости — К1, К2 …, Кn. Ион [Ag(NH3)2] + будет иметь две константы устойчивости — K1 и K2:
У иона [Cu(NH3)4]2+ будет четыре константы устойчивости, так как комплексообразователь в четыре стадии присоединяет лиганд NH3

Таким образом, при образовании комплексов в растворе происходит последовательное (стадийное) внедрение лигандов во внутреннюю сферу комплексообразователя с соответствующим отщеплением молекул воды, так как исходный ион Сu2+ был гидратирован (он имел состав [Cu(H2O)4]2+). При диссоциации комплекса [Cu(NH3)4]2+, наоборот, происходит соответствующая замена лигандов на молекулы воды. Поскольку концентрация воды при таких процессах не изменяется, ее не включают в выражение констант устойчивости или констант нестойкости.
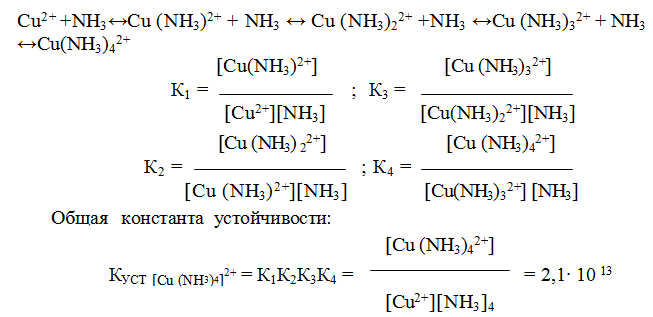
9.7.Роль комплексных соединений. Комплексные соединения широко распространены в природе. В состав многих растений и живых организмов входят соединения с макроциклическими лигандами. В упрощенном виде тетрадентантный макроцикл порфин представлен на рис. 3.3
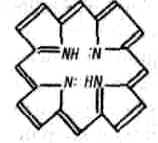
Рис. 3.3. Структура молекул порфина
Комплексы с участием порфина называются порфи-ринами. Они отличаются друг от друга центральными ионами-комплексообразователями и заместителями, присоединенными к атомам углерода на периферии лиганда. В наиболее простом виде порфиновый цикл представлен четырьмя атомами азота, соединенными углеродными цепями (рис. 3.3). Кроме того, имеются четыре или более заместителей — радикалов R1, R2, R 3, R4. В зеленом катализаторе фотосинтеза — хлорофилле роль комплексообразователя выполняет магний (рис. 3.4). Макроциклический комплекс железа входит в состав гемоглобина (рис. 3.4).
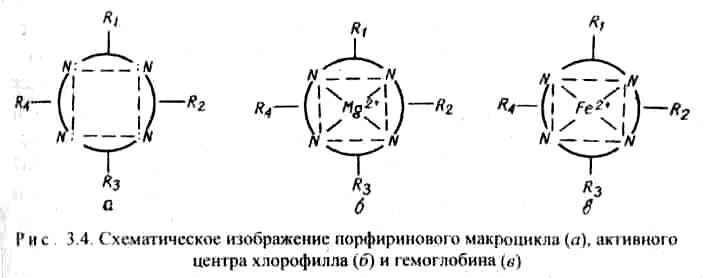
Железо координирует кислород в комплексе гемоглобина и переносит его по организму с кровью. Связь кислорода с железом в комплексе не очень прочная и поэтому кислород в организме легко реагирует с восстановителями. Недостаток железа в организме приводит к болезни — анемии. Макроциклы крови могут взаимодействовать с каталитическими ядами, например, монооксидом углерода СО, что приводит к отравлению организма.
Сложные лиганды-комплексоны широко используются в энергетике для очистки парогенераторов от накипи, в медицине — для очистки почек от камней, для выведения ядов из организма, таких как Hg2+ Pb2+ Cd2+, в химии — как катализаторы некоторых реакций, например восстановления кислорода, в аналитической химии, в частности, при определении жесткости воды.
9.8. Комплексонометрия. Жесткость воды. Жесткость воды выражается суммой миллиэквивалентов ионов Са2+ и Mg2+, содержащихся в 1 л воды (ммоль/л). Один миллимоль жесткости отвечает содержанию 20,04 мг/л Са2+ или 12,16 мг/л Mg2+.
Пример 1. Вычислите жесткость воды, зная, что в 500 л ее содержится 202,5 г Са(НСО3)2.
Приведенные примеры решают, применяя формулу Ж = m / (mЭ ∙ V)
где: т – масса вещества, обусловливающего жесткость воды или применяемого для устранения жесткости, мг;
mэ, – молярная масса эквивалента этого вещества;
V – объем воды, л.
Решение. В 1 л воды содержится 202,5 : 500 = 0,405 г Са(НСО3)2, что составляет 0,405 : 81 = 0,005 ммоль/л. 81 г/моль — эквивалентная масса Са(НСО3)2. Следовательно, жесткость воды 5ммоль. (Ж = т / (mэV)= 202 500 / (81 • 500) = 5 ммоль. 81 – эквивалентная масса Са(НСО3)2, равная половине его молярной массы).
Пример 2. Сколько граммов CaSO4 содержится в 1 м3 воды, если жесткость, обусловленная присутствием этой соли, равна 4 ммоль?
Решение. Молярная масса CaSO4 136,14 г/моль; молярная масса эквивалента равна 136,14:2 = 68,07 г/моль. В 1 м3 воды жесткостью 4 ммоль содержится 4 · 1000 = 4000 ммоль, или 4000 · 68,07 = 272 280 мг = 272,280 г CaSO4. Из формулы Ж = m / (mэV),m = 468,071000 = 272 280 мг = 272,280 г CaSO4).
Пример 3. Какую массу соды надо добавить к 500 л воды, чтобы устранить ее жесткость, равную 5 ммоль?
Решение. В 500 л воды содержится 500 · 5 = 2500 моль солей, обусловливающих жесткость воды. Для устранения жесткости следует прибавить 2500 · 53 = 132 500 мг = 132,5 г соды (53 г/моль — молярная масса эквивалента Na2CO3).
Пример 4. Вычислите карбонатную жесткость воды, зная, что на титрование 100 см3 этой воды, содержащей гидрокарбонат кальция, потребовалось 6,25 см3 0,08 н. раствора НС1.
Решение. Вычисляем молярную концентрацию эквивалентов раствора гидрокарбоната кальция. Обозначив число эквивалентов растворенного вещества в 1 л раствора, через х, составляем пропорцию:
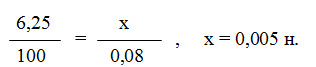
Таким образом, в 1 л исследуемой воды содержится 0,005·1000 = 5 ммоль гидрокарбоната кальция или 5 ммоль Са2+-ионов. Карбонатная жесткость воды 5 ммоль.
Как определить степень окисления в комплексном соединении
Комплексные соединения – это химические вещества сложного строения, состоящие из центрального атома – комплексообразователя, а также внутренней и внешней сферы. Внутренняя сфера состоит из нейтральных молекул или ионов, прочно связанных с комплексообразователем. Такие молекулы называются лигандами. Внешняя сфера может состоять из анионов или катионов. В любом сложном соединении элементы, входящие в его состав, имеют свою степень окисления.

Инструкция
Возьмите для примера вещество, образующееся при реакции золота с «царской водкой» – смесью трех частей концентрированной соляной кислоты и одной части концентрированной азотной кислоты. Реакция протекает по схеме: Au + 4HCl + HNO3 = H[Au(Cl)4] + NO + 2H2O.
В результате образуется комплексное соединение – тетрахлораурат водорода. Комплексообразователем в нем является ион золота, лигандами – ионы хлора, внешней сферой – ион водорода. Как же определить степени окисления элементов в этом комплексном соединении?
Прежде всего определите, какой из элементов, входящих в состав молекулы, самый электроотрицательный, то есть кто будет перетягивать к себе общую электронную плотность. Это, безусловно, хлор, поскольку он расположен в верхней правой части таблицы Менделеева, и по электроотрицательности уступает только фтору и кислороду. Следовательно, его степень окисления будет со знаком «минус». А какова величина степени окисления хлора?
Хлор, как и все другие галогены, расположен в 7-й группе таблицы Менделеева, на его внешнем электронном уровне находится 7 электронов. Перетянув на этот уровень еще один электрон, он перейдет в устойчивое положение. Таким образом, его степень окисления будет равна -1. А поскольку в этом комплексном соединении четыре иона хлора, то суммарный заряд будет равняться -4.
Но сумма величин степеней окисления элементов, входящих в состав молекулы, должна быть равной нулю, ведь любая молекула электрически нейтральна. Таким образом, отрицательный заряд -4 должен быть уравновешен положительным зарядом +4, за счет водорода и золота.
Поскольку водород является самым первым элементом таблицы Менделеева и может отдать для образования химической связи только один электрон, его степень окисления равна +1. Соответственно, для того чтобы суммарный заряд молекулы был равен нулю, ион золота должен иметь степень окисления +3. Задача решена.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Степень окисления
Трудности
определения валентности в сложных
молекулах привели исследователей к
необходимости ввести понятие о степени
окисления – величине формальной, но
легко рассчитываемой. Степенью
окисления
принято
называть условный заряд атома в молекуле,
который возникает за счет смещения
электронной плотности от менее к более
электроотрицательному атому. Степень
окисления может иметь отрицательное,
положительное и нулевое значения,
которые обычно выражают арабскими
цифрами со знаком «+» или «-» и ставят
над символом элемента. Например,


Отрицательную
степень окисления имеют атомы, которые
приняли электроны от других атомов,
т.е. в их сторону смещено связующее
электронное облако. Отрицательную
степень окисления (-1) имеет атом фтора
во всех своих соединениях.
Положительную
степень окисления имеют атомы, отдающие
свои электроны другим атомам, т.е.
связующее электронное облако оттянуто
от них. К таковым относятся металлы в
соединениях. Степень окисления щелочных
металлов равна (+1), а щелочноземельных
– (+2).
Нулевую
степень окисления имеют атомы в молекулах
простых веществ, например водорода,
хлора, азота, т.к. в этом случае связующее
электронное облако в равной мере
принадлежит обоим атомам. Если вещество
находится в атомарном состоянии, то
степень окисления его атомов также
равна нулю.
В
большинстве соединений атомы водорода
имеют степень окисления (+1), только в
гидридах металлов, например, NaH,
CaH2,
она равна (-1). Кислород в большинстве
соединений имеет степень окисления
(-2), но в соединении с фтором (F2O)
она равна (+2), в пероксидах – (-1). Пользуясь
этими сведениями можно вычислить степень
окисления атомов в сложных соединениях,
учитывая, что алгебраическая
сумма степеней окисления атомов в
соединении всегда равна нулю, а в сложном
ионе – заряду иона.
Лекция
4
Комплексные соединения (комплементарность) Структура комплексных соединений
Наиболее
лаконичное определение комплексных
(координационных) соединений
(КС), хотя и не охватывающее всего их
многообразия, следующее – это соединения
высшего порядка, образованные из
соединений низшего порядка за счет
возникновения донорно-акцепторных
связей и способные к самостоятельному
существованию. Ионы многих элементов
(Cu2+,
Ag+,
Zn2+,
Co2+,
Cr3+
и др.) способны присоединять к себе
другие молекулы, образуя сложные
комплексные ионы. Например: CrCl3×6NH3;
CrCl3×5NH3;
CrCl3×4NH3;
CrCl3×3NH3;
CoCl3×6NH3
и т.д. Как объяснить их существование?
Экспериментальные данные, полученные
после растворения каждого вещества и
добавления раствора AgNO3,
показывают, что большая часть Cl–-ионов
в этих растворах не осаждается. Так
число Cl—ионов
осаждаемых в виде AgCl
составляет в молекулах: CrCl3×6NH3
– 3; CrCl3×5NH3
– 2; CrCl3×4NH3
–
1. Другие данные также свидетельствуют
о различных типах связей. Например,
понижение температуры замерзания
водного раствора CrCl3×6NH3
указывает на то, что из 1 моля CrCl3×6NH3
в растворе образуются 4 моля частиц и
что раствор является хорошим проводником.
С другой стороны, понижение температуры
замерзания CrCl3×3NH3
указывает на то, что из 1 моля CrCl3×3NH3
в растворе образуется также 1 моль
частиц; кроме того, полученный раствор
совсем не проводит электрического тока.
Рассмотрим
более подробно комплексное соединение
CoCl3×6NH3.
В 1893 г. в Цюрихе А. Вернером была разработана
координационная
теория,
описывающая строение этих соединений.
В соответствии с этой теорией шесть
молекул аммиака (лиганды) располагаются
(координируются) около положительно
заряженного иона Со3+
(комплексообразователя). Лиганд
– это
ион (или молекула), имеющий атом с
неподеленной электронной парой. Молекулы
аммиака связаны с ионом кобальта
посредством донорно-акцепторной связи,
т.е. они предоставляют для химической
связи неподеленные (свободные) электронные
пары, а ион кобальта – вакантную орбиталь.
В комплексном соединении [Co(NH3)6]Cl3,
согласно теории Вернера комплексообразователь
и лиганды образуют внутреннюю
координационную сферу. Остальные ионы,
не размещенные во внутренней сфере,
находятся на более далеком расстоянии
от центрального иона и составляют
внешнюю координационную сферу, то есть
[Co(NH3)6]
Cl3
________________
_______
внутренняя
сфера внешняя сфера
Внутренняя
сфера комплекса в значительной степени
сохраняет стабильность при растворении.
Ее границы показывают квадратными
скобками. Ионы, находящиеся во внешней
сфере, в растворах легко отщепляются.
Поэтому говорят, что во внутренней сфере
ионы связаны неионогенно,
а во внешней – ионогенно
[Co(NH3)6]Cl3 ↔
[Co(NH3)6]
3+
+3Cl–
комплексный
ион
Комплексный
ион
–
сложный ион, который состоит из атома
элемента в определенном валентном
состоянии связанный с одной или
несколькими молекулами или ионами.
Комплексообразователь
(ко)
–
это атом или заряженный ион, способный
координировать (окружать) вокруг себя
другие частицы. Комплексообразователем
может быть:
а)
окисленный атом или положительно
заряженные ионы d-,
р-, f-элементы
(Cu2+,Hg2+,
Fe2+,
Co3+,
Ni2+,
Pt4+),
очень редко s-элементы
(Be2+);
б)
нейтральный атом p-,
d-,
f-
элемента, благородные газы (Ne,
Kr
….);
в)
отрицательно заряженные ионы (O2-,
S2-,
J–,
Br–…).
В
качестве лигандов (аддендов) могут
выступать:
а)
нейтральные полярные молекулы: H2O,
NH3,
CO,
спирт ;
б)
отрицательно заряженные ионы: F–,
Cl–,
Br–,
CN–,
NO2–,
NO3–,
CNS–,
S2O32-,
OH–
;
в)
любые молекулы органические и
неорганические способные к поляризации.
Чаще
всего комплексообразователь является
заряженной частицей. Заряд
комплексообразователя численно равен
алгебраической сумме зарядов лигандов
и ионов внешней сферы. Заряд
комплексного иона равен алгебраической
сумме зарядов составляющих его простых
ионов.
Входящие
в состав комплекса электронейтральные
молекулы (NH3,
H2O,
C2H4,
CO
и др.) не влияют на величину его заряда.
Поэтому при определении заряда комплексных
ионов их можно не учитывать.
Нейтральные
молекулы или анионы, находящиеся во
внутренней сфере комплексного соединения,
могут быть последовательно замещены
другими молекулами или анионами.
Например, путем замещения молекул
аммиака в комплексной соли [Co(NH3)6]Cl3
ионами
NO2–
получают следующие соединения:
[Co(NH3)5(NO2)]Cl2,
[Co(NH3)3(NO2)3],
K2[Co(NH3)(NO2)5],
K3[Co(NO2)6].
Число
лигандов, окружающих центральный ион,
называется координационным
числом
(кч),
которое принимает значения от 2 до 12.
Чаще всего координационное число
принимает значения 2, 4, 6. Как правило,
координационное число равно удвоенной
валентности комплексообразователя.
Например, координационное число равное
6 встречается в комплексных соединениях
Cr3+,
Co3+,
Fe3+;
координационное число равное 4 – в
комплексах Cu2+,
Zn2+,
Pd2+,
Pt2+;
координационное число равное 2 – в
комплексах Ag+,
Cu+.
Приведенные координационные числа
соответствуют максимальному насыщению
координационной сферы и относятся к
координационно-насыщенным соединениям.
Не всегда в растворах соблюдаются
условия, необходимые для этого, и тогда
образуются координационно-ненасыщенные
комплексы с меньшими координационными
числами. Например, в комплексных
соединениях Pt4+
координационное число равно 6.
Координационное число не является
неизменной величиной для комплексообразователя
и зависит от следующих факторов:
1)
природы комплексообразователя;
2)
заряда комплексообразователя;
3)
природы лиганда;
4)
концентрации и температуры;
5)
от размера или от радиуса
комплексообразователя и лиганда. Чем
больше отношение rко/rл,
тем больше координационное число.
Расположение
элемента комплексообразователя в
периодической системе обнаруживает
некоторую закономерность. Например,
комплексообразователь находящийся во
II
периоде на внешнем уровне имеет 4 орбитали
и его координационное число равно 4. У
элементов III
периода помимо s-
и p-орбиталей
могут вовлекаться и d-орбитали.
Координационное число возрастает до
6. У элементов следующих периодов
вовлекается большее число d-орбиталей
и координационное число возрастает до
7, 8, 9. Например, H2[Ta+5F7]
координационное число равно 7. Если
вовлекаются f-орбитали,
то координационное число возрастает
до 12.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Комплексные соединения, заряд комплексного иона, координационное число комплексообразователя
Решение задач по химии на комплексные соединения
Задание 304
Определите заряд комплексного иона, степень окисления и координационное число сурьмы в соединениях Rb[SbBr6]; К[SbCl6]; Na[Sb(SO4)2]. Как диссоциируют эти соединения в водных растворах?
Решение:
Заряд комплексного иона равен заряду внешней сферы, но противоположен ему по знаку. Координационное число комплексообразователя равно числу лигандов, координированных вокруг него. Степень окисления комплексообразователя определяется так же, как степень окисления атома в любом соединении, исходя из того, что сумма степеней окисления всех атомов в молекуле равна нулю. Заряды нейтральных молекул (Н2О,NH3) равны нулю. Заряды кислотных остатков определяют из формул соответствующих кислот. Отсюда:
Заряд иона Координ. число Степень окисл.
а) Rb[SbBr6] 1- 6 +5
б) К[SbCl6] 1- 6 +5
в) Na[Sb(SO4)2] 1- 4 +3
Комплексные соединения диссоциируют как сильные электролиты необратимо:
а) Rb[SbBr6] ⇔ Rb+ + [SbBr6]–;
б) К[SbCl6] ⇔ 2К+ + [PtCl6]2-;
в) Na[Sb(SO4)2] ⇔ Na+ + [Sb(SO4)2]–
Задание 305
Составьте координационные формулы следующих комплексных соединений серебра:
AgCl . 2NH3; AgCN . KCN; AgNO2 . NaNO2. Координационное число серебра равно двум. Напишите уравнения диссоциации этих соединений в водных растворах.
Решение:
Формулы координационных соединений
а)AgCl . 2NH3 —— [Ag(NH3)2]Cl – хлорид диамминсеребра(I);
б)AgCN . KCN –—- K[Ag(CN)2] – дицианоаргентат(I) калия;
в) AgNO2. NaNO2 –—– Na[Ag(NO2)2] – нитрит динитроаргентат(I) натрия.
Уравнения диссоциации комплексных соединений
а) [Ag(NH3)2]Cl ⇔ [Ag(NH3)2]+ + Cl–;
б) K[Ag(CN)2] ⇔ K+ + [Ag(CN)2]–;
в) Na[Ag(NO2)2] ⇔ Na+ + [Ag(NO2)2]–.
Задание 306
Определите заряд комплексного иона, степень окисления и координационное число комплексообразователя в соединениях К4[Fe(CN)6], К4[ТiCl8], К2[HgI4]. Как диссоциируют эти соединения в водных растворах?
Решение:
Заряд комплексного иона равен заряду внешней сферы, но противоположен ему по знаку. Координационное число комплексообразователя равно числу лигандов, координированных вокруг него. Степень окисления комплексообразователя определяется так же, как степень окисления атома в любом соединении, исходя из того, что сумма степеней окисления всех атомов в молекуле равна нулю. Заряды нейтральных молекул (Н2О,NH3) равны нулю. Заряды кислотных остатков определяют из формул соответствующих кислот. Отсюда:
Заряд иона Координ. число Степень окисл.
а) К4[Fe(CN)6] 4- 6 +2
б) К4[ТiCl8] 4- 8 +4
в) К2[HgI4] 2- 4 +2
Комплексные соединения диссоциируют как сильные электролиты необратимо:
а) К4[Fe(CN)6] ⇔ 4К+ + [Fe(CN)6]4-;
б) К4[ТiCl8] ⇔ 4К+ + [ТiCl8]4-;
в) К2[HgI4] ⇔ 2К+ + [HgI4]2-.
Определение степени окисления комплексообразователя и заряд комплексного иона
Пухаев Алан Сергеевич
Мастер
(1216),
закрыт
13 лет назад
Помогите пожалуйста определить степень окисления комплексообразователя и заряд комплексного иона в соединениях: 
Лучший ответ
Лена Лозицкая
Просветленный
(38058)
13 лет назад
1 )серебро +1 заряд комплексного иона -3
2)Железо +3, комплексный ион -3
3)железо +2 компдексный ион -4
комплексный ион в квадратных скобках
Остальные ответы
Lenivchik
Знаток
(338)
13 лет назад
Небольшая поправка – степень окисления записывается знак-число, н-р: +1, +2 …
А заряд записывается – число-знак, н-р: 1+, 2+, 3+ ..
Похожие вопросы
