Как определить степень окисления?
Автор – Александр Игоревич Новичков .
Степень окисления – это формальный заряд атома. Слово «формальный» означает, что этого заряда у атома в действительности может и не быть, вернее, он может оказаться немного другим. Однако по разным причинам эти условные заряды удобны и химики всего мира пользуются понятием «степень окисления».
Отметим, что степень окисления указывается в верхнем правом углу атома в формате или
, где
– целое число. Например:
Существуют определённые правила нахождения степени окисления.
-
- Степень окисления простых веществ равна нулю. Напомню, что простыми называют вещества, состоящие из одного вида атомов. Примеры:
- Некоторые атомы в сложных соединениях проявляют только одну степень окисления. Такие степени окисления называются постоянными.
- Степень окисления простых веществ равна нулю. Напомню, что простыми называют вещества, состоящие из одного вида атомов. Примеры:
– Исключения у водорода соединения
, в которых у водорода степень окисления
– Исключения у кислорода
-
- Сумма степеней окисления всех атомов сложного соединения должна быть равна нулю. Пользуясь именно эти правилом, мы будем расставлять степени окисления в сложных соединениях.
Как именно?
- Сумма степеней окисления всех атомов сложного соединения должна быть равна нулю. Пользуясь именно эти правилом, мы будем расставлять степени окисления в сложных соединениях.
Пример 1: расставьте степени окисления в соединении .
Мы знаем степень окисления тогда мы можем найти, что общее количество «плюсов» у четырех атомов
. Чтобы в сумме был ноль, у трех атомов
заряд должен быть
, значит у каждого атома
Пример 2: Найдите степени окисления всех атомов в соединении
Сначала подпишем постоянные степени окисления
Посчитаем общее количество плюсов и минусов
Для того, чтобы плюсов и минусов было одинаковое количество у двух хромов в сумме должно быть , а значит, у каждого атома
Пример 3: Найдите степени окисления всех атомов в соединении
Для начала заметим, что для нахождения степени окисления удобно «раскрыть скобки» и представить соединение как и тогда задание выполняется аналогично заданию из примера 2.
Ответ:
-
- В некоторых устоявшихся группах атомов в составе веществ (кислотные остатки и ион аммония) степени окисления атомов неизменны и их тоже стоит запомнить.
Пользуясь этими правилами, можно расставить степени окисления практически во всех соединений, встречающихся на ЕГЭ по химии.
Если вам понравился наш материал – записывайтесь на курсы подготовки к ЕГЭ по химии онлайн
Благодарим за то, что пользуйтесь нашими публикациями.
Информация на странице «Как определить степень окисления?» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к ЕГЭ и ОГЭ.
Чтобы успешно сдать необходимые и поступить в ВУЗ или техникум нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими статьями из разделов нашего сайта.
Публикация обновлена:
07.05.2023
Штирлиц
Высший разум
(317565)
12 лет назад
Зная степень окисления некоторых элементов, можно вычислить степень окисления других.
Молекулы электронейтральны, т. е. количество + и – должно равняться.
Щелочные металлы в соединениях имеют ст. окисления +1
кислород, как правило, -2
например
KMnO4
K +1, 4 атома кислорода дают -2 * 4 = -8
недостающие 7плюсов приходятся на атом марганца
Владимир Рогозин
Мудрец
(11728)
12 лет назад
Алгебраическая сумма всех степеней окисления равна 0 или заряду иона в сложном веществе или иона.
Например, H2SO4
зная, что степени окисления водорода и кислорода как правило равны соответственно +1 и -2, решаем
2*(+1)+х+4*(-2)=0
х=+6, т. е. степень окисления серы равна +6, прверим
+2+(+6)+(-8)=0

Как определить степень окисления
Материал по химии
Что такое степень окисления?
Степень окисления – это условная величина, отражающая количество принятых или отданных электронов при образовании заряженной частицы из электронейтрального атома при условии, что электроны переходят от одного атома к другому полностью.
Вспомним, что идеальное количество электронов на внешнем электронном уровне атома равно восьми. Такую конфигурацию внешнего слоя имеют атомы большинства благородных газов (кроме гелия). И к такой электронной конфигурации стремятся атомы других элементов.
Как определить степень окисления
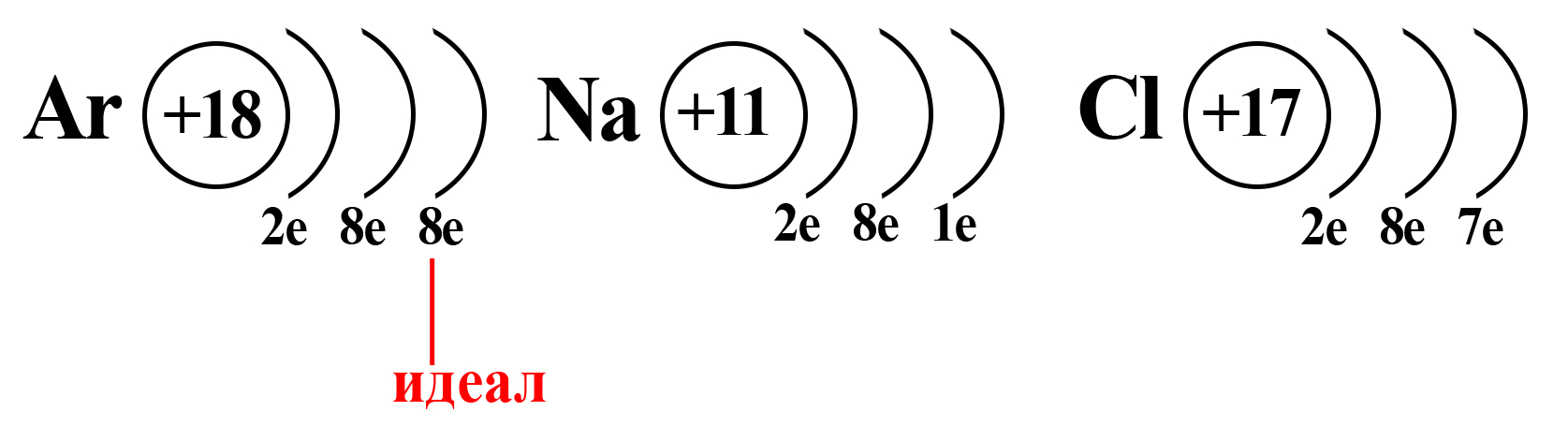
Конфигурация благородного газа
Натрий и хлор не так далеки от «идеала», как может показаться. Если атомы этих элементов столкнуться, внешний электрон натрия притянется на внешний электронный уровень хлора (из-за большей электроотрицательности хлора):
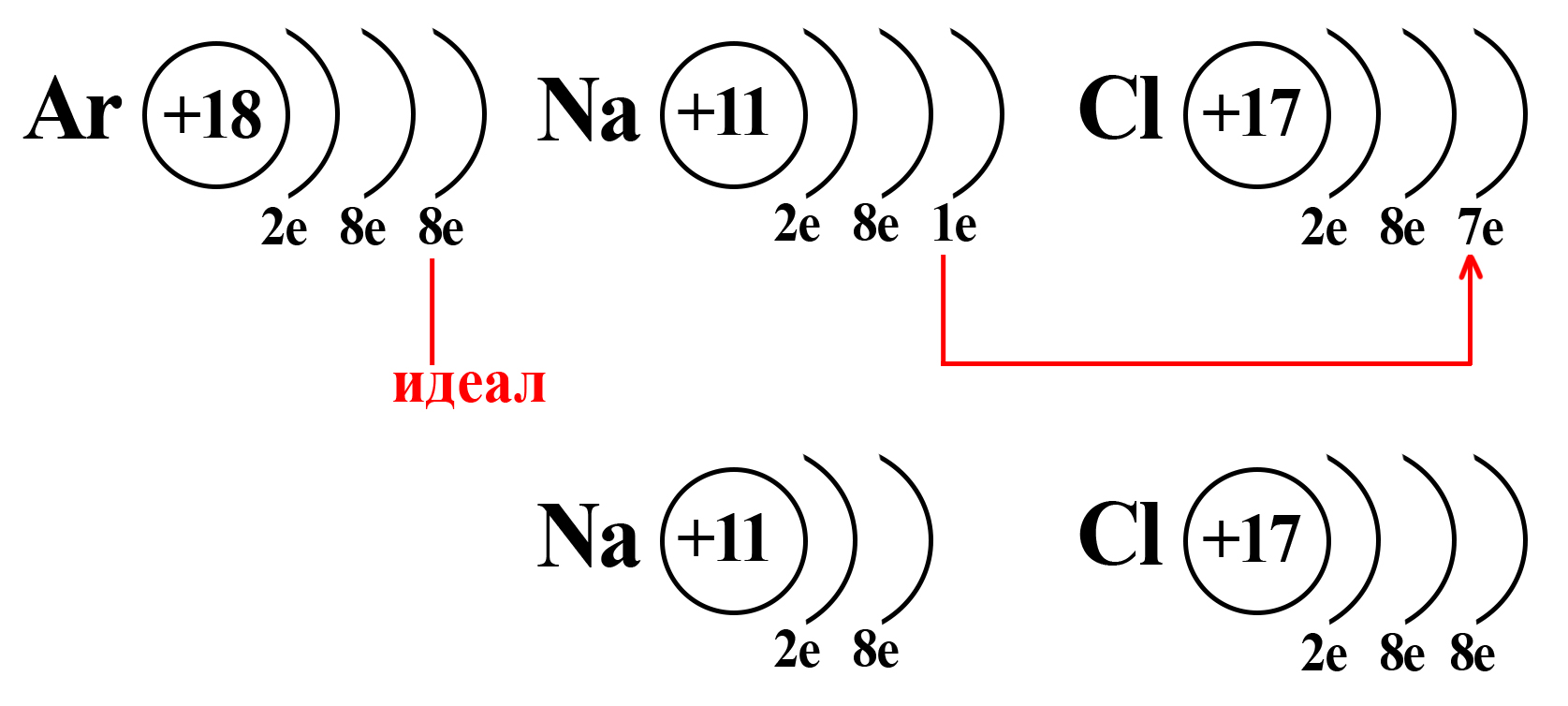
Таким образом, натрий и хлор как будто вступают в симбиоз: натрию, для приобретения «благородной» конфигурации необходимо избавиться от внешнего электрона (при потере внешнего электрона теряется и внешний уровень, а предвнешний уровень, имеющий идеальное количество электронов, становится внешним), тогда как хлору необходимо получить один электрон, чтобы завершить внешний энергетический уровень.
Потеряв один электрон, натрий приобретает положительный заряд, становится катионом (положительно заряженной частицей). Это объясняется тем, что ядро натрия по-прежнему имеет 11 протонов, а вот электронная оболочка, после взаимодействия с хлором, содержит 10 электронов. Таким образом, натрий будет иметь 11 положительно заряженных частиц и 10 отрицательно заряженных частиц. По простейшему уравнению: +11 – 10 = +1, становится ясно, откуда взялся положительный заряд.
Аналогичный расчет можно привести и для хлора. После взаимодействия с натрием ядро атома хлора не изменяется, оно содержит 17 положительно заряженных частиц (протонов), а оболочка – 18 отрицательно заряженных частиц (электронов). +17 – 18 = ‒1.
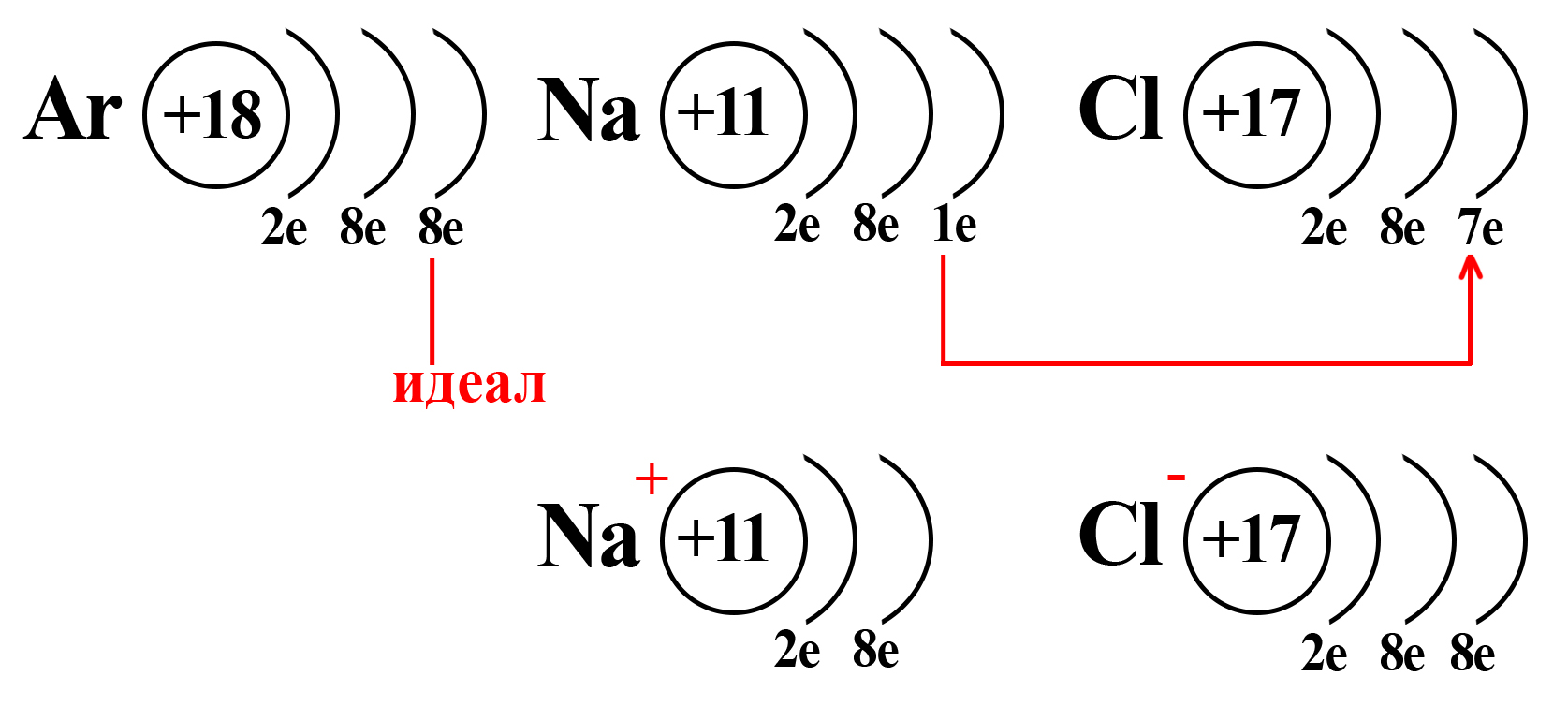
Полученные заряды и являются степенями окисления.
Также степень окисления можно выразить количеством электронов, которые иону нужно получить или отдать для того, чтобы стать электронейтральным атомом. Так, катион натрия, имеющий заряд «+1», должен получить 1 электрон, чтобы превратиться в атом натрия: Na+ +1ē = Na0. А анион хлора (хлорид-ион), имеющий заряд «‒1» должен отдать один электрон: Cl– -1ē = Cl0.
Для упрощения понятие «степень окисления» применяется не только для веществ с ионным строением (металл + неметалл), но и для веществ с ковалентными полярными связями. Несмотря на то, что в таком типе связи полного перехода электронов от одного атома к другому не происходит, полученные частичные заряды превращаются в целые.
Постоянные степени окисления.
Знания этой простой, базовой темы помогут Вам решать не только тестовые задания. Одно из самых сложных заданий ЕГЭ – расстановка коэффициентов с помощью электронного баланса – не решается без знания степеней окисления.
Таблица «Элементы, имеющие постоянную степень окисления»
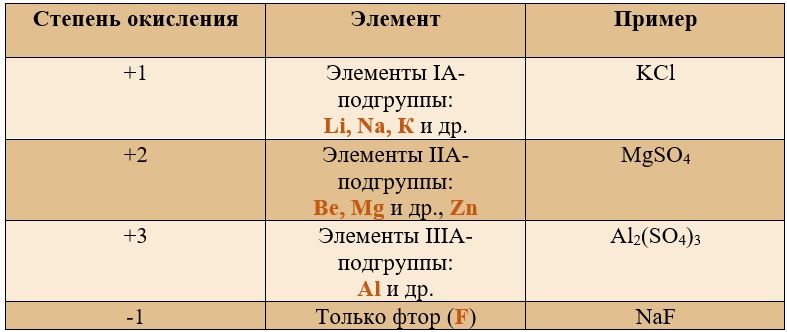
Таблица «Наиболее популярные степени окисления у остальных элементов» (Выделены бурым)*
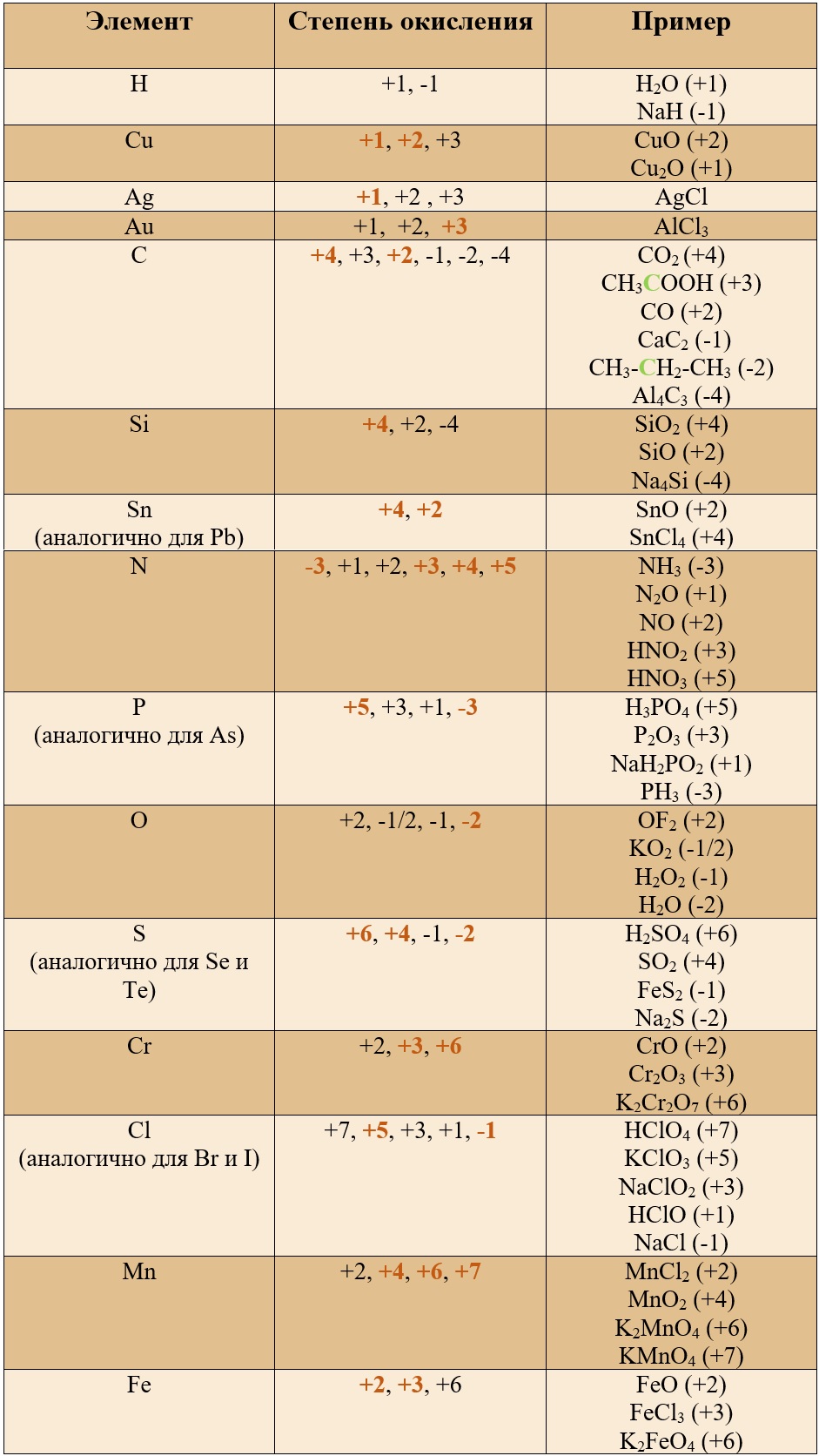
*В таблице указаны не все возможные степени окисления.
Таким образом, медь, серебро, золото и железо не проявляют высшей степени окисления, равной номеру группы, у остальных же элементов высшая степень окисления равна номеру группы.
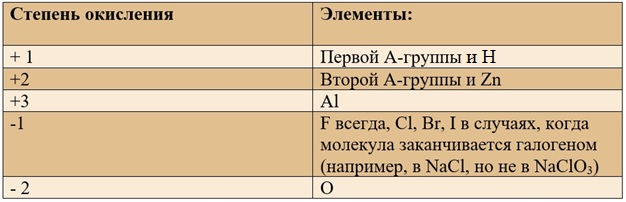
Для определения степени окисления не нужно учить всю таблицу, и тем более все степени окисления. Они приведены для справки, наиболее важными являются:
Определение степеней окисления в бинарных соединениях
Для примера возьмём оксид фосфора (P2O5)
- Определим степень окисления известного элемента (в нашем случае это кислород).

- Условно разделим молекулу на две части: чаще всего первая часть молекулы положительная, а вторая – отрицательная (искл: NH3 и PH3).

- Индекс после кислорода указывает на, что в молекуле содержится пять атомов кислорода, каждый из них имеет степень окисления «-2», поэтому общее количество отрицательных зарядов будет равно «-10».
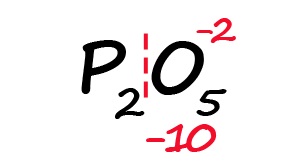
- Молекула должна быть электронейтральной, то есть количество положительных и отрицательных зарядов должны быть равными. Из этого следует, что все атомы фосфора в данной молекуле в сумме должны иметь десять положительных зарядов.
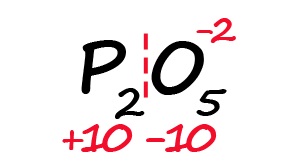
- Индекс «2» после фосфора означает, что в молекуле содержится два атома фосфора, между которыми поровну нужно разделить общий положительный заряд (+10:2=+5)
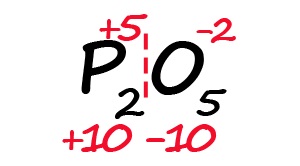
Аналогичным образом происходит определение степени окисления в более сложных веществах, для примера возьмём перманганат калия (KMnO4):
- Подпишем степени окисления для элементов, имеющих постоянные их значения:

- Разделим молекулу на положительный и отрицательный «полюс» (в соединениях, состоящих из атомов трех элементов, чаще всего первые два являются положительными, а третий – отрицательным).

- Посчитаем общее количество положительных и отрицательных зарядов с учетом индексов:
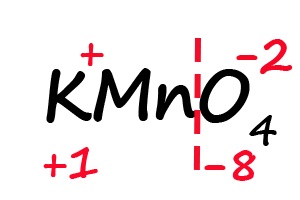
- Ответим на вопрос: какого количества плюсов не хватает, что бы положительные и отрицательные заряды имели одинаковое значение? До +8 не хватает семи положительных зарядов, откуда следует, что степень окисления марганца равна «+7».
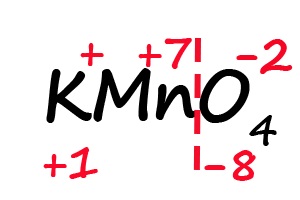
Ну и напоследок разберем степени окисления элементов в дихромате калия (K2Cr2O7):
- Подписываем известные степени окисления:
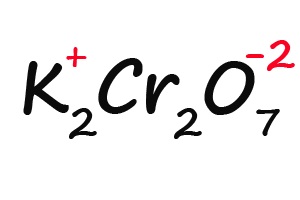
- Делим молекулу на положительную и отрицательную части:
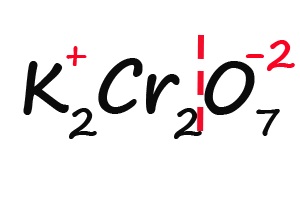
- Считаем общее количество «плюсов» и «минусов»:
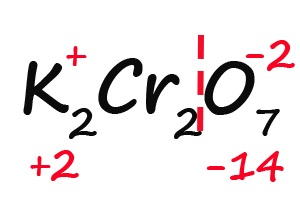
- Подсчитываем, сколько положительных зарядов не достает для того, чтобы молекула стала электронейтральной (т. е. такой молекулой, в которой количество положительных и отрицательных зарядов было одинаковым):
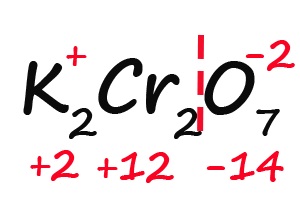
- Так как молекула содержит два атома хрома, двенадцать положительных зарядов должны распределиться между ними поровну, то есть, каждый хром имеет заряд +6:
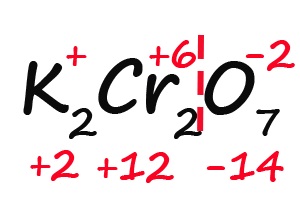
Как быть, если в формуле встретились скобки? Например, как посчитать степень окисления брома в пербромате кальция?

- Для начала определим все известные степени окисления, как делали в предыдущих примерах:
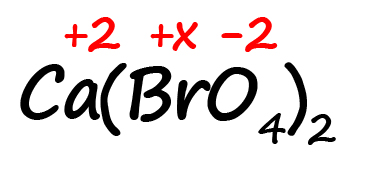
- Посчитаем сумму положительных и отрицательных зарядов. Важно учесть все индексы. Помните, что индекс. Расположенный за атомом действует только на этот атом, а индекс, расположенный за скобкой, действует на всё содержимое скобок:
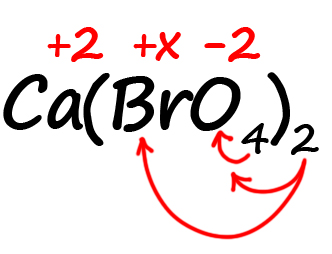
Таким образом, в пербромате кальция содержится: один атом кальция, два атома брома и 8 атомов кислорода (индексы, относящиеся к одному и тому же атому перемножаются).
Следовательно, мы имеем два положительных заряда от кальция и шестнадцать отрицательных от кислорода. Так как индекс «2» за скобками действует и на бром, его заряд можно выразить как 2х.
Получаем уравнение:
2 + 2х ‒ 16 = 0
2х = 14
х = 7
Степень окисления брома в пербромате кальция равна «+7».
Загрузить PDF
Загрузить PDF
В химии термины «окисление» и «восстановление» означает реакции, при которых атом или группа атомов теряют или, соответственно, приобретают электроны. Степень окисления — это приписываемая одному либо нескольким атомам численная величина, характеризующая количество перераспределяемых электронов и показывающая, каким образом эти электроны распределяются между атомами при реакции. Определение этой величины может быть как простой, так и довольно сложной процедурой, в зависимости от атомов и состоящих из них молекул. Более того, атомы некоторых элементов могут обладать несколькими степенями окисления. К счастью, для определения степени окисления существуют несложные однозначные правила, для уверенного пользования которыми достаточно знания основ химии и алгебры.
-

1
Определите, является ли рассматриваемое вещество элементарным. Степень окисления атомов вне химического соединения равна нулю. Это правило справедливо как для веществ, образованных из отдельных свободных атомов, так и для таких, которые состоят из двух, либо многоатомных молекул одного элемента.
- Например, Al(s) и Cl2 имеют степень окисления 0, поскольку оба находятся в химически несвязанном элементарном состоянии.
- Обратите внимание, что аллотропная форма серы S8, или октасера, несмотря на свое нетипичное строение, также характеризуется нулевой степенью окисления.
-

2
Определите, состоит ли рассматриваемое вещество из ионов. Степень окисления ионов равняется их заряду. Это справедливо как для свободных ионов, так и для тех, которые входят в состав химических соединений.
- Например, степень окисления иона Cl– равняется -1.
- Степень окисления иона Cl в составе химического соединения NaCl также равна -1. Поскольку ион Na, по определению, имеет заряд +1, мы заключаем, что заряд иона Cl -1, и таким образом степень его окисления равна -1.
-

3
Учтите, что ионы металлов могут иметь несколько степеней окисления. Атомы многих металлических элементов могут ионизироваться на разные величины. Например, заряд ионов такого металла как железо (Fe) равняется +2, либо +3.[1]
Заряд ионов металла (и их степень окисления) можно определить по зарядам ионов других элементов, с которыми данный металл входит в состав химического соединения; в тексте этот заряд обозначается римскими цифрами: так, железо (III) имеет степень окисления +3.- В качестве примера рассмотрим соединение, содержащее ион алюминия. Общий заряд соединения AlCl3 равен нулю. Поскольку нам известно, что ионы Cl– имеют заряд -1, и в соединении содержится 3 таких иона, для общей нейтральности рассматриваемого вещества ион Al должен иметь заряд +3. Таким образом, в данном случае степень окисления алюминия равна +3.
-

4
Степень окисления кислорода равна -2 (за некоторыми исключениями). Почти во всех случаях атомы кислорода имеют степень окисления -2. Есть несколько исключений из этого правила:
- Если кислород находится в элементарном состоянии (O2), его степень окисления равна 0, как и в случае других элементарных веществ.
- Если кислород входит в состав перекиси, его степень окисления равна -1. Перекиси — это группа соединений, содержащих простую кислород-кислородную связь (то есть анион перекиси O2-2). К примеру, в составе молекулы H2O2 (перекись водорода) кислород имеет заряд и степень окисления -1.
- В соединении с фтором кислород обладает степенью окисления +2, читайте правило для фтора ниже.
-

5
Водород характеризуется степенью окисления +1, за некоторыми исключениями. Как и для кислорода, здесь также существуют исключения. Как правило, степень окисления водорода равна +1 (если он не находится в элементарном состоянии H2). Однако в соединениях, называемых гидридами, степень окисления водорода составляет -1.
- Например, в H2O степень окисления водорода равна +1, поскольку атом кислорода имеет заряд -2, и для общей нейтральности необходимы два заряда +1. Тем не менее, в составе гидрида натрия степень окисления водорода уже -1, так как ион Na несет заряд +1, и для общей электронейтральности заряд атома водорода (а тем самым и его степень окисления) должен равняться -1.
-

6
Фтор всегда имеет степень окисления -1. Как уже было отмечено, степень окисления некоторых элементов (ионы металлов, атомы кислорода в перекисях и так далее) может меняться в зависимости от ряда факторов. Степень окисления фтора, однако, неизменно составляет -1. Это объясняется тем, что данный элемент имеет наибольшую электроотрицательность — иначе говоря, атомы фтора наименее охотно расстаются с собственными электронами и наиболее активно притягивают чужие электроны. Таким образом, их заряд остается неизменным.
-

7
Сумма степеней окисления в соединении равна его заряду. Степени окисления всех атомов, входящих в химическое соединение, в сумме должны давать заряд этого соединения. Например, если соединение нейтрально, сумма степеней окисления всех его атомов должна равняться нулю; если соединение является многоатомным ионом с зарядом -1, сумма степеней окисления равна -1, и так далее.
- Это хороший метод проверки — если сумма степеней окисления не равна общему заряду соединения, значит вы где-то ошиблись.
Реклама
-

1
Найдите атомы, не имеющие строгих правил относительно степени окисления. По отношению к некоторым элементам нет твердо установленных правил нахождения степени окисления. Если атом не подпадает ни под одно правило из перечисленных выше, и вы не знаете его заряда (например, атом входит в состав комплекса, и его заряд не указан), вы можете установить степень окисления такого атома методом исключения. Вначале определите заряд всех остальных атомов соединения, а затем из известного общего заряда соединения вычислите степень окисления данного атома.
- Например, в соединении Na2SO4 неизвестен заряд атома серы (S) — мы лишь знаем, что он не нулевой, поскольку сера находится не в элементарном состоянии. Это соединение служит хорошим примером для иллюстрации алгебраического метода определения степени окисления.
-

2
Найдите степени окисления остальных элементов, входящих в соединение. С помощью описанных выше правил определите степени окисления остальных атомов соединения. Не забывайте об исключениях из правил в случае атомов O, H и так далее.
- Для Na2SO4, пользуясь нашими правилами, мы находим, что заряд (а значит и степень окисления) иона Na равен +1, а для каждого из атомов кислорода он составляет -2.
-

3
Умножьте количество атомов на их степень окисления. Теперь, когда нам известны степени окисления всех атомов за исключением одного, необходимо учесть, что атомов некоторых элементов может быть несколько. Умножьте число атомов каждого элемента (оно указано в химической формуле соединения в виде подстрочного числа, следующего за символом элемента) на его степень окисления.
- В Na2SO4 мы имеем 2 атома Na и 4 атома O. Таким образом, умножая 2 × +1, получаем степень окисления всех атомов Na (2), а умножая 4 × -2 — степень окисления атомов O (-8).
-

4
Сложите предыдущие результаты. Суммируя результаты умножения, получаем степень окисления соединения без учета вклада искомого атома.
- В нашем примере для Na2SO4 мы складываем 2 и -8 и получаем -6.
-

5
Найдите неизвестную степень окисления из заряда соединения. Теперь у вас есть все данные для простого расчета искомой степени окисления. Запишите уравнение, в левой части которого будет сумма числа, полученного на предыдущем шаге вычислений, и неизвестной степени окисления, а в правой — общий заряд соединения. Иными словами, (Сумма известных степеней окисления) + (искомая степень окисления) = (заряд соединения).
- В нашем случае Na2SO4 решение выглядит следующим образом:
- (Сумма известных степеней окисления) + (искомая степень окисления) = (заряд соединения)
- -6 + S = 0
- S = 0 + 6
- S = 6. В Na2SO4 сера имеет степень окисления 6.
Реклама
- В нашем случае Na2SO4 решение выглядит следующим образом:
Советы
- В соединениях сумма всех степеней окисления должна равняться заряду. Например, если соединение представляет собой двухатомный ион, сумма степеней окисления атомов должна быть равна общему ионному заряду.
- Очень полезно уметь пользоваться периодической таблицей Менделеева и знать, где в ней располагаются металлические и неметаллические элементы.
- Степень окисления атомов в элементарном виде всегда равна нулю. Степень окисления единичного иона равна его заряду. Элементы группы 1A таблицы Менделеева, такие как водород, литий, натрий, в элементарном виде имеют степень окисления +1; степень окисления металлов группы 2A, таких как магний и кальций, в элементарном виде равна +2. Кислород и водород, в зависимости от вида химической связи, могут иметь 2 различных значения степени окисления.
Реклама
Что вам понадобится
- Периодическая таблица элементов
- Доступ в интернет или справочники по химии
- Лист бумаги, ручка или карандаш
- Калькулятор
Об этой статье
Эту страницу просматривали 644 676 раз.
