Как расставлять степени окисления в органических соединениях?.
Степени окисления в органических соединениях требуется уметь расставлять для решения заданий ЕГЭ по химии, в которых дается цепочка превращений органических веществ, часть из которых неизвестна. На данный момент это задания номер 32.
Для определения степени окисления в органических соединениях существует два метода. Суть их одинакова, но выглядят применение данных методов по-разному.
Первый способ я бы назвал методом блоков.
Метод блоков
Берем органическую молекулу, например, такого вещества, как 2-гидроксипропаналь
и изолируем друг от друга все фрагменты молекулы, содержащие по одному атому углерода следующим образом:
Суммарный заряд каждого такого блока принимаем равным нулю, как у отдельной молекулы. В органических соединениях водород всегда имеет степень окисления, равную +1, а кислород — -2. Обозначим степень окисления атома углерода в первом блоке переменной х. Таким образом, мы можем найти степень окисления первого атома углерода, решив уравнение:
x + 3∙(+1) = 0, где x – степень окисления атома углерода, +1 – степень окисления атома водорода, а 0 – заряд выбранного блока.
Решаем далее:
x + 3 = 0, отсюда x = -3.
Таким образом, степень окисления атома углерода в первом блоке равна -3.
Во второй блок, помимо одного атома углерода и двух атомов водорода, входит также и атом кислорода, который, как мы уже сказали, имеет в органических соединениях практически всегда степень окисления, равную -2. Как и в первом случае, обозначим степень окисления атома углерода второго блока через х, тогда получим следующее уравнение:
x+2∙(+1)+(-2) = 0, решая которое находим, что х = 0. Т.е. степень окисления второго атома углерода в молекуле равна нулю.
Третий блок состоит из одного атома углерода, одного атома водорода и одного атома кислорода. Аналогично составим уравнение:
x +1∙(-2)+ 1 = 0, отсюда х, то есть степень окисления атома углерода в третьем блоке равна +1.
Второй метод расстановки степеней окисления в органических веществах я называю «метод стрелок».
Метод стрелок
Для того, чтобы его использовать, нужно нарисовать сначала развернутую структурную формулу органического вещества:
Под черточками между символами элементов понимают их общие электронные пары, которые между одинаковыми атомами можно считать распределенными поровну, а между разными – смещенными к одному из атомов, обладающему большей электроотрицательностью. Среди трех элементов С, Н и О наибольшую элетроотрицательность имеет кислород, затем углерод, а самое малое значение электроотрицательности у водорода. Поэтому, если показать стрелочкой смешение электронов в сторону более электроотрицательных атомов, мы получим следующую картинку:
Как можно заметить, между атомами углерода мы не стали рисовать стрелку, оставив обычную черточку, поскольку считается, что общая электронная пара между двумя атомами углерода практически не смещена ни к одному из них.
Будет интерпретировать последний рисунок следующим образом: каждый атом, из которого стрелка исходит, «теряет» один электрон, а каждый атом, в который стрелка входит, «принимает» электрон. При этом помним, что заряд электрона отрицателен и равен -1.
Таким образом, первому атому углерода достается от трех атомов водорода по одному электрону (три входящих стрелки), в результате чего он приобретает условный заряд, т.е. степень окисления, равную -3, а каждый атома водорода — +1 (по одной исходящей стрелке).
Второму атому углерода достается от «верхнего» атома водорода один электрон (стрелка от H к С), и еще один электрон атом углерода «теряет», передавая его атому кислорода (стрелка от С к О). Таким образом, в атом углерода «входит» один электрон и один из него «выходит». Поэтому степень окисления второго атома углерода равна 0, как в отдельном атоме.
К атому кислорода направлены две стрелки, значит, он имеет степень окисления, равную -2, а от всех атомов водорода исходит по одной стрелке. То есть степень окисления всех атомов водорода равна +1.
В последний атом углерода входит одна стрелка от Н и исходит две стрелки к О, таким образом, «входит» один электрон и «выходят» два. Значит, степень окисления равна +1.
Нужно отметить, что на самом деле оба описанных метода весьма условны, как, собственно, и условно само понятие «степень окисления» в случае органических веществ. Тем не менее, в рамках школьной программы данные методы вполне справедливы и, главное, позволяют использовать их при расстановке коэффициентов в реакциях ОВР с органическими веществами. Лично мне нравится больше метод «стрелок». Советую усвоить оба метода: одним из них вы можете определять степени окисления, а вторым — убедиться в правильности полученных значений.
Рада видеть Вас на моем канале) В данной статье мы разберем как расставить степени окисления в органических веществах.
Определение степеней окисления всегда вызывает трудности у учащихся. Но на самом деле, если разобраться, то все очень просто)
Как определить степень окисления в органике?!😬
Вопрос, который мучает многих 10-классников и вызывает панику.
Давайте разбираться🤓.
Выделяют два способа для определения степеней окисления у элементов, входящих в состав органического вещества:
1) Метод блоков;
2) Метод стрелок (графический метод)
Метод блоков.
Со своими учениками я чаще всего разбираю «Метод блоков», мне кажется этот способ более простым и удобным. В чем же он заключается?
Рассмотрим на примере молекулы пропана.
1. Формулу органического соединения визуально (на первых порах можно и нарисовать) разделим на блоки так, чтобы внутри блока оказался один углерод.
Заряды внутри каждого блока компенсируют друг друга, то есть равны нулю.
2. Далее мы расставляем степени окисления у тех элементов, степень окисления которых, в большинстве соединений, является постоянной (это Н, О).
3. Считаем сколько плюсов внутри КАЖДОГО блока.
4. Теперь считаем, сколько должно быть минусов у углерода в первом блоке, чтобы в результате получился ноль?
х+(+3)=0
Х+3=0
Х=-3
Значит у углерода внутри первого блока степень окисления -3.
Также поступаем со вторым и третьим блоком.
Определение степени окисления углерода во втором блоке.
х+(+2) =0
Х+2=0
Х=-2
Попробуем определить степень окисления у вещества посложнее.
Первое действие – разделить на блоки (для удобства пронумерую углероды, чтобы было понятно о каком именно идет речь).
Обратите внимание, что второй углерод связан с кислородом и частичкой ОН, поэтому в блок мы будет выделять все вместе!
Второе – расставим степени окисления у водорода и кислорода.
Начинаем с первого углерода. Рядом с ним стоят три водорода, которые суммарно дают ТРИ ПЛЮСА.
х+(+3) = 0
х= -3
Значит, степень окисления у углерода должна быть равна МИНУС ТРИ.
Второй углерод: рядом с ним стоит один водород (+1), кислород (-2) и есть еще один водород (+1).
Считаем, +1+(-2)+(+1)+х=0
+2-2+х=0
х=0
Значит, степень окисления у второго углерода равна нулю!
Четвёртый углерод. Рядом с ним нет ни водорода, ни кислорода, а мы помним, что внутри блока степень должна быть равна нулю, значит у четвертого углерода степень окисления тоже равна нулю.
Надеюсь, я смогла помочь Вам разобраться с расстановкой степеней окисления, используя “Метод блоков”.
В следующей статье мы познакомимся с еще одним способом расстановки степеней окисления.
До скорой встречи!🥰
Вторая часть статьи
https://dzen.ru/media/id/63fb2df384d4d649ec029eee/opredelenie-stepenei-okisleniia-chast-2-63fceaa4021a136684a6073f
Как определить степень окисления в органических соединениях? Чем отличается определение степени окисления в органических соединениях от определения степени окисления в неорганических? Как составить уравнение окислительно-восстановительной реакции, в которой участвуют соединения углерода, и правильно расставить коэффициенты?
Обо всем этом в данной статье подробно и по порядку.
Содержание:
1. Что такое электроотрицательность, степень окисления и ковалентная связь
2. Как определить степень окисления в органических соединениях: примеры
3. Как расставить коэффициенты в окислительно-восстановительных реакциях с органическими веществами
Проблема, как определить степень окисления в органических соединениях, вытекает из школьного курса химии. Определенное (но не достаточное) внимание уделяется этому вопросу на примере неорганических веществ. Об органических же веществах в этой связи речь практически не идет.
Тем не менее, об окислении соединений углерода в курсе органической химии (10 класс) говорится достаточно часто. 33 задание в ЕГЭ по химии практически всегда подразумевает хотя бы одну ОВР с участием органического вещества и необходимость не только составить схему реакции, но и расставить коэффициенты.
Придя в колледж или университет, изучая курс органической химии на более серьезном уровне, студент сталкивается все с той же проблемой: как определить степень окисления в органических соединениях. Подразумевается, что бывший выпускник школы получил эти знания в школьном курсе химии, поэтому нет надобности останавливаться на данном вопросе в профессиональном образовании.
Налицо потеря взаимосвязи и преемственности разных ступеней образования: среднего основного и профессионального (СПО и ВПО).
Итак, разберемся по порядку как определить степень окисления в органических соединениях.
Что такое электроотрицательность, степень окисления и ковалентная связь
Для того чтобы правильно определить степень окисления в органическом соединении, необходимо четко и ясно усвоить три основных понятия: собственно само понятие степень окисления, электроотрицательность и ковалентная связь.
Остановимся на них кратко, так как их рассмотрение не является основной целью данной статьи.
Что такое электроотрицательность
Понятие электроотрицательности (ЭО) впервые было введено американским химиком Л.Полингом в 1932 г.
Кстати, ЭО – это еще одна относительная величина в химии. Ее правильнее называть относительной электроотрицательностью (ОЭО). Абсолютные значения ЭО очень не удобны в расчетах, поэтому их вычисляют относительно значения ЭО лития Li. Относительные величины не имеют единиц измерения.
Были получены вполне приемлемые для расчетов и анализа числа, которые сведены в удобную таблицу, в общих чертах похожую на периодическую систему химических элементов.
Способность атомов химических элементов притягивать к себе электроны других атомов в процессе образования химической связи называется электроотрицательностью.
Почему нейтральные атомы притягиваются
Раз атомы притягивают к себе электроны, то закономерно возникает следующий вопрос. Если атом, по определению, – это электронейтральная частица, то как он может вообще к себе что-то притягивать, в частности электроны – отрицательно заряженные частицы?
Вообще этот вопрос можно бы переадресовать ученым, специалистам, занимающимся проблемами квантовой механики (один из разделов современной физики).
А мы же лишь крайне упрощенно поясним, почему такое может быть.
Необходимо вспомнить, что силовые линии электрического поля положительного заряда (а им является ядро атома) всегда заканчиваются на отрицательном заряде (электроны атома).
У атомов большинства химических элементов внешний уровень не завершен. То есть в нем есть своеобразная «дырка», сквозь которую выходят силовые линии ядра. Выходят они за пределы атома и заканчиваются на электронах другого атома. В подобной ситуации, несмотря на свою общую электронейтральность, атом ведет себя как положительная частица.
Примерно так это выглядит
При всем при этом атомы полностью не «слипаются». Это не возможно, так как положительно заряженные ядра атомов будут отталкиваться. Но поскольку расстояние между ядром одного атома и электронами другого меньше расстояния между ядрами, то можно утверждать, что силы притяжения все-таки преобладают над силами отталкивания. При сближении атомов их внешние орбитали будут перекрываться. В пространстве между ядрами электронная плотность несколько увеличится. Но здесь она равномерно не распределяется, а смещается в сторону того ядра, влияние которого сильнее. Сила влияния определяется как величиной положительного заряда, так и радиусом атома.
При сближении атомов их внешние орбитали будут перекрываться. В пространстве между ядрами электронная плотность несколько увеличится. Но здесь она равномерно не распределяется, а смещается в сторону того ядра, влияние которого сильнее. Сила влияния определяется как величиной положительного заряда, так и радиусом атома.
Для чего необходимо понятие относительной электроотрицательности
Знание и понимание понятия ОЭО дает возможность определить тип химической связи между атомами. Для этого необходимо найти разность ОЭО двух элементов, атомы которых и образуют связь.
Если разность электроотрицательностей менее 0,5, то связь считается ковалентной неполярной. При разности от 0,5 до 1,6 – связь ковалентная полярная. Если более 2,0 – ионная. А если разность в промежутке от 1,6 до 2,0, то в присутствии металла связь считается ионной, при его отсутствии – ковалентной полярной.
Что такое ковалентная связь
Почему мы говорим здесь о ковалентной связи? Потому, что большинство органических соединений – ковалентные. А это очень важно при определении с.о. углерода в них.
Если коротко, то
ковалентная связь – связь между атомами элементов, возникающая за счет обобществления электронов, т.е. образования общих электронных пар.

Если связь образована между атомами с одинаковой ОЭО, то связь будет считаться ковалентной неполярной. Это потому, что между атомами не происходит перераспределения электронной плотности. Иными словами обобществленная электронная пара не смещается к какому-либо атому.
Такая ситуация возможна, если в образовании связи участвуют атомы одного и того же химического элемента-неметалла:

Но есть и редкие исключения. Молекула фосфина PH3 характеризуется ковалентной неполярной связью, так как относительные электроотрицательности водорода и фосфора равны: ОЭО(Н)=2,1 и ОЭО(Р)=2,1.
Если же связь образована элементами-неметаллами с разной ОЭО, то она считается ковалентной полярной. Происходит перераспределение электронной плотности между атомами, т.е. общая электронная пара смещается к атому с большей ОЭО. И чем сильнее будет разность в электроотрицательностях атомов элементов, тем полярнее будет и связь.
И еще одно понятие, связанное с ковалентностью, – это валентность, означающая количество общих электронных пар (или иными словами, количество связей между атомами).
Что такое степень окисления и какие значения она может принимать
Степень окисления (с.о.) – важнейшее понятие в теории окислительно-восстановительных процессов. И это условная величина.
Известно, что при образовании ковалентной связи электроны общей электронной пары смещаются к атому более электроотрицательного элемента. Но лишь смещаются, а не полностью переходят к нему!
В итоге на более электроотрицательном атоме возникнет частичный (точнее дробный) отрицательный заряд (δ-), например, -0,73, -2/3 и т.п. А на менее электроотрицательном атоме – частичный положительный (δ+) заряд. Такими дробными числами крайне неудобно пользоваться при вычислениях и составлении формул веществ. Поэтому условно (!) считают, что электроны полностью переходят от одного атома к другому, как это происходит при образовании ионной связи. И в связи с этим значения с.о. целочисленные: +2, -1, +6 и т.д.
Поэтому условно (!) считают, что электроны полностью переходят от одного атома к другому, как это происходит при образовании ионной связи. И в связи с этим значения с.о. целочисленные: +2, -1, +6 и т.д.
Классифицировать с.о. можно по разным признакам. Один из них – это постоянство для одного и того же химического элемента.
Согласно данному признаку, существуют элементы, проявляющие во всех без исключения сложных веществах одну и ту же (постоянную) степень окисления. Например: Другие элементы в разных веществах могут проявлять разные (переменные) степени окисления. Например:
Другие элементы в разных веществах могут проявлять разные (переменные) степени окисления. Например: И кстати, когда речь заходит об органических веществах, то чаще упоминается валентность углерода в них, но никак не степень окисления.
И кстати, когда речь заходит об органических веществах, то чаще упоминается валентность углерода в них, но никак не степень окисления.
А вот теперь самое интересное! Мы прекрасно знаем, что химический элемент углерод проявляет две степени окисления: +2 (в соединении СО) и +4 (СО2, например).
И настолько прочно это закрепляется в сознании, что мы и не предполагаем, что на самом деле у углерода может быть весь спектр степеней окисления от -4 до +4.
Более того, находясь в составе сложного органического соединения, углерод может иметь и нулевую степень окисления! Уж это совсем не вяжется с устоявшимися представлениями, выработанными на основе знаний о неорганических веществах. Для них мы знаем, что с.о. равная нулю возможна у атомов элементов в составе простых веществ (О3, P4, H2, N2 и т.д.)
Подведем некоторый итог.
В органических соединениях:
1) с.о. углерода принимает значения от -4 до +4;
2) с.о. углерода может быть равна 0;
3) валентность углерода постоянна, равна IV и не всегда совпадает по значению со степенью окисления.
Как определить степень окисления в органических соединениях: примеры
Методы, которыми мы пользуемся для определения с.о. в неорганических веществах, применимы к органическим лишь в очень редких случаях.
Напомним, что при этом мы всегда исходим из положения, что молекула вещества электронейтральна, то есть алгебраическая сумма всех зарядов (степеней окисления), как положительных, так и отрицательных, внутри нее равна нулю. Например: Подобный подход в случае органических веществ с полным правом можно применить тогда, когда в составе вещества только один атом углерода. А таких органических веществ крайне мало. Например:
Подобный подход в случае органических веществ с полным правом можно применить тогда, когда в составе вещества только один атом углерода. А таких органических веществ крайне мало. Например: В случае более сложных органических веществ такой подход не срабатывает:
В случае более сложных органических веществ такой подход не срабатывает: То есть в молекуле пропана С3Н8 углерод проявляет две степени окисления: -2 и -3.
То есть в молекуле пропана С3Н8 углерод проявляет две степени окисления: -2 и -3.
Особенности определения с.о. в органических веществах
Определить степень окисления в органических веществах можно разными способами. Разберем самый простой и удобный, на наш взгляд. Именно для этого мы вспомнили, что такое относительная электроотрицательность, ковалентная связь и ее виды.
Вернемся к ранее упомянутому пропану С3Н8 и рассмотрим, какие виды ковалентной связи присутствуют в его молекуле.
Для этого:
1) запишем полную структурную формулу вещества и пронумеруем атомы углерода;
2) определим, какие связи в молекуле будут ковалентными полярными и ковалентными неполярными;
3) для ковалентных полярных связей покажем смещение общей электронной пары с помощью стрелки (так как ОЭО(С) > ОЭО(Н), то смещение происходит от Н к С); 4) проставим с.о. водорода Н, она всегда в соединениях с неметаллами равна +1;
4) проставим с.о. водорода Н, она всегда в соединениях с неметаллами равна +1; 5) рассмотрим ситуацию у первого атома углерода С1; к нему будут смещены общие электронные пары от трех атомов Н; связь с соседним атомом углерода С2 неполярная, и смещения общей электронной пары здесь не происходит; следовательно, на С1 возникнет заряд (с.о.) -3. То же самое происходит и на третьем атоме углерода С3;
5) рассмотрим ситуацию у первого атома углерода С1; к нему будут смещены общие электронные пары от трех атомов Н; связь с соседним атомом углерода С2 неполярная, и смещения общей электронной пары здесь не происходит; следовательно, на С1 возникнет заряд (с.о.) -3. То же самое происходит и на третьем атоме углерода С3; 6) аналогично определяем с.о. второго атома углерода С2:
6) аналогично определяем с.о. второго атома углерода С2: Таким образом, получается, что в молекуле пропана с.о. углерода -2 и -3.
Таким образом, получается, что в молекуле пропана с.о. углерода -2 и -3.
Но даже и такой вполне удобный способ определения с.о. не всегда бывает справедлив. Все дело во влиянии атомов кислорода на распределение зарядов в молекуле.
Например, если применять указанный выше способ к определению с.о. углерода в молекуле метанола, то можно ожидать, что она буде равна -3. Однако это не так. В данной молекуле углерод имеет с.о. -2.
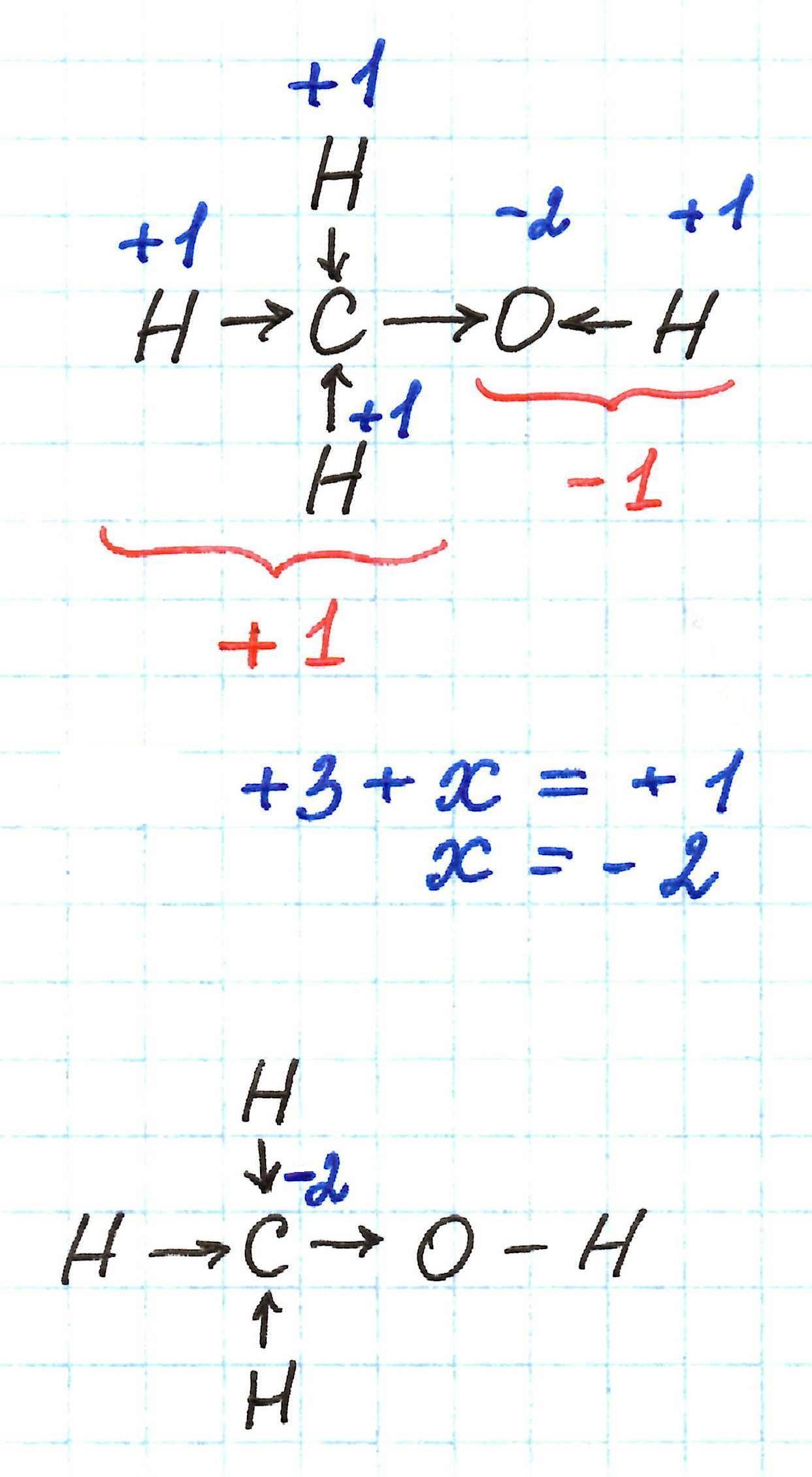
Молекулу метанола можно рассматривать как связанные между собой метильную –СН3 и гидроксильную –ОН группы. В таком случае суммарные заряды каждой из них в итоге должны дать ноль, так как молекула в целом электронейтральна.
Атом кислорода, как самый электроотрицательный в молекуле метанола, оттягивает к себе электронные плотности связей С-О и Н-О, принимая с.о. -2. Таким образом, суммарный заряд гидроксильной –ОН группы равен -1. Тогда суммарный заряд метильной –СН3 группы должен быть равен +1. А такое возможно только в том случае, если атом углерода имеет с.о. -2.
Ясно, что подобная ситуация будет возникать всегда в тех случаях, когда атом углерода связан с гидроксильной –ОН группой, образуя первичный спирт.
Нечто подобное происходит со степенью окисления углерода в молекуле диметилового эфира. Здесь также можно ожидать с.о. углерода -3. Но она равна -2 на обоих атомах.
Молекула диметилового эфира – это две метильные группы, связанные через атом кислорода (его с.о. -2). Каждая –СН3 должна иметь суммарный заряд +1. Это возможно в случае с.о. углерода -2.

Приведем другие примеры.
Метилэтиловый эфир – последовательно связанные друг с другом метильная группа –СН3, атом кислорода О, гомологическая разность –СН2– и еще одна метильная группа –СН3.
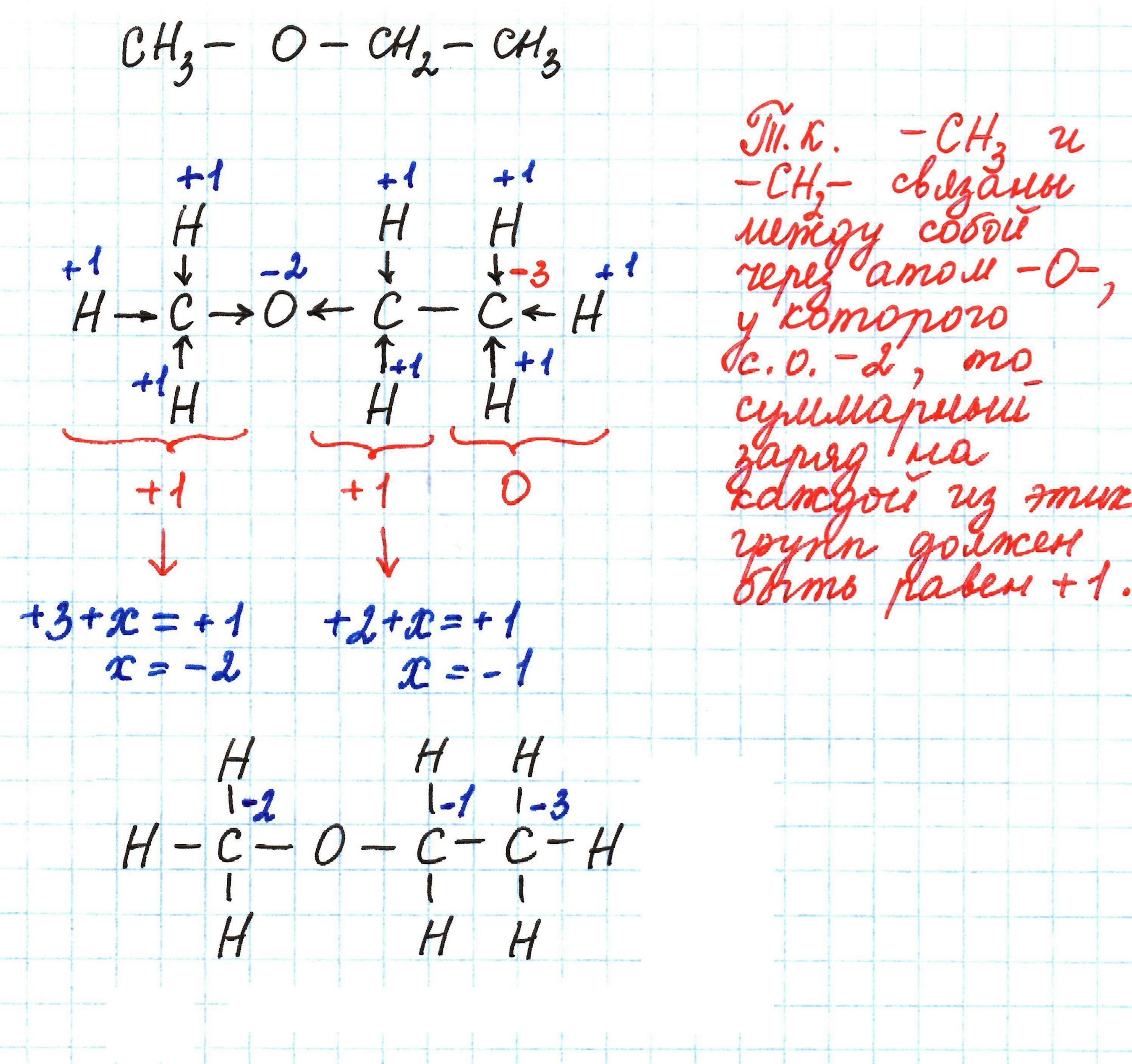
Таким образом, с. о. углерода в молекуле метилэтилового эфира: -2, -1, -3.
Степень окисления углерода в молекуле уксусного альдегида принимает значения -3 и +1: Степень окисления углерода в молекуле пропионовой кислоты равна -3, -2 и +3:
Степень окисления углерода в молекуле пропионовой кислоты равна -3, -2 и +3: Степень окисления углерода в молекуле состава С4Н8 неоднозначна. Такая молекулярная формула соответствует нескольким веществам, отличающимся друг от друга структурой (иначе говоря, изомерам):
Степень окисления углерода в молекуле состава С4Н8 неоднозначна. Такая молекулярная формула соответствует нескольким веществам, отличающимся друг от друга структурой (иначе говоря, изомерам): Степень окисления углерода в молекуле анилина составляет -1 и +1:
Степень окисления углерода в молекуле анилина составляет -1 и +1: Степень окисления углерода в молекуле глюкозы принимает три разных значения: -1, 0 и +1:
Степень окисления углерода в молекуле глюкозы принимает три разных значения: -1, 0 и +1:
Приведенные примеры позволяют сделать общие выводы о том, как определить степень окисления в органических соединениях.
1) Каждая ковалентная полярная связь, электронная плотность которой смещается К атому углерода (Н→С), добавляет в значение его с.о. -1.
2) Каждая ковалентная полярная связь, электронная плотность которой смещается ОТ атома углерода (С→О, С→N и т.д.), добавляет в его значение с.о. +1.
3) Определяя конечное значение с.о. углерода, необходимо посчитать количество смещенных ОТ него и К нему связей с учетом знака (+ или -).
! При этом не следует забывать о влиянии более электроотрицательных атомов на распределение электронной плотности (а, значит, и зарядов), что приводит в некоторых случаях к несоблюдению указанных общих выводов.
Как расставить коэффициенты в окислительно-восстановительных реакциях с органическими веществами
Существует два основных метода составления схемы ОВР и подбора коэффициентов в таких реакциях: метод электронного баланса и ионно-электронный метод (полуреакций). Каждый из них удобнее использовать в той или иной ситуации. В данной статье мы не рассматриваем суть этих методов, а останавливаемся на применении их к ОВР с участием органических веществ.
Итак, начнем с самых простых окислительно-восстановительных реакций, в которых реагентами выступают органические соединения. Для определения степени окисления углерода будем использовать выше описанный метод. В каждом конкретном примере на этом останавливаться уже не будем.
Пример 1. СН4 + О2 → СО2 + Н2О
При расстановке коэффициентов в данном случае лучше воспользоваться методом электронного баланса:
1) определим с.о. элементов;
2) составим схемы полуреакций с элементами, изменяющими свою с.о.;
3) используя данные по числу отданных и принятых электронов в полуреакциях, найдем наименьшее общее кратное и определим множители для каждой из полуреакций;
4) просуммируем полуреакции с учетом найденных множителей (коэффициентов);
5) перенесем коэффициенты в схему реакции, поставив их перед соответствующими веществами;
6) подберем коэффициенты для всех остальных химических элементов;
7) помним, что баланс количества атомов кислорода проверяем в последнюю очередь. Обычно, если число атомов кислорода слева (до стрелки) и справа (после стрелки) сходится, то это означает, что реакция составлена правильно и все остальные коэффициенты верны.
Пример 2. С3Н8 + О2 → СО2 + Н2О
В данном случае также удобнее использовать метод электронного баланса.
Расстановку коэффициентов проводим, как и в предыдущем случае. Однако есть некоторый нюанс. После определения с.о. углерода в пропане обнаруживаем, что их две: -2 и -3. Поэтому составленных схем полуреакций для углерода будет две.
Пример 3. Н2C2O4 + KMnO4 → СО2 + K2CO3 + MnO2 + Н2О
Для расстановки коэффициентов вновь воспользуемся методом электронного баланса.
Пример 4. CH3OH + K2Cr2O7 + H2SO4 → HCOOH + Cr2(SO4)3 + K2SO4 + Н2О
В данном случае метанол и дихромат калия реагируют в кислой среде. Для расстановки коэффициентов можно воспользоваться любым из методов. Еще раз применим метод электронного баланса.
Пример 5. C6H12O6 + KMnO4 + H2SO4 → CO2 + MnSO4 + K2SO4 + Н2О
Расставим коэффициенты тремя разными способами.
Способ 1. В молекуле глюкозы степень окисления углерода -1, 0 и +1. Примем, что средняя с.о. равна 0. Имейте ввиду, что такой подход не всегда и не для всех веществ будет оправдан. В данном случае это вполне возможно.
Способ 2. Расставим коэффициенты методом электронного баланса, используя все три с.о. углерода.
Способ 3. Поскольку реакция между глюкозой и перманганатом калия проходит в кислой среде (в H2SO4), расставим коэффициенты ионно-электронным методом (полуреакций):
1) молекулярные вещества (а к ним относится и глюкоза) на ионы не диссоциируют, поэтому в схемах полуреакций записываются в исходном виде;
2) количество недостающих кислорода и водорода в полуреакциях компенсируем, дописывая по необходимости молекулы воды H2O или ионы водорода Н+;
3) считаем слева и справа в каждой полуреакции суммарный заряд (он создается ионами, образовавшимися при диссоциации реагирующих веществ, и ионами водорода Н+);
4) разницу зарядов компенсируем отдаваемыми или принимаемыми электронами;
5) так же, как и в методе электронного баланса, находим наименьшее общее кратное, определяем множители для каждой из полуреакций;
6) просуммируем полуреакции с учетом найденных множителей (коэффициентов);
7) перенесем коэффициенты в схему реакции, поставив их перед соответствующими веществами;
8) подберем коэффициенты для всех остальных химических элементов;
9) помним, что баланс количества атомов кислорода проверяем в последнюю очередь.
Пример 6. C3H4 + KMnO4 + H2SO4 → CH3COOH + CO2 + MnSO4 + K2SO4 + Н2О
В исходном веществе C3H4 (пропин) степени окисления углерода принимают значения -3, -1 и 0. В образовавшейся уксусной кислоте CH3COOH: -3 и +3. Кроме того, в углекислом газе CO2 с.о. углерода равна +4.
Такое разнообразие степеней окисления одного элемента затрудняет применение метода электронного баланса. Поэтому лучше воспользоваться методом полуреакций.
Действие окислителей на органические вещества
В зависимости от строения и состава органических веществ (разветвленность углеродного скелета, наличие функциональных групп и их количество), а также от условий процесса (избыток или недостаток окислителя, его концентрация, рН раствора, нагревание или охлаждение) окисление происходит по-разному.
Так, например, при окислении алкена раствором KMnO4 в мягких условиях (без нагревания и в нейтральной или слабощелочной среде) образуется двухатомный спирт. А при окислении алкена раствором KMnO4 в жестких условиях (с нагреванием и в кислой или сильнощелочной среде) молекула по двойной связи разрушается, и образуются совершенно иные продукты. Это могут быть и карбоновая кислота, и ее соль и СО2.
Знание действия окислителей на органические вещества тех или иных классов поможет верно определить продукты окислительно-восстановительной реакции и правильно расставить в них коэффициенты.
Итак, ответ на вопрос: «Как определить степень окисления в органических веществах», – позволяет правильно составить схему реакции с участием органических веществ и подобрать наиболее оптимальный метод расстановки коэффициентов.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.

Hydrogen
| Discovered | State |
|---|---|
| 1766 | Gas |
| Atomic Mass | Density |
| 1.008 | 0.08988 g/L |
1
1
H
2
| Electrons | Protons | Neutrons |
|---|---|---|
| 1 | 1 | 0 |
| Electronic Configuration | ||
| 1s1 |
- Discovered By: Henry Cavendish
- Appearance: colorless gas
- Category: diatomic nonmetal
- Melting Point: 13.99 K
- Boiling Point: 20.271 K
- Ox. State: -1, 1
- Bonding Type: diatomic
- Electronegativity: 2.2
- Wiki Link: Source Link
- Element Image: Image Link
Hydrogen is a chemical element with chemical symbol H and atomic number 1. With an atomic weight of 1.00794 u, hydrogen is the lightest element on the periodic table. Its monatomic form (H) is the most abundant chemical substance in the Universe, constituting roughly 75% of all baryonic mass.
Helium
| Discovered | State |
|---|---|
| 1895 | Gas |
| Atomic Mass | Density |
| 4.0026022 | 0.1786 g/L |
4
2
He
| Electrons | Protons | Neutrons |
|---|---|---|
| 2 | 2 | 2 |
| Electronic Configuration | ||
| 1s2 |
- Discovered By: Pierre Janssen
- Appearance: colorless gas
- Category: noble gas
- Melting Point: 0.95 K
- Boiling Point: 4.222 K
- Ox. State:
- Bonding Type: atomic
- Electronegativity:
- Wiki Link: Source Link
- Element Image: Image Link
Helium is a chemical element with symbol He and atomic number 2. It is a colorless, odorless, tasteless, non-toxic, inert, monatomic gas that heads the noble gas group in the periodic table. Its boiling and melting points are the lowest among all the elements.
Lithium
| Discovered | State |
|---|---|
| 1817 | Solid |
| Atomic Mass | Density |
| 6.94 | 0.534 g/L |
7
3
Li
| Electrons | Protons | Neutrons |
|---|---|---|
| 3 | 3 | 4 |
| Electronic Configuration | ||
| [He] 2s1 |
- Discovered By: Johan August Arfwedson
- Appearance: silvery-white
- Category: alkali metal
- Melting Point: 453.65 K
- Boiling Point: 1615 K
- Ox. State: 1
- Bonding Type: metallic
- Electronegativity: 0.98
- Wiki Link: Source Link
- Element Image: Image Link
Lithium (from Greek:λίθος lithos, “stone”) is a chemical element with the symbol Li and atomic number 3. It is a soft, silver-white metal belonging to the alkali metal group of chemical elements. Under standard conditions it is the lightest metal and the least dense solid element.
Beryllium
| Discovered | State |
|---|---|
| 1798 | Solid |
| Atomic Mass | Density |
| 9.01218315 | 1.848 g/L |
9
4
Be
| Electrons | Protons | Neutrons |
|---|---|---|
| 4 | 4 | 5 |
| Electronic Configuration | ||
| [He] 2s2 |
- Discovered By: Louis Nicolas Vauquelin
- Appearance: white-gray
- Category: alkaline earth metal
- Melting Point: 1560 K
- Boiling Point: 2743 K
- Ox. State: 2
- Bonding Type: metallic
- Electronegativity: 1.57
- Wiki Link: Source Link
- Element Image: Image Link
Beryllium is a chemical element with symbol Be and atomic number 4. It is created through stellar nucleosynthesis and is a relatively rare element in the universe. It is a divalent element which occurs naturally only in combination with other elements in minerals.
Boron
| Discovered | State |
|---|---|
| 1807 | Solid |
| Atomic Mass | Density |
| 10.81 | 2.46 g/L |
10
5
B
| Electrons | Protons | Neutrons |
|---|---|---|
| 5 | 5 | 5 |
| Electronic Configuration | ||
| [He] 2s22p1 |
- Discovered By: Joseph Louis Gay-Lussac
- Appearance: black-brown
- Category: metalloid
- Melting Point: 2348 K
- Boiling Point: 4273 K
- Ox. State: 1, 2, 3
- Bonding Type: covalent network
- Electronegativity: 2.04
- Wiki Link: Source Link
- Element Image: Image Link
Boron is a metalloid chemical element with symbol B and atomic number 5. Produced entirely by cosmic ray spallation and supernovae and not by stellar nucleosynthesis, it is a low-abundance element in both the Solar system and the Earth’s crust. Boron is concentrated on Earth by the water-solubility of its more common naturally occurring compounds, the borate minerals.
Carbon
| Discovered | State |
|---|---|
| Ancient | Solid |
| Atomic Mass | Density |
| 12.011 | 2.26 g/L |
12
6
C
| Electrons | Protons | Neutrons |
|---|---|---|
| 6 | 6 | 6 |
| Electronic Configuration | ||
| [He] 2s22p2 |
- Discovered By: Ancient Egypt
- Appearance: black
- Category: polyatomic nonmetal
- Melting Point: 3823 K
- Boiling Point: 4300 K
- Ox. State: -4, -3, -2, -1, 1, 2, 3, 4
- Bonding Type: covalent network
- Electronegativity: 2.55
- Wiki Link: Source Link
- Element Image: Image Link
Carbon (from Latin:carbo “coal”) is a chemical element with symbol C and atomic number 6. On the periodic table, it is the first (row 2) of six elements in column (group) 14, which have in common the composition of their outer electron shell. It is nonmetallic and tetravalent—making four electrons available to form covalent chemical bonds.
Nitrogen
| Discovered | State |
|---|---|
| 1772 | Gas |
| Atomic Mass | Density |
| 14.0067 | 0.001251 g/L |
14
7
N
2
| Electrons | Protons | Neutrons |
|---|---|---|
| 7 | 7 | 7 |
| Electronic Configuration | ||
| [He] 2s22p3 |
- Discovered By: Daniel Rutherford
- Appearance: colorless gas
- Category: diatomic nonmetal
- Melting Point: 63 K
- Boiling Point: 77 K
- Ox. State: -3, -2, -1, 1, 2, 3, 4, 5
- Bonding Type: diatomic
- Electronegativity: 3.04
- Wiki Link: Source Link
- Element Image: Image Link
Nitrogen is a chemical element with symbol N and atomic number 7. It is the lightest pnictogen and at room temperature, it is a transparent, odorless diatomic gas. Nitrogen is a common element in the universe, estimated at about seventh in total abundance in the Milky Way and the Solar System.
Oxygen
| Discovered | State |
|---|---|
| 1774 | Gas |
| Atomic Mass | Density |
| 15.9994 | 1.429 g/L |
16
8
O
2
| Electrons | Protons | Neutrons |
|---|---|---|
| 8 | 8 | 8 |
| Electronic Configuration | ||
| [He] 2s22p4 |
- Discovered By: Carl Wilhelm Scheele
- Appearance: colorless gas
- Category: diatomic nonmetal
- Melting Point: 54.36 K
- Boiling Point: 90.188 K
- Ox. State: -2, -1, 1, 2
- Bonding Type: diatomic
- Electronegativity: 3.44
- Wiki Link: Source Link
- Element Image: Image Link
Oxygen is a chemical element with symbol O and atomic number 8. It is a member of the chalcogen group on the periodic table and is a highly reactive nonmetal and oxidizing agent that readily forms compounds (notably oxides) with most elements. By mass, oxygen is the third-most abundant element in the universe, after hydrogen and helium.
Fluorine
| Discovered | State |
|---|---|
| 1670 | Gas |
| Atomic Mass | Density |
| 18.998 | 1.696 g/L |
19
9
F
| Electrons | Protons | Neutrons |
|---|---|---|
| 9 | 9 | 10 |
| Electronic Configuration | ||
| [He] 2s22p5 |
- Discovered By: André-Marie Ampère
- Appearance:
- Category: diatomic nonmetal
- Melting Point: 53.48 K
- Boiling Point: 85.03 K
- Ox. State: -1
- Bonding Type: atomic
- Electronegativity: 3.98
- Wiki Link: Source Link
- Element Image: Image Link
Fluorine is a chemical element with symbol F and atomic number 9. It is the lightest halogen and exists as a highly toxic pale yellow diatomic gas at standard conditions. As the most electronegative element, it is extremely reactive:almost all other elements, including some noble gases, form compounds with fluorine.
Neon
| Discovered | State |
|---|---|
| 1898 | Gas |
| Atomic Mass | Density |
| 20.17976 | 0.9002 g/L |
20
10
Ne
| Electrons | Protons | Neutrons |
|---|---|---|
| 10 | 10 | 10 |
| Electronic Configuration | ||
| [He] 2s22p6 |
- Discovered By: Morris Travers
- Appearance: colorless gas
- Category: noble gas
- Melting Point: 24.56 K
- Boiling Point: 27.104 K
- Ox. State:
- Bonding Type: atomic
- Electronegativity:
- Wiki Link: Source Link
- Element Image: Image Link
Neon is a chemical element with symbol Ne and atomic number 10. It is in group 18 (noble gases) of the periodic table. Neon is a colorless, odorless, inert monatomic gas under standard conditions, with about two-thirds the density of air.
Sodium
| Discovered | State |
|---|---|
| 1807 | solid |
| Atomic Mass | Density |
| 22.989 | 0.968 g/L |
23
11
Na
| Electrons | Protons | Neutrons |
|---|---|---|
| 11 | 11 | 12 |
| Electronic Configuration | ||
| [Ne] 3s1 |
- Discovered By: Humphry Davy
- Appearance: silvery white metallic
- Category: alkali metal
- Melting Point: 370.944 K
- Boiling Point: 1156.09 K
- Ox. State: -1, 1
- Bonding Type: metallic
- Electronegativity: 0.93
- Wiki Link: Source Link
- Element Image: Image Link
Sodium /ˈsoʊdiəm/ is a chemical element with symbol Na (from Ancient Greek Νάτριο) and atomic number 11. It is a soft, silver-white, highly reactive metal. In the Periodic table it is in column 1 (alkali metals), and shares with the other six elements in that column that it has a single electron in its outer shell, which it readily donates, creating a positively charged atom – a cation.
Magnesium
| Discovered | State |
|---|---|
| 1808 | solid |
| Atomic Mass | Density |
| 24.305 | 1.738 g/L |
24
12
Mg
| Electrons | Protons | Neutrons |
|---|---|---|
| 12 | 12 | 12 |
| Electronic Configuration | ||
| [Ne] 3s2 |
- Discovered By: Joseph Black
- Appearance: shiny grey solid
- Category: alkaline earth metal
- Melting Point: 923 K
- Boiling Point: 1363 K
- Ox. State: 1, 2
- Bonding Type: metallic
- Electronegativity: 1.31
- Wiki Link: Source Link
- Element Image: Image Link
Magnesium is a chemical element with symbol Mg and atomic number 12. It is a shiny gray solid which bears a close physical resemblance to the other five elements in the second column (Group 2, or alkaline earth metals) of the periodic table:they each have the same electron configuration in their outer electron shell producing a similar crystal structure. Magnesium is the ninth most abundant element in the universe.
Aluminium
| Discovered | State |
|---|---|
| Ancient | solid |
| Atomic Mass | Density |
| 26.98153857 | 2.7 g/L |
27
13
Al
| Electrons | Protons | Neutrons |
|---|---|---|
| 13 | 13 | 14 |
| Electronic Configuration | ||
| [Ne] 3s23p1 |
- Discovered By: Humphry Davy
- Appearance: silvery gray metallic
- Category: post-transition metal
- Melting Point: 933.47 K
- Boiling Point: 2743 K
- Ox. State: 1, 3
- Bonding Type: metallic
- Electronegativity: 1.61
- Wiki Link: Source Link
- Element Image: Image Link
Aluminium (or aluminum; see different endings) is a chemical element in the boron group with symbol Al and atomic number 13. It is a silvery-white, soft, nonmagnetic, ductile metal. Aluminium is the third most abundant element (after oxygen and silicon), and the most abundant metal, in the Earth’s crust.
Silicon
| Discovered | State |
|---|---|
| 1854 | solid |
| Atomic Mass | Density |
| 28.085 | 2.329 g/L |
28
14
Si
| Electrons | Protons | Neutrons |
|---|---|---|
| 14 | 14 | 14 |
| Electronic Configuration | ||
| [Ne] 3s23p2 |
- Discovered By: Jöns Jacob Berzelius
- Appearance: crystalline
- Category: metalloid
- Melting Point: 1687 K
- Boiling Point: 3538 K
- Ox. State: -4, -3, -2, -1, 1, 2, 3, 4
- Bonding Type: metallic
- Electronegativity: 1.9
- Wiki Link: Source Link
- Element Image: Image Link
Silicon is a chemical element with symbol Si and atomic number 14. It is a tetravalent metalloid, more reactive than germanium, the metalloid directly below it in the table. Controversy about silicon’s character dates to its discovery.
Phosphorus
| Discovered | State |
|---|---|
| 1669 | solid |
| Atomic Mass | Density |
| 30.9737619985 | 1.823 g/L |
31
15
P
| Electrons | Protons | Neutrons |
|---|---|---|
| 15 | 15 | 16 |
| Electronic Configuration | ||
| [Ne] 3s23p3 |
- Discovered By: Hennig Brand
- Appearance: colourless
- Category: polyatomic nonmetal
- Melting Point: 317 K
- Boiling Point: 554 K
- Ox. State: -3, -2, -1, 1, 2, 3, 4, 5
- Bonding Type: covalent network
- Electronegativity: 2.19
- Wiki Link: Source Link
- Element Image: Image Link
Phosphorus is a chemical element with symbol P and atomic number 15. As an element, phosphorus exists in two major forms—white phosphorus and red phosphorus—but due to its high reactivity, phosphorus is never found as a free element on Earth. Instead phosphorus-containing minerals are almost always present in their maximally oxidised state, as inorganic phosphate rocks.
Sulfur
| Discovered | State |
|---|---|
| Ancient | solid |
| Atomic Mass | Density |
| 32.06 | 2.07 g/L |
32
16
S
| Electrons | Protons | Neutrons |
|---|---|---|
| 16 | 16 | 16 |
| Electronic Configuration | ||
| [Ne] 3s23p4 |
- Discovered By: Ancient china
- Appearance: lemon yellow
- Category: polyatomic nonmetal
- Melting Point: 388.36 K
- Boiling Point: 717.8 K
- Ox. State: -2, -1, 1, 2, 3, 4, 5, 6
- Bonding Type: covalent network
- Electronegativity: 2.58
- Wiki Link: Source Link
- Element Image: Image Link
Sulfur or sulphur (see spelling differences) is a chemical element with symbol S and atomic number 16. It is an abundant, multivalent non-metal. Under normal conditions, sulfur atoms form cyclic octatomic molecules with chemical formula S8.
Chlorine
| Discovered | State |
|---|---|
| 1774 | Gas |
| Atomic Mass | Density |
| 35.45 | 3.2 g/L |
35
17
Cl
| Electrons | Protons | Neutrons |
|---|---|---|
| 17 | 17 | 18 |
| Electronic Configuration | ||
| [Ne] 3s23p5 |
- Discovered By: Carl Wilhelm Scheele
- Appearance: pale yellow-green gas
- Category: diatomic nonmetal
- Melting Point: 171.6 K
- Boiling Point: 239.11 K
- Ox. State: -1, 1, 2, 3, 4, 5, 6, 7
- Bonding Type: covalent network
- Electronegativity: 3.16
- Wiki Link: Source Link
- Element Image: Image Link
Chlorine is a chemical element with symbol Cl and atomic number 17. It also has a relative atomic mass of 35.5. Chlorine is in the halogen group (17) and is the second lightest halogen following fluorine.
Argon
| Discovered | State |
|---|---|
| 1894 | Gas |
| Atomic Mass | Density |
| 39.9481 | 1.784 g/L |
40
18
Ar
| Electrons | Protons | Neutrons |
|---|---|---|
| 18 | 18 | 22 |
| Electronic Configuration | ||
| [Ne] 3s23p6 |
- Discovered By: Lord Rayleigh
- Appearance: colorless gas
- Category: noble gas
- Melting Point: 83.81 K
- Boiling Point: 87.302 K
- Ox. State:
- Bonding Type: atomic
- Electronegativity:
- Wiki Link: Source Link
- Element Image: Image Link
Argon is a chemical element with symbol Ar and atomic number 18. It is in group 18 of the periodic table and is a noble gas. Argon is the third most common gas in the Earth’s atmosphere, at 0.934% (9,340 ppmv), making it over twice as abundant as the next most common atmospheric gas, water vapor (which averages about 4000 ppmv, but varies greatly), and 23 times as abundant as the next most common non-condensing atmospheric gas, carbon dioxide (400 ppmv), and more than 500 times as abundant as the next most common noble gas, neon (18 ppmv).
Potassium
| Discovered | State |
|---|---|
| 1807 | Solid |
| Atomic Mass | Density |
| 39.09831 | 0.862 g/L |
39
19
K
| Electrons | Protons | Neutrons |
|---|---|---|
| 19 | 19 | 20 |
| Electronic Configuration | ||
| [Ar] 4s1 |
- Discovered By: Humphry Davy
- Appearance: silvery gray
- Category: alkali metal
- Melting Point: 336.7 K
- Boiling Point: 1032 K
- Ox. State: 1
- Bonding Type: metallic
- Electronegativity:
- Wiki Link: Source Link
- Element Image: Image Link
Potassium is a chemical element with symbol K (derived from Neo-Latin, kalium) and atomic number 19. It was first isolated from potash, the ashes of plants, from which its name is derived. In the Periodic table, potassium is one of seven elements in column (group) 1 (alkali metals):they all have a single valence electron in their outer electron shell, which they readily give up to create an atom with a positive charge – a cation, and combine with anions to form salts.
Calcium
| Discovered | State |
|---|---|
| 1808 | Solid |
| Atomic Mass | Density |
| 40.0784 | 1.55 g/L |
40
20
Ca
| Electrons | Protons | Neutrons |
|---|---|---|
| 20 | 20 | 20 |
| Electronic Configuration | ||
| [Ar] 4s2 |
- Discovered By: Humphry Davy
- Appearance:
- Category: alkaline earth metal
- Melting Point: 1115 K
- Boiling Point: 1757 K
- Ox. State: 2
- Bonding Type: metallic
- Electronegativity:
- Wiki Link: Source Link
- Element Image: Image Link
Calcium is a chemical element with symbol Ca and atomic number 20. Calcium is a soft gray alkaline earth metal, fifth-most-abundant element by mass in the Earth’s crust. The ion Ca2+ is also the fifth-most-abundant dissolved ion in seawater by both molarity and mass, after sodium, chloride, magnesium, and sulfate.
Scandium
| Discovered | State |
|---|---|
| 1876 | Solid |
| Atomic Mass | Density |
| 44.9559085 | 2.985 g/L |
45
21
Sc
| Electrons | Protons | Neutrons |
|---|---|---|
| 21 | 21 | 24 |
| Electronic Configuration | ||
| [Ar] 3d14s2 |
- Discovered By: Lars Fredrik Nilson
- Appearance: silvery white
- Category: transition metal
- Melting Point: 1814 K
- Boiling Point: 3109 K
- Ox. State: 1, 2, 3
- Bonding Type: metallic
- Electronegativity:
- Wiki Link: Source Link
- Element Image: Image Link
Scandium is a chemical element with symbol Sc and atomic number 21. A silvery-white metallic d-block element, it has historically been sometimes classified as a rare earth element, together with yttrium and the lanthanoids. It was discovered in 1879 by spectral analysis of the minerals euxenite and gadolinite from Scandinavia.
Titanium
| Discovered | State |
|---|---|
| 1791 | Solid |
| Atomic Mass | Density |
| 44.9559085 | 4.506 g/L |
48
22
Ti
| Electrons | Protons | Neutrons |
|---|---|---|
| 22 | 22 | 26 |
| Electronic Configuration | ||
| [Ar] 3d24s2 |
- Discovered By: William Gregor
- Appearance: silvery grey
- Category: transition metal
- Melting Point: 1941 K
- Boiling Point: 3560 K
- Ox. State: -1, 2, 3, 4
- Bonding Type: metallic
- Electronegativity: 1.54
- Wiki Link: Source Link
- Element Image: Image Link
Titanium is a chemical element with symbol Ti and atomic number 22. It is a lustrous transition metal with a silver color, low density and high strength. It is highly resistant to corrosion in sea water, aqua regia and chlorine.
Vanadium
| Discovered | State |
|---|---|
| 1803 | Solid |
| Atomic Mass | Density |
| 50.94151 | 6 g/L |
51
23
V
| Electrons | Protons | Neutrons |
|---|---|---|
| 23 | 23 | 28 |
| Electronic Configuration | ||
| [Ar] 3d34s2 |
- Discovered By: Andrés Manuel del Río
- Appearance: blue-silver-grey metal
- Category: transition metal
- Melting Point: 2183 K
- Boiling Point: 3680 K
- Ox. State: -1, 2, 3, 4
- Bonding Type: metallic
- Electronegativity: 1.63
- Wiki Link: Source Link
- Element Image: Image Link
Vanadium is a chemical element with symbol V and atomic number 23. It is a hard, silvery grey, ductile and malleable transition metal. The element is found only in chemically combined form in nature, but once isolated artificially, the formation of an oxide layer stabilizes the free metal somewhat against further oxidation.
Chromium
| Discovered | State |
|---|---|
| 1798 | Solid |
| Atomic Mass | Density |
| 51.99616 | 7.19 g/L |
52
24
Cr
| Electrons | Protons | Neutrons |
|---|---|---|
| 24 | 24 | 28 |
| Electronic Configuration | ||
| [Ar] 3d54s1 |
- Discovered By: Louis Nicolas Vauquelin
- Appearance: silvery metallic
- Category: transition metal
- Melting Point: 2180 K
- Boiling Point: 2944 K
- Ox. State: -2, -1, 1, 2, 3, 4, 5, 6
- Bonding Type: metallic
- Electronegativity: 1.63
- Wiki Link: Source Link
- Element Image: Image Link
Chromium is a chemical element with symbol Cr and atomic number 24. It is the first element in Group 6. It is a steely-gray, lustrous, hard and brittle metal which takes a high polish, resists tarnishing, and has a high melting point.
Manganese
| Discovered | State |
|---|---|
| 1774 | Solid |
| Atomic Mass | Density |
| 54.9380443 | 7.21 g/L |
55
25
Mn
| Electrons | Protons | Neutrons |
|---|---|---|
| 25 | 25 | 30 |
| Electronic Configuration | ||
| [Ar] 3d54s2 |
- Discovered By: Torbern Olof Bergman
- Appearance: silvery metallic
- Category: transition metal
- Melting Point: 1519 K
- Boiling Point: 2334 K
- Ox. State: -2, -1, 1, 2, 3, 4, 5, 6
- Bonding Type: metallic
- Electronegativity: 1.55
- Wiki Link: Source Link
- Element Image: Image Link
Manganese is a chemical element with symbol Mn and atomic number 25. It is not found as a free element in nature; it is often found in combination with iron, and in many minerals. Manganese is a metal with important industrial metal alloy uses, particularly in stainless steels.
Iron
| Discovered | State |
|---|---|
| Ancient | Solid |
| Atomic Mass | Density |
| 55.8452 | 7.874 g/L |
56
26
Fe
| Electrons | Protons | Neutrons |
|---|---|---|
| 26 | 26 | 30 |
| Electronic Configuration | ||
| [Ar] 3d64s2 |
- Discovered By: 5000 BC
- Appearance: lustrous metallic with a grayish tinge
- Category: transition metal
- Melting Point: 1811 K
- Boiling Point: 3134 K
- Ox. State: -2, -1, 1, 2, 3, 4, 5, 6
- Bonding Type: metallic
- Electronegativity: 1.83
- Wiki Link: Source Link
- Element Image: Image Link
Iron is a chemical element with symbol Fe (from Latin:ferrum) and atomic number 26. It is a metal in the first transition series. It is by mass the most common element on Earth, forming much of Earth’s outer and inner core.
Cobalt
| Discovered | State |
|---|---|
| Ancient | Solid |
| Atomic Mass | Density |
| 58.9331944 | 8.9 g/L |
59
27
Co
| Electrons | Protons | Neutrons |
|---|---|---|
| 27 | 27 | 32 |
| Electronic Configuration | ||
| [Ar] 3d74s2 |
- Discovered By: Georg Brandt
- Appearance: hard lustrous gray metal
- Category: transition metal
- Melting Point: 1768 K
- Boiling Point: 3200 K
- Ox. State: -1, 1, 2, 3, 4, 5
- Bonding Type: metallic
- Electronegativity: 1.88
- Wiki Link: Source Link
- Element Image: Image Link
Cobalt is a chemical element with symbol Co and atomic number 27. Like nickel, cobalt in the Earth’s crust is found only in chemically combined form, save for small deposits found in alloys of natural meteoric iron. The free element, produced by reductive smelting, is a hard, lustrous, silver-gray metal.
Nickel
| Discovered | State |
|---|---|
| 1751 | Solid |
| Atomic Mass | Density |
| 58.69344 | 8.908 g/L |
58
28
Ni
| Electrons | Protons | Neutrons |
|---|---|---|
| 28 | 28 | 30 |
| Electronic Configuration | ||
| [Ar] 3d84s2 |
- Discovered By: Axel Fredrik Cronstedt
- Appearance: lustrous, metallic, and silver with a gold tinge
- Category: transition metal
- Melting Point: 1728 K
- Boiling Point: 3003 K
- Ox. State: -1, 1, 2, 3, 4
- Bonding Type: metallic
- Electronegativity: 1.91
- Wiki Link: Source Link
- Element Image: Image Link
Nickel is a chemical element with symbol Ni and atomic number 28. It is a silvery-white lustrous metal with a slight golden tinge. Nickel belongs to the transition metals and is hard and ductile.
Copper
| Discovered | State |
|---|---|
| Ancient | Solid |
| Atomic Mass | Density |
| 63.5463 | 8.96 g/L |
64
29
Cu
| Electrons | Protons | Neutrons |
|---|---|---|
| 29 | 29 | 35 |
| Electronic Configuration | ||
| [Ar] 3d104s1 |
- Discovered By: Middle East
- Appearance: red-orange metallic luster
- Category: transition metal
- Melting Point: 1357.77 K
- Boiling Point: 2835 K
- Ox. State: 1, 2, 3, 4
- Bonding Type: metallic
- Electronegativity: 1.9
- Wiki Link: Source Link
- Element Image: Image Link
Copper is a chemical element with symbol Cu (from Latin:cuprum) and atomic number 29. It is a soft, malleable and ductile metal with very high thermal and electrical conductivity. A freshly exposed surface of pure copper has a reddish-orange color.
Zinc
| Discovered | State |
|---|---|
| 1746 | Solid |
| Atomic Mass | Density |
| 65.382 | 7.14 g/L |
65
30
Zn
| Electrons | Protons | Neutrons |
|---|---|---|
| 30 | 30 | 35 |
| Electronic Configuration | ||
| [Ar] 3d104s2 |
- Discovered By: India
- Appearance: silver-gray
- Category: transition metal
- Melting Point: 692.68 K
- Boiling Point: 1180 K
- Ox. State: 2
- Bonding Type: metallic
- Electronegativity: 1.65
- Wiki Link: Source Link
- Element Image: Image Link
Zinc, in commerce also spelter, is a chemical element with symbol Zn and atomic number 30. It is the first element of group 12 of the periodic table. In some respects zinc is chemically similar to magnesium:its ion is of similar size and its only common oxidation state is +2.
Gallium
| Discovered | State |
|---|---|
| 1875 | Solid |
| Atomic Mass | Density |
| 69.7231 | 5.91 g/L |
70
31
Ga
| Electrons | Protons | Neutrons |
|---|---|---|
| 31 | 31 | 39 |
| Electronic Configuration | ||
| [Ar] 3d104s24p1 |
- Discovered By: Lecoq de Boisbaudran
- Appearance: silver-white
- Category: post-transition metal
- Melting Point: 302.9146 K
- Boiling Point: 2673 K
- Ox. State: 1, 2, 3
- Bonding Type: metallic
- Electronegativity: 1.81
- Wiki Link: Source Link
- Element Image: Image Link
Gallium is a chemical element with symbol Ga and atomic number 31. Elemental gallium does not occur in free form in nature, but as the gallium(III) compounds that are in trace amounts in zinc ores and in bauxite. Gallium is a soft, silvery metal, and elemental gallium is a brittle solid at low temperatures, and melts at 29.76 °C (85.57 °F) (slightly above room temperature).
Germanium
| Discovered | State |
|---|---|
| 1886 | Solid |
| Atomic Mass | Density |
| 72.6308 | 5.323 g/L |
73
32
Ge
| Electrons | Protons | Neutrons |
|---|---|---|
| 32 | 32 | 41 |
| Electronic Configuration | ||
| [Ar] 3d104s24p2 |
- Discovered By: Lecoq de Boisbaudran
- Appearance: grayish-white
- Category: metalloid
- Melting Point: 1211.4 K
- Boiling Point: 3106 K
- Ox. State: -4, 1, 2, 3, 4
- Bonding Type: metallic
- Electronegativity: 2.01
- Wiki Link: Source Link
- Element Image: Image Link
Germanium is a chemical element with symbol Ge and atomic number 32. It is a lustrous, hard, grayish-white metalloid in the carbon group, chemically similar to its group neighbors tin and silicon. Purified germanium is a semiconductor, with an appearance most similar to elemental silicon.
Arsenic
| Discovered | State |
|---|---|
| Ancient | Solid |
| Atomic Mass | Density |
| 74.9215956 | 5.727 g/L |
75
33
As
| Electrons | Protons | Neutrons |
|---|---|---|
| 33 | 33 | 42 |
| Electronic Configuration | ||
| [Ar] 3d104s24p3 |
- Discovered By: Bronze Age
- Appearance: metallic grey
- Category: metalloid
- Melting Point: 1090 K
- Boiling Point: 887 K
- Ox. State: -3, 2, 3, 5
- Bonding Type: metallic
- Electronegativity: 2.18
- Wiki Link: Source Link
- Element Image: Image Link
Arsenic is a chemical element with symbol As and atomic number 33. Arsenic occurs in many minerals, usually in conjunction with sulfur and metals, and also as a pure elemental crystal. Arsenic is a metalloid.
Selenium
| Discovered | State |
|---|---|
| 1817 | Solid |
| Atomic Mass | Density |
| 78.9718 | 4.81 g/L |
79
34
Se
| Electrons | Protons | Neutrons |
|---|---|---|
| 34 | 34 | 45 |
| Electronic Configuration | ||
| [Ar] 3d104s24p4 |
- Discovered By: Jöns Jakob Berzelius
- Appearance: black, red
- Category: polyatomic nonmetal
- Melting Point: 494 K
- Boiling Point: 958 K
- Ox. State: -2, 2, 4, 6
- Bonding Type: metallic
- Electronegativity: 2.55
- Wiki Link: Source Link
- Element Image: Image Link
Selenium is a chemical element with symbol Se and atomic number 34. It is a nonmetal with properties that are intermediate between those of its periodic table column-adjacent chalcogen elements sulfur and tellurium. It rarely occurs in its elemental state in nature, or as pure ore compounds.
Bromine
| Discovered | State |
|---|---|
| 1826 | Liquid |
| Atomic Mass | Density |
| 79.904 | 23.1028 g/L |
80
35
Br
2
| Electrons | Protons | Neutrons |
|---|---|---|
| 35 | 35 | 45 |
| Electronic Configuration | ||
| [Ar] 3d104s24p5 |
- Discovered By: Antoine Jérôme Balard
- Appearance:
- Category: diatomic nonmetal
- Melting Point: 265.8 K
- Boiling Point: 332 K
- Ox. State: -1, 1, 3, 4, 5, 7
- Bonding Type: covalent network
- Electronegativity: 2.96
- Wiki Link: Source Link
- Element Image: Image Link
Bromine (from Ancient Greek:βρῶμος, brómos, meaning “stench”) is a chemical element with symbol Br, and atomic number 35. It is a halogen. The element was isolated independently by two chemists, Carl Jacob Löwig and Antoine Jerome Balard, in 1825–1826.
Krypton
| Discovered | State |
|---|---|
| 1898 | Gas |
| Atomic Mass | Density |
| 83.7982 | 3.749 g/L |
84
36
Kr
| Electrons | Protons | Neutrons |
|---|---|---|
| 36 | 36 | 48 |
| Electronic Configuration | ||
| [Ar] 3d104s24p6 |
- Discovered By: William Ramsay
- Appearance: colorless gas
- Category: noble gas
- Melting Point: 115.78 K
- Boiling Point: 119.93 K
- Ox. State: 2
- Bonding Type: atomic
- Electronegativity:
- Wiki Link: Source Link
- Element Image: Image Link
Krypton (from Greek:κρυπτός kryptos “the hidden one”) is a chemical element with symbol Kr and atomic number 36. It is a member of group 18 (noble gases) elements. A colorless, odorless, tasteless noble gas, krypton occurs in trace amounts in the atmosphere, is isolated by fractionally distilling liquefied air, and is often used with other rare gases in fluorescent lamps.
Rubidium
| Discovered | State |
|---|---|
| 1861 | Solid |
| Atomic Mass | Density |
| 85.46783 | 1.532 g/L |
85
37
Rb
| Electrons | Protons | Neutrons |
|---|---|---|
| 37 | 37 | 48 |
| Electronic Configuration | ||
| [Kr] 5s1 |
- Discovered By: Robert Bunsen
- Appearance: grey white
- Category: alkali metal
- Melting Point: 312.45 K
- Boiling Point: 961 K
- Ox. State: 1
- Bonding Type: metallic
- Electronegativity: 0.82
- Wiki Link: Source Link
- Element Image: Image Link
Rubidium is a chemical element with symbol Rb and atomic number 37. Rubidium is a soft, silvery-white metallic element of the alkali metal group, with an atomic mass of 85.4678. Elemental rubidium is highly reactive, with properties similar to those of other alkali metals, such as very rapid oxidation in air.
Strontium
| Discovered | State |
|---|---|
| 1790 | Solid |
| Atomic Mass | Density |
| 87.621 | 2.64 g/L |
88
38
Sr
| Electrons | Protons | Neutrons |
|---|---|---|
| 38 | 38 | 50 |
| Electronic Configuration | ||
| [Kr] 5s2 |
- Discovered By: William Cruickshank (chemist)
- Appearance:
- Category: alkaline earth metal
- Melting Point: 1050 K
- Boiling Point: 1650 K
- Ox. State: 2
- Bonding Type: metallic
- Electronegativity: 0.95
- Wiki Link: Source Link
- Element Image: Image Link
Strontium is a chemical element with symbol Sr and atomic number 38. An alkaline earth metal, strontium is a soft silver-white or yellowish metallic element that is highly reactive chemically. The metal turns yellow when it is exposed to air.
Yttrium
| Discovered | State |
|---|---|
| 1794 | Solid |
| Atomic Mass | Density |
| 88.905842 | 4.472 g/L |
89
39
Y
| Electrons | Protons | Neutrons |
|---|---|---|
| 39 | 39 | 50 |
| Electronic Configuration | ||
| [Kr] 4d15s2 |
- Discovered By: Johan Gadolin
- Appearance: silvery white
- Category: transition metal
- Melting Point: 1799 K
- Boiling Point: 3203 K
- Ox. State: 1, 2, 3
- Bonding Type: metallic
- Electronegativity: 1.22
- Wiki Link: Source Link
- Element Image: Image Link
Yttrium is a chemical element with symbol Y and atomic number 39. It is a silvery-metallic transition metal chemically similar to the lanthanides and it has often been classified as a “rare earth element”. Yttrium is almost always found combined with the lanthanides in rare earth minerals and is never found in nature as a free element.
Zirconium
| Discovered | State |
|---|---|
| 1789 | Solid |
| Atomic Mass | Density |
| 91.2242 | 6.52 g/L |
91
40
Zr
| Electrons | Protons | Neutrons |
|---|---|---|
| 40 | 40 | 51 |
| Electronic Configuration | ||
| [Kr] 4d25s2 |
- Discovered By: Martin Heinrich Klaproth
- Appearance: silvery white
- Category: transition metal
- Melting Point: 2128 K
- Boiling Point: 4650 K
- Ox. State: 1, 2, 3, 4
- Bonding Type: metallic
- Electronegativity: 1.33
- Wiki Link: Source Link
- Element Image: Image Link
Zirconium is a chemical element with symbol Zr and atomic number 40. The name of zirconium is taken from the name of the mineral zircon, the most important source of zirconium. The word zircon comes from the Persian word zargun زرگون, meaning “gold-colored”.
Niobium
| Discovered | State |
|---|---|
| 1801 | Solid |
| Atomic Mass | Density |
| 92.906372 | 8.57 g/L |
93
41
Nb
| Electrons | Protons | Neutrons |
|---|---|---|
| 41 | 41 | 52 |
| Electronic Configuration | ||
| [Kr] 4d45s1 |
- Discovered By: Charles Hatchett
- Appearance: gray metallic, bluish when oxidized
- Category: transition metal
- Melting Point: 2750 K
- Boiling Point: 5017 K
- Ox. State: -1, 2, 3, 4, 5
- Bonding Type: metallic
- Electronegativity: 1.6
- Wiki Link: Source Link
- Element Image: Image Link
Niobium, formerly columbium, is a chemical element with symbol Nb (formerly Cb) and atomic number 41. It is a soft, grey, ductile transition metal, which is often found in the pyrochlore mineral, the main commercial source for niobium, and columbite. The name comes from Greek mythology:Niobe, daughter of Tantalus since it is so similar to tantalum.
Molybdenum
| Discovered | State |
|---|---|
| 1778 | Solid |
| Atomic Mass | Density |
| 95.951 | 10.28 g/L |
96
42
Mo
| Electrons | Protons | Neutrons |
|---|---|---|
| 42 | 42 | 54 |
| Electronic Configuration | ||
| [Kr] 4d55s1 |
- Discovered By: Carl Wilhelm Scheele
- Appearance: gray metallic,
- Category: transition metal
- Melting Point: 2896 K
- Boiling Point: 4912 K
- Ox. State: -2, -1, 1, 2, 3, 4, 5, 6
- Bonding Type: metallic
- Electronegativity: 2.16
- Wiki Link: Source Link
- Element Image: Image Link
Molybdenum is a chemical element with symbol Mo and atomic number 42. The name is from Neo-Latin molybdaenum, from Ancient Greek Μόλυβδος molybdos, meaning lead, since its ores were confused with lead ores. Molybdenum minerals have been known throughout history, but the element was discovered (in the sense of differentiating it as a new entity from the mineral salts of other metals) in 1778 by Carl Wilhelm Scheele.
Technetium
| Discovered | State |
|---|---|
| 1937 | Solid |
| Atomic Mass | Density |
| 98 | 11 g/L |
98
43
Tc
| Electrons | Protons | Neutrons |
|---|---|---|
| 43 | 43 | 55 |
| Electronic Configuration | ||
| [Kr] 4d55s2 |
- Discovered By: Emilio Segrè
- Appearance: shiny gray metal
- Category: transition metal
- Melting Point: 2430 K
- Boiling Point: 4538 K
- Ox. State: -3, -1, 1, 2, 3, 4, 5, 6, 7
- Bonding Type: metallic
- Electronegativity: 1.9
- Wiki Link: Source Link
- Element Image: Image Link
Technetium (/tɛkˈniːʃiəm/) is a chemical element with symbol Tc and atomic number 43. It is the element with the lowest atomic number in the periodic table that has no stable isotopes:every form of it is radioactive. Nearly all technetium is produced synthetically, and only minute amounts are found in nature.
Ruthenium
| Discovered | State |
|---|---|
| 1827 | Solid |
| Atomic Mass | Density |
| 101.072 | 12.37 g/L |
101
44
Ru
| Electrons | Protons | Neutrons |
|---|---|---|
| 44 | 44 | 57 |
| Electronic Configuration | ||
| [Kr] 4d75s1 |
- Discovered By: Karl Ernst Claus
- Appearance: silvery white metallic
- Category: transition metal
- Melting Point: 2607 K
- Boiling Point: 4423 K
- Ox. State: -2, 1, 2, 3, 4, 5, 6, 7, 8
- Bonding Type: metallic
- Electronegativity: 2.2
- Wiki Link: Source Link
- Element Image: Image Link
Ruthenium is a chemical element with symbol Ru and atomic number 44. It is a rare transition metal belonging to the platinum group of the periodic table. Like the other metals of the platinum group, ruthenium is inert to most other chemicals.
Rhodium
| Discovered | State |
|---|---|
| 1803 | Solid |
| Atomic Mass | Density |
| 101.072 | 12.41 g/L |
103
45
Rh
| Electrons | Protons | Neutrons |
|---|---|---|
| 45 | 45 | 58 |
| Electronic Configuration | ||
| [Kr] 4d85s1 |
- Discovered By: William Hyde Wollaston
- Appearance: silvery white metallic
- Category: transition metal
- Melting Point: 2237 K
- Boiling Point: 3968 K
- Ox. State: -1, 1, 2, 3, 4, 5, 6
- Bonding Type: metallic
- Electronegativity: 2.28
- Wiki Link: Source Link
- Element Image: Image Link
Rhodium is a chemical element with symbol Rh and atomic number 45. It is a rare, silvery-white, hard, and chemically inert transition metal. It is a member of the platinum group.
Palladium
| Discovered | State |
|---|---|
| 1803 | Solid |
| Atomic Mass | Density |
| 106.421 | 12.023 g/L |
106
46
Pd
| Electrons | Protons | Neutrons |
|---|---|---|
| 46 | 46 | 60 |
| Electronic Configuration | ||
| [Kr] 4d10 |
- Discovered By: William Hyde Wollaston
- Appearance: silvery white
- Category: transition metal
- Melting Point: 1828.05 K
- Boiling Point: 3236 K
- Ox. State: 2, 4
- Bonding Type: metallic
- Electronegativity: 2.2
- Wiki Link: Source Link
- Element Image: Image Link
Palladium is a chemical element with symbol Pd and atomic number 46. It is a rare and lustrous silvery-white metal discovered in 1803 by William Hyde Wollaston. He named it after the asteroid Pallas, which was itself named after the epithet of the Greek goddess Athena, acquired by her when she slew Pallas.
Silver
| Discovered | State |
|---|---|
| Ancient | Solid |
| Atomic Mass | Density |
| 107.86822 | 10.49 g/L |
108
47
Ag
| Electrons | Protons | Neutrons |
|---|---|---|
| 47 | 47 | 61 |
| Electronic Configuration | ||
| [Kr] 4d105s1 |
- Discovered By: unknown, before 5000 BC
- Appearance: lustrous white metal
- Category: transition metal
- Melting Point: 1234.93 K
- Boiling Point: 2435 K
- Ox. State: 1, 2, 3
- Bonding Type: metallic
- Electronegativity: 1.93
- Wiki Link: Source Link
- Element Image: Image Link
Silver is a chemical element with symbol Ag (Greek:άργυρος árguros, Latin:argentum, both from the Indo-European root *h₂erǵ- for “grey” or “shining”) and atomic number 47. A soft, white, lustrous transition metal, it possesses the highest electrical conductivity, thermal conductivity and reflectivity of any metal. The metal occurs naturally in its pure, free form (native silver), as an alloy with gold and other metals, and in minerals such as argentite and chlorargyrite.
Cadmium
| Discovered | State |
|---|---|
| 1817 | Solid |
| Atomic Mass | Density |
| 112.4144 | 8.65 g/L |
112
48
Cd
| Electrons | Protons | Neutrons |
|---|---|---|
| 48 | 48 | 64 |
| Electronic Configuration | ||
| [Kr] 4d105s2 |
- Discovered By: Karl Samuel Leberecht Hermann
- Appearance: silvery bluish-gray metallic
- Category: transition metal
- Melting Point: 594.22 K
- Boiling Point: 1040 K
- Ox. State: 2
- Bonding Type: metallic
- Electronegativity: 1.69
- Wiki Link: Source Link
- Element Image: Image Link
Cadmium is a chemical element with symbol Cd and atomic number 48. This soft, bluish-white metal is chemically similar to the two other stable metals in group 12, zinc and mercury. Like zinc, it prefers oxidation state +2 in most of its compounds and like mercury it shows a low melting point compared to transition metals.
Indium
| Discovered | State |
|---|---|
| 1863 | Solid |
| Atomic Mass | Density |
| 114.8181 | 7.31 g/L |
115
49
In
| Electrons | Protons | Neutrons |
|---|---|---|
| 49 | 49 | 66 |
| Electronic Configuration | ||
| [Kr] 4d105s25p1 |
- Discovered By: Ferdinand Reich
- Appearance: silvery lustrous gray
- Category: post-transition metal
- Melting Point: 429.7485 K
- Boiling Point: 2345 K
- Ox. State: 1, 2, 3
- Bonding Type: metallic
- Electronegativity: 1.78
- Wiki Link: Source Link
- Element Image: Image Link
Indium is a chemical element with symbol In and atomic number 49. It is a post-transition metallic element that is rare in Earth’s crust. The metal is very soft, malleable and easily fusible, with a melting point higher than sodium, but lower than lithium or tin.
Tin
| Discovered | State |
|---|---|
| Ancient | Solid |
| Atomic Mass | Density |
| 118.7107 | 7.365 g/L |
119
50
Sn
| Electrons | Protons | Neutrons |
|---|---|---|
| 50 | 50 | 69 |
| Electronic Configuration | ||
| [Kr] 4d105s25p2 |
- Discovered By: unknown, before 3500 BC
- Appearance: silvery-white (beta, β) or gray (alpha, α)
- Category: post-transition metal
- Melting Point: 505.08 K
- Boiling Point: 2875 K
- Ox. State: -4, 2, 4
- Bonding Type: metallic
- Electronegativity: 1.96
- Wiki Link: Source Link
- Element Image: Image Link
Tin is a chemical element with the symbol Sn (for Latin:stannum) and atomic number 50. It is a main group metal in group 14 of the periodic table. Tin shows a chemical similarity to both neighboring group-14 elements, germanium and lead, and has two possible oxidation states, +2 and the slightly more stable +4.
Antimony
| Discovered | State |
|---|---|
| Ancient | Solid |
| Atomic Mass | Density |
| 121.7601 | 6.697 g/L |
122
51
Sb
| Electrons | Protons | Neutrons |
|---|---|---|
| 51 | 51 | 71 |
| Electronic Configuration | ||
| [Kr] 4d105s25p3 |
- Discovered By: unknown, before 3000 BC
- Appearance: silvery lustrous gray
- Category: metalloid
- Melting Point: 903.78 K
- Boiling Point: 1908 K
- Ox. State: -3, 3, 5
- Bonding Type: metallic
- Electronegativity: 2.05
- Wiki Link: Source Link
- Element Image: Image Link
Antimony is a chemical element with symbol Sb (from Latin:stibium) and atomic number 51. A lustrous gray metalloid, it is found in nature mainly as the sulfide mineral stibnite (Sb2S3). Antimony compounds have been known since ancient times and were used for cosmetics; metallic antimony was also known, but it was erroneously identified as lead upon its discovery.
Tellurium
| Discovered | State |
|---|---|
| 1782 | Solid |
| Atomic Mass | Density |
| 127.603 | 6.24 g/L |
128
52
Te
| Electrons | Protons | Neutrons |
|---|---|---|
| 52 | 52 | 76 |
| Electronic Configuration | ||
| [Kr] 4d105s25p4 |
- Discovered By: Franz-Joseph Müller von Reichenstein
- Appearance:
- Category: metalloid
- Melting Point: 722.66 K
- Boiling Point: 1261 K
- Ox. State: -2, 2, 4, 5, 6
- Bonding Type: metallic
- Electronegativity: 2.1
- Wiki Link: Source Link
- Element Image: Image Link
Tellurium is a chemical element with symbol Te and atomic number 52. It is a brittle, mildly toxic, rare, silver-white metalloid. Tellurium is chemically related to selenium and sulfur.
Iodine
| Discovered | State |
|---|---|
| 1811 | Solid |
| Atomic Mass | Density |
| 126.904473 | 4.933 g/L |
127
53
I
2
| Electrons | Protons | Neutrons |
|---|---|---|
| 53 | 53 | 74 |
| Electronic Configuration | ||
| [Kr] 4d105s25p5 |
- Discovered By: Bernard Courtois
- Appearance: lustrous metallic gray, violet as a gas
- Category: halogen
- Melting Point: 386.85 K
- Boiling Point: 457.4 K
- Ox. State: -1, 1, 3, 5, 7
- Bonding Type: metallic
- Electronegativity: 2.66
- Wiki Link: Source Link
- Element Image: Image Link
Iodine is a chemical element with symbol I and atomic number 53. The name is from Greek ἰοειδής ioeidēs, meaning violet or purple, due to the color of iodine vapor. Iodine and its compounds are primarily used in nutrition, and industrially in the production of acetic acid and certain polymers.
Xenon
| Discovered | State |
|---|---|
| 1898 | Gas |
| Atomic Mass | Density |
| 131.2936 | 5.894 g/L |
131
54
Xe
| Electrons | Protons | Neutrons |
|---|---|---|
| 54 | 54 | 77 |
| Electronic Configuration | ||
| [Kr] 4d105s25p6 |
- Discovered By: William Ramsay
- Appearance: colorless gas
- Category: noble gas
- Melting Point: 161.4 K
- Boiling Point: 165.051 K
- Ox. State: 2, 4, 6, 8
- Bonding Type: metallic
- Electronegativity:
- Wiki Link: Source Link
- Element Image: Image Link
Xenon is a chemical element with symbol Xe and atomic number 54. It is a colorless, dense, odorless noble gas, that occurs in the Earth’s atmosphere in trace amounts. Although generally unreactive, xenon can undergo a few chemical reactions such as the formation of xenon hexafluoroplatinate, the first noble gas compound to be synthesized.
Caesium
| Discovered | State |
|---|---|
| 1860 | Solid |
| Atomic Mass | Density |
| 132.905451966 | 1.93 g/L |
133
55
Cs
| Electrons | Protons | Neutrons |
|---|---|---|
| 55 | 55 | 78 |
| Electronic Configuration | ||
| [Xe] 6s1 |
- Discovered By: Robert Bunsen
- Appearance: silvery gold
- Category: alkali metal
- Melting Point: 301.7 K
- Boiling Point: 944 K
- Ox. State: 1
- Bonding Type: metallic
- Electronegativity:
- Wiki Link: Source Link
- Element Image: Image Link
Caesium or cesium is a chemical element with symbol Cs and atomic number 55. It is a soft, silvery-gold alkali metal with a melting point of 28 °C (82 °F), which makes it one of only five elemental metals that are liquid at or near room temperature. Caesium is an alkali metal and has physical and chemical properties similar to those of rubidium and potassium.
Barium
| Discovered | State |
|---|---|
| 1808 | Solid |
| Atomic Mass | Density |
| 137.3277 | 3.51 g/L |
137
56
Ba
| Electrons | Protons | Neutrons |
|---|---|---|
| 56 | 56 | 81 |
| Electronic Configuration | ||
| [Xe] 6s2 |
- Discovered By: Carl Wilhelm Scheele
- Appearance: silvery gold
- Category: alkaline earth metal
- Melting Point: 1000 K
- Boiling Point: 2118 K
- Ox. State: 2
- Bonding Type: metallic
- Electronegativity: 0.89
- Wiki Link: Source Link
- Element Image: Image Link
Barium is a chemical element with symbol Ba and atomic number 56. It is the fifth element in Group 2, a soft silvery metallic alkaline earth metal. Because of its high chemical reactivity barium is never found in nature as a free element.
Lanthanum
| Discovered | State |
|---|---|
| 1839 | Solid |
| Atomic Mass | Density |
| 138.905477 | 6.162 g/L |
139
57
La
| Electrons | Protons | Neutrons |
|---|---|---|
| 57 | 57 | 82 |
| Electronic Configuration | ||
| [Xe] 5d16s2 |
- Discovered By: Carl Gustaf Mosander
- Appearance: silvery white
- Category: lanthanide
- Melting Point: 1193 K
- Boiling Point: 3737 K
- Ox. State: 2, 3
- Bonding Type: metallic
- Electronegativity: 1.1
- Wiki Link: Source Link
- Element Image: Image Link
Lanthanum is a soft, ductile, silvery-white metallic chemical element with symbol La and atomic number 57. It tarnishes rapidly when exposed to air and is soft enough to be cut with a knife. It gave its name to the lanthanide series, a group of 15 similar elements between lanthanum and lutetium in the periodic table:it is also sometimes considered the first element of the 6th-period transition metals.
Cerium
| Discovered | State |
|---|---|
| 1803 | Solid |
| Atomic Mass | Density |
| 140.1161 | 6.77 g/L |
140
58
Ce
| Electrons | Protons | Neutrons |
|---|---|---|
| 58 | 58 | 82 |
| Electronic Configuration | ||
| [Xe] 4f15d16s2 |
- Discovered By: Martin Heinrich Klaproth
- Appearance: silvery white
- Category: lanthanide
- Melting Point: 1068 K
- Boiling Point: 3716 K
- Ox. State: 2, 3, 4
- Bonding Type: metallic
- Electronegativity: 1.12
- Wiki Link: Source Link
- Element Image: Image Link
Cerium is a chemical element with symbol Ce and atomic number 58. It is a soft, silvery, ductile metal which easily oxidizes in air. Cerium was named after the dwarf planet Ceres (itself named after the Roman goddess of agriculture).
Praseodymium
| Discovered | State |
|---|---|
| 1885 | Solid |
| Atomic Mass | Density |
| 140.907662 | 6.77 g/L |
141
59
Pr
| Electrons | Protons | Neutrons |
|---|---|---|
| 59 | 59 | 82 |
| Electronic Configuration | ||
| [Xe] 4f36s2 |
- Discovered By: Carl Auer von Welsbach
- Appearance: grayish white
- Category: lanthanide
- Melting Point: 1208 K
- Boiling Point: 3403 K
- Ox. State: 2, 3, 4
- Bonding Type: metallic
- Electronegativity: 1.13
- Wiki Link: Source Link
- Element Image: Image Link
Praseodymium is a chemical element with symbol Pr and atomic number 59. Praseodymium is a soft, silvery, malleable and ductile metal in the lanthanide group. It is valued for its magnetic, electrical, chemical, and optical properties.
Neodymium
| Discovered | State |
|---|---|
| 1885 | Solid |
| Atomic Mass | Density |
| 144.2423 | 7.01 g/L |
144
60
Nd
| Electrons | Protons | Neutrons |
|---|---|---|
| 60 | 60 | 84 |
| Electronic Configuration | ||
| [Xe] 4f46s2 |
- Discovered By: Carl Auer von Welsbach
- Appearance: silvery white
- Category: lanthanide
- Melting Point: 1297 K
- Boiling Point: 3347 K
- Ox. State: 2, 3, 4
- Bonding Type: metallic
- Electronegativity: 1.14
- Wiki Link: Source Link
- Element Image: Image Link
Neodymium is a chemical element with symbol Nd and atomic number 60. It is a soft silvery metal that tarnishes in air. Neodymium was discovered in 1885 by the Austrian chemist Carl Auer von Welsbach.
Promethium
| Discovered | State |
|---|---|
| 1947 | Solid |
| Atomic Mass | Density |
| 145 | 7.26 g/L |
145
61
Pm
| Electrons | Protons | Neutrons |
|---|---|---|
| 61 | 61 | 84 |
| Electronic Configuration | ||
| [Xe] 4f56s2 |
- Discovered By: Chien Shiung Wu
- Appearance: silvery white
- Category: lanthanide
- Melting Point: 1315 K
- Boiling Point: 3273 K
- Ox. State: 2, 3, 4
- Bonding Type: metallic
- Electronegativity: 1.13
- Wiki Link: Source Link
- Element Image: Image Link
Promethium, originally prometheum, is a chemical element with the symbol Pm and atomic number 61. All of its isotopes are radioactive; it is one of only two such elements that are followed in the periodic table by elements with stable forms, a distinction shared with technetium. Chemically, promethium is a lanthanide, which forms salts when combined with other elements.
Samarium
| Discovered | State |
|---|---|
| 1853 | Solid |
| Atomic Mass | Density |
| 150.362 | 7.52 g/L |
150
62
Sm
| Electrons | Protons | Neutrons |
|---|---|---|
| 62 | 62 | 88 |
| Electronic Configuration | ||
| [Xe] 4f66s2 |
- Discovered By: Lecoq de Boisbaudran
- Appearance: silvery white
- Category: lanthanide
- Melting Point: 1345 K
- Boiling Point: 2173 K
- Ox. State: 2, 3
- Bonding Type: metallic
- Electronegativity: 1.17
- Wiki Link: Source Link
- Element Image: Image Link
Samarium is a chemical element with symbol Sm and atomic number 62. It is a moderately hard silvery metal that readily oxidizes in air. Being a typical member of the lanthanide series, samarium usually assumes the oxidation state +3.
Europium
| Discovered | State |
|---|---|
| 1901 | Solid |
| Atomic Mass | Density |
| 151.9641 | 5.264 g/L |
152
63
Eu
| Electrons | Protons | Neutrons |
|---|---|---|
| 63 | 63 | 89 |
| Electronic Configuration | ||
| [Xe] 4f76s2 |
- Discovered By: Eugène-Anatole Demarçay
- Appearance: silvery white
- Category: lanthanide
- Melting Point: 1099 K
- Boiling Point: 1802 K
- Ox. State: 2, 3
- Bonding Type: metallic
- Electronegativity: 1.2
- Wiki Link: Source Link
- Element Image: Image Link
Europium is a chemical element with symbol Eu and atomic number 63. It was isolated in 1901 and is named after the continent of Europe. It is a moderately hard, silvery metal which readily oxidizes in air and water.
Gadolinium
| Discovered | State |
|---|---|
| 1880 | Solid |
| Atomic Mass | Density |
| 157.253 | 7.9 g/L |
157
64
Gd
| Electrons | Protons | Neutrons |
|---|---|---|
| 64 | 64 | 93 |
| Electronic Configuration | ||
| [Xe] 4f75d16s2 |
- Discovered By: Jean Charles Galissard de Marignac
- Appearance: silvery white
- Category: lanthanide
- Melting Point: 1585 K
- Boiling Point: 3273 K
- Ox. State: 1, 2, 3
- Bonding Type: metallic
- Electronegativity: 1.2
- Wiki Link: Source Link
- Element Image: Image Link
Gadolinium is a chemical element with symbol Gd and atomic number 64. It is a silvery-white, malleable and ductile rare-earth metal. It is found in nature only in combined (salt) form.
Terbium
| Discovered | State |
|---|---|
| 1843 | Solid |
| Atomic Mass | Density |
| 158.925352 | 8.23 g/L |
159
65
Tb
| Electrons | Protons | Neutrons |
|---|---|---|
| 65 | 65 | 94 |
| Electronic Configuration | ||
| [Xe] 4f96s2 |
- Discovered By: Carl Gustaf Mosander
- Appearance: silvery white
- Category: lanthanide
- Melting Point: 1629 K
- Boiling Point: 3396 K
- Ox. State: 1, 3, 4
- Bonding Type: metallic
- Electronegativity: 1.2
- Wiki Link: Source Link
- Element Image: Image Link
Terbium is a chemical element with symbol Tb and atomic number 65. It is a silvery-white rare earth metal that is malleable, ductile and soft enough to be cut with a knife. Terbium is never found in nature as a free element, but it is contained in many minerals, including cerite, gadolinite, monazite, xenotime and euxenite.
Dysprosium
| Discovered | State |
|---|---|
| 1886 | Solid |
| Atomic Mass | Density |
| 162.5001 | 8.54 g/L |
163
66
Dy
| Electrons | Protons | Neutrons |
|---|---|---|
| 66 | 66 | 97 |
| Electronic Configuration | ||
| [Xe] 4f96s2 |
- Discovered By: Lecoq de Boisbaudran
- Appearance: silvery white
- Category: lanthanide
- Melting Point: 1680 K
- Boiling Point: 2840 K
- Ox. State: 2, 3
- Bonding Type: metallic
- Electronegativity: 1.22
- Wiki Link: Source Link
- Element Image: Image Link
Dysprosium is a chemical element with the symbol Dy and atomic number 66. It is a rare earth element with a metallic silver luster. Dysprosium is never found in nature as a free element, though it is found in various minerals, such as xenotime.
Holmium
| Discovered | State |
|---|---|
| 1878 | Solid |
| Atomic Mass | Density |
| 164.930332 | 8.79 g/L |
165
67
Ho
| Electrons | Protons | Neutrons |
|---|---|---|
| 67 | 67 | 98 |
| Electronic Configuration | ||
| [Xe] 4f116s2 |
- Discovered By: Marc Delafontaine
- Appearance: silvery white
- Category: lanthanide
- Melting Point: 1734 K
- Boiling Point: 2873 K
- Ox. State: 2, 3
- Bonding Type: metallic
- Electronegativity: 1.23
- Wiki Link: Source Link
- Element Image: Image Link
Holmium is a chemical element with symbol Ho and atomic number 67. Part of the lanthanide series, holmium is a rare earth element. Holmium was discovered by Swedish chemist Per Theodor Cleve.
Erbium
| Discovered | State |
|---|---|
| 1842 | Solid |
| Atomic Mass | Density |
| 167.2593 | 9.066 g/L |
167
68
Er
| Electrons | Protons | Neutrons |
|---|---|---|
| 68 | 68 | 99 |
| Electronic Configuration | ||
| [Xe] 4f126s2 |
- Discovered By: Carl Gustaf Mosander
- Appearance: silvery white
- Category: lanthanide
- Melting Point: 1802 K
- Boiling Point: 3141 K
- Ox. State: 3
- Bonding Type: metallic
- Electronegativity: 1.24
- Wiki Link: Source Link
- Element Image: Image Link
Erbium is a chemical element in the lanthanide series, with symbol Er and atomic number 68. A silvery-white solid metal when artificially isolated, natural erbium is always found in chemical combination with other elements on Earth. As such, it is a rare earth element which is associated with several other rare elements in the mineral gadolinite from Ytterby in Sweden, where yttrium, ytterbium, and terbium were discovered.
Thulium
| Discovered | State |
|---|---|
| 1879 | Solid |
| Atomic Mass | Density |
| 168.934222 | 9.32 g/L |
169
69
Tm
| Electrons | Protons | Neutrons |
|---|---|---|
| 69 | 69 | 100 |
| Electronic Configuration | ||
| [Xe] 4f136s2 |
- Discovered By: Per Teodor Cleve
- Appearance: silvery gray
- Category: lanthanide
- Melting Point: 1818 K
- Boiling Point: 2223 K
- Ox. State: 2, 3
- Bonding Type: metallic
- Electronegativity: 1.25
- Wiki Link: Source Link
- Element Image: Image Link
Thulium is a chemical element with symbol Tm and atomic number 69. It is the thirteenth and antepenultimate (third-last) element in the lanthanide series. Like the other lanthanides, the most common oxidation state is +3, seen in its oxide, halides and other compounds.
Ytterbium
| Discovered | State |
|---|---|
| 1878 | Solid |
| Atomic Mass | Density |
| 173.0451 | 6.9 g/L |
173
70
Yb
| Electrons | Protons | Neutrons |
|---|---|---|
| 70 | 70 | 103 |
| Electronic Configuration | ||
| [Xe] 4f146s2 |
- Discovered By: Jean Charles Galissard de Marignac
- Appearance: silvery gray
- Category: lanthanide
- Melting Point: 1097 K
- Boiling Point: 1469 K
- Ox. State: 2, 3
- Bonding Type: metallic
- Electronegativity: 1.1
- Wiki Link: Source Link
- Element Image: Image Link
Ytterbium is a chemical element with symbol Yb and atomic number 70. It is the fourteenth and penultimate element in the lanthanide series, which is the basis of the relative stability of its +2 oxidation state. However, like the other lanthanides, its most common oxidation state is +3, seen in its oxide, halides and other compounds.
Lutetium
| Discovered | State |
|---|---|
| 1907 | Solid |
| Atomic Mass | Density |
| 174.96681 | 9.841 g/L |
175
71
Lu
| Electrons | Protons | Neutrons |
|---|---|---|
| 71 | 71 | 104 |
| Electronic Configuration | ||
| [Xe] 4f145d16s2 |
- Discovered By: Georges Urbain
- Appearance: silvery white
- Category: lanthanide
- Melting Point: 1925 K
- Boiling Point: 3675 K
- Ox. State: 3
- Bonding Type: metallic
- Electronegativity: 1.27
- Wiki Link: Source Link
- Element Image: Image Link
Lutetium is a chemical element with symbol Lu and atomic number 71. It is a silvery white metal, which resists corrosion in dry, but not in moist air. It is considered the first element of the 6th-period transition metals and the last element in the lanthanide series, and is traditionally counted among the rare earths.
Hafnium
| Discovered | State |
|---|---|
| 1923 | Solid |
| Atomic Mass | Density |
| 178.492 | 13.31 g/L |
178
72
Hf
| Electrons | Protons | Neutrons |
|---|---|---|
| 72 | 72 | 106 |
| Electronic Configuration | ||
| [Xe] 4f145d26s2 |
- Discovered By: Dirk Coster
- Appearance: steel gray
- Category: transition metal
- Melting Point: 2506 K
- Boiling Point: 4876 K
- Ox. State: 2, 3, 4
- Bonding Type: metallic
- Electronegativity: 1.3
- Wiki Link: Source Link
- Element Image: Image Link
Hafnium is a chemical element with symbol Hf and atomic number 72. A lustrous, silvery gray, tetravalent transition metal, hafnium chemically resembles zirconium and is found in zirconium minerals. Its existence was predicted by Dmitri Mendeleev in 1869, though it was not identified until 1923, making it the penultimate stable element to be discovered (rhenium was identified two years later).
Tantalum
| Discovered | State |
|---|---|
| 1802 | Solid |
| Atomic Mass | Density |
| 180.947882 | 16.69 g/L |
181
73
Ta
| Electrons | Protons | Neutrons |
|---|---|---|
| 73 | 73 | 108 |
| Electronic Configuration | ||
| [Xe] 4f145d36s2 |
- Discovered By: Anders Gustaf Ekeberg
- Appearance: gray blue
- Category: transition metal
- Melting Point: 3290 K
- Boiling Point: 5731 K
- Ox. State: 2, 3, 4
- Bonding Type: metallic
- Electronegativity: 1.5
- Wiki Link: Source Link
- Element Image: Image Link
Tantalum is a chemical element with symbol Ta and atomic number 73. Previously known as tantalium, its name comes from Tantalus, an antihero from Greek mythology. Tantalum is a rare, hard, blue-gray, lustrous transition metal that is highly corrosion-resistant.
Tungsten
| Discovered | State |
|---|---|
| 1783 | Solid |
| Atomic Mass | Density |
| 183.841 | 19.25 g/L |
184
74
W
| Electrons | Protons | Neutrons |
|---|---|---|
| 74 | 74 | 110 |
| Electronic Configuration | ||
| [Xe] 4f145d46s2 |
- Discovered By: Carl Wilhelm Scheele
- Appearance: grayish white, lustrous
- Category: transition metal
- Melting Point: 3695 K
- Boiling Point: 6203 K
- Ox. State: -2, -1, 1, 2, 3, 4, 5, 6
- Bonding Type: metallic
- Electronegativity: 2.36
- Wiki Link: Source Link
- Element Image: Image Link
Tungsten, also known as wolfram, is a chemical element with symbol W and atomic number 74. The word tungsten comes from the Swedish language tung sten, which directly translates to heavy stone. Its name in Swedish is volfram, however, in order to distinguish it from scheelite, which in Swedish is alternatively named tungsten.
Rhenium
| Discovered | State |
|---|---|
| 1925 | Solid |
| Atomic Mass | Density |
| 186.2071 | 21.02 g/L |
186
75
Re
| Electrons | Protons | Neutrons |
|---|---|---|
| 75 | 75 | 111 |
| Electronic Configuration | ||
| [Xe] 4f145d56s2 |
- Discovered By: Masataka Ogawa
- Appearance: silvery-grayish
- Category: transition metal
- Melting Point: 3459 K
- Boiling Point: 5869 K
- Ox. State: -3, -1, 1, 2, 3, 4, 5, 6, 7
- Bonding Type: metallic
- Electronegativity: 1.9
- Wiki Link: Source Link
- Element Image: Image Link
Rhenium is a chemical element with symbol Re and atomic number 75. It is a silvery-white, heavy, third-row transition metal in group 7 of the periodic table. With an estimated average concentration of 1 part per billion (ppb), rhenium is one of the rarest elements in the Earth’s crust.
Osmium
| Discovered | State |
|---|---|
| 1803 | Solid |
| Atomic Mass | Density |
| 190.233 | 22.59 g/L |
187
76
Os
| Electrons | Protons | Neutrons |
|---|---|---|
| 76 | 76 | 111 |
| Electronic Configuration | ||
| [Xe] 4f145d66s2 |
- Discovered By: Smithson Tennant
- Appearance: silvery, blue cast
- Category: transition metal
- Melting Point: 3306 K
- Boiling Point: 5285 K
- Ox. State: -2, -1, 1, 2, 3, 4, 5, 6, 7, 8
- Bonding Type: metallic
- Electronegativity: 2.2
- Wiki Link: Source Link
- Element Image: Image Link
Osmium (from Greek osme (ὀσμή) meaning “smell”) is a chemical element with symbol Os and atomic number 76. It is a hard, brittle, bluish-white transition metal in the platinum group that is found as a trace element in alloys, mostly in platinum ores. Osmium is the densest naturally occurring element, with a density of 22.59 g/cm3.
Iridium
| Discovered | State |
|---|---|
| 1803 | Solid |
| Atomic Mass | Density |
| 192.2173 | 22.56 g/L |
192
77
Ir
| Electrons | Protons | Neutrons |
|---|---|---|
| 77 | 77 | 115 |
| Electronic Configuration | ||
| [Xe] 4f145d76s2 |
- Discovered By: Smithson Tennant
- Appearance: silvery white
- Category: transition metal
- Melting Point: 2719 K
- Boiling Point: 4403 K
- Ox. State: -3, -1, 1, 2, 3, 4, 5, 6
- Bonding Type: metallic
- Electronegativity: 2.2
- Wiki Link: Source Link
- Element Image: Image Link
Iridium is a chemical element with symbol Ir and atomic number 77. A very hard, brittle, silvery-white transition metal of the platinum group, iridium is generally credited with being the second densest element (after osmium) based on measured density, although calculations involving the space lattices of the elements show that iridium is denser. It is also the most corrosion-resistant metal, even at temperatures as high as 2000 °C. Although only certain molten salts and halogens are corrosive to solid iridium, finely divided iridium dust is much more reactive and can be flammable.
Platinum
| Discovered | State |
|---|---|
| Ancient | Solid |
| Atomic Mass | Density |
| 195.0849 | 21.45 g/L |
195
78
Pt
| Electrons | Protons | Neutrons |
|---|---|---|
| 78 | 78 | 117 |
| Electronic Configuration | ||
| [Xe] 4f145d96s1 |
- Discovered By: Antonio de Ulloa
- Appearance: silvery white
- Category: transition metal
- Melting Point: 2041.4 K
- Boiling Point: 4098 K
- Ox. State: 2, 4, 5, 6
- Bonding Type: metallic
- Electronegativity: 2.28
- Wiki Link: Source Link
- Element Image: Image Link
Platinum is a chemical element with symbol Pt and atomic number 78. It is a dense, malleable, ductile, highly unreactive, precious, gray-white transition metal. Its name is derived from the Spanish term platina, which is literally translated into “little silver”.
Gold
| Discovered | State |
|---|---|
| Ancient | Solid |
| Atomic Mass | Density |
| 196.9665695 | 19.3 g/L |
197
79
Au
| Electrons | Protons | Neutrons |
|---|---|---|
| 79 | 79 | 118 |
| Electronic Configuration | ||
| [Xe] 4f145d106s1 |
- Discovered By: Middle East
- Appearance: metallic yellow
- Category: transition metal
- Melting Point: 1337.33 K
- Boiling Point: 3243 K
- Ox. State: -1, 1, 2, 3, 5
- Bonding Type: metallic
- Electronegativity: 2.54
- Wiki Link: Source Link
- Element Image: Image Link
Gold is a chemical element with symbol Au (from Latin:aurum) and atomic number 79. In its purest form, it is a bright, slightly reddish yellow, dense, soft, malleable and ductile metal. Chemically, gold is a transition metal and a group 11 element.
Mercury
| Discovered | State |
|---|---|
| Ancient | Liquid |
| Atomic Mass | Density |
| 200.5923 | 13.534 g/L |
201
80
Hg
| Electrons | Protons | Neutrons |
|---|---|---|
| 80 | 80 | 121 |
| Electronic Configuration | ||
| [Xe] 4f145d106s2 |
- Discovered By: unknown, before 2000 BCE
- Appearance: silvery
- Category: transition metal
- Melting Point: 234.321 K
- Boiling Point: 629.88 K
- Ox. State: 1, 2, 4
- Bonding Type: metallic
- Electronegativity: 2
- Wiki Link: Source Link
- Element Image: Image Link
Mercury is a chemical element with symbol Hg and atomic number 80. It is commonly known as quicksilver and was formerly named hydrargyrum (/haɪˈdrɑːrdʒərəm/). A heavy, silvery d-block element, mercury is the only metallic element that is liquid at standard conditions for temperature and pressure; the only other element that is liquid under these conditions is bromine, though metals such as caesium, gallium, and rubidium melt just above room temperature.
Thallium
| Discovered | State |
|---|---|
| 1861 | Solid |
| Atomic Mass | Density |
| 204.38 | 11.85 g/L |
204
81
Tl
| Electrons | Protons | Neutrons |
|---|---|---|
| 81 | 81 | 123 |
| Electronic Configuration | ||
| [Xe] 4f145d106s26p1 |
- Discovered By: William Crookes
- Appearance: silvery white
- Category: post-transition metal
- Melting Point: 577 K
- Boiling Point: 1746 K
- Ox. State: 1, 3
- Bonding Type: metallic
- Electronegativity: 2.04
- Wiki Link: Source Link
- Element Image: Image Link
Thallium is a chemical element with symbol Tl and atomic number 81. This soft gray post-transition metal is not found free in nature. When isolated, it resembles tin, but discolors when exposed to air.
Lead
| Discovered | State |
|---|---|
| Ancient | Solid |
| Atomic Mass | Density |
| 207.21 | 11.34 g/L |
208
82
Pb
| Electrons | Protons | Neutrons |
|---|---|---|
| 82 | 82 | 126 |
| Electronic Configuration | ||
| [Xe] 4f145d106s26p2 |
- Discovered By: Middle East
- Appearance: metallic gray
- Category: post-transition metal
- Melting Point: 600.61 K
- Boiling Point: 2022 K
- Ox. State: -4, 2, 4
- Bonding Type: metallic
- Electronegativity: 2.33
- Wiki Link: Source Link
- Element Image: Image Link
Lead (/lɛd/) is a chemical element in the carbon group with symbol Pb (from Latin:plumbum) and atomic number 82. Lead is a soft, malleable and heavy post-transition metal. Metallic lead has a bluish-white color after being freshly cut, but it soon tarnishes to a dull grayish color when exposed to air.
Bismuth
| Discovered | State |
|---|---|
| Ancient | Solid |
| Atomic Mass | Density |
| 208.980401 | 9.78 g/L |
206
83
Bi
| Electrons | Protons | Neutrons |
|---|---|---|
| 83 | 83 | 123 |
| Electronic Configuration | ||
| [Xe] 4f145d106s26p3 |
- Discovered By: Claude François Geoffroy
- Appearance: lustrous silver
- Category: post-transition metal
- Melting Point: 544.7 K
- Boiling Point: 1837 K
- Ox. State: -3, 3, 5
- Bonding Type: metallic
- Electronegativity: 2.02
- Wiki Link: Source Link
- Element Image: Image Link
Bismuth is a chemical element with symbol Bi and atomic number 83. Bismuth, a pentavalent post-transition metal, chemically resembles arsenic and antimony. Elemental bismuth may occur naturally, although its sulfide and oxide form important commercial ores.
Polonium
| Discovered | State |
|---|---|
| 1898 | Solid |
| Atomic Mass | Density |
| 209 | 9.196 g/L |
209
84
Po
| Electrons | Protons | Neutrons |
|---|---|---|
| 84 | 84 | 125 |
| Electronic Configuration | ||
| [Xe] 4f145d106s26p4 |
- Discovered By: Pierre Curie
- Appearance: silvery
- Category: post-transition metal
- Melting Point: 527 K
- Boiling Point: 1235 K
- Ox. State: -2, 2, 4, 6
- Bonding Type: metallic
- Electronegativity: 2
- Wiki Link: Source Link
- Element Image: Image Link
Polonium is a chemical element with symbol Po and atomic number 84, discovered in 1898 by Marie Curie and Pierre Curie. A rare and highly radioactive element with no stable isotopes, polonium is chemically similar to bismuth and tellurium, and it occurs in uranium ores. Applications of polonium are few.
Astatine
| Discovered | State |
|---|---|
| 1940 | Solid |
| Atomic Mass | Density |
| 210 | 26.35 g/L |
210
85
At
| Electrons | Protons | Neutrons |
|---|---|---|
| 85 | 85 | 125 |
| Electronic Configuration | ||
| [Xe] 4f145d106s26p5 |
- Discovered By: Dale R. Corson
- Appearance: silvery
- Category: metalloid
- Melting Point: 575 K
- Boiling Point: 610 K
- Ox. State: -1, 1, 3, 5
- Bonding Type: metallic
- Electronegativity: 2.2
- Wiki Link: Source Link
- Element Image: Image Link
Astatine is a very rare radioactive chemical element with the chemical symbol At and atomic number 85. It occurs on Earth as the decay product of various heavier elements. All its isotopes are short-lived; the most stable is astatine-210, with a half-life of 8.1 hours.
Radon
| Discovered | State |
|---|---|
| 1900 | Gas |
| Atomic Mass | Density |
| 222 | 9.73 g/L |
222
86
Rn
| Electrons | Protons | Neutrons |
|---|---|---|
| 86 | 86 | 136 |
| Electronic Configuration | ||
| [Xe] 4f145d106s26p6 |
- Discovered By: Friedrich Ernst Dorn
- Appearance: colorless gas
- Category: noble gas
- Melting Point: 202 K
- Boiling Point: 211.5 K
- Ox. State: 2
- Bonding Type: metallic
- Electronegativity:
- Wiki Link: Source Link
- Element Image: Image Link
Radon is a chemical element with symbol Rn and atomic number 86. It is a radioactive, colorless, odorless, tasteless noble gas, occurring naturally as a decay product of radium. Its most stable isotope, 222Rn, has a half-life of 3.8 days.
Francium
| Discovered | State |
|---|---|
| 1939 | Solid |
| Atomic Mass | Density |
| 223 | 1.87 g/L |
223
87
Fr
| Electrons | Protons | Neutrons |
|---|---|---|
| 87 | 87 | 136 |
| Electronic Configuration | ||
| [Rn] 7s1 |
- Discovered By: Marguerite Perey
- Appearance:
- Category: alkali metal
- Melting Point: 300 K
- Boiling Point: 950 K
- Ox. State: 1
- Bonding Type: metallic
- Electronegativity: 0.7
- Wiki Link: Source Link
- Element Image: Image Link
Francium is a chemical element with symbol Fr and atomic number 87. It used to be known as eka-caesium and actinium K. It is the second-least electronegative element, behind only caesium. Francium is a highly radioactive metal that decays into astatine, radium, and radon.
Radium
| Discovered | State |
|---|---|
| 1898 | Solid |
| Atomic Mass | Density |
| 226 | 5.5 g/L |
226
88
Ra
| Electrons | Protons | Neutrons |
|---|---|---|
| 88 | 88 | 138 |
| Electronic Configuration | ||
| [Rn] 7s2 |
- Discovered By: Pierre Curie
- Appearance:
- Category: alkaline earth metal
- Melting Point: 1233 K
- Boiling Point: 2010 K
- Ox. State: 3
- Bonding Type: metallic
- Electronegativity: 0.9
- Wiki Link: Source Link
- Element Image: Image Link
Radium is a chemical element with symbol Ra and atomic number 88. It is the sixth element in group 2 of the periodic table, also known as the alkaline earth metals. Pure radium is almost colorless, but it readily combines with nitrogen (rather than oxygen) on exposure to air, forming a black surface layer of radium nitride (Ra3N2).
Actinium
| Discovered | State |
|---|---|
| 1898 | Solid |
| Atomic Mass | Density |
| 226 | 10 g/L |
227
89
Ac
| Electrons | Protons | Neutrons |
|---|---|---|
| 89 | 89 | 138 |
| Electronic Configuration | ||
| [Rn] 6d17s2 |
- Discovered By: Friedrich Oskar Giesel
- Appearance:
- Category: actinide
- Melting Point: 1500 K
- Boiling Point: 3500 K
- Ox. State: 3
- Bonding Type: metallic
- Electronegativity: 1.1
- Wiki Link: Source Link
- Element Image: Image Link
Actinium is a radioactive chemical element with symbol Ac (not to be confused with the abbreviation for an acetyl group) and atomic number 89, which was discovered in 1899. It was the first non-primordial radioactive element to be isolated. Polonium, radium and radon were observed before actinium, but they were not isolated until 1902.
Thorium
| Discovered | State |
|---|---|
| 1828 | Solid |
| Atomic Mass | Density |
| 232.03774 | 11.724 g/L |
232
90
Th
| Electrons | Protons | Neutrons |
|---|---|---|
| 90 | 90 | 142 |
| Electronic Configuration | ||
| [Rn] 6d27s2 |
- Discovered By: Jöns Jakob Berzelius
- Appearance: silvery
- Category: actinide
- Melting Point: 2023 K
- Boiling Point: 5061 K
- Ox. State: 2, 3, 4
- Bonding Type: metallic
- Electronegativity: 1.3
- Wiki Link: Source Link
- Element Image: Image Link
Thorium is a chemical element with symbol Th and atomic number 90. A radioactive actinide metal, thorium is one of only two significantly radioactive elements that still occur naturally in large quantities as a primordial element (the other being uranium). It was discovered in 1828 by the Norwegian Reverend and amateur mineralogist Morten Thrane Esmark and identified by the Swedish chemist Jöns Jakob Berzelius, who named it after Thor, the Norse god of thunder.
Protactinium
| Discovered | State |
|---|---|
| 1913 | Solid |
| Atomic Mass | Density |
| 231.035882 | 15.37 g/L |
231
91
Pa
| Electrons | Protons | Neutrons |
|---|---|---|
| 91 | 91 | 140 |
| Electronic Configuration | ||
| [Rn] 5f2 6d1 7s2 |
- Discovered By: William Crookes
- Appearance: bright, silvery metallic luster
- Category: actinide
- Melting Point: 1841 K
- Boiling Point: 4300 K
- Ox. State: 3, 4, 5
- Bonding Type: metallic
- Electronegativity: 1.5
- Wiki Link: Source Link
- Element Image: Image Link
Protactinium is a chemical element with symbol Pa and atomic number 91. It is a dense, silvery-gray metal which readily reacts with oxygen, water vapor and inorganic acids. It forms various chemical compounds where protactinium is usually present in the oxidation state +5, but can also assume +4 and even +2 or +3 states.
Uranium
| Discovered | State |
|---|---|
| 1789 | Solid |
| Atomic Mass | Density |
| 238.028913 | 19.1 g/L |
238
92
U
| Electrons | Protons | Neutrons |
|---|---|---|
| 92 | 92 | 146 |
| Electronic Configuration | ||
| [Rn] 5f3 6d1 7s2 |
- Discovered By: Martin Heinrich Klaproth
- Appearance:
- Category: actinide
- Melting Point: 1405.3 K
- Boiling Point: 4404 K
- Ox. State: 3, 4, 5, 6
- Bonding Type: metallic
- Electronegativity: 1.38
- Wiki Link: Source Link
- Element Image: Image Link
Uranium is a chemical element with symbol U and atomic number 92. It is a silvery-white metal in the actinide series of the periodic table. A uranium atom has 92 protons and 92 electrons, of which 6 are valence electrons.
Neptunium
| Discovered | State |
|---|---|
| 1940 | Solid |
| Atomic Mass | Density |
| 237 | 20.45 g/L |
237
93
Np
| Electrons | Protons | Neutrons |
|---|---|---|
| 93 | 93 | 144 |
| Electronic Configuration | ||
| [Rn] 5f3 6d1 7s2 |
- Discovered By: Edwin McMillan
- Appearance:
- Category: actinide
- Melting Point: 912 K
- Boiling Point: 4447 K
- Ox. State: 3, 4, 5, 6, 7
- Bonding Type: metallic
- Electronegativity: 1.36
- Wiki Link: Source Link
- Element Image: Image Link
Neptunium is a chemical element with symbol Np and atomic number 93. A radioactive actinide metal, neptunium is the first transuranic element. Its position in the periodic table just after uranium, named after the planet Uranus, led to it being named after Neptune, the next planet beyond Uranus.
Plutonium
| Discovered | State |
|---|---|
| 1940 | Solid |
| Atomic Mass | Density |
| 244 | 19.816 g/L |
333
94
Pu
| Electrons | Protons | Neutrons |
|---|---|---|
| 94 | 94 | 239 |
| Electronic Configuration | ||
| [Rn] 5f6 7s2 |
- Discovered By: Glenn T. Seaborg
- Appearance: silvery white
- Category: actinide
- Melting Point: 912.5 K
- Boiling Point: 3505 K
- Ox. State: 3, 4, 5, 6, 7
- Bonding Type: metallic
- Electronegativity: 1.28
- Wiki Link: Source Link
- Element Image: Image Link
Plutonium is a transuranic radioactive chemical element with symbol Pu and atomic number 94. It is an actinide metal of silvery-gray appearance that tarnishes when exposed to air, and forms a dull coating when oxidized. The element normally exhibits six allotropes and four oxidation states.
Americium
| Discovered | State |
|---|---|
| 1944 | Solid |
| Atomic Mass | Density |
| 243 | 12 g/L |
243
95
Am
| Electrons | Protons | Neutrons |
|---|---|---|
| 95 | 95 | 148 |
| Electronic Configuration | ||
| [Rn] 5f7 7s2 |
- Discovered By: Glenn T. Seaborg
- Appearance: silvery white
- Category: actinide
- Melting Point: 1449 K
- Boiling Point: 2880 K
- Ox. State: 3, 4, 5, 6, 7
- Bonding Type: metallic
- Electronegativity: 1.3
- Wiki Link: Source Link
- Element Image: Image Link
Americium is a radioactive transuranic chemical element with symbol Am and atomic number 95. This member of the actinide series is located in the periodic table under the lanthanide element europium, and thus by analogy was named after the Americas. Americium was first produced in 1944 by the group of Glenn T.Seaborg from Berkeley, California, at the metallurgical laboratory of University of Chicago.
Curium
| Discovered | State |
|---|---|
| 1944 | Solid |
| Atomic Mass | Density |
| 247 | 13.51 g/L |
247
96
Cm
| Electrons | Protons | Neutrons |
|---|---|---|
| 96 | 96 | 151 |
| Electronic Configuration | ||
| [Rn] 5f7 6d1 7s2 |
- Discovered By: Glenn T. Seaborg
- Appearance: silvery metallic
- Category: actinide
- Melting Point: 1613 K
- Boiling Point: 3383 K
- Ox. State: 3, 4
- Bonding Type: metallic
- Electronegativity: 1.3
- Wiki Link: Source Link
- Element Image: Image Link
Curium is a transuranic radioactive chemical element with symbol Cm and atomic number 96. This element of the actinide series was named after Marie and Pierre Curie – both were known for their research on radioactivity. Curium was first intentionally produced and identified in July 1944 by the group of Glenn T. Seaborg at the University of California, Berkeley.
Berkelium
| Discovered | State |
|---|---|
| 1949 | Solid |
| Atomic Mass | Density |
| 247 | 14.78 g/L |
247
97
Bk
| Electrons | Protons | Neutrons |
|---|---|---|
| 97 | 97 | 150 |
| Electronic Configuration | ||
| [Rn] 5f9 7s2 |
- Discovered By: Lawrence Berkeley National Laboratory
- Appearance: silvery
- Category: actinide
- Melting Point: 1259 K
- Boiling Point: 2900 K
- Ox. State: 3, 4
- Bonding Type: metallic
- Electronegativity: 1.3
- Wiki Link: Source Link
- Element Image: Image Link
Berkelium is a transuranic radioactive chemical element with symbol Bk and atomic number 97. It is a member of the actinide and transuranium element series. It is named after the city of Berkeley, California, the location of the University of California Radiation Laboratory where it was discovered in December 1949.
Californium
| Discovered | State |
|---|---|
| 1950 | Solid |
| Atomic Mass | Density |
| 251 | 15.1 g/L |
251
98
Cf
| Electrons | Protons | Neutrons |
|---|---|---|
| 98 | 98 | 153 |
| Electronic Configuration | ||
| [Rn] 5f10 7s2 |
- Discovered By: Lawrence Berkeley National Laboratory
- Appearance: silvery
- Category: actinide
- Melting Point: 1173 K
- Boiling Point: 1743 K
- Ox. State: 2, 3, 4
- Bonding Type: metallic
- Electronegativity: 1.3
- Wiki Link: Source Link
- Element Image: Image Link
Californium is a radioactive metallic chemical element with symbol Cf and atomic number 98. The element was first made in 1950 at the University of California Radiation Laboratory in Berkeley, by bombarding curium with alpha particles (helium-4 ions). It is an actinide element, the sixth transuranium element to be synthesized, and has the second-highest atomic mass of all the elements that have been produced in amounts large enough to see with the unaided eye (after einsteinium).
Einsteinium
| Discovered | State |
|---|---|
| 1950 | Solid |
| Atomic Mass | Density |
| 252 | 8.84 g/L |
252
99
Es
| Electrons | Protons | Neutrons |
|---|---|---|
| 99 | 99 | 153 |
| Electronic Configuration | ||
| [Rn] 5f11 7s2 |
- Discovered By: Lawrence Berkeley National Laboratory
- Appearance: silvery
- Category: actinide
- Melting Point: 1133 K
- Boiling Point: 1269 K
- Ox. State: 2, 3
- Bonding Type: metallic
- Electronegativity: 1.3
- Wiki Link: Source Link
- Element Image: Image Link
Einsteinium is a synthetic element with symbol Es and atomic number 99. It is the seventh transuranic element, and an actinide. Einsteinium was discovered as a component of the debris of the first hydrogen bomb explosion in 1952, and named after Albert Einstein.
Fermium
| Discovered | State |
|---|---|
| 1952 | Solid |
| Atomic Mass | Density |
| 257 | g/L |
257
100
Fm
| Electrons | Protons | Neutrons |
|---|---|---|
| 100 | 100 | 157 |
| Electronic Configuration | ||
| [Rn] 5f12 7s2 |
- Discovered By: Lawrence Berkeley National Laboratory
- Appearance:
- Category: actinide
- Melting Point: 1800 K
- Boiling Point: K
- Ox. State: 2, 3
- Bonding Type:
- Electronegativity: 1.3
- Wiki Link: Source Link
- Element Image: Image Link
Fermium is a synthetic element with symbol Fm and atomic number 100. It is a member of the actinide series. It is the heaviest element that can be formed by neutron bombardment of lighter elements, and hence the last element that can be prepared in macroscopic quantities, although pure fermium metal has not yet been prepared.
Mendelevium
| Discovered | State |
|---|---|
| 1955 | Solid |
| Atomic Mass | Density |
| 258 | g/L |
258
101
Md
| Electrons | Protons | Neutrons |
|---|---|---|
| 101 | 101 | 157 |
| Electronic Configuration | ||
| [Rn] 5f13 7s2 |
- Discovered By: Lawrence Berkeley National Laboratory
- Appearance:
- Category: actinide
- Melting Point: 1100 K
- Boiling Point: K
- Ox. State: 2, 3
- Bonding Type:
- Electronegativity: 1.3
- Wiki Link: Source Link
- Element Image: Image Link
Mendelevium is a synthetic element with chemical symbol Md (formerly Mv) and atomic number 101. A metallic radioactive transuranic element in the actinide series, it is the first element that currently cannot be produced in macroscopic quantities through neutron bombardment of lighter elements. It is the antepenultimate actinide and the ninth transuranic element.
Одной из сложных тем школьного курса химии является составление уравнений окислительно-восстановительных реакций органических веществ. В ряде заданий единого государственного экзамена по химии части C требуется не только привести схему реакции, а составить именно уравнение реакции окисления органического соединения с правильно подобранными коэффициентами. В органической химии термин «реакция окисления» подразумевает, что окисляется именно органическое соединение, при этом окислителем в большинстве случаев является неорганический реагент.
Окислительно-восстановительные реакции с участием органических веществ встречаются в заданиях ЕГЭ С3, олимпиадных заданиях, и ,как правило вызывают наибольшие затруднения у школьников. У большинства вызывает затруднение составление уравнения электронного баланса и расстановка коэффициентов в органических ОВР.
1. Графический метод определения степени окисления в органических веществах
В органических веществах можно определять степени окисления элементов алгебраическим методом, при этом получается усредненное значение степени окисления. Этот метод наиболее применим в том случае, если все атомы углерода органического вещества по окончании реакции приобрели одинаковую степень окисления (реакции горения или полного окисления)
Рассмотрим такой случай:
Пример 1. Обугливание дезоксирибозы серной концентрированной кислотой с дальнейшим окислением:
С5Н10О4 + H2SO4 CO2 + H2O + SO2
Найдём степень окисления углерода х в дезоксирибозе: 5х + 10 – 8 = 0; х = – 2/5
В электронном балансе учитываем все 5 атомов углерода:
5С -2/5 – 22е 5С+4 2 1
Окисление
S+6 + 2е S+4 22 11
восстановление
С5Н10О4 + 11H2SO4 5CO2 + 16H2O + 11SO2
В большинстве случаев окислению подвергаются не все атомы органического вещества, а только некоторые. В этом случае в электронный баланс вносятся только атомы, изменившие степень окисления, а, следовательно, нужно знать степень окисления каждого атома.
+
Легче всего это сделать графическим методом: 1) изображается полная структурная формула вещества;
2) по каждой связи стрелкой показывается смещение электрона к наиболее электроотрицательному элементу;
3) все связи С – С считаются неполярными;
4) далее ведется подсчет: сколько стрелок направлено к атому, столько «–» , сколько от атома – столько «+». Сумма «–» и «+» определяет степень окисления атома. Рассмотрим несколько примеров:
Н
Н С С О
Н О Н
Углерод карбоксильной группы смещает от себя 3 электрона, его степень окисления +3, углерод метильного радикала притягивает к себе 3 электрона от водорода, его степень окисления – 3.
Cl
Н С С О
H H
Углерод альдегидной группы отдает 2 электрона (+2) и притягивает к себе 1 электрон ( – 1), итого степень окисления углерода альдегидной группы +1. Углерод радикала притягивает 2 электрона от водорода (-2) и отдает 1 электрон хлору (+1), итого степень окисления этого углерода -1.
Н Н
Н С С С ≡ С Н
Н Н
У первого углерода (начинаем считать справа) степень окисления -1, у второго 0, так как мы считаем все связи углерод-углерод неполярными, у третьего – 2, у четвертого – 3.
Задание 1. Определите усредненную степень окисления атомов углерода алгебраическим методом и степень окисления каждого атома углерода графическим методом в следующих соединениях:
- 2-аминопропан
- глицерин
- 1,2 – дихлорпропан
- аланин
- метилфенилкетон
2. Окислительно-восстановительные реакции с участием органических веществ, их разновидности, определение продуктов
Все ОВР в органике можно условно разделить на 3 группы:
- Полное окисление и горение. В качестве окислителей используются кислород (другие вещества, поддерживающие горение, например оксиды азота), концентрированные азотная и серная кислота, можно использовать твердые соли, при нагревании которых выделяется кислород (хлораты, нитраты, перманганаты и т.п.), другие окислители (например, оксид меди (II)). В этих реакциях наблюдается разрушение всех химических связей в органическом веществе. Продуктами окисления органического вещества являются углекислый газ и вода.
2.Мягкое окисление. В этом случае не происходит разрыва углеродной цепи. К мягкому окислению относится окисление спиртов до альдегидов и кетонов, окисление альдегидов до карбоновых кислот, окисление алкенов до двухатомных спиртов (Реакция Вагнера), окисление ацетилена до оксалата калия, толуола – до бензойной кислоты и т.д. В качестве окислителей в этих случаях используются разбавленные растворы перманганата калия, дихромата калия, азотной кислоты, аммиачный раствор оксида серебра, оксид меди (II), гидроксид меди (II).
3.Деструктивное окисление. Происходит в более жестких условиях, чем мягкое окисление, сопровождается разрывом некоторых углерод-углеродных связей. В качестве окислителей используются более концентрированные растворы перманганата калия, дихромата калия при нагревании. Среда этих реакций может быть кислой, нейтральной и щелочной. От этого будут зависеть продукты реакций.
Деструкция (разрыв углеродной цепи) происходит у алкенов и алкинов – по кратной связи, у производных бензола – между первым и вторым атомами углерода, если считать от кольца, у третичных спиртов – у атома, содержащего гидроксильную группу, у кетонов – у атома при карбонильной группе.
Если при деструкции оторвался фрагмент, содержащий 1 атом углерода, то он окисляется до углекислого газа (в кислой среде), гидрокарбоната и (или) карбоната (в нейтральной среде), карбоната (в щелочной среде). Все более длинные фрагменты превращаются в кислоты (в кислой среде) и соли этих кислот (в нейтральной и щелочной среде). В некоторых случаях получаются не кислоты, а кетоны (при окислении третичных спиртов, разветвленных радикалов у гомологов бензола, у кетонов, алкенов).
Ниже в схемах представлены возможные варианты окисления производных бензола в кислой и щелочной среде. Разными цветами выделены атомы углерода, участвующие в окислительно-восстановительном процессе. Выделение цветом позволяет проследить «судьбу» каждого атома углерода.
Окисление производных бензола в кислой среде
Схема 2. Окисление производных бензола в щелочной среде
Несколько сложнее составить уравнение реакции окисления в нейтральной среде. Точно определить, какие продукты получатся, можно только при расстановке коэффициентов. Рассмотрим последовательно такой случай.
Пример 4. Окисление фенилацетилена водным раствором перманганата калия при нагревании. При этой реакции происходит деструкция по тройной связи, образуется бензоат калия, оксид марганца (IV), остальные продукты пока не ясны, запишем КОН и КНСО3. Кстати, при расстановке коэффициентов может выясниться, что воду нужно перенести в правую часть уравнения:
С6Н5–С≡СН + KMnO4 + H2O С6Н5–СООК + MnO2 + KOH+ КНСО3
С 0 – 3е С+3
С -1– 5е С+4 8 3 восстановитель
Окисление
Mn+7 + 3е Mn+4 8 окислитель
Восстановление
Ставим коэффициенты из баланса перед углеродом и марганцем:
3С6Н5–С≡СН + 8KMnO4 + H2O 3С6Н5–СООК + 8MnO2 + KOH+ 3КНСО3
После этого уравниваем калий:
3С6Н5–С≡СН + 8KMnO4 + H2O 3С6Н5–СООК + 8MnO2 + 2KOH+ 3КНСО3
Учитывая то, что кислая соль нейтрализуется щелочью:
2KOH+ 3КНСО3 2К2СО3 + КНСО3 + 2H2O, изменим продукты реакции:
3С6Н5–С≡СН + 8KMnO4 + H2O 3С6Н5–СООК + 8MnO2 + 2К2СО3 + КНСО3
Проверим число атомов водорода в правой части уравнения – 16, в левой части – 18 без учета воды, следовательно, воду нужно перенести в правую часть:
3С6Н5–С≡СН + 8KMnO4 3С6Н5–СООК + 8MnO2 + 2К2СО3 + КНСО3+ H2O
Пример 5. Окисление бутена-1 водным раствором перманганата калия при нагревании. При этой реакции происходит деструкция по двойной связи, образуется пропионат калия, оксид марганца (IV), остальные продукты пока не ясны, запишем КОН и КНСО3.
CH3-CH2–CH=CH2 + KMnO4 + H2O С2Н5–СООК + MnO2 + KOH+ КНСО3
С -1 – 4е С+3
С -2 – 6е С+4 10 3 восстановитель
Окисление
Mn+7 + 3е Mn+4 10 окислитель
Восстановление
Ставим коэффициенты из баланса перед углеродом и марганцем:
3CH3-CH2–CH=CH2 + 10KMnO4 + H2O 3С2Н5–СООК + 10MnO2 + KOH+ 3КНСО3
После этого уравниваем калий:
3CH3-CH2–CH=CH2 + 10KMnO4 + H2O 3С2Н5–СООК + 10MnO2 + 4KOH+ 3КНСО3
Учитывая то, что кислая соль нейтрализуется щелочью:
4KOH+ 3КНСО3 3К2СО3 + КOH + 3H2O, изменим продукты реакции:
3CH3-CH2–CH=CH2 + 10KMnO4 + H2O 3С2Н5–СООК + 10MnO2 + KOH+ 3К2СО3
Проверим число атомов водорода в правой части уравнения – 16, в левой части – 24 без учета воды, следовательно, воду нужно перенести в правую часть:
3CH3-CH2–CH=CH2 + 10KMnO4 3С2Н5–СООК + 10MnO2 + KOH+ 3К2СО3 + 4H2O
Метод макроподстановки при расставлении коэффициентов в органических ОВР
В случае, когда множество атомов углерода меняют степень окисления, рассматривается каждый атом отдельно, а затем все отданные атомами углерода электроны складываются. В этом и состоит сущность макроподстановки. Рассмотрим пример 6. Пользуясь схемой 1, составим формулы продуктов реакции окисления.
+ KMnO4 + H2SO4
+ CO2 + CH3COOH + MnSO4 + K2SO4 + H2O
Теперь определим степени окисления всех атомов углерода, которые будут меняться: в гидроксильной группе – 1, в альдегидной группе +1, в метильном радикале – 3, в этильном радикале будет менять степень окисления только атом, связанный с СН, его степень окисления – 2, в СН степень окисления С – 1. Первые от бензольного кольца атомы углерода приобрели степень окисления +3, метильный радикал превратился в углекислый газ +4, углерод этильного радикала – в карбоксильную группу +3.
С -1 – 4е С+3
С +1 – 2е С+3
С -1 – 4е С+3 22 5
С -3 – 7е С+4
С -2 – 5е С+3
Окисление
Mn+7 + 5е Mn+2 22 окислитель
– 6 е +16 е
Расставим коэффициенты (органические вещества записаны в виде молекулярных формул, но так записывать не обязательно)
5С12Н16О2+ 22KMnO4 + 33H2SO4 5С9Н6О6 + 5CO2 + 5CH3COOH + 22MnSO4 + 11K2SO4 + 38H2O
Задание 4.
1) Составьте уравнение реакции деструктивного окисления по обеим двойным связям 4-метилпентадиена – 1,3 подкисленным раствором перманганата калия при нагревании.
2) Составьте уравнение реакции окисления стирола водным раствором перманганата калия при нагревании.
3) Составьте уравнение реакции окисления 1-изопропил-3-метил-2-пропил-5-этилбензола щелочным раствором перманганата калия при нагревании.
Для расставления коэффициентов используйте метод макроподстановки.
